Introducción. Las alteraciones gastrointestinales a modo de dispepsia, náuseas, diarreas, estreñimiento, úlcera péptica o hemorragia gastrointestinal son efectos indeseables asociados frecuentemente a los fármacos antiagregantes plaquetaríos. Objetivo. Identificar la estrategia terapéutica que se asocia a una mayor reducción de los problemas gastrointestinales asociados a antiagregantes plaquetaríos. Pacientes y métodos. De modo consecutivo, se incluyeron pacientes ambulatorios tratados crónicamente con fármacos antiagregantes plaquetaríos, que presentaban trastornos gastrointestinales atribuidos por el investigador al tratamiento antiagregante. Se registraron las estrategias utilizadas para el manejo de los trastornos gastrointestinales y se estudió el grado de satisfacción de los pacientes mediante escalas analógicas visuales de tolerabilidad, ccdiclacl de vida y facilidad para el cumplimiento de la medicación, tanto con el tratamiento farmacológico inicial como con el tratamiento farmacológico instaurado para manejar los trastornos gastrointestinales. Resultados. Se reclinaron 609 pacientes (55,3% hombres). Los pacientes inicialmente tratados tanto con triflusal en solución como con triflusal en cápsulas toleraban mejor la medicación que los inicialmente tratados con ácido acetilsalicílico (p < 0,0001). El cambio de tratamiento antiagregante o de dosis fue la estrategia más utilizada (65% de los casos). En 385 pacientes (63,2%) se realizó un cambio de tratamiento farmacológico. El cambio del tratamiento antiagregante inicial por triflusal solución mejoró la tolerabilidad del tratamiento y la calidad de vida, al tiempo que redujo la dificultad para el cumplimiento de la medicación. Conclusión. El triflusal en solución es una buena alternativa en pacientes que presenten trastornos gastrointestinales asociados a tratamiento antiagregante crónico. [ANGIOLOGIA 2009; 61: 185-94]
Introduction. Gastrointestinal disorders like dyspepsia, nausea, diarrhoea, constipation, peptic ulcers or gastrointestinal haemorrhages are undesirable side-effects that are qften associated to antiplatelet therapy. Aim. To identify the therapeutic strategy that leads to the greatest reduction in the number of gastrointestinal problems associated with antiplatelet drugs. Patients and methods. Our sample consisted of consecutive outpatients undergoing chronic antiplatelet therapy who presented gastrointestinal disorders that the researcher attributed to the antiplatelet therapy. The strategies used this to manage the gastrointestinal disorders were recorded and the degree of patients' satisfaction was studied by means of visual analogical scales for measuring tolerability, quality of life and ease of treatment compliance, for both the initial pharmacological treatment and pharmacological treatment that was established to manage the gastrointestinal disorders. Results. The sample was made up of 609 patients (55.3% nwles). Patients who were initially treated with triflusal solution and with triflusal capsules tolerated medication better than those who were initially treated with acetylsalicylic acid (p < 0.0001). Changing the antiplateiet therapy or the doses was the most wideiy used strategy (65% of cases). Pharmacological treatment was changed in 385 patients (63.2%). Changing the initial antiplateiet therapy for triflusal solution improved treatment tolerability and quality of life, while also lessening the difficulties involved in achieving medication compliance. Conclusions. Triflusal solution is a good alternative in patients who present gastrointestinal disorders associated to chronic antiplateiet therapy. [ANGIOLOGÍA 2009; 61: 185-94]
Es bien conocido que las plaquetas activadas participan en las fases iniciales y finales del proceso fisiopatológico de la oclusión arterial [1]. Los antiagregantes plaquetaríos constituyen el grupo de fármacos cuyo principal efecto es inhibir la activación y agregación plaquetarias.
Los antiagregantes plaquetaríos se utilizan tanto para profilaxis primaria como para la profilaxis secundaria de eventos cardiovasculares. Se habla de profilaxis primaria cuando se instaura un tratamiento antiagregante en pacientes que no han sufrido todavía un evento cardiovascular, pero que presentan algún factor de riesgo. Por el contrario, se considera profilaxis o prevención secundaria cuando el tratamiento se instaura en un paciente que ya ha sufrido algún evento cardiovascular previo, con el fin de evitar que vuelva a ocurrir. Esta profilaxis secundaria se utiliza en patología arterial coronaria, enfermedad isquémica cerebral, enfermedad arterial oclusiva periférica y tras intervenciones de revascularización arterial. Los antiagregantes plaquetarios orales más utilizados son el ácido acetilsalicílico (AAS), el tnflusal, el dipiridamol, la ticlopidina y el clopidogrel.
El efecto secundario más frecuente derivado del uso de estos fármacos es la prolongación del tiempo de sangría, que se traduce en una mayor tendencia a fenómenos hemorrágicos asociados o no a traumatismos ocasionales y/o quirúrgicos. Las alteraciones gastrointestinales a modo de dispepsia, náuseas, diarreas, estreñimiento, úlcera péptica o hemorragia gastrointestinal siguen en importancia y frecuencia en la lista de efectos colaterales indeseables asociados al tratamiento con sustancias antiplaquetarias [2].
Dado el impacto que los trastornos gastrointestinales pueden tener en la calidad de vida de los pacientes, así como el riesgo de abandono o falta de adhesión al tratamiento antiplaquetario debido a estos problemas, ha de constituir un objetivo en sí mismo el control de estos efectos indeseados, ya sea manejando la propia terapia antiagregante, modificando hábitos de vida o añadiendo fármacos específicos para el control de estos trastornos. De ahí el interés de la caracterización de los efectos secundarios gastrointestinales que sufren los pacientes en profilaxis antiagregante,y de las estrategias más efectivas para su control.
El objetivo principal del presente estudio consistió en identificar la estrategia terapéutica que se asocia a una mayor reducción de los problemas gastrointestinales percibidos por el paciente. Los objetivos secundarios consistieron en caracterizar los trastornos gastrointestinales presentados por los pacientes, así como conocer el grado de satisfacción del paciente con su situación clínica, en el momento basal y tras las actuaciones para reducir los trastornos gastrointestinales indicados por su médico.
Pacientes y métodosDiseño del estudioEstudio observacional, prospectivo y multicéntrico. El estudio tuvo un seguimiento de los pacientes de tres meses. Se registraron los datos correspondientes a dos evaluaciones, al inicio del estudio y tras tres meses de evolución. En este estudio participaron 112 investigadores, especialistas que tratan pacientes cardiovasculares, de 102 centros españoles (v. apéndice).
Aspectos éticosEl estudio se llevó a cabo de acuerdo con los requerimientos expresados en las normas internacionales relativas a la realización de estudios epidemiológicos, recogidas en las International Guidelines for Ethical Review of Epidemiological Studies –Council for the International Organizations of Medical Sciences (CIOMS), Ginebra, 1991–, así como la Declaración de Helsinki (revisión de Tokio, octubre de 2004). Se obtuvo el consentimiento informado por escrito de todos los pacientes participantes.
El protocolo del estudio fue aprobado por el Comité Ético de Investigación Clínica del Hospital Clínic i Provincial de Barcelona.
La gestión de datos del estudio se realizará siguiendo las normas establecidas en la Ley de Protección de Datos de Carácter Personal (Ley Orgánica 15/1999).
PacientesDurante un período de tres meses se reclutaron pacientes ambulatorios consecutivos tratados crónicamente con fármacos antiagregantes plaquetarios, que presentaban trastornos gastrointestinales atribuidos por el investigador al tratamiento anti agregante. El tratamiento de cada paciente siguió las condiciones de uso de cada fármaco y la práctica habitual del centro. Se excluyeron aquellos pacientes que participaban en otros protocolos de estudio, los que no podían comprometerse a su seguimiento por tres meses, los que tenían diagnosticada una enfermedad oncológica activa o los que consumían regularmente otras medicaciones gastroerosivas (antiinflamatorios no esteroideos, antibióticos) en el momento de la visita inicial.
VariablesEn la visita inicial se registraron las siguientes variables: datos demográficos; tratamiento antiagregante y motivo de la prescripción del mismo; trastornos gastrointestinales atribuidos por el investigador al tratamiento antiagregante; otras reacciones adversas (distintas de los trastornos gastrointestinales) asociadas al tratamiento antiagregante; satisfacción del paciente con su situación clínica, cuantificada mediante escalas analógicas visuales (EAV), respecto a calidad de vida, impacto de los trastornos gastrointestinales en su vida cotidiana y complejidad para cumplir el tratamiento antiagregante; estrategias utilizadas para el manejo de los trastornos gastrointestinales: adición de fármacos para el tratamiento de los trastornos gastrointestinales, recomendación de cambios de dieta, recomendación de toma con las comidas, fraccionamiento de dosis, reducción en la frecuencia diaria de administración de la medicación, cambio de la formulación y/o del tratamiento antiagregante.
En la visita final, se registraron: eventos cardiovasculares ocurridos en los tres meses previos; tratamientos concomitantes que pudieran provocar patología gastrointestinal o interferir con la misma; satisfacción del paciente con su situación clínica, cuantificada mediante EAV, respecto a la percepción de mejoría de sus trastornos gastrointestinales, percepción de tolerabilidad del nuevo tratamiento, afectación de su calidad de vida por los trastornos gastrointestinales, dificultad para la toma del tratamiento, preferencias por una u otra forma farmacéutica de los fármacos antiagregantes, valoración del sabor de la medicación; evolución de los trastornos gastrointestinales registrados en la visita inicial; nuevos trastornos gastrointestinales ocurridos durante el periodo de seguimiento; evolución de otras reacciones adversas; registro de pruebas complementarias realizadas para el diagnóstico y/o tratamiento de los trastornos gastrointestinales; visitas adicionales realizadas a médicos de familia y/o especialistas, motivadas por los trastornos gastrointestinales; en caso de pacientes con actividad laboral, número de horas perdidas debido a los trastornos gastrointestinales.
Análisis estadísticoLos datos demográficos, tipo de tratamiento antiagregante, razones para dicho tratamiento y trastornos gastrointestinales de los pacientes se trataron de forma descriptiva.
Las EAV de calidad de vida y de satisfacción del paciente en el momento inicial se analizaron con el test de Mann-Whitney y, después del cambio de estrategia, mediante el test de Wilcoxon.
ResultadosSe incluyeron en el estudio 609 pacientes, de los cuales 337 (55,3%) eran hombres. La edad media fue de 69,49 ± 10,66 años (rango: 26-95 años). Ciento cuarenta y cinco pacientes recibieron tratamiento antiagregante como profilaxis primaria, y 464, como profilaxis secundaria. La razón de la profilaxis primaria consistió en la presencia de factores de riesgo cardiovascular. Las indicaciones para la profilaxis secundaria fueron: accidente cerebrovascular transitorio en 141 casos (30,4%), accidente cerebrovascular permanente en 91 (19,6%), angina de pecho estable en 101 (21,8%), angina de pecho inestable en 64 (13,8%), infarto agudo de miocardio en 117 (25,2%), miocardiopatía dilatada en 43 (9,3%), fibrilación auricular en 85 (18,3%), prolapso mitral en 30 (6,5%), enfermedad arterial periférica en 141 (30,4%), angioplastia de cualquier nivel en 77% (16,6), derivación coronaria en 50 (10,8%) y otros motivos en 6 (1,3%).
El AAS fue el fármaco antiagregante que tomaban los pacientes en la visita inicial más común (376 pacientes, 61,7%) en dosis media de 189,83 ± 105,58mg/día (rango: 100-1.000mg/día). El clopidogrel era consumido por 75 pacientes (12,3%) en dosis media de 96,73 ± 101,99mg/día (rango: 75-600mg/día). La ticlopidina se utilizaba en 10 pacientes (1,6%) en dosis media de 435,32 ± 250,10mg/día (rango: 75-1.000mg/día). El triflusal en cápsulas era consumido por 75 pacientes (12,3%) en dosis media de 578,25 ± 197,32mg/día (rango: 300-1.200mg/día). El triflusal en solución oral sólo lo consumían 28 pacientes (4,6%) en dosis media de 600 ± 0mg/día (rango: 600-600mg/día). Los 45 pacientes restantes (7,4%) consumían una combinación de antiagregantes plaquetaríos: 37 (6,1%) lo hacían con AAS + clopidogrel, 2 (0,3%) con AAS + ticlopidina, 3 (0,5%) con AAS + triflusal en cápsulas, 1 (0,2%) con AAS + pentoxifilina, 1 (0,2%) con clopidogrel + triflusal en cápsulas y 1 (0,2%) con clopidogrel + triflusal en solución.
De los 609 pacientes incluidos, la mayoría describía molestias gastrointestinales inespecíficas (88,8%). La dispepsia estaba presente en 31 pacientes (5,1 %), seguida de dolor abdominal en 9 (1,5%), náuseas en 9 (1,5%), gastritis en 6 (1,0%), hiperacidez gástrica en 6 (1,0%), diarrea en 5 (0,8%), flatulencia en 3 (0,5%), estreñimiento en 2 (0,3%), anorexia en 1 (0,2%), hemorragia gastrointestinal en 1 (0,2%) y úlcera gástrica en 1 (0,2%).
Grado de satisfacción de los pacientes con el tratamiento antiagreganteLas puntuaciones medias (en una escala de 0-10: no tolerancia a tolerancia perfecta) en las EAV de tolerabilidad fueron de 4,89 ± 2,56. La afectación de la calidad de vida (en una escala 0-10: no afectación a gran afectación) por los trastornos gastrointestinales se puntuó con 5,22 ± 2,56, y la dificultad de cumplimiento (en escala 0-10: no complicado a complicadísimo), con 3,28 ± 2,62.
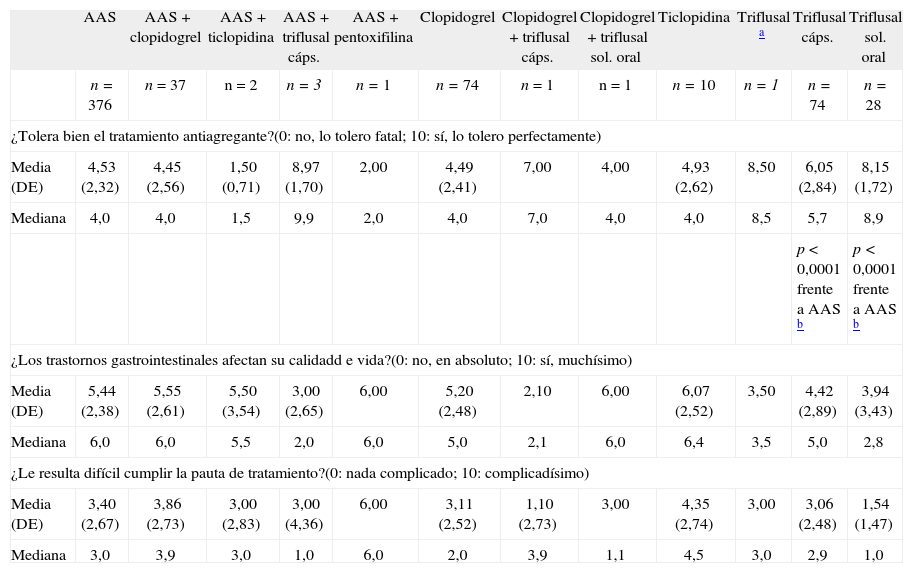
En general, los tratamientos fueron bien tolerados. Las puntuaciones en las EAV de tolerabilidad, afectación de la calidad de vida por los trastornos gastrointestinales y dificultad de cumplimiento, para cada tratamiento inicial, pueden verse en la tabla I. Los pacientes inicialmente tratados tanto con triflusal en solución como con triflusal en cápsulas toleraban mejor la medicación que los inicialmente tratados con AAS (p < 0,0001 para ambas comparaciones).
Puntuaciones de las escalas analógicas visuales de tolerabilidad, calidad de vida y dificultad de cumplimiento del tratamiento antiagregante, para cada uno de los tratamientos iniciales.
| AAS | AAS + clopidogrel | AAS + ticlopidina | AAS + triflusal cáps. | AAS + pentoxifilina | Clopidogrel | Clopidogrel + triflusal cáps. | Clopidogrel + triflusal sol. oral | Ticlopidina | Triflusal a | Triflusal cáps. | Triflusal sol. oral | |
| n = 376 | n = 37 | n = 2 | n = 3 | n= 1 | n = 74 | n = 1 | n = 1 | n= 10 | n = 1 | n = 74 | n = 28 | |
| ¿Tolera bien el tratamiento antiagregante?(0: no, lo tolero fatal; 10: sí, lo tolero perfectamente) | ||||||||||||
| Media (DE) | 4,53 (2,32) | 4,45 (2,56) | 1,50 (0,71) | 8,97 (1,70) | 2,00 | 4,49 (2,41) | 7,00 | 4,00 | 4,93 (2,62) | 8,50 | 6,05 (2,84) | 8,15 (1,72) |
| Mediana | 4,0 | 4,0 | 1,5 | 9,9 | 2,0 | 4,0 | 7,0 | 4,0 | 4,0 | 8,5 | 5,7 | 8,9 |
| p < 0,0001 frente a AAS b | p < 0,0001 frente a AAS b | |||||||||||
| ¿Los trastornos gastrointestinales afectan su calidadd e vida?(0: no, en absoluto; 10: sí, muchísimo) | ||||||||||||
| Media (DE) | 5,44 (2,38) | 5,55 (2,61) | 5,50 (3,54) | 3,00 (2,65) | 6,00 | 5,20 (2,48) | 2,10 | 6,00 | 6,07 (2,52) | 3,50 | 4,42 (2,89) | 3,94 (3,43) |
| Mediana | 6,0 | 6,0 | 5,5 | 2,0 | 6,0 | 5,0 | 2,1 | 6,0 | 6,4 | 3,5 | 5,0 | 2,8 |
| ¿Le resulta difícil cumplir la pauta de tratamiento?(0: nada complicado; 10: complicadísimo) | ||||||||||||
| Media (DE) | 3,40 (2,67) | 3,86 (2,73) | 3,00 (2,83) | 3,00 (4,36) | 6,00 | 3,11 (2,52) | 1,10 (2,73) | 3,00 | 4,35 (2,74) | 3,00 | 3,06 (2,48) | 1,54 (1,47) |
| Mediana | 3,0 | 3,9 | 3,0 | 1,0 | 6,0 | 2,0 | 3,9 | 1,1 | 4,5 | 3,0 | 2,9 | 1,0 |
Las puntuaciones en las escalas analógicas visuales correspondientes a los tratamientos con un número de pacientes muy pequeño deben interpretarse con precaución.
La estrategia más utilizada para el manejo de los trastornos gastrointestinales fue el cambio del tratamiento antiagregante o de la forma farmacéutica en 396 pacientes (65,0%). De éstos, 6 pacientes realizaron una reducción de dosis y en 5 no se especificó el cambio aplicado. En 110 pacientes (18,1%) se añadió un fármaco para el tratamiento de los trastornos. En 89 pacientes (14,6%) se recomendó tomar los larmacos antiagregantes con las comidas. En 11 pacientes (1,8%) se recomendaron cambios en la dieta y en 3 pacientes (0,5%) se aconsejó una reducción de la frecuencia de administración de la medicación antiplaquetaria. En 385 (63,2%) pacientes se realizó un cambio de tratamiento farmacológico. Los detalles de estos cambios pueden consultarse en la tabla II.
Cambios de tratamiento farmacológico: tratamiento instaurado en sustitución del tratamiento inicial (n = 385).
| Acido acetilsalicilico | 3 (0,8%) |
| Acido acetilsalicilico + triflusal solución | 1 (0,3%) |
| Clopidogrel | 20 (5,2%) |
| Clopidogrel + triflusal cápsulas | 2 (0,5%) |
| Clopidogrel + triflusal solución | 8(2,1%) |
| Ticlopidina | 3 (0,8%) |
| Triflusal cápsulas | 42 (10,9%) |
| Triflusal solución | 306 (79,5%) |
El cambio de tratamiento farmacológico consistió en la sustitución del tratamiento anterior por triflusal en solución en 306 pacientes (79,5%). A 62 de estos pacientes (20,3%) se les añadió un protector gástrico como parte de la estrategia de tratamiento de los trastornos gastrointestinales. A los 244 pacientes restantes (79,7%) se les cambió el tratamiento a triflusal en solución como monoterapia y sin protección gástrica. De ellos se dispone de puntuaciones en las escalas iniciales y finales de tolerabilidad, calidad de vida y cumplimiento de la medicación en 121, 110 y 120 pacientes, respectivamente. El cambio del tratamiento antiagregante inicial a triflusal en solución mejoró la tolerabilidad del tratamiento antiagregante, así como la calidad de vida relacionada con los trastornos gastrointestinales, y redujo la dificultad para cumplir con el tratamiento antiagregante. En la tabla III pueden verse los cambios en las puntuaciones de dichas escalas.
Cambios en las escalas analógicas visuales de tolerabilidad, calidad de vida y dificultad de cumplimiento del tratamiento antiagregante tras el cambio a triflusal en solución.
| n | Diferencia final-basal | |
| ¿Tolera bien el tratamiento antiagregante?0: no, lo tolero fatal; 10: sí, lo tolero perfectamentep< 0,0001 (test de Wilcoxon) | 121 | Media (DE): 3,4 (3,14)Mediana: 3,1 |
| ¿Los trastornos gastrointestinales afectan su calidad de vida?0: no, en absoluto; 10: sí, muchísimop< 0,0001 (test de Wilcoxon) | 110 | Media (DE):−2,8 (3,40)Mediana: −3 |
| ¿Le resulta difícil cumplir la pauta de tratamiento?0; nada complicado; 10; complicadísimop< 0,0001 (test de Wilcoxon) | 120 | Media (DE):−1,7 (2,93)Mediana:−1,0 |
El efecto antiagregante del AAS está mediado por la inhibición de la síntesis de tromboxano A2 y se produce por la acetilación irreversible de la ciclooxigenasa. Los efectos adversos más comunes del AAS consisten en náuseas, pirosis, dolor epigástrico, hemorragia digestiva y hemorragia intracraneal [2-7], Otros efectos como broncoespasmo, angioedema, urticaria o reacciones anafilácticas son menos frecuentes. En el estudio Dutch TIA, en prevención secundaria [5], en el que se compararon dosis bajas y altas de AAS (30 o 282mg/día), la incidencia de la variable compuesta de muerte vascular, accidente cerebrovascular no fatal e infarto de miocardio no fatal fue similar en ambos grupos (14,7 frente a 15,2% en el grupo de dosis baja y alta, respectivamente). Sin embargo, en el grupo de dosis baja se produjeron un 24% menos de hemorragias mayores y un 41% menos de hemorragias menores que en el grupo de dosis altas Por lo que se refiere al estudio UK-TIA, en el que se comparó AAS en dosis de 200 y 1.200mg/día con el placebo en pacientes con accidente cerebrovascular o accidente isquémico transitorio, tampoco se encontraron diferencias entre los grupos de aspirina en el mismo objetivo compuesto definido en el estudio Dutch TIA, y de nuevo el grupo de dosis altas de AAS presentó las mayores tasas de toxicidad gástrica, incluyendo episodios de sangrado [3].
Como se ha dicho, el triflusal es un antiagregante plaquetario que acetila de forma irreversible la ciclooxigenasa y, consecuentemente, inhibe la síntesis de tromboxano A2[8,9]. A diferencia del AAS, el triflusal inhibe la fosfodiesterasa, lo cual puede contribuir a su actividad antiagregante [10]. También, a diferencia de lo que ocurre con el AAS, la síntesis endotelial de prostaciclina es preservada con triflusal [8], En ensayos clínicos controlados en pacientes con infarto agudo de miocardio [11] y en pacientes con ictus isquémico o ataque isquémico transitorio [12,13], el triflusal ha demostrado una eficacia superior al AAS en la prevención de eventos, y con un menor riesgo hemorrágico. Estos resultados han sido confirmados en un metaanálisis [14]. La asociación de triflusal y anticoagulación oral de intensidad moderada es más eficaz que la anticoagulación estándar en la prevención de eventos vasculares en pacientes con fibrilación auricular [15]. En el estudio TAC1P [12], la incidencia de hemorragia gastrointestinal fue menor en el grupo tratado con triflusal que en el grupo tratado con AAS. Asimismo, en dos estudios de casos y controles [16,17], el triflusal, contrariamente al AAS, no se asoció a un riesgo significativo de hemorragia gastrointestinal.
El dipiridamol es un vasodilatador con actividad antiagregante debido a la inhibición de la fosfodiesterasa. Los efectos secundarios más frecuentes son cefalea, mareos y molestias gastrointestinales, principalmente diarrea y náuseas. En los estudios ESP-2 [18] y ESPR1T [19], ambos en pacientes con accidente cerebrovascular, se han obtenido mejores resultados en cuanto a eficacia con la asociación de AAS y dipiridamol que sólo con AAS. Sin embargo, en el estudio ESP-2 [18], no se excluyó inicialmente a los pacientes con ictus cardioembólico y tras la publicación del estudio EAFT [20] los pacientes con fibrilación auricular (n = 429) pudieron ser tratados con anticoagulantes a discreción del investigador. No se sabe cómo pudo influir esta circunstancia en el análisis por intención de tratar. Asimismo, los abandonos por cefalea fueron muy superiores en los grupos que recibieron dipiridamol que en los que recibieron sólo AAS: 31 pacientes en el grupo de sólo AAS (n = 1.649), 132 pacientes en el grupo de sólo dipiridamol (n = 1.654) y 133 pacientes en el grupo de AAS asociado a dipiridamol (n =133). El estudio ESPRIT [19] merece también algunos comentarios: en primer lugar, no fue doble ciego. Además, la dosis de AAS fue muy variable e incluyó 30mg/día, menor que la dosis mínima de 50mg/día recomendada en guías de práctica clínica [21]. Por último, existe una falta de coincidencia entre el análisis por intención de tratar y el análisis por protocolo.
La ticlopidina y el clopidogrel inhiben de forma irreversible la unión del ADO a su receptor en las plaquetas, con lo que previenen la transformación del receptor GpIlb/IIIa en su forma activa [22]. A pesar de que la eficacia de la ticlopidina como antiagregante plaquetario ha sido claramente demostrada, su perfil de seguridad la ha relegado a un segundo plano. La reacción adversa más importante es la neutropenia, que se presenta con una incidencia del 2,4% y se da en los primeros tres meses de tratamiento. La púrpura trombótica trombocitopénica ocurre en, aproximadamente, un 0,01% de pacientes. Otras reacciones adversas son hemorragias, toxicidad hepática, erupción cutánea y diarrea [22]. La evidencia de la eficacia del clopidogrel en monoterapia se deriva del estudio CAPRIE [23], un ensayo clínico realizado en pacientes con infarto de miocardio reciente o accidente cerebrovascular isquémico o arteriopatía periférica. En este estudio, el clopidogrel fue superior al AAS en la reducción de la variable compuesta de accidente cerebrovascular isquémico, infarto de miocardio o muerte vascular, si bien el beneficio se obtuvo a expensas del grupo de pacientes con arteriopatía periférica.
Los efectos secundarios más frecuentes asociados al uso del clopidogrel son los gastrointestinales: estreñimiento, vómitos, hemorragia gastrointestinal y gastritis hemorrágica. Por lo que respecta a la incidencia de hemorragias, próxima al 10%, es igual a la del AAS.
En el presente estudio, la tolerabilidad gastrointestinal fue mejor en los pacientes tratados con triflusal en solución o con triflusal en cápsulas que con AAS. El cambio del tratamiento antiagregante fue la estrategia más utilizada, con diferencia (65%), para el manejo de los trastornos gastrointestinales; el tratamiento que con más frecuencia sustituyó al tratamiento inicial fue el triflusal en solución (79,5%). Dadas estas circunstancias, ha parecido oportuno evaluar únicamente la evolución de aquellos pacientes en los cuales el tratamiento se cambió a triflusal en solución en monoterapia y se disponía de las puntuaciones iniciales y finales en las EAV. En esta subpoblación de pacientes, el cambio del tratamiento antiagregante inicial por triflusal en solución mejoró la tolerabilidad del tratamiento y la calidad de vida, al tiempo que redujo la dificultad para el cumplimiento de la medicación.
La limitación del presente estudio radica en el carácter no ciego de su diseño, lo que puede inducir a sesgo por el efecto placebo de las nuevas opciones terapéuticas. No obstante, este estudio sólo refleja el análisis de diferentes acciones estratégicas en busca de mejorar o aliviar los trastornos gastrointestinales atribuibles al consumo crónico de antiagregantes plaquetarios. El seguimiento de tan sólo tres meses, si bien puede estimarse como demasiado corto, ha permitido obtener un elevado grado de cumplimiento sin pérdidas.
En conclusión, los pacientes tratados inicialmente con triflusal en solución o con triflusal en cápsulas toleraron mejor la medicación que los tratados con AAS. El cambio del tratamiento antiagregante inicial por triflusal en solución mejoró la tolerabilidad del tratamiento y la calidad de vida, al tiempo que redujo la dificultad para el cumplimiento de la medicación. Debe considerarse la alternativa segura con triflusal en solución como profilaxis primaria o secundaria en pacientes de riesgo cardiovascular con intolerancia gastrointestinal.
Angiología y Cirugía Vascular: Cristina Abarrategui. H. 12 de Octubre (Madrid). Antonio Caklerín. H. Insular (Las Palmas de Gran Canaria). Manuel Díaz. H.I.U. (Telde). Alfonso Egido. H. Gral. de Ciudad Real (Ciudad Real). Ángel Galindo. H C. San Carlos (Madrid). Enrique Francisco González. H.U. Canarias (Santa Cruz de Tenerife). Esteban Hernández. H.U. Joan XXIII (Tarragona). Benito Méndez. H. Gral. .luán Ramón Jiménez (Huelva). M. Jesús Merino. H. 12 de Octubre (Madrid). Francisco Miguela. H. La Paz (Madrid). Josep Orliz. H. Sant Joan de Déu (Marloreil). Pablo Pérez. R. Virgen de las Nieves (Granada). José Luis Pérez. H.U. de Canarias (Sta. Cruz de Tenerife). Vicente Riambau. H. Clínic i Provincial (Barcelona). Luis Miguel Salmerón. H. Universitario San Cecilio (Granada). Ornar Semper. H. Sur (Costa-Adeje). Roberto Ucelay. H.U. Canarias (La Laguna).
Cardiología: Nadim Aboudam. H. San Juan de la Cruz (Úbeda). Hugo Alviso. H. de Coria (Coria). Víctor Amaro. H. La Línea (Algeciras). Juan M. Arnedillo. H. de Barbastro (Barbastro). Rosario Cabrera. H. Gral. Básico Minas de Riotinlo (Minas de Riotinto). Antonio Cimbora. H. Infanta Cristina (Badajoz). Mohammad Elsaheb. A.B.S. Chafarinas (Barcelona). Jaime Fernández-Dueñas. H. Alta Resolución de Puente Genil (Puente Genil). Luis C. Fernández. A.E. Dr. Avelino González (Gijón). José M. Gámez. H. Son Llátzer (Palma de Mallorca). Blas Jiménez. C.H. Jaén (La Guardia). Manuel Lagares. H.U. Puerta del Mar (Cádiz). Antonio Marino Martín. H. de Jerez de la Frontera (Jerez de la Frontera). Miguel Ángel Martínez. Consulta privada (Granada). Jesualdo Masia. H.P Socorro (Albacete). Diego Montañés. H.U. Virgen de la Victoria (Málaga). Andrés Pérez. H. de Mérida (Mérida). Laura Quintas. H. de Cruces (Barakaldo). Emilio Rubio. H. Virgen de la Salud (Toledo). Manuel Jesús Ruiz. H. La Línea de la Concepción (La Línea de la Concepción). Antonio Sánchez. Consorei Sanitari de Terrassa (Terrassa). Pedro Javier Serrano. C.M.E. Inocencio Jiménez (Zaragoza). Pedro Luis Talavera. H. Fuenlabrada (Fuenlabrada). Antonio Toral. C.E. Babel (Alicante). Juana Untaran. H. Galdakao (Galdakao). María Urrutia. H. Dr. Negrín (Las Palmas). Carlos Alberto Valle. C.A.E. Mojón (Arona). Luis Zárate. C.M.E. Ramón y Cajal (Zaragoza).
Cirugía Cardiovascular: Juan José Feijoo. H. Dr. Negrín. (Las Palmas). Gerardo Ponce. H. Dr. Negrín (Las Palmas de Gran Canaria).
Gerialría: Nicolás Maturana. Residencia Geriátrica (Almería). M. Elena Nache. Residencia de Mayores (El Ejido). Mercedes Obis. Residencia La Inmaculada (Zaragoza). M. Concepción Orliz. H. San Juan de Dios (Zaragoza).
Medicina Familiar y Comunitaria: Francisco Arroyo. C.S. Santa Clara (Burgos). M. Dolores Caballero. A.B.S. Torrassa (Barcelona). Juan Bautista Doménech. C.S. Caiarroja (Catarroja). José Antonio Fernández. C.S. Camargo (Santander). Manuel Fernández. C.S. Novoa Santos (Ourense). Manuel Fernández. CAP José Aguado (León). Susana Fernández. C.S. Valle-Inclán (Ourense). Miguel Ángel Fuentes. C.A.P. Maragall (Barcelona). Armand Izquierdo. C.H.P. Cervelló (Cervelló). Vicente López de Silanes. C.S. Gamonal y La Antigua (Burgos). César Javier Mateos. C.S. Alfaro (Alfaro). Julio Mier. C.S. Covadonga (Torrelavega). Joan Planas. C.A.P. Castellbisbal (Castellbisbal). Óscar Puente. C.S. Centro Isabel II (Santander). Elena Romero. C.S. Nalón (Miño). Jorge Manuel Romero. H. de Zafra (Zafra). Regina Romeu. C.A.P. Rocafona (Mataró). Pablo Serra. C.S. Pobla de Vallbona (La Pobla de Vallbona). Marta Ana Torres. A.B.S. Eixample (Lleida).
Medicina General: Gloria Agrilló. Residencia de Mayores (Úbeda). José Luis Blanco. C.S. Camporrobibi (Requena). Luis Enrique Calvo. C.S. Ceuti (Murcia). Luis Carlos Casado. C.S. Vallobín La Florida (Oviedo). Ricardo Cebrián. C.A.P. Requena (Requena). Jaime Creixell. C.A.P. Vallirana (Vallirana). Ana Isabel Fernández. Consulta privada (San Sebastián). Luis García-Giralda. C.S. Murcia Centro (Murcia). Julio Jiménez. C.S. Benaguacil (Valencia). Daniel López. Consulta privada (Anglés). Agustín Martínez. C.S. Plaza del Ejército (Valladolid). José Martínez. C.S. El Ranero (Murcia). Estrella Rodero. C.A.P. Emigrant (L'Hospitalet). Alfonso Sánchez. C.S. Peñaranda de Bracamonle (Peñaranda de Bracamonte). Narcís Salieras. C.A.P. Montilivi (Girona). Alvaro da Silva. R.A. Diputación (Burgos).Vicente Miguel Soler. C.S. Ribarroja (Ribarroja). José Luis Tamio. C.A.P. Massanassa (Valencia).
Medicina Interna: Luis Alkoita. Matia Fundazioa (San Sebastián). Xavier Arroyo. C. Claret (Barcelona). Francisco Javier Carrasco. H. Juan Ramón Jiménez (Huelva). José Enrique Fernández. H. Juan Grande (Jerez de la Frontera). Ricardo Gómez. H. Carlos Haya (Málaga). Julio Martínez. H. San Pedro (Logroño). José Alberto Martos. H. Sant Rafael (Barcelona). Rafael Montes. C.H. Xeral-Calde (Lugo). Emilio Mora. Hospital FREMAP (Sevilla).
Neurología: Manuel Lara. H. La Paz (Madrid). Antonio Tomás Cano. H. Mataró (Mataró). Belén Castaño. H. Valle del Nalón (Riaño). José Manuel Fernández. H. Guadalajara (Guadalajara). Covadonga Fernández. H. Cruces (Barakaldo). Nerea Foncea. H. Galdakao (Galdakao). Carlos Gahete. H. Llerena (Azuaga). Manuel Lara. H. La Paz (Madrid). Margarita López. H. Febles Campos (Sta. Cruz de Tenerife). Jaime Masjuán. H. Ramón y Cajal (Madrid). María del Sol Moreno. H. Ntra. Sra. de Sonsoles (Miraflores del la Sierra). Fernando Ortega. H. Río Hoilega (Valladolid). Hernando Pérez. H. Virgen del Rocío (Sevilla). Juan Carlos Portilla. H. San Pedro de Alcántara (Cáceres). Carlos Tejero. H.U. Lozano Blesa (Zaragoza). Antonio Yusta. H.U. Guadalajara (Guadalajara).