El cierre percutáneo de la comunicación interauricular es una alternativa al tratamiento quirúrgico.
ObjetivosComunicar los resultados del cierre percutáneo de la comunicación interauricular con el dispositivo Amplatzer®.
MétodoSe incluyeron los pacientes sometidos a hemodinamia de septiembre de 1997 a diciembre de 2011.
ResultadosSe procedió al cierre del defecto en 721 pacientes y en 85 no se cerró por considerarse no apto anatómicamente. El diámetro expandido del defecto fue de 23±6.7mm (límites, 5-42). Todos los dispositivos se colocaron con éxito. En 15 casos (2.1%) se cambió el dispositivo por considerarse inestable y en 6 (0.8%) se presentó embolización en las primeras 24h, 4 fueron rescatados y recolocados (éxito final con intención de tratamiento 719/806-89.2%). El control inmediato mostró oclusión completa en 247 pacientes (34.3%), fuga intradispositivo en 395 (54.9%), ligera en 75 (10.4%) y moderada en 2 (0.3%). Se hace seguimiento en 626 pacientes (87.1%) durante 33±27.5 meses, presentándose cefalea en 54 (8.6%), arritmias supraventriculares nuevas en 10 (1.6%), complicaciones en el sitio de punción en 4 (0.6%) y accidente vascular cerebral en uno (0.1%).
ConclusiónEl diseño del dispositivo Amplatzer® permite el cierre de la comunicación interauricular con una técnica sencilla y con seguridad para el paciente.
Percutaneous closure of atrial septal defects is an alternative to surgical treatment.
ObjectivesWe report the results of percutaneous closure of atrial septal defects with the Amplatzer® device.
MethodWe include patients taken to the catheterization laboratory from September 1997 to December 2011.
ResultsWe proceeded with defect closure in 721 patients and in 85 the defect was considered not suitable for closure. The stretched diameter of the defect was 23±6.7mm (limits, 5-42). All devices were positioned successfully. In 15 cases (2.1%) the device was changed due to instability and in 6 (0.8%) the device embolized within the first 24h, 4 were retrieved and repositioned (final success with intention to treat 719/806-89.2%). Immediate control showed complete closure in 247 patients (34.3%), leak through the device in 395 (54.9%), mild residual leak in 75 (10.4%) and moderate in 2 (0.3%). We have follow-up in 626 patients (87.1%) for 33±27.5 months, with headache in 54 (8.6%), new supraventricular arrhythmia in 10 (1.6%), puncture site complications in 4 (0.6%), and stroke in one (0.1%).
ConclusionThe design of the Amplatzer® device allows effective closure of atrial septal defects with a simple technique and patient safety.
El tratamiento del defecto septal auricular con cirugía es un método con eficacia ampliamente comprobada y con una morbimortalidad muy baja, aunque no está exento de problemas tanto a corto como a largo plazo como defectos auriculares residuales, arritmias persistentes y enfermedad miocárdica1 que dependen mucho de la edad de la cirugía2. Desde que King y Mills3 realizaron el primer intento de cierre de comunicación interauricular transcateterismo, se han desarrollado varios tipos de dispositivos que en su mayoría se basan en el principio de 2 discos opuestos para cerrar el defecto4–13. El dispositivo Amplatzer® se basa en el principio de distender el defecto septal ocluyéndolo14–16. La experiencia mundial con este dispositivo ha sido muy buena, hecho que lo ha posicionado como el dispositivo de elección para la oclusión transcateterismo de la comunicación interauricular, especialmente de defectos mayores de 20mm, en los que ningún otro dispositivo ha probado su eficacia14–28.
En el presente estudio se analiza la experiencia al cumplirse 15 años del primer caso realizado en nuestro centro, el 24 de septiembre de 199718.
MétodosPacientesEl grupo de estudio consta de 806 pacientes consecutivos llevados al laboratorio de hemodinamia para tratamiento percutáneo de comunicación interauricular de septiembre de 1997 a diciembre de 2011. De estos 806 pacientes, en 85 no se procedió a la colocación del dispositivo ya que, al realizar el estudio ecocardiográfico en el laboratorio o en el momento de realizar la oclusión con balón del defecto, se consideró que no eran candidatos a cierre percutáneo, generalmente por la ausencia de bordes septales en posiciones clave (ausencia de borde aórtico y borde posteroinferior) o por considerar el defecto demasiado grande para poder considerar su cierre. De los 721 pacientes restantes, en todos se procedió al cierre con la colocación exitosa inicial del dispositivo (éxito de colocación con intención de tratamiento 89.4%). Este grupo lo componen 216 hombres y 505 mujeres, con edad promedio de 20.6±16.5 años (límites, 1 a 71). En todos los casos se obtuvo el consentimiento informado del paciente o de su representante autorizado (padres).
ProcedimientoLos pacientes fueron llevados a la sala de cateterismo cardiaco y bajo sedación profunda o anestesia general e intubación orotraqueal, con monitorización continua del electrocardiograma (ECG) y de la saturación arterial de oxígeno transcutánea, se realizó un ecocardiograma transesofágico (HP sonos 1500 con transductor biplanar o multiplanar) y se determinó la ubicación y el tamaño exactos del defecto en el septum auricular. A partir de julio de 2002, con la introducción en nuestro laboratorio de la ecocardiografía intracardiaca, el procedimiento se realiza bajo sedación superficial y/o anestesia local y sin necesidad de intubación. La vena femoral derecha se puncionó en la forma rutinaria, se llevó a cabo una evaluación hemodinámica completa y se administraron 50u/kg de heparina. Para los casos realizados con ecocardiografía intracardiaca, se punciona también la vena femoral izquierda, sitio por donde se introduce la sonda Acunav® (Acuson, Inc.) con la cual se explora el septum interauricular. Se realizó angiografía en la vena pulmonar superior derecha en proyección oblicua anterior izquierda y con angulación craneal para demostrar la comunicación. Se introdujo un catéter con globo (St. Jude Medical) para ocluir el defecto y determinar el «diámetro expandido». Se escoge un dispositivo Amplatzer® igual, o ligeramente más grande, que el diámetro expandido del defecto. El introductor femoral se reemplazó por un introductor largo con dilatador central (St. Jude Medical) y se introdujo sobre la guía en la aurícula izquierda. Se va avanzando el oclusor septal Amplatzer® por esta camisa empujando el cable. Bajo control fluoroscópico y ecocardiográfico se despliega el disco distal y la cintura central en la porción media de la aurícula izquierda y se retira contra el septum auricular. El disco derecho se despliega en la aurícula derecha, retrayendo el introductor y manteniendo tracción ligera en el cable. En el 25% de los casos fue necesario realizar alguna maniobra especial para la colocación adecuada del dispositivo. La posición apropiada del dispositivo a través de comunicación interauricular es valorada mediante ecocardiografía. La estabilidad del dispositivo es valorada empujando y arrastrando suavemente con el cable de liberación. El rotor plástico es conectado al cable de liberación, el tornillo fijo se aprieta y el rotor se gira en forma antihoraria. La separación del dispositivo del cable liberador se observa mediante fluoroscopia y por ecocardiografía. Se pasa un catéter angiográfico a la arteria pulmonar o en la aurícula derecha y se realiza una angiografía para comprobar la posición del dispositivo y el cierre del defecto. Se finaliza repitiendo las mediciones hemodinámicas.
SeguimientoSe realizó un ECG, radiografía de tórax (posteroanterior y oblicua izquierda) y un ecocardiograma bidimensional y doppler de 24h después del procedimiento. Si el cierre es satisfactorio y la posición del dispositivo es fija, el paciente es egresado del hospital con un tratamiento de ácido acetilsalicílico de 100mg/día durante un periodo de 3 a 6 meses y profilaxis para endocarditis bacteriana. Todos los pacientes son valorados en 1, 3, 6, 12 meses y cada año con examen clínico, ECG, radiografía de tórax y/o ecocardiografía.
EstadísticaLos resultados se expresan en media o promedio±una desviación estándar. La media acotada se utilizó en la expresión de los resultados del tiempo del procedimiento y fluoroscopia debido a que algunos de los procedimientos resultaron desproporcionadamente prolongados, ya que se colocaron 2 dispositivos, y para tener una idea exacta del tiempo en el 90% de los procedimientos.
ResultadosEn todos los casos, la auscultación mostró soplo expulsivo pulmonar y desdoblamiento fijo del segundo ruido. En 85 pacientes no había cardiomegalia en la radiografía y el flujo pulmonar era normal o ligeramente aumentado. Los otros 636 pacientes, con defectos de 12mm o mayores, tenían algún grado de cardiomegalia e hiperflujo. Solo una paciente de 25 años con defecto de 7mm tenía un ECG normal, el resto presentaban bloqueo incompleto de la rama derecha del haz de His.
El defecto fue único en 684 pacientes y se encontraron 2 o más defectos en 37 pacientes (5%), 8 de ellos con fosa oval multifenestrada. El diámetro máximo del defecto principal medido con ecocardiografía fue de 19±6.2mm (límites, 3 a 37) y el diámetro expandido fue de 23±6.7mm (límites, 5 a 42). Consideramos defectos pequeños aquellos menores de 15mm de diámetro expandido, que se presentaron en 85 pacientes (12%); defectos de tamaño intermedio entre 15 y 24mm de diámetro expandido, con 343 pacientes (48%); y defectos grandes con diámetro expandido≥25mm en 276 pacientes (38%). La presión pulmonar sistólica varió de 15 a 120mmHg (promedio, 32.5±12.3), con 82 pacientes (11.4%) que tenían presión pulmonar sistólica≥50mmHg. El cociente entre el gasto pulmonar y el gasto sistémico promedio fue de 2.32±0.87 (límites, 1.1 a 6.8). Hubo 29 pacientes con cociente entre el gasto pulmonar y el gasto sistémico mayor de 4, 12 de ellos con cortocircuitos adicionales por defectos asociados (10 con persistencia del conducto arterioso que se cerró simultáneamente y 2 con comunicación interventricular). Se realizó además valvuloplastia pulmonar en 10 pacientes con estenosis valvular pulmonar y, en 2 casos con estenosis bilateral de ramas pulmonares, se colocaron stents en el mismo procedimiento.
De los 37 pacientes con defectos múltiples, estos se lograron ocluir con un solo dispositivo en 33 y con 2 dispositivos que se colocaron simultáneamente en 4. Una paciente con un defecto secundario de 3mm que parecía haber quedado cubierto con un solo dispositivo, tuvo que ser reintervenida 17 meses después para colocar un nuevo dispositivo en el defecto residual pequeño. En 15 casos (2.1%) fue necesario cambiar el dispositivo porque el colocado inicialmente se consideró inestable antes de su liberación; el resto de los dispositivos se consideraron estables y fueron liberadores. En 2 pacientes se inició el procedimiento con un dispositivo Helex® el cual embolizó y se cambió por un Amplatzer®. El control inmediato con ecocardiografía después de la liberación mostró oclusión completa de los defectos septales en 247 pacientes (34.2%), fuga mínima solo por dentro del dispositivo en 395 (54.8%), fuga ligera (considerada así por la presencia de un jet de cortocircuito menor de 1mm de diámetro) en 77 (10.7%) y fuga moderada (jet de cortocircuito entre 1 y 2mm de diámetro) en 2 pacientes (0.3%). El procedimiento completo en la sala de hemodinamia duró entre 10 y 270min (media acotada, 60) con un tiempo de fluoroscopia entre 2 y 190min (media acotada, 10.5). Los procedimientos más largos son aquellos en donde se colocaron 2 dispositivos. Se presentó embolización del dispositivo dentro de las primeras 24h después de su colocación en 6 pacientes (sin considerar los casos en donde embolizó el dispositivo Helex®) (0.8%), 4 de ellos en la sala de hemodinamia. En 4 de los casos el dispositivo fue rescatado y recolocado o cambiado por vía percutánea y solo 2 pacientes, uno con embolización a la aurícula izquierda y uno con embolización al ventrículo izquierdo fueron llevados a cirugía para la extracción del dispositivo y cierre quirúrgico del defecto sin complicaciones.
La radiografía de tórax y el ecocardiograma transtorácico realizados antes del alta mostraron adecuada posición de los dispositivos en los 719 pacientes que fueron egresados con dispositivo colocado (éxito poscolocación 99.7%, éxito final con intención de tratamiento 89.2%).
Se ha logrado seguimiento en 626 pacientes (87.1%) durante un promedio de 33±27.5 meses (límites 0.7-150). Durante el periodo de seguimiento se han presentado las siguientes complicaciones: cefalea postoclusión, la cual dura en promedio de 6 a 8 semanas y desaparece en forma espontánea, en 54 pacientes (8.6%); 10 pacientes (1.6%) presentaron arritmias supraventriculares nuevas (en 4 de ellos se habían documentado arritmias previas), y en uno de ellos con bloqueo auriculoventricular persistente fue necesaria la colocación de marcapasos definitivo (0.1%); 4 casos (0.6%) presentaron complicaciones en el sitio de punción, 2 con hematoma inguinal y 2 con fístula arteriovenosa femoral; y, finalmente, una paciente (0.1%) que tenía fibrilación auricular previa al cierre del defecto, presentó un accidente cerebrovascular 5 meses después del cierre del defecto que se presume se presentó porque la paciente suspendió el tratamiento anticoagulante después de ocluido el defecto. El estudio ecocardiográfico mostró desaparición del movimiento septal paradójico y disminución del diámetro telediastólico del ventrículo derecho de 37±6mm (límites, 18-58) a 26.2±4.1mm (límites, 18-36) (p<0.00001). En todos los pacientes seguidos excepto en 3, los defectos se encontraron completamente ocluidos después de 3 meses de seguimiento. De estos, 2 pacientes tienen fuga residual después de un año, una enferma, ya comentada previamente, tenía 2 defectos que se pensó inicialmente que quedarían cubiertos con un solo dispositivo, pero fue necesario realizar un segundo procedimiento colocando un dispositivo de 6mm en un defecto residual de 3mm de diámetro. El ecocardiograma un mes después de este último procedimiento mostró cierre completo de ambos defectos. En nuestra experiencia, no se han presentado embolizaciones de dispositivos después de las primeras 24h, ni fracturas de los dispositivos, interferencia con estructuras vecinas o erosiones de estructuras cardiacas como el techo de las aurículas o la aorta.
DiscusiónLa cirugía de la comunicación interauricular es un método de tratamiento ya probado, con una baja morbimortalidad que, sin embargo, no está exento de complicaciones a largo plazo1,2, sin mencionar el tiempo de internamiento, el dolor propio de la herida quirúrgica y el hecho de tener una cicatriz permanente de esternotomía. De hecho, en un estudio publicado recientemente por nuestro grupo, el cierre con dispositivo es superior al tratamiento quirúrgico en cuanto a la incidencia de complicaciones posprocedimiento, especialmente en pacientes adultos con hipertensión arterial pulmonar29. El intento de cierre transcateterismo de estos defectos cardiacos se inició en 1976 con King y Mills3, y desde entonces, los avances tecnológicos y la creatividad médica han creado diferentes tipos de dispositivos para el cierre percutáneo de los defectos septales interauriculares4–13. La mayoría de estos dispositivos constan de 2 discos opuestos que se adosan a cada lado del septum interauricular para cerrar el defecto. El oclusor septal Amplatzer® es un dispositivo que tiene características únicas que le proporcionan ventajas sobre los otros dispositivos15,22,23. Los resultados obtenidos con su uso lo han colocado como el dispositivo de elección para el cierre percutáneo de la comunicación interauricular, especialmente en defectos mayores de 20mm, con una alta tasa de éxito y de cierre completo de los defectos, prácticamente sin complicaciones14–30.
En nuestra experiencia de 15 años con el uso de este dispositivo, comprobamos la facilidad de su colocación con un resultado excelente; de los 721 pacientes en los que se intentó la colocación del dispositivo, se logró al final cierre completo sin cirugía en 719 (99.7%), incluso en aquellos con defectos septales múltiples. Es importante mencionar que, por las características del dispositivo, no se obtiene oclusión total inmediata del defecto, ya que existe cierto paso de sangre a través de la malla de alambre y del parche poroso de poliéster para promover la trombosis dentro del dispositivo y así obtener la oclusión completa y posterior endotelización, la cual se ha visto que se completa en 4 a 8 semanas15. Esta es la razón de mantener a los pacientes con tratamiento antiagregante plaquetario durante 3 a 6 meses, para evitar fenómenos embólicos, los cuales no se han presentado en los pacientes que han seguido adecuadamente el tratamiento.
El uso del ecocardiograma es fundamental en este procedimiento, ya que no solo nos da una visión previa inmejorable del septum interauricular y las mediciones del defecto, sino que es de primordial importancia para el adecuado posicionamiento del dispositivo y la valoración del resultado inmediato. Desde la introducción de la ecocardiografía intracardiaca en nuestro laboratorio incluso puede realizarse el procedimiento en pacientes adultos, solo con anestesia local y sin necesidad de intubación31.
En esta experiencia de 15 años, con la colocación en nuestro centro de más de 700 dispositivos, hemos observado que en la mayoría de los casos la técnica es rápida y sencilla, especialmente en los casos de defectos de tamaño pequeño o intermedio. El verdadero reto lo constituyen los defectos grandes, especialmente los mayores 25mm de diámetro expandido (276 pacientes, 38% de nuestros casos), en los cuales hay que aplicar diversas técnicas como la colocación desde las venas pulmonares, el apoyo con catéter, balón o la misma sonda de ultrasonido intracardiaco, el uso de camisas de liberación especial, etc., para poder colocar debidamente el dispositivo en su posición. Estos casos, además, suele haber ausencia de alguno de los bordes septales, generalmente el anterosuperior o retroaórtico, que está ausente en más del 70% de los casos con diámetros mayores de 25mm, o bien, más raramente, la ausencia del borde septal posteroinferior o de la vena cava inferior, especialmente si se asocia a ausencia del borde aórtico, situaciones en las que es preferible no realizar el cierre percutáneo por la alta incidencia de embolización del dispositivo32,33.
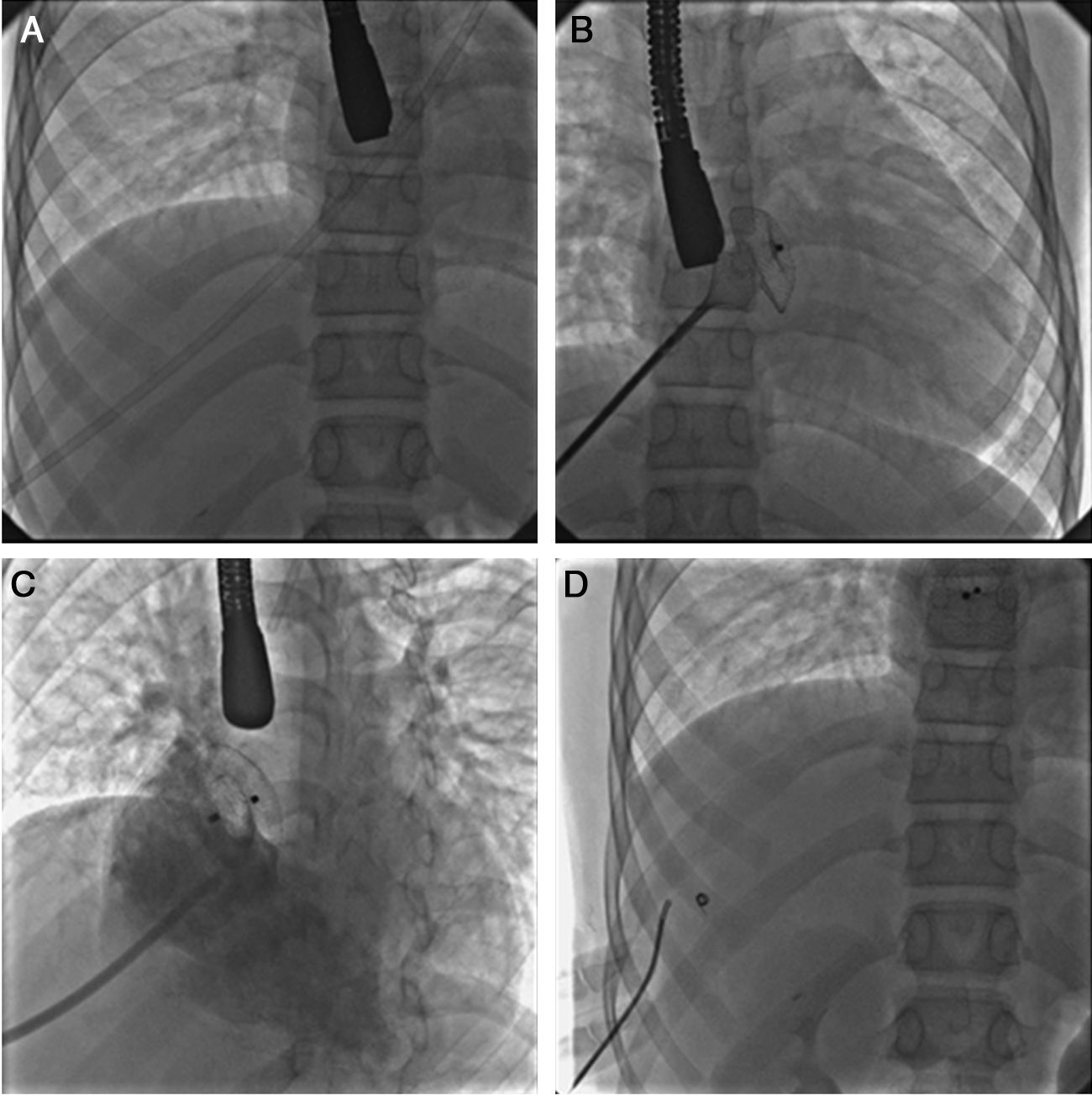
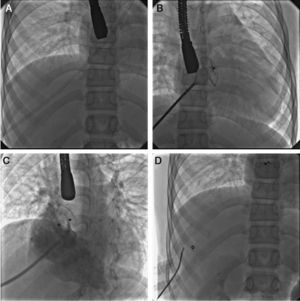
En casos especiales, como en los de levoisomerismo con interrupción de la vena cava inferior intrahepática, se puede realizar el procedimiento sin problema aunque la vía de acceso no sea femoral. En estos casos, con acceso femoral ausente, como ocurrió en 2 de nuestros pacientes, se recomienda el acceso por vía transhepática, realizado sin mayores dificultades (fig. 1). No mencionaremos las ventajas encontradas con respecto a la cirugía, ya que eso ha sido motivo de un estudio publicado previamente29; solo recordar que, aun cuando la tasa de morbilidad fuera la misma, el tiempo de estancia hospitalaria es más corto, no se requiere la administración de hemoderivados, el tiempo de anestesia es menor, y se evita el dolor y la cicatriz de la esternotomía.
Secuencia del cierre de una comunicación interauricular en un caso con levoisomerismo e interrupción de la porción hepática de la vena cava inferior por vía transhepática. A. Se observa la camisa larga en posición desde su entrada por el hígado hasta la posición de la aurícula izquierda. B. Una imagen de la colocación del dispositivo el cual se encuentra con el disco izquierdo y la cintura central completamente desplegados. C. Angiografía en posición oblicua izquierda con angulación craneal en la aurícula derecha que muestra el dispositivo colocado, liberado y en posición correcta ocluyendo el defecto. D. Imagen final una vez retirados los catéteres y ocluido el trayecto intrahepático con un dispositivo tipo espiral.
La preocupación actual con este dispositivo han sido los escasos casos informados de erosión de la raíz aórtica con fístulas hacia las aurículas, o del techo de las aurículas con el consiguiente taponamiento cardiaco y posible muerte34,35. Este hecho aparentemente se ha relacionado con el uso de dispositivos con diámetro mucho mayor que el tamaño del defecto, por lo que se recomienda no sobredimensionar excesivamente los dispositivos35. En nuestra experiencia, aún no se han presentado casos con esta grave complicación. El seguimiento ha mostrado la seguridad en nuestra experiencia, con una tasa de complicaciones totales (incluyendo la cefalea autolimitada) del 11% y complicaciones importantes en menos del 1%.
ConclusiónEl dispositivo Amplatzer® es un oclusor de comunicación interauricular cuyo diseño permite el cierre de defectos tipo ostium secundum con una técnica de carga, posicionamiento y liberación sencilla, en un tiempo relativamente corto y con seguridad para el paciente.
FinanciaciónEl presente trabajo no recibió financiamiento específico.
Conflicto de interesesEl Dr. Carlos Zabal es consultor de St. Jude Medical.