Introducción
El concepto de corazón univentricular funcional creado por Anderson y colaboradores, engloba un heterogéneo grupo de entidades anatómicas que tienen en común la presencia de una masa ventricular en la cual uno de los ventrículos es incapaz de mantener independientemente la circulación sistémica o pulmonar.1, 2
La incorporación de las técnicas quirúrgicas de by pass del ventrículo derecho por Fontan y colaboradores,3 y Kreutzer y colaboradores,4,5 han creado un nuevo paradigma que posibilitó el enfoque racional de esta patología de elevadísima morbimortalidad, cambiando sustancialmente su pronóstico y la calidad de vida de estos pacientes.6
La modificación de la técnica por De Leval y colaboradores7 consistente en lo que hoy conocemos como cavo pulmonar total (CPT) y la estrategia de hacerla en períodos secuenciales, con una anastomosis vena cava superior-arteria pulmonar (Glenn bidireccional) previa,8,9 así también como distintos adelantos en su enfoque han mejorado sensiblemente los resultados.10,11
El tratamiento quirúrgico del síndrome de hipoplasia de ventrículo izquierdo (SHVI) por Norwood y colaboradores,12 e importantes y sucesivos cambios médico quirúrgicos,13,14 posibilitaron también el by pass del ventrículo izquierdo.
El advenimiento del concepto de by pass ventricular han hecho de esta opción el tratamiento de elección del corazón univentricular funcional, diferenciándose solamente en el enfoque inicial neonatal que será necesariamente individual, acorde a la patología de base y un tratamiento quirúrgico posterior común realizado en etapas secuenciales.
Métodos
Desde mayo de 1998 a mayo de 2009 se incluyeron en forma prospectiva-retrospectiva (bidireccional) a 84 pacientes con diagnóstico de corazón univentricular funcional seguidos desde el período neonatal. Fueron excluidos los pacientes que llegaron al estadío 2 (Glenn) y estadío 3 (CPT) sin seguimiento previo de nuestro grupo. En todos se realizó un enfoque terapéutico secuencial: en el estadio 1 (neonatal) se procedió según la anatomía de base y el balance de la circulación sistémica-pulmonar, optándose por la restricción o incremento del flujo pulmonar o restitución del flujo sistémico según fuera el caso, y de existir naturalmente flujos balanceados, por el manejo clínico hasta el siguiente estadío. La segunda y la tercera etapa, fueron comunes para todos los pacientes, efectuándose en el estadio 2 una anastomosis vena cava superior (VCS)-arteria pulmonar (AP) (Glenn bidireccional) y en el estadio 3 anastomosis cavo-pulmonar total con tubo extracardiaco. Se analizaron las siguientes variables: edad, procedimientos realizados, estratificación de riesgo según el método Risk Adjustment for Congenital Heart Surgery (RACHS),15 mortalidad por estadío e ínter estadío y complicaciones en el seguimiento.
Las variables cuantitativas se reportan como mediana (rango) y las variables categóricas se reportan como porcentajes con sus respectivos intervalos de confianza (IC) 95%. Para calcular supervivencia durante el seguimiento, se realizó curva de Kaplan-Meier.Resultados
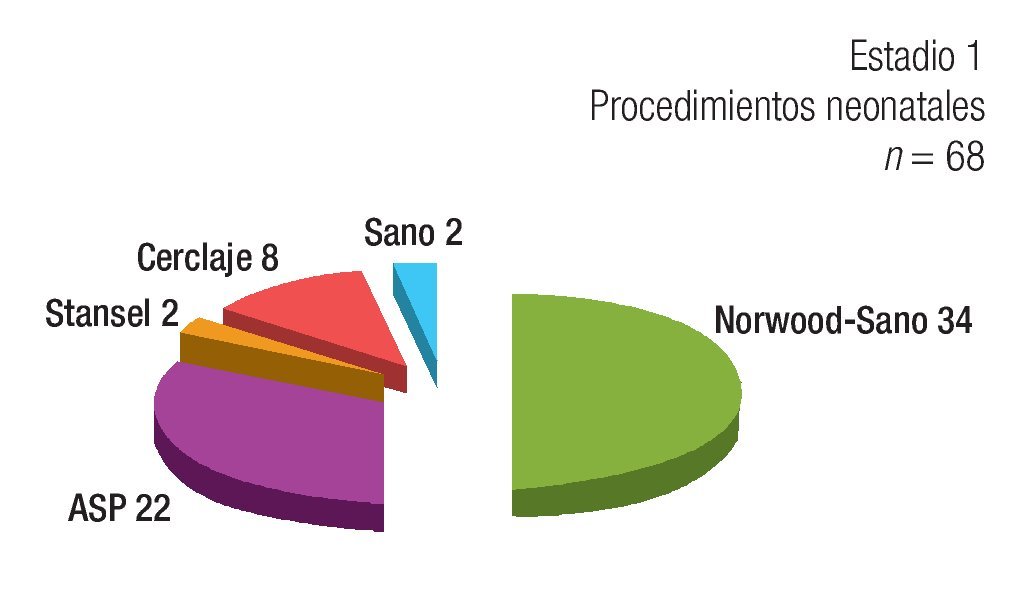
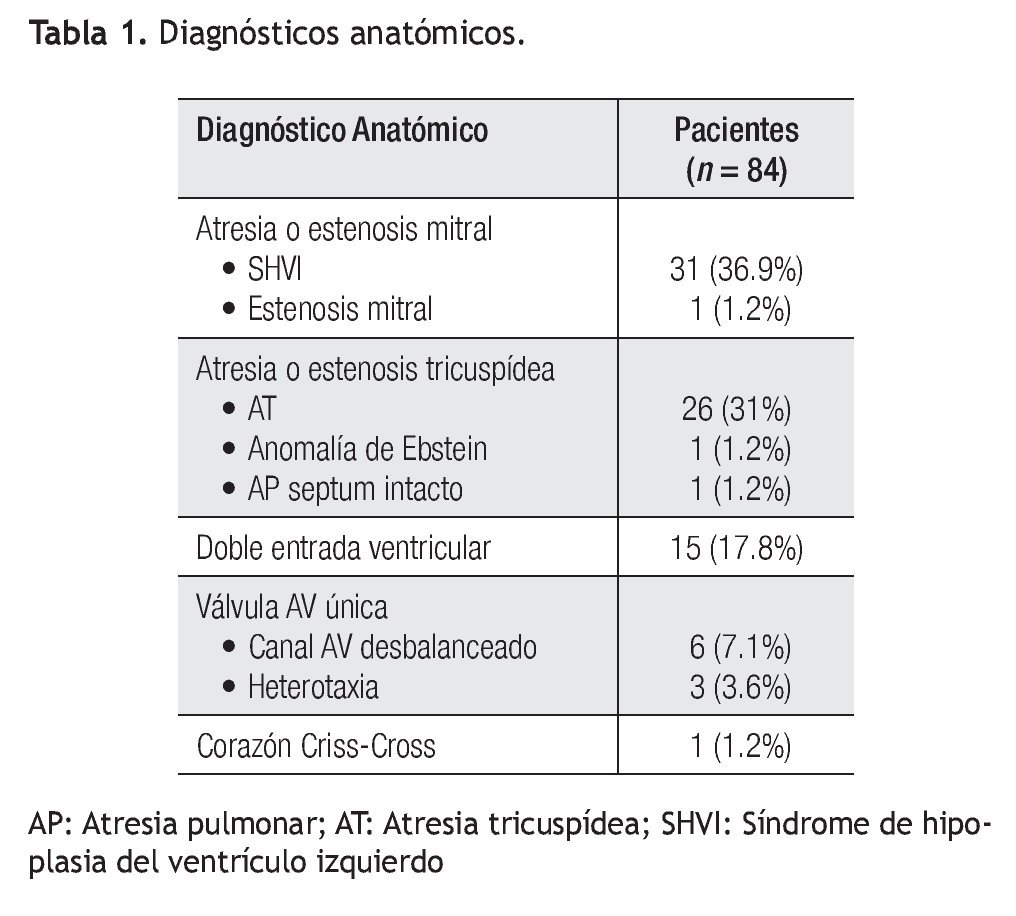
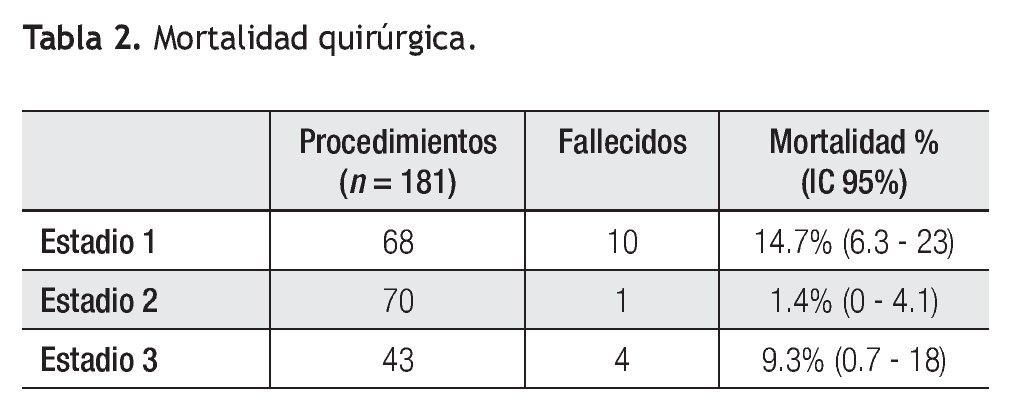
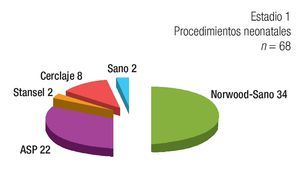
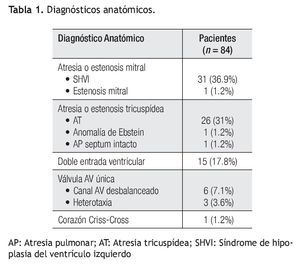
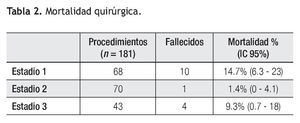
Estadio 1: De los 84 pacientes, 68 requirieron un primer estadío quirúrgico (Figura 1). Los diagnósticos anatómicos se detallan en la Tabla 1. La edad mediana fue de 5.5 días (rango = 2 a 60). Se realizó anastomosis subclavio- pulmonar (ASP) (RACHS 3) en 22 pacientes. En ocho pacientes se efectuó cerclaje pulmonar (RACHS 3); de éstos, cuatro requirieron, además, reparación de coartación de aorta. En 34 pacientes se realizó cirugía de Norwood-Sano (RACHS 6). En dos pacientes, Stansel (RACHS 6), uno de ellos con Sano, el otro con ASP. En otros dos, desconexión de arteria pulmonar más Sano (RACHS 6). La mortalidad en este estadio fue de 14.7% (IC 95: 6.3% a 23%) (Tabla 2). De los diez pacientes fallecidos, nueve fueron operados con Norwood-Sano y otro con Stansel Sano, todos RACH 6.
Figura 1. Procedimientos realizados en la etapa neonatal. ASP: anastomosis sistémico-pulmonar.
Fallecieron entre el primer y segundo estadío cuatro pacientes: tres con diagnóstico de SHVI y uno con heterotaxia poliesplenia.
Estadio 2: Se realizaron 70 cirugías de Glenn bidireccional (RACHS 2), 54 provenían del grupo anterior y 16 sin tratamiento quirúrgico previo. La edad mediana fue de cuatro meses (rango = 3 a 12). Un paciente falleció en el posoperatorio inmediato, siendo la mortalidad en esta etapa del 1.4% (IC 95: 0% a 4.1%). A once de estos pacientes se les efectuó en el mismo acto quirúrgico algún procedimiento adicional: seis septectomías auriculares, dos Stansel, dos reparaciones de coartación de aorta, y una plástica de ramas pulmonares. Entre los estadios 2 y 3 fallecieron seis pacientes (cinco con SHVI y uno con atresia pulmonar septum intacto, con sinusoides coronarios).
Estadio 3: Se realizaron 43 CPT (RACHS 3). La edad mediana fue de tres años (rango = 2 a 6). En todos se colocó tubo extracardiaco, 18 fenestrados. En este estadío fallecieron cuatro pacientes, 9.3% (IC 95: 0.7% a 18%). Se cerraron posteriormente por cateterismo ocho fenestraciones.
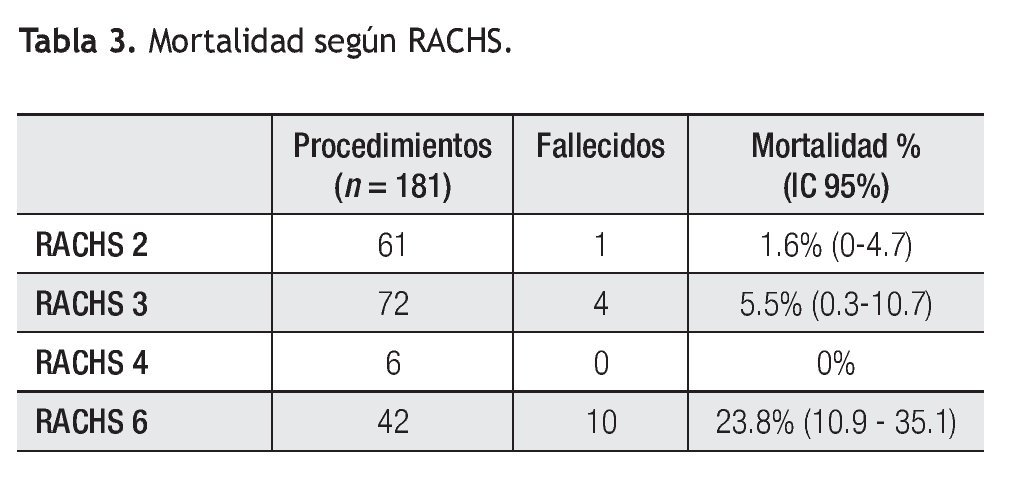
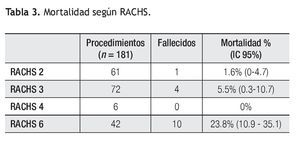
Según la estratificación de riesgo quirúrgico (RACHS) de los 181 procedimientos se observó la siguiente mortalidad (Tabla 3): RACHS 2 (n = 61) 1.6% (IC 95: 0% a 4.7%), RACHS 3 (n = 72) 5.5% (IC 95: 0.3% a 10.7%), RACHS 4 (n = 6) 0%, RACHS 6 (n = 42) 23.,8% (IC 95: 10.9% a 35.1%).
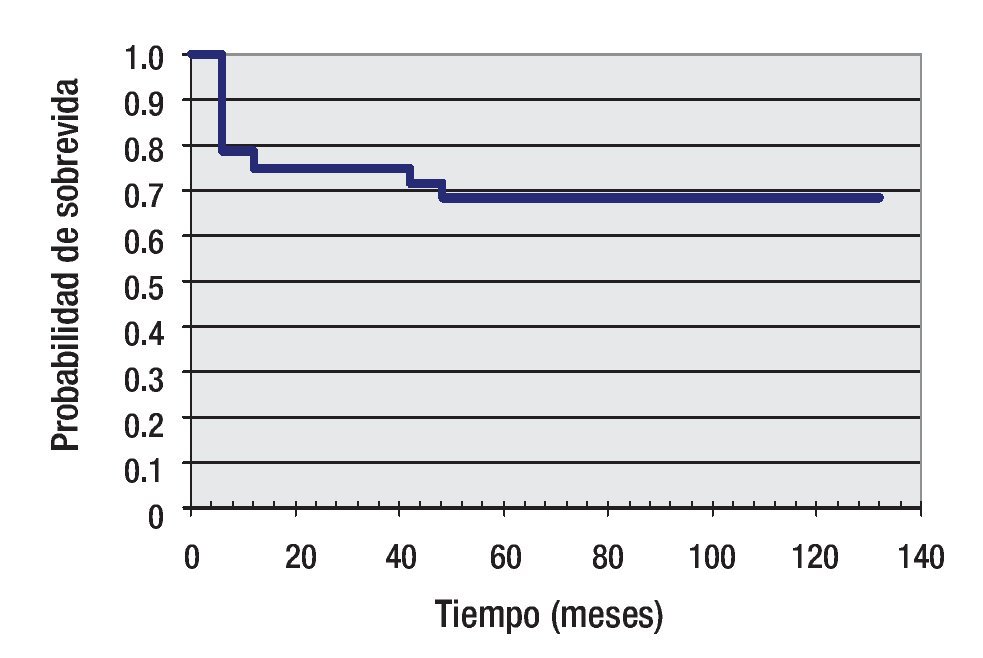
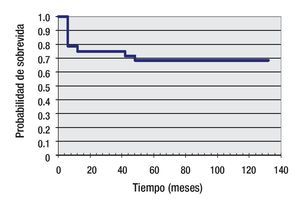
Seguimiento: La media de seguimiento fue de 52 meses (rango = 2 a 132). 39 pacientes ya completaron los tres estadíos y 20 completaron hasta el segundo estadío. Todos se encuentran en clase funcional 1. En diez pacientes se realizó angioplastia con balón por reacoartación de aorta entre el primer y tercer estadio. Tres pacientes presentaron ACV isquémicos en el postquirúrgico inmediato. En el seguimiento alejado, posterior al CPT, dos pacientes requirieron embolización de colaterales por sangrado (hemoptisis). Ningún paciente desarrolló arritmias significativas en todo el seguimiento. La mortalidad total interestadío (diez pacientes) fue de 11.9% (IC 95; 5.1% a 18.9%), cuatro pacientes entre el estadio 1 y 2, y seis entre el estadio 2 y 3. Los índices de sobrevida están expresados en la curva de Kaplan Meier (Figura 2).
Figura 2. Curva de Kaplan-Meier. Sobrevida a 10 años: 69%.
Discusión
El enfoque terapéutico inicial para el Estadio 1 del corazón univentricular funcional comienza en el período neonatal. Varía de acuerdo al diagnóstico anatómico y apunta a establecer flujos pulmonares (Qp) y sistémicos (Qs) adecuados y balanceados. Esto se logra con diversos procedimientos paliativos o reconstructores acorde a la fisiopatología de la enfermedad de base. El tratamiento inicial es médico, y de existir restricción a estos flujos, ya sea sistémico o pulmonar, el objetivo es asegurar la permeabilidad ductal y lograr una perfusión adecuada del circuito obstruido. La droga de elección es la prostaglandina, cuyo empleo ha cambiado la historia natural de esta entidad,16-18 permitiendo no sólo la sobrevida sino también la cirugía en un paciente compensado y por ende con mejor pronóstico. La paliación quirúrgica inicial cuando existe disminución del Qp es la anastomosis subclavio-pulmonar modificada; también hemos empleado la anastomosis ventrículo pulmonar conocida como Sano19 particularmente en el contexto del SHVI. La ASP permite una perfusión pulmonar apropiada en los recién nacidos y la empleamos electivamente en este estadío, pero es importante señalar que puede producir distorsiones del árbol pulmonar como así también sobrecarga de volumen crónica, con el consiguiente deterioro de la función ventricular y el agravamiento de la insuficiencia de la válvula aurículo-ventricular que muchas veces acompaña a esta entidad.
Si es necesario restringir el Qp, el procedimiento de elección es el cerclaje o banding de la arteria pulmonar, con conocidas complicaciones alejadas tales como migración, distorsión pulmonar e hipertrofia ventricular; por eso indicamos el quite del cerclaje en forma temprana y electiva en el Estadio 2. Contraindicamos este procedimiento cuando la aorta emerge del ventrículo hipoplásico (ejemplo: atresia tricuspídea más transposición) y la comunicación inter-ventricular es restrictiva, por el peligro de un rápido desarrollo de estenosis subaórtica. En esos casos preferimos el empleo de la cirugía de Stansel-Sano.20
Cuando existe restricción al flujo sistémico (ejemplo: SHVI), el restablecimiento del Qs es de mayor complejidad quirúrgica, e indicamos en los primeros días de vida la reconstrucción anatómica de la aorta empleando el procedimiento de Norwood-Sano12 o Stansel.20 Los 16 pacientes del grupo inicial de recién nacidos que presentaron un Qp- Qs naturalmente balanceado por restricción parcial al flujo pulmonar, pasaron al estadío 2 sin cirugía neonatal previa.
Por último queremos señalar la mayor mortalidad observada en este estadío, que atribuimos no a la edad sino a la complejidad de las cirugías efectuadas (RACHS 6), hecho estadísticamente demostrado en trabajos previos.21,22
Para el Estadio 2, indicamos la anastomosis VCS -AP (Glenn bidireccional), en forma electiva e independiente de la edad o del buen estado general, entre el tercer y sexto mes de vida, edad en que la resistencia vascular pulmonar cae, y permite una adecuada perfusión pulmonar. Consideramos importante restablecer un flujo pulmonar obligatorio con la consiguiente disminución de la sobrecarga de volumen ventricular y mejoría de la saturación sistémica, de ese modo se preserva al único ventrículo de los factores de riesgo que alteran su función, como los ya señalados de sobrecarga de volumen, hipertrofia e hipoxia.
En estos pacientes indicamos cateterismo cardiaco o resonancia nuclear magnética23 previos a la cirugía, por la importancia que tiene reconocer la existencia de distorsiones anatómicas que deben ser solucionadas en el mismo procedimiento, tales como comunicación interauricular restrictiva, distorsiones del árbol pulmonar, coartación de aorta y estenosis subaórtica.
En el Estadio 3, la derivación total del flujo venoso al pulmón se logra con la anastomosis de la vena cava inferior por un tubo extra cardiaco (CPT). Indicamos esta cirugía al igual que en el estadío anterior, en forma electiva, entre el tercer y cuarto año de vida.
Son varios los motivos para no demorar innecesariamente esta cirugía, entre ellos: restablecer tempranamente una oxigenación normal; restituir la circulación hepática al árbol pulmonar, ya que existe un factor hepático que inhibe el desarrollo de fístulas arteriovenosa pulmonares y favorece su regresión espontánea24,25 y la disminución, con la edad, del porcentaje del flujo venoso total que tiene la VCS.26
Previo a este estadío quirúrgico se indica siempre cateterismo cardiaco, en el cual se realiza una cuidadosa evaluación hemodinámica con toma de presiones y cálculo de resistencias pulmonares, angiografía del árbol pulmonar y embolización de colaterales sistémico pulmonares preexistentes. La fenestración del tubo se indica de existir algún factor agravante.27,28
Si bien el período de seguimiento es aún insuficiente y pocos los pacientes que han completado los tres estadíos, los eventos ocurridos en el largo plazo han sido escasos. No hay mortalidad alejada y tampoco presencia de arritmias significativas.
Después del Estadio 3, no hubo nuevas intervenciones quirúrgicas, pero sí procedimientos hemodinámicos inter-vencionistas, tales como cierre de la fenestración por cateterismo en ocho pacientes y embolización de colaterales por presentar hemoptisis en dos pacientes. Esperamos que el largo plazo nos indique si estamos en el camino correcto con este enfoque secuencial que consideramos el adecuado en base a los conocimientos actuales.
Conclusiones
El enfoque quirúrgico secuencial, desde el período neonatal, ha cambiado la historia natural de esta entidad con índices de sobrevida aceptables y una restauración de la circulación en serie que permite una oxigenación adecuada, con mortalidad acorde a la patología de base y un seguimiento a mediano plazo alentador y mejorable en el futuro.
Adendum: Desde el envío del manuscrito y hasta la fecha, el número de pacientes operados en el Estadio 1, es de (n = 80), en el Estadio 2 (n = 77) y en el Estadio 3 (n = 55).
Correspondencia: Francisco Comas.
Montañeses 2325, Ciudad Autónoma de Buenos Aires. Argentina. (C1428AQK)
Teléfono: 5777 3200 Fax: 5777 3209.
Correo electrónico:comas_f@hotmail.com; Mariano Ithuralde: mithuralde@fleni.org.ar
Recibido el 23 de febrero de 2010;
aceptado el 8 de marzo de 2011.