Las enfermedades cardiovasculares constituyen una causa importante de morbimortalidad en la población general. En este sentido el desbalance autonómico forma parte del cuadro fisiopatológico que subyace al desarrollo de estas enfermedades. El objetivo de este estudio fue determinar el efecto del entrenamiento físico sobre la variabilidad del ritmo cardiaco (VRC) en pacientes con insuficiencia cardiaca.
MetodologíaSe realizó una revisión sistemática de la literatura. Fueron considerados ensayos clínicos con asignación aleatoria, estudios cuasiexperimentales con grupo control equivalente, estudios cuasiexperimentales sin grupo control y con análisis pre- y postintervención, y estudios cruzados, con períodos de entrenamiento y desentrenamiento asignados de manera aleatoria. Se calcularon las diferencias medias estandarizadas entre los parámetros de VRC pre- y postintervención para el grupo control y experimental.
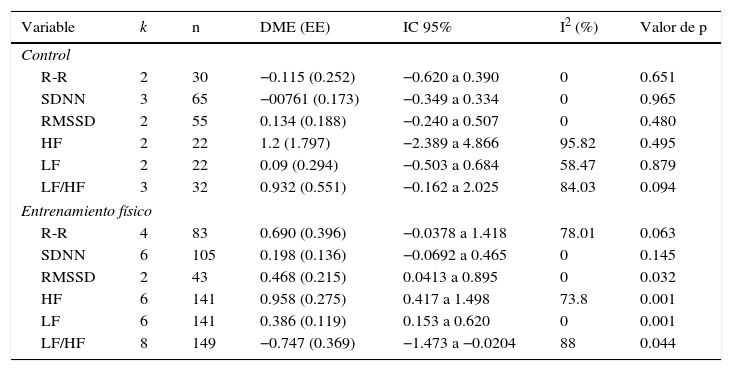
ResultadosEn el análisis intrasujeto del grupo control, no se observó significación estadística en las diferencias medias estandarizadas entre el valor preintervención y el postintervención de los parámetro de VRC. En el grupo experimental, las diferencias medias estandarizadas fueron estadísticamente significativas para la raíz cuadrada del promedio de las diferencias al cuadrado entre intervalos R-R adyacentes (+0.468±0.215; p=0.032) y las bandas de alta (HF) (0.934±0.256; p<0.001) y baja (LF) (0.415±0.096; p<0.001) frecuencia; así como para el índice LF/HF (−0.747±0.369; p=0.044). Por otra parte, tan solo 3 estudios entraron en el metaanálisis de estudios comparativos. En el metaanálisis de estudios comparativos se observó un efecto favorable al grupo experimental para las variables: LF/HF (−2.21±IC 95%: −3,83 a −0.60), HF y LF.
ConclusiónEl entrenamiento físico fue efectivo en mejorar la VRC y restableció el balance autonómico en pacientes con insuficiencia cardiaca.
Cardiovascular diseases are a significant cause of morbidity and mortality in the general population. In this sense, the autonomic imbalance is the cornerstone of the pathophysiology underlying the development of these diseases. The aim of this study was to determine the efficacy of exercise training on heart rate variability (HRV) in adult patients with chronic heart failure.
MethodologyA systematic literature review was conducted in electronic databases. The considered studies were randomised clinical trials, quasi-experimental studies with non-randomised control group, quasi-experimental studies with analysis of pre- and post- intervention, and crossover studies with randomly assigned training and non-training periods. The standardised mean differences were calculated between pre- and post-intervention in both the control and experimental group.
ResultsWithin-subject analysis of the control group showed no statistical significance in the standardised mean differences of HRV. In the experimental group, the standardised mean differences were positive for the root mean square of successive difference (+0.468±0.215; P=.032), high frequency band (HF) (0.934±0.256; P < .001) and low frequency band (LF) (< 0.415±0.096; P=.001). Moreover, the standardised mean difference was negative for LF/HF (−0.747±0.369, P=<.044). On the other hand, only 3 studies entered the comparative meta-analysis. The effect of exercise training was favourable for the experimental group in LF/HF (−2.21±95% CI: −3.83 to −0.60), HF, and LF.
ConclusionThe exercise training was effective in increasing HRV and restoring the autonomic balance in patients with heart failure.
Las enfermedades cardiovasculares son un problema que afecta a millones de personas en todo el mundo, sin distinción de sexo, edad, raza o etnia. Son la causa principal de muerte a nivel mundial con 17.3 millones de muertes por año, para el año 2030 se espera que aumente a más de 23.6 millones1,2. En el 2012 murieron por esta causa 17.5 millones de personas, lo cual representa un 31% de las muertes registradas en el mundo. De estas, 7.4 millones se debieron a la cardiopatía coronaria y 6.7 millones a accidente cerebrovascular3.
Una de las enfermedades cardiovasculares más prevalentes en la población corresponde a la insuficiencia cardiaca (IC), la cual constituye un síndrome clínico complejo que resulta de un trastorno morfológico y/o funcional que afecta la capacidad ventricular para llenar o expulsar sangre4,5. Presenta una incidencia de 10 por cada 1,000 habitantes después de los 65 años1,6. Como factores etiológicos de la IC se encuentran la cardiopatía hipertensiva, la cardiopatía isquémica asociada con un infarto previo y la miocardiopatía dilatada7,8.
En la IC, el corazón no puede responder adecuadamente a la demanda sanguínea9. Adicionalmente, la reducción del gasto cardiaco puede ocasionar congestión pulmonar y edema periférico, comprometiendo significativamente la tolerancia al ejercicio, la capacidad funcional y la calidad de vida10. Adicionalmente, en la IC existen cambios moleculares y endocrinos que se asocian a la depresión de la función sistólica. Estos se caracterizan por la activación del sistema renina-angiotensina-aldosterona (SRAA) y la simpaticoexcitación11, las cuales van a promover la remodelación del ventrículo izquierdo12,13.
Adicionalmente, diversos estudios han establecido la existencia de desregulación de los mecanismos de control cardiovascular, lo cual ha quedado en evidencia mediante la disminución de la variabilidad del ritmo cardiaco (VRC) observada en estos pacientes14,15. Estos parámetros han sido considerados importantes predictores de gravedad en este grupo de pacientes16–19.
Por otra parte, hoy en día es aceptado que el ejercicio físico (EF) posee importantes efectos cardioprotectores en este grupo de pacientes20,21. Estos han sido asociados con la activación de diversos mecanismos dirigidos al restablecimiento de la función miocárdica y reversión del desbalance autonómico22–25.
Diversos estudios han revelado que el EF incrementaría la VRC en pacientes con IC26,27. No obstante, si realmente el EF mejora la VRC y restablece el balance autonómico no ha sido estudiado mediante una revisión sistemática (RS). Por este motivo, el objetivo de este estudio fue determinar el efecto del entrenamiento sobre la variabilidad del ritmo cardiaco en pacientes con IC crónica.
El manuscrito se desarrolló siguiendo las normas PRISMA, para el reporte de RS28.
Material y métodosDiseñoEl presente estudio corresponde a una RS.
Criterios de elegibilidad de los artículos primariosFueron considerados estudios realizados en humanos, sin restricción idiomática ni año de ejecución, cuyo diseño fuese: ensayos clínicos con asignación aleatoria (EC), estudios cuasiexperimentales con grupo control equivalente, estudios cuasiexperimentales sin grupo control y con análisis pre- y postintervención; y estudios cruzados, con períodos de entrenamiento y desentrenamiento asignados de manera aleatoria.
Sujetos de estudioLos sujetos de estudio fueron caracterizados como adultos de ambos géneros, con diagnóstico de IC al momento de la intervención.
IntervenciónComo intervención fue considerada una o más de las siguientes modalidades de entrenamiento: EF aeróbico continuo por al menos 20min de intensidad baja <40%, moderada entre el 40 y 80%; ejercicio interválico de alta intensidad, el cual debía contener períodos breves de ejercicio a una intensidad superior al 80% e intervalos a intensidades entre el 40-60%; y el entrenamiento basado en ejercicios de fortalecimiento muscular.
El protocolo de entrenamiento debía ser dosificado de acuerdo a algún parámetro fisiológico de referencia como VO2máx, VO2 pico, frecuencia cardiaca de reserva, frecuencia cardiaca pico o trabajo máximo. Adicionalmente, fue considerado un período mínimo de 4 semanas de entrenamiento, el cual debía ser finalizado por al menos el 20% de la muestra inicial.
Se excluyeron aquellos estudios que agruparon los datos de adultos con otras enfermedades cardiovasculares y/o metabólicas en los que no se realizó análisis por subgrupos. También se excluyeron aquellos estudios realizados en menores de 18 años.
Variables de interésComo variables de interés fueron considerados los parámetros de VRC del dominio tiempo y dominio frecuencia. Solo fueron considerados aquellos estudios que reportaron registros continuos en condiciones de reposo, diurno o nocturno, por períodos≥5min29.
Del dominio tiempo fueron considerados el intervalo R-R, el índice desviación estándar de todos los intervalos R-R, el índice raíz cuadrada del promedio de la suma de las diferencias al cuadrado, entre intervalos R-R adyacentes (RMSSD). Por su parte, del dominio frecuencia fueron considerados los componentes espectrales obtenidos mediante análisis de poder espectral autorregresivo o transformación rápida de Fourier. Así, fue considerado el poder espectral en la banda de alta frecuencia (HF) (0.15–0.4Hz) y baja frecuencia (LF) (0.04-0.15Hz) en valores absolutos (ms2) y unidades normalizadas (nu). Adicionalmente fue considerada la relación LF/HF29.
Búsqueda de artículosLa búsqueda de artículos se realizó en las bases de datos MEDLINE, ProQuest, Scientific Electronic Library Online (SciELO), TripDatabase, Physiotherapy Evidence Database (PEDro), SPORTDiscus, Rehabilitation and Sports Medicine Source (R&SMS), Cumulative Index to Nursing & Allied Health Literature (CINAHL). Fueron considerados artículos desde su ingreso a la base de datos hasta el 21 de julio de 2016.
Fueron utilizados los términos descriptores médicos (Medical Subject Headings [MeSH]): entrenamiento, rehabilitación, ejercicio, sistema nervioso simpático e insuficiencia cardiaca; y los términos libres: entrenamiento físico, control autonómico, balance autonómico, modulación autonómica, variabilidad del ritmo cardiaco. También se utilizaron los operadores booleanos AND y OR. La búsqueda sistemática fue realizada en 2 ocasiones en las bases de datos mencionadas. La primera se efectuó el 1 de noviembre de 2015 y la segunda el 21 de julio de 2016.
Identificación de los artículosSe revisaron los títulos y los resúmenes de los artículos atingentes. Luego se obtuvieron los textos extensos de aquellos resúmenes que cumplieron con los criterios de elegibilidad. Los datos fueron enmascaradamente extraídos por 2 investigadores independientes (VS, IR) y registrados en una planilla ad hoc. Se registró el nombre del autor, año de publicación, tipo de diseño, lenguaje de publicación, tamaño de la muestra, edad de los sujetos, protocolo de entrenamiento, modalidad de entrenamiento, intensidad de ejercicio, duración del entrenamiento, parámetros considerados para el análisis de VRC, las condiciones del registro, duración del registro y el método utilizado para el registro.
Evaluación de la calidad metodológica y riesgo de sesgoLa calidad metodológica (CM) fue evaluada de manera independiente por 2 revisores (VS, IR) a través de la escala PEDro, las discrepancias fueron resueltas por consenso. Los artículos primarios fueron categorizados de acuerdo a su CM como «excelentes» si presentaron una puntuación de 9-11; de «buena calidad», si presentaron un puntaje de 6-8; de calidad «regular», si presentaron una puntuación de 4 o 5; mientras que los estudios con una puntuación por debajo de 4 fueron categorizados como «mala» CM.
El riesgo de sesgo fue evaluado en todos los artículos primarios por los investigadores (VS, IR) de acuerdo a las recomendaciones sugeridas por el manual Cochrane para RS30. De este modo, fue determinada la existencia de riesgo de sesgo de selección, de realización, de detección, de desgaste y de notificación en los estudios incluidos.
Síntesis de datos y análisis estadísticoSe realizó análisis descriptivo de los datos con cálculo de promedios ponderados para las variables cuantitativas y porcentajes para las variables cualitativas. Con el fin de combinar los datos de los artículos primarios fueron calculadas las diferencias medias estandarizadas (DME) entre los valores de los parámetros pre- y postintervención, tanto en el grupo control como en el experimental31–41. En los estudios con diseño cruzado fue considerado como grupo control el período de desentrenamiento de la muestra estudiada34,35. Adicionalmente, fue comparada la magnitud del efecto entre grupos en aquellos estudios comparativos (ECA y estudios cuasiexperimentales con grupo control equivalente) que reportaron los mismos parámetros de enfermedad cardiovascular36–41. Esto se realizó mediante el cálculo de las DME de la magnitud del efecto entre el grupo control y experimental.
El metaanálisis fue realizado de acuerdo al modelo de efectos aleatorios y la heterogeneidad fue determinada mediante el cálculo del coeficiente I2, el cual, fue calculado como I2=100%×(Q×df)/Q; donde Q es el coeficiente Cochrane y df son los grados de libertad.
El análisis estadístico fue realizado con el software RevMan 5.3 y fue considerado un valor de p<0.05 como significativo.
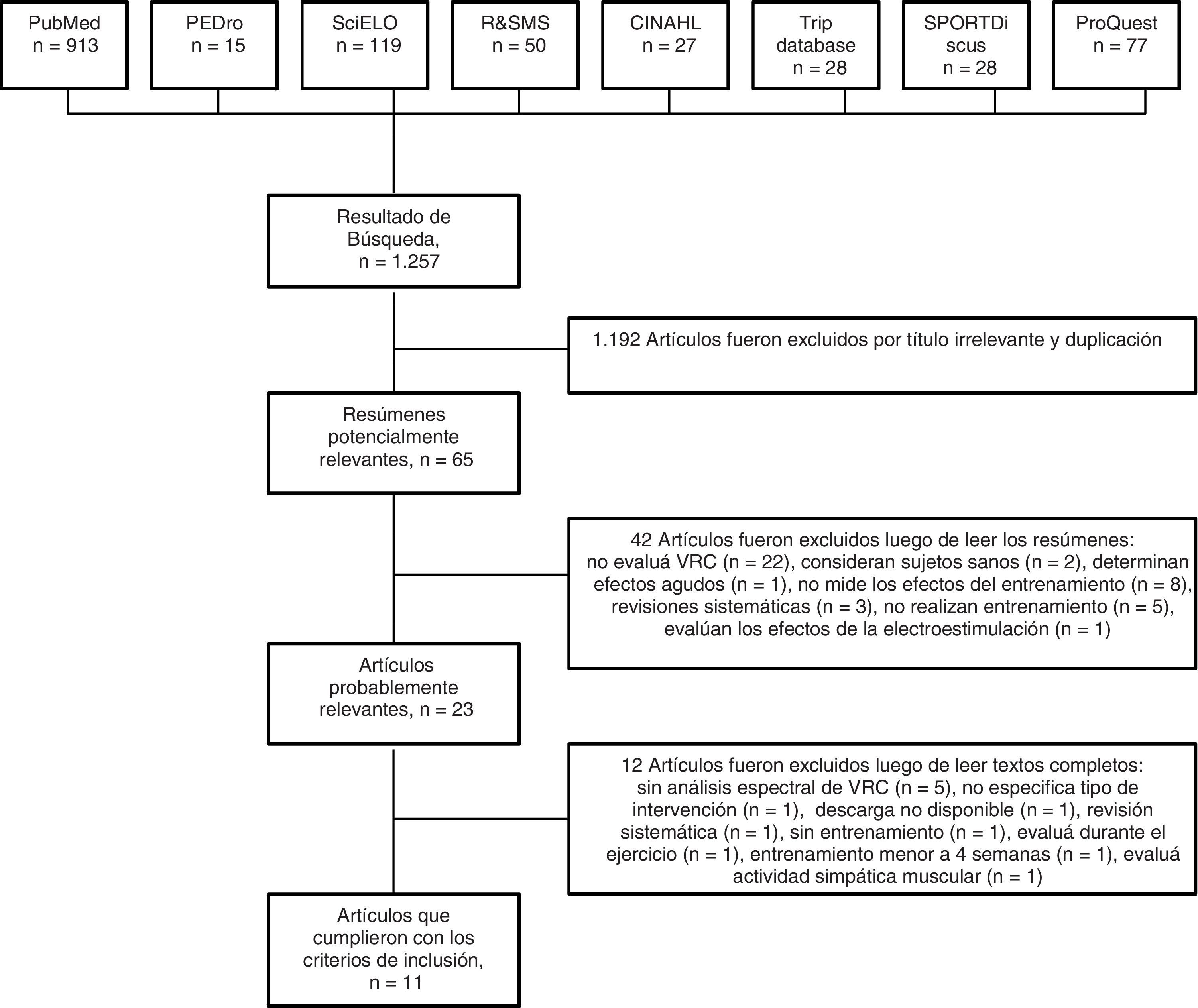
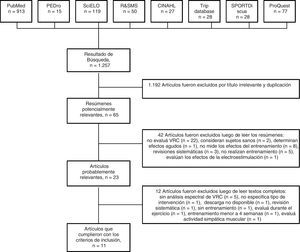
ResultadosSelección de los estudiosLas estrategias de búsqueda arrojaron un total de 1,257 artículos desde las 8 bases de datos consultadas. En la figura 1 se describe la secuencia de búsqueda sistemática y las razones de la exclusión. Un total de 11 artículos fueron finalmente considerados para la revisión (fig. 1).
Características de los artículos primariosTodos los artículos fueron escritos en inglés. El rango de años de las publicaciones fue entre 1995 y 2014. El tamaño de la muestra encontrado en los artículos analizados fue entre 6 y 57 participantes. La población de los 11 estudios representa a un total de 352 sujetos, de ellos 92 integraron el grupo control y 260 el grupo experimental. Por otro lado, 226 (86.9%) fueron hombres y 69 (26.5%) mujeres. En los 11 (100%) artículos se describieron los rangos de edad. El promedio ponderado de la edad fue 60.7 años (mínima de 49.3 y máxima de 10.7 años).
Cinco de los 11 estudios son EC36–40, un estudio es cuasiexperimental con grupo control equivalente 41, 3 estudios son estudios cuasiexperimentales sin grupo control y con análisis pre- y postintervención31–33 y los otros 2 son estudios cruzados, con períodos de entrenamiento y desentrenamiento asignados de manera aleatoria34,35. Por otra parte, de los estudios comparativos, 5 compararon al efecto del entrenamiento físico con relación a un grupo control sedentario36–40, y uno comparó el efecto del entrenamiento continuo de intensidad moderada con el entrenamiento interválico de alta intensidad36.
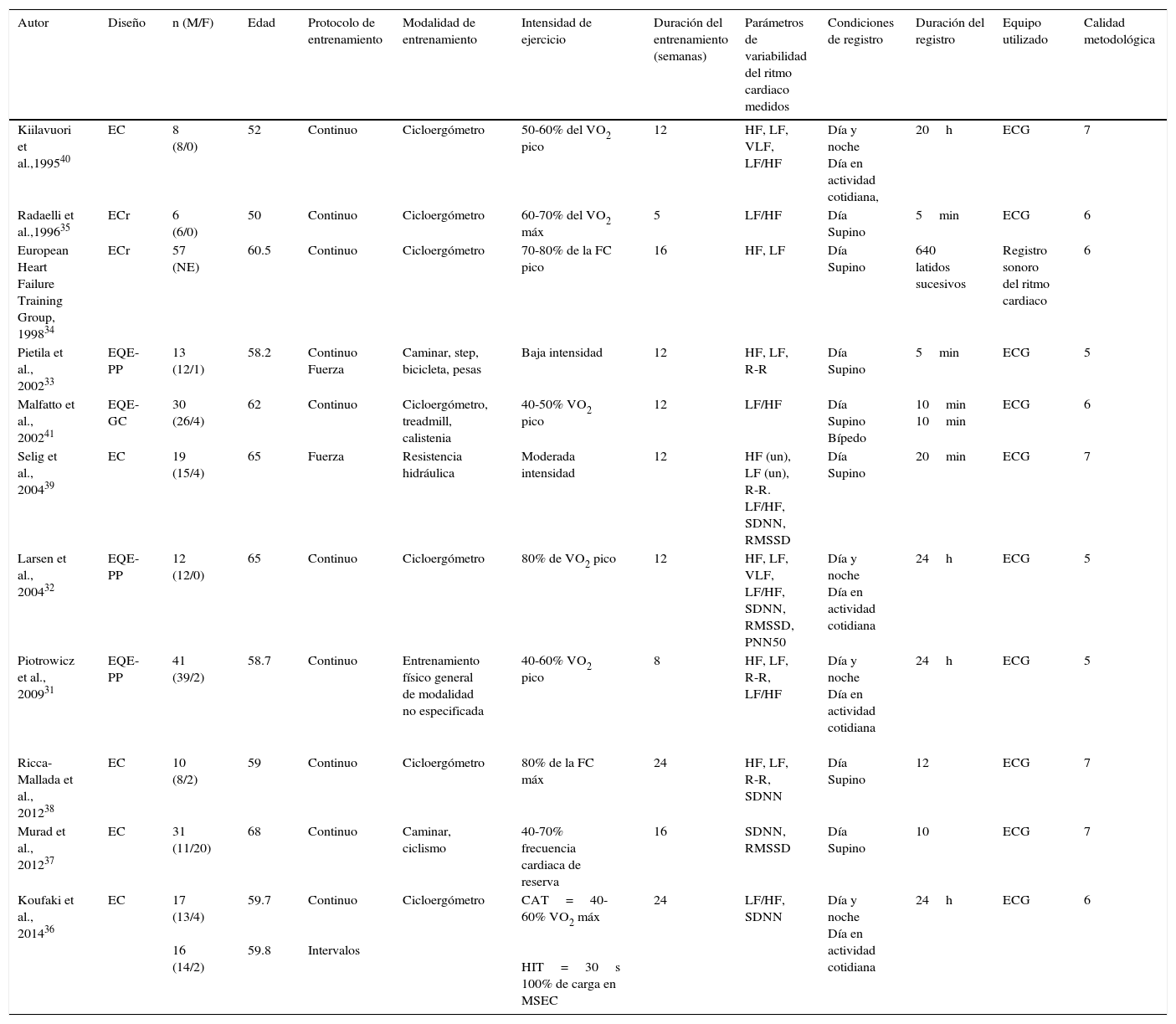
Con relación a las características del entrenamiento, en 6 artículos (N=126) la modalidad de entrenamiento empleada fue cicloergómetro, en uno (N=30) cicloergómetro y treadmill, en uno (N=31) caminata y ciclismo, en uno (N=19) entrenamiento de fuerza con resistencia hidráulica, en uno (N=13) entrenamiento combinado caminata, step y bicicleta o fuerza y en otro (N=41) entrenamiento físico general de modalidad no especificada. Respecto a la intensidad de ejercicio, en 8 artículos se evaluó el efecto del entrenamiento continuo de intensidad moderada32,34,35,37,38,40,41, en un artículo se evaluó el efecto de entrenamiento de intensidad moderada y entrenamiento interválico de alta intensidad36, en un artículo se evaluó ejercicio continuo de baja intensidad y el efecto del entrenamiento de fuerza33 y en otro, el efecto del entrenamiento de fuerza39.
Respecto a las características del registro del intervalo R-R; en 10 de los 11 artículos se realizó Holter de electrocardiograma, en 3 de ellos se evaluó durante 24h; en uno, durante 20h; en otro, durante 20min; en otro, durante 12min; en 2 artículos, durante 10min; y en los 2 restantes, durante 5min. Por otro lado, en un artículo se reportó la duración del registro en número de latidos por minuto. De los estudios analizados, 6 realizaron análisis de variables en dominio frecuencia; en otro, del dominio tiempo; y en 4 artículos, se analizaron ambas bandas de frecuencia (tabla 1).
Características de los estudios
| Autor | Diseño | n (M/F) | Edad | Protocolo de entrenamiento | Modalidad de entrenamiento | Intensidad de ejercicio | Duración del entrenamiento (semanas) | Parámetros de variabilidad del ritmo cardiaco medidos | Condiciones de registro | Duración del registro | Equipo utilizado | Calidad metodológica |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Kiilavuori et al.,199540 | EC | 8 (8/0) | 52 | Continuo | Cicloergómetro | 50-60% del VO2 pico | 12 | HF, LF, VLF, LF/HF | Día y noche Día en actividad cotidiana, | 20h | ECG | 7 |
| Radaelli et al.,199635 | ECr | 6 (6/0) | 50 | Continuo | Cicloergómetro | 60-70% del VO2 máx | 5 | LF/HF | Día Supino | 5min | ECG | 6 |
| European Heart Failure Training Group, 199834 | ECr | 57 (NE) | 60.5 | Continuo | Cicloergómetro | 70-80% de la FC pico | 16 | HF, LF | Día Supino | 640 latidos sucesivos | Registro sonoro del ritmo cardiaco | 6 |
| Pietila et al., 200233 | EQE-PP | 13 (12/1) | 58.2 | Continuo Fuerza | Caminar, step, bicicleta, pesas | Baja intensidad | 12 | HF, LF, R-R | Día Supino | 5min | ECG | 5 |
| Malfatto et al., 200241 | EQE-GC | 30 (26/4) | 62 | Continuo | Cicloergómetro, treadmill, calistenia | 40-50% VO2 pico | 12 | LF/HF | Día Supino Bípedo | 10min 10min | ECG | 6 |
| Selig et al., 200439 | EC | 19 (15/4) | 65 | Fuerza | Resistencia hidráulica | Moderada intensidad | 12 | HF (un), LF (un), R-R. LF/HF, SDNN, RMSSD | Día Supino | 20min | ECG | 7 |
| Larsen et al., 200432 | EQE-PP | 12 (12/0) | 65 | Continuo | Cicloergómetro | 80% de VO2 pico | 12 | HF, LF, VLF, LF/HF, SDNN, RMSSD, PNN50 | Día y noche Día en actividad cotidiana | 24h | ECG | 5 |
| Piotrowicz et al., 200931 | EQE-PP | 41 (39/2) | 58.7 | Continuo | Entrenamiento físico general de modalidad no especificada | 40-60% VO2 pico | 8 | HF, LF, R-R, LF/HF | Día y noche Día en actividad cotidiana | 24h | ECG | 5 |
| Ricca- Mallada et al., 201238 | EC | 10 (8/2) | 59 | Continuo | Cicloergómetro | 80% de la FC máx | 24 | HF, LF, R-R, SDNN | Día Supino | 12 | ECG | 7 |
| Murad et al., 201237 | EC | 31 (11/20) | 68 | Continuo | Caminar, ciclismo | 40-70% frecuencia cardiaca de reserva | 16 | SDNN, RMSSD | Día Supino | 10 | ECG | 7 |
| Koufaki et al., 201436 | EC | 17 (13/4) 16 (14/2) | 59.7 59.8 | Continuo Intervalos | Cicloergómetro | CAT=40-60% VO2 máx HIT=30s 100% de carga en MSEC | 24 | LF/HF, SDNN | Día y noche Día en actividad cotidiana | 24h | ECG | 6 |
EC: ensayos clínicos con asignación aleatoria; ECG: electrocardiograma; ECr: estudios cruzados, con períodos de entrenamiento y desentrenamiento asignados de manera aleatoria; EQE-CG: estudios cuasiexperimentales con grupo control equivalente; EQE-PP: estudios cuasiexperimentales sin grupo control y con análisis pre- y postintervención; F: femenino; FC: frecuencia cardiaca; HF: alta frecuencia; LF: baja frecuencia; LF/HF: relación LF/HF; M: masculino; NE: no especificado; RMSSD: raíz cuadrada del promedio de la suma de las diferencias al cuadrado, entre intervalos R-R adyacentes; R-R: intervalos R-R; SDNN: desviación estándar de todos los intervalos R-R.
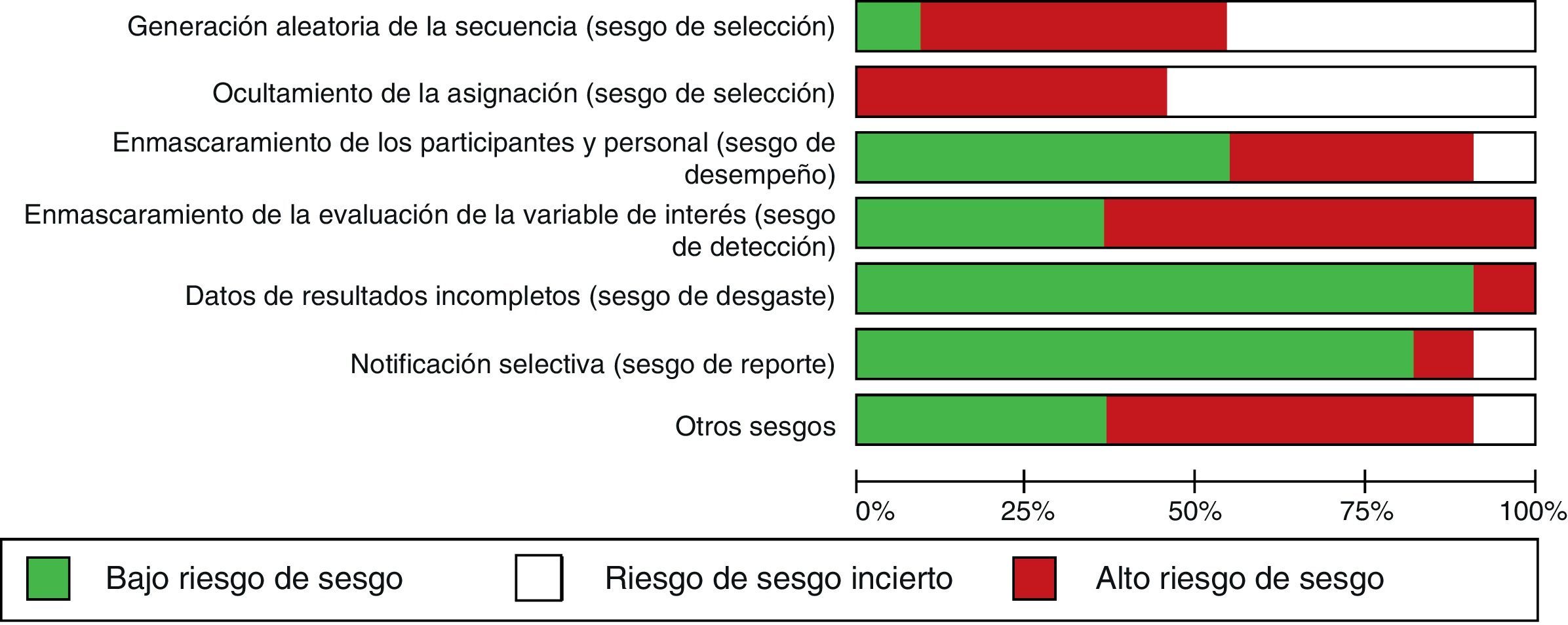
La CM de los artículos primarios se ubicó en un rango de 5-7 puntos de la escala PEDro. Así, 3 artículos presentaron una CM de 5 puntos; 3, una CM de 6 puntos; y 4, una CM de 7 puntos. Por otra parte, en la figura 2 se puede apreciar el riesgo de sesgo de los artículos primarios; en ella se nota que un alto porcentaje de los artículos presentó un elevado riesgo de sesgo de selección, y por otro lado, el sesgo de desgaste y de reporte fueron los menos prevalentes entre los estudios primarios (fig. 2).
Efecto del entrenamiento físico sobre la variabilidad del ritmo cardiacoEn el análisis intrasujeto del grupo control, no se observó significación estadística en las DME entre el valor preintervención y postintervención de los parámetro de VRC. En el grupo experimental, las DME fueron estadísticamente significativas para las variables RMSSD, HF, LF, y LF/HF; observándose DME positiva para RMSSD (+0.468±0.215; p=0.032), HF (0.934±0.256; p<0.001), LF (0.415±0.096; <0.001) y negativa para LF/HF (−0.747±0.369; p=0.044) (tabla 2).
Metaanálisis del efecto intrasujeto del entrenamiento físico sobre los parámetros de variabilidad del ritmo cardiaco en pacientes con insuficiencia cardiaca
| Variable | k | n | DME (EE) | IC 95% | I2 (%) | Valor de p |
|---|---|---|---|---|---|---|
| Control | ||||||
| R-R | 2 | 30 | −0.115 (0.252) | −0.620 a 0.390 | 0 | 0.651 |
| SDNN | 3 | 65 | −00761 (0.173) | −0.349 a 0.334 | 0 | 0.965 |
| RMSSD | 2 | 55 | 0.134 (0.188) | −0.240 a 0.507 | 0 | 0.480 |
| HF | 2 | 22 | 1.2 (1.797) | −2.389 a 4.866 | 95.82 | 0.495 |
| LF | 2 | 22 | 0.09 (0.294) | −0.503 a 0.684 | 58.47 | 0.879 |
| LF/HF | 3 | 32 | 0.932 (0.551) | −0.162 a 2.025 | 84.03 | 0.094 |
| Entrenamiento físico | ||||||
| R-R | 4 | 83 | 0.690 (0.396) | −0.0378 a 1.418 | 78.01 | 0.063 |
| SDNN | 6 | 105 | 0.198 (0.136) | −0.0692 a 0.465 | 0 | 0.145 |
| RMSSD | 2 | 43 | 0.468 (0.215) | 0.0413 a 0.895 | 0 | 0.032 |
| HF | 6 | 141 | 0.958 (0.275) | 0.417 a 1.498 | 73.8 | 0.001 |
| LF | 6 | 141 | 0.386 (0.119) | 0.153 a 0.620 | 0 | 0.001 |
| LF/HF | 8 | 149 | −0.747 (0.369) | −1.473 a −0.0204 | 88 | 0.044 |
DME: diferencia media estandarizada; EE: error estándar; HF: alta frecuencia; I2: porcentaje de inconsistencia; IC 95%: intervalo de confianza del 95%; LF: baja frecuencia; LF/HF: relación LF/HF; RMSSD: raíz cuadrada del promedio de la suma de las diferencias al cuadrado, entre intervalos R-R adyacentes; R-R: intervalos R-R; SDNN: desviación estándar de todos los intervalos R-R.
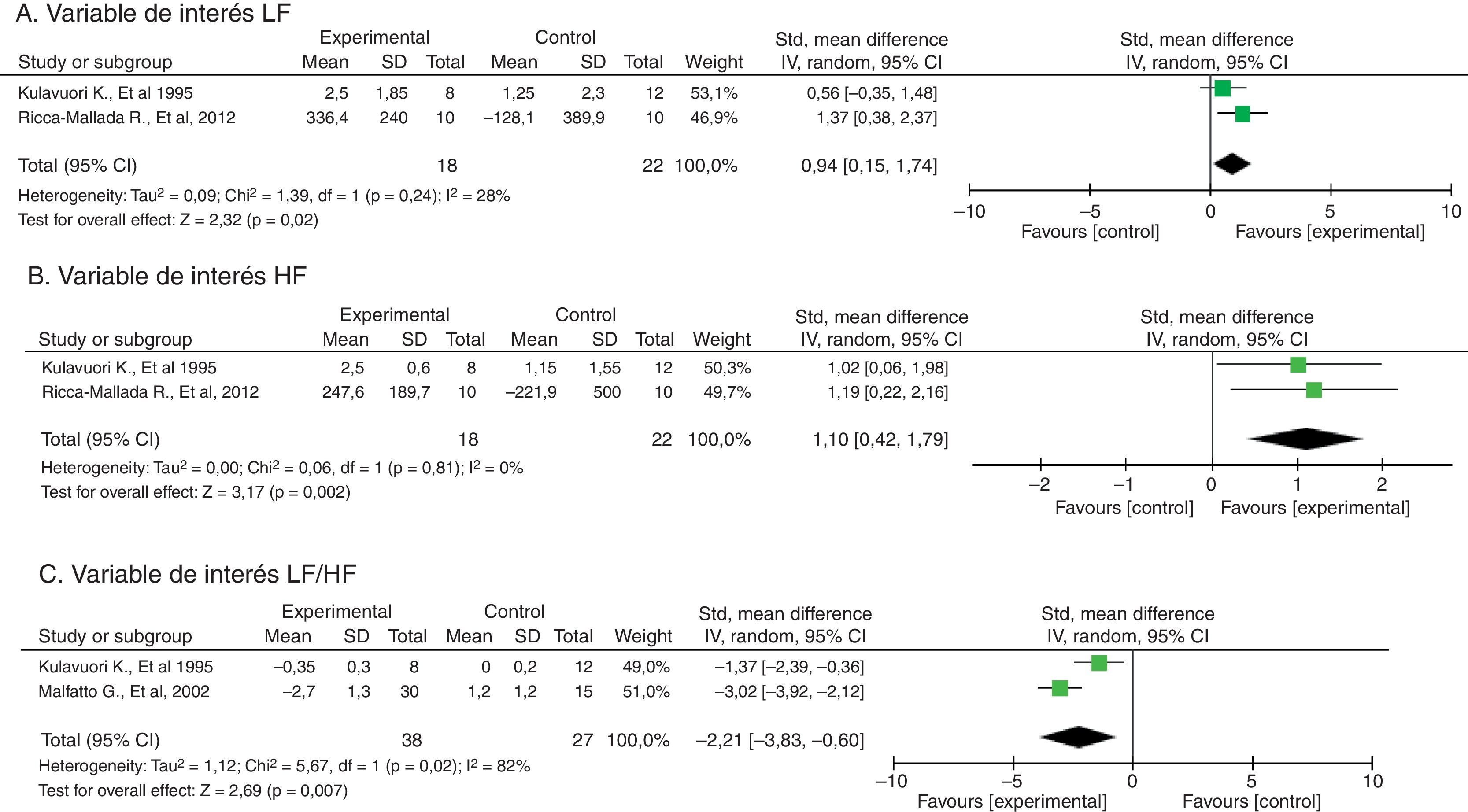
Por otra parte, tan solo 3 estudios entraron en el metaanálisis de estudios comparativos38,40,41. En ellos se observó una DME favorable al grupo experimental para las variables del dominio frecuencia: LF/HF (−2.21±intervalo de confianza del 95% −3.83 a −0.60), HF y LF. No fue posible realizar metaanálisis de las variables del dominio tiempo (fig. 3).
Gráfico de bosque del metaanálisis de efectos aleatorios con relación al efecto del entrenamiento físico sobre los parámetros de variabilidad del ritmo cardiaco. En A, banda de baja frecuencia (LF: low frequency); B, banda de alta frecuencia (HF: high frequency) y C, relación LF/HF.
El presente estudio fue realizado con el fin de evaluar, a través del resumen de la evidencia mediante una RS, el impacto del EF sobre los parámetros del dominio tiempo y dominio frecuencia de la VRC de sujetos adultos con IC. Dada la gran diversidad de modalidades de EF existentes, se agrupó los artículos considerando todas las modalidades de entrenamiento como una sola intervención, con el fin de establecer conclusiones estadísticas para esta intervención de modo general.
Es así como los principales hallazgos del estudio fueron que los individuos que realizaron algún tipo de EF incrementaron la magnitud de las variables del dominio tiempo, principalmente la variable RMSSD; así como los componentes espectrales de las bandas de alta y baja frecuencia. Adicionalmente, fue posible constatar una reducción significativa de la relación LF/HF en los sujetos entrenados, lo cual es sabido que se asocia fuertemente con el restablecimiento en el balance autonómico hacia un predominio parasimpático. Este fenómeno no fue observado en los sujetos que recibieron tratamiento médico convencional sin EF, lo cual concuerda con aquellos estudios en los que se ha evaluado el efecto del EF sobre el control autonómico del paciente con IC, tanto de RS cualitativas, como ensayos clínicos27,42.
Vale la pena destacar que la VRC es un marcador electrocardiográfico no invasivo que representa el control fino del sistema cardiovascular, latido a latido, el cual es mediado por mecanismos autonómicos y barorreflejos43.
Los parámetros de la VRC de dominio de tiempo reflejan la modulación autonómica del componente parasimpático, específicamente el parámetro RMSSD32,37,39. En nuestro estudio, se pudo observar que el único parámetro del dominio tiempo que mostró cambios significativos posterior a la intervención fue la variable RMSSD, lo cual, muestra que el EF no solamente induce respuestas simpático-inhibitorias, sino también parasimpático-excitatorias en los mecanismos de control cardiovascular de estos pacientes.
Por otro lado, en análisis del dominio de frecuencia se ha establecido que el componente HF representa actividad parasimpática, mientras que el LF representa la actividad tanto simpática como parasimpática. Así, la relación LF/HF se asocia íntimamente con el equilibrio autonómico en los mecanismos de control del sistema cardiovascular31–36,38–41. En nuestro estudio se observó que el EF incrementa la varianza de ambos componentes espectrales (HF y LF), no obstante, la magnitud de este incremento fue mayor en la banda HF, comparado con la LF, lo cual redujo significativamente la relación LF/HF en los pacientes con IC posterior a la intervención (tabla 1). Esto fue además confirmado en el metaanálisis de estudios comparativos (fig. 3), reafirmando la idea de que el EF restaura el balance autonómico en este grupo de pacientes.
En la IC los cambios hemodinámicos asociados a la alteración en la función cardiaca están determinados por la activación del sistema nervioso simpático y la inhibición del sistema nervioso parasimpático, contribuyendo directamente a la progresión de la IC. Una de las primeras respuestas a la lesión miocárdica es la activación del sistema nervioso simpático; este corazón dañado presenta cambios en la actividad de las fibras aferentes y las fibras eferentes del sistema nervioso autónomo contribuirán al desequilibrio simpático-vagal, reflejado por una VRC disminuida44. Esta disminución genera como consecuencia una menor capacidad de adaptación fisiológica, lo cual incrementa el riesgo de taquiarritmias ventriculares y muerte súbita16,17. Por lo tanto, el EF, mediante el incremento en la VRC y el restablecimiento del balance autonómico45, podría contribuir significativamente a la prevención de estos fenómenos fisiopatológicos, lo cual impactaría significativamente en el pronóstico de la IC46,47.
Este estudio presenta ciertas debilidades que deben ser discutidas. Entre ellas vale la pena mencionar que, si bien es cierto que la mayoría de los artículos primarios fueron categorizados como de «buena» CM (66.6%), un alto porcentaje de ellos presentaron un alto riesgo de sesgo de selección, de detección, así como otros potenciales sesgos, los cuales fueron principalmente asociados al desarrollo del protocolo experimental. Adicionalmente, la mayoría de los artículos primarios considerados evaluaron pequeños grupos de sujetos y presentaron gran heterogeneidad en los diferentes protocolos de entrenamiento realizados, lo cual obligó a considerar el «entrenamiento físico» como una sola intervención indistintamente de la modalidad empleada. En consecuencia, los alcances de los resultados de este estudio solo pueden considerar la intervención basada en EF general y no pueden dirigirse a una modalidad específica de EF. Por otro lado, las características del análisis espectral y los métodos de reporte de los parámetros de VRC difirieron entre los estudios. Mientras que algunos solo consideraron el dominio tiempo, otros únicamente estimaron el dominio frecuencia y escasamente fueron considerados ambos métodos de análisis, lo cual dificultó el análisis comparativo entre los resultados de los artículos primarios.
Deberían conducirse nuevos estudios con el propósito de determinar los mejores métodos y modalidades de entrenamiento para producir mejoras sobre los mecanismos de control cardiovascular y VRC. En este sentido, algunos estudios han revelado la existencia de diferentes mecanismos inducidos por las distintas modalidades de entrenamiento en este grupo de pacientes27; por lo tanto, si estos efectos son transferidos a los mecanismos autonómicos de control cardiovascular, sería de gran interés establecer el protocolo de entrenamiento que produce una mayor magnitud de efectos en este grupo de pacientes. Esto contribuiría significativamente a los métodos de dosificación del entrenamiento físico en el contexto clínico actual.
De acuerdo a la evidencia existente es posible concluir que protocolos de entrenamiento físico superiores a 4 semanas parecen incrementar la VRC y restablecer el desbalance autonómico de individuos adultos con IC crónica. Se requiere un mayor número de estudios experimentales y de mejor CM.
FinanciaciónNo existen fuentes de financiamiento formal.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.