El implante de válvula aórtica transcatéter es un tratamiento alternativo para aquellos pacientes con estenosis aórtica grave sintomática, inoperables o de elevado riesgo quirúrgico. El motivo de esta comunicación es informar de los resultados de la experiencia de esta nueva técnica y compararlos con la literatura.
MétodoRevisión de datos de 17 paciente con estenosis aórtica grave sintomática de elevado riesgo quirúrgico o inoperables tratados con implante de válvula aórtica transcatéter, por acceso vascular con apertura y cierre quirúrgico con la prótesis CoreValve™ (Medtronic, EE. UU.), entre septiembre de 2013 y julio de 2014.
ResultadosTodos los pacientes que tenían estenosis aórtica grave con gradiente medio de 46±14mmHg recibieron una CoreValve™ (Medtronic, EE. UU.). A los primeros pacientes se les administró anestesia general, la otra mitad anestesia regional y local. La mortalidad hospitalaria fue del 11.7% y hubo una defunción en el seguimiento realizado desde septiembre de 2013 hasta el momento de elaboración de este informe (5.9%), con una mortalidad total a un año del 17,6%. El éxito del procedimiento fue del 82.4%, con un gradiente inmediato postimplantación de 5.4±3.4mmHg. Se observó insuficiencia aórtica grado i, en 5 pacientes (29.4%), 2 pacientes con insuficiencia grado ii (11.7%). Se realizó posdilatación en 6 pacientes (35.2%). No observamos complicaciones vasculares. Hubo necesidad de implantar marcapasos definitivo en 6 pacientes (35.2%); un paciente con insuficiencia renal aguda, 2 eventos vasculares cerebrales intrahospitalarios de tipo isquémico (11.7%); ningún paciente tuvo necesidad de cirugía cardiaca, se presentaron 2 sangrados mayores que requirieron transfusión de 2 paquetes globulares.
ConclusionesEn pacientes con elevado riesgo quirúrgico o inoperables, el implante de válvula aórtica transcatéter es una opción de tratamiento, que mejora la calidad de vida, el número de hospitalizaciones, la supervivencia, etc.; pueden presentarse complicaciones e incluso la muerte, por lo que la adecuada selección de los pacientes y la presencia de un equipo multidisciplinario son requisitos fundamentales para el éxito del procedimiento.
Transcatheter aortic valve implantation (TAVI) is an alternative treatment for patients with severe symptomatic aortic stenosis, inoperable or at high surgical risk. The purpose of this communication is to report the results of the experience of this new technique and compare them with literature.
MethodsReview of 17 patients data with symptomatic severe aortic stenosis at high surgical risk or inoperable, treated with a transcatheter implantation aortic valve (TAVI) via femoral surgical access with Core Valve (Medtronic, EE.UU.) between September 2013 and July 2014.
ResultsAll patients had severe aortic stenosis with a mean gradient of 46¿æ14mmHg received CoreValveTM (Medtronic, USA). Half of patients was performed under general anesthesia, the other half with regional and local anesthesia. In-hospital mortality was 11.7% and one death in follow-up from September 2013 until the time of preparing this report (5.9%).Total mortality at one year follow-up was 17.6%. The technical success rate was 82.4%, with an immediate post-implantation gradient of 5.4¿æ3.4 mmHg. Aortic regurgitation I degree was observed in 5 patients (29.4%); 2 patients (11.7%) had aortic regurgitation grade II. Post dilatation was made in 6 patients (35.2%). We did not have any vascular complications. Permanent pacemaker implantation was needed in 6 patients (35.2%). One patient complicated with acute renal failure, 2 had in-hospital ischemic stroke (11.7%), none had need for cardiac surgery; 2 patients had major bleeding complications that required transfusion.
ConclusionsIn patients with high surgical risk or inoperable, TAVI is a treatment option that improves life quality, survival and diminsh the need of hospitalizations. There can be some complications and even death, so that a proper patient selection and a multidisciplinary team is needed and fundamental for a successful procedure.
La estenosis aórtica (EA) degenerativa es la enfermedad valvular más frecuente en ancianos en países desarrollados (2-7% de la población mayor de 65 años1,2). Sin cirugía, el pronóstico es extremadamente ominoso, con una tasa de supervivencia a 3 años inferior al 30%; sin embargo, aun con estas cifras, el 33% de todos los pacientes mayores de 75 años con EA grave no son candidatos apropiados para ser sometidos a tratamiento quirúrgico debido a su elevado riesgo operatorio3. La valvuloplastia con balón fue la primera técnica basada en catéter para resolver este problema con resultados iniciales prometedores4,5, pero a largo plazo demostró una elevada tasa de reestenosis así como ausencia de mejoría clínica significativa6. Por ello, la valvuloplastia con balón es hoy considerada solo como una opción de emergencia y como puente hacia la cirugía o implante de válvula aórtica transcatéter (TAVI). El reemplazo valvular quirúrgico es aún el tratamiento de elección en pacientes con EA grave sin contraindicación para cirugía. La EA grave en pacientes de elevado riesgo quirúrgico o inoperables solo se manejaba con tratamiento médico. En la actualidad, ya está descrito que en los pacientes que tienen contraindicación para cirugía el TAVI es el tratamiento de elección, valorados previamente por el equipo médico-quirúrgico7. Las 2 prótesis con más experiencia en el mundo son la prótesis balón-expandible Sapien Edwards® (Edwards Lifesciences LLC, Irvine, CA, EE. UU.)8 y la válvula autoexpandible CoreValve®, ahora Medtronic CoreValve® (Medtronic CoreValve, Irvine, CA, EE. UU.)9–11.
Las primeras series de centros únicos demostraron la viabilidad y eficiencia de esta modalidad de tratamiento. Posteriormente, en estudios multicéntricos confirmaron su eficacia y en todo el mundo han determinado una rápida penetración de esta técnica12,13. Recientemente se publicaron 2 trabajos con la válvula autoexpandible CoreValveTM: el primero comparó el TAVI con la cirugía en pacientes de elevado riesgo quirúrgico, observando mayor supervivencia a un año en los pacientes con TAVI14; el segundo trabajo fue realizado en pacientes inoperables con EA grave, tratados con el sistema Medtronic CoreValveTM en donde se concluye que la implantación de esta válvula es segura y eficaz15. Durante los últimos 10 años, más de 50,000 válvulas cardiacas transcatéter se han implantado en todo el mundo, ampliando sus indicaciones; En la actualidad, en las guías 2014 para el tratamiento de la enfermedad valvular del Colegio Americano de Cardiología, el TAVI en paciente de elevado riesgo es considerado clase IC, y para pacientes inoperables IB16 y en estudios de investigación en pacientes con riesgo intermedio17,18.
El objetivo del presente trabajo es presentar la experiencia de un equipo cardiológico-quirúrgico, en un solo centro y su comparación con la literatura internacional.
MétodosSe incluyeron todos los pacientes consecutivos con EA grave sintomática tratados con TAVI entre septiembre de 2013 y julio de 2014. Todos los pacientes otorgaron el consentimiento informado antes del procedimiento.
El estudio previo a la selección de los pacientes incluyó exámenes generales, ecocardiograma transtorácico, ecocardiograma transesofágico (ETE) realizados por el mismo operador, para confirmar el diagnóstico. En 16 de 17 pacientes se realizó una TCMD-tomografía computada multicorte (Tomógrafo Phillips Brilliance 64), realizando estudio gatillado de corazón con angiotomografía de aorta abdominal hasta arterias femorales.
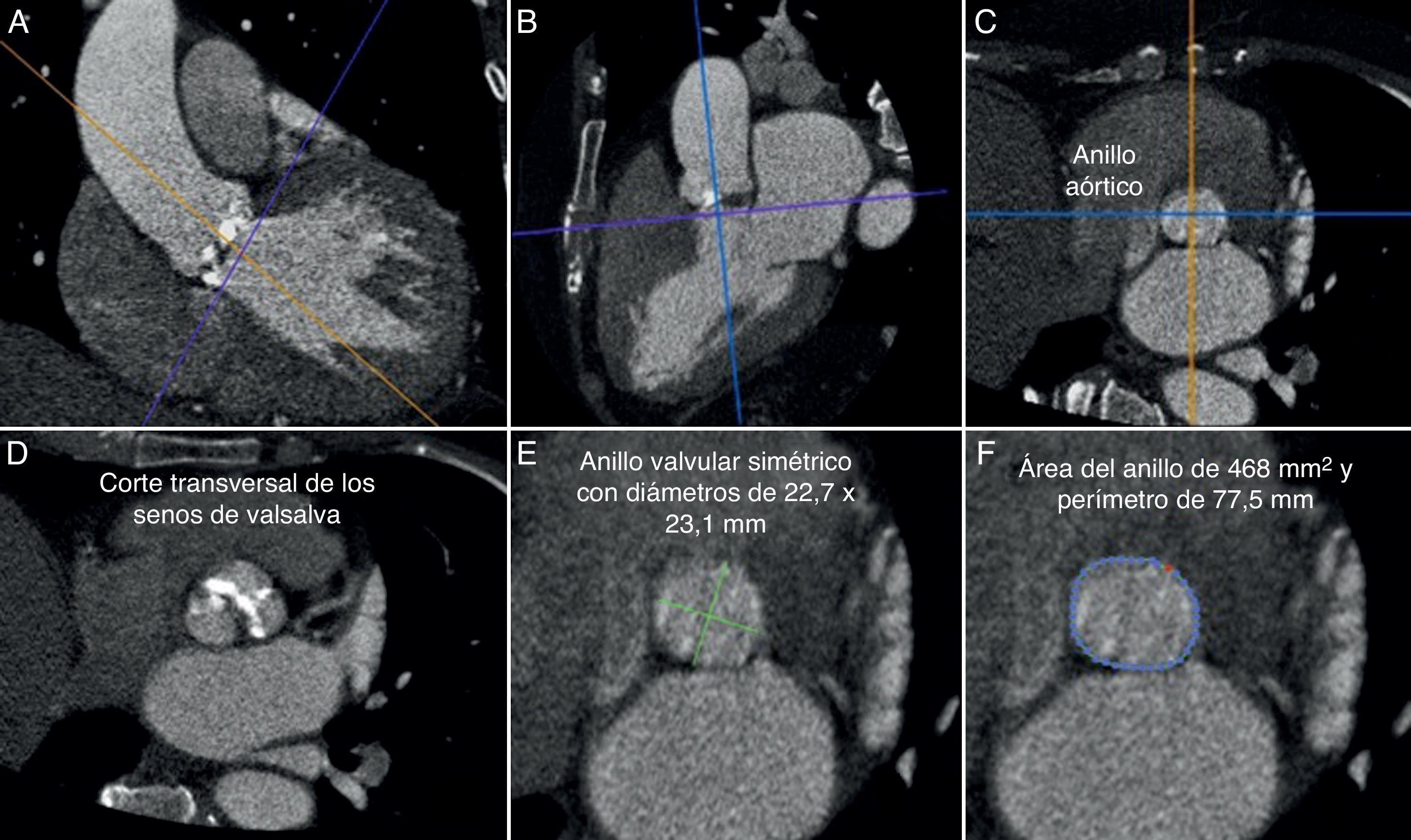
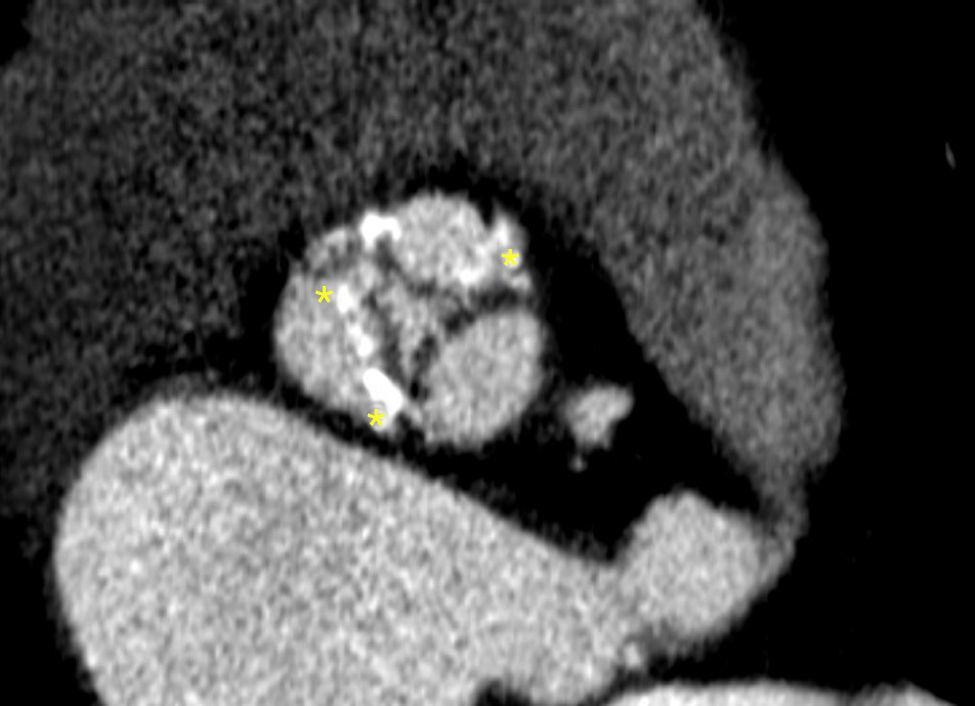
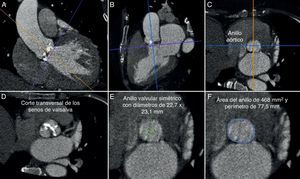
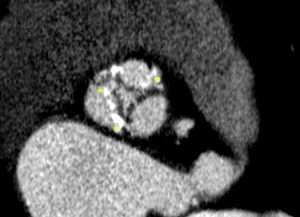
En la figura 1 se muestra el análisis de las mediciones del corazón y grandes vasos en el programa OSIRIX: primero se alinearon los 3 ejes (fig. 1A, 1B y 1C), para después buscar el anillo aórtico, se ubica el eje corto a nivel de los senos de Valsalva (fig. 1D) y se va bajando hasta que desaparecen por completo los 3 senos de Valsalva, se mide el diámetro menor, diámetro mayor, perímetro y el área del anillo aórtico en el eje corto (fig. 1E y 1F), así como el resto de las mediciones.
Valoración anatómica del anillo con TCMD en el programa OSIRIX para evaluar las características de la válvula nativa. Primero alineando los 3 ejes a nivel del anillo aórtico (A, B y C), ya alineados nos pasamos al eje corto donde se observan todavía los senos de Valsalva (D); posteriormente se baja la imagen hacia el tracto de salida hasta que desaparecen los 3 senos y es en esta ubicación donde se miden el diámetro mayor y menor, el perímetro y el área (E y F).
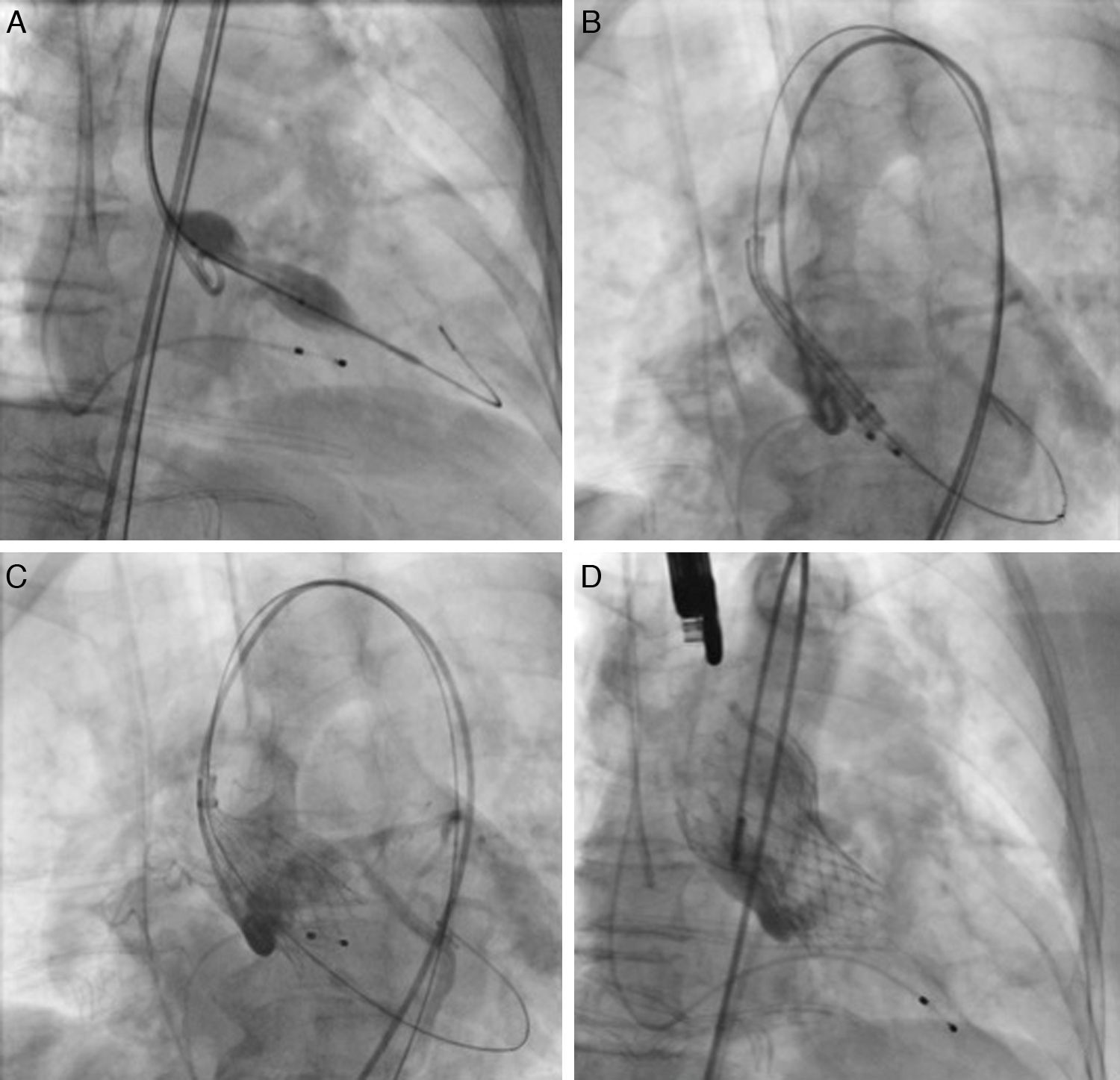
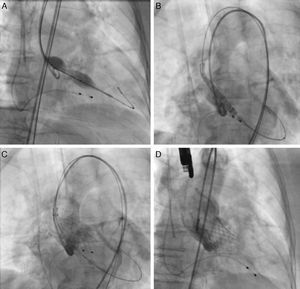
Se utilizaron los métodos, ETE y TCMD, para evaluar las dimensiones de la aorta y de la válvula aórtica, así como su morfología, grado y distribución de las calcificaciones. Todos los pacientes fueron llevados a coronariografía y aortografía previo al procedimiento. En el 70% de los casos, el TAVI se realizó bajo ETE. En el 30% se dejó el equipo de ecocardiografía dentro de la sala de hemodinámica y se realizó un ecocardiograma transtorácico al término de la implantación. La decisión de tratar, así como de realizar el TAVI, se basó en el consenso del equipo cardiología-cirugía. El procedimiento se realizó de acuerdo con la técnica y protocolos descritos en la literatura. Comienza primero el cirujano cardiovascular realizando la incisión quirúrgica, disección por planos y exposición de la arteria femoral común o la arteria periférica que se eligió como acceso terapéutico; posteriormente se coloca un cable de marcapasos transitorio en todos los casos para la estimulación rápida durante la valvuloplastia pre- y eventual posdilatación así como para tratar de inmediato el bloqueo auriculoventricular (AV); la implantación de la válvula la realizan los cardiólogos Intervencionistas como se observa en la figura 2. Primero, en la mayoría de los casos, se realiza la valvuloplastia aórtica (fig. 2A), en la figura 2B se va liberando lentamente la válvula con control angiográfico y medio de contraste hasta las dos terceras partes de la válvula (fig. 2C), posteriormente se libera completamente y se realiza aortografía de control (fig. 2D)19,20.
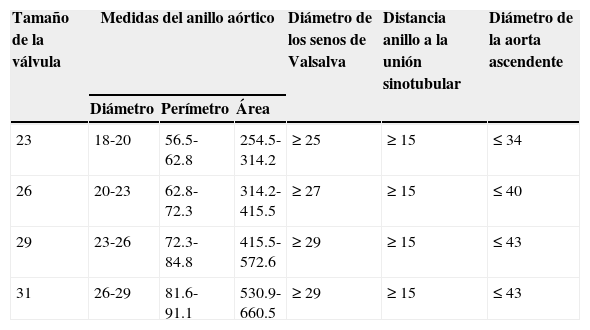
La prótesis Medtronic CoreValveTM es una prótesis trivalvular biológica de pericardio porcino, montada y suturada en un marco de stent autoexpandible de nitinol. Actualmente, el sistema de liberación tiene un tamaño de 18French. A la fecha, existen en el mundo 4 tamaños de dispositivos para las distintas dimensiones de anillo aórtico. En México se cuenta con las válvulas de 26, 29 y 31mm, encontrándose actualmente aún en trámite la válvula n.o 23.
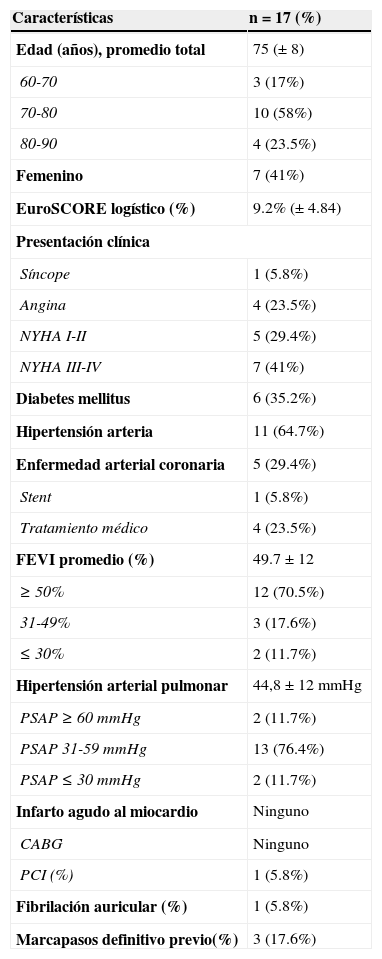
Características de la poblaciónEn nuestro centro se han implantado 18 válvulas en un total en 17 pacientes; la primera válvula se implantó en septiembre del 2013 (tabla 1). La edad promedio de la población fue de 75±8 años; el paciente más joven, de 60 años, fue rechazado para cirugía por fracción de eyección del ventrículo izquierdo (FEVI) del 25%, 4 pacientes de 80 a 90 años con comorbilidades y fragilidad reversible; la función ventricular estaba gravemente deprimida en 2 pacientes con valores inferiores al 30%, motivo por el cual fueron rechazados de cirugía. El EuroSCORE logístico fue de bajo riesgo (con una media del 9.2%) y un STS (modelo de la Society of Thoracic Surgeons) de 2.7 (±1.69) porque la mayoría de los pacientes tenían otras comorbilidades que no se valoran en el EuroSCORE o STS que los hacía de riesgo quirúrgico elevado. Cuatro pacientes (23%) tenían enfermedad pulmonar obstructiva crónica; 2 de ellos (11%) con una FEVI 1<30% y uso de oxígeno en su domicilio; la insuficiencia renal crónica estaba presente en un paciente con creatinina de 1.9mg/dl y sin tratamiento sustitutivo. Un paciente con enfermedad trivascular fue llevado a angioplastia más stent. Las principales indicaciones de TAVI fueron: elevado riesgo quirúrgico o inoperables por sus múltiples comorbilidades (entre otras, la disfunción ventricular severa, hipertensión pulmonar grave, insuficiencia renal crónica, edad, índice de fragilidad) y el rechazo de los pacientes por el servicio de cirugía. Todos los casos fueron discutidos por el equipo de cardiología y cirugía cardiaca integrado en nuestra institución.
Características clínicas de los pacientes
| Características | n=17 (%) |
|---|---|
| Edad (años), promedio total | 75 (±8) |
| 60-70 | 3 (17%) |
| 70-80 | 10 (58%) |
| 80-90 | 4 (23.5%) |
| Femenino | 7 (41%) |
| EuroSCORE logístico (%) | 9.2% (±4.84) |
| Presentación clínica | |
| Síncope | 1 (5.8%) |
| Angina | 4 (23.5%) |
| NYHA I-II | 5 (29.4%) |
| NYHA III-IV | 7 (41%) |
| Diabetes mellitus | 6 (35.2%) |
| Hipertensión arteria | 11 (64.7%) |
| Enfermedad arterial coronaria | 5 (29.4%) |
| Stent | 1 (5.8%) |
| Tratamiento médico | 4 (23.5%) |
| FEVI promedio (%) | 49.7±12 |
| ≥50% | 12 (70.5%) |
| 31-49% | 3 (17.6%) |
| ≤30% | 2 (11.7%) |
| Hipertensión arterial pulmonar | 44,8±12mmHg |
| PSAP≥60mmHg | 2 (11.7%) |
| PSAP31-59mmHg | 13 (76.4%) |
| PSAP≤30mmHg | 2 (11.7%) |
| Infarto agudo al miocardio | Ninguno |
| CABG | Ninguno |
| PCI (%) | 1 (5.8%) |
| Fibrilación auricular (%) | 1 (5.8%) |
| Marcapasos definitivo previo(%) | 3 (17.6%) |
CABG: del inglés coronary artery bypass graft; FEVI: fracción de eyección del ventrículo izquierdo; NYHA: del inglés New York Heart Association; PCI: percutaneous coronary intervention; PSAP: presión sistólica de la arteria pulmonar.
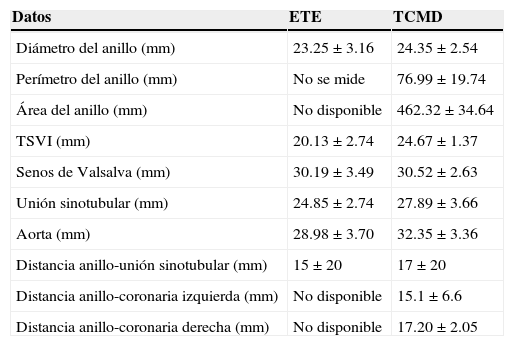
La válvula aórtica y la funcionalidad del corazón se valoraron con un ecocardiograma transtorácico, confirmando la gravedad de la EA, FEVI y daño a otras estructuras. En todos los pacientes se realizó una ETE y en 16 pacientes una tomografía de corazón, excepto en el paciente con insuficiencia renal crónica en quien se decidió el tamaño de la válvula por el ETE. Las mediciones del anillo con la TCMD fueron las medidas en las cuales nos basamos para la estrategia del implante y el tamaño de la válvula. Encontramos 6 pacientes con una válvula aortica bicúspide, 3 con una válvula aórtica claramente bicúspide y 3 se comportaban como bicúspides pero de difícil identificación por la presencia de calcificación grave y deformación de la anatomía de las mismas; el 41% de los pacientes presentaban en forma concomitante insuficiencia valvular aórtica grado ii a iii.
En los primeros pacientes, el aortograma no se realizó con pig-tail marcado; por lo tanto no se hicieron las mediciones que se describen en la tabla 2, basando nuestras decisiones con la TCMD y ETE. La angiografía fue de mucha utilidad para descartar enfermedad coronaria y la aortografía para definir la proyección de inicio durante el TAVI, así como para evaluar el grado de insuficiencia aórtica inmediatamente. Solo en un caso se realizó angiografía de arterias femorales por la presencia de insuficiencia renal crónica con Cr. 1.9mg/dl, que contraindicaba la TCMD de corazón; la medición del anillo se hizo con el ETE.
Datos de la evaluación de la válvula aórtica nativa con el ETE y TCMD
| Datos | ETE | TCMD |
|---|---|---|
| Diámetro del anillo (mm) | 23.25±3.16 | 24.35±2.54 |
| Perímetro del anillo (mm) | No se mide | 76.99±19.74 |
| Área del anillo (mm) | No disponible | 462.32±34.64 |
| TSVI (mm) | 20.13±2.74 | 24.67±1.37 |
| Senos de Valsalva (mm) | 30.19±3.49 | 30.52±2.63 |
| Unión sinotubular (mm) | 24.85±2.74 | 27.89±3.66 |
| Aorta (mm) | 28.98±3.70 | 32.35±3.36 |
| Distancia anillo-unión sinotubular (mm) | 15±20 | 17±20 |
| Distancia anillo-coronaria izquierda (mm) | No disponible | 15.1±6.6 |
| Distancia anillo-coronaria derecha (mm) | No disponible | 17.20±2.05 |
ETE: ecocardiograma transesofágico; TCMD: tomografía computarizada multidetector; TSVI: tracto de salida del ventrículo izquierdo.
En el diámetro del anillo los datos fueron similares entre las mediciones del ETE y TCMD; sin embargo, la selección del tamaño de la válvula se realizó con base en el perímetro y el área del anillo en la TCMD, con un perímetro promedio de todos los pacientes de 76.99±19.74.
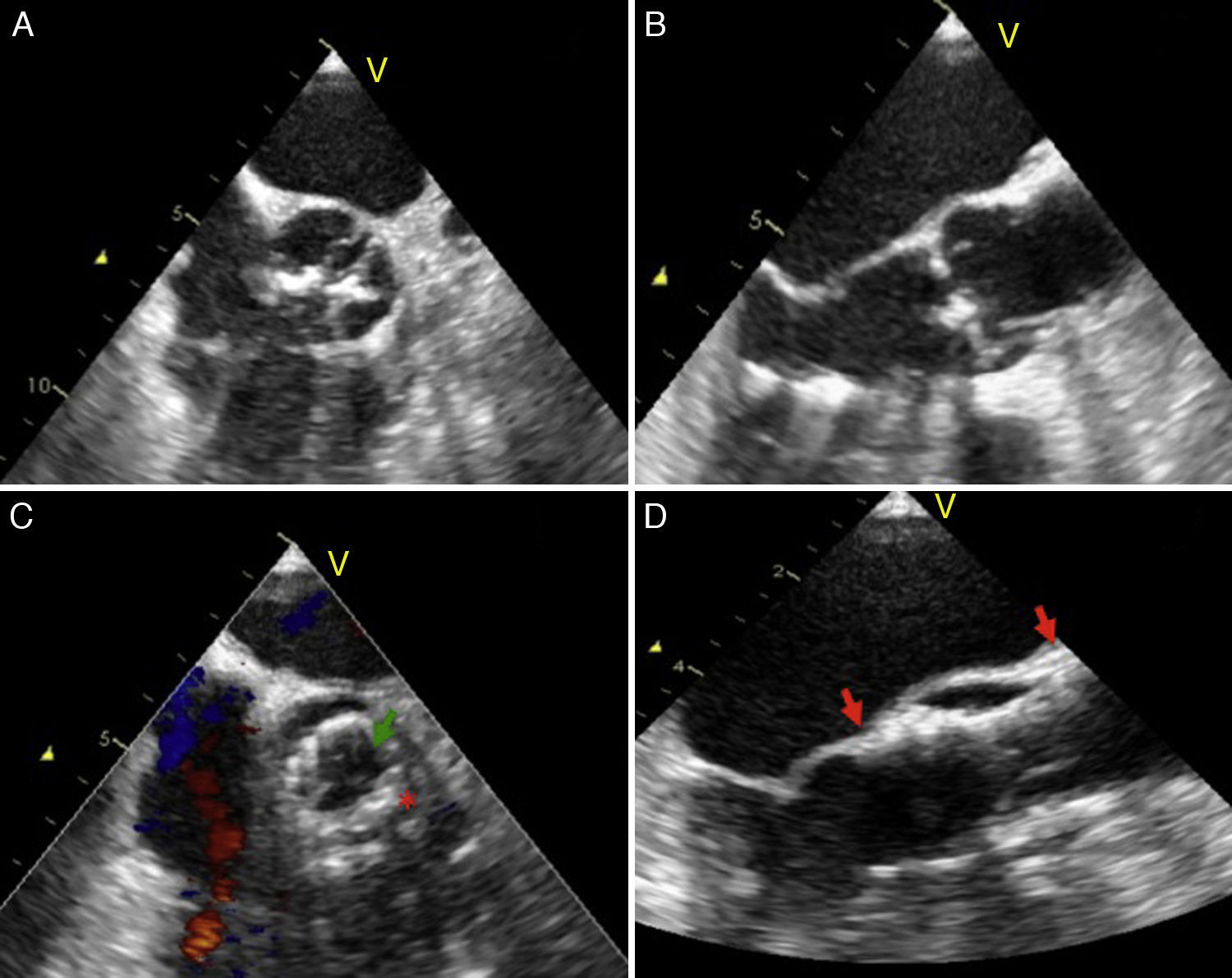
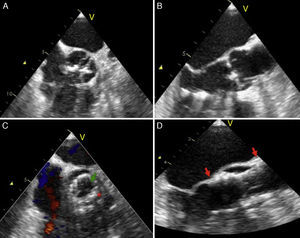
El ETE se realizó pre- y transprocedimiento. En la figura 3 se observa el ETE durante la implantación de la válvula, se valora el gradiente medio posprocedimiento, la correcta posición de la válvula y la evaluación de las fugas central y perivalvular.
Ecocardiografía transesofágica, A y B. Eje corto y eje largo de un paciente con válvula aórtica bicúspide; C. Eje corto del ETE después del TAVI, la flecha verde señala las valvas de la prótesis y el asterisco rojo la parte metálica (stent de nitinol); D. Eje longitudinal después de la implantación, las flechas rojas señalan la longitud de la válvula.
El éxito y las complicaciones se basaron en los criterios del Valve Academic Research Consortium-2 (VARC-2)21. En el 94% de los casos el acceso vascular fue abordado por vía femoral (un solo caso vía subclavia izquierda). Todos los abordajes de los accesos vasculares fueron quirúrgicos y no se observaron complicaciones; sin embargo, según criterios VARC-2, se presentaron 2 sangrados mayores con descenso de la hemoglobina de 3g/dl, y necesidad de transfundir más de 2 paquetes globulares; esto fue secundario en ambos casos a un hematoma en el sitio de punción de la arteria femoral no terapéutica, limitándose con compresión manual y vigilancia, sin requerir cirugía.
El implante valvular fue un procedimiento electivo en todos los pacientes. Es este motivo se pudo discutir antes de iniciar la implantación el tamaño de la válvula basada en los datos del TCMD, en especial el perímetro, diámetro y área, siendo decisivo el perímetro del anillo para elegir el tamaño de la válvula (tabla 2). Se llevó a cabo la implantación de 3 tamaños de válvulas (tabla 3) disponibles en México (números 26, 29 y 31mm).
Medidas necesarias para la elección de un tamaño de válvula CoreValve
| Tamaño de la válvula | Medidas del anillo aórtico | Diámetro de los senos de Valsalva | Distancia anillo a la unión sinotubular | Diámetro de la aorta ascendente | ||
|---|---|---|---|---|---|---|
| Diámetro | Perímetro | Área | ||||
| 23 | 18-20 | 56.5-62.8 | 254.5-314.2 | ≥25 | ≥15 | ≤34 |
| 26 | 20-23 | 62.8-72.3 | 314.2-415.5 | ≥27 | ≥15 | ≤40 |
| 29 | 23-26 | 72.3-84.8 | 415.5-572.6 | ≥29 | ≥15 | ≤43 |
| 31 | 26-29 | 81.6-91.1 | 530.9-660.5 | ≥29 | ≥15 | ≤43 |
El tiempo medio de duración de la intervención fue de 192min y la cantidad de contraste de 178ml (Ultravist y xenetix). El éxito de la implantación de la válvula, según los criterios VARC-2 se observó en 14 pacientes (82%) durante el procedimiento; en estos pacientes, la válvula se implantó en una posición angiográficamente adecuada (4-6mm por debajo del anillo)22, con gradiente transaórtico residual posprocedimiento de 5.4±3.4mmHg. La insuficiencia aórtica residual fue medida por angiografía en todos los casos y por la disponibilidad del equipo en la mitad de los pacientes con ETE al final del procedimiento; se observó en un 29.4% de los pacientes insuficiencia aórtica grado i postprocedimiento en ambos métodos (tabla 4) y 2 pacientes con insuficiencia grado ii(11.7%). La insuficiencia aórtica grado ii valorada inmediatamente después del TAVI en 2 pacientes se considera como no exitoso el procedimiento (criterios VARC-2), es de predominio paravalvular y secundario al exceso de calcio en la válvula nativa, sin mejorar con la posdilatación. En el tercer paciente fue considerado el procedimiento de TAVI fallido; es una paciente con excesivo calcio, se la predilató y al liberar la primera válvula esta queda debajo de 4mm del anillo, al retirar el cono del catéter liberador de la válvula del tracto de salida del ventrículo izquierdo a la aorta se ancla a la válvula y con un pequeño esfuerzo, la válvula migra a la aorta, produciendo una insuficiencia aórtica importante y la necesidad de implantar una segunda válvula del mismo tamaño con buen resultado. En un solo caso (fig. 4) se realizó TAVI, sin predilatar, en consenso con el equipo médico, dada la poca cantidad de calcio, con una distribución homogénea y distribución simétrica del mismo.
Detalles del procedimiento
| Electiva | 100% |
| Tipo de válvula | |
| CoreValve n.o26 | 5 (29.4%) |
| CoreValve n.o29 | 9 (52.9%) |
| CoreValve n.o31 | 3 (17.4%) |
| Características del procedimiento | |
| Tiempo de intervención (min) | 192.76±56.21 |
| Tiempo de fluoroscopia (min) | 16±5.7 |
| Medio de contraste (ml) | 178±63 |
| Resultados del procedimiento | |
| Predilatación | 16 (94.11%) |
| Éxito del procedimientoa | 16 (94.11%) |
| Posdilatación | 6 (35.29%) |
| Gradientes posprocedimiento | 5,4±3,4mmHg |
| Insuficiencia aórtica residual | |
| Grado I (%) | 5 (29.4%) |
| Grado II (%) | 2 (11.7%) |
| Implante de marcapasos antes del alta (%) | 5 (29.4%) |
| Implantación de 2 válvulas | 1 (5.8%) |
| Anestesia general | 9 (52.9%) |
| Anestesia regional y sedación | 8 (47.5%) |
Dentro de las complicaciones mayores, en nuestra serie hubo 3 muertes, 2 de ellas ocurrieron durante la hospitalización. Describiremos primero las 2 muertes intrahospitalarias. El primer paciente de 83 años, con enfermedad pulmonar obstructiva crónica Gold IV, con una FEV 1<30% y con insuficiencia cardiaca NYHA IV; este paciente presentaba una EA grave con una válvula funcionalmente bicúspide y extremadamente calcificada. Se llevó a cabo la implantación con mucha dificultad para predilatar (dado que se observaba que no abría la válvula con persistencia de la muesca en el balón), implantando la válvula y dejando primero una insuficiencia aórtica grave, y después de posdilatar en varias ocasiones (incluso utilizando un balón con un diámetro 1:1), termina con una insuficiencia aórtica grado iiy sin la posibilidad de cirugía ya que era considerado inoperable (EuroSCORE de 11.2% pero con una neumopatía grave) se decidió vigilancia hemodinámica con un catéter de flotación pulmonar y apoyo de ventilación mecánica. A los 3 días se observa un infiltrado en parche de ambos campos pulmonares, fiebre y leucocitosis, con un patrón hemodinámico mixto (cardiogénico y distributivo). Desarrolla sepsis pulmonar y fallece a los 25 días de la implantación. El segundo paciente de 91 años con insuficiencia renal crónica y sin necesidad de sustitución renal en esos momentos; se le implanta la válvula con éxito pero presenta a los 4 días de la implantación un infarto mesentérico; es llevado a cirugía con resección de 15cm de intestino, presentando en el postoperatorio insuficiencia renal aguda postimplante y según criterios VARC-2 en etapa 3 (clasificación AKIN), con anuria y necesidad inminente de sustitución renal; fallece a los 7 días de la implantación. El tercer paciente de 86 años de edad falleció en su casa durante el seguimiento, por causa desconocida a los 47 días de la implantación; considerada como muerte cardiaca.
También se presentaron 2 eventos vasculares cerebrales como complicaciones graves manifestadas clínicamente con hemiplejía faciocorporal. En ambos casos tenían válvulas bicúspides, muy calcificadas. El primer caso, paciente con cardiopatía isquémica, enfermedad trivascular grave, disfunción grave del ventrículo izquierdo y con aorta en porcelana, presentó paro cardiorrespiratorio al momento de la valvuloplastia aórtica, con necesidad de ventilación mecánica; se implanta la válvula con éxito angiográfico y al momento del retiro de la sedación clínicamente se observa hemiparesia faciocorporal y, en una tomografía de cráneo, un infarto cerebral. El segundo paciente, con una válvula bicúspide muy calcificada, al momento de realizar la valvuloplastia aórtica, el marcapasos no captura y el balón es expulsado a la aorta (esto ocurre en 2 ocasiones), presentando deterioro neurológico con afasia y hemiparesia faciocorporal inmediatamente después de la valvuloplastia; este paciente solo estaba con sedación, anestesia local y regional por lo tanto estaba despierto y cooperador lo cual nos permitió hacer el diagnóstico al instante. Sin embargo no pudimos realizar tratamiento intervencionista con el equipo de neurorradiología invasiva dado que quedó fuera de ventana durante el resto del procedimiento y el tiempo en realizar tomografía de cráneo para descartar hemorragia cerebral.
Ningún paciente presentó infarto agudo al miocardio ni necesidad de cirugía cardiaca, 2 pacientes con sangrados mayores por hematoma en el acceso vascular no terapéutico fueron tratados con compresión mecánica. La estancia en la unidad de cuidados intensivos en la hospitalización fue de 5±4.9 días.
Antes de la implantación, 3 pacientes tenían marcapasos definitivo previamente implantado, 5 pacientes ameritaron marcapasos definitivo posterior a la implantación por bloqueo AV completo. La colocación del marcapasos se realizó en las primeras 24h de la implantación en 4 casos, en un caso se implantó el marcapasos antes del alta; en este último caso, la válvula se implantó baja (8-10mm de profundidad), además fue desarrollando un bloqueo completo de rama izquierda del haz de His y bloqueo AV de primer grado, con el riesgo de evolucionar a un bloqueo avanzado del nodo AV.
A un paciente con implante de marcapasos definitivo, con un bloqueo de rama izquierda completo antes del alta, al mes del seguimiento se le realiza una monitorización de la frecuencia cardiaca de 24h en la que se observa alternancia de la morfología del QRS entre bloqueo de rama izquierda y derecha con frecuencias cardiacas entre 60-80lpm, motivo por el cual se decide implante de marcapasos definitivo.
El seguimiento se efectuó al mes, 3, 6 y 12 meses. En este momento, el primer paciente de la serie tiene 12 meses postimplante con una clase funcional i y sin datos de disfunción de la válvula. La clase funcional de los pacientes vivos a los 3 meses mejoró, de clase funcional ii-iii pasó a ser actualmente clase i; a la fecha todos están asintomáticos y no hay ningún reingreso al hospital.
DiscusiónEl TAVI está comenzando a adquirir una gran relevancia en el tratamiento de la EA sintomática en todo el mundo y por supuesto en México23,24.
Materializar un programa de válvulas conlleva requisitos indispensables para el éxito del procedimiento, y según nuestra experiencia podemos comentar los siguientes:
- 1.
La necesidad de líder que organice, agrupe y determine la función de cada integrante.
- 2.
La enseñanza del personal directivo, administrativo, médico y de enfermería sobre la EA grave y el TAVI.
- 3.
Adiestramiento del personal que integrará el equipo médico-quirúrgico que implanta la válvula mediante conferencias, asistencia a cursos, asistencia a casos de implante en otros hospitales, simuladores.
- 4.
Necesidad de permanecer los mismos integrantes del grupo desde el inicio y en cada caso hasta tomar la experiencia necesaria.
- 5.
La asistencia de un experto (proctor) que proporciona la casa comercial, que por su habilidad y experiencia muestra y enseña detalles del procedimiento. El experto está disponible para cualquier eventualidad que no pueda resolver el grupo médico durante el procedimiento. Es indispensable el experto mientras el centro no esté certificado; tras la certificación, es elección del centro solicitar apoyo a la casa comercial.
La selección del paciente fue otro reto para nuestro grupo. Al inicio del programa solo participaban cirugía cardiaca y cardiología intervencionista. Sin embargo, en nuestro centro, de 4 pacientes mayores de 80 años, 3 fallecieron y solo una permanece viva, en clase funcional i; esta última paciente había sido rechazada para el TAVI en 2 ocasiones, lo cual deja ver la complejidad de la selección del paciente. Por ello se decidió formar un grupo multidisciplinario con geriatría, rehabilitación cardiaca, nefrología, neurología, neurorradiología y departamento de arritmias, para valorar previamente al paciente y llevar un seguimiento por las especialidades antes mencionadas y un trabajo de equipo para resolver las complicaciones que se pudieran presentar. Esta serie de 17 pacientes ha sido la base para adquirir la experiencia de todo el equipo multidisciplinario dado que el éxito de la selección de los pacientes, del procedimiento y el seguimiento depende de cada uno de los integrantes.
En la selección del paciente se tomaron inicialmente todos aquellos pacientes que fueron rechazados para cirugía cardiaca el año previo al inicio del programa. Esto es importante ya que la edad media de esta serie de casos está por debajo de lo comunicado en otros registros y es resultado de 3 pacientes de 60-70 años, que ingresaron al programa, sin comorbilidades, con un EuroSCORE bajo, pero previamente rechazados por el servicio de cirugía cardiaca por elevado riesgo quirúrgico debido a una FEVI entre 25-31% (con reserva contráctil medida por ecocardiografía transtorácica de estrés); es importante comentar que nuestra institución es un hospital general y que la mortalidad de cirugía cardiaca es elevada para pacientes de alto riesgo quirúrgico por diversos motivos institucionales y logísticas. Por motivo de TAVI en 4 pacientes mayores de 80 años de los cuales 3 fallecieron, reevaluamos el costo-beneficio del programa en nuestra institución, y la selección del paciente se lleva a cabo de una forma estricta para el éxito del programa, incluyendo recientemente al servicio de geriatría en la evaluación inicial del paciente mayor de 75 años como posible candidato a TAVI.
Para establecer la indicación de TAVI es importante la estimación precisa del riesgo quiru¿rgico. Para esto se dispone de varias calculadoras de riesgo, que pueden ser subjetivas e imprecisas, y no incluir caracteri¿sticas cli¿nicas que pueden repercutir en la mortalidad. Entre ellas destacan el modelo de la STS y el EuroSCORE; esto se observa frecuentemente y se han criticado estos formatos de evaluación que no incluyen todas las variables que pueden influir en la morbimortalidad de un paciente25. En nuestra serie, el promedio del EuroSCORE fue del 9.2% (±4.84), y del STS de 2.7 (±1.69); ambas escalas predicen un riesgo bajo o intermedio de mortalidad, pero la evaluación de estos pacientes fue por otras comorbilidades no evaluadas en las escalas, además de tomar en cuenta en nuestra institución la morbimortalidad elevada en los pacientes llevados a cirugía cardiaca. Por lo tanto, estos pacientes son evaluados por un equipo médico-quiru¿rgico que contempla las escalas y otras caracteri¿sticas cli¿nicas valoradas por el equipo multidisciplinario.
Existen 2 estudios en pacientes con EA grave y riesgo intermedio en los que se observan resultados similares en la mortalidad global a los 30 días y un año después de TAVI o reemplazo quirúrgico. Sin embargo, cada tratamiento no era asignado aleatoriamente sino por criterios específicos en cada caso, y había un riesgo inevitable de sesgo en la selección del tratamiento26,27. Estudios aleatorizados en curso (todavía no publicados) han sido diseñados para proporcionar una evidencia más sustentable en pacientes de riesgo intermedio (PARTNER II cohorte A con la válvula Edwards SAPIEN XT en EE. UU., y el estudio SURTAVI con la válvula CoreValve de Medtronic). Por lo tanto todavía no existe la suficiente evidencia científica que justifique el TAVI en pacientes de riesgo intermedio; sin embargo, actualmente hay una tendencia para elegir a los pacientes con riesgo intermedio en varios centros; En nuestro centro se tomaron en cuenta 3 factores importantes para elegir a los pacientes: a) La mayoría de los pacientes fueron elegidos por otras comorbilidades no valoradas en las escalas de medición específicas; b) Una morbimortalidad alta en cirugía cardiaca de nuestro centro, con tiempos prolongados de espera para reemplazo valvular (3-6 meses); c) La fragilidad del paciente; aunque al inicio era valorada por el cardiólogo intervencionista, actualmente está incluido en el programa el servicio de geriatría para una valoración más objetiva. Lo que hemos aprendido es que en nuestra población pacientes mayores de 80 años, aun con riesgo intermedio en la escalas de valoración quirúrgica, son pacientes que pueden no tener una fragilidad reversible y estar expuestos a mayores riesgos con el TAVI, por ello la elegibilidad de este tipo de pacientes viene dada por la valoración geriátrica. Nos hemos planteado la posibilidad de incluir a pacientes de riesgo intermedio y sin comorbilidades, por el costo elevado de la válvula, con la intención de que mejoren los resultados, y que el equipo médico-quirúrgico adquiera la experiencia suficiente.
Un metaanalisis28 del 2012 utilizó los primeros criterios VARC para unificar los resultados; describieron todas las causas de mortalidad hasta los 30 días de TAVI, de un 1.7-14.3%. La mortalidad vista en nuestra serie a los 30 días fue del 11.7%, y aunque es una serie con muy pocos pacientes, los resultados están dentro de lo que se menciona en la literatura. La mortalidad después de 30 días a un año fue del 14.3-19.6%; en nuestra serie solo tenemos un paciente con mortalidad después de los 30 días que en total suman un 17.6%, este último paciente según criterios VARC-2 es considerado dentro de la mortalidad cardiovascular por causa desconocida.
La ocurrencia de eventos cerebrovasculares es una de las complicaciones más temidas. La tasa dentro de los 30 primeros di¿as es de alrededor del 3.6%, segu¿n lo reportado en el estudio PARTNER A8, hasta el 11.2% reportado en el PARTNER B29. En nuestro trabajo se presentaron 2 complicaciones mayores de tipo infarto cerebral (11.7%) en pacientes que tenían una válvula aórtica bicúspide extremadamente calcificada, ambos pacientes con secuelas neurológicas; esto sobrepasa lo mencionado en la literatura pero es una serie con pocos pacientes, en un equipo recién formado, con carga importante de calcio en la válvula. Para evitar o disminuir las secuelas neurológicas, incluimos en el equipo multidisciplinario a los neurorradiólogos intervencionistas para el tratamiento inmediato en las embolias cerebrales clínicamente valorables para tratar con angioplastia o trombólisis según sea el caso. Más aún si contamos en la sala de hemodinamia con un tubo de fluoroscopia que funciona también como un tomógrafo de 8 cortes para descartar una hemorragia cerebral y efectuar tratamiento inmediato.
No se presentaron complicaciones de tipo infarto agudo al miocardio y necesidad de cirugía cardiaca en el seguimiento.
Con base en nuestra experiencia, inicialmente se hacía el procedimiento con anestesia general y ventilación mecánica; sin embargo, en los últimos 8 pacientes decidimos utilizar lo menos posible la anestesia general para poder evidenciar un cuadro de infarto cerebral clínicamente evidente durante el procedimiento y tratarlo de forma inmediata, además de evitar la ventilación mecánica en aquellos pacientes con neumopatía crónica. En cuanto nuestro centro tome la suficiente experiencia en la implantación, realizaremos el abordaje percutáneo para evitar la anestesia general.
Las publicaciones iniciales con TAVI no incluyeron a pacientes con válvulas bicúspide VAB, por lo tanto, era considerada una contraindicación relativa, y tema importante en la práctica clínica dado que es una cardiopatía relativamente común (hasta un 2% en la población general)30. Recientemente se publicó un estudio comparando a los pacientes con EA grave y elevado riesgo quirúrgico con válvulas bicúspides y tricúspides tratados con TAVI hasta un año de seguimiento y se observó que los resultados son similares en ambos grupos. Ellos recomiendan que pacientes con EA grave y VAB puedan ser tratados con TAVI, con resultados similares a los reportados en pacientes con válvulas tricúspides. Un punto importante es que en este estudio, aunque no fue estadísticamente significativo, las VAB presentaban mayor cantidad de fugas paravalvulares≥231. En nuestra experiencia, de los 6 pacientes con válvulas aórticas funcionalmente bicúspides, hubo 4 pacientes con implantación exitosa (presentaban calcio suficiente para el anclaje de la válvula CoreValve) y 2 tuvieron complicaciones, uno de ellos con insuficiencia aórtica grado ii después del procedimiento y otro con infarto cerebral clínicamente evidente. Las complicaciones fueron secundarias al exceso de calcio distribuido de forma asimétrica; sin embargo, estos 2 pacientes fueron rechazados para cirugía por la disfunción ventricular y no había otra opción terapéutica.
Las imágenes no invasivas tienen un papel crucial en la selección de pacientes y para la congruencia con posterioridad a un tamaño específico de la válvula transcatéter con el fin de asegurar el despliegue preciso de la prótesis y minimizar las complicaciones peri- y después del procedimiento. En relación con los estudios diagnósticos previos al procedimiento, en nuestra experiencia la tomografía multicorte (TCMD) aportó datos sobre diámetros y grado de calcificación de los accesos vasculares, así como también sobre la cuantificación y distribución del calcio valvular, morfología de la aorta ascendente y mediciones del anillo. Nosotros nos basamos en el perímetro y área para seleccionar el tamaño de todas las válvulas. La revisión de estudios nos proporcionó la experiencia no solo para elegir el tamaño de la válvula, sino también para seleccionar la estrategia adecuada y detectar las posibles complicaciones, y a partir de esto, tratar de evitarlas o disminuirlas; se detectó una válvula poco calcificada con distribución homogénea y apertura simétrica accesible para implantar sin valvuloplastia previa, terminando el procedimiento con éxito. Esto ya lo realizan muchas instituciones en todo el mundo, queriendo abatir los costos del balón de valvuloplastia pero principalmente la disminución de eventos vasculares cerebrales con los cuales se asocia la valvuloplastia32,33. En un solo caso se observó arterias femorales tortuosas y se decidió vía de acceso subclavio izquierdo, aunque en la literatura ya existe evidencia del éxito del procedimiento con esta anatomía34.
ConclusionesEl TAVI debe ser considerado un programa y no una técnica dado que se involucran en su valoración, implantación y seguimiento a personal y equipo especializados, todos necesarios para el éxito del programa. Por lo tanto, es indispensable que en las instituciones que inician un programa TAVI se capacite a todo el grupo para disminuir en lo posible los errores. En nuestra experiencia, los pacientes posibles candidatos a TAVI son valorados inicialmente por un cardiólogo clínico y es indispensable la valoración por el servicio de geriatría; posteriormente todo el equipo tiene que ver físicamente al paciente durante la valoración antes del TAVI. En las instituciones que comienzan con un programa de TAVI, en el caso de la válvula CoreValve de Medtronic, se requieren de 3 estudios de imagen por cada posible candidato a TAVI, estos son necesarios y aportan información complementaria (ETE, TCMD y una coronariografía). Inicialmente la casa comercial recopila los estudios y la información clínica para aportar una opinión técnica del procedimiento, además de que la misma casa comercial apoya con un experto en cada procedimiento y que además califica al equipo para poder certificar al hospital. Una vez que la institución se certifique podrá enviar los estudios de forma opcional para las recomendaciones técnicas. Una de las complicaciones que se presentaron en nuestra serie fue que el porcentaje de eventos vasculares cerebrales fue mayor que lo reportado en la literatura, sin embargo, es una serie muy pequeña para poder llegar a una conclusión. Qué hemos aprendido de nuestras complicaciones: a) lo principal para el éxito del programa es involucrar a todo el equipo de salud en la selección, tratamiento y seguimiento de los pacientes, b) en los pacientes de más de 75 años es necesaria una valoración funcional por parte de geriatría, y c) las válvulas muy calcificadas y con una distribución asimétrica son un riesgo para insuficiencia aórtica perivalvular.
Con el avance de la tecnología, el mejoramiento de la válvula y el sistema de liberación, en un futuro se tendrán mínimas complicaciones y se podrán extender sus indicaciones13 y, aunado a esto, una mayor supervivencia de nuestra población. Esta opción de tratamiento debe ser accesible para los pacientes que lo necesiten y estar disponible en las instituciones de referencia de enfermedades cardiovasculares que tengan los recursos materiales y humanos.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
FinanciaciónNingún financiamiento para este trabajo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Dra. Iriabeth Soledad Villanueva López, Lic. María del Rocío Martín Hernández.