Introducción
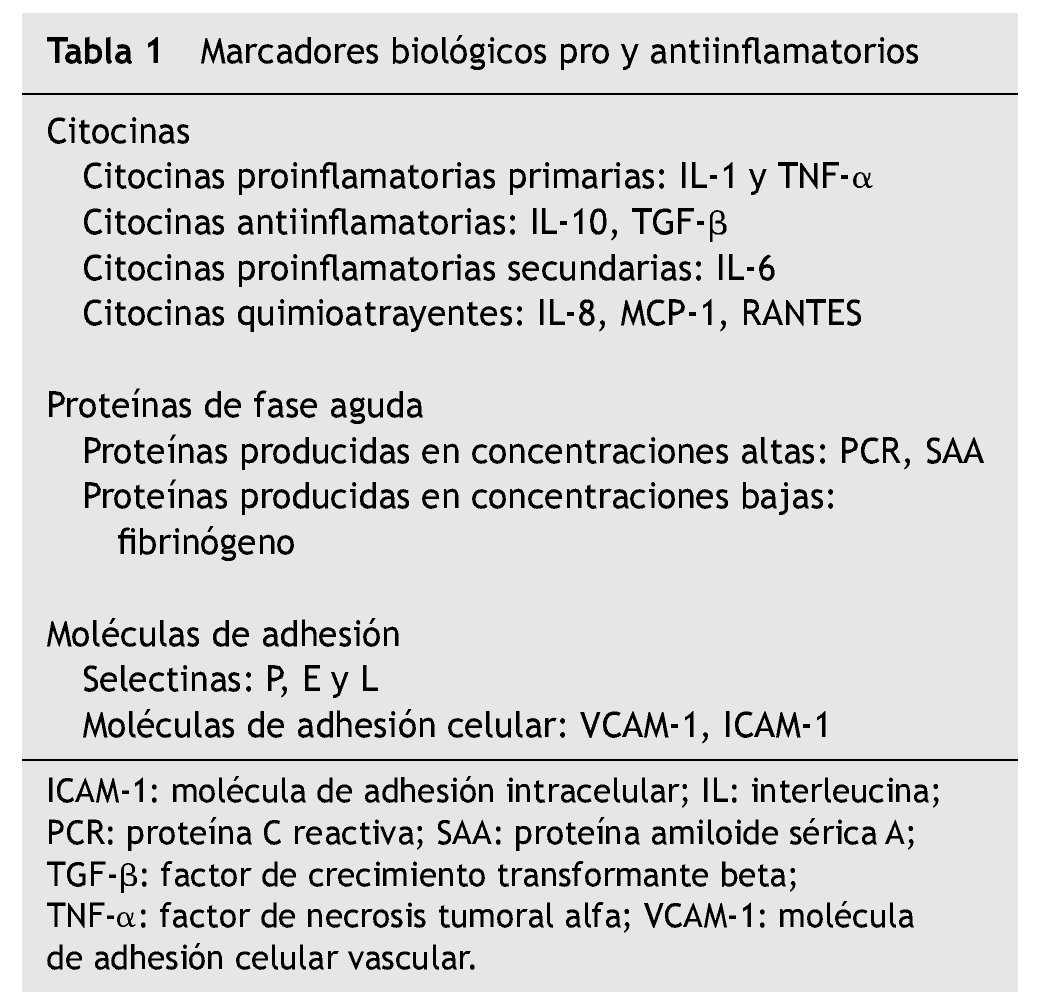
La enfermedad arterial coronaria (EAC) es una de las principales causas de morbimortalidad en el mundo; sin embargo, aún se desconoce cómo se inicia esta afección. Se sabe que los componentes primarios más importantes en un evento coronario agudo (infarto agudo de miocardio o angina inestable) son la aterosclerosis y la trombosis, sin olvidar los desencadenantes de riesgo clásicos, como la hipercolesterolemia, la hipertensión, la diabetes, la obesidad, el tabaquismo y las infecciones 1. Recientemente se ha observado que la inflamación tiene un papel importante en la EAC y otras manifestaciones de la aterosclerosis. Se sabe que en estadios tempranos de las placas ateroscleróticas, las moléculas del sistema inmunitario están presentes acelerando la progresión de la lesión, lo que conlleva al síndrome isquémico coronario agudo (SICA) 2. La inflamación, en la aterosclerosis, origina una gran variedad de estímulos que causan daño. El proceso se caracteriza por el movimiento de células del lumen vascular hacia la pared arterial, bajo la influencia de factores quimiotácticos producidos localmente 3. El desarrollo de una lesión aterosclerótica temprana involucra, además, la adhesión de monocitos y su trasmigración del endotelio hacia el lumen vascular. Esto también provoca el reclutamiento de células inflamatorias y la proliferación de células de músculo liso que dan inicio al desarrollo de una placa aterosclerótica madura, que se cubre de una capa de fibras que separa el conjunto lipídico protrombótico del flujo sanguíneo laminar (fig. 1). Cuando esta capa es muy delgada, puede romperse e iniciar el evento coronario agudo 4. Este evento es mediado por citocinas pro y antiinflamatorias, factores de crecimiento, células del músculo liso, células endoteliales y moléculas de adhesión 5,6. Las citocinas proinflamatorias, como la interleucina 1 (IL-1), la IL-6 y el factor de necrosis tumoral alfa (TNF-α), pueden estimular la producción de citocinas quimioatrayentes, así como integrinas alfa y beta, que desempeñan un papel importante en la aterogénesis, especialmente en la etapa de trasmigración del monocito al lumen vascular. La IL-6, una citocina proinflamatoria secundaria 7, estimula la producción de proteínas de fase aguda, como la proteína C reactiva (PCR), la proteína amiloide sérica A (SAA) y el fibrinógeno, en el hígado 8,9. Actualmente, ambas proteínas (IL-6 y PCR) se usan como marcadores de inflamación. Por otro lado, citocinas antiinflamatorias, como la IL-10 y el factor de crecimiento transformante beta (TGF-β), parecen tener un efecto protector en la enfermedad 10,11. Conocer los perfiles de producción de citocinas pro y antiinflamatorias permite establecer su papel en diferentes fases de la aterogénesis (tabla 1).
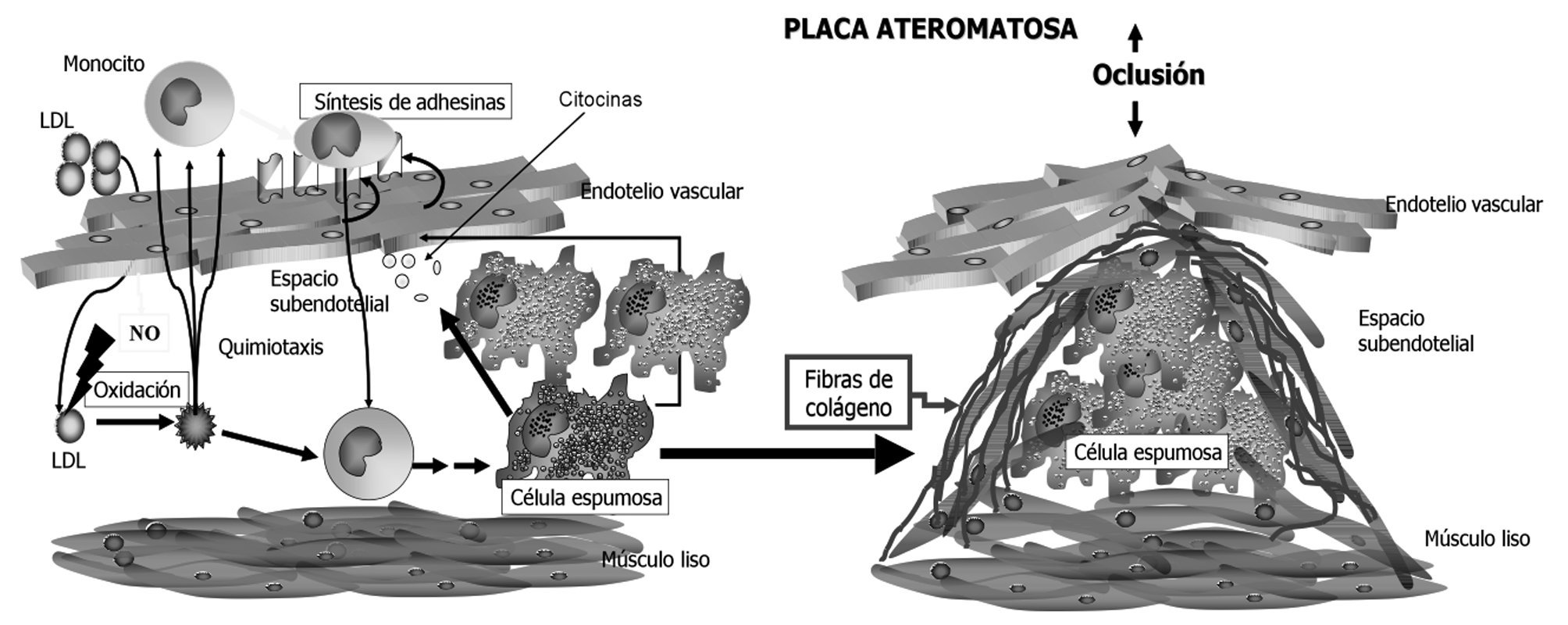
Figura 1 Modelo hipotético del proceso inflamatorio que se inicia cuando las lipoproteínas (LDL) circulantes quedan atrapadas en la matriz extracelular subendotelial y son oxidadas por especies reactivas de oxígeno, adquiriendo así propiedades proinflamatorias que dan lugar a una cadena de eventos que van desde el depósito de monocitos circulantes que exacerban la respuesta inflamatoria por la producción de citocinas al fagocitar las lipoproteínas oxidadas y la producción excesiva de elementos de la matriz extracelular y reclutamiento de nuevas células que dan lugar a la formación de la placa ateromatosa. LDL: lipoproteínas de baja densidad; NO: óxido nítrico.
Interleucina 1
La IL-1 es una de las primeras citocinas proinflamatorias en producirse durante el proceso aterogénico 12. Esta citocina presenta dos formas biológicamente activas: la IL-1α y la IL-1β 12. En humanos, la IL-1β se encuentra predominantemente en circulación y la IL-1α es un regulador de eventos intracelulares y mediador de inflamación local 12,13. La IL-1α y la IL-1β se pueden unir a los mismos receptores en la superficie de las células blanco 14. Existen dos tipos de receptores de IL-1 (IL-1R), el tipo I (IL1-RI) y el tipo II (IL-1RII) 12. La IL-1 se puede unir a el IL-1RI y transducir señales; además, puede formar un complejo de baja afinidad con proteínas accesorias, pero cuando se une al IL-1RII no transduce señales 12. Los principales tipos celulares que sintetizan IL-1 son los monocitos, los macrófagos y los macrófagos derivados de células espumosas; sin embargo, hay otras células, como las endoteliales, que también pueden producirla 12,13.
La IL-1 está involucrada en la inflamación que ocurre en la pared vascular durante la aterogénesis mediante la activación de monocitos y la expresión de moléculas de adhesión en células endoteliales, además de otras citocinas, quimiocinas y factores de crecimiento que estimulan la proliferación de células del músculo liso 12,13. De esta manera, la IL-1 puede participar en la aterogénesis mediante la proliferación de células del músculo liso 15 y la actividad procoagulante de las células endoteliales 16. También se ha observado que puede afectar al metabolismo de los lípidos 17. Finalmente, se ha demostrado que la IL-1 tiene un papel importante en la patogénesis de la EAC debido a que hay un aumento en la síntesis de esta citocina en las placas ateromatosas, además de concentraciones elevadas de IL-1β en suero de pacientes con EAC 18. Aunque el papel de la IL-1 parece ser muy importante en la aterogénesis, no se sabe con certeza si es un marcador independiente o asociado a eventos cardiovasculares o sólo es una molécula que se produce por otros estímulos inmunológicos de la afección. De hecho, un estudio epidemiológico con marcadores genéticos (VNTR) (repetidos en tándem de número variable) en el gen del antagonista del receptor de IL-1 (IL-1Ra) y un polimorfismo de un solo nucleótido (SNP) en el gen de IL-1B no reportó evidencia de asociación entre estos polimorfismos y la EAC 19.
De tal forma, que se requieren más estudios para determinar si valores elevados de IL-1 en plasma están asociados con EAC y SICA e incursionar en el estudio genético de esta citocina para tratar de conocer si, además, existe susceptibilidad genética en el desarrollo de esta enfermedad al analizar el gen y sus polimorfismos en diferentes poblaciones humanas.
Factor de necrosis tumoral alfa
El TNF-α es una citocina proinflamatoria con múltiples actividades biológicas y con un potente efecto inotrópico negativo 20. Entre las funciones biológicas descritas para el TNF-α se encuentran la producción de citocinas, proteínas de fase aguda, aumento en la expresión de moléculas de adhesión, activación de neutrófilos y coestimulador de activación de células T. El TNF-α transduce señales a través de 2 vías distintas debido a 2 tipos de receptores transmembrana, el receptor TNF-α tipo I (TNFR-I) y el receptor tipo II (TNFR-II) 21,22. Se ha identificado la expresión de estos receptores en todos los tipos celulares, excepto en eritrocitos 20,21. Además de estos receptores, hay formas solubles que se pueden unir al TNF-α. Estos receptores solubles son formas truncadas de TNF-α, que pueden unirse a esta molécula y regular su actividad biológica 23. Las principales células que sintetizan TNF-α son los monocitos y macrófagos, aunque otras células que también los sintetizan son los linfocitos T, las células asesinas naturales (NK, del inglés natural killer), las células de músculo liso, las células endoteliales y algunas células tumorales 24. Tanto el TNF-α como la IL-1β se han asociado directamente con inflamación local y generalizada debido a que tienen un efecto biológico similar 20.
Se ha documentado que el TNF-α influye en la patogénesis de la aterosclerosis debido a que está involucrado en la síntesis de proteínas de fase aguda, como la PCR, y de otras citocinas, como la IL-1 y la IL-6, que actúan como factores de riesgo en enfermedades cardiovasculares 20. Los valores elevados de TNF-α y de sus receptores solubles en plasma se han asociado con la insuficiencia cardíaca, el infarto agudo de miocardio (IAM) y la EAC 25. Algunos autores han reportado que la forma soluble de los receptores podría tener un papel protector contra el efecto proinflamatorio del TNF-α 26-28. Sin embargo, ahora se sabe que tanto el TNF-α como sus receptores solubles (TNFR-I y TNFR-II) son predictores independientes de mortalidad en la insuficiencia cardíaca 29. Un estudio sugirió que la forma soluble del TNFR-I es el principal predictor, a corto y largo plazo, de mortalidad y eventos cardiovasculares en pacientes que presentaron IAM 30.
Interleucina 6
La IL-6 es una citocina proinflamatoria secundaria, con múltiples funciones biológicas, como la regulación de la respuesta inmunitaria, inflamación, hematopoyesis y regulación de la síntesis de proteínas de fase aguda en el hígado 7,31-33. La IL-6 es producida por diversos tipos celulares, como las células del endotelio, del músculo liso, los linfocitos y los macrófagos, y uno de sus principales papeles es la regulación de la respuesta inmunitaria humoral, que afecta a la producción de inmunoglobulinas en las células B, y de tipo celular al regular la actividad citotóxica de la célula T 34. Evidencias experimentales indican que esta molécula tiene un papel medular en muchas afecciones crónicas inflamatorias y en el daño tisular 35. El efecto biológico de la IL-6 depende de su interacción con su receptor (IL-6R). El complejo entre la IL-6/IL-6R se asocia a una proteína de membrana celular que transduce señales, denominada gp130. Este evento permite la dimerización de gp130 para iniciar la cascada de señalización intracelular 32,36.
El IL-6R se presenta en dos formas: a) unida a la membrana celular, y b) en su forma soluble (sIL-6R). Esta última, de manera interesante, no tiene un efecto antagonista en la función biológica de IL-6, sino un efecto agonista. Estudios in vivo han demostrado que el complejo IL-6/sIL-6R asociado a gp130 puede activar varios tipos celulares; sin embargo, se ha observado que la IL-6 por sí sola no puede ejercer este efecto biológico 36,37. La forma soluble que se produce de la gp130 (sgp130) puede inhibir la actividad de la IL-6 mediante su unión con el complejo IL-6/sIL-R6 32,36-38. Varios estudios muestran que la IL-6 no sólo actúa como una de las principales citocinas inductoras de proteínas de fase aguda, sino también de citocinas y factores de crecimiento, activación de plaquetas, regulación de procesos procoagulantes y de la actividad mitogénica de las células de músculo liso 20.
Como ya se ha dicho, en la EAC y en el SICA, la inflamación tiene un papel central y se ha observado que proteínas de fase aguda, como la PCR, se encuentran aumentadas en el plasma de los pacientes, por lo que se ha sugerido que la IL-6 tiene un efecto directo en ambas afecciones. De hecho, en las placas ateroscleróticas humanas se han encontrado valores elevados de la IL-6 y varios estudios han reportado una asociación directa entre la IL-6 y el desarrollo de la EAC y de SICA 20,39. Actualmente, se sabe que la IL-6 es un factor de riesgo independiente de futuros eventos de IAM 40. Pai et al 41 encontraron que los valores elevados de IL-6 en circulación son un marcador predictor que incrementa la mortalidad en individuos con EAC inestable y que es independiente de otros como la troponina T y la PCR 42. Thomas et al también encontraron una asociación entre los valores elevados de la IL-6 y la presencia de IAM, que confirma lo hallado en los estudios en que se establece que la IL-6 es un marcador independiente de otras proteínas como la PCR para futuros eventos de IAM.
Quimiocinas
Las quimiocinas, denominadas también citocinas quimioatrayentes, pertenecen a una gran familia de polipéptidos de bajo peso molecular altamente básicos y que están formadas por 70-125 aminoácidos. Su función consiste en regular procesos celulares como la migración, el crecimiento y la activación de leucocitos, y otros tipos celulares 43,44. Actualmente, se han identificado aproximadamente 40 quimiocinas que pueden clasificarse en cuatro principales familias, de acuerdo con los residuos de cisteínas cercanas a su dominio amino (NH2) terminal. Estas familias se designan como CC (beta), CXC (alfa) y dos familias de quimiocinas recién descritas: C y CX3C4 (en donde X representa a cualquier aminoácido diferente de cisteína [C] y el subíndice al número de aminoácidos) 45. Las quimiocinas se producen en respuesta a una serie de citocinas proinflamatorias primarias, tales como la IL-1β y el TNF-α en los sitios donde ocurre daño. Una de estas quimiocinas es la proteína 1 quimioatrayente de monocitos (MCP-1), que es producida por macrófagos, células del músculo liso y células endoteliales 46. Otra de estas quimiocinas, la IL-8, se produce principalmente por macrófagos en lesiones humanas, como las placas ateromatosas 47.
La MCP-1 y la IL-8 son importantes en la aterogénesis, debido a que ambas moléculas inducen la atracción de monocitos y células T activadas. Se ha descrito que la MCP-1 y la IL-8 están involucradas en la inducción de los procesos de adhesión de los monocitos a la superficie endotelial 48,49. La función de la IL-8 comprende: la actividad angiogénica, la inducción de la migración y la proliferación de células de músculo liso, la inducción de una respuesta inmunitaria local y el reclutamiento de células T y macrófagos en placas aterogénicas tempranas 50. De esta manera, una vez que las células T activadas están en las placas, pueden sintetizar citocinas inflamatorias que inducen la expresión de metaloproteasas en macrófagos, contribuyendo al desarrollo de una placa aterosclerótica inestable 51. Estudios clínicos muestran valores elevados de la IL-8 en el plasma de pacientes con angina inestable e IAM 52. Inoue et al 53 encontraron valores elevados de la IL-8 en pacientes con EAC. En este estudio, estos valores fueron predictores de eventos cardiovasculares y los resultados mostraron que esta quimiocina es un factor de riesgo independiente de la PCR 53. Al parecer, la IL-8 activa y atrae a los neutrófilos a los sitios de inflamación y esta activación puede estar relacionada con futuros eventos cardiovasculares. Además, estas quimiocinas se han visto involucradas en el remodelamiento vascular que ocurre durante la formación de placas ateroscleróticas inestables.
Moléculas de adhesión
Las moléculas de adhesión son proteínas específicas que se encuentran en la superficie de las células endoteliales; su contraparte, los receptores, se encuentran en la superficie de los linfocitos. Entre sus principales funciones se encuentran la regulación de la migración de los leucocitos de la sangre a la pared de los vasos 54-56. La L-selectina, la E-selectina y la P-selectina son algunas de las moléculas de adhesión que pertenecen a la familia de las selectinas. Estas proteínas median la adhesión de leucocitos a la superficie endotelial, así como el paso de la superficie endotelial a la pared vascular 54-56. Por otro lado, miembros de la superfamilia de inmunoglobulinas, como la molécula de adhesión intracelular 1 (ICAM-1) y la molécula de adhesión celular vascular 1 (VCAM-1), participan en el arresto y la migración de leucocitos hacia la pared vascular 54-57. La expresión de estas proteínas en la superficie endotelial depende de la respuesta de la IL-1β y del TNF-α. Algunas moléculas de adhesión unidas a la membrana pueden presentar una rotura proteolítica y producir formas solubles. Tales proteínas sirven como marcadores de activación de células endoteliales e inflamación vascular.
Las concentraciones de moléculas de adhesión solubles en el suero de individuos con EAC, IAM y restenosis postangioplastia temprana se han relacionado directamente con la patogénesis de la afección 20. Estudios previos han reportado valores elevados de moléculas de adhesión asociados con angina estable, angina inestable e IAM. Por ejemplo, se ha demostrado que la forma soluble de la P-selectina es un factor de riesgo independiente para futuros eventos cardiovasculares 58. Del mismo modo, la forma soluble de ICAM-1 (ICAMs) se ha asociado como un factor de riesgo independiente de futuros eventos cardiovasculares en individuos aparentemente sanos y con EAC 59-61. Otro estudio reportó que las ICAMs puede ser un factor de riesgo para el desarrollo de SICA, particularmente angina inestable 62. Además, se ha reportado que las formas solubles de VCAM-1, ICAM-1 y E-selectina están asociadas con la mortalidad en pacientes con EAC 63.
Proteína C reactiva
La PCR fue la primera proteína de fase aguda descrita 64 y se ha empleado como un marcador sistémico muy sensible en enfermedades inflamatorias e infecciosas. De esta manera, esta proteína tiene una amplia utilidad clínica en el monitoreo y diagnóstico diferencial. La PCR consta de 5 subunidades polipeptídicas, no glucosiladas e idénticas, que se asocian de forma no covalente para formar una configuración anular pentamérica cíclica 65. Su síntesis ocurre principalmente en el hígado, bajo el estímulo de varias citocinas, primordialmente la IL-6 8,64, aunque otras, como la IL-1 o el TNF-α, pueden inducir su producción 66. La PCR es un marcador de inflamación generalizada y de daño tisular 64; de hecho, sus valores pueden aumentar hasta 1.000 veces durante un proceso de inflamación aguda 9. El papel directo de la PCR en la aterosclerosis se observa cuando, en presencia de esta proteína, la ingesta de lipoproteínas de baja densidad por macrófagos se incrementa y contribuye a la formación de células espumosas. Además, puede activar al complemento en la placa aterosclerótica, llevándola a su inestabilidad, e induce la producción de moléculas de adhesión en células endoteliales humanas y se ha asociado también con disfunción endotelial, lo cual facilita la activación, la migración y el alojamiento de leucocitos que contribuyen a la formación de lesiones vasculares. Finalmente, también tiene propiedades proinflamatorias que pueden potenciar la patogénesis y la progresión de la placa aterosclerótica 67-70. La PCR tiene un papel por demás interesante en la biología y la patología de las afecciones cardiovasculares, no sólo porque se une selectivamente a lipoproteínas de baja densidad (LDL) en su forma oxidada en las placas ateromatosas 68, sino también porque se deposita en la mayoría de ellas 69. Existen diversos estudios que han demostrado el valor pronóstico de la PCR en el síndrome coronario agudo y su valor como predictor independiente de otros marcadores que están relacionados con futuros eventos cardiovasculares en individuos aparentemente sanos y en pacientes con IAM y EAC 20,71,72. En resumen, la PCR es de gran utilidad en el pronóstico en pacientes con EAC y es un fuerte predictor independiente de futuros eventos coronarios en individuos aparentemente sanos.
Amiloide sérico A
El SAA es una de las principales proteínas reactantes de fase aguda, con un aumento en su concentración de más de 1.000 veces durante procesos inflamatorios 73. El SAA está constituido por una familia de apolipoproteínas que rápidamente se liga a las lipoproteínas de alta densidad (HDL) después de su síntesis y es potencialmente influido por el metabolismo del colesterol durante el estado inflamatorio. Durante la inflamación, el SAA puede asociarse principalmente con la tercera porción de la HDL3, remplazando a la apolipoproteína A-1 (apolipoproteína predominante de esta molécula) 73. El SAA se sintetiza principalmente en el hígado 73; sin embargo, también puede haber síntesis extrahepática, ya sea en tejidos normales o afectados 74, dependiendo de estímulos sinérgicos entre las citocinas IL-1 e IL-6 75. En humanos, se ha encontrado SAA en todos los tipos celulares presentes en las lesiones ateroscleróticas, aunque no se sabe cuál es el papel de esta proteína en la aterogénesis 75,76.
Algunos estudios han analizado el riesgo a presentar enfermedades cardiovasculares asociadas con el gen del SAA y han encontrado que el riesgo que confiere este gen es bajo 77. Por otro lado, se ha documentado un modesto aumento en los valores de SAA en pacientes con enfermedades cardiovasculares 78 y también se ha reportado que esta proteína es útil en el pronóstico del SICA 79. Algunos estudios indican que el SAA es un marcador más sensible que la PCR en enfermedades inflamatorias; sin embargo, se requieren más estudios para confirmar esta propuesta. Un estudio clínico mostró que valores elevados de SAA en pacientes hospitalizados con angina inestable e IAM tienen un mayor riesgo de mortalidad temprana 80, pero aún son pocos los estudios para determinar si esta proteína puede servir como un marcador predictor independiente de futuros eventos coronarios agudos 80.
Fibrinógeno
El fibrinógeno es una glucoproteína soluble que se encuentra en el plasma 81, que se sintetiza principalmente en el hígado y tiene una vida media de, aproximadamente, 100 h 82. El fibrinógeno es una proteína clave del sistema de la coagulación y es el precursor de la fibrina; en plasma, esta proteína es un reactante de fase aguda 83. Varios estudios han encontrado que el fibrinógeno es importante en procesos fisiopatológicos como la inflamación, la aterogénesis y la trombogénesis. Se ha sugerido que el fibrinógeno está involucrado en mecanismos como el aumento en la agregación plaquetaria y la formación de trombos. En estadios tempranos, el fibrinógeno se ha involucrado en la formación de placas que se integran a la pared de las arterias y que pueden convertirse en fibrina y en productos de degradación del fibrinógeno; también puede unirse a HDL y secuestrar más fibrinógeno. Tanto el fibrinógeno como sus productos degradados pueden mediar la adhesión de macrófagos a la superficie endotelial y su migración a la capa íntima 84.
Se ha demostrado que concentraciones elevadas de fibrinógeno se asocian con el riesgo de padecer un evento cardiovascular 83. El fibrinógeno se ha asociado a una variedad de factores clásicos de riesgo en la aterosclerosis, como la edad, el tabaquismo, colesterol unido a LDL (cLDL), inactividad física y presión sanguínea, que influyen en el desarrollo de EAC 85. Se ha sugerido que el fibrinógeno es por sí solo un factor independiente predictor de mortalidad, después de un IAM 86. Además, se ha reportado que predice futuros eventos de EAC 87, como se observa en un metaanálisis que incluyó 6 estudios epidemiológicos prospectivos con muestras representativas de población general. En este estudio se observó que los valores de fibrinógeno en plasma representan un factor independiente de riesgo cardiovascular 83. Por otro lado, también se ha propuesto que valores reducidos de fibrinógeno, en pacientes con enfermedades coronarias, pueden ser benéficos 20.
Interleucina 10
La IL-10 es una citocina antiinflamatoria que tiene varios efectos biológicos, incluidas la inhibición del TNF-α, de la IL-18 y de la metaloproteasa 9 88,89. Entre sus principales funciones biológicas están la limitación y el "apagado" final de la reacción inflamatoria de un huésped en respuesta a un patógeno 90. Su efecto sobre los macrófagos no está limitado sólo a la regulación de citocinas, sino también a su papel en la inhibición de la expresión de moléculas de adhesión, de antígenos leucocitarios humanos (HLA) clase II, la presentación de antígenos y activación de linfocitos 90. De hecho, en suero de pacientes con SICA se han encontrado valores bajos de IL-10 91. Estas evidencias experimentales sugieren que valores reducidos de IL-10 en plasma pueden favorecer la inestabilidad de la placa y el desarrollo del SICA. Por otro lado, valores altos de IL-10 en plasma se han asociado a una mejoría vasorreactiva endotelial sistémica en pacientes con valores elevados de PCR 92. Esto concuerda con lo reportado en algunos estudios en donde se ha observado que valores elevados de IL-10 en suero en pacientes con enfermedades cardiovasculares no sólo predicen un mejor resultado clínico después de un SICA, sino que también eliminan el riesgo asociado a valores elevados de PCR en suero 10,33. De hecho, la IL-10 ha mostrado tener un efecto protector en la función endotelial después de un estímulo inflamatorio agudo, ya que limita la generación de superóxido dentro de la pared vascular 93. Estudios in vitro sugieren que la IL-10 tiene un efecto antiaterogénico debido a que inhibe la adhesión de monocitos a células endoteliales, que es el primer paso para la invasión a la pared celular 94,95. Otra función de la IL-10 consiste en inhibir la síntesis de la metaloproteasa 9, mediante la producción de inhibidores fisiológicos e inhibidores de las metaloproteasas 95. A pesar de estas evidencias experimentales, se requieren de más estudios clínicos acerca de la IL-10 en plasma durante enfermedad aterosclerótica estable e inestable, ya que hasta el momento los datos obtenidos en humanos son escasos y controvertidos.
Factor de crecimiento transformante β1
El TGF-β1 es una proteína pleiotrópica que es secretada por muchos tipos celulares, como los macrófagos, los linfocitos, las células de músculo liso y las plaquetas. Se secreta en forma inactiva pero se activa cuando es degradado proteolíticamente 96. Se ha descrito que el TGF-β1 tiene acción antiinflamatoria 92. Ensayos in vitro sugieren que el TGF-β1 puede regular la expresión de moléculas de adhesión de células vasculares en humanos, inducidas por citocinas proinflamatorias 11. En los últimos años, se ha propuesto que el TGF-β1 puede tener un papel protector en la aterogénesis mediante la inhibición de la migración y la proliferación de células del músculo liso y macrófagos y ejerciendo un efecto protector en la función endotelial 97,98. Se ha observado que el TGF-β1 disminuye la adhesividad de las células endoteliales a los leucocitos y linfocitos. Este efecto protector se debe a la inhibición en la expresión de VCAM-1, que es regulada por el TGF-β1 11.
Algunos estudios han reportado valores bajos de la forma activa del TGF-β1 en estadios avanzados de aterosclerosis 99. Otros han explorado la asociación entre el TGF-β1 y la EAC, y han observado valores en suero de la forma activa del TGF-β1 y se ha relacionado con la gravedad de la enfermedad, por lo cual éste se ha reportado como un factor de riesgo independiente de otros marcadores estándar 100. Asimismo, se sabe que el TGF-β1 tiene un efecto proinflamatorio y que participa en la excesiva acumulación de matriz extracelular en las paredes de los vasos dañados, lo que es muy desfavorable para éstos 11,101. Esto último contradice lo que sabemos acerca del TGF-β1; sin embargo, cada vez se acepta más la teoría de que el TGF-β1 tiene un papel antiaterogénico y estabilizador de las placas 101. Finalmente, y de la misma forma que en el conocimiento de otras moléculas pro y antiinflamatorias, es necesario realizar más estudios para determinar el papel de esta molécula en la aterosclerosis, la EAC y el SICA.
Conclusiones
Diversos estudios clínicos y experimentales indican que varias proteínas relacionadas con el proceso inflamatorio tienen un papel importante en la fisiopatología del SICA y los estadios tempranos de la formación y la rotura de la placa ateromatosa. Se ha observado que citocinas proinflamatorias y quimiocinas promueven el reclutamiento de diversos tipos celulares, incluidos monocitos, células T y mastocitos, entre otras, a los sitios de formación de la placa. Estas citocinas, además, pueden activar proteínas procoagulantes y factores fibrinolíticos que favorecen la trombosis. Las evidencias experimentales indican que los marcadores proinflamatorios, como la PCR, el SAA, la IL-6 y el fibrinógeno, no sólo son importantes en el desarrollo de la EAC y el SICA, sino que además son factores predictores de futuros eventos coronarios agudos o de mortalidad. Otros marcadores, como el TNF-α, la IL-1β o sus receptores solubles, se están analizando arduamente y, a pesar de que hay algunos reportes que muestran a estas moléculas como predictores de futuros eventos coronarios agudos, aún falta evidencia experimental que nos indique si estos biomarcadores se pueden utilizar para tal objetivo en la práctica médica. Por otro lado, las citocinas antiinflamatorias, como la IL-10 y el TGF-β, desempeñan un papel muy importante en la inhibición de la respuesta inmunitaria celular; esto es de suma importancia en la EAC y el SICA, ya que evitan la síntesis de citocinas proinflamatorias involucradas en su desarrollo y en futuros eventos de IAM. Sin embargo, los estudios con respecto a citocinas antiinflamatorias son incompletos como para poder utilizarlos como biomarcadores de predicción. Se requieren de más estudios que evidencien si tienen un efecto predictor de protección en la EAC y el SICA, y en enfer medades cardiovasculares de algunas citocinas proinflamatorias (IL-1, TNF-α), quimiocinas (MCP-1), proteínas de adhesión celular (V-CAM, selectina E) y antiinflamatorios (IL10, TGF-β) para poder concluir si son biomarcadores de riesgo independiente de PCR, IL6, SAA, y si tienen un valor predictivo en futuros eventos, como IAM, o mortalidad, ya que hasta el momento los datos no son concluyentes. Consideramos que las futuras líneas de investigación de la ciencia cardiológica deberán explorar con mayor profundidad el papel que desempeñan las citocinas pro y antiinflamatorias en el desarrollo de los SICA con el fin de establecer su papel como marcadores pronósticos de estos padecimientos.
*Autor para correspondencia.
Correo electrónico: gvargas63@yahoo.com (G. Vargas-Alarcón).
Recibido el 3 de julio de 2007;
aceptado el 14 de agosto de 2008.