Introducción
Recientemente los descubrimientos científicos en materia biológica se han encaminado hacia la transición de modelos in vitro a modelos in vivo. Hoy, los esfuerzos se dirigen a desarrollar tecnologías de imagen no invasivas y con alta resolución específicas para animales pequeños. El objetivo principal de la imagen molecular en roedores es obtener una señal lo más fuerte posible, factible de ser localizada de la manera más exacta mediante el marcaje de blancos específicos y con la menor cantidad de radiotrazador posible. Así mismo, desarrollar un dispositivo capaz de producir imágenes tridimensionales de información anatómica y funcional fusionada con una alta resolución temporal.
Una ventaja sobre la experimentación in vitro y en cultivos celulares se puede lograr mediante la realización de estudios repetidos en el mismo animal, usando ensayos de imágenes biológicas en distintos tiempos. Esto revela un cuadro dinámico y más significativo de los cambios progresivos en parámetros biológicos bajo estudio, así mismo es posible la valoración temporal de las respuestas terapéuticas, todo en el mismo animal y sin la necesidad de sacrificarlo. Con lo que se obtienen resultados de mejor calidad usando menos animales de experimentación. Al utilizar una menor cantidad de sujetos de investigación mediante técnicas de imagen molecular se atiende a cuestiones éticas relacionadas con el uso adecuado de animales de laboratorio.
La tomografía por emisión de positrones (PET) ofrece la capacidad única de medir en forma no invasiva el flujo de substratos miocárdicos regionales y el índice de reacciones bioquímicas en mmol por minuto por gramo de miocardio. Mientras que este aspecto es verdaderamente único, la PET ofrece otras capacidades adicionales, como por ejemplo la evaluación o cuantificación del flujo sanguíneo miocárdico regional.1
En las últimas décadas la incidencia de enfermedades cardiovasculares ha aumentado de manera drástica, especialmente en los países en vías de desarrollo, donde el estilo de vida está presentando una tendencia de comportamiento similar al de los países de primer mundo, tanto en hábitos dietéticos (mayor prevalencia de obesidad en gente joven) como el sedentarismo. Estadísticas del INEGI informaron para fines del 2006 como la principal causa de muerte en México a la cardiopatía isquémica (CI) y en éste rubro el infarto al miocardio (IAM), con un promedio de 40 a 60 mil defunciones al año, especialmente en personas mayores de 65 años, seguida de padecimientos crónico-degenerativos como la diabetes mellitus y después los padecimientos oncológicos.
En muchas ocasiones la enfermedad se manifiesta de manera inesperada, ya sea por infarto agudo de miocardio o bien por muerte súbita sin antecedentes clínicos relevantes, sin embargo, en otros casos, puede pasar inadvertido especialmente en pacientes diabéticos. Con base en lo anterior, el diagnóstico se ha dirigido hacia una detección precoz con el fin de intervenir la enfermedad en fases tempranas.
Actualmente se cuenta con una amplia gama de estudios tanto no invasivos como invasivos para el diagnóstico de la CI, entre los más importantes se cuenta con la Ecocardiografía, la tomografía vascular contrastada, la resonancia magnética (RM), la tomografía por emisión de fotón único (SPECT), la angiografía coronaria y la PET. La utilidad en el diagnóstico de la isquemia miocárdica por las diferentes técnicas de imagen anteriormente mencionadas, ha sido reportada en múltiples estudios, compitiendo por certeza diagnóstica en la determinación del tejido viable tras un evento de infarto miocárdico.2-6
La reciente puesta en operación del sistema de Micro-PET en la unidad PET-CT de la UNAM, primer equipo en su tipo en América Latina permite la realización de estudios de imagen nuclear en animales de experimentación, facilitando así la profundización en el conocimiento científico a varios niveles.
Es fundamental la realización de evaluaciones miocárdicas en modelos animales que fijen las bases para el posterior estudio de fisiopatologías específicas, así como sus posibles tratamientos.
Metabolismo glucolítico cardiaco y su evaluación con 18F-FDG
El mantenimiento homeostático de los niveles de glucosa sanguínea es fundamental para la vida de los organismos mamíferos. La glucosa es el sustrato más confiable para la producción energética en el corazón debido a que su concentración plasmática se mantiene dentro de un estrecho rango. La importancia del metabolismo de la glucosa vía glicolisis ha sido considerada al evaluar el miocardio isquémico e hipertrofiado,7-10 pero el metabolismo aeróbico de la glucosa para el mantenimiento de la función contráctil normal ha recibido menos atención, principalmente debido al hecho bien conocido de que los ácidos grasos son, en condiciones normales, el principal sustrato para la producción energética del corazón.8,11,12
El corazón es un órgano "omnívoro" que funciona mejor cuando éste oxida diferentes sustratos simultáneamente.13
El azúcar simple D-glucosa es la molécula orgánica más abundante en la naturaleza. La glucosa que es utilizada por el corazón, proviene ya sea de la circulación sanguínea o de los almacenes intracelulares de glucógeno. El transporte de la glucosa hacia el interior de la célula miocárdica es regulado por transportadores específicos. La glucosa intracelular es rápidamente fosforilada y se convierte en sustrato adecuado para la glucólisis, la síntesis de glucógeno o la síntesis de ribosa. Tras incorporarse a la vía glucolítica, la glucosa es transformada en última instancia en piruvato, el cual, es sustrato de vías metabólicas posteriores.
La captación de glucosa, definida como el transporte y fosforilación de la misma, es medible mediante el análogo 18F-2-deoxi-2-fluoro-D-glucosa (18F-FDG) y PET. La PET con 18F-FDG se considera el estudio más sensible para el diagnóstico de viabilidad miocárdica debido a que detecta la actividad metabólica de la célula miocárdica. La 18F-FDG se inyecta por vía intravenosa y se incorpora a la célula cardiaca metabólicamente activa (células miocárdicas vivas) que preservan integridad de membrana y persistencia de los procesos bioquímicos. Comparado con las técnicas tradicionales de Cardiología Nuclear es aún más sensible, debido a que estas últimas exploran la perfusión de la célula miocárdica y no su actividad metabólica. Se ha demostrado que 40% a 50% de los pacientes considerados con necrosis sin tejido viable residual, por los estudios de medicina nuclear, poseen viabilidad cuando se les efectúa un estudio de PET con 18F-FDG.14
Tras su administración, el transporte de la 18F-FDG se lleva a cabo por proteínas transportadoras de la familia GLUT, un sistema saturable estéreo-específico de transportadores.15-17 La GLUT-4 es la principal isoforma que se expresa en la superficie del miocardio adulto, es dependiente de insulina y se puede encontrar también en tejido adiposo.15 Además, la célula miocárdica expresa el transportador GLUT-1, que predomina en el miocardio fetal y presumiblemente es independiente de la acción de la insulina.16 La fosforilación de la glucosa por parte de la hexocinasa, es el primer paso regulatorio dentro del metabolismo glucolítico. El corazón presenta dos isoenzimas: la hexocinasa I que predomina en el corazón fetal y de recién nacido, y la hexocinasa II, regulada por insulina y predominante en el corazón adulto.18 Además de ingresar a la vía glucolítica, una fracción de la glucosa-6-fosfato es sustrato para la síntesis de glucógeno. El glucógeno ocupa cerca de 2% del volumen celular del miocardio adulto y aproximadamente 30% del miocito cardiaco fetal y del recién nacido.19 Contrario a lo que ocurre en hígado y músculo esquelético, el músculo cardiaco aumenta su contenido de glucógeno con el ayuno.20 Esto concuerda con el principio de que los ácidos grasos, principal sustrato energético miocárdico, inhiben la glucólisis en mayor medida que a la captación de glucosa, redirigiendo así a la glucosa hacia la síntesis de glucógeno. El almacenamiento de glucógeno se incrementa también por influencia de la insulina, debido a la estimulación simultánea del transporte de glucosa y la síntesis de glucógeno.21 Así mismo, la glucogenogénesis se incrementa cuando el lactato actúa como principal sustrato energético del corazón.22-23La inhibición de la oxidación de glucosa por los ácidos grasos es un fenómeno bien conocido del metabolismo de los mamíferos. Los mecanismos implicados se definieron en estudios con corazones perfundidos, que llevaron a la formulación del "ciclo glucosa-ácidos grasos".11 Por otro lado, la glucosa también es capaz de inhibir la oxidación de ácidos grasos. La transferencia de los ácidos grasos activados hacia el interior de la mitocondria, donde ocurre la β-oxidación, es catalizada por la carnitinapalmitoil transferasa-1(CPT-1 y CPT-2). La tasa de oxidación de ácidos grasos es controlada por su tasa de transferencia hacia el interior mitocondrial a través de la CPT-1.12 Este último paso es inhibido por la malonil-CoA,24 formada a partir de acetil-CoA por la acetil-CoA carboxilasa.25-26 Condiciones como un aumento en la concentración de glucosa o lactato, o la adición de insulina, que incrementan la producción de acetil-CoA a partir de piruvato; estimulan la producción de malonil-CoA, inhibiendo así la β-oxidación.
Los productos de la glucólisis ingresan posteriormente al ciclo de Krebs, donde convergen las vías metabólicas encaminadas a la oxidación de las moléculas combustibles para la producción de ATP a partir de acetil-CoA e incluyendo el reciclaje de CO2 y H2O.
Metabolismo oxidativo cardiaco y su evaluación con 1-11C-acetato
El corazón depende casi por completo en la oxidación aeróbica de sustratos para la generación del ATP necesario para el mantenimiento de su función contráctil. En el corazón normal, la demanda de oxígeno se encuentra en balance con el aporte del mismo, que es determinado por el flujo sanguíneo miocárdico y la extracción de oxígeno. Dicha extracción miocárdica de oxígeno es alta (~70%) en sujetos normales en reposo, presenta una variación importante durante el ejercicio y bajo diferentes patologías como enfermedad arterial coronaria, entre otras.27 Así mismo, el balance entre la demanda y el aporte de oxígeno se ve alterado en muchas enfermedades. En consecuencia, para un mejor entendimiento de la fisiopatología y la evaluación de posibles terapias, es importante medir además de la perfusión, el consumo miocárdico de oxígeno (MVO2), sobre todo a nivel regional.
Con la introducción de la PET, se han desarrollado varios trazadores destinados a la cuantificación regional de perfusión y metabolismo miocárdicos. En las dos últimas décadas del siglo pasado, varios estudios determinaron que el PET con 1-11C-acetato provee una estimación acertada del MVO2 y la perfusión cardiaca.
El MVO2 se puede dividir en dos componentes: el oxígeno necesario para la contracción (trabajo) y el necesario para los demás procesos en las células cardiacas, como conducción eléctrica y metabolismo basal. Se han descrito 9 determinantes del MVO2.28 Entre los más importantes se encuentran el desarrollo de tensión, la contractilidad y la frecuencia cardiaca. Estos determinantes de MVO2 determinan también el requerimiento de ATP, por lo que se podría asumir que el requerimiento de ATP es igual al requerimiento de oxígeno. El ATP se produce ya sea, a nivel de sustrato o por fosforilación oxidativa de ADP. La contribución de fosforilación a nivel de sustrato a la producción total de ATP es baja. La fosforilación oxidativa es el proceso de reducción de equivalentes mediante transferencia de electrones al oxígeno por una cadena de acarreadores, produciendo agua en el último paso. Este es el mecanismo principal de uso del oxígeno dentro de la célula, y el único mecanismo presente en el miocardio. Por lo tanto el MVO2 es idéntico al flujo a través de la fosforilación oxidativa.29
Los equivalentes de reducción que participan en la fosforilación oxidativa, NADH + H+ y FADH2 acarrean electrones de procesos en el ciclo de los ácidos tricarboxílicos, la glucólisis y la β-oxidación. La relación entre estos equivalentes de reducción derivados del ciclo de los ácidos tricarboxílicos y los derivados de la glucólisis y la β-oxidación es relativamente estable. Esta relación es aproximadamente de 2:1 a favor del ciclo de los ácidos tricarboxílicos. Consecuentemente, cerca de dos terceras partes del oxígeno utilizado en la célula corresponde al utilizado en la reducción de los equivalentes derivados del ciclo de los ácidos tricarboxílicos. La relación es dependiente de la longitud de la cadena de ácidos grasos usados por la célula. Los mamíferos utilizan principalmente cadenas de entre 16 y 18 C, resultando en un cambio máximo en la relación de 6%.
El acetato, un ácido graso libre de dos carbonos, entra directamente al ciclo de los ácidos tricarboxílicos tras su conversión a acetil-CoA. Debido a esto, el acetato marcado puede ser utilizado para medir el flujo del ciclo, así como la producción de los equivalentes de reducción, que a su vez se encuentra acoplado firmemente al consumo de oxígeno, mismo que se puede estimar midiendo el flujo del acetato a través del ciclo de Krebs.
El 1-11C-acetato es ampliamente usado como radiotrazador del ciclo de los ácidos tricarboxílicos, y así, del metabolismo oxidativo en general a nivel miocárdico.30 Este uso aprovecha el hecho de que la mayoría de los sustratos miocárdicos oxidables, incluyendo ácidos grasos, glucosa, lactato, piruvato, cuerpos cetónicos y algunos aminoácidos, son oxidados vía conversión a acetil-CoA y oxidación a través del ciclo de los ácidos tricarboxílicos.31 La relación entre el ciclo de los ácidos tricarboxílicos y la tasa de consumo de oxígeno miocárdico es similar para la mayoría de los sustratos.32
Se ha descrito que el acetato comparte un transportador monocarboxilato con lactato y piruvato a través de la membrana sarcolémica en corazones perfundidos de conejo33 y miocitos cardiacos de cobayo.34 Una vez transportado al interior de la célula, el C-1 acetato es activado fácilmente a C-1 acetil-CoA por la acetil-CoAsintetaza, localizada en la matriz mitocondrial35 y entonces es oxidado en el ciclo de Krebs. En el miocardio el acetato no es metabolizado por ninguna otra vía.36 A su paso por el ciclo, el carbono marcado se incorpora en distintas posiciones de los intermediarios del ciclo de los ácidos tricarboxílicos.36-37
En varios estudios se ha demostrado una estrecha correlación entre la tasa de aclaramiento miocárdico de C-1 acetato y el MVO2 en corazón perfundido de rata y miocardio canino bajo diferentes condiciones de flujo y metabolismo.36,38-41
El acetato es extraído ávidamente por el tejido miocárdico, con fracciones de extracción in vivo en el rango de 65% a tasas de flujo fisiológicamente normales (~1 ml·g-1·min-1) a 47% bajo estado de hiperemia inducida con dipiramidol (~5 ml·g-1·min-1).42
Contrario al 18F-FDG, la tasa de aclaramiento del 1-11C-acetato no tiene variación al modificar la disponibilidad de sustratos.43,44 Además, el aclaramiento de 1-11C-acetato ha resultado homogéneo en varios estudios cuyo objetivo fue buscar diferencias regionales en miocardio normal.40,42,45,46 Por lo que no se necesita estandarización metabólica.
El rápido aclaramiento del 1-11C-acetato en su primera fase se correlaciona estrechamente con el consumo miocárdico de oxígeno en animales38,41,47 y en el hombre.42,48
Debido a que se ha demostrado que la captación temprana de 1-11C-acetato es útil como índice indirecto de la tasa de perfusión miocárdica regional en pacientes estables con enfermedad arterial coronaria,49,50 un modelo simplificado para 1-11C-acetato proporcionaría información cuantitativa acerca del flujo sanguíneo miocárdico regional y el metabolismo oxidativo en un solo estudio PET con acetato.
Flujo sanguíneo miocárdico
Los trazadores como el agua marcada con oxígeno-15 (H215O) y amoniaco marcado con nitrógeno-13 (13NH3) son los radiotrazadores más utilizados por PET para la cuantificación regional y absoluta del flujo sanguíneo. Los estudios comparativos realizados en flujo sanguíneo miocárdico utilizando cualquiera de estos trazadores tanto en reposo como durante vasodilatación coronaria inducida farmacológicamente son similares. El H215O tiene una extracción miocárdica completa que es independiente de flujo y del estado metabólico del miocardio; por otro lado, las imágenes obtenidas con 13NH3 son de mejor calidad.51 Ambos tienen vidas medias muy cortas, lo cual hace posible la medición repetitiva de diferentes parámetros durante una misma sesión de PET.
Las imágenes de perfusión miocárdica mediante PET con 13N-amoniaco han mostrado ser un método altamente sensible (94% a 98%) y específico (95% a 100%) para la detección de enfermedad arterial coronaria, superior a SPECT tanto en precisión diagnóstica como en calidad de imagen.52
Además, la elevada fracción de extracción del 13N-amoniaco permite identificar isquemia leve de manera más precisa en comparación con trazadores SPECT como el Tc-99m, cuya fracción de extracción es menor.
La evaluación de la perfusión miocárdica es de gran relevancia en pacientes con CI, en los cuales es posible determinar no sólo el grado de isquemia miocárdica, sino también la medición cuantitativa del flujo sanguíneo regional y de la reserva de flujo coronario, pudiendo establecer el impacto funcional de las lesiones coronarias y del flujo colateral, con lo cual podemos realizar una estratificación pronóstica precisa en estos pacientes.53
Asimismo, el estudio de perfusión miocárdica mediante PET con 13N-amoniaco permite la evaluación de distintas aproximaciones terapéuticas orientadas a mejorar la perfusión miocárdica que requieren una medición no invasiva y precisa del flujo sanguíneo miocárdico.
Métodos
Animales
Se utilizaron ratas Wistar macho, con un peso de 300 a 350 gramos. Los animales fueron proporcionados por el bioterio central de la Facultad de Medicina, tras la aprobación de La Comisión de Investigación del MicroPet y La Comisión de Ética, ambas de la Facultad de Medicina de la UNAM. El manejo óptimo de los sujetos de experimentación se llevó a cabo con base en la Norma Oficial Mexicana NOM-062-ZOO-1999 "Especificaciones técnicas para la producción, cuidado y uso de animales de laboratorio". Para el protocolo con 18F-FDG se utilizaron cinco ratas, ocho ratas en el caso de 1-11C-acetato y 10 animales para el protocolo con 13NH3.
18F-FDG (diseño de grupos)
Para el estudio de metabolismo glucolítico los animales se estudiaron en tres diferentes protocolos, realizados en distintos tiempos (con al menos un día de diferencia entre cada uno), con el fin de establecerlos como sus propios controles.
El diseño de los protocolos fue el siguiente:
1. Sin ayuno (libre acceso de comida y agua inmediatamente antes del estudio).
2. Con ayuno (se restringió el acceso de comida ocho horas antes del estudio, solo con acceso de agua a libre demanda).
3. Con ayuno más carga oral de glucosa (ayuno de ocho horas, con administración de glucosa al 50% vía oral, a dosis de 0.4 mg de glucosa por gramo de peso corporal, 30 minutos antes de la administración de la 18F-FDG).
En cada protocolo se adquirieron dos rastreos PET de 30 minutos; el primero a los 30 minutos después de la administración de una dosis intraperitoneal de 370 - 555 MBq de 18F-FDG y el segundo rastreo a los 60 minutos, esto con el fin de determinar cuál de las dos adquisiciones presenta una mejor relación blanco-fondo, para la adecuada definición del miocardio ventricular.
1-11C-acetato
Los animales fueron divididos en dos grupos de igual número de animales. Se adquirieron cuatro estudios estáticos y cuatro estudios dinámicos.
En el primer caso se administró una dosis de 370 - 555 MBq de 1-11C-acetato a través de la vena caudal, tras dos minutos se inició una adquisición de 30 minutos.
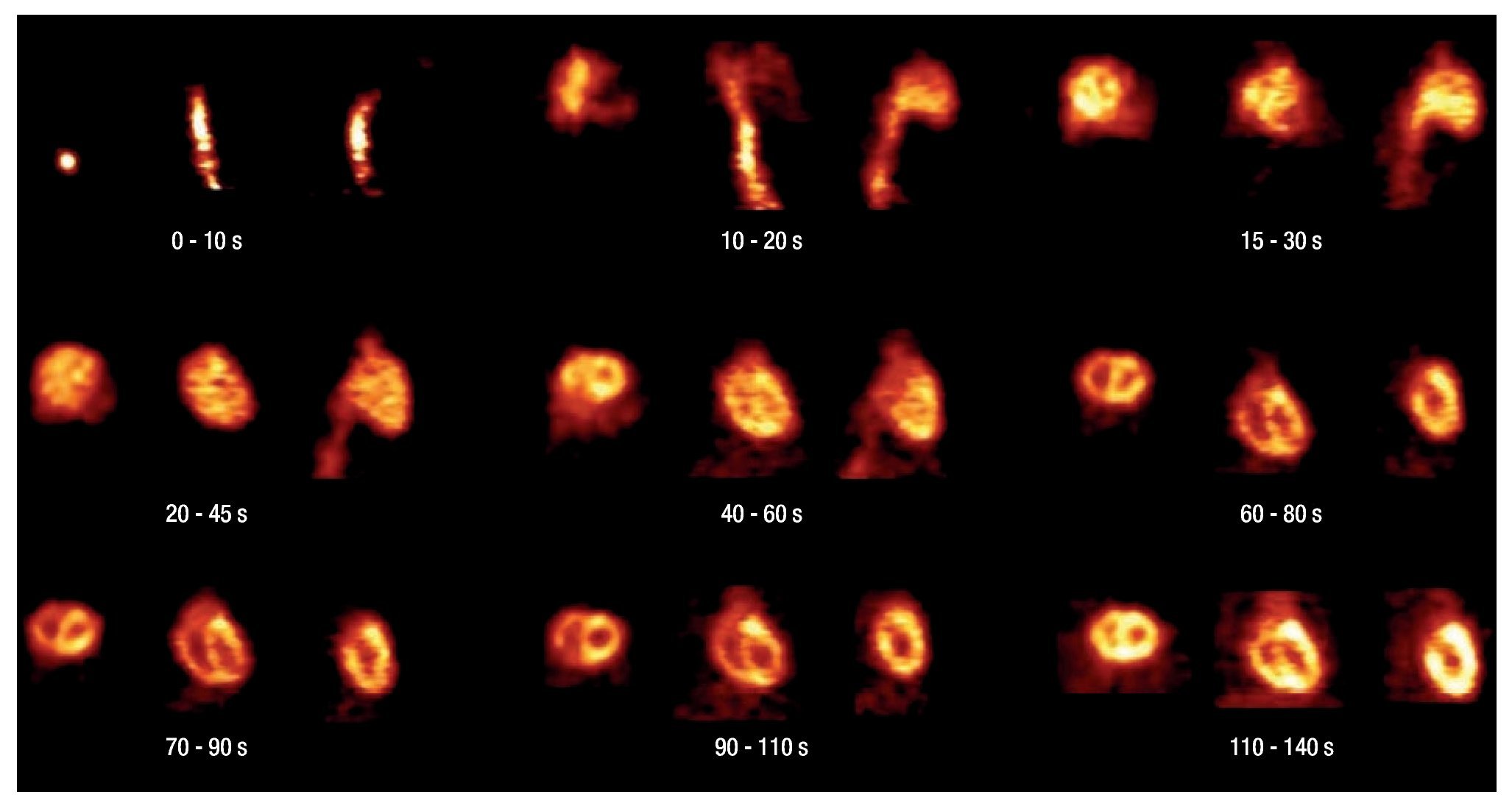
Para el caso de la adquisición dinámica, se administró igual cantidad de radiotrazador vía intravenosa, se adquirió el estudio durante los 30 minutos inmediatos a la administración, con la siguiente secuencia: 24 imágenes X 5 s; 15 imágenes X 20 s; siete imágenes X 40 s; cinco imágenes X 96 s; cuatro imágenes X 150s.
13NH3
Se adquirieron 10 rastreos estáticos de 15 minutos tras la administración intravenosa de 370 - 555 MBq de 13NH3
El estudio de metabolismo glucolítico con 18F-FDG se llevó a cabo con los animales bajo condiciones de anestesia a dosis de 50 mg/Kg de pentobarbital vía intraperitoneal. En el resto de los estudios se utilizó isofluorano como anestésico a dosis de inducción de 4% y 1.5% a 2% de mantenimiento durante la realización de los estudios.
Los animales se colocaron en posición supina con fijación externa de las cuatro extremidades. La cama fue centrada a la altura del corazón para obtener imágenes de tórax utilizando un apuntador láser. Se registró constantemente la frecuencia respiratoria y se monitoreó el estado anestésico durante el periodo de adquisición.
Se utilizó un equipo microPET Focus 120 de tipo Concorde Microsystems LLC (SIEMENES Inc, Knoxville, TN) para la adquisición de las imágenes. El microPET cuenta con un anillo detector de 17.2 cm de diámetro, con un campo de visión (FOV, por sus siglas en inglés) transaxial de 112 mm y 18 mm en el eje axial. El equipo se encuentra conformado por un total de 13 384 cristales detectores de LSO (Ortosilicato de Lutecio) de 1.5 mm por 1.5 mm por 1.0 mm cada uno. La resolución intrínseca de los cristales en promedio es de 1.68 mm, con una resolución energética entre el 15% y 25% y un tiempo de resolución de 2.4 ns (nanosegundos) para fotones de 511 keV. Este equipo opera en modo 3D. La resolución espacial del equipo es de 0.5 a 1.3 mm al centro de la cama para imágenes reconstruidas y su resolución volumétrica es de 8 mm3, el pico absoluto de sensibilidad es de 7.1%. La tasa de conteo está en el orden de las 800 kcps (kilocuentas por segundo) a una dosis de 88 MBq de radiotrazador. 54,55 La reconstrucción de las imágenes se realizó con el algoritmo FBP utilizando un filtro de Rampa. Se obtuvieron imágenes en cortes axial, coronal y sagital en todos los estudios.
Análisis
En el caso de los estudios con 18F-FDG, se realizaron dos tipos análisis: cualitativo y semi-cuantitativo. El análisis cualitativo se realizó por dos médicos con el fin de evaluar la calidad de las imágenes, comparando los dos tiempos de adquisición (30 o 60 minutos) y determinar así el más conveniente para el análisis de metabolismo miocárdico de la 18F-FDG.
Para el análisis semi-cuantitativo se realizó el renderizado volumétrico de todos los estudios (reconstrucción tridimensional de las imágenes) utilizando el programa AMIDE.56 Se determinaron tres ROIs (regiones de interés, por sus siglas en inglés) igualmente volumétricos (esferas 3D de 1900 voxeles en promedio, lo que se traduce en 904 mm3 en promedio por cada ROI)
Las regiones de interés seleccionadas fueron: corazón, pulmón y músculo esquelético.
Se determinó al tejido pulmonar como región de interés importante para la valoración visual. Ya que es el órgano contiguo al corazón, el contraste entre estos dos tipos de tejido debe ser elevado para permitir una correcta definición de la silueta cardiaca.
Se determinó al músculo esquelético (bíceps derecho) como región de interés para evaluar la competencia por el sustrato energético, en este caso 18F-FDG mediante la variación del aporte alimenticio de cada grupo.
Se obtuvieron los valores estandarizados de captación (SUVs por sus siglas en inglés, standardized uptake value) de los tres ROIs de cada estudio (90 en total), de los cuales se extrajeron los siguientes valores: mediana, media, varianza, desviación estándar, rango, tamaño en voxeles y en mm. Con los valores medios de radiactividad se realizó el cálculo de distribución con base en los distintos grupos. Derivados de dichos SUVs se calcularon porcentajes de captación de los diferentes ROIs de cada sujeto experimental, así mismo se calcularon contrastes: Contraste visual, definido como la relación entre el valor promedio de la región correspondiente al tejido miocárdico y al tejido pulmonar; y contraste metabólico-visual correspondiente a la relación entre el valor estandarizado de captación del músculo cardiaco y el músculo esquelético.
Se realizó análisis estadístico con los valores medios de radiactividad en SUVs utilizando el programa SPSS.
Los estudios con 1-11C-acetato y 13NH3 se analizaron cualitativamente por dos médicos para determinar la calidad de las imágenes.
Resultados
18F-FDG
Análisis cualitativo
Comparación por tiempos de distribución del radiotrazador
Se obtuvo una mejor definición del área miocárdica en la imagen de 60 minutos en la mayoría de los casos. Especialmente para las imágenes de los protocolos uno y tres; ya que en la imagen de 30 minutos aún se encuentra parte del radiotrazador por circulación sistémica, dando como resultado cierta distribución de la 18F-FDG en tejidos blandos como son grasa parda, músculos torácicos (paravertebrales e intercostales), mediastino y área pulmonar; en la imagen de 60 minutos dicha captación disminuye lo que permite mayor definición de las paredes ventriculares para su adecuada valoración.
Comparación de las imágenes por tipo de protocolo
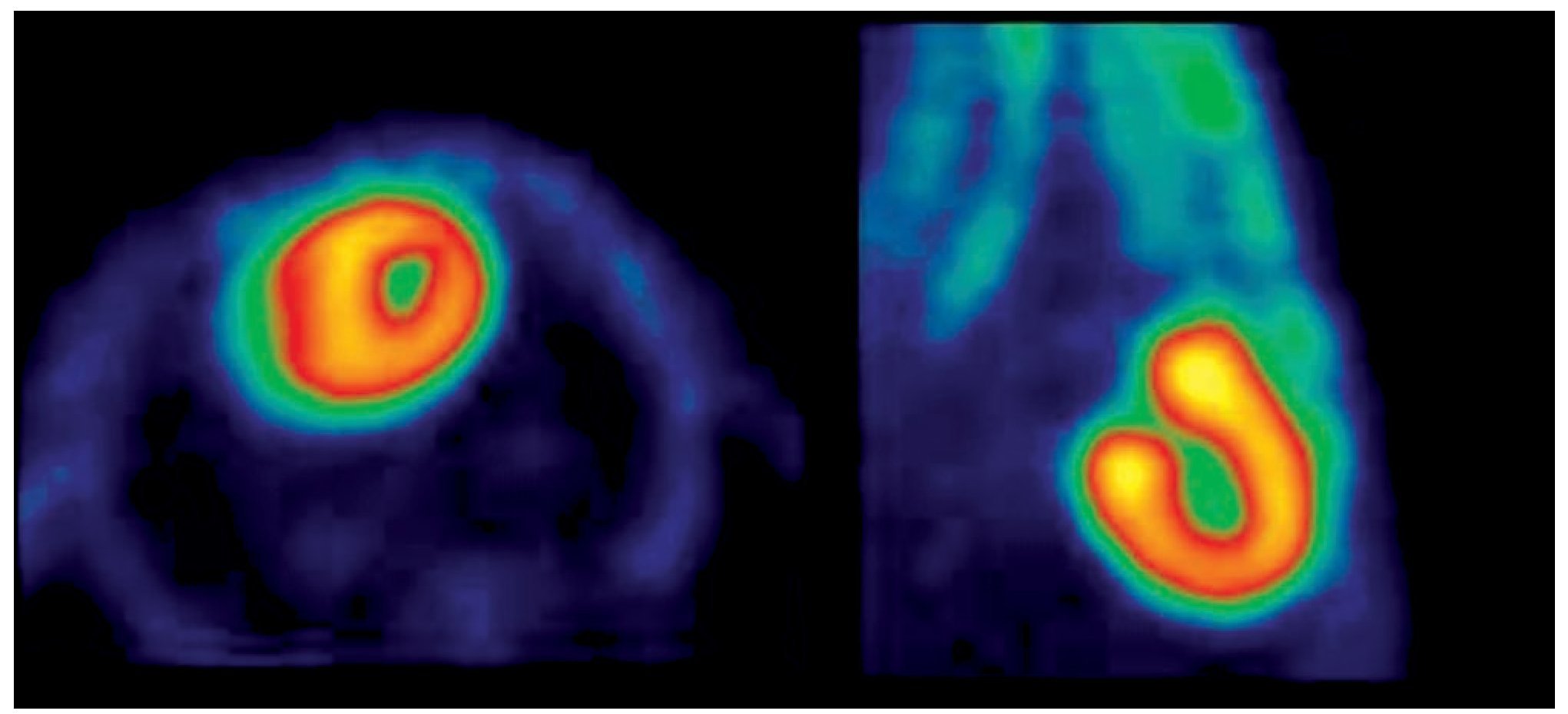
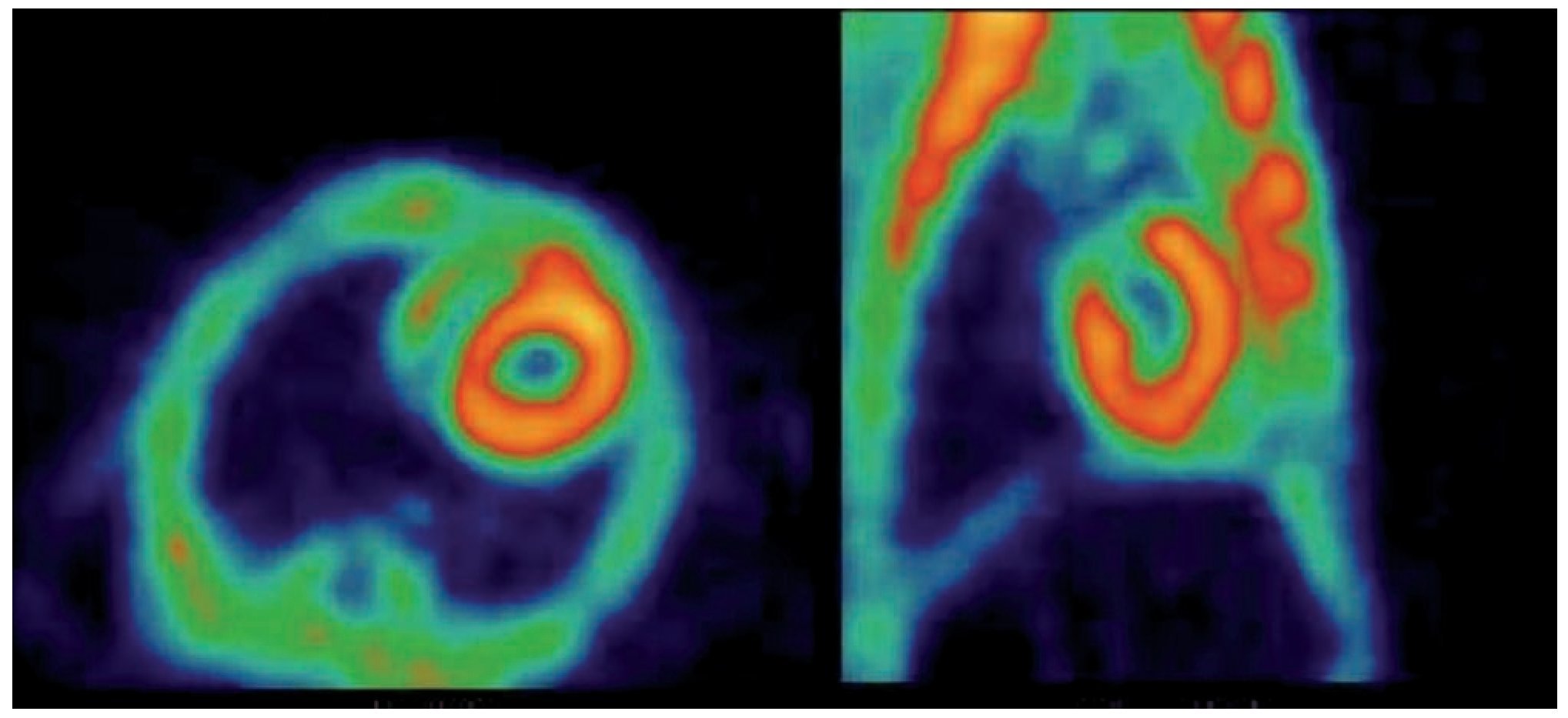
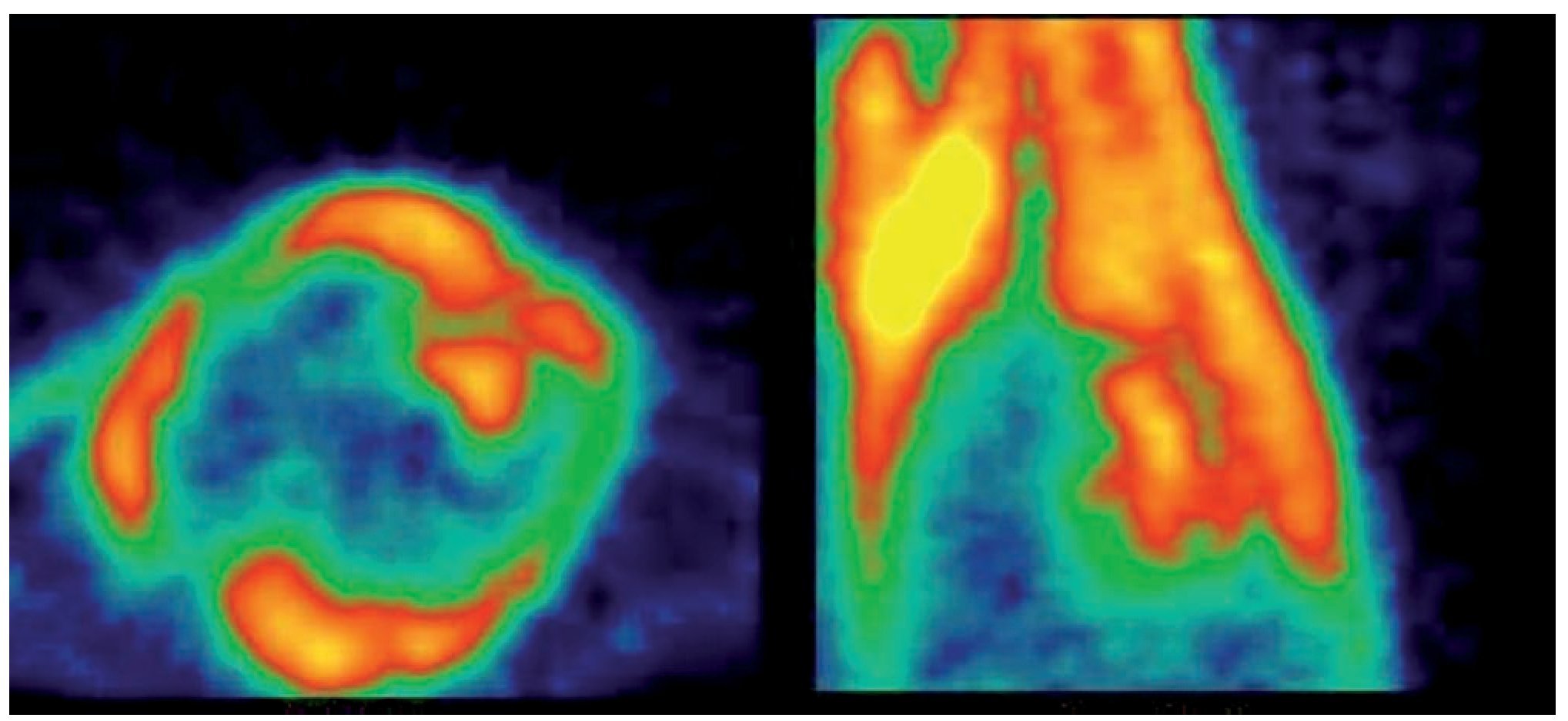
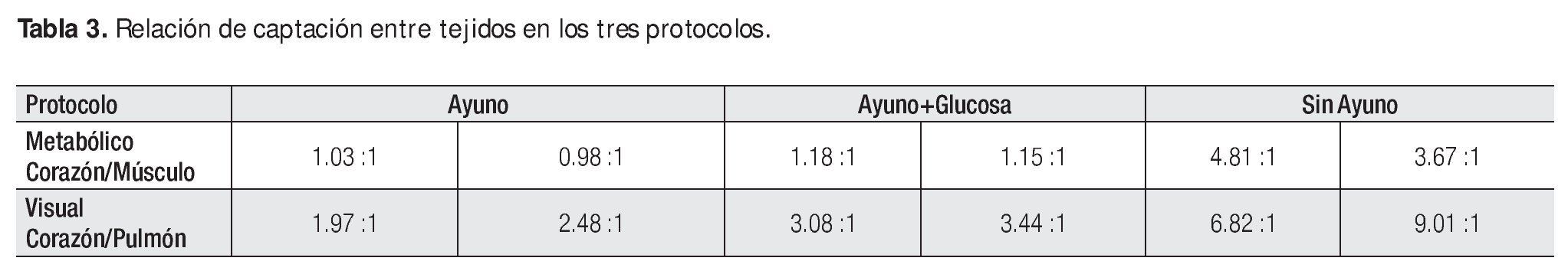
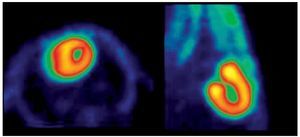
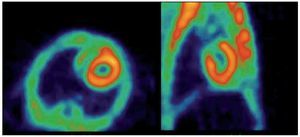
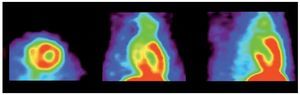
Con el protocolo uno se obtuvieron las imágenes de mayor captación y definición de las paredes ventriculares izquierdas, especialmente con la imagen de 60 minutos. Se puede definir perfectamente el ventrícuclo izquierdo, parte del ventrículo derecho, con escasa captación del radiotrazador por tejidos blandos del tórax (Figura 1). La calidad de imagen observada en el protocolo sin ayuno se obtuvo sólo en 60% de las imágenes del protocolo tres (ayuno con carga de glucosa oral) pues en el resto, el grado de captación miocárdica fue menor, con distribución de la 18F-FDG de manera importante a nivel muscular y grasa parda (Figura 2). En el caso de las imágenes del protocolo con ayuno, la captación del radiotrazador tanto por miocardio como en tejidos blandos del tórax es casi nula, lo que impide definir completamente la silueta cardiaca en muchos casos (Figura 3).
Figura 1. Rata sin ayuno. (1) Adquisición a los 60 min post-administración de 18F-FDG. Izquierda: Corte Axial. Derecha: Corte Sagital.
Figura 2. Rata con ayuno + glucosa oral. (3) Adquisición a los 60 min post-administración de 18F-FDG. Izquierda: Corte Axial. Derecha: Corte Sagital.
Figura 3. Rata sin ayuno. (2) Adquisición a los 60 min post-administración de 18F-FDG. Izquierda: Corte Axial. Derecha: Corte Sagital.
Análisis semi-cuantitativo
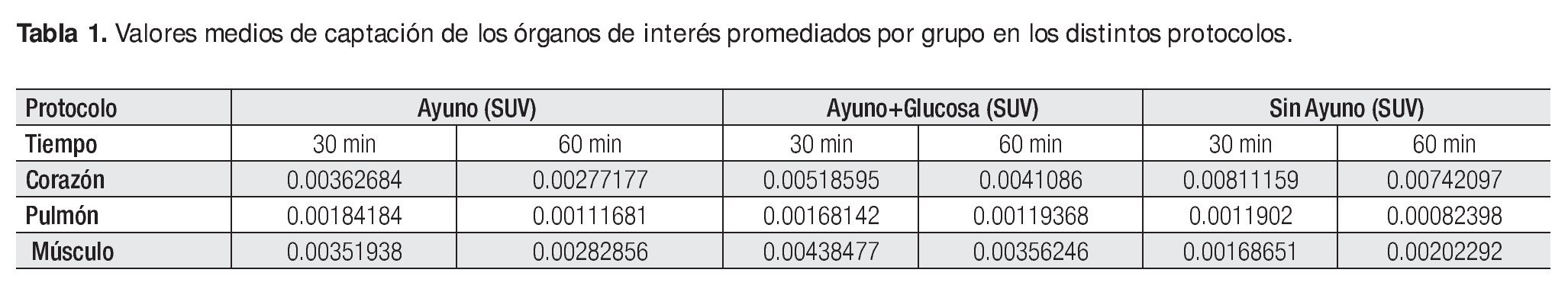
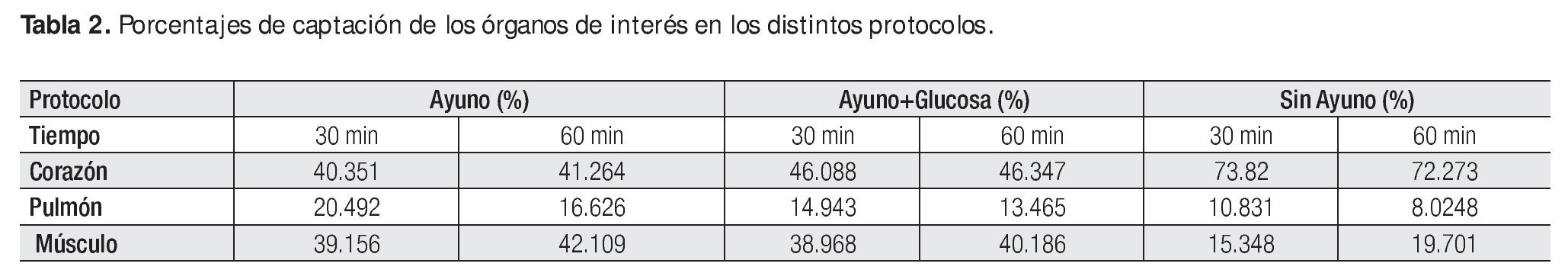
Se obtuvieron 90 ROIs correspondientes a tejidos miocárdico, pulmonar y músculo esquelético; de los cinco animales, en cada uno de los tres protocolos y los dos tiempos de adquisición (Tablas 1, 2 y 3).
Para el caso del contraste visual, es decir la relación entre la captación de 18F-FDG en tejido miocárdico vs tejido pulmonar del protocolo de ayuno se encontró entre 2 y 2.5:1. Para el protocolo de ayuno + glucosa, el contraste resultó cercano a 3 y 3.5:1 a los 30 y 60 minutos respectivamente. El mayor contraste visual se encontró en el protocolo sin ayuno, 6.8:1 en el periodo de 30 minutos de biodistribución y 9:1 a los 60 minutos post administración. Estas cifras concuerdan con la calidad de imágenes obtenidas para la evaluación cualitativa, misma que se realizó sin problemas al definir la silueta cardiaca en todos los casos del protocolo uno.
A la relación entre la captación del radiotrazador por músculo cardiaco y la captación en músculo esquelético se le denominó contraste metabólico-visual. Dicho contraste es el resultado de la distribución de glucosa radiomarcada. Es dependiente de los requerimientos energéticos de los tejidos a evaluar, en este caso músculo cardiaco y esquelético. Tanto en el protocolo de ayuno como en el de ayuno + glucosa, esta proporción de captación se encontró muy cercana a una relación 1:1 bajo los dos periodos de biodistribución evaluados, es decir; la 18F-FDG se concentró casi en la misma cantidad en el músculo cardiaco que en el músculo esquelético, lo que dificultó su evaluación debido al bajo contraste. En cambio, en el protocolo uno la relación de actividad registrada en el miocardio fue en promedio 4.25 veces mayor que en el músculo esquelético, lo que se traduce en un alto contraste metabólico-visual que permitió una adecuada valoración del tejido miocárdico.
El protocolo sin ayuno presentó en ambos tipos de contraste valores muy superiores a los obtenidos con los otros dos protocolos. Después de 30 minutos de biodistribución se alcanzó el mayor contraste metabólico-visual (4.81:1) y 1 hora post-inyección se presentó el mayor contraste visual (9.01:1). Por lo que el protocolo sin ayuno resultó el más adecuado para la definición de las paredes ventriculares mediante la evaluación del metabolismo glucolítico cardiaco.
Tras el análisis de varianza no se encontraron diferencias estadísticamente significativas entre tejido pulmonar y muscular; se encontraron diferencias (p < 0.05) entre corazón y los tejidos de comparación mediante análisis de Tukey.
Mediante análisis de varianza no se encontraron diferencias estadísticamente significativas entre los protocolos de ayuno y ayuno + glucosa; se encontraron diferencias (p < 0.05) entre el protocolo sin ayuno y los otros dos al realizar análisis de Tukey.
1-11C-acetato
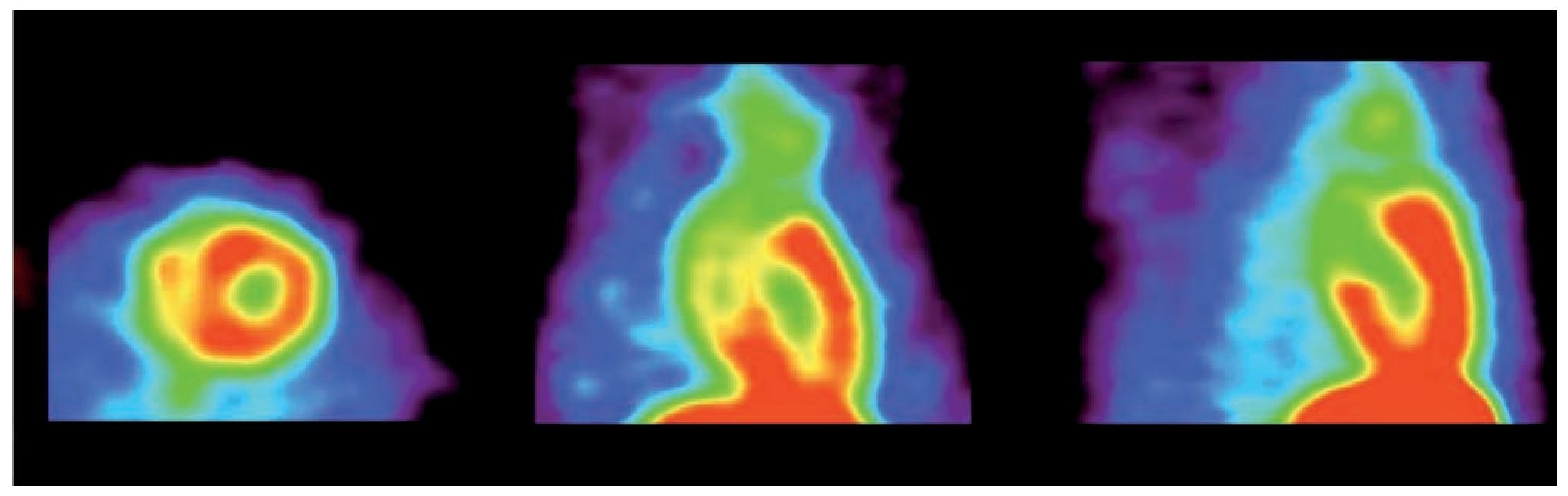
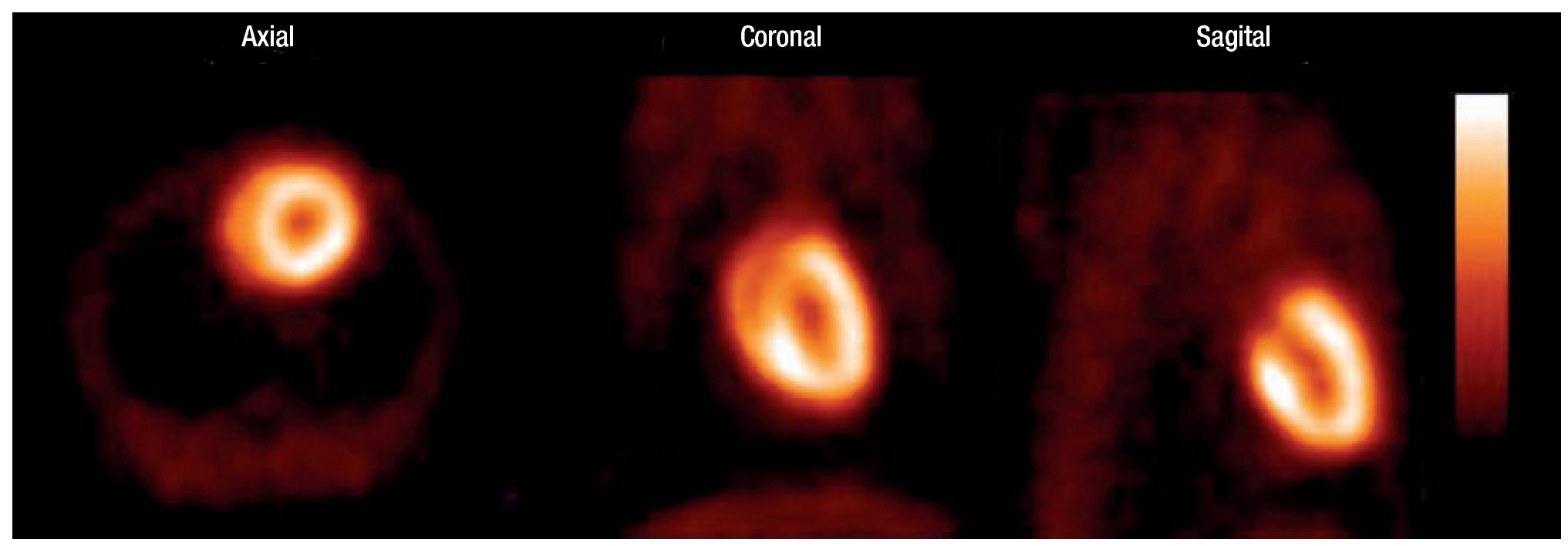
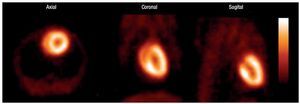
En las imágenes de los estudios estáticos fue posible definir sin dificultad la silueta cardiaca, lo que permite evaluar visualmente el metabolismo oxidativo del tejido miocárdico de la rata (Figura 4).
Figura 4. Imagen estática. 30 min. post-administración de 1-11C-acetato. De izquierda a derecha: cortes axial coronal y sagital.
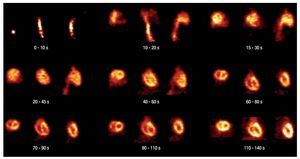
Mediante la adquisición dinámica, se puede apreciar la perfusión miocárdica, se distingue con claridad el trayecto del radiotrazador, es posible definir la vena cava, el paso inicial a través de corazón derecho y evaluar con detalle el área ventricular izquierda (Figura 5).
Figura 5. Rata. Imagen dinámica de 1-11C-acetato.
13NH3
Las imágenes permitieron observar una distribución homogénea del radiotrazador en los diferentes segmentos del ventrículo izquierdo en el eje corto, eje largo vertical y eje largo horizontal (Figura 6).
Figura 6. Rata Imagen estática. 15 min post-administración de 13NH3
Discusión
El objetivo principal de la imagen molecular mediante PET desarrollada en animales de experimentación como modelos de enfermedad es obtener información anatómica, fisiológica o bioquímica la cual comparte mucha similitud a la obtenida en los humanos; facilitando con esto, la correlación de los hallazgos obtenidos entre el área básica y la clínica. Además, la capacidad no invasiva de esta técnica de imagen permite múltiples adquisiciones de un proceso en particular, facilitando así el estudio a través del tiempo de la progresión de la enfermedad o bien, de la respuesta terapéutica en el mismo animal. Así pues, la fisiopatología de la cardiopatía isquémica se ha trasladado al área de la investigación básica no sólo in vitro, sino también in vivo, donde resulta más factible la realización de investigaciones para la intervención temprana del evento isquémico con resultados favorables.57-59
Como es sabido en condiciones normales, el flujo coronario aporta la suficiente cantidad de sustratos y oxígeno para los requerimientos de energía necesarios, cumpliendo así el adecuado funcionamiento y excreción celular. Cuando aumenta la demanda miocárdica, el flujo coronario puede llegar a aumentar entre cuatro a seis veces, gracias a la vasodilatación secundaria a múltiples respuestas en el organismo: en condiciones no patológicas se puede mencionar el ejercicio físico, como ejemplo. El aumento se presenta de manera uniforme en los diferentes vasos coronarios y dicha capacidad de respuesta se denomina reserva funcional o reserva de flujo coronario. 60,61
En condiciones fisiológicas, los metabolitos llegan por la microcirculación y son extraídos por los miocitos mediante diversos mecanismos, incluyendo procesos pasivos o por medio de transporte activo. El miocardio normal utiliza un 80% aproximadamente de ácidos grasos de cadena larga como fuente de energía, la glucosa es un sustrato adicional en estas circunstancias.62 En algunas ocasiones, el lactato puede llegar a ser fuente de energía. Estos metabolitos son metabolizados en el Ciclo de Krebs, obteniendo así ATP, H2O y CO2.63
La cantidad y la calidad del aporte de substratos cardiacos están determinadas por el estado dietético y la actividad física del organismo en conjunto. Los ácidos grasos de cadena larga son el principal substrato para el corazón. Durante el ayuno, los ácidos grasos y los triglicéridos son liberados del tejido adiposo incorporándose a la circulación. Los ácidos grasos son incorporados al miocito cardiaco para ser degradados a acetil-CoA. La oxidación de acetil-CoA comienza con la formación de citrato, el primer intermediario del ciclo de ácido cítrico. Mediante un mecanismo de retroalimentación alostérica, el citrato inhibe la glucólisis a nivel de la fosfofructinasa.64 La inhibición del metabolismo glucolítico por parte de la oxidación de ácidos grasos se caracterizó inicialmente en corazones perfundidos11 y posteriormente in vivo.65 Los ácidos grasos inhiben la oxidación de glucosa más que a la glucólisis y a la glucólisis más que a la captación de glucosa.66,67 La glucosa es el principal sustrato metabólico en el corazón cuando el nivel de ácidos grasos es bajo y las concentraciones de glucosa e insulina altas, tal como ocurre en el posprandio.13 La glucosa disminuye la tasa de oxidación de ácidos grasos de cadena larga a nivel de la CPT-1.31 La utilización de otros sustratos como lactato y cuerpos cetónicos a nivel miocárdico, está en función de su concentración sanguínea.13
El adecuado acoplamiento entre trabajo cardiaco,flujo coronario, y oxidación de substratos constituye una característica central de la fisiología cardiaca.
Entendiendo este fenómeno fisiológico, se pueden explicar las características de las imágenes obtenidas en el protocolo uno y dos, respectivamente; pues con la administración a libre demanda de alimento, se presentó una mayor captación del radiotrazador por el miocardio desde las imágenes tempranas, permitiendo una mejor definición de las paredes ventriculares en las imágenes tardías, asociado con menor captación de la 18F-FDG por tejidos blandos. En el caso de las imágenes de ayuno, se puede explicar la dificultad para visualizar la silueta cardiaca, pues bajo esas condiciones, el mayor aporte metabólico a nivel miocárdico está dado por los ácidos grasos, por lo que la 18F-FDG administrada se distribuye preferentemente a órganos vitales como es el cerebro, que en condiciones de ayuno, requiere glucosa como principal sustrato energético.68
Únicamente en la mitad de las imágenes obtenidas en el protocolo tres se pudo valorar adecuadamente el corazón, dado que la absorción de la glucosa por vía oral puede variar de un animal a otro, además se deben tener en cuenta otros factores tales como la velocidad de absorción por la mucosa gástrica y duodenal, la velocidad de vaciamiento gástrico y el tránsito intestinal; lo que hace de esta técnica un método inespecífico con el cual se pueda lograr un estado metabólico ideal para la adecuada captación de la 18F-FDG por el miocardio.
La habilidad de combinar estudios de flujo-metabolismo usando un solo radiotrazador repercute de manera importante en la investigación de la isquemia miocárdica y la enfermedad arterial coronaria. El 1-11C-acetato tiene el potencial para caracterizar in vivo los mecanismos responsables de varias enfermedades cardiacas.
Después de la validación de los estudios iniciales con 1-11C-acetato para determinar el MVO2 en forma no invasiva, se han realizado varios estudios clínicos y experimentales orientados hacia la detección de estados de isquemia, aturdimiento e hibernación.29
El 1-11C-acetato es capaz de sustituir al 13N-amoniaco en la cuantificación de perfusión miocárdica mediante PET en toda la gama de variaciones fisiológicas de flujo. La posibilidad de cuantificar perfusión y consumo de oxígeno simultáneamente en un solo estudio con PET permite remplazar los protocolos actuales que utilizan dos radiotrazadores para la detección de miocardio viable.69
Se han realizado estudios con 1-11C-acetato para la evaluación de diferentes patologías cardiacas. Hicks y colaboradores evaluaron el aclaramiento del acetato en pacientes con estenosis aórtica, encontrándolo significaivamente superior en comparación a voluntarios sanos.70 Tadamura y colaboradores demostraron reducción en el aclaramiento del acetato en pacientes con cardiomiopatía hipertrófica no obstructiva al compararlo con sujetos sanos.71 Bengel y colaboradores determinaron una disminución en la eficiencia miocárdica en pacientes con cardiomiopatía dilatada utilizando acetato.72
La primera etapa en la utilización de microPET para estudiar modelos de enfermedades cardiacas en roedores, consiste en la validación de las técnicas y métodos de análisis utilizados.73 Una medición adecuada de la perfusión miocárdica es esencial para estudiar la fisiología y el metabolismo cardiacos. La determinación del metabolismo cardiaco requiere de mediciones precisas del flujo sanguíneo miocárdico. El microPET ha sido utilizado para obtener evaluaciones secuenciales de tasas metabólicas cardiacas en un mismo animal.59,74,75
La medición no invasiva de la perfusión miocárdica es primordial en la caracterización de los cambios de dicha perfusión, asociados a las distintas enfermedades cardiacas, al igual que la evaluación de las terapias diseñadas para mejorarla. El PET es utilizado ampliamente en investigación básica y clínica para cuantificar de forma no invasiva el flujo sanguíneo miocárdico usando varios trazadores, entre ellos: 13N-amoniaco, 1-11C-acetato, 82Rb y 15O-agua en conjunto con modelos cinéticos validados.30,53,73,76
Existe un amplio interés en trasladar estas metodologías a modelos animales de enfermedades cardiacas, para entender mejor cómo los mecanismos asociados a alteraciones metabólicas en patologías —tales como obesidad, diabetes, y miocardiopatías— contribuyen a las disfunciones cardíacas. Para lograr esta transición, es necesario validar con roedores y microPET, dichas metodologías utilizadas rutinariamente con PET en humanos.
Conclusiones
Este estudio permitió la estandarización de protocolos de adquisición de imágenes de los tres radiotrazadores principales utilizados en la práctica clínica para el estudio del metabolismo y perfusión cardiacos, en un modelo animal, utilizando un equipo PET especializado para tal efecto. Actualmente los resultados obtenidos en roedores permiten evaluar alteraciones tanto perfusorias como metabólicas a nivel miocárdico, jugando un importante papel en el estudio de múltiples estados patológicos y no patológicos, como son la edad, obesidad, hipertensión arterial, hipertrofia ventricular, diabetes, e infarto al miocardio, entre otros.
El diseño de un protocolo adecuado en investigación básica para el estudio de estos y otros estados patológicos es de suma importancia dado la trascendencia que puede tener en el entendimiento y por consiguiente la intervención terapéutica precoz en el área clínica.
El uso del microPET puede ser muy útil para el análisis molecular del metabolismo del corazón y permite generar un modelo auxiliar para el estudio de la cardiopatía isquémica.
El contar con un modelo animal, y métodos de obtención de imágenes moleculares que reflejen fielmente la fisiología normal del corazón, así como sus alteraciones, constituye un gran paso dentro de la investigación básica en el campo de la cardiología de nuestro país, colocándolo a la vanguardia de los países de Latinoamérica.
Correspondencia: Rafael Ojeda Flores.
Unidad PET/CT-Ciclotrón. Facultad de Medicina, UNAM. Edificio de Investigación PB. Ciudad Universitaria, Circuito Interior. CP. 04510, México, D.F.
Teléfono: +52 (55) 5623 2288 Fax: +52 (55) 5623 2115 Móvil: 55 1320 7039.
Correo electrónico:ojeda_rafael@yahoo.com.mx
Recibido el 2 de diciembre de 2009;
aceptado el 20 de septiembre de 2010.