Introducción
La Muerte súbita (MS) cardiaca de causa eléctrica constituye un gran conflicto clínico y de salud pública, que recibe especial atención de la comunidad cardiológica internacional. Recuérdese que la MS cardiaca representa 90% de todas las MS, que 50% de las muertes cardiovasculares son súbitas, y que 80% a 85% de las cardiacas se deben a arritmias ventriculares malignas, 40% a 60% de las cuales recurren. Se presentan 3 millones de MS cardiacas al año, 300 000 en Estados Unidos de América, y aunque se ha logrado una disminución de la muerte cardiaca total, no ha sucedido lo mismo con la súbita y no se espera que disminuya mucho más. Sólo 10% de estos pacientes tiene perfil de alto riesgo antes del evento fatal; en 40% no hay testigos, 80% ocurren en el hogar y más de la mitad de las víctimas ignora tener problema cardiológico. Sólo de 5% a 20% se recuperan del paro cardiaco extrahospitalario al lograrse una reanimación exitosa.
Se trata de precisar su epidemiología, sus mecanismos fisiopatológicos, los factores disparadores, estratificar riesgos, caracterizar las arritmias responsables del evento y los factores anteriores que lo propician, para después tomar las distintas medidas terapéuticas que eviten recurrencias e identificar, dentro de la población de bajo riesgo, los posibles candidatos de alto riesgo.1-6
A pesar de los estudios multicéntricos y multinacionales de los programas comunitarios, de la integralidad entre muchas esferas y de los avances en los distintos terrenos, que permiten entender mejor su epidemiología, etiología, clínica e historia natural, se está lejos de prevenir y predecir quienes están en riesgo de un evento de muerte súbita. La estratificación de riesgo es muy difícil, y a veces imposible, por el pobre valor predictivo de los métodos diagnósticos invasivos y no invasivos. Ello resultaría fundamental para los sujetos en quienes el evento es el debut, por el elevado número de recurrencias de eventos arrítmicos malignos en quienes ya lo hicieron y por el bajo número de sujetos reanimados.1-6
Se presenta un paciente con un evento de MS domiciliaria, sin testigos, excepto el equipo de registro Holter que portaba.
Presentación de caso
Se trata de un hombre, de 76 años de edad, conocido en una primera consulta médica de cardiología, a la que asistió por haber presentado un episodio sincopal tiempo antes, con recuperación espontánea. Antecedentes familiares sin importancia, no recibía medicamentos ni fármacos antiarrítmicos. Se ordenaron algunos estudios con objeto de precisar la causa del episodio sincopal, entre ellos ecocardiograma (no llegó a realizarse) y registro electrocardiográfico de 24 horas, Holter. Paciente sin síntomas previos en los días anteriores a su consulta. Se planeó su ingreso para realizar una estimulación eléctrica programada. Al examen físico, como dato positivo, se auscultó soplo sistólico II/VI en foco mitral. En el electrocardiograma, bloqueo de rama izquierda del haz de His. Al siguiente día se colocó el equipo de registro, que grabó 24 horas. La familia encontró fallecido al paciente en una habitación de su domicilio, sin testigos, excepto el equipo Holter.
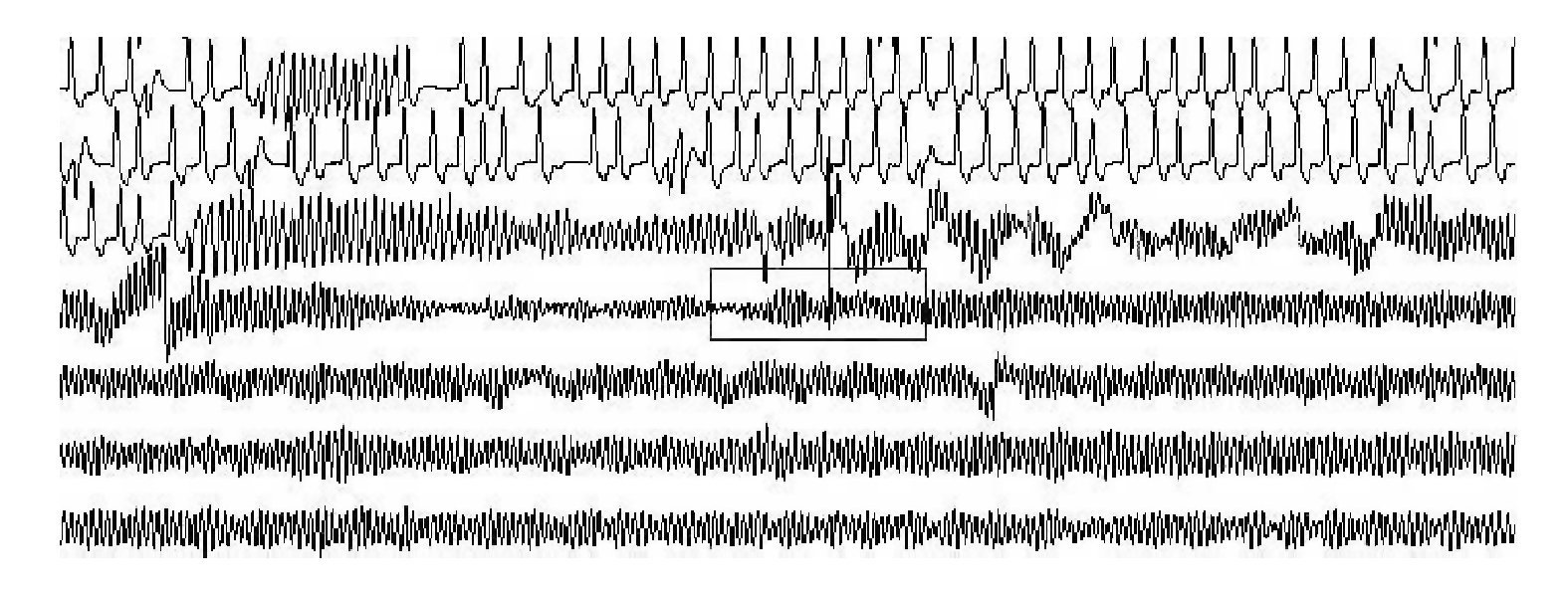
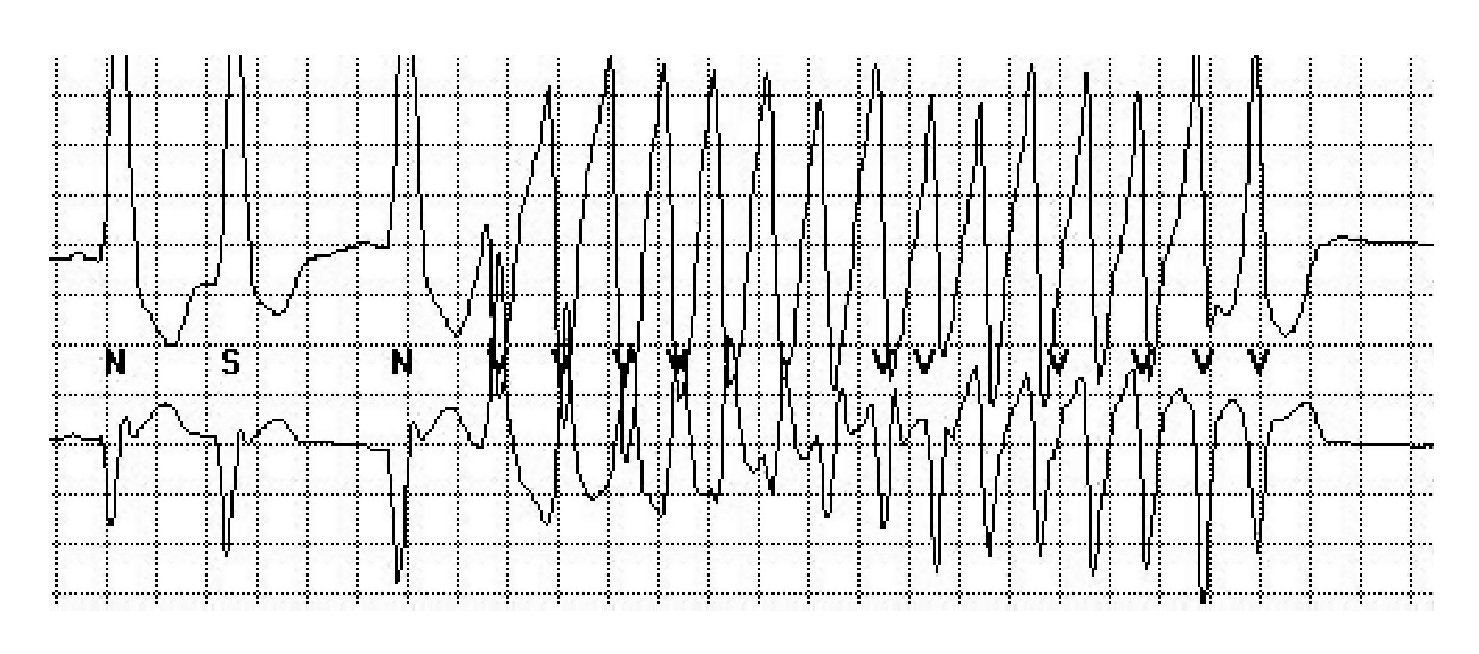
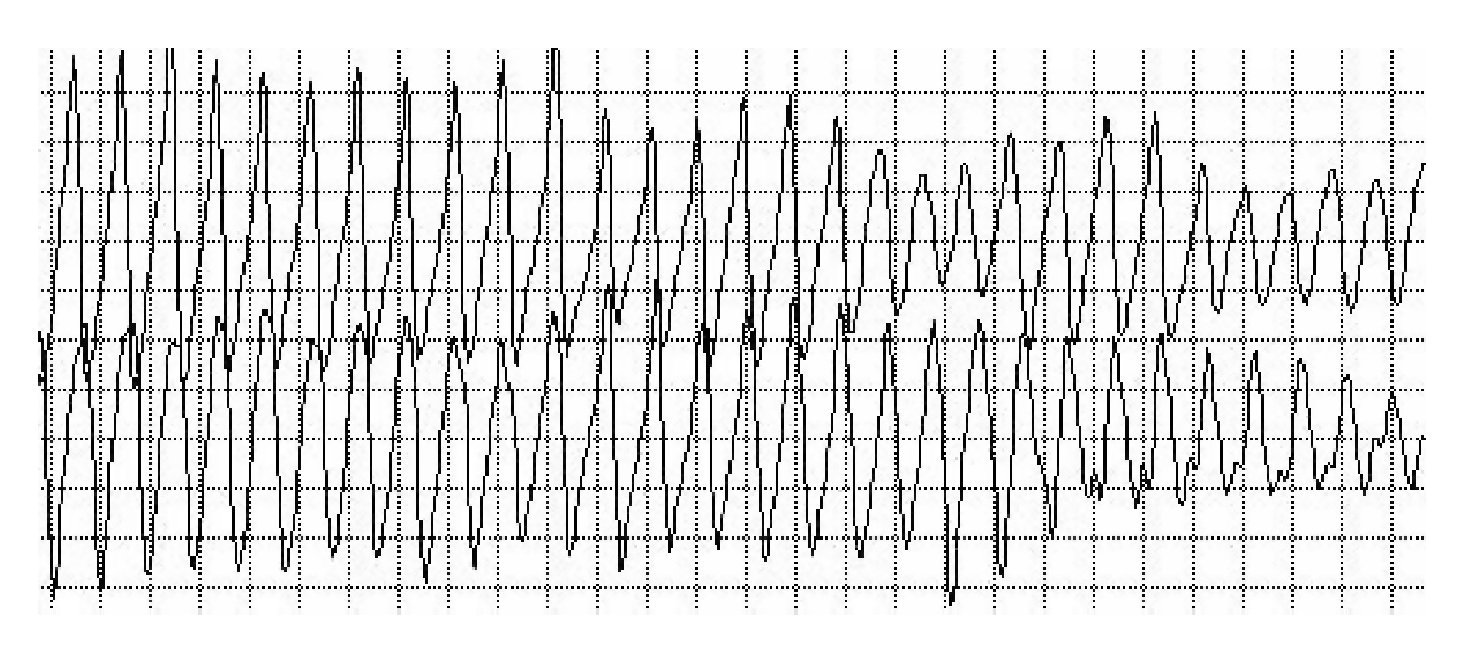
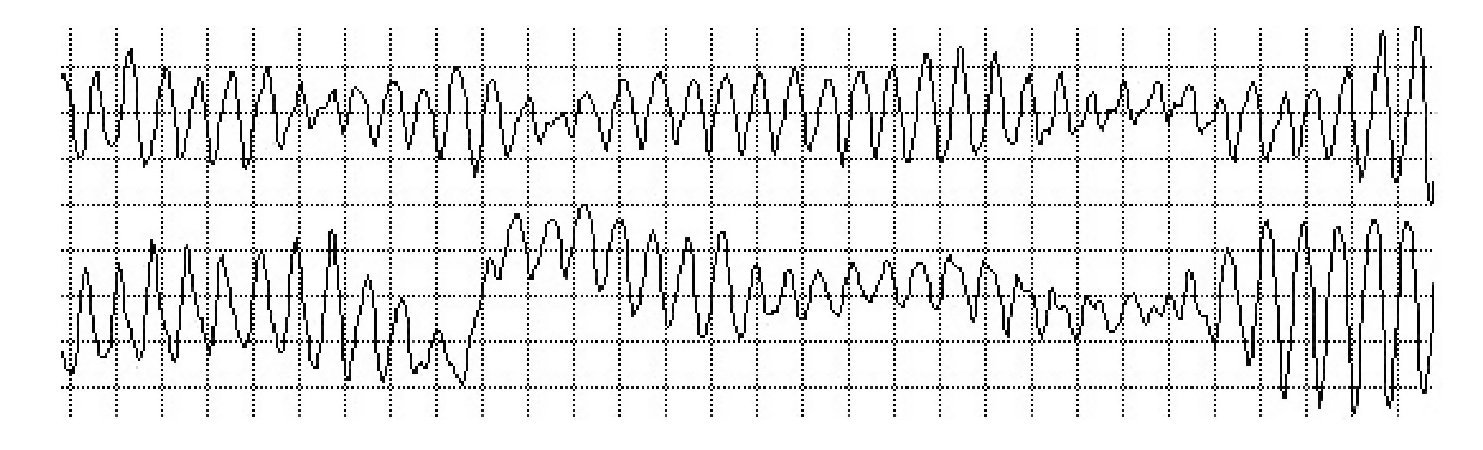
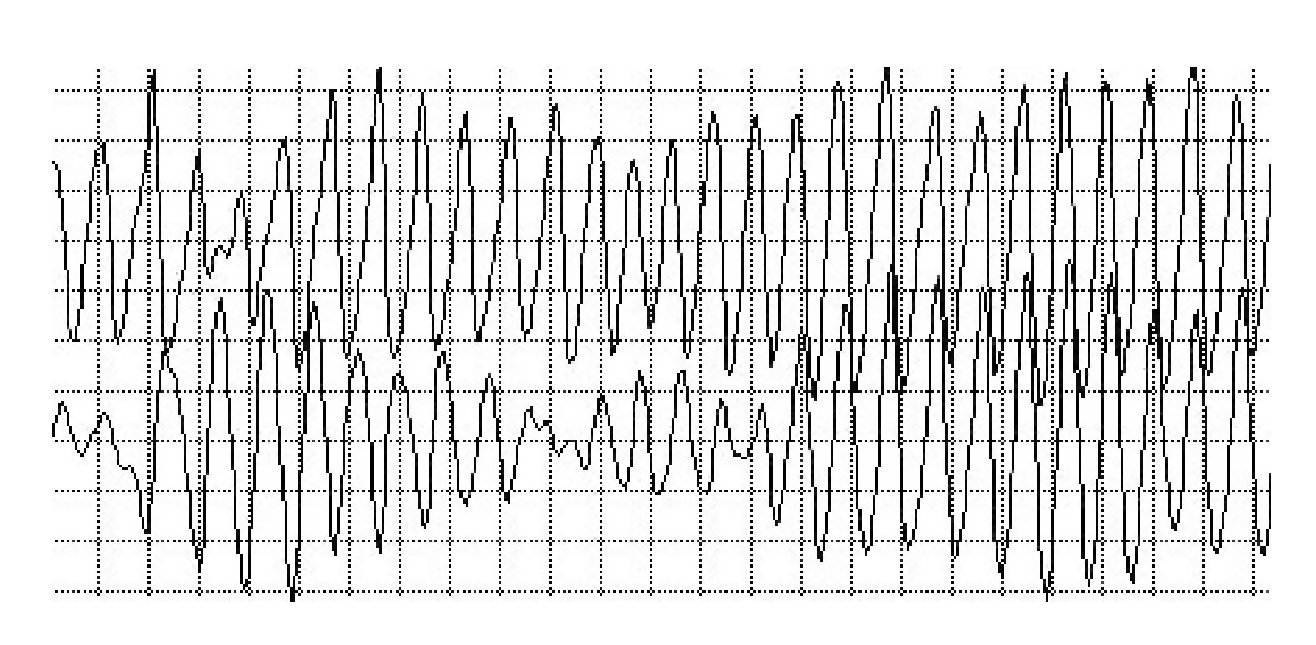
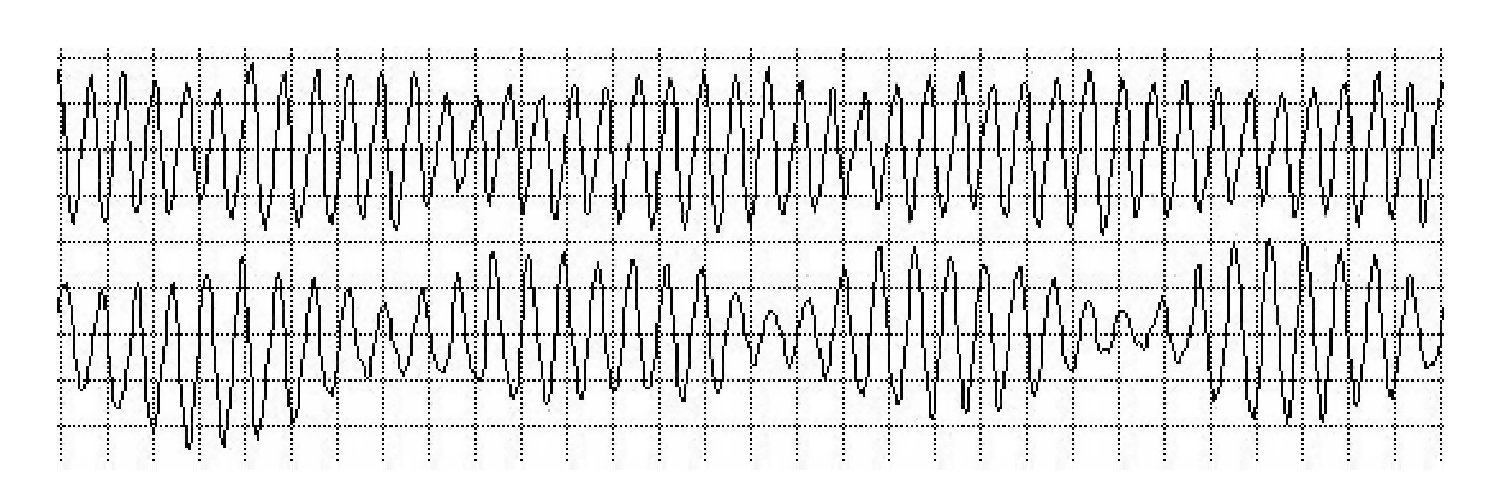
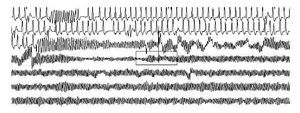
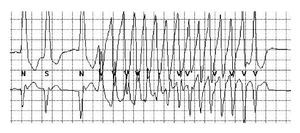
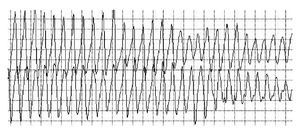
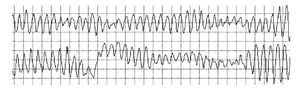
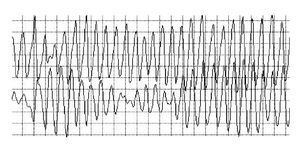
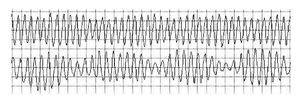
La lectura del registro indicó: en las primeras horas sólo se observaba el bloqueo de rama izquierda visto en el electrocardiograma de la consulta; frecuencias cardiacas sinusales con tendencia a ser elevadas, 95 latidos por minuto; presencia de extrasístoles auriculares y algunas ventriculares. A las 19:35 horas se observó un breve episodio autolimitado de torsión de puntas (Figuras 1A y 1B), seguido de ritmo sinusal y, poco después, rachas de flutter y fibrilación ventriculares (FV) (Figuras 2A y 2B), esta última de muy diversas características electrocardiográficas (Figuras 3A y 3B). Las arritmias ventriculares malignas duraron 25 minutos, hasta su muerte.
Figura 1A Registro condensado. Bloqueo de rama izquierda. Se observa un evento autolimitado de torsión de puntas. Extrasístoles supraventriculares y ventriculares muy precoces (una pareja), frecuencia cardiaca basal sinusal, pero con tendencia a ser alta. Después, fibrilación ventricular de larga duración y cambios en sus modelos electrocardiográficos, que muestran mayor y menor grado de desorganización
Figura 1B Acercamiento del trazado anterior, primer episodio. El trazado muestra ritmo sinusal, con morfología de bloqueo de rama izquierda, una extrasístole supraventricular y episodio autolimitado de torsión de puntas
Figura 2AFlutter ventricular que degenera en fibrilación ventricular
Figura 2B Fibrilación ventricular con alto grado de desorganización
Figura 3A Fibrilación ventricular con menor desorganización de las ondas
Figura 3B Fibrilación ventricular con repeticiones y periodicidad de las ondas, lo que se traduce en menor grado de desorganización
Discusión
En nuestro servicio se implantan aproximadamente 750 dispositivos electrocardiográficos ambulatorios de larga duración por año, desde hace más de 20 años. Esta es la primera vez en la cual un paciente fallece con el equipo Holter colocado. Como antecedente de interés, un episodio sincopal con recuperación espontánea tiempo antes y la presencia de un trastorno de conducción intraventricular ya existente (bloqueo de rama izquierda), como se sabe uno de los predictores de riesgo. Su evento mayor fue precedido por algunos factores premonitorios y disparadores de eventos arrítmicos, frecuencias alrededor de 95 por minuto y algunas extrasístoles precoces, sin cambios de la repolarización ventricular. Se carece de algunos datos que serían importantes, puesto que el paciente empezaba a atenderse y sus estudios paraclínicos apenas se iniciaban.
Por otra parte, el tiempo transcurrido, 25 minutos con arritmias ventriculares malignas (torsión de puntas, flutter y FV), con el equipo como testigo inigualable, permite observar los variados modelos electrocardiográficos de sus arritmias malignas. Por ejemplo, las variedades eléctricas de la FV, con formas desorganizadas y otras tendientes a la repetición, periodicidad y menor desorganización.
En trabajos anteriores se han presentado series de pacientes con episodios de muerte mientras portaban un equipo Holter, oportunidad de excepción para entender estos fenómenos. Las arritmias que provocaron el evento fueron: taquicardia ventricular monomorfa y polimórfica, flutter ventricular, torsión de puntas, FV. A veces se encontraron elementos que precedían o precipitaban estas arritmias ventriculares malignas, tales como extrasístoles ventriculares con acoplamiento corto o largo, complejidad de la ectopia, frecuencia cardiaca alta o baja, trastornos de la repolarización ventricular, alteraciones electrolíticas, empleo de fármacos antiarrítmicos, rachas de taquicardia ventricular, intervalo QT largo, fibrilación auricular; en ocasiones no se presentaban estos elementos. Se trataba de pacientes con cardiopatía isquémica, miocardiopatía o no se precisaba el diagnóstico.7-17
En realidad, la FV es una familia de arritmias; no existe un modelo único, sino que se encuentran diferencias electrocardiográficas, y electrofisiológicas; en sus mecanismos fisiopatológicos se dan modos de inicio y perpetuación, disparadores y necesidades terapéuticas. En ella existe caos y organización: de un mayor desorden puede pasar a uno menor con periodicidad espaciotemporal, repeticiones, regularidad y viceversa; de la coherencia a la incoherencia o en sentido inverso. Ello lleva a preguntarse ¿cuántos tipos de inestabilidades hay? Cada uno tiene su propia inestabilidad o varias de ellas. Existen diferentes tipos o combinaciones de inestabilidades. Un corazón no es exacto a otro; el mismo puede tener diferentes tipos de FV en diferentes tiempos o diversos tipos en distintas regiones al mismo tiempo. Uno puede preguntarse: por fin, ¿cuántos tipos de inestabilidades hay? Lo trascendente es establecer el número de inestabilidades clínicamente importantes, identificarlas, caracterizarlas y emprender las terapias preventivas en cada tipo.18-28
*Autor para correspondencia: Margarita Dorantes Sánchez.
17 # 702, Plaza, CP 10400, Ciudad de La Habana, Cuba.
Correo electrónico: dorantes@infomed.sld.cu
Recibido el 3 de marzo de 2008;
aceptado el 31 de octubre de 2008.