Introducción
Se considera a la tetralogía de Fallot con atresia pulmonar como la expresión patológica más severa de esta cardiopatía troncoconal.1-5 Esta malformación cardíaca extremadamente heterogénea se caracteriza por la ausencia de comunicación entre el ventrículo derecho y el tronco de la arteria pulmonar que es secundaria a una obstrucción total localizada a nivel del infundíbulo del ventrículo derecho y/o de la válvula pulmonar; existe además una comunicación interventricular infundibular posterior (subaórtica) con aorta que puede ser biventricular o nacer completamente del ventrículo derecho.
Esta cardiopatía ha recibido múltiples denominaciones: atresia pulmonar con comunicación interventricular,1-4 Fallot extremo,3 pseudotronco arterioso,6-8 atresia pulmonar con aorta biventricular,9 tronco aórtico solitario,10 tronco común tipo IV11 y única vía de salida con atresia pulmonar.12-18 Esta nomenclatura variada ha surgido de los diversos enfoques en el estudio de esta cardiopatía y sobre todo porque refleja la existencia de un amplio espectro anatómico que se caracteriza por la tendencia progresiva de la desaparición de la conexión vascular entre el ventrículo derecho y la circulación arterial intrapulmonar. En este trabajo se describe este espectro y se establecen los diferentes tipos de conexión ventrículoarterial que se presentan en esta malformación cardíaca; además se destaca la importancia de su anatomía quirúrgica, en particular las diferentes formas de la circulación arterial pulmonar que explican su fisiopatología y cuya determinación diagnóstica es de fundamental importancia para el tratamiento quirúrgico. De la variada nomenclatura se ha escogido el término de tetralogía de Fallot con atresia pulmonar19 ya que es más específico que el de atresia pulmonar con comunicación interventricular, término que puede aplicarse a otras cardiopatías diferentes a la del presente estudio.
El conocimiento del desarrollo embrionario de las conexiones del plexo arterial intrapulmonar con el infundíbulo del ventrículo derecho a través de la arteria pulmonar, de los sextos arcos aórticos y de las arterias postbranquiales por un lado y con la aorta descendente a través de las colaterales aortopulmonares por el otro, constituye la base fundamental para comprender las alteraciones de la circulación pulmonar que se presentan en esta cardiopatía.20-25 Los resultados de este trabajo son de utilidad para el clínico, el hemodinamista y el cirujano que deben conocer todas las variantes anatómicas en esta malformación congénita. Por otro lado se muestra la importancia que tiene el conocimiento embriológico para comprender la estructura anatómica de la misma que explica la fisiopatología y las peculiaridades del espectro patológico.
Métodos
Se estudiaron 35 corazones portadores de tetralogía de Fallot con atresia pulmonar de la colección patológica del departamento de embriología del Instituto Nacional de Cardiología Ignacio Chávez. Este material fue estudiado según los lineamientos metodológicos del sistema secuencial segmentario utilizado en el diagnóstico de las cardiopatías congénitas.12-18 El análisis morfológico comprendió las siguientes determinaciones: situs atrial, tipos y modos de conexión atrioventricular; en ambos ventrículos se describieron las porciones de entrada, trabecular y de salida; en el ventrículo derecho se determinó la posición del septum infundibular, la trabécula septomarginal y el pliegue infundíbulo-ventricular lo que permitió precisar los bordes de la comunicación interventricular y de sus extensiones. Se determinó el estado de la válvula pulmonar, se buscó la presencia de senos de Valsalva y de sigmoideas fusionadas; cuando no fue posible identificar estos elementos se consideró la válvula atrésica como tejido empastado. Se especificó el grado de cabalgamiento aórtico y la relación mitro-aórtica y tricúspide-aórtica. Si la aorta nacía en 50% de su área valvular a partir del ventrículo derecho, la conexión ventrículo arterial se consideró concordante y si dicho nacimiento ocurría en más de 50% sobre ese ventrículo se catalogó como doble salida de ventrículo derecho.26 En aquellos corazones en los que el tronco pulmonar estuvo representado por un cordón fibroso, el tipo de conexión ventrículoarterial se consideró concordante o doble vía de salida con modo imperforado según el grado de cabalgamiento aórtico. En los especímenes en los que se perdió la conexión entre el ventrículo derecho y las ramas de la arteria pulmonar la conexión ventrículoarterial se consideró como única vía de salida. Se determinaron las dimensiones del tronco y ramas de la arteria pulmonar, la existencia de confluencia de dichas ramas y la presencia de colaterales aortopulmonares. Se especificó el número y posición del conducto arterioso que fue correlacionado con el tipo de arco aórtico. Los especímenes que presentaron rasgos anatómicos comunes se agruparon en grados de severidad.
Resultados
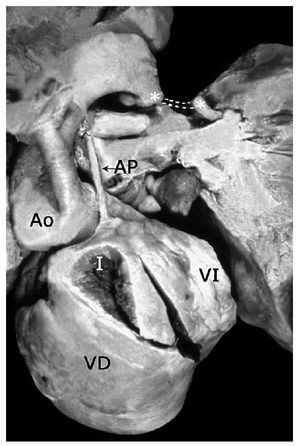
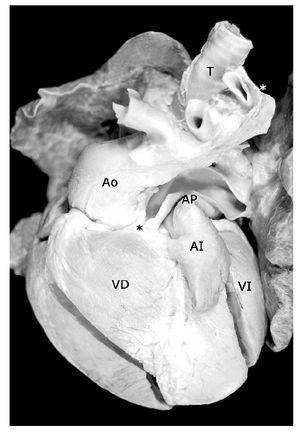
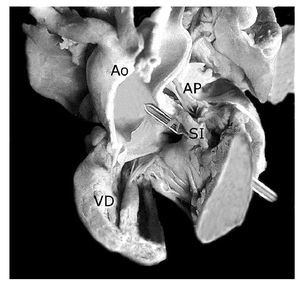
Los 35 especímenes estudiados tuvieron situs solitus atrial; 33 (94.28%) con conexión atrioventricular concordante (Figura 1), uno (2.86%) con doble entrada en ventrículo único y uno (2.86%) con ausencia de conexión atrioventricular derecha (Figura 2). La conexión ventrículoarterial fue concordante con modo imperforado en 17 (48.57%) (Figuras 3A, 4, y 5), doble salida de ventrículo derecho con modo imperforado en nueve (25.71%) (Figuras 1, 2, 6, 7 y 8) y única vía de salida de la variante de tronco aórtico solitario en nueve (25.71%) (Figura 9).
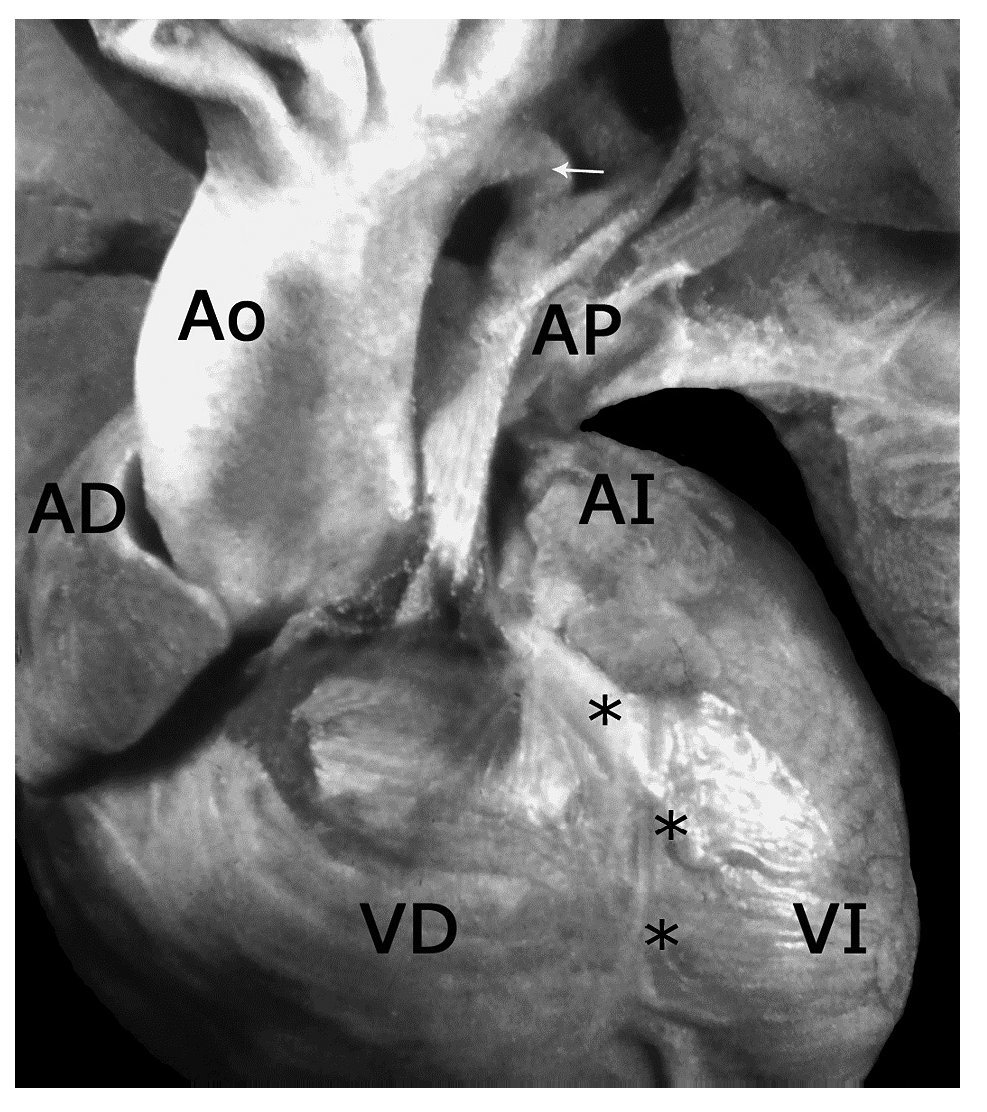
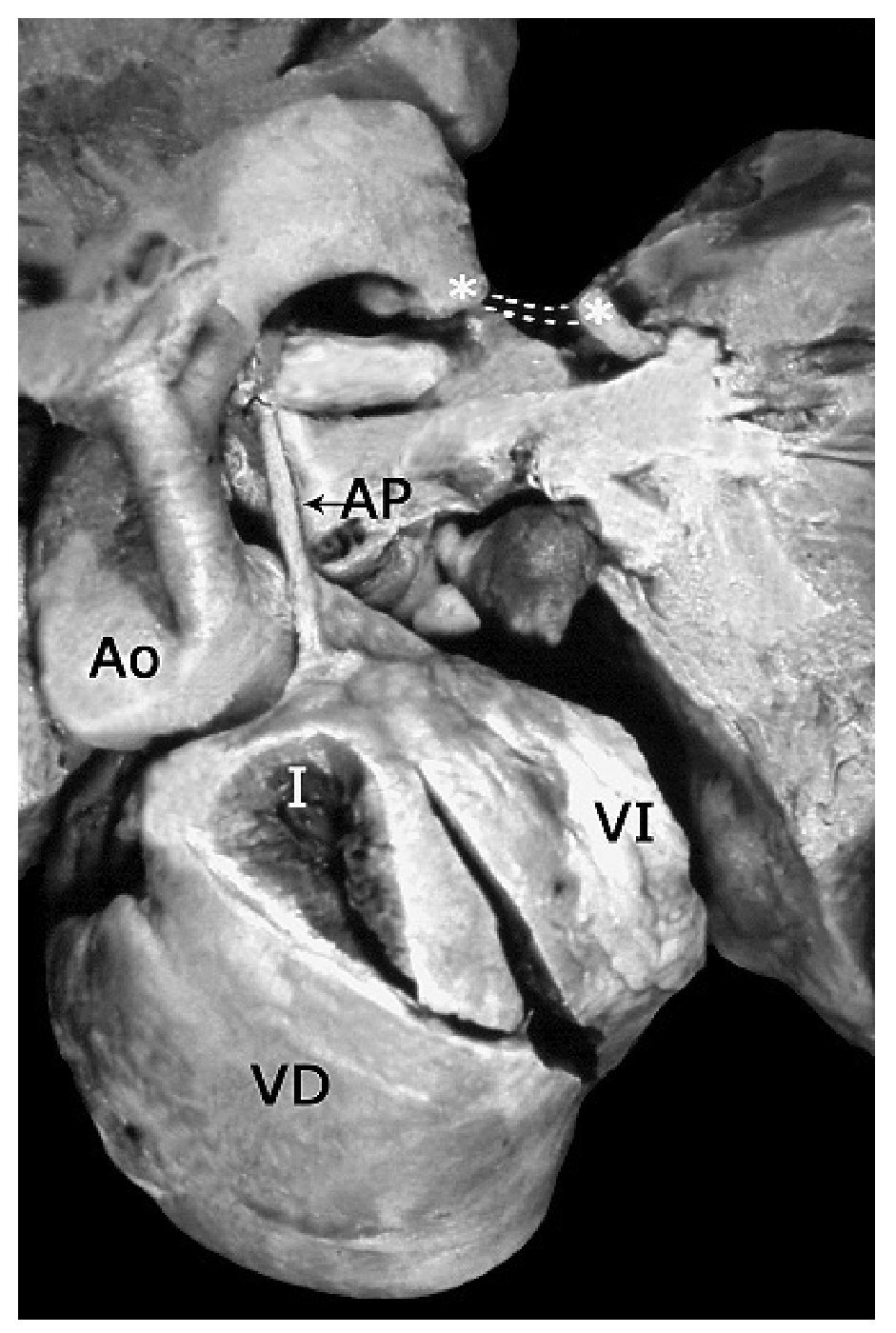
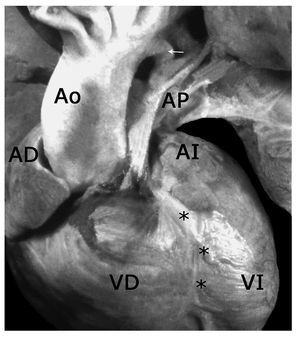
Figura 1. Corazón con tetralogía de Fallot y atresia pulmonar en situs solitus. Obsérvese el tronco de la arteria pulmonar (AP) de calibre disminuido y la aorta (Ao) dextropuesta. Los asteriscos señalan a la arteria descendente anterior y la flecha al conducto arterioso. Abreviaturas: AD = atrio derecho; VD = ventrículo derecho; AI = atrio izquierdo; VI = ventrículo izquierdo.
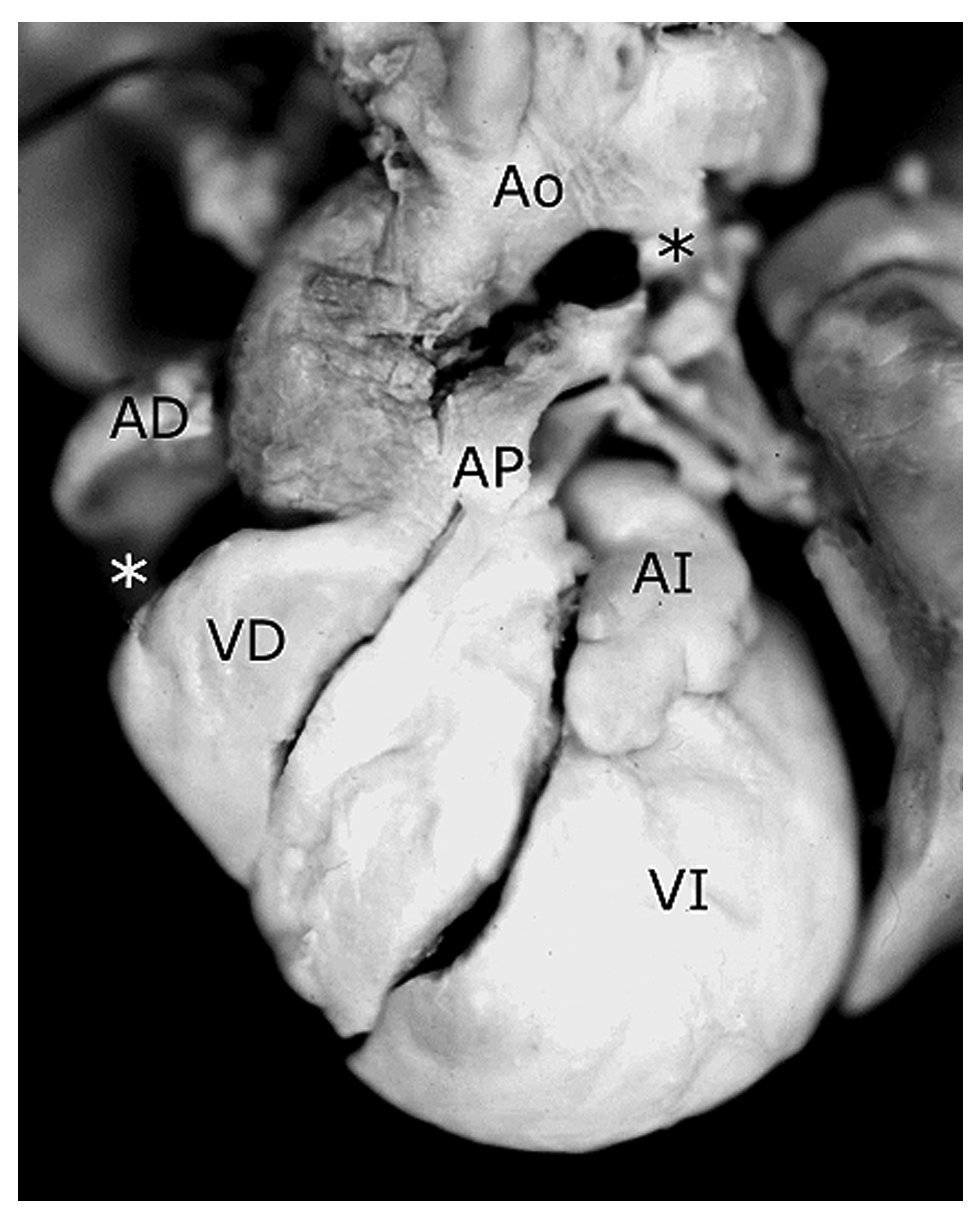
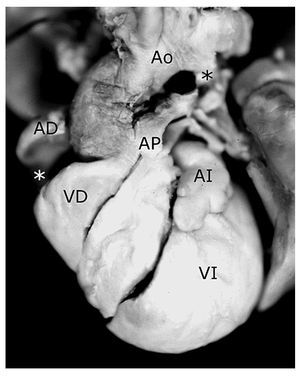
Figura 2. Corazón con ausencia de conexión atrioventricular derecha en situs solitus con doble salida de ventrículo derecho, tetralogía de Fallot y atresia pulmonar. Obsérvese el surco profundo que separa al atrio derecho del ventrículo derecho pequeño (asterisco blanco) y el conducto arterioso (asterisco negro). Las abreviaturas iguales a las anteriores.
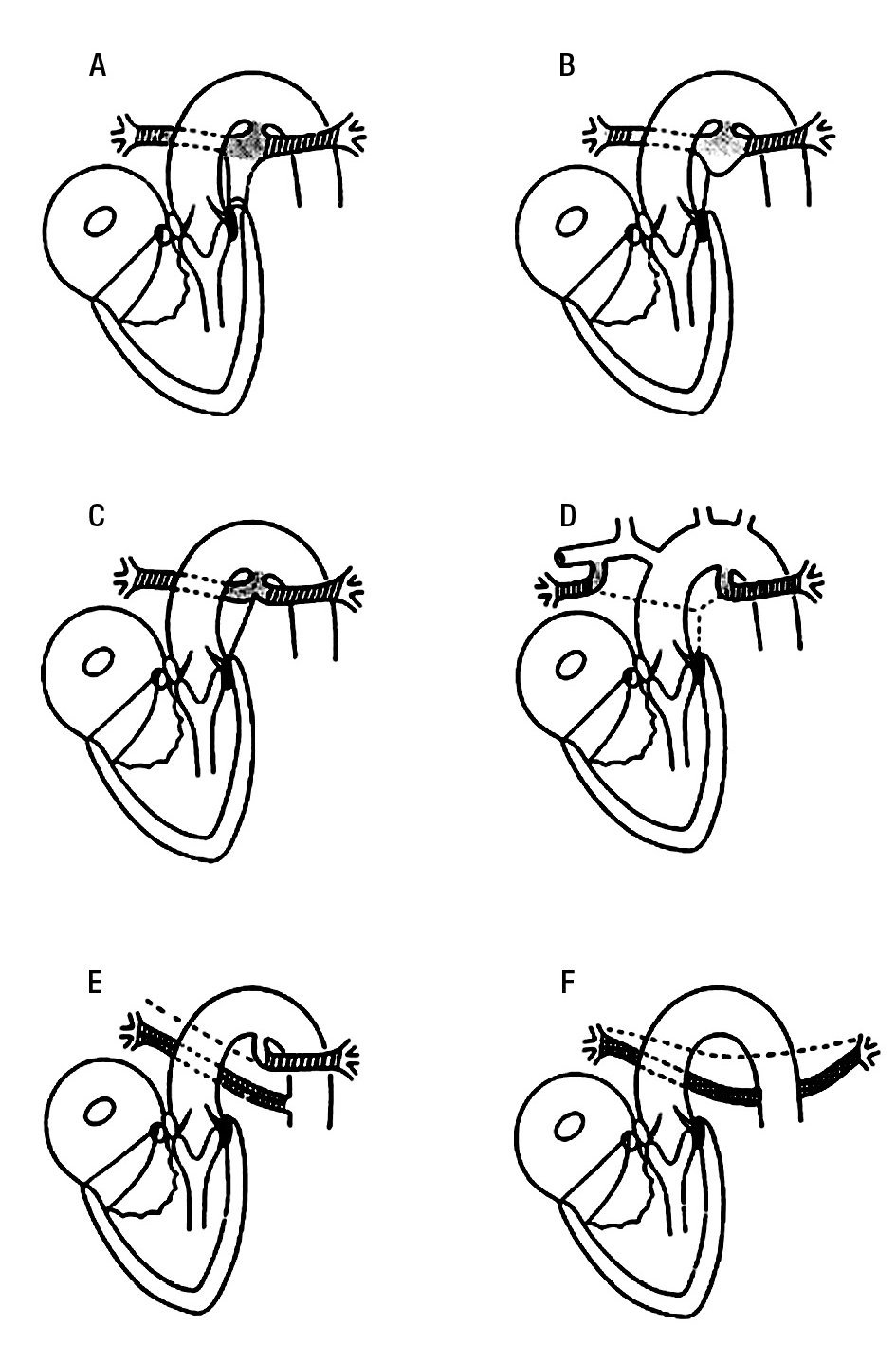
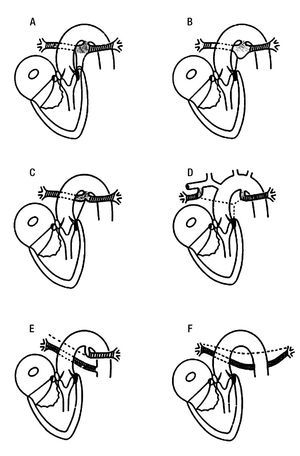
Figuran 3. Esquemas que muestran el espectro anatomopatológico de la tetralogía de Fallot con atresia pulmonar. A) Atresia valvular con infundíbulo ciego. B) Atresia infundibular, valvular y de la porción proximal del tronco pulmonar. C) Ausencia del tronco pulmonar, las ramas confluentes nacen de un conducto arterioso. D) Ausencia de confluencia de las ramas pulmonares que nacen en sendos conductos arteriosos. E) Ausencia de una rama pulmonar substituida por una colateral aortopulmonar, la otra rama pulmonar nace de un conducto arterioso. F) Ausencia de tronco, ramas pulmonares y conductos arteriosos con presencia de colaterales aortopulmonares. El color negro representa al septum infundibular; el punteado al conducto arterioso y a la porción proximal de las ramas pulmonares; lo rallado a la porción distal de las ramas pulmonares y el cuadriculado a las colaterales aortopulmonares.
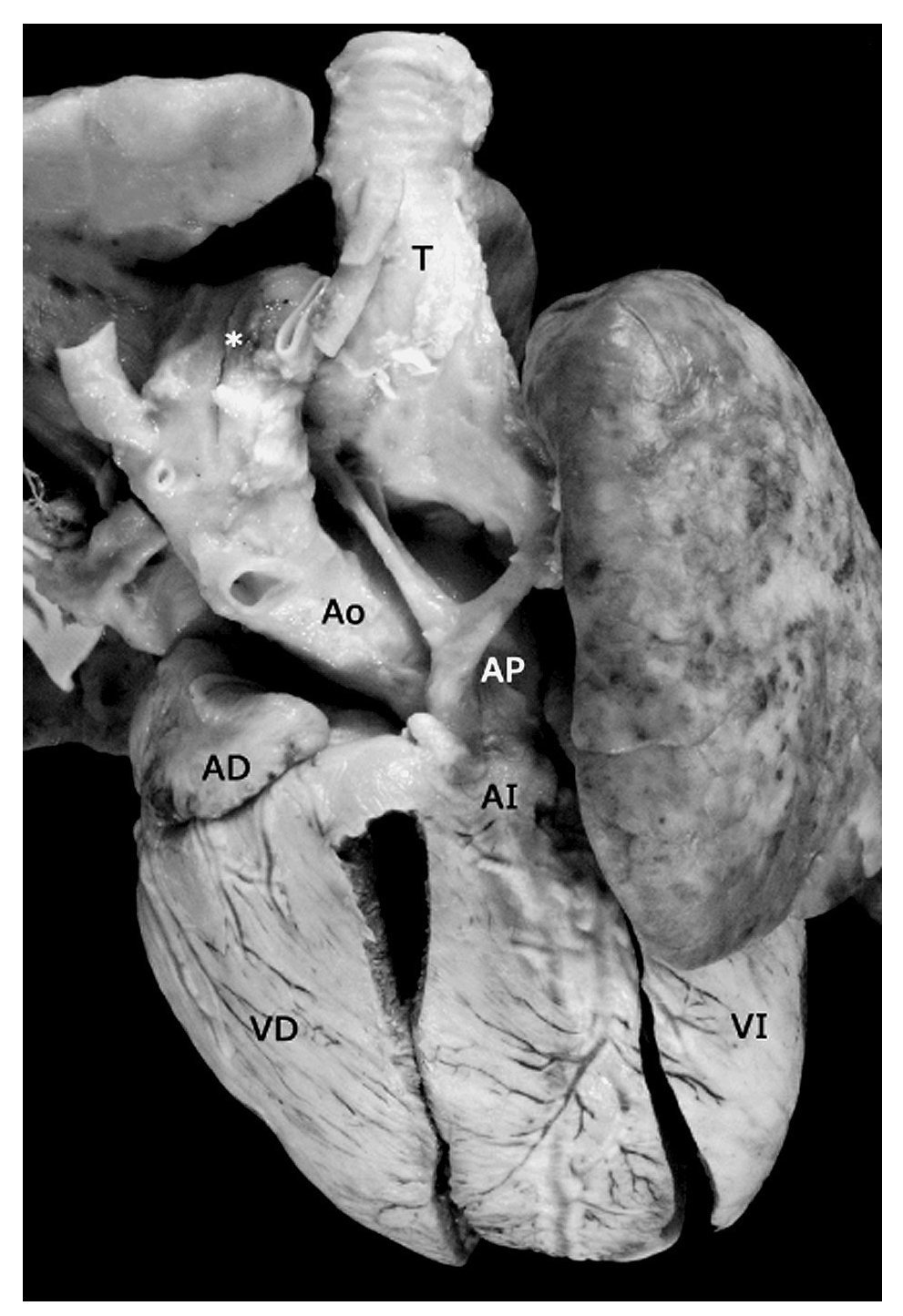
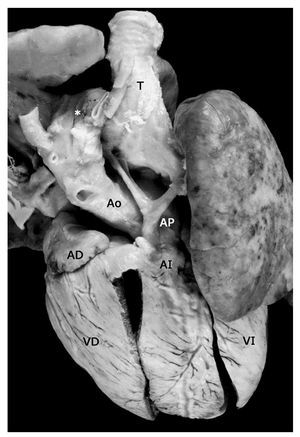
Figura 4. Tetralogía de Fallot con atresia pulmonar en situs solitus, conexión ventriculoarterial concordante y arco aórtico a la derecha (asterisco). Obsérvese la arteria pulmonar hipoplásica con ramas confluentes. Abreviaturas: T = tráquea. Las demás abreviaturas iguales a las anteriores.
Figura 5. Tetralogía de Fallot con atresia pulmonar. Obsérvese la gran hipoplasia del tronco pulmonar que se continúa con un conducto arterioso y con la rama derecha de la arteria pulmonar, la rama izquierda está ausente y se muestra una colateral aortopulmonar hacia el pulmón izquierdo (asteriscos). Abreviaturas: I = infundíbulo. Las demás abreviaturas iguales a las anteriores.
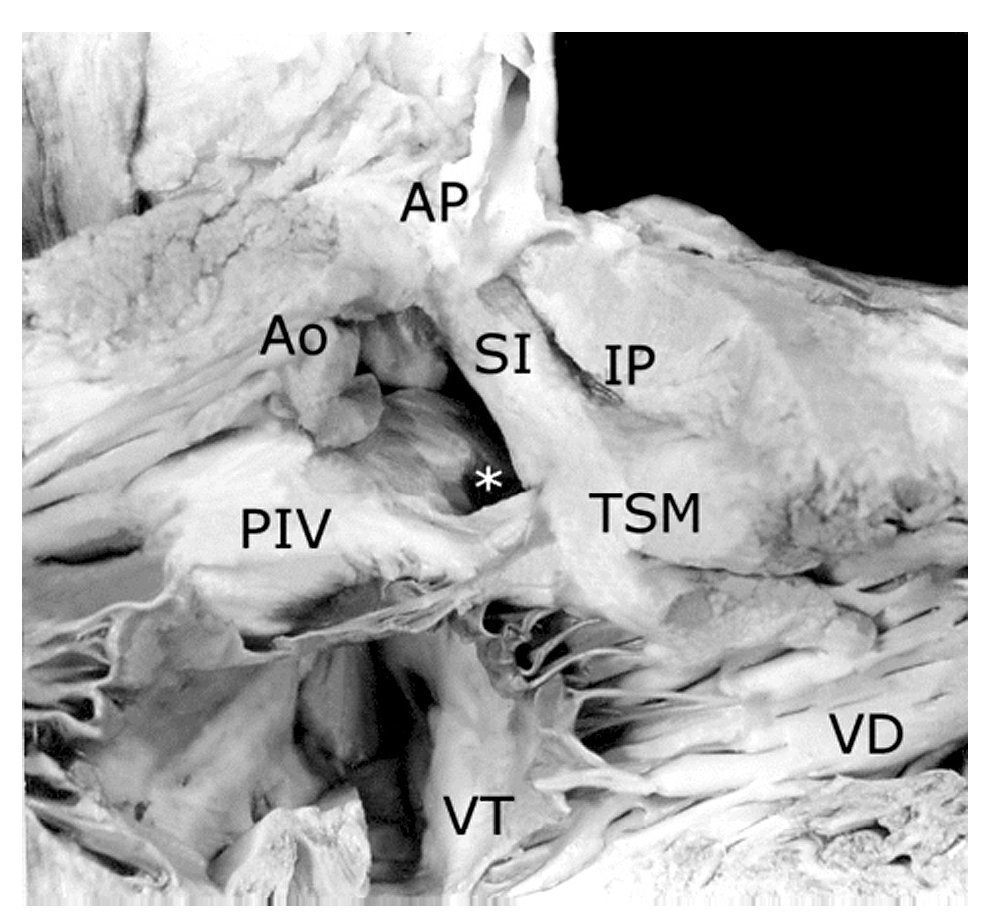
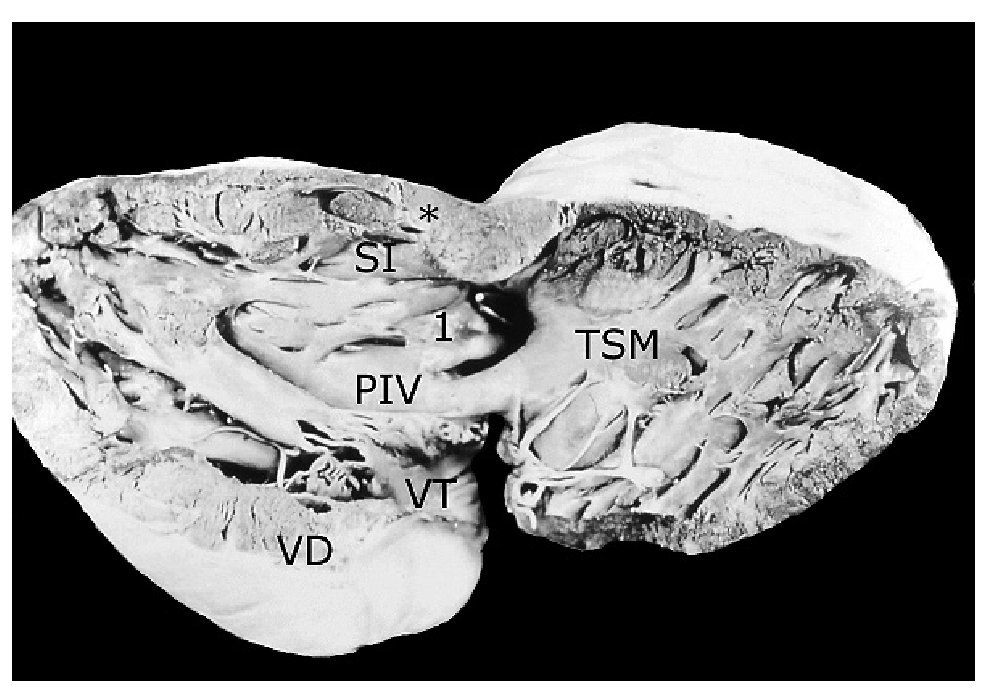
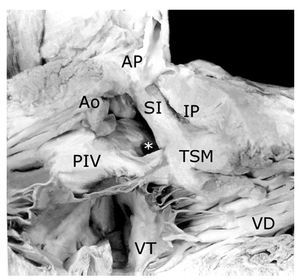
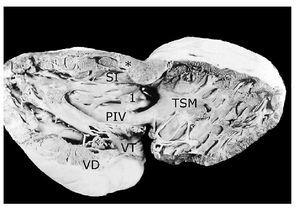
Figura 6. Vista interna del ventrículo derecho de un corazón con tetralogía de Fallot, atresia pulmonar y doble salida de ventrículo derecho. Obsérvese el tronco pulmonar hipoplásico y la válvula aórtica por encima de la comunicación interventricular (asterisco) y del pliegue infundíbulo ventricular (PIV). Abreviaturas: SI = septum infundibular; TSM = trabécula septomarginal; VT = válvula tricúspide. Las demás abreviaturas iguales a las anteriores.
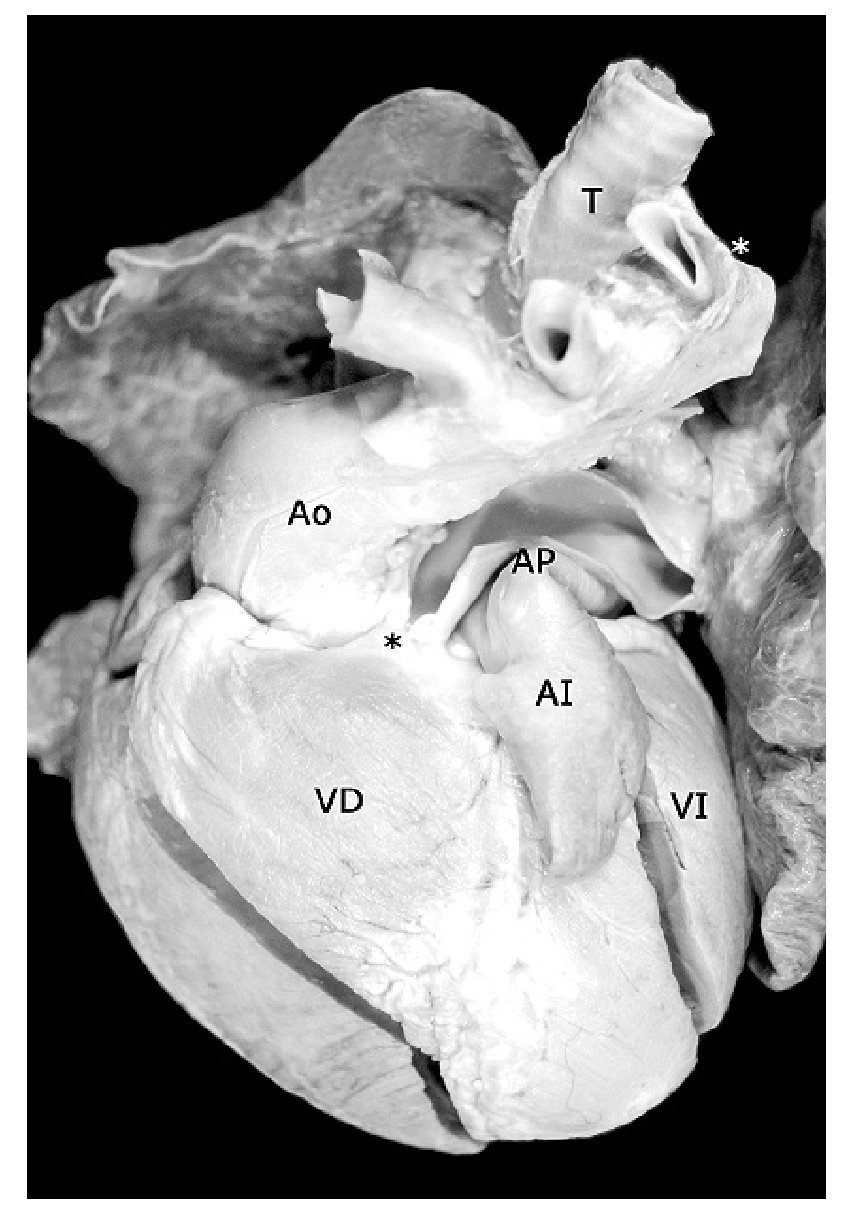
Figura 7. Corazón con tetralogía de Fallot, atresia pulmonar y doble salida de ventrículo derecho. Vista externa. Obsérvese la hipoplasia de la arteria pulmonar; el asterisco negro indica la atresia valvular pulmonar y el blanco señala al arco aórtico izquierdo. Las abreviaturas iguales a las anteriores.
Figura 8. Corazón con tetralogía de Fallot, atresia pulmonar y doble salida de ventrículo derecho. Obsérvese la hipoplasia del tronco pulmonar y los rafés de las sigmoideas pulmonares fusionadas. Las abreviaturas iguales a las anteriores.
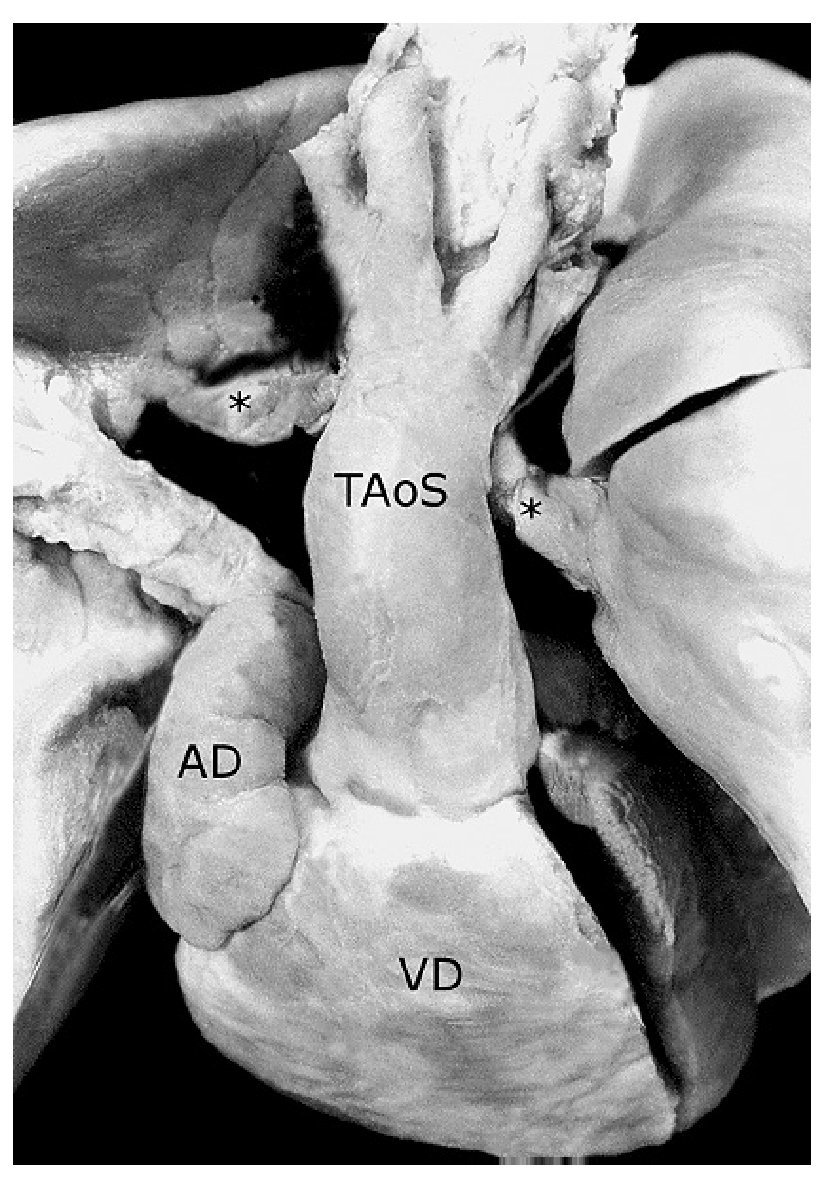
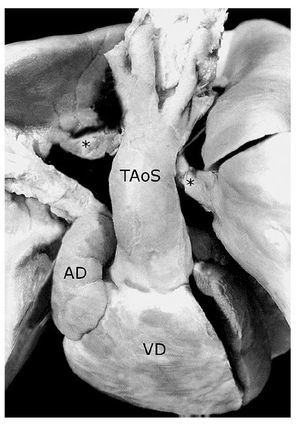
Figura 9. Tronco aórtico solitario (TAoS) que emerge del ventrículo derecho. Obsérvese las ramas de la arteria pulmonar (asteriscos) conectadas a un conducto arterioso derecho que nace de la cara posterior del cayado de la aorta. Las abreviaturas iguales a las anteriores.
La válvula pulmonar atrésica mostró tres senos de Valsalva rudimentarios y tres rafés por fusión de las sigmoideas en 10 corazones (28.58%) (Figura 8). El tejido valvular imperforado estuvo empastado en 10 especímenes (28.58%) en los que no existieron senos rudimentarios ni rafés, y en quince corazones (42.86%) no se encontró rastro de tejido valvular.
De los 35 corazones dos (5.71%) presentaron ausencia del septum infundibular, en ellos se observó continuidad fibrosa valvular entre las sigmoideas aórticas y el tejido valvular pulmonar empastado; los 33 corazones restantes (94.29%) mostraron una hiper-desviación del septum infundibular hacia la izquierda en sentido cefalad y anteriad (Figuras 6, 8, 10 y 11), de ellos 10 (30.3%) presentaron separación entre este septum y la pared anterior del infundíbulo (Figuras 6, 8, y 11), mientras que en los veintitrés restantes (69.7%) ocurrió fusión entre ambos elementos infundibulares (atresia infundibular) (Figura 10). De los 35 corazones, uno (2.86%) presentó ventrículo único y 34 (97.14%), dos ventrículos, en éstos últimos la comunicación interventricular fue infundibular posterior (subaórtica) de los cuales catorce (41.18%) tuvieron bordes musculares (Figuras 6 y 10) y 20 (58.82%), mostraron extensión perimembranosa (Figura 11). El pliegue infundibuloventricular estuvo presente en catorce corazones (41.18%) en los que existió discontinuidad valvular aortotricuspídea y en 20 corazones (58.82%) estuvo ausente en los que hubo continuidad aortotricuspídea.
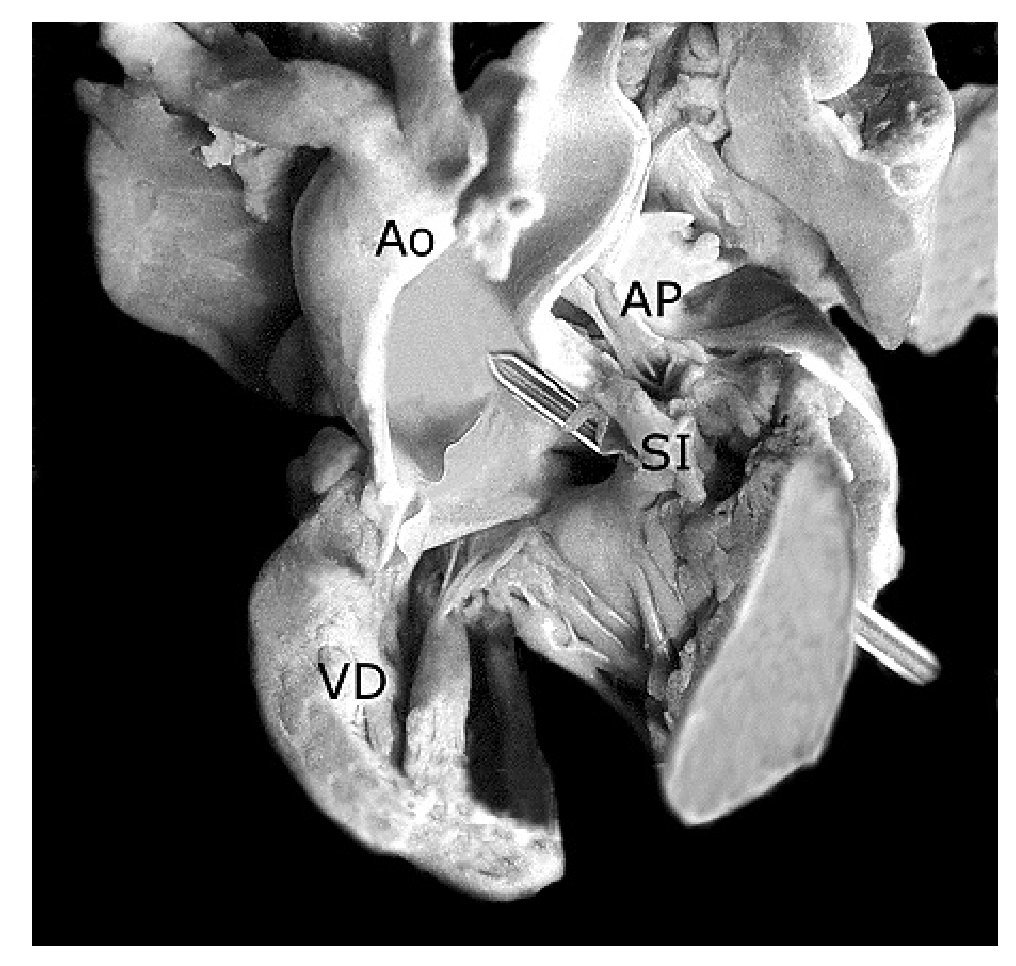
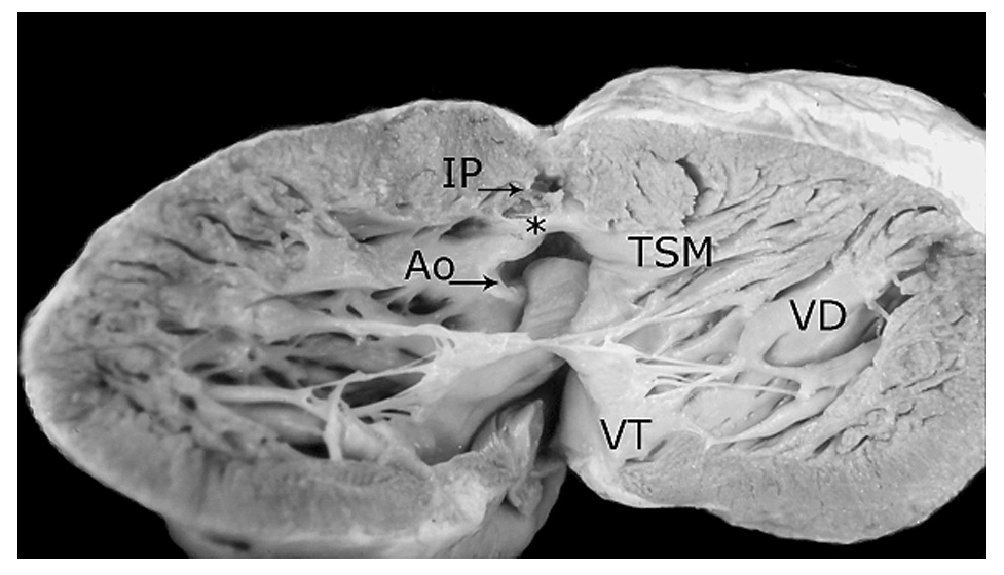
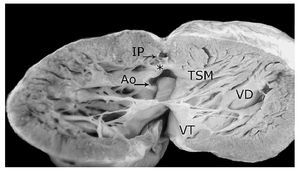
Figura 10. Ventrículo derecho abierto. Obsérvese la fusión del septum infundibular con la pared anterior del infundíbulo (asterisco), la comunicación interventricular de contorno muscular (estilete) y la aorta biventricular concordante (1). Las abreviaturas iguales a las anteriores.
Figura 11. Ventrículo derecho abierto. Obsérvese el septum infundibular hiperdesviado hacia la parte anterior (asterisco), el infundíbulo subpulmonar estrecho y ciego y la aorta biventricular. Las abreviaturas iguales a las anteriores.
El tronco de la arteria pulmonar fue hipoplásico en 20 corazones (57.14%) (Figuras 1, 2, 4, 5, 6, 7 y 8), atrésico en su porción proximal en seis (17.14%) (Figura 3B) y estuvo ausente en nueve (25.71%) (Figura 3C, D, E y F). Las ramas de la arteria pulmonar estuvieron confluentes e hipoplásicas en veinticinco corazones (71.43%) (Figuras. 1, 2, 4 y 7) y en cinco (14.29%) existió ausencia de las porciones proximales de ambas ramas pulmonares que estuvieron irrigadas por sendos conductos arteriosos (Figura 3D y E) y en los cinco restantes (14.29%) dichas ramas estuvieron ausentes (Figura 3F). El conducto arterioso estuvo ausente en cinco corazones (14.29%) y presente en 30 (85.71%) (Figura 1) de los cuales 20 (66.67%) fueron izquierdos, cinco (16.67%) derechos y cinco (16.67%) bilaterales.
Las colaterales aortopulmonares estuvieron presentes en 10 corazones (28.57%), cinco unilaterales y cinco bilaterales (Figura 12); estos vasos se anastomosaron con las ramas intrapulmonares a nivel de los hilios. El ventrículo derecho estuvo hipertrofiado en 34 corazones (97.14%) (Figuras 10 y 11); el corazón univentricular estuvo hipertrofiado. El arco aórtico fue izquierdo en 20 (57.14%) y derecho en quince (42.86%).
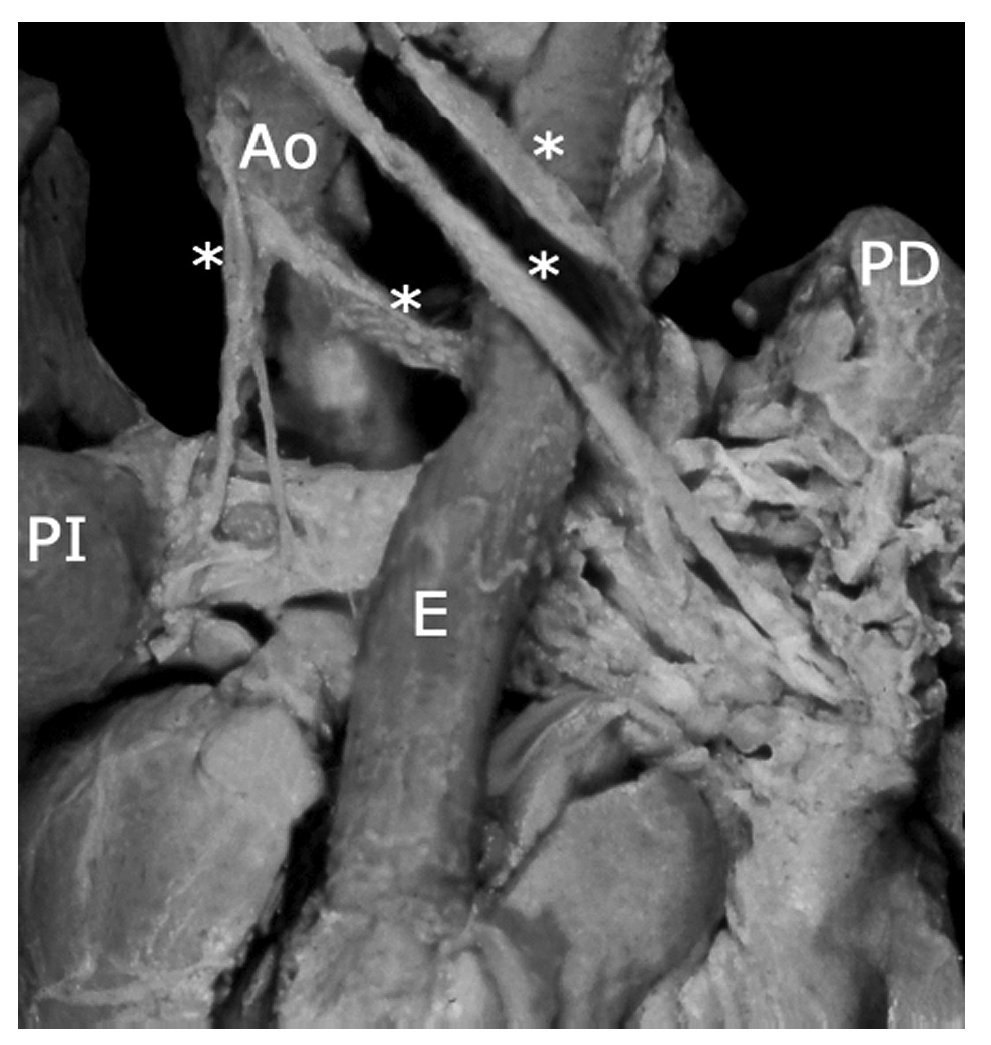
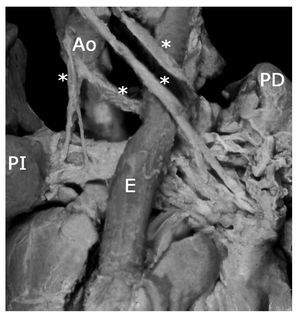
Figura 12 Colaterales aortopulmonares (asteriscos). Vista posterior. Abreviaturas: PI = pulmón izquierdo; PD = pulmón derecho; E = esófago. Las demás abreviaturas iguales a las anteriores.
El análisis comparativo de los especímenes nos ha permitido elaborar un espectro anatomopatológico de la tetralogía de Fallot con atresia pulmonar que muestra un abanico de grados de severidad de esta cardiopatía que expresa un patrón obstructivo del flujo sanguíneo hacia los pulmones. Se constituyeron cinco grupos; cada uno incluye a los especímenes que comparten rasgos anatómicos similares.
Grado 1. La forma menos severa del espectro anatómico lo constituyen los corazones en los que solo existe atresia de la válvula pulmonar la cual forma un diafragma imperforado que evita la comunicación entre la arteria pulmonar y el infundíbulo del ventrículo derecho (Figura 3A): en algunas ocasiones pueden identificarse tres senos de valsalva rudimentarios en el fondo ciego del tronco pulmonar. Se reconoce el septum infundibular desviado hacia delante y a la izquierda, situado por delante de la trabécula septomarginal, las dos ramas de esta trabécula circunscriben el piso muscular de la comunicación interventricular. Está presente un conducto arterioso que irriga al tronco y a las ramas pulmonares confluentes.
Grado 2. Lo forman aquellos corazones que además de la atresia valvular se agrega atresia infundibular por fusión del septum infundibular con la pared anterior del infundíbulo: generalmente el tejido valvular pulmonar se encuentra empastado (Figura 3B).
Grado 3. En este grupo se incluyen corazones que presentan atresia del tronco pulmonar ya sea parcial en su porción proximal o total. Las ramas pulmonares confluentes están irrigadas por un conducto arterioso, en esta última situación el tronco de la arteria pulmonar está representado por un cordón fibroso que conecta la masa infundibular con las ramas pulmonares confluentes (Figura 3 B y C).
Grado 4. Los especímenes de este grupo presentan atresia de la porción confluente de las ramas pulmonares las cuales surgen de sendos conductos arteriosos (Figura 3 D y E).
Grado 5. En este grupo están presentes las colaterales aortopulmonares, pueden ser unilaterales cuando en el lado opuesto está una rama de la arteria pulmonar (Figura 3 E), o bilaterales cuando ambas ramas pulmonares están ausentes (Figura 3 F).
En los grupos cuatro y cinco la única arteria que surgió del corazón fue la aorta, situación que ha sido denominada tronco aórtico solitario (Figuras 3C, D,E, F y 11).
Discusión
En los casos de tetralogía de Fallot y atresia pulmonar con gran restricción de la circulación hacia los pulmones ocurre una reducción en el número total de alvéolos y una disminución en tamaño pero no en número de las arterias pulmonares preacinares e intraacinares,24,25,27,28 estos cambios se han atribuido a la disminución del flujo sanguíneo pulmonar. En base a que en el segundo año de vida postnatal ocurre gran parte del desarrollo alveolar y de las arterias intraacinares, se ha sugerido que la intervención quirúrgica en edades anteriores puede mejorar tanto el desarrollo alveolar como el crecimiento del lecho vascular pulmonar.24,27
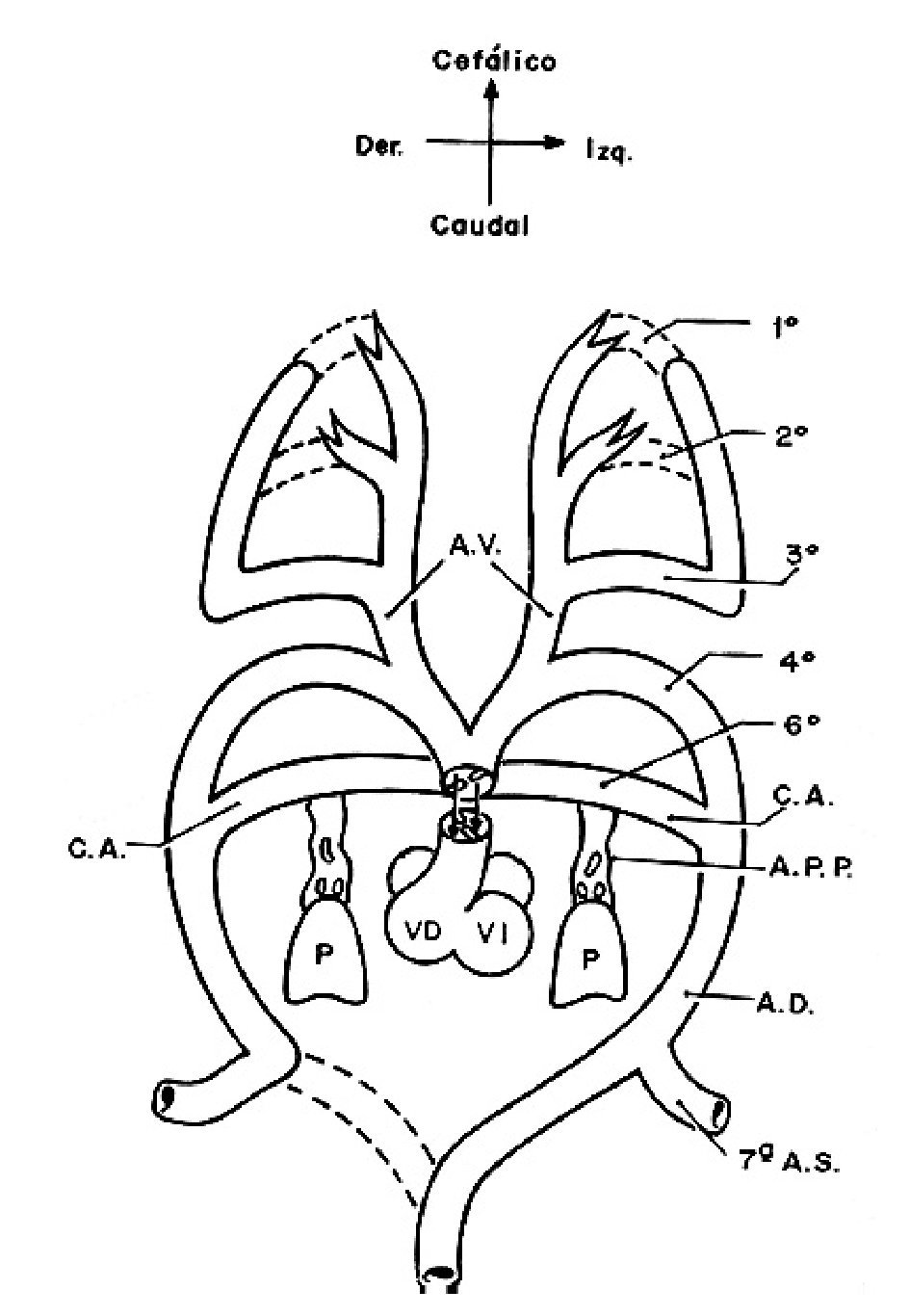
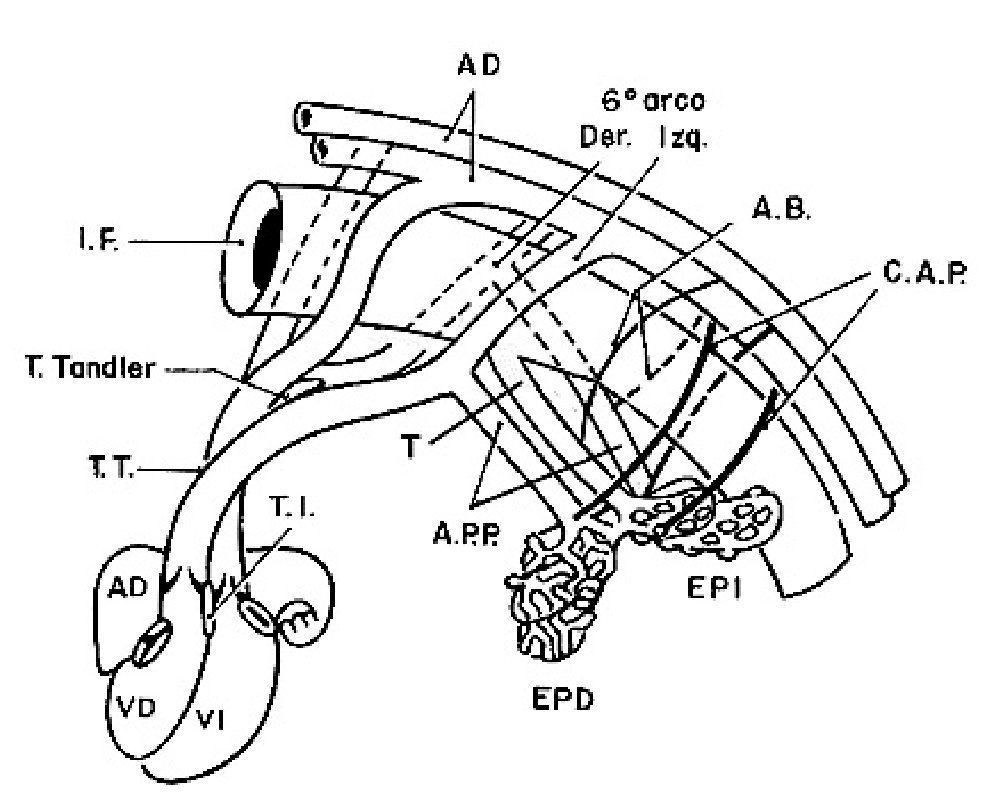
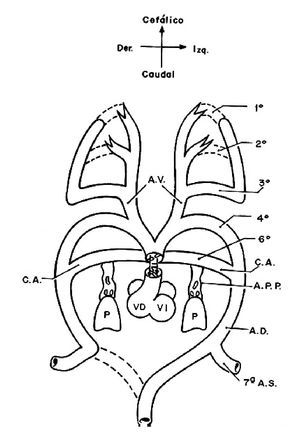
Para comprender la doble irrigación de ambos pulmones, la que proviene del ventrículo derecho por la arteria pulmonar y sus ramas y la que surge de la aorta descendente a través de las colaterales aortopulmonares, es necesario resumir el desarrollo embrionario de la circulación pulmonar. Los arcos aórticos son vasos comunicantes que en el embrión conectan las aortas ventrales con las dorsales y están contenidos dentro de los arcos branquiales,29 éstos son estructuras mesenquimatosas derivadas de las crestas neurales que rodean ventrolateralmente a la faringe primitiva. Los sextos arcos aórticos que constituyen el par más caudal están cercanos a los esbozos pulmonares y se conectan con la vasculatura pulmonar a través de la arteria postbranquial que se forma a partir del horizonte XIII de Streeter30 (27 a 29 días, 4 a 6mm) cuando aparecen cúmulos celulares de angioblastos entre los sextos arcos aórticos y los esbozos pulmonares los cuales forman capilares en el horizonte XIV de Streeter30 (28-30 días, 7 a 8 mm), éstos se fusionan y forman las arterias postbranquiales (Figura13), las cuales se unen con los sextos arcos aórticos y los dividen en una porción medial que forma la parte proximal de las ramas de la arteria pulmonar y otra distal que origina a los conductos arteriosos. La confluencia de las ramas de la arteria pulmonar se origina por la unión de los dos sextos arcos aórticos (derecho e izquierdo) que embonan con la arteria pulmonar resultante de la tabicación del tronco-cono del corazón. Las arterias postbranquiales originan las porciones distales de las ramas pulmonares que penetran a los respectivos hilios de cada pulmón (Figura 14).31
Figura 13. Vista frontal del esquema que representa el doble arco aórtico embrionario. Obsérvese la conexión de los arcos aórticos cuarto y sextos con el tronco del corazón y las arterias postbranquiales que unen al pulmón con los sextos arcos aórticos. Abreviaturas: P = pulmón; AD = aorta dorsal; AV = aorta ventral; APP = arteria pulmonar postbranquial; 1-6 = arcos aórticos; 7ª AS = séptima arteria segmentaria. Las demás abreviaturas iguales a las anteriores.
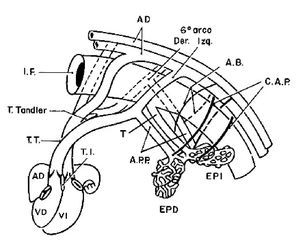
Figura 14. Esquema que muestra las conexiones del plexo arterial intrapulmonar con las colaterales aortopulmonares, las arterias postbranquiales, los sextos arcos aórticos y de la arteria pulmonar del segmento troncoconal con el ventrículo derecho. Abreviaturas: IF = intestinofaríngeo; AB = arterias bronquiales; CAP = colaterales aortopulmonares; EPD = esbozo pulmonar derecho; EPI = esbozo pulmonar izquierdo. Las demás abreviaturas iguales a las anteriores.
Los pulmones surgen de una evaginación endodérmica de la porción caudal del piso de la faringe primitiva en el horizonte XII de Streeter (25-27 días, 2.5 mm).32 El esbozo laringotraqueopulmonar queda cubierto por una capa de mesodermo esplácnico que origina a los tejidos cartilaginoso, conjuntivo fibroso y elástico, músculo liso, vasos linfáticos y una extensa red de capilares que ulteriormente se diferencian en venas, arterias pulmonares y bronquiales. Las arterias bronquiales restringen su irrigación para las necesidades nutricias del árbol respiratorio, mientras que las pulmonares quedan circunscritas al intercambio de gases en el epitelio respiratorio.
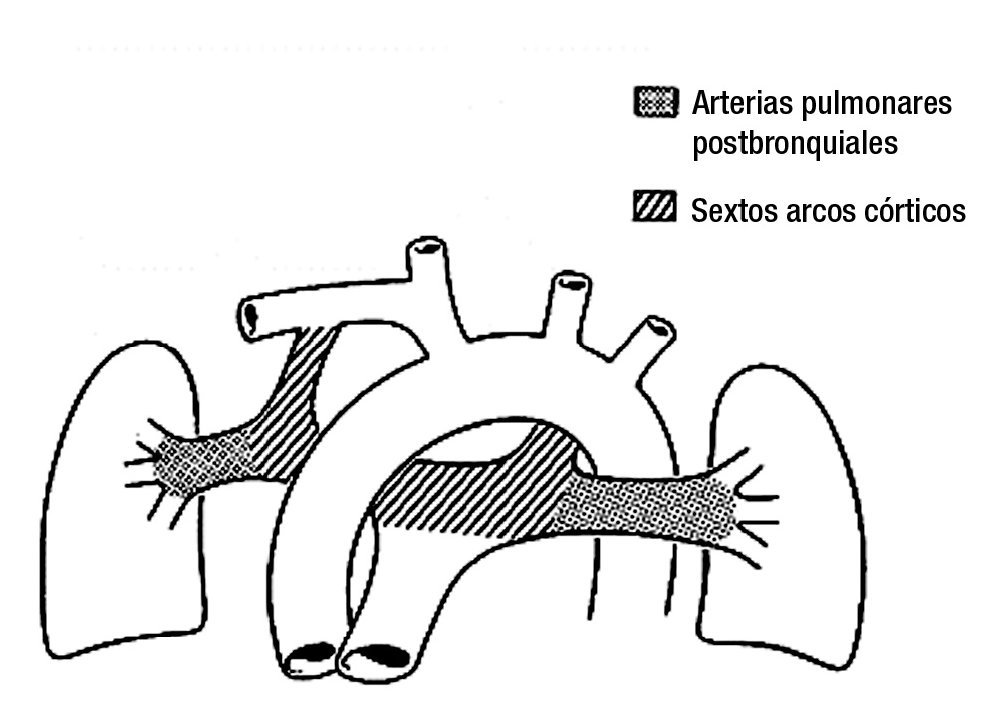
Los esbozos pulmonares también desarrollan conexiones con pequeños vasos que surgen de la aorta descendente los cuales se conectan con las arterias intrapulmonares a nivel del hilio del pulmón, estos vasos se desarrollan y forman las colaterales aortopulmonares cuando disminuye o está ausente la circulación proveniente del ventrículo derecho hacia la arteria pulmonar y sus ramas. Cuando esta circulación fluye normalmente hacia los pulmones las colaterales aortopulmonares involucionan y desaparecen (Figura 15).
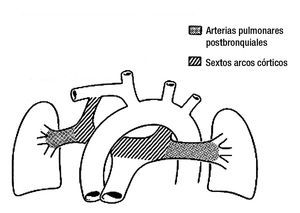
Figura 15. Esquema que muestra los componentes que originan las ramas de la arteria pulmonar y los conductos arteriosos. El punteado representa a las arterias pulmonares postbranquiales y el rallado a los derivados de los sextos arcos aórticos.
El troncocono del corazón embrionario constituye la continuación cefálica del ventrículo derecho, al tabicarse separa los canales aórtico y pulmonar a través de un tabique de forma helicoidal. En la tetralogía de Fallot ocurre una tabicación troncoconal desigual a expensas de la arteria pulmonar, ésta queda estrecha y conectada con el infundíbulo del ventrículo derecho, mientras que la aorta nace de manera biventricular por encima de la comunicación interventricular.
Patogenéticamente se ha considerado a la tetralogía de Fallot con atresia pulmonar como la forma anatómica mas severa de esta cardiopatía;1-4 debido a que la arteria pulmonar queda muy estrecha a nivel de la válvula pulmonar los esbozos sigmoideos se desarrollan en un espacio muy reducido lo que favorece la fusión de las sigmoideas.1
En esta cardiopatía existen tres tipos de conexión ventrículoarterial: concordante con modo imperforado, doble salida de ventrículo derecho con modo imperforado y única vía de salida por tronco aórtico solitario cuando no existe la estructura que representa a la arteria pulmonar; la otra cardiopatía que forma parte de la única vía de salida es el tronco común.
Como puede observarse en nuestros resultados, la tetralogía de Fallot con atresia pulmonar se muestra con una gran variabilidad en la anatomía de las arterias pulmonares y en el origen de la circulación pulmonar. Se han propuesto varias clasificaciones en torno a los diferentes tipos de circulación pulmonar.3,33-38 Casi todas las clasificaciones coinciden en dividir a las ramas de la arteria pulmonar en confluentes y no confluentes, son confluentes cuando ambas presentan continuidad entre sí, exista o no tronco de la arteria pulmonar y no confluentes cuando cada una es irrigada por un conducto arterioso; esta situación puede combinarse con tronco pulmonar o con ausencia de éste. Cuando están ausentes tanto los conductos arteriosos como las ramas de la arteria pulmonar se desarrollan las arterias colaterales aortopulmonares que surgen de la aorta descendente,39-42 aunque se ha descrito su origen a partir de las arterias sistémicas del cuello43 y de las arterias coronarias.33,43-45 Todas estas variantes anatómicas complican los casos cuando la circulación pulmonar es multifocal (ramas pulmonares mas arterias colaterales sistémicas) y no distribuye la sangre en forma simétrica y homogénea a todos los lóbulos pulmonares.33,45-47
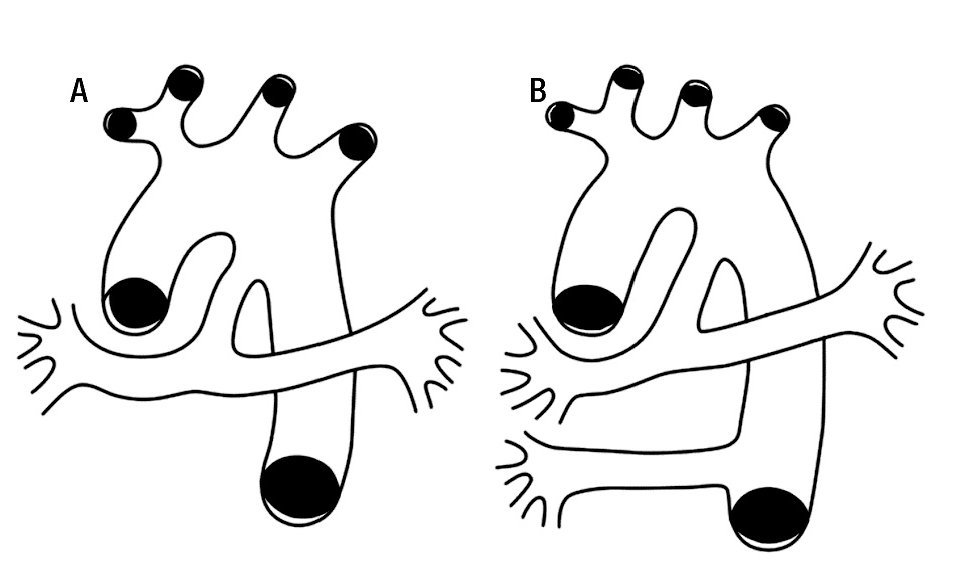
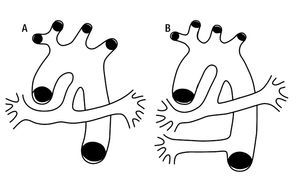
Ante la complejidad que presenta la circulación pulmonar en esta cardiopatía congénita, el diagnóstico de la confluencia de las ramas pulmonares es un indicador del estado anatómico de la circulación pulmonar aunque no tiene utilidad para describir el estado hemodinámico del paciente, por lo que es mejor describir dicha circulación con los términos unifocal y multifocal.43 La primera es aquella en la que todo el flujo pulmonar se efectúa a través de una sola estructura anatómica como puede ser un conducto arterioso (Figura 16A); la segunda es la que se lleva cabo a través de varias estructuras anatómicas como el conducto arterioso y una o varias colaterales sistémicas aortopulmonares (Figuras 16 B); estas últimas nacen de la aorta descendente, pueden variar en número de una a cinco, ser de pequeño o gran calibre y conectarse con las arterias intrapulmonares a nivel de un lóbulo o de un segmento broncopulmonar, generalmente son tortuosas y pueden presentar estenosis en su origen, en su trayecto o a nivel parenquimatoso donde se conectan con la circulación intrapulmonar.23 Las colaterales pequeñas se aprecian mejor angiográficamente que por inspección anatómica y son más numerosas que las de grueso calibre, su trayecto es más tortuoso y su distribución es subpleural; se ha pensado que estas pequeñas colaterales son adquiridas más que originarias.47,48 En un tiempo se consideró que las colaterales aortopulmonares eran arterias bronquiales desarrolladas; actualmente la mayoría de los autores no lo consideran así, son vasos de diferente origen, embriológicamente se desarrollan en etapas más tempranas.21,49
Figura 16. Esquemas que representan la circulación arterial pulmonar. A) unifocal. B) multifocal.
El estudio histopatológico de Thiene y colaboradores21 demostró que en los casos que presentan colaterales aortopulmonares no estenóticas, las arterias pulmonares intraparenquimatosas desarrollan hipertrofia de la capa media con proliferación de la íntima y presentan lesiones plexiformes y diversos grados de enfermedad vascular pulmonar de acuerdo a la clasificación de Heath y Edwards.50 Por otro lado Haworth y Macartney22 demostraron que dichas colaterales presentan crestas de la íntima proyectadas hacia la luz vascular a nivel de su anastomosis con las arterias pulmonares intraparenquimatosas, lo que se ha interpretado como un intento de involución del vaso primitivo.
Lo que hace especial a esta cardiopatía congénita es lo variado que pueden ser los diferentes niveles de interrupción de la vía pulmonar desde el ventrículo derecho hasta las arterias intrapulmonares. La atresia puede involucrar a las arterias pulmonares de manera proximal o distal. Si el segmento atrésico involucra a la válvula y al tronco pulmonar las ramas pulmonares derecha e izquierda pueden ser confluentes. La determinación de la confluencia de las arterias pulmonares es una de las consideraciones clínicas más importantes a realizar para la decisión quirúrgica. En los pacientes con arterias pulmonares confluentes que tienen un flujo a través de un conducto arterioso la irrigación de los 20 segmentos pulmonares es completa. De los pacientes con arterias pulmonares no confluentes, 80% tienen una distribución pulmonar incompleta y cerca de una tercera parte de ellas irrigan menos de 10 segmentos pulmonares. Los segmentos pulmonares que no están conectados a las arterias pulmonares centrales habitualmente son irrigados por colaterales aortopulmonares. El conducto arterioso y las colaterales aortopulmonares pueden coexistir en el mismo paciente pero excepcionalmente lo hacen en el mismo lecho pulmonar.5, 33, 36, 46, 49, 51,52
El conducto arterioso es habitualmente unilateral y se asocia a arterias pulmonares en más de 80% de los casos y con estenosis en 35% a 50% de los pacientes. Las colaterales presentan estenosis localizada en los sitios de su emergencia aórtica o en la anastomosis intrapulmonar en 60%.24 Dada la hipoperfusión de algunos segmentos broncopulmonares con la hiperperfusión de otros, el lecho pulmonar vascular puede presentar una amplia variedad de lesiones histopatológicas que van desde la trombosis in situ hasta la enfermedad hipertensiva vascular pulmonar. El grado de hipoplasia de las ramas pulmonares está en relación con el flujo a través del conducto arterioso y del número de colaterales aortopulmonares.
Los pacientes con esta cardiopatía pueden presentar manifestaciones clínicas desde el periodo neonatal; la cianosis es el signo más evidente y de no existir colaterales aortopulmonares el cierre del conducto arterioso producirá una hipoxemia severa, en aquellos pacientes neonatales que no la presentan ya sea porque el conducto arterioso permanece abierto o por existir colaterales aortopulmonares, en el periodo de lactancia exhiben cianosis y fatiga progresiva, manifestaciones que están en relación directa al mayor o menor flujo pulmonar y al crecimiento y actividad del niño. El manejo médico siempre es difícil y obliga a un tratamiento quirúrgico temprano.22,24,38,53-55 La historia natural de los pacientes con esta cardiopatía es difícil de establecer por su amplia gama de variaciones anatómicas; sin embargo, en los enfermos con arterias pulmonares confluentes y mínima hipoplasia cuyos 20 segmentos pulmonares están abastecidos a través de un conducto arterioso, 50% de ellos suele morir en los primero seis meses de vida y 90% en el primer año. Cuando las arterias pulmonares son confluentes pero la irrigación de muchos de los segmentos pulmonares se efectúa por medio de colaterales aortopulmonares, la mitad de los pacientes fallecen antes de los tres años de vida y 90% no alcanza los 10 años. En ausencia de confluencia de ramas pulmonares o cuando no existen arterias centrales pulmonares y la irrigación de los segmentos pulmonares es a través de múltiples y grandes colaterales aortopulmonares la sobrevida puede ser hasta la edad adulta, aunque el fallecimiento ocurre en la mayoría de los casos antes de los 30 años de edad.4,38
Debido al espectro de presentación de esta cardiopatía principalmente en lo referente al árbol pulmonar y sus flujos sanguíneos tributarios, es difícil determinar el mejor abordaje quirúrgico para efectuar un tratamiento que debe ser individualizado.6-59 En los pacientes con ramas pulmonares confluentes y de buen calibre la corrección quirúrgica total se establece restaurando la continuidad entre el ventrículo derecho y el árbol bronquial pulmonar con un injerto valvado; aquí el cierre de la comunicación interventricular es posible y el resultado de la intervención suele ser bueno; no sucede así cuando existe hipoplasia arterial moderada o alteración en la arborización pulmonar, circunstancias que requieren de una cirugía paliativa previa mediante la creación de una fístula sistémico-pulmonar, posteriormente se procede a la corrección definitiva en dos o tres tiempos quirúrgicos adicionales.60-62 Cuando la hipoplasia de las arterias pulmonares es muy grave la corrección total no es posible y se hace necesaria una operación preliminar paliativa que estimule el desarrollo de las ramas pulmonares. La fístula de Blalock-Taussig modificada utilizando un injerto de politetrafluoroetileno expandido (PTFEE) se ha convertido en el procedimiento más utilizado para este fin ya que proporciona un flujo pulmonar bilateral adecuado, promueve el desarrollo de las arterias pulmonares y es excepcional que ocasione distorsión o estenosis como ocurre con las fístulas tipo Waterston o Potts.
En los pacientes con arterias pulmonares no confluentes el manejo quirúrgico está enfocado a restablecer la confluencia de las arterias pulmonares centrales, mejorar el flujo pulmonar a través de una fístula sistémicopulmonar y para un segundo tiempo quirúrgico colocar un injerto valvado entre el ventrículo derecho y las ramas pulmonares centrales.62,63
Resulta útil la clasificación anatómica propuesta por Barbero-Marcial59 para la toma de decisiones quirúrgicas y el análisis de resultados. Esta clasificación consta de los siguientes grupos:
Grupo A: Comprende casos en quienes todos los segmentos broncopulmonares están irrigados a través de arterias pulmonares centrales. Se dividen en dos subgrupos:
A1 cuando los vasos son confluentes y tienen calibre normal o ligeramente disminuido por hipoplasia.
A2 cuando las arterias pulmonares centrales tienen estenosis o no son confluentes.
Grupo B: Cuando unos segmentos broncopulmonares estan irrigados por ramas de la arteria pulmonar y otros reciben flujo a través de colaterales aortopulmonares.
Grupo C: Todos los segmentos broncopulmonares reciben flujo por colaterales aortopulmonares y no existen arterias pulmonares centrales.
Las características anatómicas, la edad del paciente y su estado clínico determinan la planificación del tratamiento quirúrgico que incluye las etapas y procedimientos que a continuación se mencionan:
Fístula sistémico pulmonar por medio de injerto de PTFEE (Blalock-Taussig modificada).
Unifocalización del flujo pulmonar que consiste en la reparación de la arborización pulmonar inapropiada por la presencia de colaterales aortopulmonares que irrigan diferentes segmentos pulmonares. Por medio de este procedimiento se intenta dar un flujo pulmonar completo, adecuado y uniforme a todos los segmento pulmonares por medio de ligadura de las colaterales desde su origen en la aorta, para luego conectarlas a las ramas de la arteria pulmonar cuando éstas se encuentran presentes o a un injerto de PTFEE o de pericardio bovino para establecer una sola fuente de aporte sanguíneo. Esta técnica se aplica a los pacientes que se clasifican dentro el grupo B y C.64-66
Cirugía definitiva por medio de los siguientes procedimientos:
A. Ventriculotomía derecha con ampliación del tracto de salida por medio de un injerto valvado que establece la conexión ventrículo-pulmonar.
B. Ventriculotomía derecha con ampliación del tracto de salida por medio de un parche de pericardio o utilizando tejido de la orejuela izquierda que conecta el tronco de la arteria pulmonar con el ventrículo derecho (técnica de Barbero-Marcial).65
C. La aorta y la pulmonar se seccionan, el cabo proximal de la arteria pulmonar se cierra y el cabo distal se amplía con una incisión anterior vertical. La aorta es reposicionada atrás de la bifurcación de la arteria pulmonar reconstruida. La parte posterior del segmento distal de la arteria pulmonar se anastomosa al filo cefálico de la ventriculotomía derecha, formando el piso de la conexión del ventrículo derecho con la arteria pulmonar; finalmente se coloca un parche encima de la ventriculotomía derecha para conformar el techo de la vía de salida del ventrículo derecho utilizando una valva monocúspide en dicha vía (técnica de Lecompte).
La mayoría de los pacientes del grupo A tienen una anatomía óptima para la corrección definitiva en un solo tiempo quirúrgico, aunque algunos requieren una fístula sistémico-pulmonar como tratamiento inicial. En la actualidad es posible y preferible resolver las estenosis de las ramas pulmonares por medio de técnicas de cardiología intervencionista colocando prótesis endovasculares (stents).5,33,36,46,49,51,52
El grupo B se caracteriza por presentar algunos segmentos irrigados por colaterales aortopulmonares, lo que hace que las anomalías sean mas complejas y heterogéneas requiriendo varias intervenciones quirúrgicas como primer paso antes de la corrección definitiva que se realiza entre los dos y cinco años24,45 que consiste en conectar las ramas pulmonares ya unifocalizadas al ventrículo derecho. Es importante señalar que no todos los pacientes son candidatos a la corrección definitiva ya que la anatomía no siempre lo permite imposibilitando la reconstrucción de las ramas pulmonares para unirlas con el ventrículo derecho: sin embargo, la unifocalización brinda al paciente un flujo pulmonar balanceado, evitando las complicaciones producidas por flujo pulmonar disminuido o aumentado hacia determinados segmentos pulmonares. Dentro de los problemas reportados en este grupo que son causas principales de mala evolución postquirúrgica figuran la ventriculotomía derecha, las dificultades técnicas para conectar las ramas unifocalizadas, la insuficiencia ventricular derecha como consecuencia de la ventriculotomía y la ampliación del tracto de salida así como las estenosis de las ramas pulmonares después de los procedimientos de unifocalización.38
El grupo C se caracteriza por no tener arterias pulmonares centrales y todos los segmentos broncopulmonares se encuentran irrigados por colaterales aortopulmonares. La corrección definitiva depende de la existencia de ramas intraparenquimatosas adecuadas. Como ya se ha dicho, cuando las condiciones anatómicas del paciente no permiten la corrección definitiva, la unifocalización asegura un flujo pulmonar balanceado con mejor evolución del paciente.45 Recientemente, Abella67 publicó su experiencia con un novedoso procedimiento en el que la conexión ventrículo-pulmonar se establece utilizando todo el segmento aórtico de donde se originan las colaterales aortopulmonares.
En cuanto a la nomenclatura, el término de atresia pulmonar con comunicación interventricular no es el más adecuado ya que existen otras cardiopatías que presentan los mismos rasgos patológicos como son la doble salida de ventrículo derecho con aorta anterior y pulmonar posterior que presenta comunicación interventricular y válvula pulmonar atrésica; la transposición de las grandes arterias puede acompañarse de atresia pulmonar y de una comunicación interventricular; en algunos casos de ausencia de conexión atrioventricular derecha pueden presentar atresia de la válvula pulmonar en presencia de comunicación interventricular muy restrictiva.
Conclusiones
La tetralogía de Fallot con atresia pulmonar se caracteriza por una interrupción de la salida de sangre del ventrículo derecho hacia la circulación pulmonar con tendencia a la desaparición de la conexión vascular entre el infundíbulo del ventrículo derecho y las arterias intrapulmonares.
Debido a que se presenta una hiperdesviación anterior e izquierda del tabique troncoconal, patogenéticamente se incluye dentro del espectro anatómico de la tetralogía de Fallot, de ahí uno de sus nombres alternativos que es el de Fallot extremo.
Esta malformación congénita cardíaca se expresa anatómicamente como un espectro de grados de severidad patológica desde la atresia valvular pulmonar con infundíbulo y tronco de esta arteria permeables hasta el tronco aórtico solitario en el que desaparece por involución el tronco pulmonar y sus ramas así como el conducto arterioso, por lo que se desarrollan las antiguas conexiones vasculares entre el plexo arterial intrapulmonar y la aorta descendente que originan las colaterales aortopulmonares.
En esta cardiopatía las conexiones ventriculoarteriales son tres: concordante, doble salida de ventrículo derecho ambas con modo imperforado por atresia de la válvula pulmonar y única vía de salida por estar ausente la conexión entre el ventrículo derecho y la circulación arterial intrapulmonar, por lo que un solo vaso nace del corazón que es la aorta.
El conocimiento embriológico es fundamental para comprender la estructura de esta cardiopatía congénita, particularmente en sus conexiones vasculares con la circulación pulmonar.
Los siguientes elementos anatómicos son importantes por su repercusión hemodinámica y son determinantes para la elección de las estrategias quirúrgicas: tamaño del conducto, confluencia y grado de desarrollo de las ramas de la arteria pulmonar, número de colaterales aortopulmonares y su forma de conexión con las arterias intraparenquimatosas de cada lóbulo pulmonar y estenosis o dilatación de esas colaterales.
La tetralogía de Fallot con atresia pulmonar es una de las cardiopatías congénitas con alto grado de dificultad diagnóstica y de manejo quirúrgico por las características anatómicas tan variadas que presenta, de ahí la utilidad de la clasificación anatómica de Barbero-Marcial para el diagnóstico y el abordaje quirúrgico de esta compleja cardiopatía.
Correspondencia: Luis Muñoz Castellanos,
Departamento de Embriología, Instituto Nacional de Cardiología, Ignacio Chávez, Juan Badiano N° 1, Colonia Sección XVI, Tlalpan. México, D.F.
Tel. 5573 2911. Extensión: 1257
Correo electrónico:munoz-embriologia@hotmail.com
Recibido el 8 de junio de 2009;
aceptado el 14 de marzo de 2010.