La mortalidad de la disección aórtica en síndrome de Marfan (SM) es del 90% por lo que el manejo quirúrgico urgente con cirugía de reemplazo de raíz y aorta ascendente con injerto tubular valvulado denominado procedimiento de Bentall y de Bono (PBB) se considera de elección en estos pacientes. Esta técnica ha demostrado baja morbimortalidad con una sobrevida a los 5 y 10 años del 70-80% y del 50-70%, respectivamente; sin embargo, la mortalidad temprana está asociada a la presencia de choque cardiogénico el cual incrementa la mortalidad hasta 4 veces con un porcentaje de hasta el 80%1,2.
McCarthy et al. en un metaanálisis del uso de asistencia ventricular mediante oxigenación por membrana extracorpórea (ECMO) en choque cardiogénico, reportó que el choque cardiogénico poscardiotomía tiene la mortalidad más alta de todas las indicaciones del uso de la ECMO y en un análisis a 15 años del registro Extracorporeal Life Support Organization (ELSO) se reportó una sobrevida de tan solo del 15%3,4.
A pesar de los desalentadores resultados en la sobrevida de los pacientes con choque poscardiotomía con asistencia ventricular, este manejo está considerado en las guías actuales de tratamiento de la insuficiencia cardiaca aguda con una clase IIb, nivel de evidencia C5.
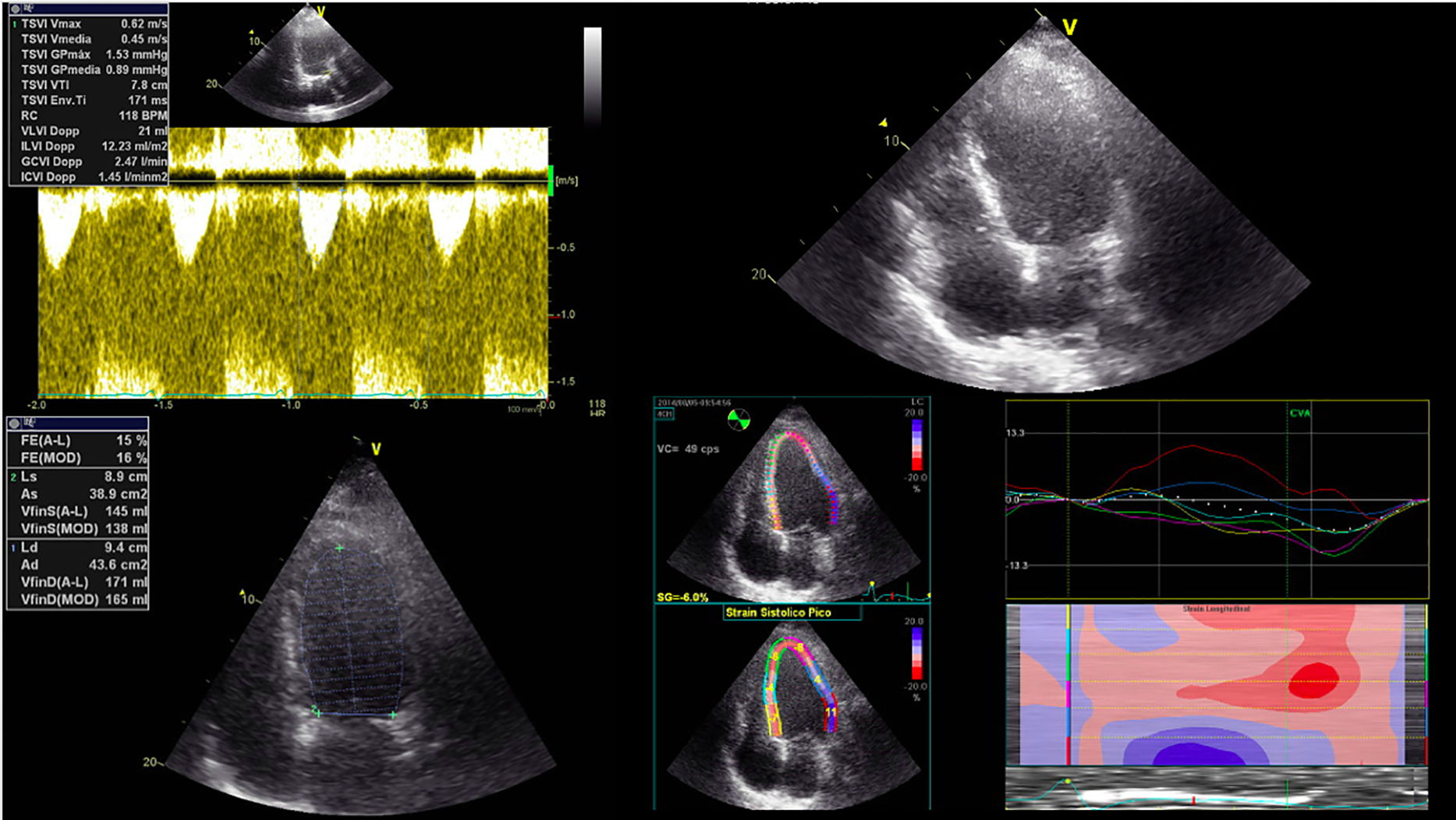
Presentación del casoMujer de 38 años con diagnóstico definitivo de SM. Ingresó al servicio de urgencias por dolor torácico típico de disección aórtica. Se le realizó una angiotomografía la cual reportó dilatación de aorta ascendente de 56.6mm y disección aórtica desde la raíz a nivel de los senos de Valsalva con flap de disección extendido al tronco braquiocefálico, aorta ascendente, arco aórtico, aorta descendente inmediatamente posterior al istmo, disección del segmento proximal de la carótida común derecha. Se le realizó PBB con prótesis aórtica biológica tipo INC, sustitución del arco aórtico, revascularización de troncos supraaórticos (revascularización extra anatómica de la subclavia izquierda) y reimplante de arterias coronarias. Se decidió utilizar un injerto valvulado fabricado en nuestro instituto con una válvula de manufactura propia de pericardio bovino además de un tubo de Dacron para la aorta ascendente y arco aórtico y no un injerto prefabricado porque en nuestra experiencia institucional, esto reduce los costes económicos y ofrece la misma utilidad. Tuvo un tiempo de circulación extracorpórea de 272min y pinzamiento aórtico de 197min. Evolucionó con hemorragia mayor a lo habitual, vasoplejía y choque cardiogénico. Se le realizó un ecocardiograma transtorácico en el cual se observó alteraciones del engrosamiento global y FE del 15% (fig. 1). Su perfil hemodinámico inicial con IC 1.3, PCP 15 y posteriormente, a pesar de optimizar precarga y del manejo con noradrenalina 40μg/min, vasopresina 10UI/h, dobutamina 10μg/kg/min y levosimendán 0.2μg/kg/min presentó hipotensión y bajo gasto cardiaco persistente, motivo por el cual se decidió colocar balón intraaórtico de contrapulsación y ECMO veno-arterial con canulación periférica femoral la cual fue realizada en quirófano. No se colocó cánula de reperfusión y no hubo complicaciones isquémicas del miembro pélvico documentadas; la decisión de realizar un abordaje femoral fue considerado por el equipo quirúrgico dado que la disección no se extendía a la aorta abdominal. La utilidad de utilizar ambos dispositivos fue disminuir la poscarga impuesta por la canulación de la ECMO. Los parámetros del oxigenador de la ECMO se ajustaron para obtener valores de saturación venosa mixta de O2>70%, PaCO2: 37-42mmHg, PaO2 en la sangre a la salida del oxigenador>300mmHg. Se anticoaguló con heparina no fraccionada en infusión continua con ajustes precisos para mantener un tiempo de coagulación activado (TCA) entre 160-180s. Esta anticoagulación se inició después de las primeras 24h para evitar hemorragia y el soporte ventricular se mantuvo durante 72h en conjunto con manejo presor, inotrópico y balón de contrapulsación intraaórtico de 40cc el cual se mantuvo por 72h más una vez retirado la ECMO. Evolucionó con lesión renal aguda con requerimiento de terapia lenta continua y posteriormente hemodiálisis intermitente. Presentó hígado de choque, coagulopatía por consumo, falla respiratoria, neumonía nosocomial, choque séptico, miopatía del enfermo en estado crítico. Tras el fracaso multiorgánico y la resolución paulatina del mismo, tuvo una hospitalización prolongada de 4 meses. Fue egresada a su domicilio con una FEVI del 10% con tratamiento médico para falla cardiaca y rehabilitación.
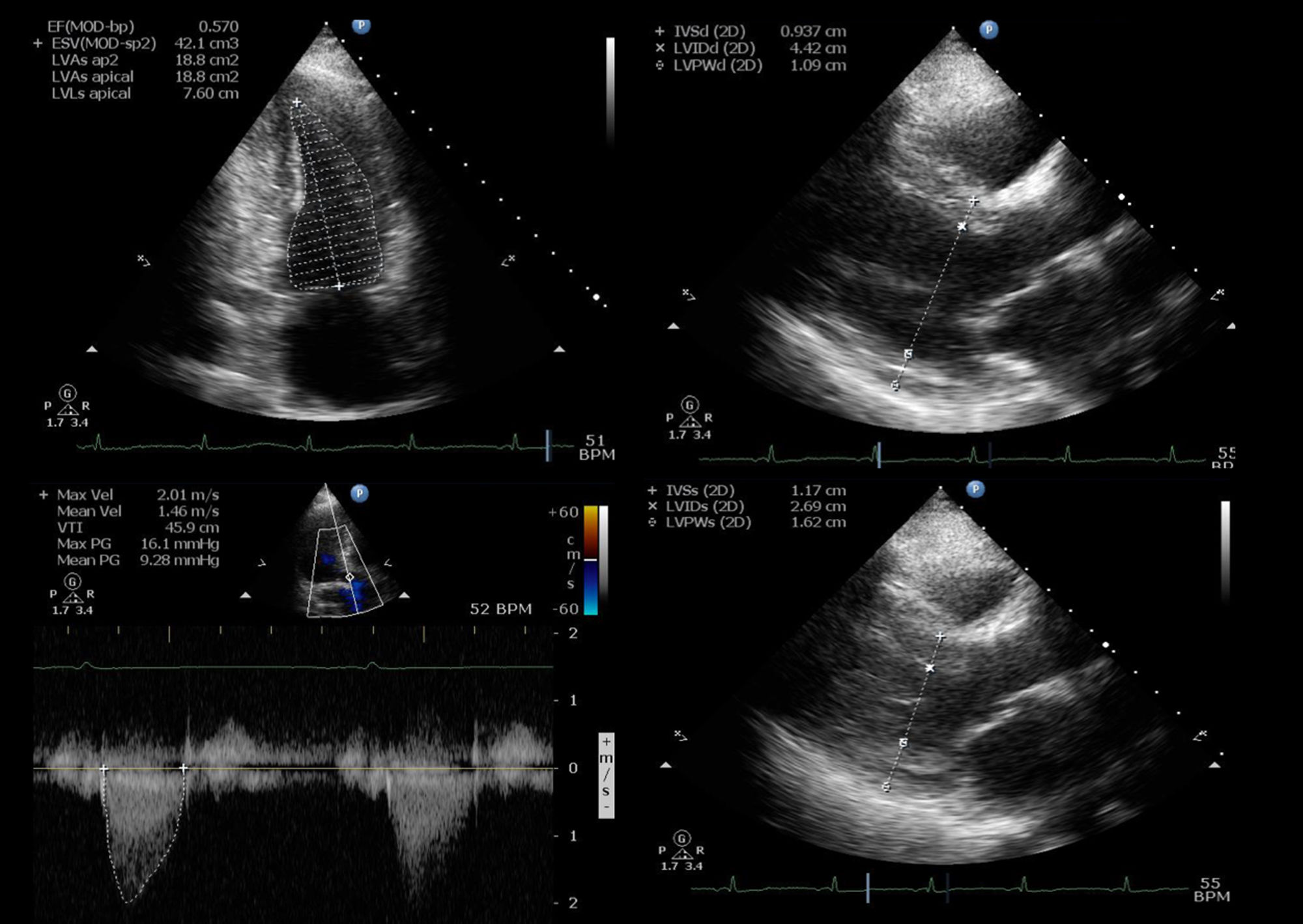
Actualmente, la paciente se encuentra en fase III de rehabilitación cardiaca en clase funcional I. Su ecocardiograma de 2016, reportó una FEVI del 56%, cavidades cardiacas sin dilatación, movilidad global y segmentaria en reposo normal y prótesis biológica aórtica normofuncionante (fig. 2).
DiscusiónEl choque cardiogénico poscardiotomía complica el 2-6% de todos los casos de cirugía cardiaca y es caracterizado por el desarrollo de un síndrome de bajo gasto cardiaco e hipoperfusión en el periodo postoperatorio temprano. Se define como refractario cuando cursa con hipoperfusión tisular, presión arterial sistólica menor a 90mmHg e índice cardiaco menor a 2l/min/m2 a pesar del manejo con balón de contrapulsación intraaórtico, soporte inotrópico y vasopresor, con una mortalidad hospitalaria del 50-80% y el manejo se orienta a la implantación de dispositivos de asistencia ventricular como en este caso. Los factores de riesgo para presentarlo son la edad avanzada, disfunción ventricular izquierda preexistente y tiempos prolongados de circulación extracorpórea y pinzamiento aórtico. El choque cardiogénico prequirúrgico es un factor independiente de mortalidad con RR 2.66. El tratamiento con soporte ventricular ECMO veno-arterial temprano es crucial en el tratamiento; provee un soporte hemodinámico biventricular completo con la ventaja principal de su implementación periférica rápida en la cama del paciente7,8.
El caso presentado muestra un paciente con SM y enfermedad aórtica compleja manejada con PBB y reconstrucción de arco aórtico con evolución con choque cardiogénico refractario el cual fue manejado según guías mexicanas e internacionales de tratamiento de la falla cardiaca aguda, inicialmente con optimización del entorno metabólico y de las determinantes del gasto cardiaco, tratamiento guiado por objetivos y monitorización hemodinámico invasivo con catéter Swan-Ganz, así como monitorización hemodinámica no invasiva guiada por ecocardiografía transtorácica. La ausencia de mejoría hemodinámica tras 30min de apoyo presor e inotrópico nos obligó a colocar balón de contrapulsación intraaórtico y la ausencia de mejoría en las siguientes horas, a implementar asistencia ventricular con ECMO veno-arterial9. La evolución hemodinámica fue buena, sin embargo, no suficiente para evitar la falla multiorgánica y las complicaciones crónicas e infecciosas esperadas de una hospitalización prolongada; sin embargo, el manejo multidisciplinario y la rehabilitación cardiaca iniciada culminaron con la recuperación total de la enferma.
Enfatizamos la importancia del manejo guiado por objetivos con implante temprano de dispositivos de asistencia ventricular para mejorar la atención y el pronóstico de estos pacientes.