En paÍses desarrollados, las tasas de mortalidad perinatal y materna1,2 han presentado un notable descenso en las últimas décadas, expresión entre otras de la calidad de la atención durante la gestación.
El seguimiento de embarazos sin necesidad de cuidados adicionales en atención primaria (AP) supone, básicamente, la realización de actividades de promoción y prevención de la salud, que deben iniciarse al manifestar la mujer deseo de gestación.
La consulta preconcepcional comprende una actualización de la situación clÍnica, detectar circunstancias subsidiarias de cuidados adicionales, recomendar la ingesta de 400 μg de ácido fólico, 1-2 meses antes de la concepción para evitar defectos del tubo neural (DTN)3-5 (recomendación fuerte), identificación de posibles riesgos de exposición laboral-ambiental (Ley 39/1999 de conciliación de la vida familiar y laboral)6, y promocionar hábitos saludables en la mujer y su pareja. En caso de antecedentes familiares o personales de enfermedades hereditarias o historia de complicaciones obstétricas previas, realizar consejo reproductivo. En mujeres con diabetes mellitus tipo 1, se recomienda aplazar la gestación hasta mantener cifras de hemoglobina glucosilada (HbA1c) < 6,5 los 6 meses anteriores a la concepción, por riesgo de malformaciones. Con HbA1c > 10 se debe desaconsejar la gestación7. Ofertar serologÍa para cribado de hepatitis C en visita preconcepcional mediante estrategia de alto riesgo puede evitar el embarazo en mujeres portadoras8 (recomendación débil).
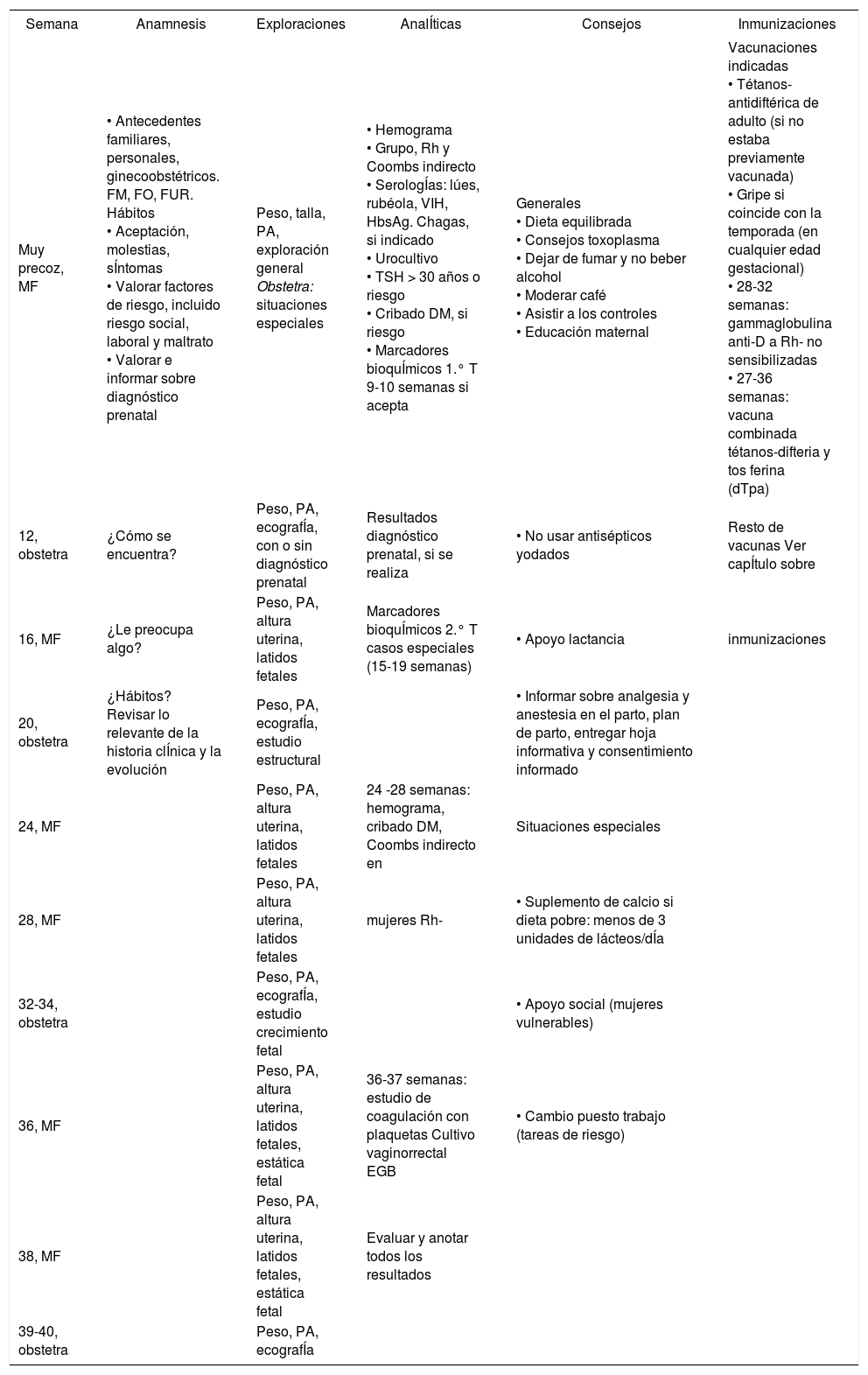
La primera visita será lo más precoz posible antes de la semana 12 de gestación. Se aconseja una visita/mes, ya que el seguimiento con más de 8-12 visitas no mejora los resultados9. Un menor número de visitas se asocia a peores resultados10 (recomendación débil). En la tabla 1 se recogen las intervenciones en el seguimiento de embarazos sin necesidad de cuidados adicionales en AP11.
Seguimiento del embarazo sin necesidad de cuidados adicionales (ESNCA)
| Semana | Anamnesis | Exploraciones | AnalÍticas | Consejos | Inmunizaciones |
|---|---|---|---|---|---|
| Muy precoz, MF | • Antecedentes familiares, personales, ginecoobstétricos. FM, FO, FUR. Hábitos • Aceptación, molestias, sÍntomas • Valorar factores de riesgo, incluido riesgo social, laboral y maltrato • Valorar e informar sobre diagnóstico prenatal | Peso, talla, PA, exploración general Obstetra: situaciones especiales | • Hemograma • Grupo, Rh y Coombs indirecto • SerologÍas: lúes, rubéola, VIH, HbsAg. Chagas, si indicado • Urocultivo • TSH > 30 años o riesgo • Cribado DM, si riesgo • Marcadores bioquÍmicos 1.° T 9-10 semanas si acepta | Generales • Dieta equilibrada • Consejos toxoplasma • Dejar de fumar y no beber alcohol • Moderar café • Asistir a los controles • Educación maternal | Vacunaciones indicadas • Tétanos-antidiftérica de adulto (si no estaba previamente vacunada) • Gripe si coincide con la temporada (en cualquier edad gestacional) • 28-32 semanas: gammaglobulina anti-D a Rh- no sensibilizadas • 27-36 semanas: vacuna combinada tétanos-difteria y tos ferina (dTpa) |
| 12, obstetra | ¿Cómo se encuentra? | Peso, PA, ecografÍa, con o sin diagnóstico prenatal | Resultados diagnóstico prenatal, si se realiza | • No usar antisépticos yodados | Resto de vacunas Ver capÍtulo sobre |
| 16, MF | ¿Le preocupa algo? | Peso, PA, altura uterina, latidos fetales | Marcadores bioquÍmicos 2.° T casos especiales (15-19 semanas) | • Apoyo lactancia | inmunizaciones |
| 20, obstetra | ¿Hábitos? Revisar lo relevante de la historia clÍnica y la evolución | Peso, PA, ecografÍa, estudio estructural | • Informar sobre analgesia y anestesia en el parto, plan de parto, entregar hoja informativa y consentimiento informado | ||
| 24, MF | Peso, PA, altura uterina, latidos fetales | 24 -28 semanas: hemograma, cribado DM, Coombs indirecto en | Situaciones especiales | ||
| 28, MF | Peso, PA, altura uterina, latidos fetales | mujeres Rh- | • Suplemento de calcio si dieta pobre: menos de 3 unidades de lácteos/dÍa | ||
| 32-34, obstetra | Peso, PA, ecografÍa, estudio crecimiento fetal | • Apoyo social (mujeres vulnerables) | |||
| 36, MF | Peso, PA, altura uterina, latidos fetales, estática fetal | 36-37 semanas: estudio de coagulación con plaquetas Cultivo vaginorrectal EGB | • Cambio puesto trabajo (tareas de riesgo) | ||
| 38, MF | Peso, PA, altura uterina, latidos fetales, estática fetal | Evaluar y anotar todos los resultados | |||
| 39-40, obstetra | Peso, PA, ecografÍa |
DM: diabetes mellitus; EGB: estreptococo grupo B; FM: fórmula menstrual; FO: fórmula obstétrica; FUR: fecha última regla; HbsAg: antÍgeno de superficie de la hepatitis B; MF: médico de familia; PA: pesión arterial.
Para prevenir la transmisión vertical de infecciones se recomienda solicitar a todas las mujeres al inicio del embarazo las siguientes serologÍas: lúes6,12,13 (recomendación débil); rubéola6,12,14 (recomendación fuerte), si es negativa vacunar tras el parto; virus de la inmunodeficiencia humana4,6,12,15 (recomendación fuerte); hepatitis B6,12,16 (recomendación fuerte). La serologÍa de toxoplasmosis no está recomendada, presenta un balance riesgo-beneficio negativo por la baja incidencia de la enfermedad, la dificultad diagnóstica y el riesgo teratogénico del tratamiento6,12,17. Se debe insistir mucho en las medidas preventivas18 (tabla 2) (recomendación débil). Ofertar serologÍa para cribado de enfermedad de Chagas a las mujeres procedentes de paÍses latinoamericanos con endemia6,19,20 (recomendación fuerte) (tabla 3). En portadoras, no hay indicación de cesárea. No realizar cribado de hepatitis C en gestantes21, ya que no existen estrategias efectivas para reducir el riesgo de transmisión (recomendación fuerte).
Recomendaciones frente a toxoplasma
|
Sorologia do Chagas
| Falsos positivos | Falsos negativos |
|---|---|
| Roaccion cruzada con los antigenos do loishmania, plasmodio, micobacteria tuberculosa y Treponema pallidum | Cuadros do inmunodoficioncias, pacientes ya tratados do enfermedad do Chagas y on portadores del VIH |
VIH: virus de la inmunodeficiencia humana.
Se debe prevenir la exposición a la hipertermia22. Son fármacos contraindicados en la gestación: dietilestilbestrol, talidomida, misoprostol, andrógenos, dosis > 5.000 U de vitamina A y retinoides. Ante dudas al prescribir un medicamento, se debe consultar siempre la ficha técnica actualizada (apartado 4.6: datos clÍnicos de uso en fertilidad, embarazo y lactancia) disponible on line en la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS): https://www.aemps.gob.es/cima/publico/home.html. Evitar la automedicación, pero no abandonar tratamientos especÍficos (antiepilépticos, antiasmáticos, hipertensión arterial) adecuándolos con los compatibles con el embarazo. Recomendar abandono del hábito tabáquico4,6 (recomendación fuerte). No tomar alcohol, no hay dosis segura4,6 (recomendación fuerte). Aconsejar bajar el consumo de cafeÍna a 50 mg/dÍa (1 taza de café contiene entre 100-150 mg), cifras > 300 mg/dÍa pueden inducir abortos, infertilidad y teratogenia23.
Para evitar los DTN se recomienda la ingesta diaria de 400 μg de ácido fólico, desde el diagnóstico de embarazo (si la mujer no lo tomó antes de la concepción) y continuar hasta el cierre del tubo neural, semana 12 de gestación3-5 (recomendación fuerte). En mujeres que han tenido un hijo anterior con DTN, diabéticas, obesidad con IMC > 35 y mujeres en tratamiento antiepiléptico, se recomienda una dosis diaria de 5 mg de ácido fólico (tabla 4). No se deben ofrecer suplementos de hierro sistemáticamente24. El cribado de anemia se realiza mediante la determinación de hemoglobina/hematocrito en la primera visita y otra entre las semanas 24-28 (recomendación débil), y un valor de hemoglobina < 11 g/dl es diagnóstico. La confirmación de anemia ferropénica se realiza con una determinación de ferritina sérica4,12 (recomendación fuerte).
Prevención con ácido fólico de los defectos del tubo neural (DTN)
|
IMC: Índice de masa corporal.
Durante el embarazo se produce un incremento de la función tiroidea, aumentando los requerimientos diarios de yodo, que pasa de 150 a 250 μg/dÍa. En estudios epidemiológicos españoles25, se ha constatado una mejorÍa en el déficit de yodo previo en población general. Se puede alcanzar una ingesta de yodo suficiente con el uso de sal yodada y la ingesta diaria de 3 raciones de lácteos o sus derivados25 (recomendación débil). Otros alimentos, como las legumbres y el pescado, también tienen un elevado contenido en yodo. No hay evidencia firme sobre beneficios y daños de los suplementos de yodo durante el embarazo26. La suplementación de yodo durante el embarazo y la lactancia actualmente no está justificada en España de forma generalizada6,26,27 (recomendación débil). En caso de gestantes que no tomen sal yodada ni leche de vaca o derivados, se puede indicar el suplemento de 200 μg/dÍa de yoduro potásico2,6,27 (recomendación débil). La Organización Mundial de la Salud (WHO 2007)28 recomienda yodar la sal de cocina para evitar el déficit de yodo en la población general. Solo en las regiones con déficit de yodo en la población, se aconseja la ingesta diaria de suplementos de 200 μg de yodo a las gestantes y durante la lactancia, para asegurar los requerimientos diarios.
Existe controversia sobre la realización del cribado sistemático de disfunción tiroidea en la gestación. Algunos grupos recomiendan el cribado sistemático29,30. Sin embargo, esta estrategia no ha demostrado beneficio en variables maternas o infantiles31. Se recomienda un cribado en gestantes con riesgo elevado de enfermedad tiroidea (tabla 5), de acuerdo con guÍas internacionales y nacionales32-34 (recomendación débil). El retraso en nuestro medio de la edad para concebir sÍ hace que haya un importante número de gestantes con más de 30 años e indicación de cribado. Existe un acuerdo sobre la indicación de tratamiento en el embarazo del hipotiroidismo clÍnico, niveles TSH > 10 independientemente de los valores de T4 libre. Hay controversia para el abordaje del hipotiroidismo subclÍnico, TSH > percentil 97,5 para valores de referencia propios y < 10 con T4 libre normal31,33. La levotiroxina es un fármaco seguro para tratar el hipotiroidismo. Si una mujer hipotiroidea con tratamiento queda embarazada, debe aumentarse inmediatamente la dosis un 30%, y ajustar la dosis en el curso del embarazo. Las pruebas de función tiroidea se deben interpretar con la utilización de rangos de TSH y T4 trimestre-especÍficos35.
Factores de riesgo para el cribado de enfermedad tiroidea en gestantes en la primera visita de embarazo
|
DM1: diabetes mellitus tipo 1.
Fuente: referencia 6.
Al inicio del embarazo se debe valorar el Índice de masa corporal, ya que la obesidad o la delgadez extrema se asocian con malos resultados obstétricos3,7,36 (recomendación fuerte).
Se debe realizar la toma de presión arterial en todas las visitas para cribado de preeclampsia2,3,7,37 (recomendación fuerte). Los estados hipertensivos inducidos por el embarazo son una de las 4 primeras causas de mortalidad materna y de morbilidad perinatal.
No se recomienda el cribado mediante determinación de proteinuria38,39 (recomendación débil). Actualmente se está llevando a cabo la prevención de preeclampsia en mujeres con factores de alto riesgo mediante uso de ácido acetilsalicÍlico 60-150 mg/dÍa desde el final del primer trimestre. Si bien los principales ensayos clÍnicos individuales no muestran, en general, resultados favorables40-43, guÍas de práctica clÍnica internacionales recomiendan esta práctica7,44,45. DeberÍa individualizarse el riesgo antes de tomar la decisión45-47.
A todas las gestantes se debe solicitar el grupo sanguÍneo, el factor Rh y el test de Coombs indirecto en la primera visita4,6,12 (recomendación fuerte). El test de Coombs indirecto debe repetirse en la semana 28 a las gestantes con Rh-4,6,12 (recomendación fuerte). La incidencia de isoinmunización ha descendido desde que se estableció la profilaxis con gammaglobulina especÍfica anti-D: en gestantes Rh– se recomienda administrar una dosis completa (300 mg) de inmunoglobulina anti-D si el test de Coombs indirecto es negativo en el tercer trimestre4,6,12 (recomendación fuerte). El cribado de bacteriuria asintomática (BA) para la prevención de complicaciones perinatales se debe realizar mediante solicitud de urocultivo en la primera visita4,6,12 (recomendación fuerte). La BA de la gestante (> 100.000 colonias/ml), incluida la BA por estreptococo del grupo B48, se debe tratar siempre.
No hay pruebas concluyentes de que la realización sistemática de ecografÍas mejore los resultados obstétricos. Se recomienda la realización de ecografÍa obstétrica en la semana 12 de gestación para cribado de gestaciones múltiples y malformaciones-cromosomopatÍas, y la realización de ecografÍa en el segundo trimestre, una vez completada la organogénesis, para cribado de malformaciones congénitas4,6 (recomendación fuerte). Se recomienda la auscultación de latidos fetales mediante Doppler a partir de la semana 12. No está recomendado el registro ecocardiotocográfico sistemáticamente anteparto.
Actualmente, en España, el 8-10% de los partos son partos pretérmino (PPT). Revisiones sistemáticas actuales muestran la reducción de la incidencia de PPT mediante cribado universal, en gestantes de 18-24 semanas, asintomáticas y con embarazo simple, a través de la medida ecográfica de la longitud cervical y tratamiento con progesterona (recomendación débil), aunque existe controversia debido a su reducido impacto en términos absolutos y en variables centradas en la paciente49,50.
La prevalencia de diabetes mellitus gestacional (DMG) en España oscila entre un 6 y un 8%. No hay pruebas suficientes para determinar si el cribado de DMG, o qué tipo de cribado, puede mejorar los resultados de salud materna e infantil. En general se recomienda realizar cribado universal en la semana 2451,52 (recomendación débil) o al inicio del embarazo si existen factores de riesgo que sugieran la existencia de una diabetes mellitus previa no diagnosticada53 (tabla 6). Para el cribado se utiliza el test de O’Sullivan. Si su resultado es ≥ 140 mg de glucemia debe realizarse un test diagnóstico de sobrecarga oral de glucosa (SOG), con 100 g de glucosa y 4 determinaciones de glucemia: basal, y a 1, 2 y 3 h de ingerir la glucosa. Se ha propuesto la realización alternativa del test de SOG con 75 g de glucosa y 3 determinaciones de glucemia: basal, y a 1 y 2 h de la ingesta de glucosa54-56, que es positivo con un solo valor alterado55. Esta estrategia se ha incorporado, entre otras, a las recomendaciones de la NICE52. La aplicación de esta estrategia aumenta el número de mujeres diagnosticadas de DMG, aunque no existe evidencia sobre los beneficios del tratamiento.
Factores de riesgo de diabetes gestacional (DG)
|
IMC: Índice de masa corporal.
Se recomienda realizar cultivo vaginorrectal a todas las gestantes entre las semanas 35 y 37 para prevenir la sepsis neonatal, la meningitis y las neumonÍas por Streptococcus agalactiae del grupo B (EGB)4,6,12,57 (recomendación débil). No hay que tratar a las portadoras. La profilaxis antibiótica se realiza cuando se inicia el parto.
Las técnicas de cribado del primer trimestre permiten valorar en la gestante el riesgo de ser portadora de un feto con alteración cromosómica58-60. El cribado en el primer trimestre o cribado combinado se realiza en 2 pasos, mediante la determinación en sangre materna de marcadores bioquÍmicos (proteÍna A plasmática asociada al embarazo y fracción β-libre de la gonadotropina coriónica humana [β-hCG]), que se realiza entre las semanas 9-10 de gestación, y el estudio ecográfico (traslucencia nucal, huesos nasales, ángulo facial, pulsatilidad del ductus venoso, regurgitación tricuspÍdea) entre las semanas 11-13 + 6 (recomendación fuerte). El cribado del segundo trimestre mediante marcadores bioquÍmicos (alfa-fetoproteÍna, β-hCG, estradiol no conjugado e inhibina A), se ofrecerá entre las semanas 15-19 de gestación solo a las gestantes en las que no se haya podido hacer el cribado del primer trimestre. Las técnicas diagnósticas son la biopsia corial en el primer trimestre y la amniocentesis en el segundo. Se está incorporando a los programas de cribado un nuevo test61-63 que detecta el ADN fetal en sangre materna. Es una prueba segura, la extracción sanguÍnea materna se puede realizar entre las semanas 10-22 de gestación y el resultado se puede tener en 1 semana. Al tratarse de una prueba de cribado, un resultado positivo requiere confirmación mediante biopsia corial o amniocentesis.
Se consideran vacunas seguras durante el embarazo aquellas en las que el material utilizado son virus o bacterias muertos o inactivados (gripe, hepatitis B). Cuando la gestación coincida con la época de gripe estacional, se recomienda6,64.66 vacunar a la embarazada (recomendación fuerte). Debido al aumento de incidencia de tosferina, actualmente se recomienda la vacunación de las embarazadas, preferiblemente en las semanas 28 a 32 (aunque se puede vacunar hasta la 36) con la vacuna dTPa (difteria, tétanos y pertussis acelular de baja carga antigénica) como estrategia para disminuir la transmisión de tosferina a los niños en los primeros meses de vida67-71 (recomendación fuerte). En caso de riesgo de exposición se pueden administrar las vacunas meningocócica, poliomielitis parenteral, rabia y hepatitis A.
No se dispone de información sobre la seguridad en el embarazo de las vacunas tifoidea parenteral y cólera. En caso necesario, realizar balance riesgo-beneficio. Durante el embarazo está contraindicada la administración de vacunas en las que el material usado sean virus o bacterias vivos o atenuados (sarampión, rubéola, parotiditis)72 (recomendación fuerte).
La guÍa CHEST 2012 recomienda valorar la indicación de tromboprofilaxis en embarazo y posparto de forma individualizada73 (recomendación débil). La enfermedad tromboembólica venosa es una de las principales causas de morbimortalidad materna; sin embargo, el impacto real de las medidas puede ser reducido. La mayorÍa de los casos son de trombosis venosa profunda y ocurren en el posparto74.
Prevención de embarazos no planificadosIntroducción y magnitud del problemaLas actividades preventivas en anticoncepción deben estar dirigidas a ayudar a mujeres y varones a planificar y espaciar los embarazos, evitar embarazos no planificados (ENP) y reducir el número de abortos. Estas actividades anticonceptivas se deben ofrecer con unos criterios de calidad que parten de un conocimiento cientÍfico actualizado, garantizando una información centrada en el/la paciente sobre la seguridad y efectividad de los diferentes métodos, en el momento que la demanda y con un servicio eficiente, accesible y con equidad1.
La tasa de interrupciones voluntarias del embarazo (IVE) por 1.000 mujeres de entre 15 y 44 años de edad en España ha tenido una tendencia creciente hasta el año 2011, con una disminución progresiva pasando de una tasa, ese año, de 12,47 a 10,36 en 2016, lo que supone 93.131 IVE2. Desde que en 2009 entró en vigor la libre dispensación de la pÍl- dora anticonceptiva de urgencia (PAU) de levonorgestrel (LNG) su venta en farmacias ha ido aumentando, desde las 331.000 unidades del año 2008 a las 825.865 en 20113. En España y Reino Unido, solo un tercio de las usuarias de PAU la obtienen directamente en la farmacia, mientras que los otros dos tercios los obtienen en centros de salud u hospitales 4.
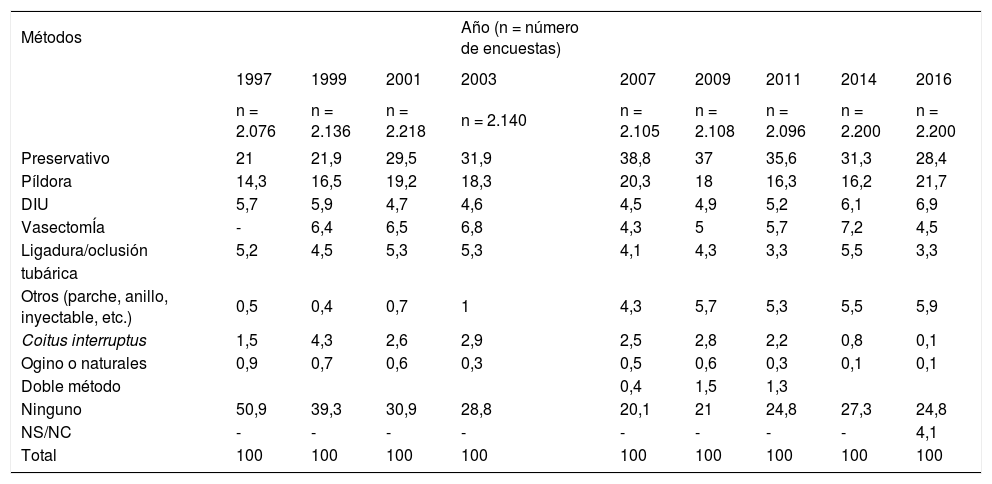
Una encuesta sobre uso de anticonceptivos entre las mujeres españolas (tabla 1) en el año 2016 estima que el 24,7% de las mujeres en edad fértil no utiliza ningún método anticonceptivo, aunque tan solo el 16,4% del total tiene riesgo real de quedar embarazada5. Estos datos apuntan a un elevado uso de anticonceptivos; esto sugiere que buena parte de los ENP se producen por mal uso o problemas de cumplimiento con el método elegido6-8.
Utilización de métodos anticonceptivos en España 1997-2015 en mujeres de 15-49 años (%)
| Métodos | Año (n = número de encuestas) | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1997 | 1999 | 2001 | 2003 | 2007 | 2009 | 2011 | 2014 | 2016 | |
| n = 2.076 | n = 2.136 | n = 2.218 | n = 2.140 | n = 2.105 | n = 2.108 | n = 2.096 | n = 2.200 | n = 2.200 | |
| Preservativo | 21 | 21,9 | 29,5 | 31,9 | 38,8 | 37 | 35,6 | 31,3 | 28,4 |
| Píldora | 14,3 | 16,5 | 19,2 | 18,3 | 20,3 | 18 | 16,3 | 16,2 | 21,7 |
| DIU | 5,7 | 5,9 | 4,7 | 4,6 | 4,5 | 4,9 | 5,2 | 6,1 | 6,9 |
| VasectomÍa | - | 6,4 | 6,5 | 6,8 | 4,3 | 5 | 5,7 | 7,2 | 4,5 |
| Ligadura/oclusión | 5,2 | 4,5 | 5,3 | 5,3 | 4,1 | 4,3 | 3,3 | 5,5 | 3,3 |
| tubárica | |||||||||
| Otros (parche, anillo, inyectable, etc.) | 0,5 | 0,4 | 0,7 | 1 | 4,3 | 5,7 | 5,3 | 5,5 | 5,9 |
| Coitus interruptus | 1,5 | 4,3 | 2,6 | 2,9 | 2,5 | 2,8 | 2,2 | 0,8 | 0,1 |
| Ogino o naturales | 0,9 | 0,7 | 0,6 | 0,3 | 0,5 | 0,6 | 0,3 | 0,1 | 0,1 |
| Doble método | 0,4 | 1,5 | 1,3 | ||||||
| Ninguno | 50,9 | 39,3 | 30,9 | 28,8 | 20,1 | 21 | 24,8 | 27,3 | 24,8 |
| NS/NC | - | - | - | - | - | - | - | - | 4,1 |
| Total | 100 | 100 | 100 | 100 | 100 | 100 | 100 | 100 | 100 |
DIU: dispositivo intrauterino. NS/NC: no sabe/no contesta.
Fuente: referencias 5 y 6.
En el ámbito de la AP se plantean diferentes estrategias para abordar las actividades preventivas en anticoncepción.
Cribado oportunista, consejo contraceptivo y estrategias de intervenciónLa evidencia sobre la efectividad del consejo contraceptivo estructurado en diferentes ámbitos asistenciales es limitada y con resultados controvertidos9. La mayorÍa de los estudios cuenta con importantes limitaciones metodológicas10-12. Si hace años el USPSTF suprimió el consejo de sus recomendaciones13, otros organismos proponen incluirlo14. Estudios observacionales que analizan el impacto del consejo contraceptivo facilitado en el ámbito de la AP concluyen que se asocia a un incremento de uso de los anticonceptivos hormonales y puede reducir los ENP15.
La efectividad del consejo depende de su contenido, teniendo en cuenta los intereses individuales y los grupos de edad16,17. Hay evidencia de efectividad en el posparto con la entrega de hojas informativas y la visita puerperal a domicilio18-20. Las evidencias sobre la mejora del uso de anticonceptivos basadas en teléfonos móviles son aún limitadas21. Algunas intervenciones efectuadas en el medio escolar y en centros de planificación familiar parecen ayudar a prevenir los ENP22,23. Los programas más efectivos son los que no se limitan a dar información acerca de la sexualidad y la anticoncepción, sino que ofrecen acceso a los métodos y apoyo psicológico, aunque la efectividad desaparece cuando se interrumpen estas actividades.
Los médicos de familia (MF), en consulta, deben descartar la posibilidad de embarazo al prescribir fármacos con potencial teratógeno, o al solicitar estudios radiológicos24. Al realizar el consejo personalizado25, deben mantener actualizados los criterios médicos para elegir un anticonceptivo26 (tabla 2), orientar cómo usarlos de manera segura y eficaz27, y abordar la anticoncepción como una actividad preventiva más. La revisión sistemática Cochrane 2013 destaca como crucial para hacer una elección informada el conocimiento sobre la efectividad de cada método28.
CategorÍas de la OMS de las condiciones que afectan a la elegibilidad de los anticonceptivos
|
Fuente: referencia 26.
La eficacia anticonceptiva se evalúa midiendo el Índice de Pearl, número de fallos por cada 100 mujeres-año de exposición (tabla 3)29. Para el abordaje clÍnico se debe tener en cuenta, sobre todo, la eficacia real, el “uso tÍpico”, las cifras de continuidad de uso, la aceptabilidad y no tanto el “uso perfecto”. Para la mayorÍa de los métodos hay evidencia de alta eficacia. La mayorÍa de las mujeres sobrestima la eficacia de pÍldoras y preservativos30.
Anticonceptivos reversibles de larga duración
| Uso tipico (tasa de fallos, %) | Uso perfecto (tasa de fallos, %) | Continuidad al ano (%) | Retorno de la fertilidad | Composicion | Duracion de la eficacia | |
|---|---|---|---|---|---|---|
| Implante subcutaneo | 0,05 | 0,05 | 84 | 1 mes | Etonogestrel | 3 anos |
| DIU-LNG | 0,2 | 0,2 | 80 | Inmediato | Levonorgestrel | 5 anos |
| DIU cobre | 0,8 | 0,6 | 78 | Inmediato | Cobre | 5-10 anos |
| Inyeccion trimestral | 3 | 0,3 | 56 | 6 meses | AMP | 3 meses |
AMP: acetato de medroxiprogesterona; DIU: dispositivo intrauterine; LNG: levonorgestrel.
Fuente: elaboracion propia.
Los anticonceptivos reversibles de larga duración (ARLD) son métodos que no requieren cumplimiento y son los más coste-efectivos (tabla 4) en todos los grupos de edad31. Estos métodos están infrautilizados en España, donde solo un 6,1% de las mujeres en edad fértil utiliza el dispositivo intrauterino (DIU), frente a un 25% en los paÍses nórdicos32,33.
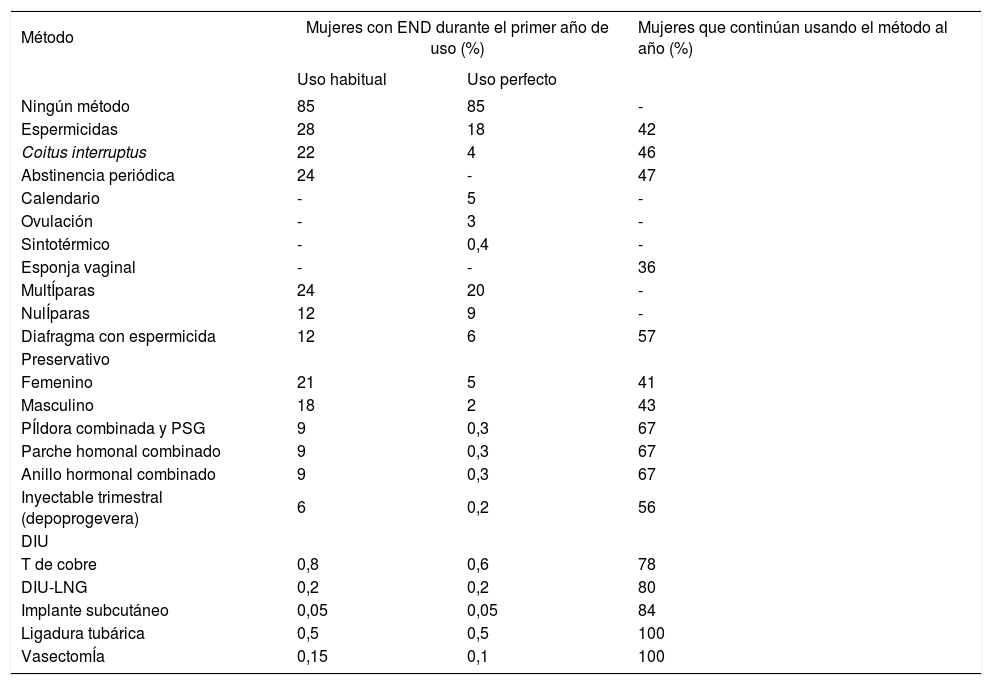
Mujeres que experimentan un embarazo no deseado (END) durante el primer año de uso y mujeres que continúan usando el método al final del primer año (Estados Unidos)
| Método | Mujeres con END durante el primer año de uso (%) | Mujeres que continúan usando el método al año (%) | |
|---|---|---|---|
| Uso habitual | Uso perfecto | ||
| Ningún método | 85 | 85 | - |
| Espermicidas | 28 | 18 | 42 |
| Coitus interruptus | 22 | 4 | 46 |
| Abstinencia periódica | 24 | - | 47 |
| Calendario | - | 5 | - |
| Ovulación | - | 3 | - |
| Sintotérmico | - | 0,4 | - |
| Esponja vaginal | - | - | 36 |
| MultÍparas | 24 | 20 | - |
| NulÍparas | 12 | 9 | - |
| Diafragma con espermicida | 12 | 6 | 57 |
| Preservativo | |||
| Femenino | 21 | 5 | 41 |
| Masculino | 18 | 2 | 43 |
| PÍldora combinada y PSG | 9 | 0,3 | 67 |
| Parche homonal combinado | 9 | 0,3 | 67 |
| Anillo hormonal combinado | 9 | 0,3 | 67 |
| Inyectable trimestral (depoprogevera) | 6 | 0,2 | 56 |
| DIU | |||
| T de cobre | 0,8 | 0,6 | 78 |
| DIU-LNG | 0,2 | 0,2 | 80 |
| Implante subcutáneo | 0,05 | 0,05 | 84 |
| Ligadura tubárica | 0,5 | 0,5 | 100 |
| VasectomÍa | 0,15 | 0,1 | 100 |
DIU: dispositivo intrauterino; LNG: levonorgestrel; PSG: pÍldora solo gestágenos.
Fuente: referencia 29.
Se implementan estrategias para su utilización en AP34-36. Entre las mujeres adolescentes incluidas en el proyecto CHOICE, la gran mayorÍa preferÍa un ARLD37. En adolescentes, los ARLD han demostrado reducir las tasas de embarazos, partos y abortos38. Se podrÍa doblar su uso si se retiran las barreras de acceso para la inserción39-41. Se debe estar atento a los nuevos datos sobre efectividad en los métodos de más reciente comercialización42. En este sentido, los últimos datos de fallos de DIU de cobre (0,52%) y de LNG (0,06%)43 son inferiores que los de la ligadura tubárica (2%) y Essure (2,4%)44. Essure, actualmente retirado de nuestro medio, parece ser menos eficaz de lo que inicialmente se describÍa.
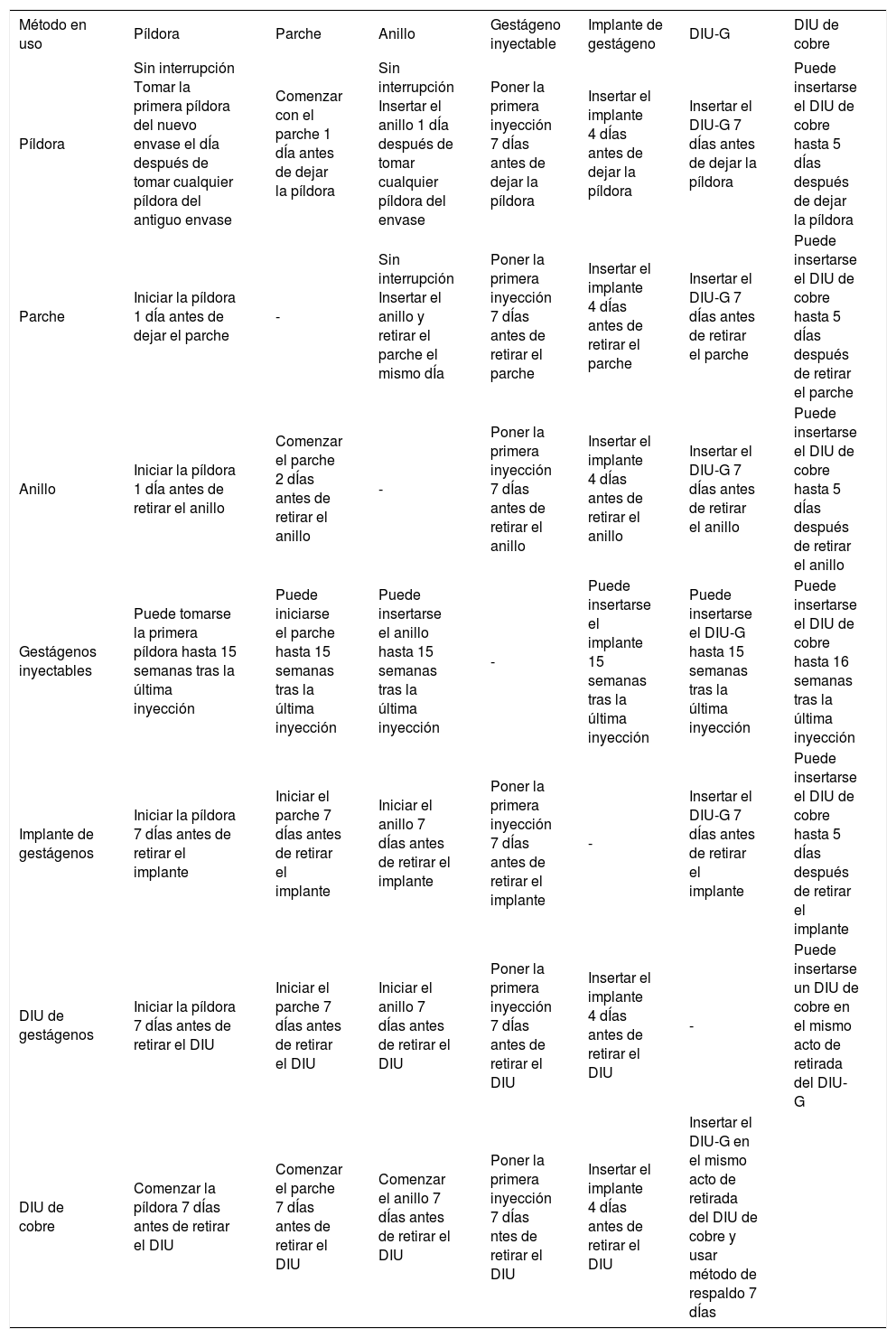
Al dejar un método para pasar a otro, se deben evitar las interrupciones, solapándolos cuando sea necesario hasta que el nuevo método sea ya eficaz (tabla 5)45.
Prevención de la desprotección en los cambios de anticonceptivos: pautas de cambio
| Método en uso | Píldora | Parche | Anillo | Gestágeno inyectable | Implante de gestágeno | DIU-G | DIU de cobre |
|---|---|---|---|---|---|---|---|
| Píldora | Sin interrupción Tomar la primera píldora del nuevo envase el dÍa después de tomar cualquier píldora del antiguo envase | Comenzar con el parche 1 dÍa antes de dejar la píldora | Sin interrupción Insertar el anillo 1 dÍa después de tomar cualquier píldora del envase | Poner la primera inyección 7 dÍas antes de dejar la píldora | Insertar el implante 4 dÍas antes de dejar la píldora | Insertar el DIU-G 7 dÍas antes de dejar la píldora | Puede insertarse el DIU de cobre hasta 5 dÍas después de dejar la píldora |
| Parche | Iniciar la píldora 1 dÍa antes de dejar el parche | - | Sin interrupción Insertar el anillo y retirar el parche el mismo dÍa | Poner la primera inyección 7 dÍas antes de retirar el parche | Insertar el implante 4 dÍas antes de retirar el parche | Insertar el DIU-G 7 dÍas antes de retirar el parche | Puede insertarse el DIU de cobre hasta 5 dÍas después de retirar el parche |
| Anillo | Iniciar la píldora 1 dÍa antes de retirar el anillo | Comenzar el parche 2 dÍas antes de retirar el anillo | - | Poner la primera inyección 7 dÍas antes de retirar el anillo | Insertar el implante 4 dÍas antes de retirar el anillo | Insertar el DIU-G 7 dÍas antes de retirar el anillo | Puede insertarse el DIU de cobre hasta 5 dÍas después de retirar el anillo |
| Gestágenos inyectables | Puede tomarse la primera píldora hasta 15 semanas tras la última inyección | Puede iniciarse el parche hasta 15 semanas tras la última inyección | Puede insertarse el anillo hasta 15 semanas tras la última inyección | - | Puede insertarse el implante 15 semanas tras la última inyección | Puede insertarse el DIU-G hasta 15 semanas tras la última inyección | Puede insertarse el DIU de cobre hasta 16 semanas tras la última inyección |
| Implante de gestágenos | Iniciar la píldora 7 dÍas antes de retirar el implante | Iniciar el parche 7 dÍas antes de retirar el implante | Iniciar el anillo 7 dÍas antes de retirar el implante | Poner la primera inyección 7 dÍas antes de retirar el implante | - | Insertar el DIU-G 7 dÍas antes de retirar el implante | Puede insertarse el DIU de cobre hasta 5 dÍas después de retirar el implante |
| DIU de gestágenos | Iniciar la píldora 7 dÍas antes de retirar el DIU | Iniciar el parche 7 dÍas antes de retirar el DIU | Iniciar el anillo 7 dÍas antes de retirar el DIU | Poner la primera inyección 7 dÍas antes de retirar el DIU | Insertar el implante 4 dÍas antes de retirar el DIU | - | Puede insertarse un DIU de cobre en el mismo acto de retirada del DIU-G |
| DIU de cobre | Comenzar la píldora 7 dÍas antes de retirar el DIU | Comenzar el parche 7 dÍas antes de retirar el DIU | Comenzar el anillo 7 dÍas antes de retirar el DIU | Poner la primera inyección 7 dÍas ntes de retirar el DIU | Insertar el implante 4 dÍas antes de retirar el DIU | Insertar el DIU-G en el mismo acto de retirada del DIU de cobre y usar método de respaldo 7 dÍas |
DIU-G: dispositivo intrauterino de gestágeno.
Fuente: referencia 45.
No hay estudios especÍficos sobre los requisitos previos ni sobre los controles posteriores que se deben realizar. Hay opiniones de expertos, conferencias de consenso46-50, excelentes revisiones bibliográficas51 y estudios especÍficos acerca de algunas exploraciones52.
Para iniciar un anticonceptivo hormonal combinado (AHC) se debe realizar una historia clÍnica personal y familiar, especialmente orientada hacia la detección de contraindicaciones (tablas 6 a 8) y de factores de riesgo cardiovascular, medir la presión arterial, pesar e informar a la mujer53-56. No se recomienda el screening rutinario de trombofilia ni dislipemia25. Una visita de seguimiento a los 3-6 meses parece útil para reforzar el cumplimiento. Anualmente se recomienda medir la presión arterial y actualizar la historia clÍnica. La evidencia cientÍfica no justifica la realización de descansos durante el uso de AHC29. La seguridad de los AHC se ha estudiado ampliamente. El uso de AHC durante las etapas iniciales del embarazo no se asocia a la aparición de defectos congénitos57.
Contraindicaciones de los anticonceptivos hormonales combinados (AHC)
| CategorÍas OMS | |
|---|---|
| Lactancia: < 6 semanas posparto/6 semanas-6 meses posparto | 4/3 |
| Posparto < 21 dÍas (+ factores riesgo TEV)/> 21 dÍas (+ factores riesgo TEV) | 3 (4)/2 (3) |
| Fumadora > 35 años: < 15 cigarrillos/dÍa/> 15 cigarillos/dÍa | 3/4 |
| Múltiples factores de riesgo cardiovascular: previo/durante el uso | 3/4 |
| HTA(mmHg): historia-HTA buen control/PAS 140-159 o PAD 90-99/PAS > 160 o PAD > 100/enfermedad vascular | 3/4/4 |
| TVP y/o TEP: historia/en fase aguda, con o sin terapia anticoagulante | 4/4 |
| CirugÍa mayor con inmovilización prolongada | 4 |
| Trombofilia con mutaciones conocidas | 4 |
| CardiopatÍa isquémica: actual o historia | 4 |
| Ictus: actual o historia | 4 |
| ValvulopatÍa cardÍaca complicada (hipertensión pulmonar, FA, historia de endocarditis bacteriana subaguda) | 4 |
| LES con anticuerpos antifosfolÍpidos+ o no conocidos | 4 |
| Migraña: sin aura < 35 años aparece durante uso/> 35 historia-aparece durante uso/con aura | 3/3-4/4 |
| Cáncer de mama: sin recurrencia en 5 años/en curso | 3/4 |
| DM con nefropatÍa, retinopatÍa, neuropatÍa/otra enfermedad vascular/> 20 años | 3-4* |
| Litiasis vesicular sintomática activa y/o con tratamiento médico | 3/2 CIC |
| Historia de colestasis relacionada con AHC | 3/2 CIC |
| Hepatitis viral aguda | 3-4* I |
| Cirrosis grave (descompensada). Adenoma | 4/3 CIC |
| Carcinoma hepático | 4/3-4* CIC |
| Interacciones: fenitoÍna, carbamazepina, barbitúricos, primidona, topiramato, oxcarbazepina, rifampicina, | 3/2 CIC |
| rifabutina | |
| Interacciones: lamotrigina | 3 |
CIC: anticonceptivo inyectable combinado; DM: diabetes mellitus; FA: fibrilación auricular; HTA: hipertensión arterial; I: inicio;
LES: lupus eritematoso sistémico; PAD: presión arterial diastólica; PAS: presión arterial sistólica; TEP: tromboembolia pulmonar;
TVP: tromboembolia venosa profunda.
Contraindicaciones de los anticonceptivos hormonales de solo gestágeno (AHSG)
| CategorÍa OMS | |
|---|---|
| Lactancia < 6 semanas posparto | 3 AMP |
| Múltiples factores de riesgo cardiovascular | 3 AMP |
| HTA con sistólica > 160 o diastólica > 100, o con enfermedad vascular | 3 AMP |
| TVP/TEP en fase aguda sin tratamiento anticoagulante establecido | 3 todos |
| CardiopatÍa isquémica: historia/durante el uso | 3 AMP/3 todos |
| Ictus: historia/durante el uso | 3 AMP/3 todos |
| LES: anticuerpos antifosfolÍpido+ o no conocidos/historia trombocitopenia grave | 3 todos/3 AMP |
| Migraña con aura durante el uso | 3 todos |
| Hemorragia vaginal inexplicada (no evaluado) | 3 AMP e ISG |
| Cáncer de mama: sin recurrencia 5 años/activo | 3 todos/4 todos |
| DM y nefropatÍa, retinopatÍa o neuropatÍa | 3 AMP |
| Otra enfermedad vascular o DM de > 20 años de evolución | 3 AMP |
| Cirrosis hepática grave (descompensada). Adenoma. Cáncer hepático | 3 todos |
| Interacciones: fenitoÍna, carbamazepina, barbitúricos, primidona, topiramato, oxcarbazepina, | 3 PSG |
| rifampicina |
AMP: acetato de medroxiprogesterona; DM: diabetes mellitus; HTA: hipertensión arterial; ISG: implante subcutáneo gestágeno;
LES: lupus eritematoso sistémico; PSG: pildora solo gestágeno; TEP: tromboembolia pulmonar; TVP: tromboembolia venosa profunda.
Fuente: referencia 26.
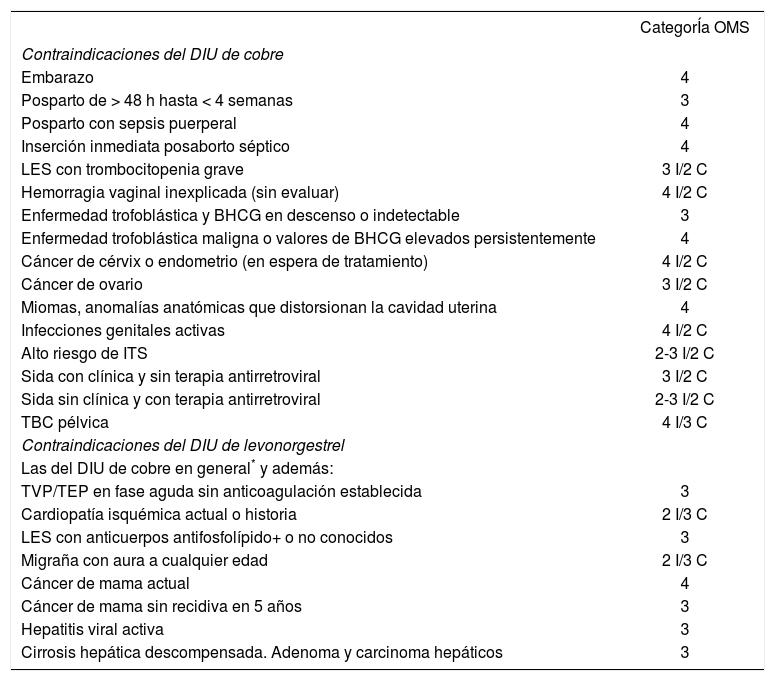
Contraindicaciones del dispositivo intrauterino (DIU)
| CategorÍa OMS | |
|---|---|
| Contraindicaciones del DIU de cobre | |
| Embarazo | 4 |
| Posparto de > 48 h hasta < 4 semanas | 3 |
| Posparto con sepsis puerperal | 4 |
| Inserción inmediata posaborto séptico | 4 |
| LES con trombocitopenia grave | 3 I/2 C |
| Hemorragia vaginal inexplicada (sin evaluar) | 4 I/2 C |
| Enfermedad trofoblástica y BHCG en descenso o indetectable | 3 |
| Enfermedad trofoblástica maligna o valores de BHCG elevados persistentemente | 4 |
| Cáncer de cérvix o endometrio (en espera de tratamiento) | 4 I/2 C |
| Cáncer de ovario | 3 I/2 C |
| Miomas, anomalías anatómicas que distorsionan la cavidad uterina | 4 |
| Infecciones genitales activas | 4 I/2 C |
| Alto riesgo de ITS | 2-3 I/2 C |
| Sida con clínica y sin terapia antirretroviral | 3 I/2 C |
| Sida sin clínica y con terapia antirretroviral | 2-3 I/2 C |
| TBC pélvica | 4 I/3 C |
| Contraindicaciones del DIU de levonorgestrel | |
| Las del DIU de cobre en general* y además: | |
| TVP/TEP en fase aguda sin anticoagulación establecida | 3 |
| Cardiopatía isquémica actual o historia | 2 I/3 C |
| LES con anticuerpos antifosfolípido+ o no conocidos | 3 |
| Migraña con aura a cualquier edad | 2 I/3 C |
| Cáncer de mama actual | 4 |
| Cáncer de mama sin recidiva en 5 años | 3 |
| Hepatitis viral activa | 3 |
| Cirrosis hepática descompensada. Adenoma y carcinoma hepáticos | 3 |
BHCG: beta-gonadotropina coriónica humana; C: continuación; I: inicio; ITS: infección de transmisión sexual; LES: lupus eritematoso sistémico; sida: síndrome de la inmunodeficiencia adquirida; TBC: tuberculosis. TEP: tromboembolia pulmonar; TVP; tromboembolia venosa profunda.
La European Medicines Agency y una reciente revisión sistemática confirman que el riesgo de tromboembolia venosa (TEV) es pequeño, del orden de 20-40 casos por 100.000 mujeres/año de uso, y varÍa entre los distintos AHC estudiados. En el rango superior están los AHC de tercera y cuarta generaciones. Todos los AHC se asocian con un aumento del riesgo de TEV y confirman que este riesgo es pequeño, como norma general, y que depende del progestágeno utilizado y de la dosis de etinilestradiol. El riesgo de TEV de los AHC con 30 a 35 mg de etinilestradiol y gestodeno, desogestrel, acetato de ciproterona y drospirenona fue similar y aproximadamente un 50-80% mayor que con LNG58. Los más seguros son los que contienen LNG o norgestimato, sin que existan diferencias en función de la vÍa de administra- ción59,60. Los nuevos preparados con estradiol, frente a los clásicos con EE, buscan la reducción del riesgo de TEV, sin significación estadÍstica hasta ahora, y se necesitan series más grandes para sacar conclusiones61.
Respecto al cáncer de mama y su relación con “todos” los anticonceptivos hormonales, se ha descrito recientemente un riesgo relativo de 1,20 en mujeres que los usan o han usado recientemente62. Un aumento muy bajo, en términos absolutos, frente al efecto anticonceptivo, beneficios adicionales sobre dismenorrea y menorragia, y la reducción global del cáncer, a expensas de una significativa disminución del riesgo de cáncer de ovario, endometrio y colon63.
Antes de insertar un DIU hay que realizar la historia clínica, una exploración pélvica con histerometría e informar e insertar en día óptimo. En una visita 1-3 meses posintervención se deben visualizar los hilos por el orificio cervical y valorar la tolerancia. Si se realiza autopalpación de los hilos, no se precisarían revisiones posteriores64. No hay evidencia para realizar más pruebas. En situaciones especiales, realizar prescripción y seguimiento adaptados65. En las mujeres en la década de los 40, también se puede usar el DIU de cobre. Siempre descartar contraindicaciones (tabla 8).
Anticoncepción de urgenciaHay sólida evidencia de la eficacia de varios métodos de anticoncepción de urgencia (AU) (tabla 9)66. El método más eficaz en AU es el DIU de cobre67. Cuando una mujer solicita la AU, cualquiera que sea su edad, el coito no protegido (CNP) ya ha ocurrido y el tiempo no tiene marcha atrás. Las PAU no tienen contraindicaciones, inhiben o retrasan la ovulación, no son abortivas y pueden evitar el embarazo y los abortos derivados de los ENP68. La PAU de ulipristal acetato (UPA) impide, significativamente, más embarazos que la PAU de LNG en las 72-120 h tras el CNP, debido a que, cuando la ovulación es inminente, el UPA es más eficaz que el LNG en retrasarla, ya que impide la rotura de folículos con mayor tamaño. Algunos estudios apuntan un posible menor efecto del LNG en las mujeres obesas69,70, en las que los niveles plasmáticos son menores, por lo que doblar la dosis en ellas puede ser razonable71. Con UPA, los niveles son iguales en obesas y no obesas.
Métodos de anticoncepción de urgencia disponibles
| Dosis | Fallos (%) | Plazo uso | Prescripción médica | |
|---|---|---|---|---|
| Píldora LNG | 1,5 mg (DU) | 1,1a 1,5b 2,2c | 72 y 120 h tras CNP | No |
| Píldora ulipristal | 30 mg (DU) | 1,4c | 72 y 120 h tras CNP | No |
| Píldoras EE + LNG (Yuzpe)d | 0,1 mg EE + 0,5 mg LNG (2 dosis, 12 h intervalo) | 3,2a | 72 h tras CNP | Sí |
| DIU de cobre | Alta carga de cobre, > 300 mm2 | 0d | 5 días tras CNP 5 días tras día estimado ovulación | SíDosis |
CNP: coito no protegido; DU: dosis única; EE: etinilestradiol; LNG: levonorgestrel.
* La pauta de Yuzpe, en desuso, puede hacerse con preparados de anticonceptivos orales combinados.
Se recomienda iniciar otro método eficaz, al día siguiente de tomar PAU de LNG, prescribiéndolo a la vez72. Con UPA, no debe iniciarse otro método hormonal hasta que pasen al menos 5 días.
Accesibilidad, información y atención a la anticoncepción en los centros de saludLos MF, dada su accesibilidad, favorecen la anticoncepción si manejan en sus consultas todos los métodos anticonceptivos reversibles. La consulta a demanda del MF es la mejor opción para abordar la anticoncepción, respondiendo al criterio de buena práctica de aprovechar la oportunidad1. Las consultas programadas, las específicas de la mujer, suelen ser menos accesibles, menos discretas, y la demora en la atención aumenta el riesgo de ENP73. Las mejoras en anticoncepción pasan por una mayor utilización de los ARLD74. Es clave aumentar el uso de DIU e implantes, que pueden ser manejados por los MF36.
Debe garantizarse tanto la accesibilidad como la atención. La anticoncepción es un derecho y no puede negarse por objeción de conciencia, falta de competencia o por otros motivos. Hay estudios que apuntan que los profesionales de AP75 infraestiman el problema de los ENP. Es necesario garantizar una adecuada formación de los profesionales.
- •
Hacer cribado oportunista sobre anticoncepción en todas las mujeres en edad fértil, en los varones y a sus parejas respectivas, aprovechando cualquier motivo de consulta, con una periodicidad anual o menor en situaciones de riesgo o vulnerabilidad (grado de recomendación D)
- •
Ofrecer consejo contraceptivo estructurado, que in-cluya información sobre los distintos métodos anticonceptivos y su efectividad en la prevención de ENP, ITS y VIH, sus beneficios y efectos adversos. Usar hojas impresas para reforzar la informacion (grado de recomendación B)
- •
Facilitar una elección informada, indicar métodos y garantizar el seguimiento y la accesibilidad para con-sultar las posibles dudas (grado de recomendación A)
- •
Si la opción es AHC, se recomienda la prescripción de etinilestradiol, a la dosis más baja posible, y LNG (grado de recomendación A)
- •
Informar acerca de la posibilidad de AU ante una relación sin protección o un fallo del método anti-conceptivo, y prescribirla cuando haya indicación. La PAU-LNG es un método anticonceptivo seguro y eficaz (grado de recomendación A)
- •
Aumentar el uso de los ARLD, DIU e implantes, abordándolo desde AP (grado de recomendación D)
- •
Si el profesional tuviera problemas para resolver la demanda de anticoncepción, debe facilitar la atención por otro profesional (grado de recomendación D)
- •
Los MF, dada su accesibilidad, favorecen la anticoncepción si administran en sus consultas a demanda, sin demoras, la mayoría de los anticonceptivos reversibles (grado recomendación D)
ITS: infecciones de transmisión sexual; VIH: virus de la inmunodeficiencia humana.
Actividades preventivas en la transición menopáusica y en la posmenopausiaSíntomas asociados al descenso de estrógenosEl descenso estrogénico puede originar síntomas vasomotores y sequedad vaginal para los cuales los estrógenos, con o sin progestágenos, al igual que la tibolona1, se han mostrado eficaces2-4. No existen datos para asociar el climaterio con las alteraciones del estado del ánimo5, que están más en relación con padecimientos depresivos previos, acontecimientos vitales estresantes6 o con actitudes negativas sobre la menopausia7, por lo que no se justifica el tratamiento ni la prevención de estos con terapia hormonal8. No se ha demostrado que el tratamiento hormonal sea eficaz para prevenir infecciones urinarias9, ni tratar la incontinencia urinaria10,11, o prevenir la enfermedad cardiovascular si se administra antes de los 60 años12,13, como sugerían algunos autores14. En los ensayos WHI15 y WISDOM16 y en la reciente revisión de la Cochrane17 se constata el incremento del riesgo cardiovascular con el tratamiento hormonal combinado (estrógenos-gestágenos) o con estrógenos solos18. Los efectos de la terapia hormonal1,15,19-22 se ilustran en la tabla 1. Dichos efectos desaparecen a los años de interrumpir el tratamiento23.
Efectos de la terapia hormonal
| Número de eventos a lo largo de 1 año en 10.000 mujeres mayores de 50 años | Efecto producido en 10.000 mujeres por la toma de estrógenos y progesterona durante 1 año | Efecto producido en 10.000 mujeres por la toma de estrógenos solos durante 1 año | |
|---|---|---|---|
| Cáncer de mama | 30 | 8 más | No cambios |
| Ictus | 21 | 8 más | 12 más |
| Tromboembolia pulmonar | 8 | 8 más | 7 más |
| Demencia/Alzheimer en | 22 | 23 más | No cambios |
| mujeres > 65 años | |||
| Cáncer colorrectal | 16 | 6 menos | No cambios |
| Fracturas de cadera | 15 | 5 menos | 6 menos |
- •
En mujeres con síntomas vasomotores y sequedad vaginal que, por su intensidad o frecuencia, repercutan en la calidad de vida de la mujer, se recomienda ofrecer el tratamiento hormonal con estrógenos/ gestágenos a la mínima dosis eficaz y durante el menor tiempo posible (no superior a 5 años) (recomendación fuerte).
- •
Valores y preferencias: el grupo de trabajo ha asignado una importancia alta a la mejora en la calidad de vida y baja a los potenciales efectos adversos poco frecuentes, cuando los síntomas son suficientemente importantes
El tabaquismo24,25 y la obesidad26 incrementan la incidencia de síntomas vasomotores en la etapa de transición menopáusica, que, en el caso de la obesidad, mejoran tras la menopausia27. Existen estudios que muestran alivio de los sofocos con intervenciones dirigidas a la pérdida de peso28 y a la práctica de ejercicio29, si bien en el caso del ejercicio sus resultados no son concluyentes30.
Los antidepresivos inhibidores de la recaptación de serotonina (IRS) reducen los sofocos, aunque con escasa relevancia clínica, y pueden ser una alternativa al tratamiento de estos31-33; las mejores evidencias están en la paroxetina, el citalopram y el escitalopram34, y la venlafaxina y la desvenlafaxina, en caso de tratamiento con tamoxifeno35-37. La guía NICE los aconseja como terapia de segunda línea de tratamiento de síntomas vasomotores38.
Las revisiones sistemáticas sobre fitoestrógenos muestran que o no producen efectos en los síntomas vasomotores o que estos son mínimos39-44. Dado que existe alguna evidencia, en estudios de baja calidad, de los extractos naturales o sintéticos de soja, trébol rojo, concentrados de genisteína o suplementos dietéticos de soja, estos podrían ser una opción de segunda línea en el tratamiento de síntomas vasomotores45,46. Se han constatado algunas acciones beneficiosas sobre la densidad mineral ósea47, pero se desconoce su efecto sobre las fracturas48.
Los fitoestrógenos no tienen importantes efectos secundarios49, pero sí pueden producir interacciones con otros medicamentos. No parece que incrementen el cáncer de mama50-52, aunque los resultados no son concluyentes.
Prevención de la osteoporosisPromoción de estilos de vidaDiversos metaanálisis muestran asociación entre el tabaco y la fractura vertebral53 y de cadera54. Existen estudios que asocian la realización de ejercicio con el aumento de masa ósea55,56 y con disminución de caídas, con la mejoría del balance articular y del tono muscular57-60 y, muchos menos, con la disminución de las fracturas61.
La eficacia de los suplementos de calcio y vitamina D en la reducción de fracturas es un tema controvertido. Hay ensayos clínicos y revisiones sistemáticas que muestran la eficacia de la vitamina D62-64, el calcio65, con o sin vitamina D, la administración conjunta de calcio y vitamina D66-68 y otros que no encuentran resultados favorables69-73. La revisión de la USPSTF74 concluye que la vitamina D y el calcio reducen la incidencia de fractura en mujeres con graves carencias, y se muestran en contra de la administración de suplementos de calcio y vitamina D en mujeres no institucionalizadas, al no demostrarse beneficio y sí incidencia de efectos secundarios75, datos coincidentes con los de un me- taanálisis reciente76.
- •
Se aconseja evitar el sedentarismo y el tabaquismo, tomar el sol al menos 10 min al día, con una zona de exposición de al menos la cara y las manos, tomar una dieta rica en calcio (entre 1.000 y 1.500 mg/ día) y vitamina D (> 800 U/día) y realizar ejercicio (recomendación débil)
- •
Los suplementos de calcio y vitamina D tan solo se aconsejan en mujeres institucionalizadas. Valorar su indicación en mayores de 70 años con déficits nutricionales importantes, ingesta de calcio inferior a 500-700 mg/día y escasa exposición solar (recomendación débil)
La osteoporosis se define como un trastorno que se caracteriza por una densidad mineral ósea (DMO) baja y un deterioro de la microarquitectura del hueso. En 1994, la OMS estableció criterios de osteoporosis en función de la DMO: < 2,5 desviaciones estándar (DE) respecto a la media de las mediciones de DMO en población joven (t-score); la osteopenia se define con cifras de DMO entre < -1 y > - 2,5 DE.
Dichos criterios sirven para clasificar, y no para diagnosticar o tratar, y contemplan solo uno de los factores de riesgo de osteoporosis.
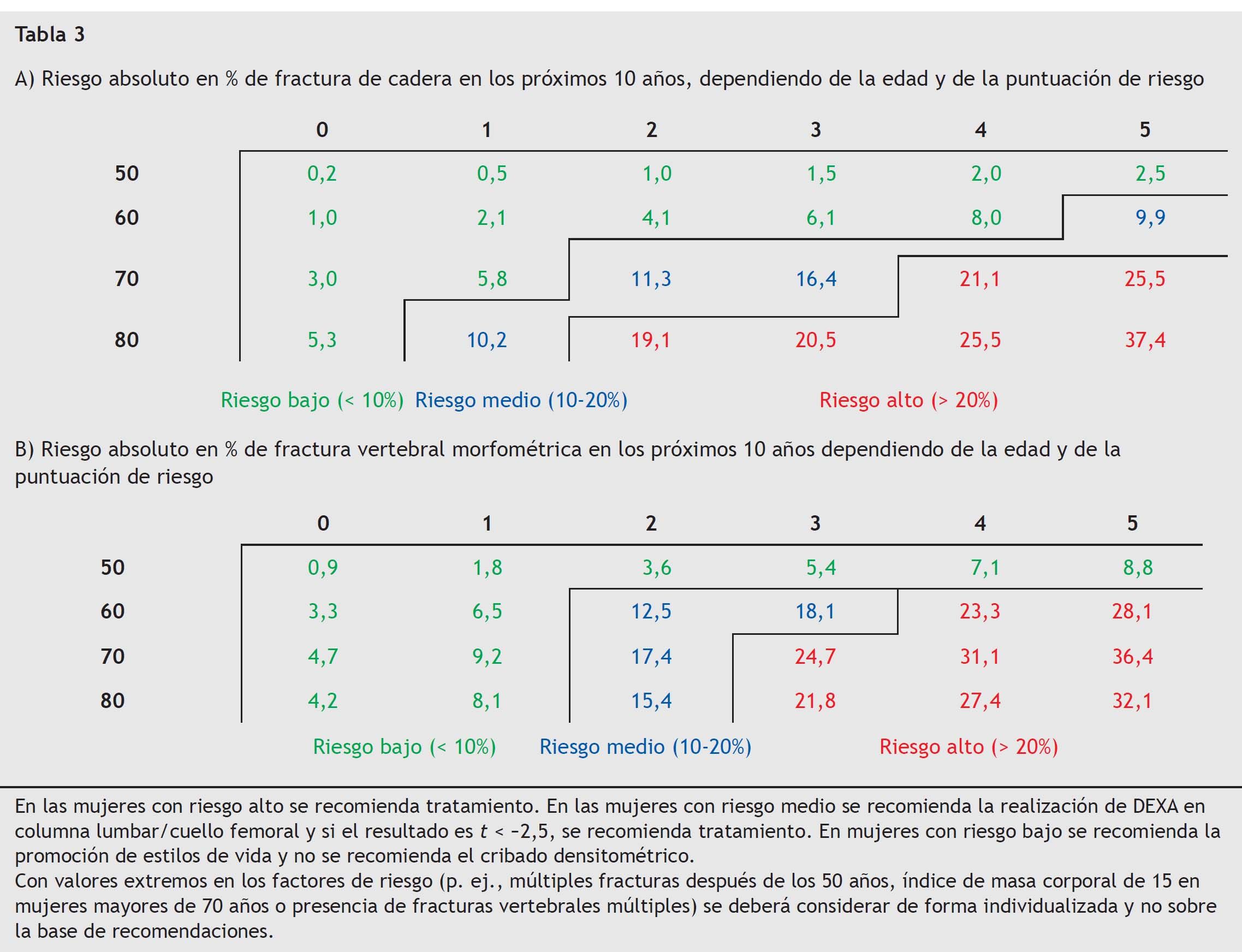
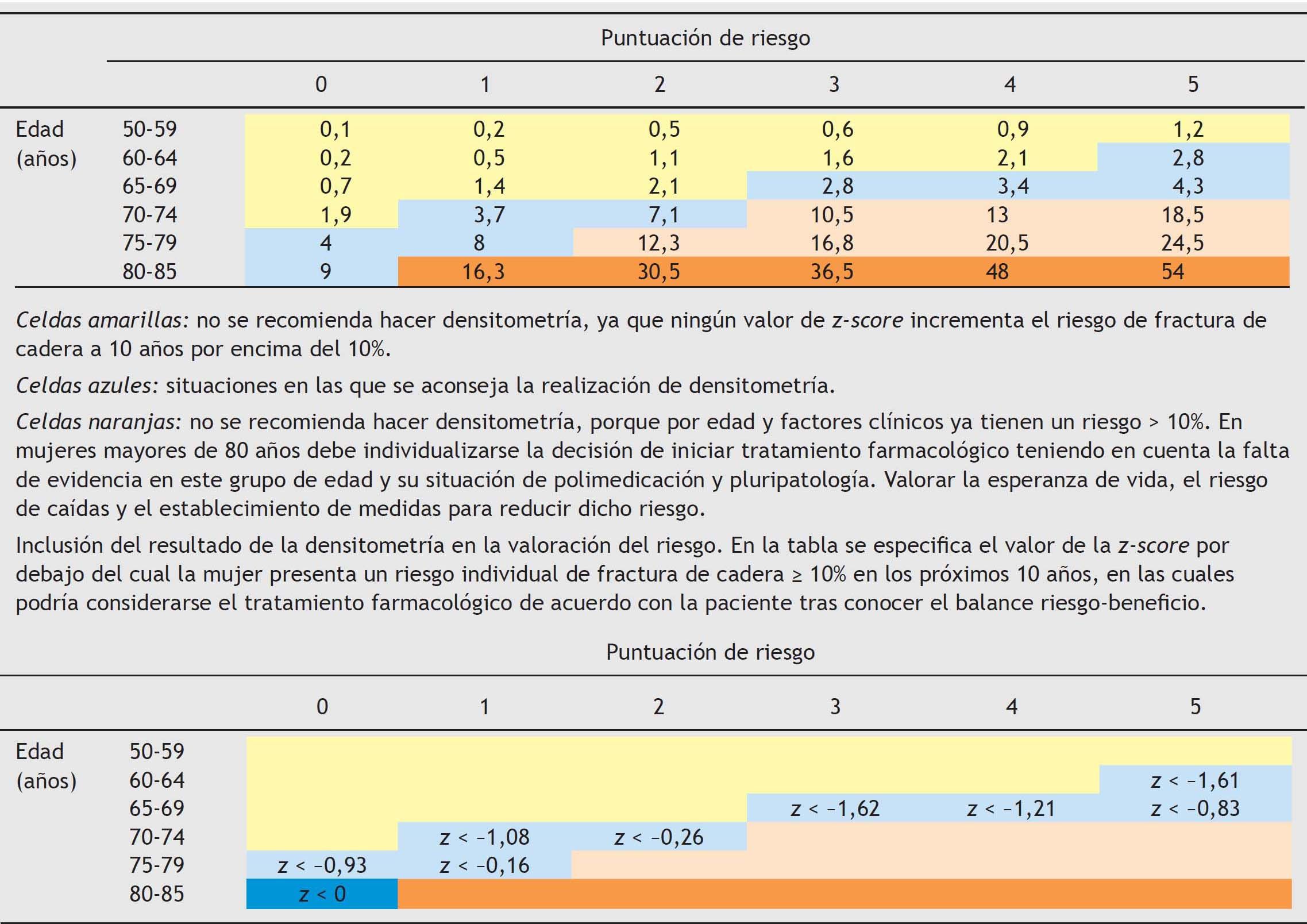
La DMO tiene un escaso valor predictivo positivo de fracturas cuando se aplica a poblaciones de bajo riesgo (tabla 2), y su baja sensibilidad (40%) la hace inapropiada para cribado77. La indicación de cribado se hará en función del riesgo absoluto de fractura. La Dirección General de Farmacia de la Comunidad de Madrid, con los datos del estudio Rotterdam78,79 y mediante un modelo matemático establecido80, propuso, en función de la edad y la presencia de factores de riesgo, el cálculo del riesgo absoluto de fractura81, que se plasma en la tabla 3. En la tabla 4 se expone la puntuación resultante de riesgo en función de los factores de riesgo considerados (los que suponen un riesgo relativo > 2). Los niveles de riesgo que justifican intervención son los mismos que los de las guías canadienses82: más del 20% justifica el tratamiento farmacológico, entre el 10 y el 20%, la indicación de densitometría y por debajo del 10%, la no intervención.
Estimaciones de sensibilidad y especificidad y valor predictivo positivo (VPP) de la densitometría para predecir futuras fracturas en 10 años con una DMO < -1 desviaciones estándar (DE) (z-score)
| Mujeres con bajo riesgo (mayores de 65 años con 2 factores de riesgo como máximo) | Mujeres con alto riesgo (mayores de 65 años con más de 5 factores de riesgo) | |
|---|---|---|
| Sensibilidad (%) | 40 | 40 |
| Especificidad (%) | 85 | 94 |
| VPP (%) | 8 | 75 |
Con 2 DE, la sensibilidad es del 14% y la especificidad, del 99% (The Swedish Council on Technology Assesment in Health Care).
Factores que hay que considerar para el cálculo de la puntuación de riesgo
| Factores de riesgo | puntuación |
|---|---|
| IMC < 19 | 1 |
| Fractura después de 50 años | 1 |
| Fractura de cadera en madre, padre o hermana | 1 |
| Deformidad vertebral morfométrica (disminución del 20% de la altura del cuerpo vertebral)* | 2 |
IMC: índice de masa corporal.
*Se recomienda hacer radiografía a mujeres mayores de 60 años cuando exista pérdida de estatura significativa (4 cm) y/o hipercifosis. Los factores asociados a los estilos de vida (tabaco, alcohol, baja ingesta de calcio, ejercicio) han mostrado menor consistencia.
Las tablas de predicción de riesgo de fracturas de la OMS (FRAX: http://www.shef.ac.uk/FRAX/faq.htm) incluyen, además de los factores anteriormente considerados, el tabaquismo y la ingesta mayor de 3 unidades de alcohol al día. Pueden suponer una alternativa válida para el cálculo del riesgo de fractura, si bien existen estudios que cuestionan su utilidad en la población española. Azagra et al83, con los datos del estudio FRIDEX, analizan la capacidad predictiva de fracturas del FRAX, y establecen el umbral de riesgo de cualquier fractura osteoporótica, según las tablas FRAX, que justificaría la realización de densitometría (por encima del 5%) y también una posible indicación de tratamiento (el 7,5%, incluyendo en la escala de riesgo el valor de la densitometría). Desde nuestro punto de vista, este modelo potenciaría el sobrediagnósico y el sobretratamiento.
La U.S. Preventive Services Task Force84 propone el cribado por encima de 65 años (grado B de recomendación) y en mujeres más jóvenes que tengan un riesgo de fracturas similar (en torno al 10% en los próximos 10 años). En población española, el riesgo de fracturas en torno al 10% se alcanza en mujeres a los 72 años.
La guía NICE85 recomienda realizar cribado en mujeres mayores de 65 años en función de la presencia de determinados factores de riesgo. Por debajo de esta edad, solo lo recomienda en función de la presencia de varios de estos factores de riesgo, siempre y cuando la opción terapéutica sea el alendronato, por criterios de coste-utilidad. La Agencia de Evaluación de Tecnologías Sanitarias del Instituto de Salud Carlos III86 considera que el alendronato es coste-útil en comparación con el calcio y la vitamina D o placebo a partir de los 69 años. La guía SIGN propone la realización de densitometría si el riesgo de fractura es mayor del 10% en los próximos 10 años87, según tablas del predicción de riesgo del FRAX o del Qfracture, a pesar de la enorme variabilidad que dichas tablas presentan (se justificaría el cribado en el 28% de la población o en el 3%, en función de la escala se-leccionada)88.
La NOF89 recomienda cribado a partir de los 65 años y por debajo si existen factores de riesgo. Aconseja tratamiento si la t-score < -2,5 DE, y en mujeres con osteopenia y con un nivel de riesgo de fractura de cadera mayor del 3% en los próximos 10 años o de otras fracturas totales clínicas mayor del 20%.
En la actualización del documento de osteoporosis de la Comunidad de Madrid90, teniendo en cuenta los estudios que demuestran la escasa validez de las tablas FRAX83 en la predicción del riesgo de fractura (debido a la escasa representación de la cohorte española), se han configurado unas nuevas tablas de riesgo, aplicando el modelo matemático antes referido, pero con datos de las fracturas de cadera de la Comunidad de Madrid. Dado que los datos de fractura vertebral son datos poco confiables, se ha establecido el criterio de intervención exclusivamente en función del riesgo de fractura de cadera, que es el evento que más morbimortalidad provoca. Al igual que en el caso del riesgo cardiovascular (en el que se propone la utilización de tablas de riesgo de muerte cardiovascular, en lugar de las de riesgo de eventos, previniéndose igualmente infartos e ictus no mortales), su utilización evita fracturas de cadera y vertebrales. En un estudio en el que se analiza la predicción de fracturas atendiendo tan solo al cri-terio densitométrico del cuello femoral o mixto, femoral y columna lumbar, no se encuentran diferencias significativas en la predicción de fracturas totales o no vertebrales, y tan solo una discreta mejor predicción con el modelo mixto en el caso de las fracturas vertebrales91.
El criterio de toma de decisiones no es el t-score, sino el z- score (mujeres de su edad), como criterio razonable para evitar el sobrediagnóstico. Se justificaría el tratamiento cuando el riesgo de fractura de cadera es mayor del 10% en los próximos 10 años. Entre el 3 y el 10% se aconseja la realización de densitometría y por debajo del 3% no se aconseja intervención. El criterio del umbral de intervención por encima del 10% se establece en relación con la prevalencia de fracturas en los estudios disponibles en los que se ha demostrado eficacia de los tratamientos (tabla 5). Con estos criterios, no está indicada, como se aprecia en la tabla 5, la realización de densitometrías en mujeres menores de 60 años.
En los casos en los que esté indicada la densitometría, el z-score por debajo del cual se justifica tratamiento sería el que incrementa el riesgo basal al 10% (tabla 5).
Respecto a los tratamientos en mujeres sin fracturas vertebrales, tan solo han demostrado eficacia con raloxifeno92 y alendronato93, y con un t-score < -2,5 DE. Otros tratamientos que han demostrado disminución de fracturas vertebrales y/o de cadera lo han hecho con poblaciones con fracturas previas.
Los bifosfonatos pueden incrementar las fracturas de estrés atípicas y la osteonecrosis de mandíbula94, lo que ha llevado a las autoridades sanitarias a no recomendar su uso más de 5 años. El denosumab presenta idénticos riesgos que los bifosfonatos.
- •
En mujeres con riesgo de fractura de cadera superior al 10% en los próximos 10 años, se debe valorar el tratamiento farmacológico. En mujeres con riesgo de fractura de cadera superior al 3% y valores de z-score que incrementen el riesgo hasta el 10% se aconseja valorar la indicación de tratamiento farmacológico (tabla 5). Los bifosfonatos son los tratamientos de primera elección durante un tiempo estimado, en general, no mayor de 5 años (recomendación débil)
No existen datos de la eficacia del tratamiento en mujeres con osteopenia95.
Los ultrasonidos presentan baja sensibilidad y, debido a la falta de datos sobre su eficacia diagnóstica y terapéutica, no se aconsejan como método de cribado96.