En los últimos años ha habido cambios significativos en la anticoagulación oral (AC) y su control. En los países industrializados, la población en tratamiento anticoagulante (TAO) alcanza tasas de más de 5.000/millón de habitantes. Sin embargo, debido a que se han modificado las indicaciones de este tratamiento y al aumento de la esperanza de vida de la población, se estima un incremento progresivo superior al 15% anual en el número de pacientes sujetos a TAO1. Este aumento de la población subsidiaria de TAO, junto con el control tan estricto que implica debido a la idiosincrasia del propio tratamiento para evitar las graves complicaciones que pueden derivarse del control inapropiado de la AC, hace que nos situemos ante un problema de salud pública de gran trascendencia social y económica que obligará a tomar importantes decisiones en las políticas sanitarias.
La efectividad clínica del TAO se ha establecido en virtud de diferentes ensayos clínicos bien diseñados. Sin embargo, se estima que sólo un tercio de los pacientes con fibrilación auricular (FA) está recibiendo cumarínicos2,3. Este hecho está probablemente asociado al temor de los médicos a que se produzca una hemorragia. Otros factores que también pueden influir son los problemas logísticos del control del tiempo de protrombina o International Normalized Ratio (INR) y la falta de consenso sobre los pacientes que deben ser tratados y el nivel de INR óptimo4. Esta actitud puede conducir a un exceso de fenómenos tromboembólicos potencialmente evitables. ¿Hay fundamento en ese miedo a la hemorragia? ¿Cuándo hay que administrar AC en los pacientes con FA?
El objetivo de este estudio ha sido realizar una revisión bibliográfica de las bases científicas para la indicación del TAO y de la identificación de los pacientes con un riesgo elevado de ictus y hemorragia. Para ello se han seleccionado las publicaciones relevantes sobre la AC y la FA no reumática en MEDLINE utilizando los filtros de artículos de revisiones, guías clínicas, metaanálisis y estudios aleatorizados y controlados. Finalmente, se han aplicado los criterios de la medicina basada en la evidencia de validación, relevancia y aplicabilidad clínica de las evidencias encontradas.
Consistencia de la indicación del tratamiento anticoagulante en pacientes con fibrilación auricular
La FA es el trastorno del ritmo cardíaco más común. Su prevalencia comienza a aumentar en ambos sexos después de los 40 años y sobre todo a partir de los 65, con una prevalencia del 10% en personas mayores de 80 años5. Según el Framingham Heart Study5, el riesgo absoluto de embolia es del 1,5% en pacientes de 50-59 años, el cual se incrementa con la edad hasta el 23,5% en los mayores de 80 años, en los que es el único problema cardiovascular asociado al ictus. En este contexto, parece clara la indicación de alguna terapia antitrombótica o anticoagulante para la prevención del ictus.
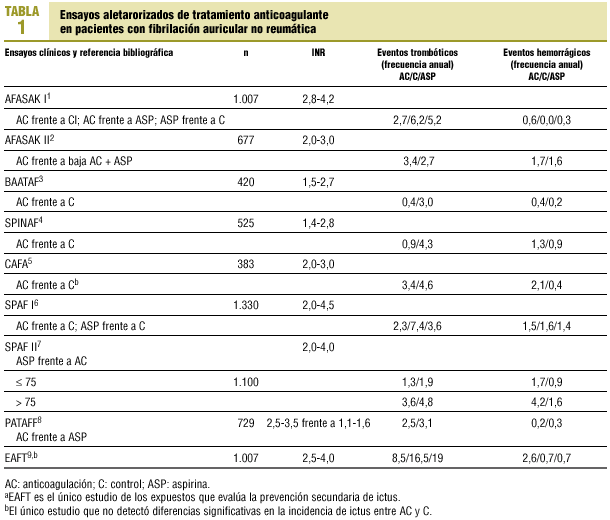
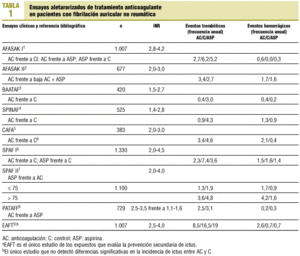
Durante los pasados 15 años, un gran número de estudios aleatorizados6-18, análisis de pacientes19-21, metaanálisis22-29 y revisiones30-33 han evaluado la profilaxis tromboembólica en pacientes con FA. La mayoría de los ensayos clínicos, así como sus revisiones, han demostrado la efectividad de la AC para la prevención primaria y secundaria de fenómenos tromboembólicos en la FA. En general, los cumarínicos reducen el riesgo de embolia en un 65-85%, siempre que la dosis esté bien ajustada, mientras que complicaciones hemorrágicas mayores ocurren en el 5-28 pacientes-año6-8,10,11. La aspirina también disminuye el riesgo del ictus, aunque en menor medida22. En la tabla 1 se recogen los principales ensayos realizados para verificar la eficacia de la anticoagulación en pacientes con FA frente a un grupo control o a la administración de aspirina.
A pesar de que la mayor parte de los ensayos han demostrado la superioridad de la AC sobre la aspirina en la prevención de fenómenos tromboembólicos, algunas revisiones cuantitativas de los estudios presentan resultados dispares; en algunos casos, la AC es sustancialmente más beneficiosa que la aspirina22,29; en otros, la evidencia es moderada24 y, por último, algunos autores consideran que el valor del TAO a largo plazo es incierto23. En lo que sí parece haber unanimidad es en el mayor riesgo de hemorragia con el uso de la AC.
Taylor et al23 realizaron un metaanálisis del AFASAK I y II, SPAFF II, SIFA18 y PATAFF. Con una población total de 3.298 pacientes aleatorizados, estos autores llegaron a la conclusión de que, debido a la heterogeneidad de los estudios y sus resultados limitados, la eficacia del TAO en pacientes con FA era cuestionable. Por otro lado, observaron una asociación con el riesgo de hemorragia, con el consiguiente aumento de los costes globales, lo que se traduce en un balance negativo de la relación riesgo-beneficio que se debe tener en cuenta al tomar la decisión de iniciar TAO frente a tratamiento antiagregante.
La Colaboración Cochrane llevó a cabo otra revisión sistemática24. Tras analizar 14 estudios (incluidos los anteriores), los autores llegaron a la conclusión inversa, es decir, la warfarina fue más eficaz que el placebo y la aspirina en la prevención de ictus primario en pacientes con un riesgo elevado, aunque con un evidente mayor número de hemorragias. Para la prevención primaria, asumiendo un riesgo basal de 45 accidentes cerebrovasculares (ACV) por 1.000 pacientes-año, la warfarina podría prevenir 30 ACV con la aparición de 6 hemorragias importantes adicionales, mientras que la aspirina podría prevenir 17 ACV sin un aumento del número de hemorragias importantes. Estos autores concluyen con que hay una evidencia moderada de su efectividad. Sí parece estar demostrada la escasa eficacia de la AC a dosis bajas12,13 o a dosis bajas más aspirina12,15.
Hart et al22, en un metaanálisis de los estudios AFASAK I, SPAF I, BAATAF, CAFA, SPINAF y EAFT demostraron que la dosis ajustada de warfarina (con un INR = 2,0-3,0) reducía la incidencia de ictus al 60%, con una reducción absoluta del 3% al año para la prevención primaria y del 8% al año para la secundaria. En contraste, la aspirina reducía el ictus alrededor del 20%, con una disminución absoluta del riesgo del 1,5% al año de la prevención primaria y del 2,5% al año de la secundaria.
Van Walraven et al29, con los datos del AFASAK I y II, PATAF, EAFT y SPAF I, II y III, encontraron que la probabilidad de padecer un ictus fue de 2,4 frente a 4,5 eventos por 100 pacientes-año (hazard ratio [HR] = 0,55; intervalo de confianza [IC] del 95%, 0,43-0,71), aunque con una mayor frecuencia de hemorragias (2,2 frente a 1,3 eventos por 100 paciente-año, HR = 1,71; IC del 95%, 1,21-2,41). Asimismo, añadieron que la relación riesgo-beneficio varía entre los subgrupos de pacientes pero que, en general, el riesgo absoluto de los fenómenos tromboembólicos es casi 2 veces superior al de los hemorrágicos.
Factores de riesgo
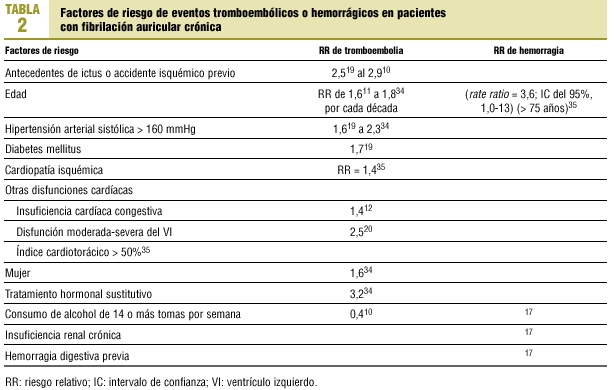
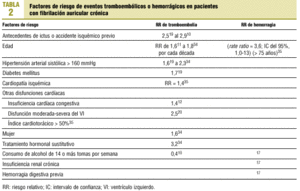
En la práctica clínica habitual es de todos conocido que tanto los fenómenos tromboembólicos como hemorrágicos pueden presentarse en pacientes con un INR en rango. En la bibliografía se han analizado distintos factores que favorecen o se asocian a fenómenos hemorrágicos, embólicos o ambos. En la tabla 210-12,17,19,20,34,35 se muestran los factores de riesgo con sus riesgos relativos (RR).
En general, según la bibliografía, los factores de riesgo más importantes para la incidencia de fenómenos tromboembólicos son la historia reciente de accidente isquémico19,34, la edad19,35, la diabetes19, la presión arterial sistólica mayor de 160 mmHg19,34,36 y la cardiopatía isquémica35. El gupo de estudio SPAF Investigators34 encontró como factores asociados ser mujer y el tratamiento hormonal sustitutivo34. Sin embargo, otros autores los han catalogado como factores predictores inconsistentes4, especialmente ser mujer mayor de 75 años y, por tanto, estos datos deben ser confirmados.
Entre los factores que parece que reducen el riesgo de ictus se encuentran el consumo de 14 o más dosis de alcohol por semana (RR = 0,4)34 y la insuficiencia mitral de moderada a severa4.
Para los eventos hemorrágicos, la edad parece ser el factor fundamental35,37. Los pacientes mayores de 75 años tienen una probabilidad más alta de hemorragia aun con un INR en rango (rate ratio = 3,6; IC del 95%, 1,0-13)35.
Estratificación del riesgo
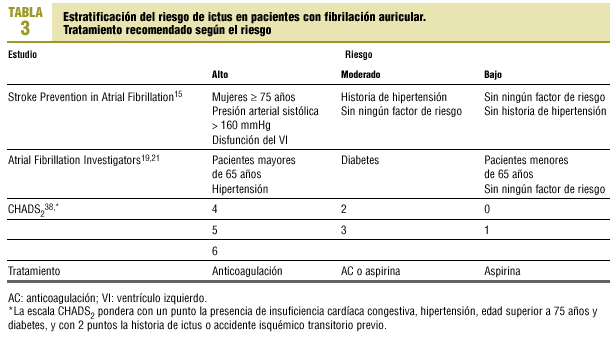
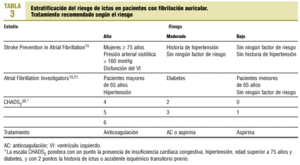
Sobre esta base, con múltiples factores influyentes, los investigadores han creado distintos sistemas. En la tabla 315,19,21,38 se incluyen las escalas más interesantes.
Hart et al34 realizaron un análisis multivariable de los 2.012 pacientes incluidos en los estudios SPAF I y III que fueron seguidos durante 2 años y observaron durante este período 130 ictus isquémicos. Clasificaron a los pacientes en 3 estratos según la probabilidad de ictus: alta (> 7%/año), moderada (2,6%/año) y baja (0,9%/año). Los pacientes con varios factores de riesgo parecen tener un riesgo sustancialmente mayor de ictus que los que tienen uno solo34.
Por su parte, los autores del estudio Atrial Fibrillation Investigators (AFI)19 basaron sus criterios de estratificación en el análisis multivariable de 1.593 pacientes asignados a control o placebo en 5 ensayos aleatorizados, en los que se produjeron 106 ictus isquémicos durante 1,6 años de seguimiento. Clasificaron a los pacientes en 2 grupos: los de riesgo bajo y los de riesgo alto o intermedio. En el primer grupo se encontraban los pacientes menores de 65 años y los que no tenían ningún factor de riesgo moderado o alto. En este esquema, el riesgo de presentar ictus se multiplicaba por 1,4 por cada 10 años de edad y por cada factor de riesgo (historia previa de isquemia cerebral, hipertensión arterial y diabetes). Estos autores encontraron 5,9-10,4 ictus por 100 pacientes-año entre los que tenían al menos 1 de los 3 factores de riesgo. En cambio, si no había ningún factor de riesgo, el número de ictus fue de 2,7-4,3 por 100 pacientes-año. Los pacientes menores de 65 años sin ningún factor de riesgo presentaron 1,0-1,8 ictus por 100 pacientes-año21.
Aunque estos 2 grandes estudios19,34 que evalúan los factores de riesgo coinciden en los factores fundamentales (ictus previo, diabetes, edad e hipertensión arterial), difieren en el riesgo absoluto observado. Para los pacientes sin historia previa de ictus, el riesgo anual de ictus es del 4,0% según el estudio AFI y del 2,7% según el estudio SPAF. Estas diferencias pueden ser el resultado de las distintas poblaciones de pacientes o al beneficio terapéutico de la aspirina en los datos del SPAF. También la diferencia del impacto de la edad es evidente en ambos estudios: para el AFI, tendrían un riesgo alto todos los pacientes mayores de 65 años (incluso los que no tienen otro factor de riesgo). En cambio, en el esquema del SPAF, las mujeres menores de 75 años y los varones de cualquier edad sin otro factor de riesgo tendrían un riesgo bajo. El resultado es la incertidumbre sobre el riesgo de los pacientes de 65-75 años y los varones de cualquier edad sin otro factor de riesgo, que corresponderían al 20% de la población con FA.
Gage et al38 validaron una escala clínica para predecir el ictus. El CHADS2 index se construyó asignando 1 punto a cada uno de los siguientes factores: insuficiencia cardíaca congestiva, hipertensión, edad superior a 75 años y diabetes; y 2 puntos a la historia de ictus o TIA previo. Se establecieron 7 estados o situaciones de riesgo diferentes, para lo que se utilizó el Registro Nacional de FA con 1.733 pacientes de 65-95 años que tuvieron 94 casos de ictus. Al construir su sistema predictivo encontraron que la frecuencia de ictus se multiplicaba por 1,5 (IC del 95%, 1,3-1,7) por cada punto de aumento en la escala CHADS2. Demostraron con el estadístico c que su escala tenía mayor capacidad predictiva que las dos anteriores (0,82; IC del 95%, 0,80-0,84 frente 0,68; IC del 95%, 0,65-0,71 para el estudio AFI, y 0,74; IC del 95%, 0,71-0,76 para el SPAF). Posiblemente, esto se deba a que es una escala más discriminativa, con más niveles de riesgo; cuando hicieron la reducción en 3 estratos, la capacidad predictiva se aproximaba a la de las escalas anteriores.
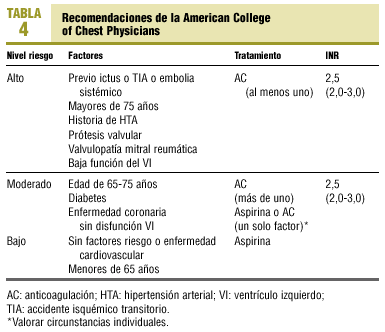
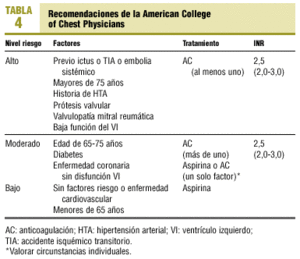
Ante esta variabilidad y la incertidumbre en determinados pacientes, algunas sociedades médicas también han elaborado distintas guías por consenso de expertos39, que se muestran en la tabla 4.
En conclusión: ¿cuándo indicar tratamiento anticoagulante?
Parece que hay suficientes evidencias para la indicación del TAO en pacientes con FA y alto riesgo de ictus. No obstante, la heterogeneidad de los estudios debida a la diversidad de criterios utilizados, tanto en la inclusión de pacientes como en la definición de eventos o fenómenos, asociada al número de pacientes incluidos y a la escasez de eventos en ellos, dificulta la elaboración de conclusiones.
Por el momento, y con los datos disponibles, a la hora de indicar el TAO es necesario y fundamental establecer el riesgo de embolia o hemorragia individual sopesando, por tanto, el riesgo-beneficio para cada paciente según los parámetros analizados. En esta toma de decisiones, no sólo hay que tener en cuenta la situación clínica del paciente (edad, enfermedades previas, etc.), que determinará el riesgo basal, sino también los factores personales relacionados con las preferencias de éste y los logísticos relativos al cumplimiento del tratamiento y el acceso a su control.