La hiperplasia benigna de próstata (HPB) es una enfermedad con alta prevalencia entre los varones de más de 50 años que requiere una continuidad asistencial entre los 2 niveles existentes en nuestro país, el de atención primaria (AP) y el de atención especializada; motivo por el que era necesario consensuar unos criterios de derivación o de continuidad que sirvan de orientación a ambos colectivos. La historia clínica del paciente, el Índice Internacional de Síntomas Prostáticos (IPSS, International Prostate Symptom Score), el tacto rectal y el antígeno prostático específico (PSA, prostate-specific antigen) son herramientas accesibles en el ámbito de la AP que permiten un diagnóstico adecuado de la HBP. Conscientes de tal necesidad, las sociedades científicas de atención primaria (Sociedad Española de Médicos de Atención Primaria [SEMERGEN], Sociedad Española de Medicina General [SEMG] y Sociedad Española de Medicina de Familia y Comunitaria [semFYC]) y la Asociación Española de Urología (AEU) elaboraron este documento de consenso. A los pacientes con IPSS<8 se los deberá mantener en vigilancia y evaluar anualmente; en los pacientes con IPSS 8-20, si el tamaño de la próstata es pequeño, se recomienda el tratamiento con bloqueadores alfa y evaluación al primer y tercer mes, si el tamaño de la próstata es grande se recomienda el tratamiento con bloqueadores alfa o inhibidores de la 5-alfa-reductasa y evaluación al tercery sexto mes, y en el caso de pacientes con próstata grande y PSA 41,5 ng/ml se recomienda el tratamiento combinado y la evaluación al primer y sexto mes. En este documento se establecen unos criterios de derivación al urólogo claros, que facilitan el tratamiento de este tipo de pacientes. Se derivarán al urólogo aquellos pacientes con HBP que no presenten mejoría al tercer mes de tratamiento con bloqueadores alfa, o al sexto mes de tratamiento con inhibidores de la 5-alfa-reductasa. Se derivarán también los pacientes con síntomas del tracto urinario inferior en los que se observe algún hallazgo patológico durante el tacto rectal, IPSS >20, PSA >10 ng/ml o PSA >4 ng/ml y PSA libre <20% o pacientes con edades < 50 años y sospecha de HBP, así como aquellos pacientes con alguna complicación urológica.
Benign prostatic hyperplasia (BPH) is a high prevalence condition in men over 50 years that requires continued assistance between primary care and urology. Therefore, consensus around common referral criteria was needed to guide and support both levels. Medical history, symptom assessment with International Prostate Symptom Score (IPSS) questionnaire, digital rectal examination and prostate-specific antigen (PSA) measurement are diagnostic tests available for general practitioners that allow setting a correct BPH diagnose. Patients with an IPSS<8 should be monitored by evaluating them annually. Treatment with α-blockers and an evaluation at the first and third month is recommended in patients with an IPSS 8-20 and if the prostate is small, if the prostate size is large treatment with α-blockers or 5α-reductase inhibitors and evaluation at the third and six month is recommended, and in patients with a large prostate and a PSA >1.5ng/ml combined treatment and evaluation at the first and sixth month is recommended. Some clear criteria for referral to urology are established in this document, which help in the management of these patients. Those patients with BPH who do not show any improvement at the third month of treatment with α-blockers, or the sixth month with 5α-reductase inhibitors, will be referred to urology. Patients will also be referred to urology if they have lower urinary tract symptoms, a pathological finding during rectal examination, IPSS>20, PSA>10ng/ml or PSA>4ng/ml and free PSA<20% or if they are <50 years with suspected BHP, or if they have any urological complication.
La hiperplasia benigna de próstata (HBP) es una enfermedad que se caracteriza por un crecimiento histológico de la glándula prostática, que produce una obstrucción al flujo de salida urinario y se manifiesta clínicamente por los denominados síntomas del tracto urinario inferior (STUI)1. Éstos pueden llegar a ser muy acentuados y limitar de forma importante la calidad de vida del paciente1. El aumento de la sintomatología con la edad del paciente no siempre se acompaña de un empeoramiento de la calidad de vida, lo que indica cierta capacidad de adaptación con la edad2,3. De todos los síntomas, los que más alteran la calidad de vida son la nocturia y el chorro miccional débil1. El aumento palpable de la próstata no siempre muestra una sintomatología clínica4; sólo un 50% de los pacientes con cambios histológicos va a presentar manifestaciones clínicas prostáticas y solicitará consejo al médico de Atención Primaria (AP) o al urólogo.
La evolución de la enfermedad está relacionada con la edad5. La próstata en el adulto pesa unos 20 g. Tamaños prostáticos superiores a 20–30g se consideran indicativos de aumento prostático1. Su crecimiento comienza en la pubertad y suele completarse hacia los 30 años. A partir de los 30–40 años de edad comienzan a aparecer focos de hiperplasia en el tejido glandular y fibromuscular. Por encima de la quinta o sexta década de la vida se puede iniciar una segunda fase de crecimiento.
La HBP es la enfermedad urológica más frecuente en el varón, y la primera causa de consulta ambulatoria al especialista2. Es el tumor benigno más frecuente en el varón mayor de 50 años y representa la segunda causa de intervención quirúrgica6. La prevalencia de la HBP comienza a mediana edad y aumenta progresivamente con el envejecimiento. La falta de una definición clínica estandarizada de la HBP dificulta la realización de estudios epidemiológicos que valoren adecuadamente su prevalencia7. En España, los resultados del estudio realizado por Chicharro et al2, siguiendo criterios de la Organización Mundial de la Salud, indicaron que la prevalencia media de la HBP, en el total de la población masculina analizada era del 11,8%, y oscilaba desde el 0,75% en los varones de 40–49 años, hasta el 30% en aquellos mayores de 70 años. En una revisión8 en la que se analizó la prevalencia histológica de la HBP en función de la edad, según los datos procedentes de 10 estudios con más de 1.000 próstatas, se observó que la prevalencia de la HBP era del 8% en la década de los cuarenta, del 50% en la década de los cincuenta y alcanzaba al 88% de las muestras histológicas en la década de los noventa7,8.
La etiología de la HBP es multifactorial. Actualmente, no existe una evidencia científica que permita aceptar como factores de riesgo el tabaquismo, la vasectomía, la obesidad o la elevada ingesta de alcohol7. Los únicos factores de riesgo relacionados con el desarrollo de la HBP son la edad y el estado hormonal del paciente7,9. La glándula prostática es una estructura dependiente del andrógeno, que requiere el estímulo de la testosterona para su desarrollo y función. La enzima 5-alfa-reductasa transforma la testosterona dentro de la célula prostática en la dihidrotestosterona (DHT), metabolito activo mediador del crecimiento prostático. El tratamiento con inhibidores de la 5-alfa-reductasa logran reducir los niveles de DHT de la próstata y el volumen prostático.
Justificación y objetivosLas enfermedades prostáticas pueden ser diagnosticadas inicialmente en AP, ya que se dispone de los medios materiales necesarios para ello10. Más de la mitad de los pacientes con HBP pueden ser controlados en AP2,11. La alta prevalencia de la HBP junto con la importancia de una buena coordinación entre la AP y la atención especializada justifican la necesidad de tener sistematizados los criterios respecto a cuando un paciente con HPB pueda ser tratado y seguido en AP, y cuando debe ser derivado al urólogo.
No existen guías nacionales de cómo se ha de tratar en AP la HBP. Actualmente, las guías de la Asociación Europea de Urología (EAU)7 son la referencia, pero en ellas no se definen que actuaciones deben realizar en uno y otro nivel. Por eso, la Asociación Española de Urología (AEU), conjuntamente con la Sociedad Española de Médicos de Atención Primaria (SEMERGEN), la Sociedad Española de Médicos Generales y de Familia (SEMG) y la Sociedad Española de Medicina de Familia y Comunitaria (semFYC), ha elaborado este documento de consenso.
Los objetivos que se pretenden son promover el óptimo tratamiento de los pacientes con HBP en el ámbito de la AP y la urología, y aportar unos criterios unificados y concisos de derivación de pacientes con HBP al urólogo, fácilmente asumibles por todos los niveles asistenciales.
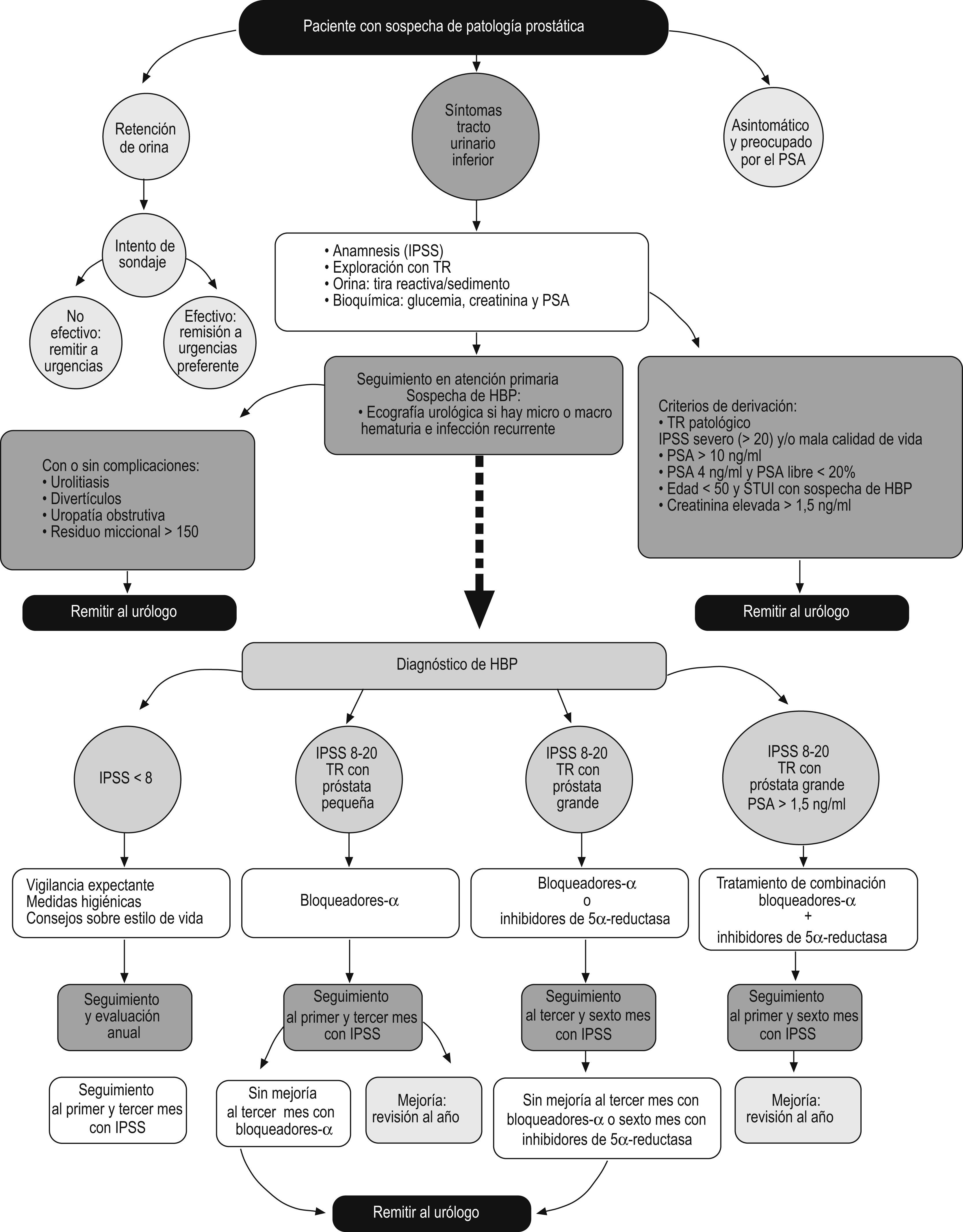
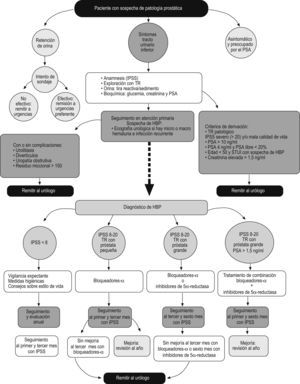
El documento de consenso consta de 2 partes: por un lado, el algoritmo (fig. 1) en el que se esquematiza el tratamiento del paciente que acude a consulta con STUI indicativos de HBP y, por otro, se detalla cada uno de los pasos de esta herramienta, tales como pruebas diagnósticas, tratamientos disponibles, seguimiento del paciente y criterios de derivación al urólogo.
Algoritmo de decisión a partir de los resultados de la anamnesis, la exploración física y la analítica. HBP: hiperplasia benigna de próstata; IPSS: Índice Internacional de Síntomas Prostáticos (International Prostate Symptom Score); PSA: antígeno prostático específico (prostate-specific antigen); TR: tacto rectal.
Este documento de consenso pretende ser, por tanto, una herramienta útil que facilite el tratamiento del paciente con síntomas prostáticos, así como la coordinación entre los niveles asistenciales de AP y atención especializada.
MetodologíaLas recomendaciones que se presentan en este consenso son el resultado de la búsqueda, la evaluación crítica y la síntesis de la evidencia científica existente sobre la HBP.
Siempre que ha sido posible, se ha incluido el nivel de evidencia y el grado de recomendación que sustenta cada una de las recomendaciones utilizadas en este documento, siguiendo la clasificación de la Agency of Healthcare Research and Quality (tabla 1), utilizada por la EAU2.
Niveles de evidencia científica y grados de recomendación
| Clasificación de las recomendaciones en función del nivel de evidencia disponible |
| Ia. La evidencia científica procede de metaanálisis de ensayos clínicos controlados y aleatorizados |
| Ib. La evidencia científica procede de al menos un ensayo clínico controlado y aleatorizado |
| IIa. La evidencia científica procede de al menos un estudio prospectivo controlado, bien diseñado y sin aleatorizar |
| IIb. La evidencia científica procede de al menos un estudio casi experimental, bien diseñado |
| III. La evidencia científica procede de estudios descriptivos no experimentales, bien diseñados, como estudios comparativos, de correlación o de casos y controles |
| IV. La evidencia científica procede de documentos u opiniones de expertos o experiencias clínicas de autoridades de prestigio |
| Grados de recomendación |
| A. Existe buena evidencia sobre la base de la investigación para apoyar la recomendación |
| B. Existe moderada evidencia sobre la base de la investigación para apoyar la recomendación |
| C. La recomendación se basa en la opinión de expertos o en un panel de consenso |
| X. Existe evidencia de riesgo para esta intervención |
Los motivos de consulta de los pacientes con sospecha de enfermedad prostática que acuden al médico de AP suelen ser por la presencia de STUI y por retención aguda de orina, o bien se trata de pacientes asintomáticos y preocupados ante una posible enfermedad prostática (fig. 1).
La HBP se manifiesta clínicamente mediante los STUI; sin embargo, no toda la sintomatología del tracto urinario inferior es debida a la HBP. Se debe tener en cuenta, por tanto, que los STUI también pueden deberse a la presencia de otras enfermedades1. Una anamnesis detallada junto con una adecuada exploración física permitirá, en la mayoría de los casos, un correcto diagnóstico, confirmado posteriormente con las pruebas complementarias necesarias.
La evaluación diagnóstica inicial de los pacientes con STUI deberá realizarse en función de los resultados de los siguientes procedimientos diagnósticos (fig. 1):
- •
Anamnesis que incluya el Índice Internacional de Síntomas Prostáticos (IPSS, International Prostate Symptom Score)12.
- •
Exploración física con tacto rectal.
- •
Analítica de orina y bioquímica sanguínea.
Es el primer paso en el método diagnóstico y un procedimiento fundamental en la consulta del médico de AP. Se debe realizar una anamnesis detallada, que permita descartar otro tipo de enfermedades distintas de la HBP que cursen con STUI.
Se debe valorar la presencia o ausencia de alteraciones potencialmente graves, como hematuria (macro y micro), dolor, fiebre, retención de orina, anuria o alteración de la función renal.
La anamnesis deberá recoger los siguientes datos clínicos:
Antecedentes familiares de enfermedad prostática
Presencia de enfermedades que puedan causar STUI: diabetes, insuficiencia cardíaca, enfermedades neurológicas (Parkinson, esclerosis múltiple), antecedentes de enfermedades de transmisión sexual, enfermedad vesical, orquitis, enfermedad rectal.
Tratamiento actual con diuréticos (aumentan la frecuencia miccional), antagonistas del calcio (disminuyen la contractilidad vesical), antidepresivos tricíclicos (aumentan el tono prostático) o antihistamínicos de primera generación (disminuyen la contractilidad vesical).
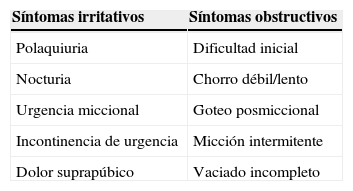
Cuadro clínico de los STUI: se deberá valorar el tiempo de evolución, los síntomas y la gravedad. Los STUI pueden alterar significativamente la calidad de vida del paciente; su correcta identificación constituye un aspecto determinante en la elección individualizada de las medidas terapéuticas más indicadas en cada caso. Los STUI se clasifican en obstructivos e irritativos (tabla 2). Los irritativos son los que interfieren más en las actividades de la vida diaria y en la calidad de vida13.
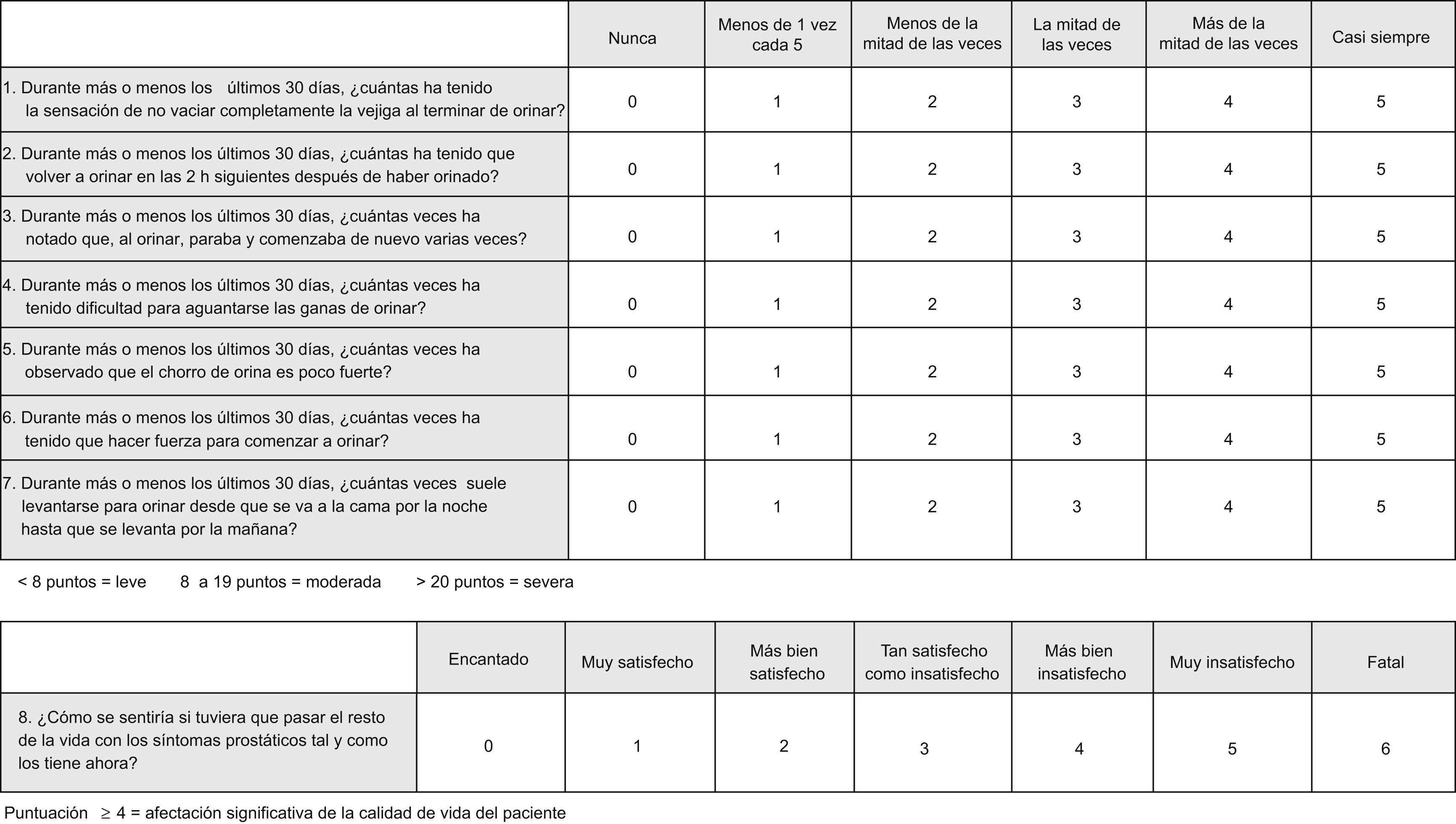
Para la valoración de la gravedad de los STUI, la mayoría de las sociedades científicas recomiendan la aplicación del IPSS14 (fig. 2) ***(nivel de evidencia III, grado de recomendación B). El IPSS es una herramienta validada al castellano15 y autoaplicada. Consta de 7 preguntas relacionadas con diferentes STUI, puntuadas de 0 a 5. La suma de la puntuación de cada pregunta determina la gravedad del cuadro: leve (< 8), moderada (8–19) o grave (>20). La puntuación de la pregunta 8 indica el deterioro en la calidad de vida del paciente debido a los STUI (>4 afectación significativa). Una mejoría en la puntuación de los síntomas de al menos 3 unidades respecto a la puntuación basal, se considera como perceptible por el paciente y, por lo tanto, está aceptada como umbral mínimo de mejoría clínica16. El IPSS no debe sustituir a la historia clínica, pero ayuda a valorar la necesidad de tratamiento y a monitorizar la evolución de la gravedad de los síntomas durante el seguimiento.
Exploración físicaLa exploración física del paciente con STUI debe ser lo más completa posible y enfocada en la identificación de signos de enfermedad nefrourológica7 (nivel de evidencia III, grado de recomendación C). Una correcta exploración física siempre deberá incluir lo siguiente:
Exploración general: para determinar la presencia/ausencia de edemas, fiebre, infección del tracto urinario (ITU) u otros signos de afectación renal (puñopercusión en ambas fosas renales).
Exploración del abdomen: para descartar masas y globo vesical.
Exploración del escroto: se deberá valorar el tamaño, la consistencia y sensibilidad de los testículos, presencia de hidrocele, varicocele y masas induradas.
Tacto rectal (nivel de evidencia III, grado de recomendación C): es una exploración urológica fundamental en varones con STUI17. El examen ha de realizarse con la vejiga vacía y en la posición más cómoda y factible según la experiencia del médico (decúbito supino, de pie, decúbito lateral o posición rodilla-codo). En condiciones normales, se palpará una glándula simétrica con un surco medio y 2 lóbulos laterales. Se debe valorar lo siguiente:
- •
Estado de la mucosa rectal: permite descartar fisuras o valorar la presencia de hemorroides.
- •
El tono del esfínter anal.
- •
La sensibilidad: muy dolorosa en el caso de las prostatitis agudas.
- •
El tamaño glandular: el crecimiento progresivo hace desaparecer el surco medio prostático.
- •
La consistencia: en condiciones normales es fibroelástica, homogénea en toda su superficie; si encontramos algún punto de consistencia pétrea se debe sospechar de una enfermedad tumoral.
- •
Los límites: se pueden acotar con nitidez los límites de la glándula, en caso contrario se debe sospechar de una enfermedad tumoral.
- •
La movilidad: en condiciones normales es discretamente móvil, si se encuentra fija se debe sospechar un proceso neoplásico.
Aunque el tacto rectal es una herramienta muy útil en el diagnóstico diferencial de enfermedades prostáticas y anorrectales, un tacto rectal normal no descarta el carcinoma prostático (CaP), ya que en fases precoces, con el tacto rectal sólo se diagnostica el 10% de los CaP. Cuando se palpa el CaP mediante tacto rectal, ya se encuentra al menos en fase T218.
El uso conjunto del tacto rectal con el resultado del antígeno prostático específico (PSA, prostate-specific antigen) permite excluir la presencia de CaP, prostatitis y otras enfermedades pélvicas7,19 (nivel de evidencia IB, grado de recomendación B).
Analítica de orina y sangreA los pacientes con STUI en AP deben realizarles las siguientes pruebas analíticas:
Tira reactiva de orina: con el fin de descartar la presencia de nitritos, leucocitos, proteínas y microhematuria. Es una prueba sencilla, muy sensible, pero poco específica (frecuentes falsos positivos). La presencia de sangre debe confirmarse posteriormente siempre, mediante un sistemático de orina con sedimento.
Sistemático de orina, sedimento y anormales (nivel de evidencia IV, grado de recomendación C): con el fin de descartar infección del tracto urinario y hematuria.
Glucemia: con el fin de descartar diabetes.
Creatinina plasmática (nivel de evidencia IV, grado de recomendación C): la HBP puede causar dilatación del tracto urinario superior y fallo renal7. A pesar de que los resultados del estudio Medical Therapy of Prostatic Symptoms (MTOPS)20 indicaron que el riesgo de desarrollar insuficiencia renal en un varón con STUI es menor del 1%, la EAU7 aconseja la determinación de creatinina en la evaluación inicial del paciente con HBP. Si hubiese sospecha de alteración de la función renal (creatinina>1,5), se debería solicitar una ecografía para descartar uropatía obstructiva.
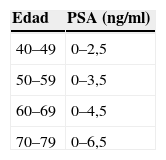
Antígeno prostático específico (nivel de evidencia III, grado de recomendación B)7: no es un marcador específico de carcinoma, sino de tejido prostático. Aunque es cierto que se ha relacionado un nivel alto de PSA con un aumento de la posibilidad de desarrollar CaP, existen otros cuadros clínicos, como ITU, HBP o prostatitis21,22, que también pueden elevar los niveles de PSA. No se recomienda el uso del PSA sin el tacto rectal. La combinación de ambos es el método más efectivo para la detección precoz del CaP7,19. Los valores normales varían con la edad. Los varones de edad avanzada presentan cifras de PSA ligeramente más altas que los varones más jóvenes23 (tabla 3). En el caso de observarse valores anómalos, los procedimientos para tener en cuenta serían los siguientes:
- •
Si el valor del PSA es>10ng/ml hay que realizar una biopsia guiada por ecografía.
- •
Si el valor del PSA se sitúa entre 4 y 10ng/ml, hay que valorar el cociente PSA libre/total y la velocidad del PSA:
- ○
Un cociente PSA libre/total >0,2 (>20%) indica HBP
- ○
Un cociente PSA libre/total<0,2 (<20%) indica CaP y obliga a practicar una biopsia.
- ○
- •
Un aumento del PSA>0,75ng/ml/año indica CaP. Los pacientes diagnosticados de CaP que presentan una velocidad de PSA>2,0ng/ml/año tienen 9,8 veces más probabilidades de morir de CaP que los que presentan una velocidad de PSA<2ng/ml/año.
- •
En los pacientes tratados con inhibidores de la 5-alfa-reductasa las cifras de PSA se reducen a la mitad a partir de los 6 meses de tratamiento24, por lo que para conocer el valor real de PSA se deberá multiplicar por 2 la cifra de PSA. La cifra obtenida mantiene la sensibilidad y especificidad del PSA obtenido25.
Rango normal del antígeno prostático específico (PSA, prostate-specific antigen) en función de la edad
| Edad | PSA (ng/ml) |
| 40–49 | 0–2,5 |
| 50–59 | 0–3,5 |
| 60–69 | 0–4,5 |
| 70–79 | 0–6,5 |
Oesterling et al23.
Se recomienda20,26–30 valorar los niveles de PSA en todos los varones mayores de 50 años que consulten por STUI, en pacientes mayores de 45 años con un antecedente familiar de primer grado de CaP, en pacientes mayores de 40 años con 2 o más antecedentes familiares de primer grado de CaP, en varones de raza negra mayores de 45 años. En varones mayores de 70 años o con esperanza de vida inferior a 10 años no se recomienda la realización de una estrategia diagnóstica precoz.
En el caso de pacientes asintomáticos mayores de 50 años, la solicitud del PSA es controvertida31. Diversas entidades científicas proponen compartir con el paciente las decisiones sobre el diagnóstico precoz del CaP26, y recomiendan que se les informe mediante un consentimiento informado31,32 sobre los beneficios y los riesgos de la prueba33,34 para que decidan por sí mismos libremente. Los beneficios potenciales abarcan un diagnóstico temprano de cáncer con una mejor oportunidad de cura. Entre los riesgos, se encuentran un aumento de los costes de la atención médica, la realización de biopsias prostáticas innecesarias, la probabilidad de falsos negativos, lo que da lugar al retraso en el diagnóstico del cáncer, o de falsos resultados positivos que generan un aumento de ansiedad innecesario. Cada paciente deberá sopesar estos factores para determinar si el examen de rutina está justificado en su caso1,35,36.
Otras pruebas complementariasEcografía abdominal (nivel de evidencia III, grado de recomendación B)Es una exploración inocua que sirve para valorar lo siguiente2,37:
- •
El tamaño prostático: peso de la próstata (gramos) = A × B × C × 1/2, donde A, B, y C son la anchura, la altura y la profundidad de la próstata.
- •
El residuo posmiccional: volumen (mililitros) = A + B + C × 3/4, donde A, B y C son la anchura, altura y profundidad vesical. Un volumen posmiccional >100–200ml indica disfunción vesical y elevada probabilidad de retención aguda de orina (RAO), que predice una menor respuesta al tratamiento, por lo que debe plantearse la cirugía como posible tratamiento1. Debido a la variabilidad de esta prueba diagnóstica, se aconseja realizar al menos 2 ecografías37. A pacientes con niveles permanentemente elevados de residuo posmiccional se les debe solicitar estudios y pruebas de imagen del tracto urinario superior para descartar fallo renal38. La presencia de residuo posmiccional permanente también puede indicar una baja actividad del detrusor, por lo que, si se sospecha, debería valorarse la realización de estudios urodinámicos para conocer la función vesical y descartar enfermedades distintas a HBP39
- •
Las vías urinarias, en caso de hematuria, infección urinaria, insuficiencia renal o litiasis.
Se deberá solicitar una ecografía abdominal en:
- •
Pacientes con antecedentes de litiasis renal.
- •
Pacientes con microhematuria o macrohematuria.
- •
Pacientes con globo vesical.
- •
Pacientes con sospecha de obstrucción.
- •
Presencia de sintomatología grave.
- •
Pacientes con antecedentes de trauma espinal, neuropatía y otras alteraciones neurológicas asociadas.
- •
Pacientes con valores de creatinina aumentada.
Es una exploración que sirve para determinar el volumen prostático y la morfología cuando el tacto rectal ha dado indicios de enfermedad neoplásica. No es una exploración que nos permita valorar las vías urinarias ni cuantificar el residuo2. Aunque es una prueba que no se recomienda en la evaluación inicial, si se tiene sospecha de enfermedad grave prostática, está totalmente indicada su utilización diagnóstica, en ámbito ambulatorio. Solicitaremos ecografía transrectal en pacientes que presenten sospecha de malignidad (cifras alteradas de PSA o tacto rectal positivo) para la realización de biopsias ecodirigidas2.
Tratamiento para la hiperplasia benigna de próstataEl tratamiento de la HBP tiene como objetivos disminuir los síntomas, mejorar la calidad de vida y evitar la aparición de complicaciones como la retención urinaria7.
El abordaje terapéutico variará en función de la edad del paciente, la sintomatología, la calidad de vida, las complicaciones y la enfermedad asociada.
Existen 3 opciones terapéuticas para la HBP7: vigilancia expectante y medidas higienicodietéticas, tratamiento farmacológico o tratamiento quirúrgico (fig. 1).
Vigilancia expectante y medidas higienicodietéticasLos pacientes controlados mediante vigilancia expectante han de comprender que se trata de un programa activo que los obliga a que se les realice revisiones periódicas y a realizar cambios en su estilo de vida, tales como evitar el sedentarismo, restricción de líquidos por la noche, restricción del consumo de café, alcohol y determinados medicamentos que actúan sobre la fibra muscular lisa (neurolépticos, anticolinérgicos, etc.), así como modificar los hábitos miccionales.
Tratamiento farmacológicoAgentes fitoterapéuticos (extractos de plantas)La mayor parte de las evidencias sobre su eficacia proceden de estudios clínicos con problemas de diseño (escaso número de pacientes, seguimiento inferior a 6 meses, etc.), por lo que se desconoce cuáles son con exactitud sus mecanismos de acción, y existe gran controversia sobre la eficacia clínica. No están recomendados como tratamientos de primera elección por las guías de la EAU de 20047 para el tratamiento de la HBP. Se les suele atribuir una eficacia similar al placebo. La única sustancia de este grupo de la que se disponen datos científicos más fiables (nivel de evidencia IIa, grado de recomendación B) es la Serenoa repens en dosis de 160mg/12h. En una revisión sistemática40 se indicó que la S. repens era más efectiva que el placebo y proporcionaba una mejoría de leve a moderada en los síntomas urinarios y las medidas de flujo, similar a la observada con finasterida pero con menor incidencia de efectos adversos.
Bloqueadores alfaadrenérgicos (nivel de evidencia Ia, grado de recomendación A)Los bloqueadores alfa actúan fundamentalmente sobre el aspecto sintomático de la HBP, no tienen ningún efecto sobre el volumen de la próstata ni previenen su crecimiento11,12. El tratamiento de la HBP con bloqueadores alfa-1 puede llegar a mejorar la sintomatología en 4 a 6 puntos del IPSS7. Los receptores adrenérgicos tipo alfa-1 se encuentran localizados en el cuello vesical, el trígono, la uretra prostática y la próstata. Se conocen diferentes subtipos de receptores alfa-1 (A, B, D y L); en la próstata predomina en un 98% el subtipo alfa-1A. La estimulación simpática de estos receptores provoca un aumento en la resistencia uretral; por el contrario, su bloqueo se traduce en una relajación de la fibra muscular lisa que hace disminuir la resistencia uretral a la salida de la orina41.
Inicialmente, se usaron en el tratamiento de la HBP fármacos bloqueadores alfa no selectivos, que actuaban sobre los receptores alfa-1 y alfa-2 (fentolamina, fenoxibenzamina) con importantes efectos adversos. Posteriormente, aparecieron fármacos bloqueadores alfa selectivos de los receptores alfa-1 (doxazosina, prazosina, terazosina) que producían menos efectos secundarios. Actualmente se dispone de otra opción terapéutica: los bloqueadores alfa-1A (alfuzosina y tamsulosina); son uroselectivos, por lo que presentan una mejoría importante en la tolerancia42, y no se observan diferencias significativas en relación con los efectos secundarios, respecto al grupo placebo1. Los efectos secundarios se minimizan al administrarlos por la noche y comenzar con dosis bajas, y desaparecen al retirarlos. A pesar de que los bloqueadores alfa no selectivos, por su efecto hipotensor, se han venido utilizando para tratar, como única medicación, a los pacientes afectados de HBP e hipertensión arterial (HTA)43, hoy no se debería recomendar la utilización de los bloqueadores alfa como tratamiento único de la HTA, y se debería considerar por separado ambas enfermedades en el momento de plantearse el tratamiento44.
Inhibidores de la 5-alfa-reductasa (nivel de evidencia Ia, grado de recomendación A)La enzima 5-alfa-reductasa transforma la testosterona dentro de la célula prostática en un metabolito activo, la DHT. En la próstata existen 2 formas isoenzimáticas de la 5-alfa-reductasa (tipo 1 y tipo 2). El contenido de DHT en la próstata de pacientes con HBP se encuentra aumentado entre 3 y 4 respecto al de la próstata normal1. Estos fármacos disminuyen el tamaño de la próstata en un 20–30% y reducen los niveles de PSA a la mitad de su valor, por lo que para la evaluación precoz del cáncer de próstata se aconseja multiplicar por 2 el valor de PSA obtenido. No se alteran los valores de PSA libre2. El beneficio terapéutico aparece a partir de los 3–6 meses.
Los inhibidores de la 5-alfa-reductasa comercializados son la finasterida y la dutasterida. La finasterida es un inhibidor de la isoenzima tipo 2. Los resultados de estudios realizados en pacientes con volumen prostático mayor de 40 cm3 indican que reduce los niveles de DHT en un 70%, mejora los síntomas y reduce el riesgo de RAO45 y de cirugía. La dutasterida es un inhibidor de las isoenzimas tipos 1 y 2. Estudios realizados en pacientes con volumen prostático a partir de 30 cm3 muestran que la dutasterida es capaz de reducir el nivel de DHT en >90%46, mejorar los síntomas de forma continuada durante el tiempo, disminuir el riesgo de RAO en un 57% y el riesgo de cirugía en un 48%2,47.
Los efectos secundarios más frecuentes que pueden aparecer con los inhibidores de la 5-alfa-reductasa son principalmente de la esfera sexual y debidos al bloqueo hormonal que realizan: disfunción eréctil (5–7%), disminución de la libido (3%), reducción del volumen eyaculatorio o trastornos en la eyaculación (1,5–2%) y ginecomastia (1,3–3%)
Tratamiento combinado (nivel de evidencia Ib, grado de recomendación A)El tratamiento combinado consiste en la asociación de un bloqueador alfa y un inhibidor de la 5-alfa-reductasa. Los resultados de recientes estudios clínicos prospectivos y aleatorizados20,48 indicaron que el tratamiento combinado de un bloqueador alfa y un inhibidor de la 5-alfa-reductasa resultaba más eficaz que el tratamiento con esos fármacos en monoterapia. Según los estudios MTOPS20 y CombAT48 (combinación de Avodart® [dutasteride] y tamsulosin), el tratamiento combinado estaría especialmente indicado en aquellos pacientes que se presenten con síntomas moderados o graves del tracto urinario inferior (TUI), crecimiento prostático demostrable y cifras de PSA>1,5ng/ml, por ser todos ellos factores pronósticos de enfermedad progresiva.
En el estudio CombAT48, el tratamiento combinado con dutasterida y tamsulosina logró una significativa mejora en la sintomatología respecto del tratamiento en monoterapia con dutasterida (a partir del tercer mes) o con tamsulosina (a partir del noveno mes). Mejoras similares se observaron en cuanto a la calidad de vida del paciente y en el flujo urinario máximo. Estas evidencias nos han llevado a proponer en el algoritmo del tratamiento médico de HBP, la elección del tratamiento combinado de dutasterida y tamsulosina en pacientes con IPSS moderado (8-20), volumen prostático grande al tacto rectal y PSA>1,5ng/ml.
Tratamiento quirúrgicoEl tamaño prostático es un determinante a la hora de elegir la vía de abordaje quirúrgico1. Las principales técnicas quirúrgicas convencionales son las siguientes7:
La incisión transuretral de la próstata (ITUP): es el método quirúrgico de elección en los varones con próstata de volumen inferior a 30 cm3 y sin lóbulo medio.
La resección transuretral de próstata (RTUP): indicada en pacientes con una próstata de volumen intermedio, entre 30 y 80 cm3. Es el método más utilizado, ya que el 90% de los pacientes se encuentra en este rango de volumen prostático.
La prostatectomía o adenomectomía abierta: es el método quirúrgico de elección en varones con próstata mayor de 60–80 cm3.
Tras la intervención se logra una mejora del flujo máximo en más de 10ml/s y de la sintomatología en 15–20 puntos del IPSS. Los riesgos más frecuentes a largo plazo son la eyaculación retrógrada (el 80% adenomectomía, el 65–70% RTUP, el 40% ITUP), la contractura del cuello vesical o estenosis uretral (5%) y la incontinencia urinaria (1–2%).
Existen actualmente otras técnicas quirúrgicas alternativas, poco invasivas, con una eficacia clínica similar a la de las técnicas convencionales y con menor riesgo de hemorragia, tiempo de sondaje y hospitalización. Las principales técnicas quirúrgicas alternativas son las siguientes:
La electroevaporización transuretral: técnica apropiada en pacientes de alto riesgo con próstata de pequeño tamaño.
La resección prostática con energía láser (holmio y KTP [potasio-titanio-fósforo]): técnica indicada en pacientes de alto riesgo que requieren un tratamiento poco invasivo en próstatas de pequeño o moderado volumen.
La enucleación con láser Holmio: indicada en próstatas de moderado o gran tamaño.
Recomendación terapéuticaVigilancia expectanteIndicado en pacientes que presenten puntuaciones del IPSS ≤7 y con una situación clínica libre de complicaciones (hematuria, infecciones o RAO).
Tratamiento farmacológicoEl tratamiento farmacológico está indicado en pacientes con sintomatología moderada-grave (IPSS 8-20), que no presentan una indicación absoluta de cirugía y que no cumplen los criterios de derivación al urólogo (fig. 1).
En función del grado de gravedad de los síntomas, el tamaño prostático evaluado mediante tacto rectal y el PSA podemos diferenciar 3 situaciones clínicas:
Pacientes con puntuaciones de IPSS entre 8 y 20, con próstata pequeña al tacto rectal: se recomienda iniciar tratamiento con bloqueadores alfa.
Pacientes con puntuaciones de IPSS entre 8 y 20, con próstata grande al tacto rectal: se recomienda iniciar con bloqueadores alfa o con inhibidores de la 5-alfa-reductasa (dutasterida o finasterida).
Puntuaciones de IPSS entre 8 y 20, con próstata grande al tacto rectal y PSA>1,5ng/ml: se recomienda tratamiento combinado con bloqueadores alfa y con inhibidores de la 5-alfa-reductasa (dutasterida o finasterida).
El tratamiento con S. repens no está recomendado por la guías de la EAU de 20047.
Tratamiento quirúrgicoSegún las guías clínicas para HBP de la EAU7, el tratamiento quirúrgico estaría indicado en los pacientes con síntomas moderados o graves del STUI que no mejoran después de tratamiento farmacológico (o que solicitan una intervención activa en lugar del tratamiento farmacológico) y que presentan alguna de las siguientes indicaciones claras para la cirugía: insuficiencia renal, litiasis vesical, retención urinaria refractaria, infección urinaria recurrente, o hematuria recurrente refractaria al tratamiento médico con inhibidores de la 5-alfa-reductasa.
SeguimientoA los pacientes en tratamiento que carezcan de criterios quirúrgicos se los puede seguir en AP49.
Pacientes en vigilancia expectante: se deberá revaluar al paciente, como mínimo al año, y valorar el cambio de síntomas o la aparición de complicaciones.
Pacientes en tratamiento con un bloqueador alfa: se deberá evaluar su eficacia y tolerabilidad mediante el IPSS, al primer y al tercer mes del inicio del tratamiento.
Pacientes tratados con un inhibidor de la 5-alfa-reductasa: se deberá evaluar su eficacia y tolerabilidad mediante el IPSS al sexto mes del inicio del tratamiento.
Pacientes en tratamiento combinado (bloqueador alfa con un inhibidor de la 5-alfa-reductasa): se deberá evaluar su eficacia y tolerabilidad mediante el IPSS al primer y al sexto mes del inicio del tratamiento.
Si hubiese mejoría, la revisión pasaría a ser anual y se incluiría la evaluación del IPSS, exploración física con tacto rectal, tira de orina, valoración de los niveles de creatinina y una determinación del PSA50,51.
De forma individualizada y si existe riesgo de obstrucción, aconsejaremos prioritariamente una flujometría y, en su defecto, una ecografía renovesicoprostática con residuo posmiccional de forma anual.
Criterios de derivaciónSe deberán derivar al especialista:
- •
Los pacientes con STUI que tras el diagnóstico diferencial presenten alguna de las siguientes anomalías:
- ○
Tacto rectal patológico: superficie irregular, aumento de la consistencia, existencia de nódulos o límites mal definidos.
- ○
IPSS grave (>20) o mala calidad de vida.
- ○
PSA >10ng/ml.
- ○
PSA >4ng/ml y PSA libre <20%.
- ○
Edad <50 y STUI con sospecha de HBP.
- ○
Creatinina elevada >1,5ng/ml: si la ecografía indica uropatía obstructiva se derivará al paciente al hospital o a urología. Si hay alteración de la función renal y se descarta uropatía obstructiva, la derivación se hará a nefrología.
- ○
- •
Los pacientes sin HBP.
- •
Los pacientes que presenten alguna de las siguientes complicaciones:
- ○
Urolitiasis
- ○
Divertículos
- ○
Uropatía obstructiva
- ○
Residuo miccional >150.
- ○
- •
A los pacientes que acudan a consulta con RAO, de no estar contraindicado, se les deberá intentar sondar; en caso de no ser efectivo, se los deberá remitir a urgencias, y en caso contrario serán derivados al urólogo.
- •
Pacientes con signos de retención crónica de orina, valorada por residuo posmiccional, dado que habitualmente requieren un tratamiento quirúrgico.
- •
Los pacientes en tratamiento farmacológico para la HBP si no presentaran mejoría:
- ○
Al tercer mes de tratamiento continuado con bloqueadores alfa.
- ○
Al sexto mes de tratamiento continuado con 5-alfa-reductasa.
- ○
Este documento de consenso se publica simultáneamente y de forma íntegra en las siguientes publicaciones: SEMERGEN, Medicina General y Actas Urológicas Españolas.