(95% CI 0.161-0.744). Conclusions. In children aged less than 1 year, we have not found protective effects of breast-feeding against acute respiratory infectious diseases. Only in the period 3-6 months old, we have found that BF protects against these diseases.
Introducción
La leche humana desempeña un destacado papel como nutriente óptimo para el recién nacido y el lactante pequeño (hasta los 12 meses de vida)1. La lactancia materna (LM) parece conferir protección inmunológica frente a las infecciones y los procesos alérgicos, y puede reducir la incidencia de enfermedades infecciosas en la infancia2. El amamantamiento promueve los factores bioactivos, hormonas, factores de crecimiento, nutrientes específicos y factores estimulantes de la flora bacteriana,
y produce la maduración de la mucosa gastrointestinal3. Además, los niños con LM se exponen menos a los antígenos de la dieta complementaria o externa. La protección de la LM se extiende incluso después de finalizarla3. Recientes publicaciones aportan evidencias de los beneficios de la LM en la protección inmunológica3 y se asocia con tasas más bajas de hospitalización2. En países en vías de desarrollo4 hay pocas dudas sobre su eficacia para disminuir la incidencia de estos procesos. Sin embargo, cuando estas investigaciones se realizan en países desarrollados, los resultados son contradictorios4.
En el año 1989, la Organización Mundial de la Salud (OMS) y la UNICEF hicieron una declaración conjunta para fomentar la LM. Estos organismos internacionales declaran que la LM forma parte natural e ideal de la alimentación del lactante y constituye una base biológica única para el desarrollo del niño5. La Asociación Española de Pediatría aconseja la alimentación del niño con LM durante el primer semestre de vida y recomienda la puesta en marcha de programas para fomentarla6. Los programas de promoción en otros países han conseguido aumentos significativos de la LM, pero continúa habiendo dificultades en su prolongación durante un período suficiente para que proporcione los efectos beneficiosos deseados7-9.
A pesar de las recomendaciones de los expertos5-8, su prevalencia en niños menores de 4 meses sigue siendo baja en muchos países europeos10. Como sucede en nuestro país, estudios recientes revelan unas tasas bajas de LM: aunque cerca del 90% de las madres la empiezan, al mes sólo continúa un 30%; a los 3 meses más de la mitad de los niños toma lactancia artificial y a los 6 meses sólo un 10% mantiene la LM8. Un reciente informe del comité LM de la Asociación de Pediatría Española presenta un ligero aumento en el número de madres que lactan a sus hijos6. Se han detectado varios factores relacionados con ello9,11,17: el modelo de atención primaria en centros de salud, la asistencia al Programa del Niño Sano, la visita domiciliaria y los grupos de apoyo.
La finalidad del presente estudio es analizar si hay relación entre en LM y el mayor protección ante infecciones agudas respiratorias y digestivas en niños de 0-12 meses de vida atendidos en el Programa del Lactante Sano de un centro de salud.
Material y métodos
Diseño
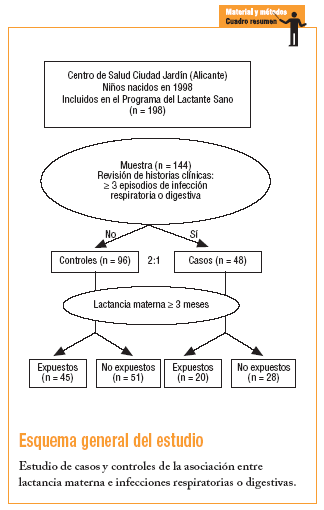
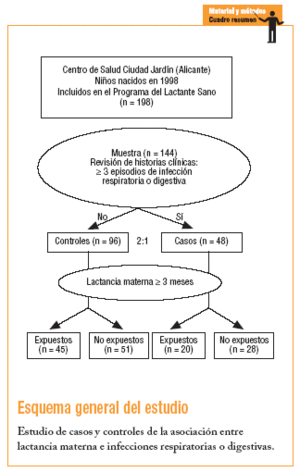
Estudio observacional analítico de casos y controles.
Ámbito
Centro de Salud de Ciudad Jardín (Alicante, área de salud 18) que abarca una zona de características urbanas de clase media, con una población asignada de 22.500 habitantes (2.100 niños de 0-14 años).
Criterios de selección
Criterios de inclusión: recién nacido sano a término que esté incluido en el programa del lactante sano y acuda a los controles periódicos, desde los 15 días hasta el control de 12 meses, y cuyo seguimiento se encuentre registrado en su totalidad en la historia clínica.
Criterios de exclusión: a) enfermedades congénitas del metabolismo, como galactosemia, mucoviscidosis, celiaquía o inmunodepresión y estenosis de píloro, y b) no acudir a los controles periódicos del lactante y no tener registro en su historia de las actividades que se realizan al niño, tanto en el ámbito preventivo como asistencial, dentro del Programa del Lactante Sano.
Definición de caso: niño incluido en el Programa del Lactante Sano en cuya historia se hubiera registrado 3 o más episodios de infección respiratoria o digestiva ocurridos durante el primer año de vida.
Definición de control: niño incluido en el Programa del Lactante Sano en cuya historia se hubiera registrado menos de 3 episodios durante el mismo período (primer año de vida).
Definición sobre la exposición: se considera que un niño está expuesto si ha recibido LM durante 3 meses o más, y no expuesto si ha recibido LM menos de 3 meses2.
Población de estudio
Estaba constituida por todos los niños de 0-12 meses nacidos entre el 1 de enero y el 31 de diciembre de 1998 que tenían historia clínica en el centro de salud y habían sido seguidos por el Programa del Lactante Sano (n = 190).
Tamaño muestral
El cálculo se realizó considerando un riesgo alfa de 0,05 y un riesgo beta de 0,20, una hipótesis unilateral, una proporción de exposición a la lactancia en el grupo de casos del 48% y una proporción en el grupo de controles del 71%, con una potencia suficiente para detectar una odds ratio (OR) de 0,4. Aplicando la fórmula de Lilinfield18 modificada para grupos con tamaño desigual, se precisan 48 sujetos en el grupo de casos y 96 sujetos en el grupo de controles (n = 144). El número de controles respecto de los casos es de 2:1, según los criterios de Lilinfield18 y de Rebagliato19. El tamaño de la muestra se estableció en 144 participantes
Muestreo
Se realizó un muestreo aleatorio simple a partir del listado de las historias incluidas en el Programa del Lactante Sano de los niños nacidos durante el año 1998. Se excluyeron las historias que no cumplían los criterios de inclusión requeridos para el estudio, hasta completar el tamaño muestral necesario.
Descripción de las variables
El factor de estudio corresponde al tipo de lactancia: LM exclusiva (LMEX), LM combinada con fórmula (LMIX) o lactancia artificial (LA). La duración de la lactancia se recogió en meses (variable cuantitativa).
La variable de respuesta fue la presencia de infección respiratoria o digestiva. Los criterios diagnósticos de los procesos infecciosos fueron los siguientes: respiratorios (faringoamigdalitis, bronquitis, otitis y neumonía) y digestivos (gastroenteritis); la presencia o ausencia de infecciones respiratorias (IR) y las infecciones digestivas (ID) se recogieron como variables categóricas (cualitativas). Se consideró el diagnóstico registrado en la historia. Cuando sólo constaban signos y síntomas, se consultó al pediatra responsable del niño. Se contó con el asesoramiento de un pediatra para clasificar los diagnósticos de infección respiratoria y/o digestiva aguda.
Fuentes de información y hoja de recogida de datos
Los datos procedían de las historias pertenecientes al Programa del Lactante Sano. Se elaboró una hoja específicamente diseñada para recoger los datos del estudio.
Estrategia de análisis
Se realiza una descripción de la población estudiada. Se estudió la asociación de las variables dependientes (IR e ID) e independientes (duración de la LM) mediante la OR20 y se calculó el intervalo de confianza con un 95% de seguridad (IC del 95%). El estudio se completó con el análisis de diversos grados de exposición a la LM: 1, 2 y 4 meses. También se realizó un análisis independiente de la asociación entre LM e IR para cada trimestre de vida (es decir, analizando exclusivamente los episodios de enfermedad ocurridos en ese trimestre y la exposición durante éste a LM).
Finalmente, se realiza un análisis multivariable (regresión logística), para lo que se utiliza el criterio de evaluación como variable dependiente y el resto de variables como independientes.
Se realizó un análisis de comparabilidad de los grupos y de correlación de Pearson, correlación simple entre la duración de la LM y otros parámetros estudiados, como peso al nacer y ganancia ponderal por trimestres.
Resultados
Características de los sujetos estudiados
El 50,7% (73) era varón. Hubo un 33% (n = 48) de controles y un 67% (n = 96) de casos.
Tipo de alimentación
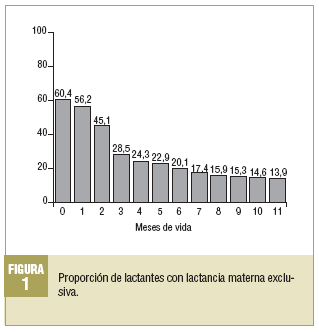
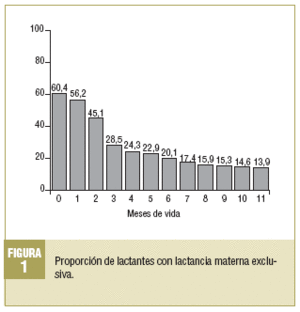
El 60,4% (n = 87) de los recién nacidos inicia LM exclusiva (tabla 1), pero sólo el 28,5% (n = 41) recibe al menos 3 meses de LM (fig. 1). El porcentaje de niños con lactancia desciende en los sucesivos trimestres, de forma que al inicio del cuarto trimestre sólo la recibe el 15,3% (n = 22) y al final del año el 13,9% (n = 20) de los niños. La media ± desviación estándar (DE) de meses con LM exclusiva es de 3,3 ± 4,2. Si se incluyen tanto la LM exclusiva como la mixta, el 72,9% (n = 105) de los recién nacidos inicia este tipo de alimentación, la mantiene el 40,6% (n = 58) en los 3 primeros meses, el 27,7% (n = 40) llega al cuarto trimestre y sólo el 26,3% (n = 38) la recibe durante todo el primer año. La media de meses con LM exclusiva o mixta es de 5,16 ± 4,7. La lactancia artificial presenta los porcentajes complementarios de la LM (exclusiva o mixta). Así, un 27,1% (n = 39) de las madres opta por dar desde el nacimiento lactancia artificial. Al inicio del segundo trimestre, el 59,4% (n = 86) de los niños recibe esta modalidad. Al inicio del cuarto trimestre, el 72,3% (n = 104) se alimenta con lactancia artificial.
Infecciones respiratorias y digestivas
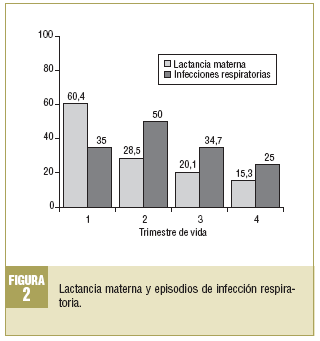
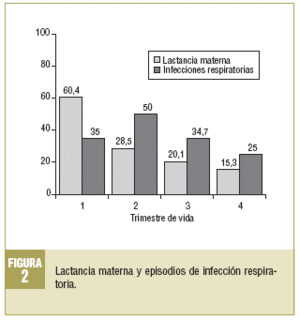
Respecto de las IR, al menos el 79,2% (n = 114) padeció alguna en el primer año. En la figura 2 se describe la evolución y se observa que el segundo trimestre de vida es el que presenta la mayor proporción de IR (50%; n = 72), mientras que en el cuarto se observa la menor (25%; n = 36).
Las ID fueron muy poco frecuentes. Sólo el 14,6% de los niños padeció alguna durante el primer año de vida y únicamente se contabilizó un total de 21 episodios.
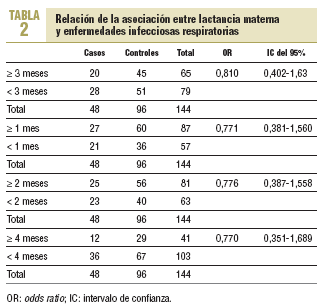
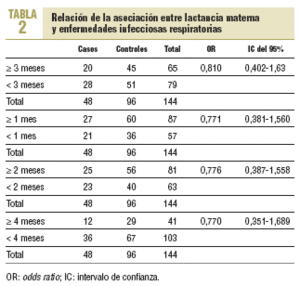
Al analizar la asociación entre LM de 3 o más meses y presencia de enfermedad infecciosa respiratoria durante el primer año, se observa una OR de 0,81 (IC del 95%, 0,40-1,63) (tabla 2).
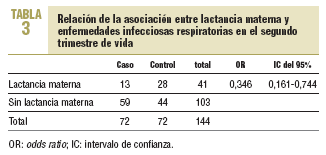
En el segundo trimestre se observa una OR de 0,346 (IC del 95%, 0,161-0,744), con una asociación estadísticamente significativa entre ambas variables (tabla 3). Por tanto, en el segundo trimestre, la LM es un factor protector para las IR en una relación 1/2,89. Los niños no alimentados con LM tienen una probabilidad casi 3 veces superior de padecer IR.
Al analizar la correlación entre la duración de la LM y el resto de las variables estudiadas (edad, peso, talla) no se encontró significación estadística. Se aplicó un modelo multivariable de regresión logística sin que éste fuera significativo.
Discusión
Los estudios de casos y controles20 presentan una ventaja importante: el grado de información que ofrecen y el tiempo que se precisa para obtenerla permiten estudiar a un gran número de casos de una enfermedad en poco tiempo, mientras que en un estudio de cohortes es necesario mucho tiempo para que unos pocos desarrollen la enfermedad. Además, permiten estimar el riesgo de padecer una enfermedad en relación con una exposición y evaluar varios factores de riesgo simultáneamente. Por sus características, los estudios de casos y controles son utilizados en la valoración de medidas preventivas cuando, por razones éticas o logísticas, los ensayos clínicos no se pueden realizar19. Por su eficiencia en tiempo y coste, se decidió elegir este tipo de estudio para realizar nuestro trabajo. También hemos tenido en cuenta las posibles limitaciones que presenta. Un factor esencial en estos estudios de casos y controles es conseguir la mayor comparabilidad entre los grupos para que la posible asociación entre la exposición y la enfermedad sea válida20. Conocedores de este hecho, pasamos a describir las estrategias empleadas para minimizarlos con el objetivo de asegurar una adecuada validez interna19-21.
La selección de los controles proviene de la población general de lactantes atendida en el centro, lo que facilita la comparabilidad20. De los niños adscritos al centro de salud en 1998, sólo un 1% no estaba incluido en el seguimiento del Programa de Atención al Lactante Sano.
Al utilizar datos recogidos de historias clínicas (datos secundarios) puede haber limitaciones relacionadas con la cumplimentación de los datos registrados. Podría producirse un sesgo de información si no se especifican claramente los criterios diagnósticos o si hubiera episodios que no hubieran sido registrados, o si el paciente hubiera recurrido a otros servicios sanitarios; esto produciría un sesgo por mala clasificación y se podría catalogar a un paciente como control cuando en realidad debería ser incluido como caso20. Ante estos posibles sesgos, los criterios diagnósticos de nuestro centro han sido uniformes, pues hay criterios unificados en el equipo, aunque no se puede garantizar el registro absoluto en las historias de todos los procesos. Por la experiencia de la práctica diaria sabemos que la mayoría de las madres que acuden al Programa del Lactante Sano no suele recurrir a servicios privados, pues se consideran bien atendidas.
El control periódico del lactante puede interactuar como efecto protector y modificar el criterio de evaluación, y habría que considerarlo como un posible factor de confusión. En este estudio está controlado, pues todos los sujetos proceden del Programa del Lactante; por tanto, los grupos estudiados, tanto los casos como los controles, son similares en relación con esta característica.
Respecto de los resultados obtenidos, al revisar la bibliografía observamos que en países con un sistema de salud poco desarrollado, como en Filipinas, la LM tiene un efecto protector importantísimo, pues disminuye el número de muertes por infecciones15. En otro estudio de casos y controles14 realizado en Brasil en niños < 1 año sobre el efecto de la LM en los ingresos hospitalarios por neumonía se evidencia que los que no recibieron LM (sólo lactancia artificial) tenían 17 veces más probabilidad de ser ingresados por esta causa que los alimentados con LM. En Estados Unidos, Leventhal et al2 realizaron un estudio de casos y controles emparejados, en niños de 3 meses de edad, para determinar si la LM protege de las infecciones. Se obtuvo una OR de 0,50 (IC del 95%, 0,32-0,77), lo que indica que la LM es protectora. Pero este efecto desapareció al estratificar según la gravedad de la infección. Estos datos sugieren que la LM protege más del ingreso hospitalario que de las infecciones2.
Kramer et al25 demuestran en un estudio reciente la efectividad de los cursos promovidos por la OMS-UNICEF con el objetivo de promover y proteger las prácticas de la LM y la prevención sobre los procesos infecciosos gastrointestinales y respiratorios y el eccema atópico.
En otro reciente estudio en el que participaron 2.602 niños se analiza la relación entre la duración de la LM y la morbilidad en las IR en el primer año de vida, resultando que el predominio de la LM durante 6 meses y la toma de lactancia mixta durante el primer año de vida puede reducir la prevalencia de la morbilidad de las enfermedades respiratorias e infecciones en la infancia22,23.
Parece, pues, que hay datos recientes a favor de que la LM no confiere protección generalizada, sólo en los casos más graves15 o en períodos concretos del primer año de vida23,25,26, al igual que ocurre en nuestro estudio.
En nuestro trabajo, en los trimestres 1, 3 y 4 no se encontró una asociación estadísticamente significativa, pero en el análisis independiente por trimestres se observa que en el segundo trimestre de vida hay casi 3 veces más probabilidad de padecer una proceso infeccioso respiratorio en los niños que no recibieron LM. Esto podría sugerir que ambos grupos proceden de una misma población y que el control periódico del lactante influye de manera positiva en su proceso de nutrición y crecimiento y en el control de posibles enfermedades infecciosas, como es el caso de las enfermedades e infecciones digestivas, que son poco frecuentes en el ámbito de la atención primaria. Posiblemente los casos con gastroenteritis más graves acudan al hospital, lo que también podría influir en el número tan bajo de estos enfermos en los centros de salud.
Sin embargo, en nuestro estudio, en el segundo trimestre se produce un aumento de los procesos infecciosos respiratorios que coincide con más abandonos de la LM, y se ha encontrado que hay casi 3 veces más probabilidad de padecer un proceso infeccioso respiratorio en los niños que no recibieron LM.
Ante estos resultados podemos concluir que, aunque se considera que la LM es beneficiosa para los lactantes, sigue habiendo controversias sobre la protección que confiere frente a las enfermedades infecciosas en los niños lactantes de países desarrollados y con un buen sistema sanitario16,24,26,27.
Por tanto, creemos necesario seguir investigando en esta línea mediante estudios de carácter prospectivo, como de cohortes, que nos aporten nuevos resultados sobre las ventajas y los beneficios de la lactancia materna.