En 1994, la Organización Mundial de la Salud estableció criterios de osteoporosis en función de la densidad mineral ósea (en términos de T score) otorgando a un factor de riesgo la categoría de enfermedad. Dado que tiene un escaso valor predictivo positivo de fracturas cuando se aplica a poblaciones de bajo riesgo, su uso como prueba de cribado es controvertido al favorecer el sobrediagnóstico por el falso etiquetado de enfermedad que produce. La indicación de densitometría se hará en función del riesgo absoluto de fractura en los próximos años. Este es el criterio adoptado por el Programa de Actividades Preventivas y de Promoción de la Salud que en sus últimas recomendaciones propone la utilización de la Z-score en lugar de T-score, como criterio de valoración densitométrico, en un claro esfuerzo por luchar contra el sobrediagnóstico.
In 1994, the World Health Organisation established osteoporosis criteria based on bone mineral density (in terms of T-Score), granting a risk factor the category of disease. Given that it has a low positive predictive value of fractures when applied to low-risk populations, its use as a screening test is controversial because it favours overdiagnosis due to the false labelling of the disease it produces. In the coming years, the indication of densitometry will be made based on the absolute risk of fracture. This is the criterion adopted by the PAPPS (Programa de Actividades Preventivas y de Promoción de la Salud or Programme for Preventive Activities and the Promotion of Health), which proposes as part of its latest recommendations the use of the Z-score instead of the T-Score, as a densitometric evaluation criterion, in a clear effort to fight against overdiagnosis.
En el año 1994 se adoptó como criterio diagnóstico de osteoporosis el valor densitométrico, definiéndose como osteoporosis una densidad mineral ósea (DMO) menor o igual de –2,5 DS y como osteopenia una DMO < –1 DS y > –2,5DS; según estos criterios, en España, el 17,2% de las mujeres entre 50 y 60 años serían osteoporóticas, aumentando al 35,2% en el grupo de 60-70 años y a un 52,5% en las mayores de 70 años1. El criterio utilizado para la medición de la masa ósea (T-score) supone comparar la DMO individual con la de una mujer joven (20-25 años), en lugar de la razonable comparación con mujeres de su misma edad (Z-score). De esta forma, se favorece el sobrediagnóstico y como consecuencia también el sobretratamiento y la iatrogenia.
Cribado de la osteoporosisNinguna sociedad científica se ha pronunciado a favor del cribado poblacional de osteoporosis en mujeres posmenopáusicas; sin embargo, la National Osteoporosis Foundation (NOF)2 justifica la realización de densitometría a toda mujer mayor de 50 años que presente determinados factores de riesgo muy prevalentes en la sociedad (historia de fracturas por fragilidad, fumadora, menopausia precoz, baja ingesta de calcio, baja actividad física, etc.), lo que supone preconizar un cribado «de facto».
A la hora de plantear una estrategia de cribado poblacional, hay que tener en cuenta 3 aspectos: la validez de la herramienta de cribado, la eficacia de los tratamientos disponibles y la magnitud del problema.
- a.
La validez de la herramienta de cribado, en este caso la DMO (tabla 1):
Tabla 1.Sensibilidad, especificidad y valor predictivo positivo de la densitometría para predecir fractura de cadera en los próximos 10 años, en función del riesgo de fractura (prevalencia)
Incidencia acumulada de fractura de cadera en los próximos 10 añosa Sensibilidad (%) Especificidad (%) Valor predictivo positivo (%) 3% equivalente aproximadamente a una mujer de 70 años de la Comunidad de Madrid 47 83 9 15% equivalente aproximadamente a una mujer de 80 años de la Comunidad de Madrid 37 88 36 aDependiendo de la incidencia acumulada a lo largo de la vida en la población de referencia, el punto de corte densitométrico será distinto ya que la medida que se utiliza es Z-score.
Fuente: Revilla Abad et al.6.
- –
Sensibilidad: la mitad de las fracturas de cadera y fracturas no vertebrales se producen en mujeres con una DMO normal3. Esto supone un porcentaje importante de falsos negativos, por lo que la validez de la DMO como criterio único en la toma de decisiones es relativa y su uso como herramienta de cribado sería dudoso, sobre todo, considerando que el aumento de edad es 7 veces más importante que el descenso densitométrico para el riesgo de fractura4. Esto ha hecho que muchos autores hayan planteado, como solución a este obstáculo, modificar el umbral de tratamiento y tratar también la osteopenia, es decir, disminuir los falsos negativos a costa de aumentar los falsos positivos.
- –
Especificidad: una medida indirecta de la especificidad es el NNT, valor muy ligado a la prevalencia, por ejemplo, en mujeres de alto riesgo de fractura el NNT fue de 72 (IC del 95%: 61-92) y en las de bajo riesgo de 1.790 (IC del 95%: 1507-2455)4.
- –
Valor predictivo positivo (VPP): mide la eficacia real de una prueba diagnóstica, dando la probabilidad de padecer una enfermedad una vez conocido el resultado de la prueba diagnóstica, y está muy ligado a la prevalencia. La importancia de la DMO depende de la edad5. Un T-score de –3 a los 50 años supone un riesgo de fractura de cadera en 10años menor del 5%, mientras que a los 80 años supone un riesgo del 20%.
- b.
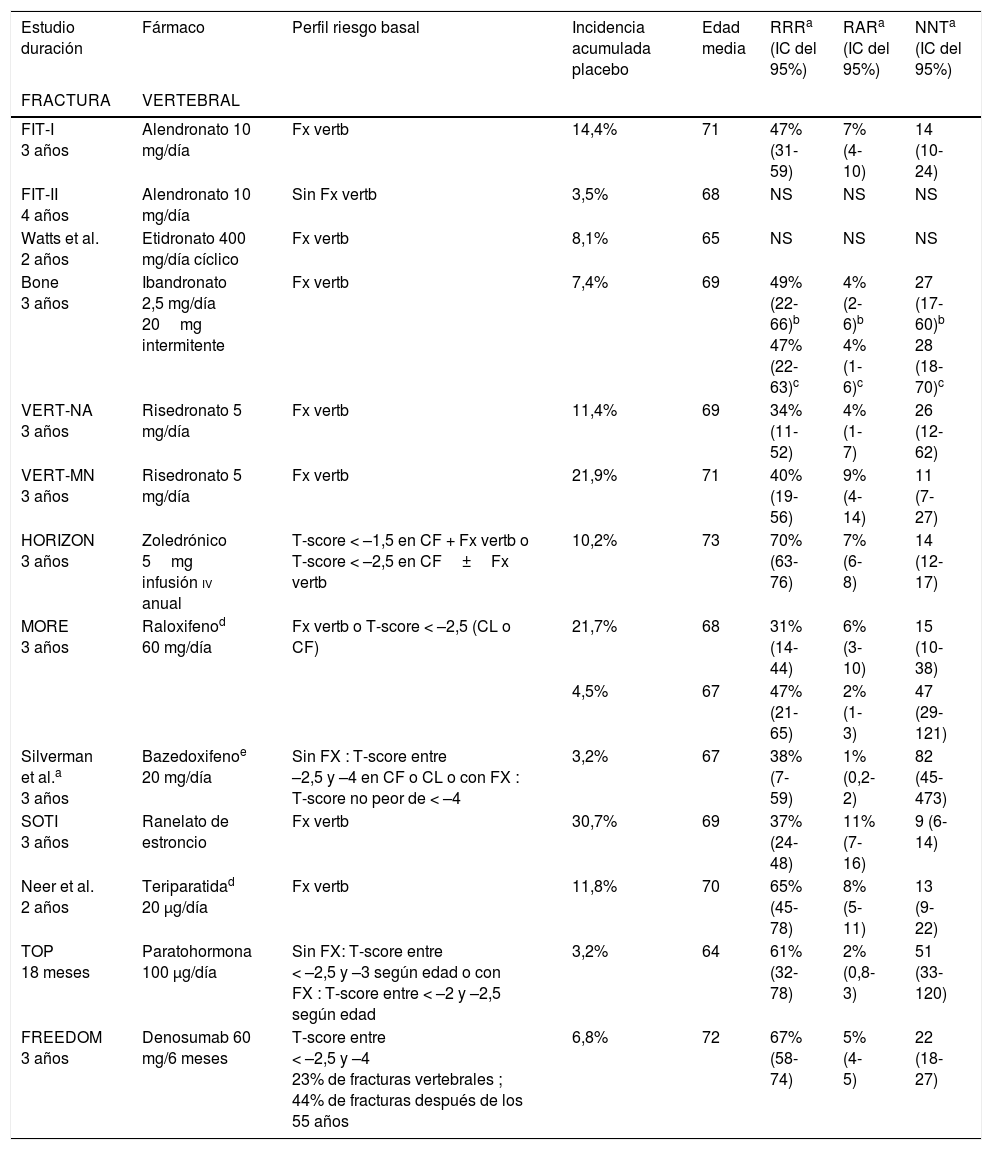
Eficacia del tratamiento: todos los fármacos han demostrado eficacia en mujeres con antecedentes de fracturas vertebrales, pero solo el raloxifeno y el alendronato han demostrado eficacia en prevención primaria (mujeres sin fractura),y lo han hecho en pacientes con T-score < –2,5 DS. No existen estudios que demuestren disminución de fracturas en mujeres con osteopenia7. Por otro lado, tampoco existen estudios que permitan analizar la eficacia del tratamiento de la osteoporosis densitométrica en mujeres menores de 65 años (tabla 2).
Tabla 2.Estudios en prevención de fracturas. Resumen de eficacia
Estudio duración Fármaco Perfil riesgo basal Incidencia acumulada placebo Edad
mediaRRRa
(IC del 95%)RARa
(IC del 95%)NNTa
(IC del 95%)FRACTURA VERTEBRAL FIT-I
3 añosAlendronato 10 mg/día Fx vertb 14,4% 71 47% (31-59) 7% (4-10) 14 (10-24) FIT-II
4 añosAlendronato 10 mg/día Sin Fx vertb 3,5% 68 NS NS NS Watts et al.
2 añosEtidronato 400 mg/día cíclico Fx vertb 8,1% 65 NS NS NS Bone
3 añosIbandronato 2,5 mg/día
20mg intermitenteFx vertb 7,4% 69 49% (22-66)b
47% (22-63)c4% (2-6)b
4% (1-6)c27 (17-60)b
28 (18-70)cVERT-NA
3 añosRisedronato 5 mg/día Fx vertb 11,4% 69 34% (11-52) 4% (1-7) 26 (12-62) VERT-MN
3 añosRisedronato 5 mg/día Fx vertb 21,9% 71 40% (19-56) 9% (4-14) 11 (7-27) HORIZON
3 añosZoledrónico
5mg infusión iv anualT-score < –1,5 en CF + Fx vertb o T-score < –2,5 en CF±Fx vertb 10,2% 73 70% (63-76) 7% (6-8) 14 (12-17) MORE
3 añosRaloxifenod
60 mg/díaFx vertb o T-score < –2,5 (CL o CF) 21,7% 68
31% (14-44) 6% (3-10) 15 (10-38) 4,5% 67
47% (21-65) 2% (1-3) 47 (29-121) Silverman et al.a
3 añosBazedoxifenoe 20 mg/día Sin FX : T-score entre
–2,5 y –4 en CF o CL o con FX : T-score no peor de < –43,2% 67 38% (7-59) 1% (0,2-2) 82 (45-473) SOTI
3 añosRanelato de estroncio Fx vertb 30,7% 69 37% (24-48) 11% (7-16) 9 (6-14) Neer et al.
2 añosTeriparatidad
20 μg/díaFx vertb 11,8% 70 65% (45-78) 8% (5-11) 13 (9-22) TOP
18 mesesParatohormona
100 μg/díaSin FX: T-score entre
< –2,5 y –3 según edad o con FX : T-score entre < –2 y –2,5 según edad3,2% 64 61% (32-78) 2% (0,8-3) 51 (33-120) FREEDOM
3 añosDenosumab 60 mg/6 meses T-score entre
< –2,5 y –4
23% de fracturas vertebrales ; 44% de fracturas después de los 55 años6,8% 72 67% (58-74) 5% (4-5) 22 (18-27) FRACTURA DE CADERA FIT-I106
3 añosAlendronatoSG
10 mg/díaFx vertb 2,2% 71 51% (–0,8-76) 1% (0,01-2) 90 (45-11.364) HIP91
3 añosRisedronato
2,5 y 5 mg/díaGrupo 1: edad 70-79 años, T-score en CF < –4 o < –3 y FR de fractura cadera 2,5% 74
40% (11-59)f1% (0,2-2)f 99 (55-540)f HIP91
3 añosRisedronato
2,5 y 5 mg/díaGrupo 2: edad > 80 años y FR de fractura cadera o T-score de < –4 o < –3 con longitud del eje de la cadera 11,1cm o más 3,7% 83
NS
NS
NSHORIZON125
3 añosZoledrónico
5mg infusión iv anualT-score < –1,5 en CF+Fx vertb basal o T-score < –2,5 en CF±Fx vertb 2,3% 73
41% (17-58)
0,9% (0,3-2)109 (66-303) FREEDOM140
3 añosDenosumabV2 60 mg/6 meses T-score entre < –2,5 y –4 1,1% 72 39% (2-63) 0,4% (0,02-1) 230 (118-5.122) CF: cuello femoral; CL: columna lumbar; NNT: número de pacientes que necesitan ser tratados para prevenir una fractura vertebral; RAR: reducción absoluta del riesgo; RRR: reducción relativa del riesgo; SG: datos obtenidos en un análisis de subgrupos; V2: variable secundaria del estudio; vertb: vertebral.
aLos datos de RRR, RAR y NNT están calculados a partir de la incidencia absoluta del evento en el periodo global del estudio utilizando la población aleatorizada y la calculadora de riesgo de SIGN.
dAunque se comparan varias dosis con placebo, en la tabla se incluyen solamente las dosis autorizadas.
eEn este ECA se comparan 2dosis de bazedoxifeno frente a placebo 20mg y 40mg al día. En la tabla solamente se incluyen los datos de la dosis de 20mg/día que es la que está autorizada. El ensayo incluye además un control activo, raloxifeno 60mg/día, pero no está diseñado para hacer comparaciones entre los 2fármacos activos.
fLos datos proceden del análisis agrupado de las 2dosis de risedronato: 2,5 y 5mg diarios, aunque únicamente con la dosis de 2,5mg diarios las diferencias fueron estadísticamente significativas respecto a placebo. Fuente: Revilla Abad et al.6.
- c.
En relación con la magnitud de la enfermedad, se ha exagerado la importancia de la misma. Al decir que el 50% de las mujeres tendrán una fractura osteoporótica a lo largo de su vida, se crea cierto alarmismo social sin fundamento, similar al que tendría afirmar que el 100% de las mujeres morirán a lo largo de su vida. Se han acuñado términos desafortunados, como el de salud ósea, sometiendo a mujeres con mínimo riesgo de fracturas a tratamientos que pueden favorecer complicaciones en el ámbito de la «salud no ósea» (trombosis venosas, fibrilación auricular) e incluso de la «ósea» (osteonecrosis, fracturas atípicas). España lidera el consumo de fármacos para el tratamiento de la osteoporosis, a pesar de ser de los países con menor prevalencia de fracturas8.
La osteoporosis es una enfermedad de mujeres mayores de 65 años, si hablamos de fractura vertebral, y por encima de 75 años si hablamos de fractura de cadera, por lo que parece que la estrategia más razonable es plantear la indicación de cribado densitométrico en función del riesgo de fracturas, no a lo largo de la vida, sino en los próximos 10 años. En este sentido:
- –
la U.S. Preventive Services Task Force (USPSTF)9 indica cribado por encima de 65 años, y en mujeres más jóvenes que tengan un riesgo total de fracturas análogo a las mujeres de 65 años según las tablas FRAX (9,3% de riesgo de fractura en los próximos 10 años. Se debe resaltar que para conseguir en población española un riesgo de fracturas en torno al 10%, en mujeres sin otros factores de riesgo, habría que ir a edades en torno a los 72 años).
- –
La guía NICE10 recomienda, sin concretar sobre umbrales de tratamiento o de indicación de densitometría, evaluación sistemática del riesgo de fractura con la herramienta FRAX (véase más adelante) o con el Q-Fracture, a partir de los 65 años; entre 51 y 65 años se aconseja revisar a mujeres con una serie de factores de riesgo (fracturas previas, tratamiento con corticoides, caídas, fractura de cadera en la familia, IMC menor de 18,5, tabaquismo y consumo de alcohol superior a 14 unidades por semana11).
- –
El programa de actividades preventivas y de promoción de la salud (PAPPS)12 de la Sociedad Española de Medicina Familiar y Comunitaria (SEMFYC) plantea la indicación de cribado en función del riesgo absoluto de fractura en los siguientes 10 años. En 2016, el PAPPS actualizó sus recomendaciones y se considera Z-score como criterio de intervención (véase más adelante), tal y como corresponde al modelo elaborado por la Dirección General de Farmacia de la Comunidad de Madrid6.
Por lo tanto, salvo excepciones, la mayoría de sociedades científicas asumen la estrategia de calibrar el riesgo de fracturas en los próximos 10 años. A continuación, se enumeran algunas de las escalas de riesgo más utilizadas:
- –
Garvan Fracture Risk Calculator13: considera edad, IMC, frecuencia de primeras caídas y número de caídas en el último año, la DMO de cadera es optativa. Es utilizada en Canadá, Australia y Nueva Zelanda.
- –
FRAX®14: tablas realizadas por la Organización Mundial de la Salud, los factores de riesgo analizados son edad, sexo, IMC y variables dicotómicas (tabaquismo, ingesta de más de 3 unidades de alcohol/día, antecedentes de fracturas después de los 50 años, antecedentes familiares de fractura de cadera y tratamiento con corticoides). Permite el cálculo de riesgo con y sin DMO, considerando tan solo el T-score de cuello femoral.
- –
QFracture15: solo validada en Reino Unido. Incluye, como el FRAX, tabaco (4 niveles), alcohol (5 niveles), tratamiento con corticoides, antecedentes familiares de fractura de cadera y además de historia de caída. NICE recomienda la utilización tanto del FRAX como del QFracture.
- –
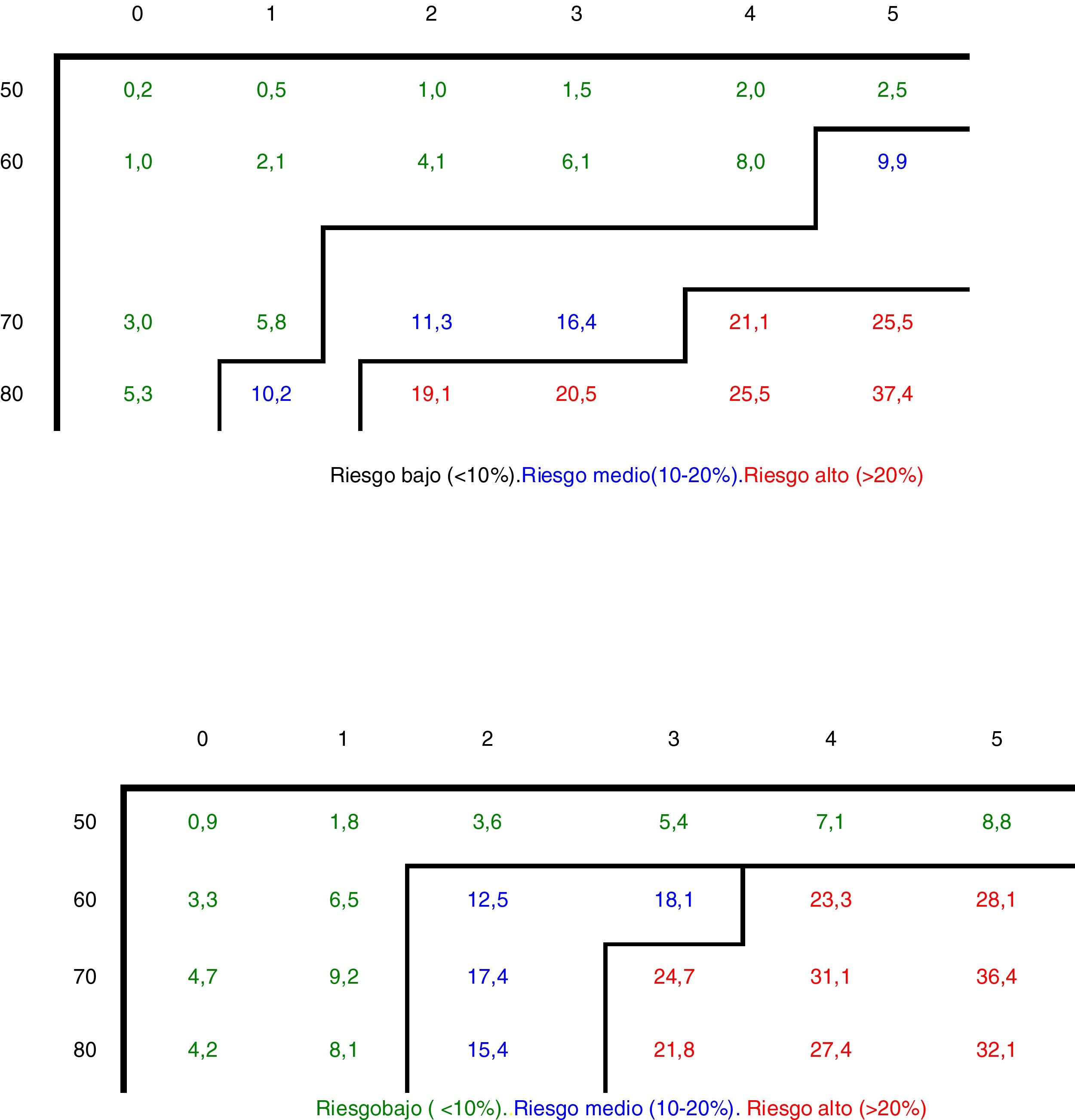
Hace algunos años, la Comunidad de Madrid16 elaboró una escala (fig. 1), con base en el estudio Rotterdam, para calcular el riesgo de fractura en los próximos 10 años3. No exigen la DMO para hacer el cálculo, sino que nos ayudan a determinar a qué mujeres se les realiza la densitometría y a qué mujeres no, y cuáles son candidatas a iniciar un tratamiento sin necesidad de DMO.
Figura 1.Riesgo absoluto de fracturas en función de la edad y de la puntuación de riesgo según el estudio Rotterdam.
Consideraciones de la Comunidad de Madrid en el abordaje de mujeres con riesgo de fracturas:
En las mujeres con riesgo alto se recomienda tratamiento. En las mujeres con riesgo medio se recomienda la realización de DEXA en columna lumbar/cuello femoral y si el resultado es T < –2,5 se recomienda tratamiento.
Con valores extremos en los factores de riesgo (p. ej., múltiples fracturas después de los 50 años, IMC de 15 en mujeres mayores de 70 años o presencia de fracturas vertebrales múltiples) se deberá considerar de forma individualizada y no sobre la base de recomendaciones.
Fuente: van der Klift et al.3.
(0.19MB).
Una vez establecida la posible herramienta de cribado, el punto clave es establecer los umbrales de riesgo y de intervención.
Las recomendaciones de la NOF17 son tenidas en cuenta por la comunidad científica, a pesar de sus conflictos de interés con la industria. Defienden el cribado a mujeres por encima de los 65 años, y por encima de los 50 si tienen factores de riesgo de fractura, y a hombres por encima de los 70 años. Recomiendan, independientemente de la edad y de los factores de riesgo, el tratamiento en todo paciente con DMO < –2,5 DS de T-score, otorgando categoría de enfermedad a lo que tan solo es un factor de riesgo. Si hay un riesgo mayor del 20% de fracturas totales o del 3% de fracturas de cadera en los próximos 10 años, el tratamiento se aconseja si la DMO está en rango de osteopenia (< –1 DS y > –2,5DS), a pesar de que no hay datos de eficacia de tratamiento farmacológico en mujeres con osteopenia. Se sigue primando la DMO sobre otros factores de riesgo a pesar de que el efecto de la edad es mucho mayor que la reducción de la DMO18,19. Considerando estos criterios de intervención, el 75% de las mujeres americanas de más de 65 años y el 95% de las mujeres mayores de 75 años deberían realizar tratamiento farmacológico20. Con algunas modificaciones, estas recomendaciones se siguen en otras partes del mundo como por ejemplo Canadá o Japón; en algunos países se establecen diferentes niveles de intervención en función de la edad, pero en términos muy parecidos.
Situación en EspañaValidación de las tablas FRAXUna de las limitaciones de la aplicación de las escalas de riesgo es la variabilidad de la prevalencia de fracturas en los diferentes países. Esto hace que el criterio densitométrico de riesgo varía ampliamente dependiendo de cada país. Por dicha razón, es importante que las tablas de riesgo de cada país estén suficientemente validadas en la población referenciada.
En España, Azagra et al., tras analizar una selección de paciente sin tratamiento osteoporótico de la cohorte FRIDEX21, llegan a la conclusión de que la capacidad predictiva para fractura principal es baja, siendo del orden del 1,72 (IC del 95%: 1,27-2,27) para FRAX® sin DMO y de 1,61 (IC del 95%: 1,19-2,12) para FRAX® con DMO del cuello femoral, lo que conduce a una infraestimación de las fracturas principales y de fémur proximal. La herramienta FRAX® muestra, igualmente, una pobre capacidad discriminativa para fracturas principales y buena para fracturas proximales de fémur.
Con el fin de ajustar los resultados de las tablas a la realidad, el modelo de Azagra establece como rangos de riesgo: menos del 5% riesgo bajo, riesgo entre 5 y 7,5% riesgo intermedio, y riesgo alto mayor o igual a 7,5%. El umbral para realizar la densitometría sería un riesgo mayor o igual al 5%. Una vez hecha la densitometría, habría que reclasificar el riesgo, incluyendo esos valores, y plantear intervención a partir de un riesgo mayor o igual al 7,5%, es decir, un riesgo alto. Con esta adecuación, el análisis de precisión diagnóstica mejora la especificidad en más de 6 puntos y el VPP en casi 10 puntos respecto al modelo de diagnóstico tradicional, sin que se modifiquen la sensibilidad ni el valor predictivo negativo.
Aunque el modelo de Azagra está construido con rigor y es un modelo mejorado con respecto al modelo de criterio densitométrico, hay que tener en cuenta una serie de aspectos. En primer lugar, la selección de la muestra de los 816 pacientes no es aleatoria y, además, el escaso número de fracturas limita las conclusiones (46 fracturas mayores —15 de cadera, 3 vertebrales, 15 de humero proximal y 17 de muñeca— de las 816 que componían la muestra, de las cuales el 49% de las mujeres fracturadas tenían antecedentes previos de fractura versus el 18,5% de las no fracturadas). Por otro lado, el modelo Azagra desatiende la edad como factor limitante para plantear la intervención a pesar de que la edad (media en el grupo fracturado de 63 años versus 56 del grupo no fracturado), junto con el antecedente de fracturas previas y la presencia de osteoporosis densitométrica, son las variables claramente significativas entre las mujeres que han sufrido fracturas frente a las que no.
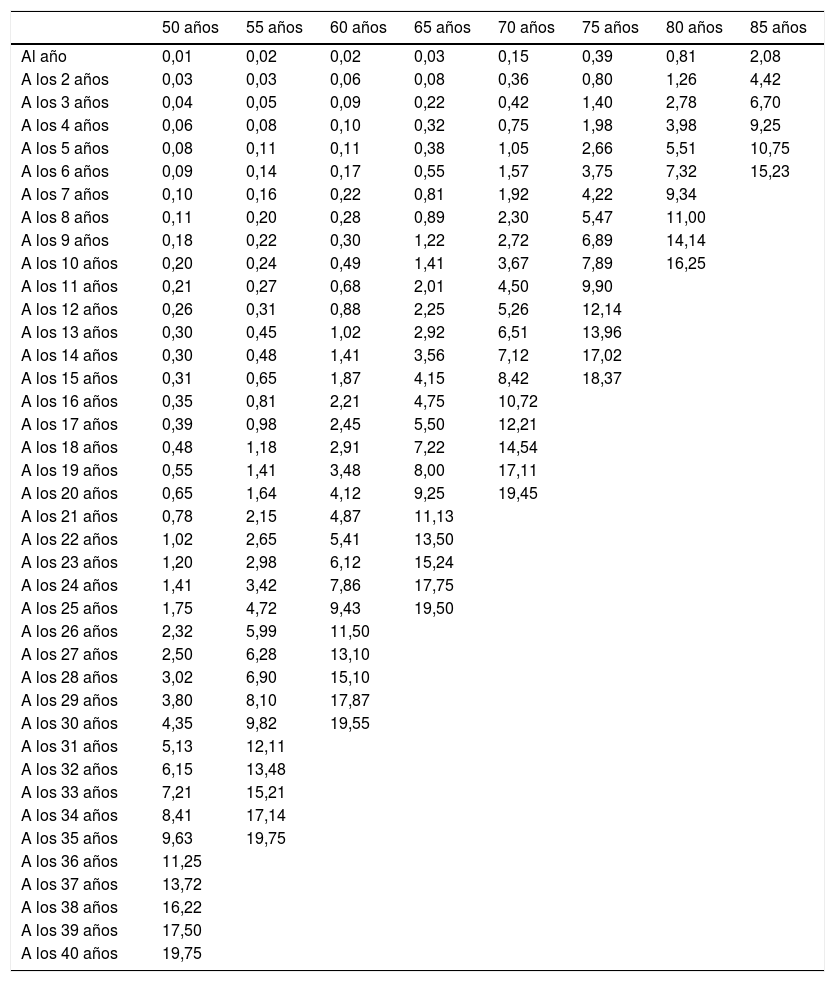
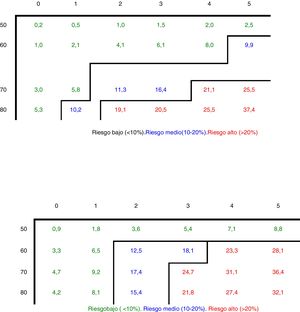
Utilización de los propios datos y cambio de paradigma: Z-scoreRecientemente, la Comunidad de Madrid ha presentado una actualización de la guía de Recomendaciones para la valoración y tratamiento de la osteoporosis6, aplicando el modelo matemático del estudio de Rotterdam22 a los datos de fractura de cadera de la Comunidad de Madrid (tabla 3). Las nuevas recomendaciones suponen un cambio de paradigma, ya que en la valoración de los resultados de la densitometría se tiene en cuenta: tan solo la fractura de cadera (sobre la que existen datos y provoca mayor morbimortalidad), y el Z-score en lugar del T-score, pareciendo razonable utilizar la variable que compara mujeres de la misma edad, y no con otras más jóvenes como ocurre con el T-score (tabla 4).
Probabilidad (riesgo absoluto en porcentaje) de presentar una fractura de cadera en los próximos años, dependiendo de la edad en mujeres de la Comunidad de Madrid
| 50 años | 55 años | 60 años | 65 años | 70 años | 75 años | 80 años | 85 años | |
|---|---|---|---|---|---|---|---|---|
| Al año | 0,01 | 0,02 | 0,02 | 0,03 | 0,15 | 0,39 | 0,81 | 2,08 |
| A los 2 años | 0,03 | 0,03 | 0,06 | 0,08 | 0,36 | 0,80 | 1,26 | 4,42 |
| A los 3 años | 0,04 | 0,05 | 0,09 | 0,22 | 0,42 | 1,40 | 2,78 | 6,70 |
| A los 4 años | 0,06 | 0,08 | 0,10 | 0,32 | 0,75 | 1,98 | 3,98 | 9,25 |
| A los 5 años | 0,08 | 0,11 | 0,11 | 0,38 | 1,05 | 2,66 | 5,51 | 10,75 |
| A los 6 años | 0,09 | 0,14 | 0,17 | 0,55 | 1,57 | 3,75 | 7,32 | 15,23 |
| A los 7 años | 0,10 | 0,16 | 0,22 | 0,81 | 1,92 | 4,22 | 9,34 | |
| A los 8 años | 0,11 | 0,20 | 0,28 | 0,89 | 2,30 | 5,47 | 11,00 | |
| A los 9 años | 0,18 | 0,22 | 0,30 | 1,22 | 2,72 | 6,89 | 14,14 | |
| A los 10 años | 0,20 | 0,24 | 0,49 | 1,41 | 3,67 | 7,89 | 16,25 | |
| A los 11 años | 0,21 | 0,27 | 0,68 | 2,01 | 4,50 | 9,90 | ||
| A los 12 años | 0,26 | 0,31 | 0,88 | 2,25 | 5,26 | 12,14 | ||
| A los 13 años | 0,30 | 0,45 | 1,02 | 2,92 | 6,51 | 13,96 | ||
| A los 14 años | 0,30 | 0,48 | 1,41 | 3,56 | 7,12 | 17,02 | ||
| A los 15 años | 0,31 | 0,65 | 1,87 | 4,15 | 8,42 | 18,37 | ||
| A los 16 años | 0,35 | 0,81 | 2,21 | 4,75 | 10,72 | |||
| A los 17 años | 0,39 | 0,98 | 2,45 | 5,50 | 12,21 | |||
| A los 18 años | 0,48 | 1,18 | 2,91 | 7,22 | 14,54 | |||
| A los 19 años | 0,55 | 1,41 | 3,48 | 8,00 | 17,11 | |||
| A los 20 años | 0,65 | 1,64 | 4,12 | 9,25 | 19,45 | |||
| A los 21 años | 0,78 | 2,15 | 4,87 | 11,13 | ||||
| A los 22 años | 1,02 | 2,65 | 5,41 | 13,50 | ||||
| A los 23 años | 1,20 | 2,98 | 6,12 | 15,24 | ||||
| A los 24 años | 1,41 | 3,42 | 7,86 | 17,75 | ||||
| A los 25 años | 1,75 | 4,72 | 9,43 | 19,50 | ||||
| A los 26 años | 2,32 | 5,99 | 11,50 | |||||
| A los 27 años | 2,50 | 6,28 | 13,10 | |||||
| A los 28 años | 3,02 | 6,90 | 15,10 | |||||
| A los 29 años | 3,80 | 8,10 | 17,87 | |||||
| A los 30 años | 4,35 | 9,82 | 19,55 | |||||
| A los 31 años | 5,13 | 12,11 | ||||||
| A los 32 años | 6,15 | 13,48 | ||||||
| A los 33 años | 7,21 | 15,21 | ||||||
| A los 34 años | 8,41 | 17,14 | ||||||
| A los 35 años | 9,63 | 19,75 | ||||||
| A los 36 años | 11,25 | |||||||
| A los 37 años | 13,72 | |||||||
| A los 38 años | 16,22 | |||||||
| A los 39 años | 17,50 | |||||||
| A los 40 años | 19,75 |
Fuente: Revilla Abad et al.6.
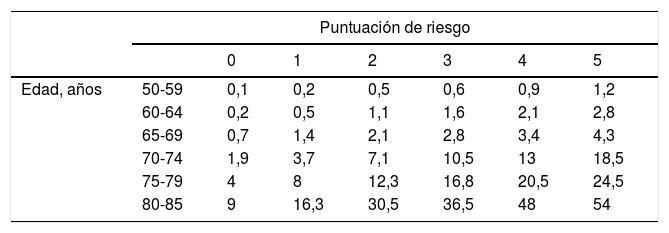
A) Adecuación de riesgo de fractura a la tabla del estudio Rotterdam con datos de la Comunidad de Madrid
| Puntuación de riesgo | |||||||
|---|---|---|---|---|---|---|---|
| 0 | 1 | 2 | 3 | 4 | 5 | ||
| Edad, años | 50-59 | 0,1 | 0,2 | 0,5 | 0,6 | 0,9 | 1,2 |
| 60-64 | 0,2 | 0,5 | 1,1 | 1,6 | 2,1 | 2,8 | |
| 65-69 | 0,7 | 1,4 | 2,1 | 2,8 | 3,4 | 4,3 | |
| 70-74 | 1,9 | 3,7 | 7,1 | 10,5 | 13 | 18,5 | |
| 75-79 | 4 | 8 | 12,3 | 16,8 | 20,5 | 24,5 | |
| 80-85 | 9 | 16,3 | 30,5 | 36,5 | 48 | 54 | |
| B) Valor del Z-score en cuello femoral, por debajo del cual la mujer presenta riesgo de fractura de cadera mayor del 10% en 10 años | |||||||
|---|---|---|---|---|---|---|---|
| Puntuación de riesgo | |||||||
| 0 | 1 | 2 | 3 | 4 | 5 | ||
| Edad, años | 50-59 | ||||||
| 60-64 | Z < –1,61 | ||||||
| 65-69 | Z < –1,62 | Z < –1,21 | Z < –0,83 | ||||
| 70-74 | Z < –1,08 | Z < –0,26 | |||||
| 75-79 | Z < –0,93 | Z < –0,16 | |||||
| 80-85 | Z <0 | ||||||
Fuente: Revilla Abad et al.6.
A la hora de plantear el punto de intervención, el riesgo considerado para indicar tratamientos farmacológicos es de un riesgo mayor del 10% de fractura de cadera en los próximos 10 años. Con estos resultados, y valorando una reducción de fracturas con los tratamientos disponibles de un 0,4-0,5% al año, el NNT se situaría en torno a los 200-250 pacientes. Si consideramos un riesgo de fractura mayor del 3%, como plantean algunas guías (como la NOF), el NNT sería de 570, que se antoja demasiado alto y poco coste-efectivo.
El umbral a partir del cual se recomienda considerar la densitometría es un riesgo del 2,8% (tabla 4). Tras realizar la densitometría en los casos indicados, habría que recalibrar el riesgo para considerar tratamiento farmacológico, una vez informada la paciente del balance beneficio riesgo del mismo. El cálculo de los factores de riesgo se hace otorgando un punto a los factores de riesgo con un riesgo relativo igual o mayor a 2, y 2 puntos a los que tienen un riesgo relativo mayor o igual a 4 (tabla 5).
Factores a considerar para el cálculo de la puntuación de riesgo
| Factores de riesgo | Puntuación |
|---|---|
| Índice de masa corporal < 19 | 1 |
| Fractura después de los 50 años | 1 |
| Fractura de cadera en madre, padre o hermana | 1 |
| Deformidad vertebral morfométrica (disminución 20% de la altura del cuerpo vertebral)a | 2 |
Se recomienda realizar radiografía a mujeres mayores de 60 años con pérdida de estatura de 4cm o cifoescoliosis.
Fuente: Revilla Abad et al.6.
En el modelo propuesto, el Z-score, además, no obra como variable cualitativa (osteoporosis o no osteoporosis), sino como variable cuantitativa: en cada nivel de riesgo considerado, se analiza el valor del Z-score necesario para que la mujer tenga (sumando el riesgo acumulado según edad y factores de riesgo, y el riesgo que supone un Z-score disminuido) un 10% de riesgo de fractura de cadera, y así justificar un tratamiento farmacológico. Con ellos se previenen no solo fracturas de cadera, sino todo tipo de fracturas, al igual que en riesgo cardiovascular la aplicación del score (que predice muerte cardiovascular) evita no solo muerte, sino eventos cardiovasculares.
ConclusiónLa osteoporosis densitométrica quizás sea uno de los ejemplos más palmarios de promoción de enfermedad. Los esfuerzos dirigidos a racionalizar su abordaje, evitando el etiquetado injustificado de enfermedad, la realización de pruebas innecesarias y los sobretratamientos redundarán en una mejor utilización de las tecnologías sanitarias. No es una cuestión baladí el que la mayoría de las estrategias vayan dirigida, no tanto a la promoción de estilos de vida saludables, sino a la implantación de tratamientos farmacológicos. Dado que 1/3 de las mujeres mayores de 65 años se caen una vez al año, y hasta el 50% de las mujeres mayores de 80 años, porque no se ponen los esfuerzos en disminuir las caídas que predicen un 40% del total de las fracturas23, mientras que la DMO solo predice menos del 30%24. Sobre todo, que la fractura de cadera, por muy baja que sea la DMO, si no hay caída, no hay fractura25.
Conflicto de interesesLos autores declaran no tener conflictos de interés.