La hipoglucemia facticia es la acción por parte del paciente de forma deliberada de provocar bajos niveles de glucosa en sangre mediante la administración subrepticia de insulina subcutánea o agentes hipoglucemiantes orales.
Debido a que suele tratarse de un diagnóstico de exclusión, frecuentemente se agotan los recursos diagnósticos con los que se cuenta para descartar otras entidades con mayor repercusión clínica, tales como el insulinoma, la nesidioblastosis o la presencia de anticuerpos contra la insulina.
Presentamos el caso de un paciente con episodios repetidos de hipoglucemia sin hiperinsulinismo según el método de detección de insulina de nuestro hospital (Elecsys® E170, Roche), al que se practican múltiples estudios para discernir la causa de la misma.
Se trata de un paciente de 48 años al que conocemos en abril de 2010 tras ser enviado desde atención primaria para estudio de hipoglucemias. Como antecedentes familiares destacamos que su hermana padecía diabetes mellitus tipo 1 desde 1985, con mal control metabólico crónico, y que tiene un hijo también con diabetes mellitus tipo 1 (en tratamiento con insulina glargina y lispro) desde 2008. Como antecedentes destaca un ingreso en el Servicio de Neurología en 2005 por hemihipoestesia izquierda, sin evidenciarse enfermedad (RMN y EEG normales), síndrome depresivo en tratamiento con múltiples fármacos, y varios estudios por hipotensión, atribuida a insuficiencia autónoma (habiéndose descartado insuficiencia suprarrenal) y tratamiento antidepresivo.
En aquel momento el paciente refería, desde hacía aproximadamente 2 años, cuadros recurrentes de sudoración, palpitaciones y sensación de hambre, que se aliviaban con la ingesta y ocurrían 2-3 veces al día, en algunas ocasiones en ayunas, pero las más sintomáticas, 1h posprandiales. Constató glucemias capilares coincidiendo con esos episodios de entre 40 y 70mg/dL, refiriendo también un episodio con pérdida de conocimiento y glucemia capilar de 36mg/dL. Se decide ingreso, por tanto, para estudio de hipoglucemias. No fue necesario realizar test de ayuno debido a que los episodios de hipoglucemia ocurrían tanto en el período pre como en el posprandial. Por tanto, se extraen muestras analíticas de insulina, proinsulina, péptido C, sulfonilureas en orina, anticuerpos antiinsulina, anticuerpos antirreceptor de insulina, y se realiza TC abdominopélvica cara a descartar un insulinoma como primera posibilidad diagnóstica. Dado que los resultados analíticos coincidentes con hipoglucemia en sangre venosa no demuestran hiperinsulinismo, tampoco sin desaparición del péptido C y que en la TC no se objetiva enfermedad, decidimos dar el alta con dieta repartida en 5 tomas, en la que deben predominar los hidratos de carbono de absorción lenta.
Durante el seguimiento ambulatorio el paciente refiere seguir con los mismos episodios de hipoglucemia (constatadas con el glucómetro de su hijo), a pesar de haber modificado la dieta como se le indicó, por lo que decidimos ingresar de nuevo al paciente para realizar nuevas pruebas diagnósticas y así comparar con las anteriores. En estas nuevas determinaciones no objetivamos tampoco hiperinsulinismo, y confirmamos negatividad de las pruebas autoinmunes. Dado que estas presentan en ocasiones falsos negativos, y teniendo en cuenta la carga familiar autoinmune, atribuimos las hipoglucemias a esta causa y comenzamos tratamiento esteroideo (prednisona 75mg/día).
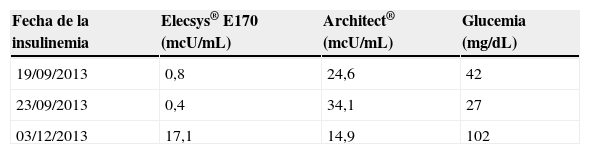
Tras el inicio del tratamiento siguen sin controlarse los episodios de hipoglucemia, así que, aunque la medición de insulinemia nunca fue elevada y los niveles tanto de proinsulina como de péptido C no fueron mínimos, decidimos enviar las muestras desde nuestro hospital, en el que se utilizó el inmunoanálisis electroquimioluminiscente Elecsys® E170 para la determinación de insulina en el analizador Cobas® 8000 de Roche, al laboratorio Reference, donde se utiliza el inmunoanálisis quimioluminiscente de micropartículas en el analizador Architect® i2000 de Abbott, y se compararon los resultados tanto en hipoglucemia como en normoglucemia.
Con Elecsys® E170, dado que solamente detecta insulina humana y no análogos, se obtienen unos valores de insulinemia mínimos. Sin embargo, al analizar las mismas muestras (en hipoglucemia) con el otro método (Architect® i2000 de Abbott), que detecta todos los análogos (excepto glulisina a concentraciones bajas), obtenemos unos valores muy elevados, aunque sin poder distinguir el tipo concreto de análogo de insulina ni, por tanto, discernir si se trata del que usa su hijo regularmente (glargina o lispro). Presumiblemente se trata del análogo de acción rápida, dado que el perfil de hipoglucemia que reflejaría la sobredosis de insulina glargina no es el que presenta el paciente.
En normoglucemia los valores de insulina son similares en los 2 laboratorios (ver tabla 1).
Como consecuencia del incremento en especificidad de los métodos inmunométricos de medición de insulina disponibles, la presencia de reactividad cruzada entre insulina humana y análogos puede hacer que los resultados difieran sustancialmente entre los mismos1–3.
Por tanto, es recomendable que cuando se sospeche la presencia de hipoglucemia facticia, si se utiliza uno de los 4 ensayos específicos para insulina humana (entre los que se encuentra el inicialmente practicado por nuestro laboratorio, Elecsys®, de Roche), este se emplee en paralelo a otro que presente reactividad cruzada con análogos de insulina, para así disponer de una segunda medición.
Se le comunicaron los resultados analíticos tanto al paciente como a su médico psiquiatra, que convino modificar el tratamiento a este respecto. Desde entonces los episodios hipoglucémicos han desaparecido.
Cuatro ensayos (entre los que se encontraba Elecsys®) mostraron una elevada especificidad4 a la insulina humana, con una pequeña o ninguna reactividad cruzada con cualquiera de los análogos estudiados.
En un estudio realizado en 2008 se comparó la capacidad de los diferentes métodos disponibles para medir la insulinemia. Los resultados mostraron que el método existente en nuestro hospital (Elecsys® E170) era el único que no disponía de la capacidad de determinar la cantidad de glargina ni de lispro/aspart5.
La degradación proteolítica de la insulina glargina la convierte en 2 metabolitos activos: M1 y M2, formados por la eliminación secuencial de las 2 argininas del extremo carboxi-terminal de la cadena beta y una deaminación adicional de la treonina en posición B30. Su similitud con la estructura de la insulina humana llevó a realizar ensayos para comprobar la reactividad cruzada con la misma. Esta resultó en alrededor del 100% en 5 inmunoanálisis, y al menos otros 2 mostraron valores de reactividad cruzada<5%. En general, los valores de reactividad cruzada fueron similares para los 2 metabolitos, excepto para Elecsys®, que presentó una reactividad cruzada para M1 de alrededor del 22%, pero ninguna para M2.
La diferencia en la reactividad cruzada entre los metabolitos de glargina (M1 y M2) usando el análisis Elecsys® puede ser explicada por la estructura de M1, que conserva la cadena beta, manteniendo así el lugar de reconocimiento por los anticuerpos dirigidos hacia el extremo C-terminal de la cadena beta. M2 no es reconocido debido a la alteración del extremo C-terminal de la cadena beta. Esto es de una importancia primordial para discriminar glargina de sus metabolitos.
Así, cuando sospechamos la presencia de hipoglucemia facticia, uno de los 4 ensayos específicos para insulina humana debe ser usado en paralelo a una segunda medición que presente reactividad cruzada con análogos de insulina.
Creemos que este caso clínico representa la dificultad que entraña actualmente el diagnóstico certero de la hipoglucemia facticia, teniendo en cuenta la diversidad de métodos para la detección de insulinemia y las características propias de cada uno.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.