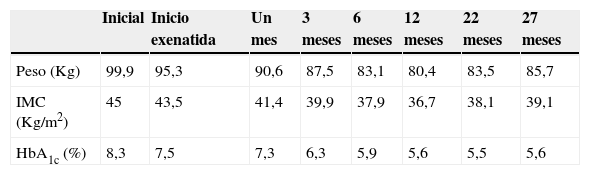
Presentamos el caso de una mujer de 25 años diagnosticada en la primera infancia de síndrome de Prader-Willi (SPW). Fue remitida a nuestra consulta por detectarse en una analítica rutinaria hiperglucemia y disfunción de hormonas tiroideas. Además de lo referido, entre sus antecedentes personales destacaba epilepsia diagnosticada a los 9 meses, en tratamiento con valproato hasta los 7 años, epifisiolisis tibial izquierda, pies planos, hibernoma en región costal derecha, dislipidemia y glucemia basal alterada, diagnosticada 3 años antes. Así mismo, como alteraciones propias de su síndrome, presentaba obesidad grado iii, talla baja, hipogonadismo con amenorrea primaria y retraso mental. No había recibido previamente tratamiento con hormona de crecimiento ni estroprogestágenos. Entre sus antecedentes familiares se recogía que tenía varios familiares maternos con diabetes mellitus tipo 2 (DM2). La paciente presentaba conducta hiperfágica, con ganancia ponderal asociada, de carácter progresivo, y trastornos de la conducta (impaciencia, ataques de ira) en estudio por Neurología y Psiquiatría. En la analítica inicial destacaba: glucemia 122mg/dl, HbA1c 8,3%, discreto aumento de transaminasas, TSH 7,19μU/ml, T4 libre 1,08ng/dl, anticuerpos antiperoxidasa elevados, colesterol total 301mg/dl (LDL 192mg/dl, HDL 40mg/dl) y triglicéridos 343mg/dl. En analíticas previas se observaron glucemias en ayunas en torno a 130-140mg/dl, lo que dada la elevación de la HbA1c, evidenciaba una hiperglucemia de predominio posprandial en probable relación con sus transgresiones dietéticas. En la exploración presentaba un peso de 99,9Kg, una talla de 148cm (IMC 45,6kg/m2), un porcentaje de masa grasa de 45,4% (medida por impedanciometría), obesidad de distribución central, aspecto infantil y rasgos dismórficos propios del SPW (frente estrecha, pies y manos pequeños, genu valgo e hipotonía muscular generalizada). No se detectó bocio. La exploración cardiorrespiratoria resultó normal, con TA 100/60mmHg y frecuencia cardiaca de 80lpm. El abdomen era globuloso, con abundante panículo adiposo, sin palpación de masas ni megalias. No presentaba desarrollo mamario (S1) y tenía mínima presencia de vello pubiano (P2). Con estos datos se diagnosticó a la paciente de DM2, hipotiroidismo primario subclínico y dislipidemia mixta. Se inició en ese momento educación diabetológica, modificación estructurada de la conducta alimentaria y recomendación de actividad física. Se prescribió tratamiento con metformina oral a dosis crecientes hasta 850mg 3 veces al día, levotiroxina 50mcg/día y fenofibrato de liberación modificada 145mg/día. Solicitamos nueva analítica, retinografía digital, ecografía abdominopélvica y densitometría ósea. Al mes la paciente presentaba un peso de 95,3Kg (−4,6Kg), glucemias preprandiales entre 90-130mg/dl, sin conseguir registros posprandiales. Analíticamente destacaba una glucemia basal de 96mg/dl, HbA1c 7,5%, colesterol total 221mg/dl (HDL 49mg/dl, LDL 129mg/dl), triglicéridos 216mg/dl, FSH 6,7mU/ml, LH 1mU/ml, estradiol 14pg/ml, testosterona 1,7nmol/l, prolactina 114μU/ml, TSH 1,4μU/ml y T4 libre 1,34ng/dl. En la retinografía digital no se detectaron hallazgos de retinopatía diabética. En la ecografía abdominal destacaban hallazgos compatibles con esteatosis hepática, siendo el estudio pélvico poco valorable. Persistía una hiperfagia severa, que obligaba a los familiares a un control estricto del acceso de la paciente a la comida, por lo que se decidió iniciar tratamiento con exenatida 5mcg 2 veces al día, que aumentamos posteriormente a 10mcg 2 veces al día, con buena tolerancia. En ningún momento presentó náuseas ni vómitos, ni hipoglucemias. Objetivamos una buena respuesta en el control glucémico y en la conducta alimentaria, con la consecuente pérdida ponderal. A los 3 meses del inicio de exenatida se había logrado una pérdida adicional de 7,8Kg de peso, que alcanzó los 14,9Kg al final del primer año (tabla 1). Son de destacar los cambios referidos por los familiares en la actitud de la paciente con las comidas, con mejoría evidente en la hiperfagia. Respecto al control glucémico, los niveles de HbA1c descendieron progresivamente, consiguiendo cifras de HbA1c inferiores al 6% a los 6 meses, que se han mantenido posteriormente sin hipoglucemias. Respecto al resto de los parámetros analíticos, a los 3 meses se normalizaron las transaminasas, y los lípidos entraron en objetivos terapéuticos, manteniendo el fenofibrato. Las hormonas tiroideas se normalizaron con una dosis sustitutiva final de levotiroxina de 75mcg/día. La densitometría solicitada hizo evidente una osteoporosis franca (L2-L4: T score −2,9DE), por lo que añadimos a su tratamiento suplementos de calcio-vitamina D orales y se instauró terapia hormonal sustitutiva por su hipogonadismo (estroprogestágenos por vía transdérmica a dosis progresivas). La paciente inició el desarrollo mamario y presentó la menarquia al año. Finalmente, se ha observado en las revisiones posteriores al año y medio una discreta recuperación ponderal, sin deterioro del control glucémico (tabla 1).
El SPW es la causa más frecuente de obesidad genética, con una incidencia de un caso por cada 10.000-25.000 recién nacidos vivos. Se debe a la falta de expresión de la región cromosómica 15q11-q13 de procedencia paterna. Los pacientes afectos adquieren un fenotipo característico con rasgos dismórficos como dolicocefalia, frente estrecha, ojos almendrados, boca pequeña, etc. Se caracterizan por presentar hipotonía neonatal, una hiperfagia exagerada desde la infancia que conduce a obesidad mórbida, retraso mental en diversos grados, alteraciones del comportamiento y diversos déficits hormonales, como déficit de hormona de crecimiento, e hipogonadismo hipogonadotropo, entre otros1. La composición corporal en los pacientes con SPW, en comparación con individuos obesos sin este síndrome, se caracteriza por presentar una mayor proporción de masa grasa, aunque con una mayor relación grasa subcutánea/grasa visceral, un menor índice de insulinorresistencia y mayores niveles de adiponectina1,2. Todo ello apunta a una disociación entre obesidad y resistencia a la insulina en estos pacientes con respecto a obsesos sanos. No obstante, se han descrito diferencias en los mecanismos glucorreguladores en estos pacientes, como una menor respuesta de insulina y péptido C a la sobrecarga oral de glucosa y un mayor aclaramiento de insulina frente a obesos sanos3. De hecho, las alteraciones en el metabolismo hidrocarbonado están presentes en el 7-40% de los casos, especialmente después de la pubertad y en individuos obesos4, siendo la incidencia de diabetes mayor que en la población general1. Aunque no están bien dilucidadas las causas subyacentes de la hiperfagia en los pacientes con SPW, los niveles elevados de grelina, péptido con efecto orexígeno, tanto en ayunas como posprandiales, se han involucrado en la falta de saciedad en este síndrome1,5. También se han descrito en estos pacientes descensos de los niveles en ayunas del péptido anorexígeno YY, con una falta de elevación tras la ingesta1, aunque otros trabajos ofrecen resultados dispares5,6. Niveles elevados de grelina y el descenso de los niveles de péptido YY estimularían las neuronas hipotalámicas productoras del neuropéptido Y, aumentando el apetito. También se han referido niveles bajos de polipéptido pancreático en estos pacientes, lo que también podría contribuir a la hiperfagia1. Por otra parte, no se han detectado diferencias en los niveles de leptina ni en los de glucagon-like peptide 1 (GLP-1, «péptido similar al glucagón tipo 1») en pacientes con SPW respecto a individuos obesos sanos1,5. Los análogos de GLP-1 se emplean actualmente en el tratamiento de pacientes obesos con DM2 por su efecto beneficioso tanto en el control glucémico como en el del peso. Este efecto en la pérdida de peso parece ser el resultado de acciones tanto a nivel central como periférico sobre los receptores de GLP-1, que promueven conjuntamente la saciedad7. La utilización de estos fármacos en pacientes con SPW, donde la obesidad y la hiperfagia tienen especial relevancia, resulta una opción terapéutica de gran interés. Estudios previos han mostrado la eficacia de los análogos de GLP-1 en pacientes con DM2 y SPW. Exenatida se ha mostrado eficaz en la mejora del control glucémico y en el de la saciedad en estos pacientes, y con menos efectos secundarios que en obesos mórbidos con DM28. Posiblemente en el efecto de la saciedad intervenga el descenso en los niveles de grelina inducido por esta molécula, efecto que se ha mostrado en algunos modelos animales9, aunque con resultados dispares cuando se analiza en humanos8. Por su parte, otro análogo de GLP-1, liraglutida, sí ha demostrado disminuir los niveles de grelina en pacientes con SPW, mejorando también la secreción y sensibilidad de la insulina9. Nuestra paciente experimentó una mayor pérdida de peso y una mayor efectividad en el control glucémico que las reportadas en otras series publicadas4,10. A diferencia de otros estudios en los que el control glucémico empeoraba después del primer año de tratamiento con estos fármacos4, nuestra paciente mantiene un control glucémico óptimo después de más de 2 años. No obstante, sí mostró tendencia a la ganancia de peso después del primer año, que atribuimos a una pérdida de eficacia de exenatida en el control del apetito a lo largo del tiempo. Ello viene a corroborar la gran variabilidad individual que existe en la respuesta a estos fármacos. Nuestra paciente no presentó efectos secundarios con exenatida, confirmando así lo referido en la literatura de una mejor tolerancia al fármaco en pacientes con SPW8. Algunos autores muestran la posibilidad de usar en estos pacientes dosis más elevadas del fármaco, sin embargo, alertan de casos reportados de dilatación gástrica y perforación en pacientes con SPW, dado el efecto de estos fármacos en el vaciado gástrico4, por lo que sería necesaria una vigilancia estrecha en estos casos.
En conclusión, los análogos de GLP-1 representan una buena opción terapéutica en pacientes con DM2 y SPW, ya que actúan sobre los mecanismos que regulan el apetito, paliando así la hiperfagia en estos pacientes. La pérdida de peso conseguida junto con el control glucémico resultan especialmente beneficiosos en términos de salud, puesto que la obesidad mórbida y sus complicaciones constituyen la mayor causa de morbimortalidad en estos pacientes. Quedaría por evaluar la efectividad a más largo plazo, tanto en el control glucémico como en el ponderal.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.