La diabetes mellitus tipo 1 es un síndrome orgánico multisistémico crónico que se caracteriza por un aumento de los niveles de glucosa en la sangre que tiene lugar como resultado de concentraciones bajas de la hormona insulina debido a una eliminación selectiva de las células beta pancreáticas como consecuencia de una respuesta autoinmune aberrante. Los resultados obtenidos con el trasplante de islotes pancreáticos en pacientes con diabetes mellitus tipo 1 han provocado un interés creciente en este campo. Esta técnica precisa de un número importante de islotes pancreáticos para conseguir el objetivo de insulinoindependencia. Así pues, el estudio de estrategias que permitan preservar la masa de células beta en pacientes con diabetes mellitus tipo 1 o generar células beta de novo para su posterior trasplante representa un objetivo de primera necesidad. En este sentido, las estrategias de terapia celular basadas en las células troncales constituyen una alternativa muy esperanzadora.
Diabetes mellitus type 1 is a multisystem chronic organic syndrome characterized by increased blood glucose levels that occur as a result of low concentrations of insulin hormone due to selective elimination of pancreatic beta cells as a consequence of an aberrant autoimmune response. The results of clinical trials based on islet transplantation performed in patients with diabetes mellitus type 1 have greatly increased the interest in this field. This technique requires a significant number of pancreatic islets to achieve the objective of insulin-independence. Thus, the current strategies seek to preserve beta cell mass in patients with diabetes mellitus type 1 or generate de novo beta cells for transplantation. In this regard, cell therapy strategies based on stem cells represent a very promising alternative.
La diabetes mellitus (DM) es un grupo de enfermedades metabólicas cuyo nexo en común es la hiperglucemia secundaria a un déficit en la secreción de insulina, a un defecto de su actividad metabólica, o a ambos. La hiperglucemia mantenida de forma continuada ocasiona complicaciones crónicas de tipo macrovascular, microvascular y/o neuropático, que son comunes a todos los tipos de DM y que conllevan elevadas tasas de morbididad y mortalidad. En la DM tipo 1 (DM1), la pérdida de las células beta pancreáticas tiene lugar como consecuencia de una destrucción autoinmune con el consecuente deterioro progresivo de estas, que hace que cada vez haya una mayor demanda de insulina y un menor número de células beta capaces de regenerarse y reponer la masa de células beta pancreáticas perdida.
Sin duda, la DM se ha convertido en uno de los problemas sanitarios más graves de nuestro tiempo. Sus proporciones son ya epidémicas en la mayor parte del mundo, estimándose que en la actualidad existen cerca de 250 millones de personas afectadas, con predicciones de aumento en los años venideros. Estudios recientes llevados a cabo en España, tales como el estudio Di@bet.es y otros1, han detectado prevalencias cercanas al 12%. Aunque la DM1 representa solo un 10% de la población total de pacientes con DM, su incidencia también está aumentando considerablemente.
El tratamiento estándar para la DM1 se basa en la administración de insulina acompañado de un riguroso control de los niveles de glucosa en sangre. Sin embargo, la insulinoterapia difícilmente es capaz de conseguir un buen control glucémico, estando frecuentemente asociada a episodios de hipoglucemia severa, ya que la insulina exógena no es capaz de simular la fisiología de la secreción de insulina por parte de las células beta. Por esta razón, la búsqueda de nuevas fuentes de células que puedan suplir las células beta eliminadas en los pacientes con DM1 se ha convertido en un objetivo de primera necesidad.
En los últimos años, la medicina regenerativa ha sufrido un desarrollo considerable. Los avances en este campo se han vinculado estrechamente con los nuevos conocimientos adquiridos sobre las células troncales y su capacidad para convertirse en células con características propias de otros tejidos. En este sentido, la DM1 es una de las enfermedades que más podrían beneficiarse de intervenciones de medicina regenerativa, debido principalmente a que el origen de la enfermedad se encuentra en la alteración de un único tipo celular, la célula beta productora de insulina.
Terapia sustitutivaTrasplante de islotes (Protocolo de Edmonton)El primer trasplante de islotes pancreáticos realizado con éxito en animales de experimentación tuvo lugar en 19722,3. Dos años después se llevó a cabo el primer trasplante de islotes en un paciente diabético4. Sin embargo, a lo largo del tiempo esta aproximación terapéutica no se ha consolidado como una alternativa al trasplante de órgano sólido. De hecho, durante los 25 años posteriores al primer trasplante solo se realizaron unos 300 trasplantes de islotes en pacientes con DM15. En el año 2006, Shapiro et al.6 presentaron los resultados de un ensayo clínico multicéntrico donde se habían incluido 36 pacientes con DM1 trasplantados con islotes con el que consiguieron que un 67% de los mismos (n=24) mostraran al menos una función parcial de los islotes trasplantados. La insulinoindependencia al año del trasplante se consiguió en 58% de los pacientes (n=21). Este porcentaje disminuyó al 13,9% (n=5) trascurridos 2 años desde el momento del trasplante. Sin embargo, los niveles de péptido C fueron detectables (>0,3ng/ml) en un 70% de los pacientes incluidos en este estudio a los 2 años del trasplante, lo que indica que los islotes trasplantados eran funcionales aunque insuficientes para normalizar la glucemia7. En este sentido, muchos de estos pacientes necesitaron 2 o 3 infusiones de islotes para conseguir la independencia de la insulina que, como ya se ha mencionado, en la mayoría de los casos no se mantuvo más de un año6.
Aunque los resultados obtenidos tras más de 1.000 intervenciones realizadas de trasplante de islotes a nivel mundial muestran el potencial terapéutico de esta estrategia, este procedimiento no ha llegado a convertirse en el tratamiento estándar para DM1 debido a: 1) la variabilidad en la calidad de los órganos donantes para proceder al aislamiento de los islotes, 2) la dificultad de la técnica para conseguir aislar un número suficiente de islotes y con un grado de viabilidad adecuado, 3) el alto coste que supone esta técnica, así como el mantenimiento de un laboratorio con personal altamente especializado y 4) la necesidad por parte del paciente receptor de vivir con un régimen inmunosupresor de por vida. Por esta razón, el trasplante de islotes es una estrategia terapéutica aplicada solo a un grupo reducido de pacientes caracterizados por una inestabilidad glucémica severa, hipoglucemia recurrente y poca capacidad para detectar los síntomas previos a la aparición de la hipoglucemia. En estos pacientes, el trasplante de islotes ha demostrado reducir la frecuencia de episodios de hipoglucemia mejorando la capacidad para detectar los momentos previos a un estadio de hipoglucemia.
Por otra parte, para poder hacer frente a la enorme demanda, debido al potencial número de receptores de trasplante, sería necesario disponer de sistemas de expansión de los islotes in vitro, o de fuentes alternativas de células productoras de insulina. En este sentido, las células troncales podrían jugar un papel relevante.
Células troncalesCaracterísticas propias de las células betaLa extraordinaria sofisticación de las células beta pancreáticas surge como resultado de una compleja evolución. Estas células son capaces de regular de forma muy precisa la producción de insulina, con el objetivo de mantener los niveles de glucosa en plasma en un margen muy estrecho (entre 4 y 8mM) en sujetos sanos. La precisión y rapidez con la que se controla esta secreción es extraordinaria, incrementando los niveles de insulina en sangre más de 50 veces tras la ingesta de alimento. Además, no solo se consiguen niveles elevados de insulina en un corto espacio de tiempo, sino que la capacidad de disminuir su secreción cuando su acción ya no es requerida tiene lugar de manera igualmente rápida, evitando así situaciones de hipoglucemia pospandrial.
Debido a la urgencia para desarrollar células capaces de producir insulina, han surgido múltiples estrategias, algunas de las más relevantes se comentarán a continuación. Sin embargo, hasta la fecha, lamentablemente ninguna de estas estrategias ha sido llevada a la clínica con éxito. La razón de ello es que ninguna de ellas ha conseguido generar verdaderas células beta. En la tabla 1 se citan algunas de las propiedades que deberían cumplir las células beta generadas a partir de diferentes fuentes de células troncales para ser consideradas como tales8.
Características específicas de una célula beta
| Síntesis y acumulación de insulina e IAPP. Actividad de las convertasas PC1 y PC2 para procesar proinsulina |
| Secreción regulada: grandes cantidades de insulina liberadas de manera rápida frente al estímulo de la glucosa, así como otros nutrientes |
| Patrón de secreción de insulina: liberación temprana de insulina de forma bifásica incluyendo los siguientes componentes |
| 1. Mecanismo de secreción de insulina estimulada por glucosa (GSIS) dependiente de la actividad de: GLUT2/GLUCOKINASA, acoplados para el reconocimiento preciso de la insulina |
| 2. Canal de potasio dependiente de ATP (KATP), incluyendo el poro del canal (KIR6.2) y la subunidad reguladora (SUR-1), que permita la depolarización de la membrana |
| 3. Canales de calcio tipo L dependientes de voltaje |
| 4. Proteínas SNARE responsables de la exocitosis de los gránulos de insulina |
| Bajos niveles de gluconeogénesis |
| Producción de lactato en bajos niveles |
| Bajo ratio de síntesis de ácidos grasos |
| Respuesta a incretinas: GLP-1 & GIP |
| Regulación precisa de la masa de células beta |
Características específicas de una célula beta que presumiblemente deberían estar presentes en cualquier célula troncal que, tras ser convenientemente manipulada, pretenda ser utilizada en terapia celular sustitutoria para el tratamiento de la DM1.
Además de cumplir todas las características citadas en la tabla 1, una vez encontrada la «célula ideal» capaz de detectar de forma precisa los niveles de glucosa y regular la secreción de insulina con una respuesta rápida y adecuada, es importante que esta célula pueda implantarse correctamente en localizaciones anatómicas diferentes al páncreas, siendo suficientemente resistente a fenómenos como la hipoxia, la inflamación y el ataque por parte del sistema inmunitario del hospedador8.
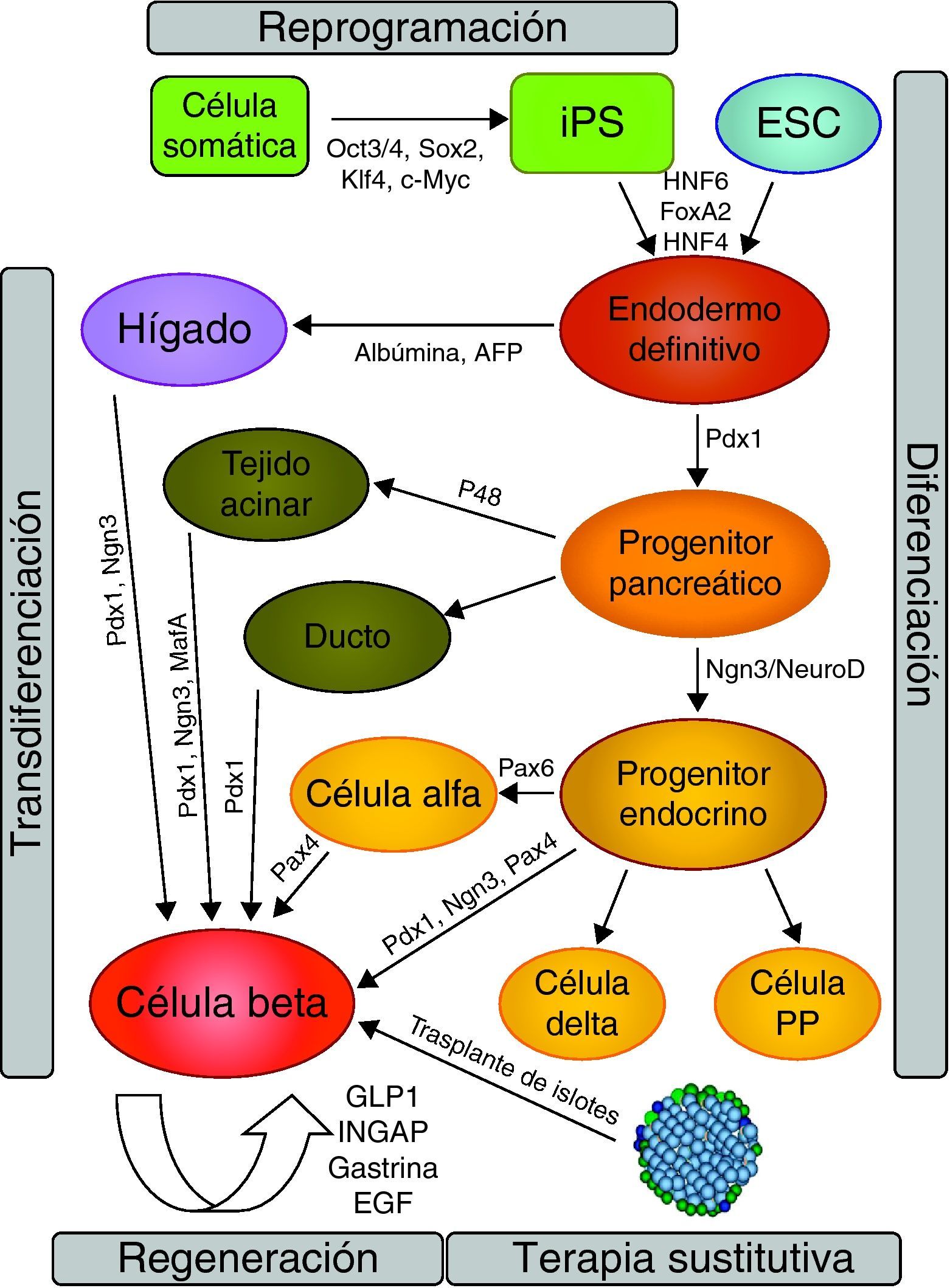
Células troncales pluripotentesCélulas troncales embrionariasLa extraordinaria capacidad de diferenciación atribuida a las células troncales embrionarias (ESC)9,10 ha hecho que numerosos grupos de investigación se hayan centrado en estas células como base para la obtención de células productoras de insulina. La mayor parte de estos trabajos sugieren que el éxito en el proceso de diferenciación para obtener células beta se basa en la recapitulación in vitro de los pasos que tienen lugar durante el desarrollo normal del páncreas in vivo11,12 (fig. 1). De acuerdo con estos estudios, los primeros pasos durante el desarrollo del páncreas consisten en la inducción del endodermo definitivo, paso que requiere de las señales inducidas por proteínas de la familia de TGF-β, tales como activina o nodal13. Aplicando estos conocimientos al proceso de diferenciación de ESC, recientemente se ha descrito que, tanto ESC de ratón como humanas, pueden ser convertidas a endodermo mediante el tratamiento con activina14,15. Los pasos posteriores a la obtención de endodermo definitivo tienen como objetivo guiar el fenotipo de estas células prediferenciadas hacia la especificación pancreática, para continuar con la obtención de linaje endocrino y posterior maduración de las células beta pancreáticas12,16,17 (fig. 1). En este sentido, el grupo del Dr. Baetge inicialmente demostró que es posible obtener células progenitoras pancreáticas a partir de ESC, aunque estas células no eran capaces de producir insulina, siendo consideradas bastante inmaduras18. Recientemente, este mismo grupo de investigadores ha mejorado el proceso de diferenciación, llegando a obtener progenitores pancreáticos que, una vez trasplantados bajo la cápsula renal de ratones diabéticos, son capaces de diferenciarse hacia células beta maduras protegiendo a estos ratones de la hiperglucemia inducida tras la administración de estreptozotocina19.
Estrategias utilizadas con diferentes tipos de células troncales para el tratamiento de la DM1. Dependiendo del tipo celular de partida, los factores que intervienen y las estrategias utilizadas son diferentes. Entre las más utilizadas destacan la reprogramación celular, diferenciación, transdiferenciación, regeneración y sustitución del tejido dañado (trasplante de islotes).
Otras estrategias utilizadas para diferenciar ESC y así obtener células productoras de insulina, se han basado en la sobreexpresión de factores de trascripción clave en el desarrollo pancreático, tales como Pdx-1 o Pax-420,21 o en la selección de ESC, previamente sometidas a un proceso de diferenciación, mediante el uso de promotores pancreáticos específicos, tales como el de la insulina, que dirigen la expresión de proteínas que confirieren resistencia a antibióticos22.
Los actuales protocolos de diferenciación que parten de ESC para obtener células productoras de insulina utilizan más de 10 proteínas recombinantes (citoquinas e inhibidores)23. Aunque esta estrategia ha dado notables resultados, sin embargo, su aplicación a gran escala resulta inviable, en primer lugar por el coste de las citoquinas y los factores de crecimiento y la diferenciación que deberían producirse en condiciones aptas para su uso clínico, así como por el número de células necesarias para su trasplante. Por esta razón, las estrategias actuales se basan en el uso de pequeñas moléculas que es posible generar a gran escala en condiciones aptas para su uso clínico, de manera reproducible y con capacidad para dirigir la diferenciación de estas células hacia células beta de manera eficiente24,25.
Sin embargo, todavía quedan por resolver varios aspectos que dificultan la aplicación clínica de las ESC para el tratamiento de la DM1. Entre estos, las consideraciones éticas respecto a su origen, la formación de teratomas y la dificultad para obtener verdaderas células beta que secreten la cantidad adecuada de insulina en respuesta a glucosa, son los principales problemas que impiden su aplicación.
Células troncales pluripotentes inducidasLas investigaciones lideradas por el Dr. Yamanaka en la Universidad de Kyoto han supuesto un auténtico cambio de paradigma en la biología de las células troncales. Los resultados de su investigación demuestran que es posible revertir el destino de las células ya especializadas, algo hasta hace poco tiempo considerado imposible. La sobreexpresión de cuatro genes (Oct3/4, Sox2, Klf4 y c-Myc) en células somáticas ha permitido obtener células con características similares a las ESC, denominadas «induced Pluripotent Stem cells» (iPS), en cuanto al patrón de genes expresados y su potencial de diferenciación26,27. El desarrollo de esta tecnología permitiría generar células pluripotentes a partir de células somáticas del propio paciente para su posterior trasplante, una vez diferenciadas hacia el tejido deseado. De esta manera, estas células no serían rechazadas por el sistema inmunitario del hospedador. En este sentido, ya se ha logrado generar iPS a partir de fibroblastos obtenidos de pacientes con DM128. Además, recientemente se ha demostrado que es posible generar células productoras de insulina a partir de iPS29–32 así como revertir la hiperglucemia inducida experimentalmente en ratones30.
Células troncales adultasCélulas troncales hematopoyéticasLas células troncales derivadas de la médula ósea (BM), principalmente las células troncales hematopoyéticas (HSC), poseen la capacidad de reconstituir el sistema hematopoyético. Estudios recientes sugieren que estas células pueden dar lugar a múltiples linajes celulares, incluyendo hepatocitos, neuronas, piel y músculo33,34. De igual manera, algunos autores han sugerido que células procedentes de este tejido son capaces de transdiferenciarse para dar lugar a células beta funcionales35. Mediante el sistema Cre-LoxP, el grupo dirigido por el Dr. Hussain ha demostrado que, aunque con una baja frecuencia, células derivadas de la médula ósea pueden contribuir a la formación de nuevas células beta, que no son el resultado de procesos de fusión celular35. Sin embargo, existe cierta controversia sobre el potencial de diferenciación de estas poblaciones celulares presentes en la médula ósea. En este sentido, varios grupos de investigación han mostrado que las células de médula ósea no tienen el potencial para generar células productoras de insulina. Aun así, se ha observado cierta mejoría al ser trasplantadas en ratones diabéticos36–38. Hasta la fecha se desconoce el mecanismo responsable de este fenómeno, aunque algunos investigadores sugieren que las células troncales derivadas de la medula ósea, pese a no diferenciarse a células beta, sí son capaces de inducir la regeneración de los islotes de manera indirecta39.
Además de la supuesta capacidad de diferenciación atribuida a las células troncales de la médula ósea, algunos investigadores han sugerido que el potencial de estas células para reconstituir el sistema hematopoyético podría ser utilizado para el tratamiento de la DM1. En el año 2003, el grupo liderado por el Dr. Voltarelli llevó a cabo un ensayo clínico en fase I/II donde trataron a pacientes con DM1 de reciente diagnóstico con altas dosis de inmunosupresión acompañado de la administración de HSC40. El objetivo principal de esta estrategia consistía en frenar el ataque inmunológico al que estaban sometidas las células beta de estos pacientes, mediante el uso de fármacos inmunosupresores, y restaurar el sistema inmunológico dañado utilizando HSC autólogas. Los investigadores mostraron resultados esperanzadores en 15 pacientes después de su seguimiento entre 7 y 36 meses, demostrando el potencial inmunomodulador de las células troncales de la médula ósea para el tratamiento de la DM140. Recientemente, este mismo grupo de investigación ha publicado resultados de la ampliación del ensayo clínico inicial, mostrando que 12 de los 20 pacientes con DM1 incluidos en este nuevo ensayo permanecieron libres del tratamiento con insulina exógena durante 31 meses (rango entre 14-52 meses)41. Aunque en un principio existió cierta controversia con los resultados obtenidos por estos investigadores, recientemente Snarski et al. han demostrado que el trasplante de células CD34+ autólogas junto con el tratamiento con ciclofosfamida y globulina anti-timocitos mejora el control glucémico en pacientes con DM1, disminuyendo el porcentaje de HbA1c tanto a 3 como 6 meses postrasplante42.
Células troncales mesenquimalesLas células troncales mesenquimales (MSC) fueron aisladas originariamente como una población con morfología fibroblástica capaz de dar lugar a precursores osteogénicos43. Posteriormente se amplió su definición, siendo consideradas como una población de células multipotentes no-hematopoyéticas presentes en una baja proporción en la médula ósea con la capacidad de diferenciarse hacia múltiples linajes de origen mesenquimal, incluyendo hueso, grasa y cartílago44. Aunque hasta la fecha no se ha identificado un marcador de membrana específico que defina las MSC, existe cierto consenso respecto a las características fenotípicas que definen esta población celular45.
Además de la capacidad de las MSC para diferenciarse hacia tejido adiposo, hueso o cartílago46, estas células son capaces de sintetizar y secretar factores de crecimiento y citoquinas, tales como inteleuquina (IL)-6, IL-11, IL-15 y VEGF, estando implicadas en la regulación de la hematopoyesis, en procesos de señalización celular y en la modulación de la respuesta inmunitaria47. Es precisamente esta última propiedad la que las hace especialmente interesantes para su aplicación en el tratamiento de enfermedades de origen autoinmune, como es el caso de la DM1. Varios grupos de investigación han demostrado que el tratamiento de ratones NOD con MSC protege los islotes pancreáticos retrasando así la aparición de la enfermedad48–50. En este sentido cabe destacar que son varios los grupos que, aprovechando estas propiedades inmunomoduladoras de las MSC, han iniciado ensayos clínicos en pacientes con DM1 de reciente diagnóstico utilizando MSC derivadas tanto de médula ósea como de tejido adiposo (tabla 2).
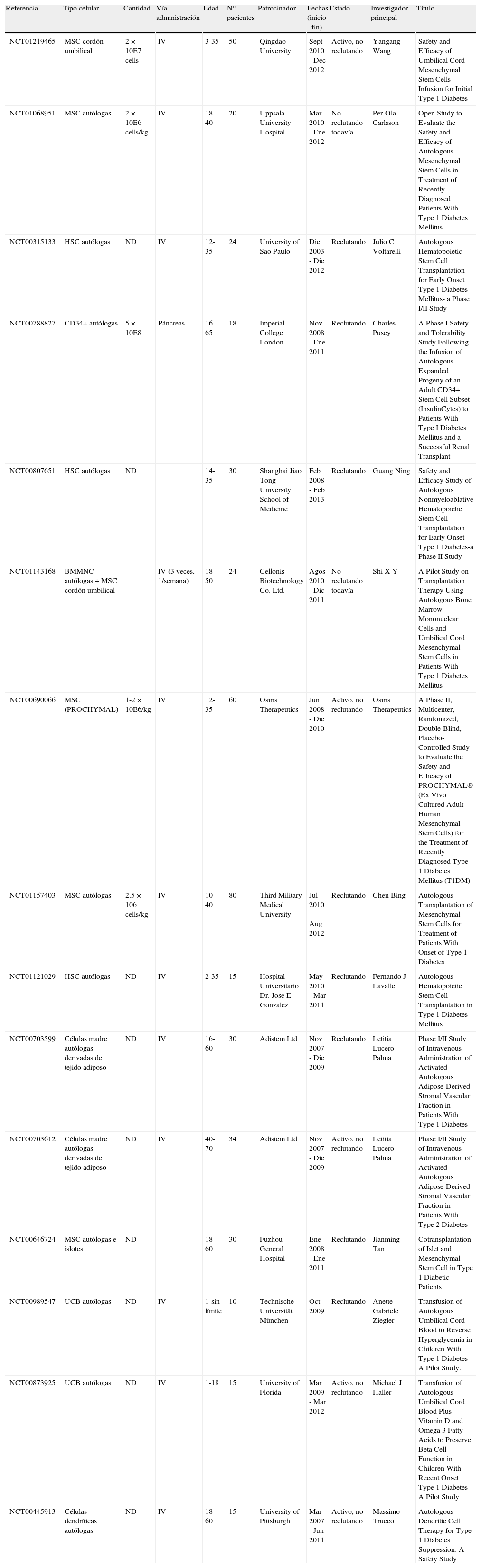
Ensayos clínicos iniciados o en fase de inicio basados en terapia celular para el tratamiento de la DM1
| Referencia | Tipo celular | Cantidad | Vía administración | Edad | N° pacientes | Patrocinador | Fechas (inicio - fin) | Estado | Investigador principal | Título |
| NCT01219465 | MSC cordón umbilical | 2×10E7 cells | IV | 3-35 | 50 | Qingdao University | Sept 2010 - Dec 2012 | Activo, no reclutando | Yangang Wang | Safety and Efficacy of Umbilical Cord Mesenchymal Stem Cells Infusion for Initial Type 1 Diabetes |
| NCT01068951 | MSC autólogas | 2×10E6 cells/kg | IV | 18-40 | 20 | Uppsala University Hospital | Mar 2010 - Ene 2012 | No reclutando todavía | Per-Ola Carlsson | Open Study to Evaluate the Safety and Efficacy of Autologous Mesenchymal Stem Cells in Treatment of Recently Diagnosed Patients With Type 1 Diabetes Mellitus |
| NCT00315133 | HSC autólogas | ND | IV | 12-35 | 24 | University of Sao Paulo | Dic 2003 - Dic 2012 | Reclutando | Julio C Voltarelli | Autologous Hematopoietic Stem Cell Transplantation for Early Onset Type 1 Diabetes Mellitus- a Phase I/II Study |
| NCT00788827 | CD34+ autólogas | 5×10E8 | Páncreas | 16-65 | 18 | Imperial College London | Nov 2008 - Ene 2011 | Reclutando | Charles Pusey | A Phase I Safety and Tolerability Study Following the Infusion of Autologous Expanded Progeny of an Adult CD34+ Stem Cell Subset (InsulinCytes) to Patients With Type I Diabetes Mellitus and a Successful Renal Transplant |
| NCT00807651 | HSC autólogas | ND | 14-35 | 30 | Shanghai Jiao Tong University School of Medicine | Feb 2008 - Feb 2013 | Reclutando | Guang Ning | Safety and Efficacy Study of Autologous Nonmyeloablative Hematopoietic Stem Cell Transplantation for Early Onset Type 1 Diabetes-a Phase II Study | |
| NCT01143168 | BMMNC autólogas+MSC cordón umbilical | IV (3 veces, 1/semana) | 18-50 | 24 | Cellonis Biotechnology Co. Ltd. | Agos 2010 - Dic 2011 | No reclutando todavía | Shi X Y | A Pilot Study on Transplantation Therapy Using Autologous Bone Marrow Mononuclear Cells and Umbilical Cord Mesenchymal Stem Cells in Patients With Type 1 Diabetes Mellitus | |
| NCT00690066 | MSC (PROCHYMAL) | 1-2×10E6/kg | IV | 12-35 | 60 | Osiris Therapeutics | Jun 2008 - Dic 2010 | Activo, no reclutando | Osiris Therapeutics | A Phase II, Multicenter, Randomized, Double-Blind, Placebo-Controlled Study to Evaluate the Safety and Efficacy of PROCHYMAL® (Ex Vivo Cultured Adult Human Mesenchymal Stem Cells) for the Treatment of Recently Diagnosed Type 1 Diabetes Mellitus (T1DM) |
| NCT01157403 | MSC autólogas | 2.5×106 cells/kg | IV | 10-40 | 80 | Third Military Medical University | Jul 2010 - Aug 2012 | Reclutando | Chen Bing | Autologous Transplantation of Mesenchymal Stem Cells for Treatment of Patients With Onset of Type 1 Diabetes |
| NCT01121029 | HSC autólogas | ND | IV | 2-35 | 15 | Hospital Universitario Dr. Jose E. Gonzalez | May 2010 - Mar 2011 | Reclutando | Fernando J Lavalle | Autologous Hematopoietic Stem Cell Transplantation in Type 1 Diabetes Mellitus |
| NCT00703599 | Células madre autólogas derivadas de tejido adiposo | ND | IV | 16-60 | 30 | Adistem Ltd | Nov 2007 - Dic 2009 | Reclutando | Letitia Lucero-Palma | Phase I/II Study of Intravenous Administration of Activated Autologous Adipose-Derived Stromal Vascular Fraction in Patients With Type 1 Diabetes |
| NCT00703612 | Células madre autólogas derivadas de tejido adiposo | ND | IV | 40-70 | 34 | Adistem Ltd | Nov 2007 - Dic 2009 | Activo, no reclutando | Letitia Lucero-Palma | Phase I/II Study of Intravenous Administration of Activated Autologous Adipose-Derived Stromal Vascular Fraction in Patients With Type 2 Diabetes |
| NCT00646724 | MSC autólogas e islotes | ND | 18-60 | 30 | Fuzhou General Hospital | Ene 2008 - Ene 2011 | Reclutando | Jianming Tan | Cotransplantation of Islet and Mesenchymal Stem Cell in Type 1 Diabetic Patients | |
| NCT00989547 | UCB autólogas | ND | IV | 1-sin límite | 10 | Technische Universität München | Oct 2009 - | Reclutando | Anette-Gabriele Ziegler | Transfusion of Autologous Umbilical Cord Blood to Reverse Hyperglycemia in Children With Type 1 Diabetes - A Pilot Study. |
| NCT00873925 | UCB autólogas | ND | IV | 1-18 | 15 | University of Florida | Mar 2009 - Mar 2012 | Activo, no reclutando | Michael J Haller | Transfusion of Autologous Umbilical Cord Blood Plus Vitamin D and Omega 3 Fatty Acids to Preserve Beta Cell Function in Children With Recent Onset Type 1 Diabetes - A Pilot Study |
| NCT00445913 | Células dendríticas autólogas | ND | IV | 18-60 | 15 | University of Pittsburgh | Mar 2007 - Jun 2011 | Activo, no reclutando | Massimo Trucco | Autologous Dendritic Cell Therapy for Type 1 Diabetes Suppression: A Safety Study |
Fuente: ClinicalTrials.gov.
Por otra parte, algunos grupos de investigación han sugerido que, aplicando determinados protocolos de diferenciación, es posible obtener células productoras de insulina a partir de MSC51–53 que, una vez trasplantadas en modelos animales de diabetes, son capaces de revertir la hiperglucemia53. Sin embargo, existen ciertas discrepancias sobre la robustez de los resultados obtenidos y la reproducibilidad de los mismos por otros grupos de investigación, no siendo, pese a la facilidad de obtención y crecimiento de las MSC, una de las estrategias comúnmente utilizada. No obstante, el grupo liderado por el Dr. Prockop ha demostrado que las MSC podrían jugar un papel relevante en la regeneración de los islotes pancreáticos dañados en un modelo de diabetes inducida artificialmente mediante el uso de estreptozotocina en ratones NOD/scid39.
Células troncales de cordón umbilicalLa sangre del cordón umbilical (UCB) contiene muchos tipos de células troncales entre las que se incluyen las HSC, MSC, células progenitoras endoteliales, monocitos y células troncales multipotentes derivadas de la sangre de cordón (CB-SC). Estas células han sido utilizadas en diferentes tipos de estrategias en medicina regenerativa54. Además, la amplia experiencia clínica que se tiene en el uso de CB-SC sin ningún efecto adverso reportado en los pacientes trasplantados, hace que su aplicación, gracias al uso de bancos de células, sea inmediata55. En este sentido, una de las enfermedades que más podría beneficiarse de las propiedades de estas células es la DM156. A nivel experimental, las 2 estrategias que se han ensayado utilizando CB-SC han sido la generación de células productoras de insulina57,58 y la inmunomodulación54,59. Los resultados obtenidos en los estudios preclínicos han demostrado que las CB-SC son biológicamente seguras y efectivas en modelos de DM159. Por esta razón, se han iniciado varios ensayos clínicos en los que se pretende trasplantar células derivadas de cordón umbilical en pacientes con DM1 (tabla 2).
Células troncales del páncreasDiversos estudios han permitido evidenciar que, bajo ciertos estímulos, la generación de nuevos islotes pancreáticos tiene lugar a partir de células troncales progenitoras que parecen emerger a partir de los ductos pancreáticos. De hecho, varios estudios in vitro han demostrado que es posible generar células productoras de insulina a partir de tejido ductal pancreático adulto60,61. Estas células parecen tener capacidad para diferenciarse no solo hacia tejido endocrino sino también hacia tejido acinar pancreático y órganos de diferentes orígenes como el hígado, el estómago y el intestino. Sin embargo, este fenómeno parece ser poco frecuente in vivo y dependiente del estímulo aplicado, siendo en muchos casos las propias células beta preexistentes las responsables de la formación de nuevas células productoras de insulina62. Otros autores afirman que existen células precursoras multipotentes en el páncreas capaces de dar lugar a células productoras de insulina63. Estas células son capaces de proliferar in vitro formando colonias que se expanden de manera clonal y que coexpresan tanto marcadores pancreáticos como neurales.
Hasta la fecha no hay un consenso sobre la existencia de un progenitor de origen pancreático responsable de la regeneración del tejido endocrino, ni sobre los marcadores que debería expresar este hipotético progenitor. Sin duda, la baja tasa de renovación del propio páncreas está dificultando la localización de esta supuesta célula troncal pancreática.
Transdiferenciación celularEl término transdiferenciación se define como la conversión de un tipo celular totalmente desarrollado hacia otro que presenta un fenotipo completamente diferente64,65 (fig. 1). Tradicionalmente, solo aquellos tejidos que derivan de las regiones adyacentes de una misma capa embrionaria poseen el potencial de transdiferenciarse. Así, por ejemplo, se ha demostrado que los hepatocitos, que derivan del endodermo, son capaces de dar lugar a células que también se originan a partir de esta capa embrionaria, tales como las células beta pancreáticas66. En comparación con las ESC, si utilizamos células cuyo origen embrionario es cercano al páncreas como punto de partida de la diferenciación, el número de pasos requeridos durante el proceso de transdiferenciación para conseguir el tejido definitivo es relativamente menor y, de igual manera, el tiempo necesario para completar este proceso. En este sentido, el uso de vectores virales para sobreexpresar genes importantes en el desarrollo del páncreas endocrino en tejidos como el hígado ha permitido generar células beta pancreáticas a partir de hepatocitos. De esta manera, mediante la expresión del factor de transcripción Pdx1, decisivo en el desarrollo del páncreas67, se han obtenido células capaces de producir insulina en el hígado68. Por otra parte, el grupo liderado por el Dr. Chan69 utilizó un adenovirus que codificaba para el gen Neurogenina-3 en ratones diabéticos, pudiendo observar la generación de células productoras de insulina en el hígado, concretamente células situadas en las áreas periportales del hígado.
En este mismo sentido, la transferencia de 3 factores de transcripción (Pdx-1, Ngn3 y MafA) en el tejido acinar pancreático ha permitido obtener células beta con una eficiencia mayor que la observada a partir del tejido hepático70. La mayor cercanía, en cuanto al origen del tejido acinar, respecto al tejido endocrino podría explicar los resultados obtenidos (fig. 1).
RegeneraciónLa generación de nuevas células beta a partir de la renovación de las células preexistentes se ha propuesto como una estrategia terapéutica cuyo objetivo último sería incrementar la masa de células beta endógena (fig. 1). En modelos de pancreatectomía parcial se ha demostrado que la regeneración del tejido eliminado parece proceder principalmente de la proliferación de las células beta remanentes62. Sin embargo, se desconoce si esta repoblación tiene lugar a partir de la propia célula beta o de una célula troncal especializada presente dentro del islote o si todas las células beta presentes tendrían la misma capacidad de regeneración. En este sentido, la replicación de las células beta ha sido sugerida como el mecanismo presente en la expansión de la masa de célula beta en etapas temprana del desarrollo tras el nacimiento71. De igual manera, este mecanismo también parece estar involucrado en la adaptación de la masa de células beta en situaciones de mayor demanda, tales como el embarazo72.
Por esta razón, la búsqueda de factores tróficos implicados en la neogénesis de los islotes podría dar lugar a nuevas moléculas cuya aplicación última en la clínica sería la inducción de la replicación de las células beta endógenas. En este sentido se han identificado varias moléculas entre las que se encuentran los análogos de la incretina glucagon-like peptide 1 (GLP-1)73, la combinación del factor de crecimiento epidérmico (EGF) junto con gastrina74, y, por último, proteínas asociadas a la neogénesis de islotes (INGAP)75 (fig. 1).
Lamentablemente la tasa renovación de la célula beta adulta es muy baja y la regeneración de la masa de células beta a partir de las células beta preexistentes es una estrategia que presenta serias limitaciones en el tratamiento de la DM1, sobre todo teniendo en cuenta que en esta enfermedad las células beta son eliminadas de manera selectiva76. Una posible aplicación de esta estrategia podría ser su combinación con algún tipo de tratamiento inmunosupresor que permitiera así evidenciar el verdadero efecto de la regeneración endógena de las células beta pancreáticas.
InmunomodulaciónUna de las estrategias terapéuticas donde se ha dedicado más esfuerzo en el tratamiento de la DM1 se basa en el bloqueo de la respuesta inmunitaria responsable de la destrucción de las células beta pancreáticas. El objetivo fundamental de este tipo de intervenciones es retrasar o prevenir la aparición de la enfermedad, en aquellos casos en los que hay indicios, o frenar su evolución cuando esta ya se ha instaurado. Un aspecto de gran importancia para el éxito de esta estrategia consiste en la identificación de aquellos individuos que poseen un riesgo relativo de padecer la enfermedad77. Sin embargo, la mayoría de los pacientes con DM1 no tienen un familiar con DM1, lo cual dificulta su identificación. La habilidad para predecir la aparición de DM1 basándose en evidencias inmunológicas, genéticas y marcadores metabólicos ha sido ampliamente utilizada, aunque los resultados obtenidos no han llegado a ser realmente concluyentes78.
En el caso de la DM1, la mayoría de las inmunointervenciones que se realizan para detener la enfermedad comienzan poco después de su identificación. El objetivo común de estas estrategias terapéuticas consiste en preservar la función de la masa de células beta remanente, permitiendo así un mejor control glucémico que evitaría futuros episodios de hipoglucemia y complicaciones a largo plazo asociadas a la enfermedad. En la actualidad, la evaluación de la función de las células beta pancreáticas se realiza mediante la determinación de los niveles de péptido C en respuesta a un estímulo que induzca su secreción79. En este sentido, alguna de las aproximaciones utilizadas han mostrado resultados prometedores. Entre estas se cuentan el tratamiento con anticuerpos monoclonales anti-CD3 (teplizumab80 y otelixizumab81), el anticuerpo monoclonal anti-CD20 (rituximab)82, una vacuna GAD83 y aproximaciones más agresivas, que ya han sido mencionadas con anterioridad, que implican protocolos de inmunosupresión basados en tratamientos con ciclofosfamida y globulina anti-timocito en combinación con el trasplante de células de médula ósea autólogas40,41.
Respecto al uso de células troncales con propiedades inmunomoduladoras para el tratamiento de la DM1, recientemente se ha probado con éxito el uso de MSC en el modelo de ratón diabético NOD48–50. Los resultados obtenidos por diferentes grupos de investigación demuestran que las MSC ejercen un efecto protector sobre los islotes pancreáticos, disminuyendo la insulitis y retrasando así la aparición de la enfermedad. Como ya se ha mencionado con anterioridad, estos esperanzadores resultados han animado el desarrollo de ensayos clínicos con diferentes tipos de células troncales con el objeto de frenar el ataque inmunológico y proteger o incluso restaurar la función celular beta (tabla 2).
Monitorización de la función celular beta en la diabetes mellitus tipo 1Para el desarrollo de cualquier estrategia terapéutica en la DM1 uno de los aspectos en los que debería ponerse especial interés es la determinación precisa de la función de la célula beta. Si bien existen biomarcadores (glucosa plasmática, niveles de insulina, niveles de péptido C) que indican la función de la célula beta pancreática, desafortunadamente no pueden considerarse como predictores reales o marcadores surrogados del desarrollo de la enfermedad, dado que sus niveles dependen de muchas otras variables biometabólicas y de parámetros de comorbilidad asociados a la diabetes. Además, los mecanismos de compensación de la homeostasis glucídica hacen que las alteraciones sustanciales de los niveles de los referidos biomarcadores aparezcan demasiado tarde en el proceso de la enfermedad, por lo que no pueden emplearse como verdaderos marcadores centinela.
Un biomarcador de células beta pancreáticas debería permitir una mejor comprensión de la fisiopatología de la pérdida de estas células durante el proceso de desarrollo de la DM1. La capacidad de secreción de insulina tras sobrecarga de glucosa se emplea actualmente como una medida indirecta de la masa de células beta. Sin embargo, las mediciones de la secreción de insulina presentan diversas limitaciones, no solo por su incapacidad para predecir el desarrollo de la enfermedad, dado que el estrés metabólico o una respuesta inflamatoria reversible pueden comprometer la función de las células beta sin que exista una pérdida real de estas, sino también por su gran variabilidad84 y por el metabolismo hepático de la insulina.
El péptido C se segrega junto a la molécula de insulina en cantidades equimolares y, a diferencia de lo que ocurre con la insulina, no sufre metabolismo hepático por lo que se considera un marcador de la secreción endógena de insulina. Las concentraciones plasmáticas de péptido C se pueden medir en situación basal o tras estímulo con una comida mixta líquida o con glucagón79.
La toma de muestras de células beta mediante técnicas invasivas no es solo un procedimiento invasivo técnicamente complejo, sino que además debe tenerse en cuenta la morbilidad asociada a un procedimiento que debe considerarse de elevado riesgo.
Un biomarcador adecuado de células beta mediante imagen molecular debe dirigirse frente a una diana que sea específica de dichas células y que a pesar de su baja proporción en el tejido pancreático permita no solo su identificación y visualización, sino también una cuantificación precisa.
La tomografía de emisión de positrones (PET) es una técnica utilizada frecuentemente para la visualización in vivo de diversos parámetros biológicos y fenómenos de neurotransmisión. Entre las ventajas sustanciales de la PET se encuentran: 1) una extraordinaria sensibilidad que permite detectar cantidades picomolares de los compuestos radiactivos directamente en el tejido diana, 2) la posibilidad de llevar a cabo estudios de cuerpo entero, 3) de hacer estudios de seguimiento longitudinal en un mismo sujeto a lo largo del tiempo, y 4) el hecho de que la traslacionalidad de los estudios en animales a estudios clínicos en seres humanos puede hacerse de manera muy rápida. En la identificación de biomarcadores para imagen molecular que permitan la cuantificación no invasiva de la masa de célula beta se han identificado una serie de marcadores que podrían ser característicos de las células beta85. Entre estos genes destaca el del transportador vesicular de monoaminas VMAT2, que se expresa en las células beta y en las neuronas monoaminérgicas del sistema nervioso central, pero no en el páncreas exocrino86,87.
Aunque hasta la fecha no existe ningún biomarcador PET establecido para la identificación y cuantificación de las células beta, se han llevado a cabo experiencias piloto con algunos compuestos tales como 11C-acetato88, dirigido frente a los transportadores aniónicos de los acinos pancreáticos, o 11C-dihidrotetrabenazina (11C-DTBZ)89 o su análogo fluorado ([18F]FP-DTBZ)90 como ligandos de VMAT2.
Ensayos clínicos con células troncales para el tratamiento de la diabetes mellitus tipo 1El número de ensayos clínicos basados en terapia celular para el tratamiento de pacientes con DM1 se ha incrementado considerablemente en los últimos 5 años. La mayoría de estos ensayos tiene como finalidad el bloqueo de la respuesta autoimune desencadenante en último término de la aparición de la enfermedad. Los tipos celulares elegidos para el tratamiento de la DM1 son fundamentalmente MSC, HSC y UCB (tabla 2). La experiencia previa en el cultivo de estas células en condiciones aptas para su uso clínico, así como los buenos resultados obtenidos en otras enfermedades de origen autoinmune, sin la observación de efectos adversos no deseados, han supuesto su rápida aplicación en la DM1.
Todavía serán necesarios unos cuantos años hasta que el uso de células troncales con potencial para diferenciase hacia células productoras de insulina sea una realidad.
ControversiasEl objetivo de cualquier terapia cuya finalidad sea el tratamiento de la DM1 ha de pasar irremediablemente por la consecución de células capaces de producir y secretar insulina en respuesta a glucosa o, en el caso que sea posible, la preservación y/o regeneración de la masa de célula beta presente en el páncreas del paciente con DM1. Tal y como se ha mencionado con anterioridad, estas células podrían ser obtenidas a partir de células troncales de diferentes orígenes y con distintas propiedades o de los propios islotes pancreáticos. Aunque se han realizado ciertos avances en la aplicación de determinadas poblaciones de células troncales en pacientes con DM1 (tabla 2), todavía quedan algunas cuestiones por resolver antes de que la terapia celular sea una realidad. Entre estas destacan: 1) el potencial oncogénico de algunas poblaciones de células troncales (ESC e iPS), 2) el debate ético sobre el origen de determinados tipos de células troncales (ESC), 3) los posibles efectos adversos derivados de un control impreciso de la glucemia, 4) la inmunosupresión generalizada mediada por algunas poblaciones de células troncales (MSC, CB-SC, BM) y, a efectos prácticos, 5) la posibilidad de generar un número suficiente de células para su trasplante.
ConclusionesRestaurar la funcionalidad de la masa de célula beta en los pacientes con DM1 es un objetivo de primera necesidad en la investigación en diabetes. El trasplante de islotes es probablemente la vía más rápida para conseguir su aplicación clínica, pero también es la alternativa que más problemas puede conllevar, entre las que destaca la escasez de islotes suficientes para tratar a todos los pacientes con DM1, sumado a las complicaciones asociadas a la medicación aplicada para evitar su rechazo. El uso de células troncales podría superar estos inconvenientes, en especial utilizando aquellas células que muestren un mayor potencial para diferenciarse hacia célula beta y cuyo origen sea autólogo. Sin embargo, hasta la fecha ninguna célula ha mostrado comportarse tal y como lo hace una célula beta. Por esta razón, muchas de las estrategias terapéuticas que en la actualidad se encuentran en fase de ensayo clínico se basan en potenciar la regeneración de la masa de células beta endógena combinado con el bloqueo de la respuesta autoinmune que desencadena la enfermedad. Con estas estrategias se pretende proteger o incluso potenciar la capacidad regenerativa del páncreas endocrino evitando así la eliminación selectiva de los islotes generados de novo. En este sentido, la terapia farmacológica podría potenciar los efectos beneficiosos observados con la terapia celular.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.