A pesar de los avances en el diagnóstico y en el tratamiento antibiótico/quirúrgico, la endocarditis infecciosa sigue siendo una enfermedad con una morbimortalidad muy elevada.
ObjetivoAnalizar las características de los pacientes diagnosticados de endocarditis en un hospital de tercer nivel entre enero de 1996 y diciembre de 2008. Evaluar los hallazgos ecocardiográficos, la estrategia terapéutica empleada y la morbimortalidad hospitalaria y durante el seguimiento.
MétodosEstudio observacional retrospectivo de 107 pacientes diagnosticados consecutivamente según los criterios de Duke. Seguimiento medio de 16±2 meses.
ResultadosLa edad media fue de 57±16 años, siendo el 37,4% mayores de 65 años; el 50,5% de las endocarditis afectó la válvula aórtica. Fueron endocarditis sobre la válvula nativa el 71,1% y sobre la prótesis el 28,9%. Los Staphylococcus aureus y Streptococcus viridans fueron los gérmenes más prevalentes. El ecocardiograma fue patológico en el 98%. La ecocardiografía transtorácica fue la primera exploración realizada, siendo diagnóstica en el 45,4%; en el 54,6% se realizó una ecocardiografía transesofágica. El 87% de los casos tuvo complicaciones. Precisó tratamiento quirúrgico durante la fase hospitalaria un 48,6%; el 5,8% precisó una segunda intervención diferida. La mortalidad hospitalaria fue del 19,6% y en el seguimiento del 8,4%. La principal causa de muerte fue la insuficiencia cardíaca. La principal secuela extracardíaca fue el ictus embólico.
ConclusionesLa valvulopatía degenerativa ha sustituido a la reumática como principal factor de riesgo. La ecocardiografía transesofágica constituye una técnica obligada en la mayoría de los pacientes con sospecha de endocarditis infecciosa. Prácticamente la mitad de los pacientes precisa cirugía precoz en la fase hospitalaria; en la actualidad todavía existe una importante tasa de mortalidad hospitalaria.
Despite advances in its diagnosis and antibiotic and surgical management, infective endocarditis remains a disease associated with considerable high morbidity and mortality.
AimTo analyze characteristics of patients diagnosed with infective endocarditis in a third-level hospital from January 1996 to December 2008, evaluating the echocardiography findings, the therapeutic strategy used, and both morbidity and mortality rates in hospital and during long term follow-up.
MethodsObservational retrospective study of 107 consecutive patients diagnosed according to the Duke criteria with a mean follow-up of 16±2 months.
ResultsThe mean age was 57±16 years, with 37.4% ≥65 years; 71.1% had native valve endocarditis and 28.9% prosthetic valve endocarditis. S. aureus and S. viridans were the predominant microorganisms. Echocardiography was pathological in 98%. Transthoracic echocardiography was the first exploration made, and it was positive in 45.4%. In 54.6% a transesophageal echocardiography was performed. There were complications in 87% of the cases. Surgical treatment during the active disease phase was needed in 48.6%, with 5.8% needed a deferred second intervention. The in-hospital mortality was 19.6% and in the follow-up period 8.4%. The main cause of death was severe heart failure. The main extracardiac consequence was the presence of embolic stroke.
ConclusionsDegenerative valve disease has replaced that of rheumatic as a major risk factor. The transesophageal echocardiography is a mandatory technique used in patients with suspected infective endocarditis. Surgery is needed in up to 50% of patients during hospital stay; however, in spite of this, the current mortality rate is still high.
La endocarditis infecciosa (EI) fue descrita por primera vez en 1885 por William Osler. Desde entonces, ha experimentado numerosos cambios tanto en sus aspectos clínicos y microbiológicos como en los terapéuticos y pronósticos. La introducción de la ecocardiografía transesofágica (ETE) y el perfeccionamiento de las técnicas microbiológicas, serológicas y de biología molecular permiten un diagnóstico más precoz y preciso; pero, a pesar de esto, la incidencia de la EI se mantiene estable y la mortalidad continúa siendo elevada (20–30%)1–4. Nuestro esfuerzo debe dirigirse a identificar a la población vulnerable, teniendo en consideración los cambios en el perfil epidemiológico y clínico de la enfermedad para poder realizar un diagnóstico precoz, reconocer los factores predictores de mal pronóstico y plantear la mejor estrategia terapéutica medicoquirúrgica en el momento más adecuado para contribuir a mejorar el pronóstico de esta enfermedad.
La enfermedad degenerativa valvular ha sustituido a la reumática como principal factor de riesgo, hecho relacionado con la mayor expectativa de vida que hay en la actualidad y la mayor manipulación diagnóstica y terapéutica a la que se somete a este grupo de población. Por otra parte, el incremento de la adicción a drogas por vía parenteral llevó durante la década de 1990, fundamentalmente, a un incremento de la EI en el grupo de edad comprendido entre los 20–40 años, afectando mayoritariamente la válvula tricúspide; a partir del año 2001, se comprueba en todas las series publicadas un descenso de la incidencia de la EI derecha secundario a un cambio en los hábitos de drogadicción, que pasó en los grandes centros de 8–10 casos tratados por año a 1–2 por año. Por último, el aumento de pacientes sometidos a cirugía cardíaca con recambio valvular, así como el incremento de técnicas diagnósticas y terapéuticas invasivas han llevado a un incremento significativo de la EI en los pacientes con prótesis cardíaca/dispositivos cardíacos y la EI nosocomial5.
El objetivo de nuestro trabajo fue analizar las características epidemiológicas, clínicas y microbiológicas de todos los pacientes diagnosticados de EI en un hospital de tercer nivel desde enero de 1996 hasta diciembre de 2008; evaluar los hallazgos ecocardiográficos y la técnica diagnóstica empleada, la tasa de complicaciones cardíacas y extracardíacas, la estrategia terapéutica recibida y la mortalidad intrahospitalaria. En el seguimiento analizamos la recurrencia de la enfermedad, la necesidad de cirugía o la muerte.
Material y métodosSe trata de un estudio observacional retrospectivo en el que incluimos 107 casos de EI diagnosticados de forma consecutiva entre 1996–2008. El diagnóstico se estableció según los criterios de Duke: el 92,5% cumplió los criterios de EI definitiva y el 7,5% los de EI posible. En el caso de las EI sobre la válvula protésica (EIVP), se consideraron como EIVP precoces aquellas en las que el episodio de EI ocurrió en los 12 meses siguientes a la implantación de la prótesis, mientras que los casos diagnosticados a partir de los 12 meses tras la cirugía se consideraron EIVP tardías. En caso de tratamiento quirúrgico, se definió como cirugía urgente a aquella que no podía posponerse más de 24h sin riesgo para la vida del paciente, cirugía electiva a la que sí podía demorarse unos días sin aumento del riesgo vital y cirugía diferida a la que se indicaba durante el seguimiento. La media de seguimiento fue 16±2 meses, mediante una revisión clínica y ecocardiográfica o mediante contacto telefónico en caso de no acudir el paciente. La infección se consideró curada cuando los hemocultivos obtenidos a los 2 meses del alta hospitalaria eran negativos. La muerte precoz se definió como aquella que tenía lugar durante la fase hospitalaria; las muertes producidas tras el alta se consideraron tardías. Se definió como recidiva de la EI a la reaparición de signos de infección con hemocultivos positivos para el mismo germen que produjo el episodio inicial dentro de los 2 meses siguientes al alta hospitalaria, mientras que un nuevo episodio de EI causado por un germen distinto del primero se consideró una EI recurrente.
Análisis estadísticoEl análisis estadístico fue realizado usando el programa SPSS. Las variables cuantitativas continuas se expresaron como media±desviación estándar y las variables discretas como porcentajes. Se utilizó el test de t-Student para comparar las medias y el test Chi-cuadrado con corrección de Fischer para comparar las variables discretas. Para el análisis multivariante se utilizó la regresión logística. Se calcularon las odds ratio y los intervalos de confianza del 95%. Para las pruebas de contraste de hipótesis, un valor de p<0,05 fue considerado estadísticamente significativo.
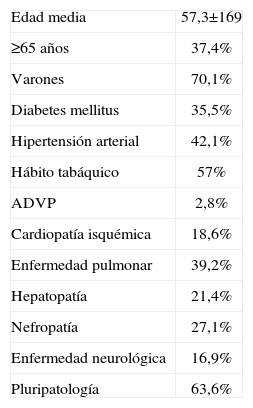
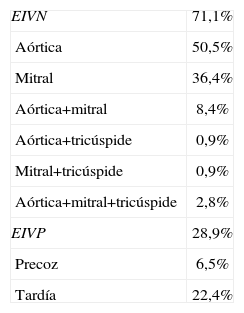
ResultadosSe registraron un total de 107 casos de EI con un predominio de varones (el 70,1 vs. el 29,9%), la edad media de los pacientes fue de 57,3±16,9 años (rango: 18–102) y el 37,4% de los pacientes tenía más de 65 años. Las características epidemiológicas de los pacientes se describen en la tabla 1. La válvula más frecuentemente afectada fue la válvula aórtica en el 50,5%, seguida de la válvula mitral en el 36,4% (tabla 2). Se evidenció la presencia de cardiopatía predisponente en 62 pacientes (57,9%), de los cuales el 37,1% desconocía su presencia; observamos cómo la valvulopatía degenerativa sustituyó a la reumática como principal factor de riesgo (el 44,7 vs. el 34,5%) (tabla 3). Tres pacientes eran adictos a drogas por vía parenteral (2,8%). Existían antecedentes de EI previa en 6 pacientes (5,6%).
Características epidemiológicas
| Edad media | 57,3±169 |
| ≥65 años | 37,4% |
| Varones | 70,1% |
| Diabetes mellitus | 35,5% |
| Hipertensión arterial | 42,1% |
| Hábito tabáquico | 57% |
| ADVP | 2,8% |
| Cardiopatía isquémica | 18,6% |
| Enfermedad pulmonar | 39,2% |
| Hepatopatía | 21,4% |
| Nefropatía | 27,1% |
| Enfermedad neurológica | 16,9% |
| Pluripatología | 63,6% |
ADVP: adicción a drogas por vía parenteral.
Características generales
| EIVN | 71,1% |
| Aórtica | 50,5% |
| Mitral | 36,4% |
| Aórtica+mitral | 8,4% |
| Aórtica+tricúspide | 0,9% |
| Mitral+tricúspide | 0,9% |
| Aórtica+mitral+tricúspide | 2,8% |
| EIVP | 28,9% |
| Precoz | 6,5% |
| Tardía | 22,4% |
EIVN: endocarditis infecciosa sobre la válvula nativa; EIVP: endocarditis infecciosa sobre la válvula protésica.
Fueron EI sobre la válvula nativa el 71,1%, y el 28,9% fueron EIVP (el 6,5%, precoces; el 22,4%, tardías; el 71%, sobre prótesis metálica, y el 21%, sobre prótesis biológica). Se recogieron 4 casos de EI sobre el cable del marcapasos. Se identificó la puerta de entrada en un 39,6%: manipulación dentaria, catéteres de diálisis o manipulación del tracto genitourinario fueron las principales. El tiempo medio de retraso en el diagnóstico fue de 37 días.
Se extrajeron hemocultivos de 106 pacientes (en un caso no fue posible por fallecimiento precoz), que resultaron positivos en el 86,9% y negativos en el 12,1%; ante un hemocultivo negativo, si la sospecha de EI era importante, se realizaban pruebas serológicas para Brucella y otros microorganismos de difícil aislamiento, como Coxiella burnetti y clamidias. El Staphylococcus aureus y el Streptococcus viridans fueron los gérmenes más prevalentes (44%; la prevalencia de gérmenes se describe en la tabla 4); en un 10% de los casos no se identificó el germen responsable. La causa más frecuente de hemocultivo negativo fue el tratamiento previo con antibioterapia.
Prevalencia de gérmenes en nuestro estudio
| Staphylococcus aureus | 22% |
| Streptococcus viridans | 22% |
| Enterococcus | 15% |
| No filiados | 10% |
| Staphylococcuscoagulasa (−) | 9% |
| Streptococcus bovis | 5% |
| Coxiella, grupo HACEK, S. agalactiae y otros | <2% |
HACEK: Haemophilus, Actinobacillus actinomycetemcomitans, Cardiobacterium hominis, Eikenella corrodens y Kingella kingae.
El ecocardiograma fue patológico en el 98% de los pacientes. La ecocardiografía transtorácica (ETT) constituyó la primera exploración realizada en el 90,6%, resultando diagnóstica en el 45,4%. En el 54,6%, la ETT resultó normal o con imágenes sugestivas pero no diagnósticas, por lo que se realizó a continuación una ETE. Solo en el 7,5% se realizó como primera exploración una ETE y no se realizaron ecocardiografías en el 1,9%. El número de ecocardiogramas realizados por paciente fue 1 ecocardiograma en el 63,5%, 2 en el 28%, 3 en el 7,5% y 4 en el 0,9%.
Los hallazgos ecocardiográficos principales fueron vegetaciones en el 78,5% (la mayoría de tamaño <1cm), disfunción valvular o protésica en el 9,3%, rotura del aparato subvalvular en el 1,9% y perforación valvular en el 0,9%. Encontramos regurgitación valvular en >del 90%, con predominio de regurgitación aórtica severa, mitral moderada y tricuspídea leve. Ante una mala evolución clínica a pesar del tratamiento antibiótico adecuado, se repitió la exploración ecocardiográfica (ETE), encontrándose complicaciones cardíacas en el 29,9% de los casos (tabla 5). Las complicaciones extracardíacas se describen en la tabla 5. En nuestra serie, la tasa global de complicaciones, cardíacas y extracardíacas, fue del 87%, cifra similar a la de otros estudios.
Incidencia de complicaciones en nuestro estudio
| Globales | 87% |
| Cardíacas | |
| Insuficiencia cardíaca | 53% |
| Absceso periaórtico/mitral | 11,2% |
| Perforación/rotura valvular | 4,7% |
| Comunicaciones – fístulas | 3,7% |
| Obstrucción valvular | 0,9% |
| Derrame pericárdico | 2,8% |
| Otras | |
| ACV embólico | 12,2% |
| Aneurisma micótico | 1,9% |
| Alteraciones del SNC | 4,7% |
| Fenómenos vasculares | 27,1% |
| Fenómenos inmunológicos | 23,3% |
| Infarto esplénico | 6,5% |
| Fracaso renal multifactorial (secundario a aminoglucósidos, glomerulonefritis, o IRA prerrenal) | 30,8% |
ACV: accidente cerebrovascular; IRA: insuficiencia renal aguda; SNC: sistema nervioso central.
El ECG se mantuvo normal o sin cambios con respecto al previo en el 82,4% de los pacientes; apareció bloqueo agudo en el 8,8%, fibrilación auricular paroxística en el 7,8% y arritmia ventricular en el 1%.
Todos los pacientes recibieron tratamiento antibiótico; la pauta más utilizada fue penicilina+gentamicina, con una duración media del tratamiento de 31,3 días. Precisó tratamiento quirúrgico durante la fase hospitalaria el 48,6%, predominando la cirugía urgente frente a la electiva (el 43,9 vs. el 4,7%); las causas principales de indicación quirúrgica fueron la insuficiencia cardíaca y la persistencia de sepsis a pesar de un tratamiento antibiótico correcto. Encontramos una tasa de mortalidad intrahospitalaria del 19,6% (21 pacientes), una intraoperatoria del 19% y una postoperatoria del 81%.
La media de seguimiento fue de 16±2 meses; observamos una mortalidad durante el seguimiento del 8,4%. Un 70,1% de los pacientes sobrevivió sin recurrencia de la endocarditis, un 28% falleció y un 1,9% presentó recurrencia de la enfermedad. Seis pacientes (5,8%) precisaron una segunda intervención de forma diferida (>60 días). La principal causa de muerte fue la disfunción ventricular severa asociada a secuelas estructurales de la endocarditis. El hallazgo ecocardiográfico más frecuente fue prótesis/válvula nativa normofuncionante y se objetivó la persistencia de vegetaciones en <2%. La secuela principal extracardíaca fue la presencia de déficit neurológico secundario a accidente cerebrovascular embólico.
DiscusiónNuestra serie es comparable a otras publicadas en los últimos años6–9. Al tratarse de un hospital terciario que dispone de cirugía cardíaca, recibimos pacientes procedentes de otros centros que cursan con evolución tórpida, lo que constituye un sesgo para tener en cuenta a la hora de analizar la tasa de complicaciones y de indicación quirúrgica.
Encontramos un 37,4% del total de pacientes con una edad ≥65 años, dato observado en otros registros en los que la edad media de la EI va aumentando de forma gradual. El 42,1% no tenía cardiopatía predisponente, cifra elevada pero similar a la tendencia de otros estudios, y se convierte en el tipo más frecuente de EI sobre la válvula nativa. Esto parece deberse al mayor porcentaje de pacientes expuestos a procedimientos médicos invasivos, como diálisis, circulación extracorpórea, canulación endovenosa prolongada, así como al aumento progresivo de pacientes con dispositivos intravasculares, prótesis cardíacas y marcapasos endocavitarios. La mayor edad de los pacientes también eleva su comorbilidad (mayor frecuencia de insuficiencia renal, diabetes, hepatopatías, enfermedad inflamatoria intestinal)10,11.
El hemocultivo es la prueba de laboratorio más importante para el diagnóstico. Deben obtenerse al menos tres hemocultivos en las primeras horas y, si son negativos y el paciente recibió antibióticos las dos últimas semanas, deberán repetirse a las 72h. En pacientes sin antecedente de toma de antibióticos previos a su ingreso, el porcentaje de EI con cultivo negativo suele ser inferior al 5%. En la literatura médica se observa un porcentaje de hemocultivos negativos que oscila entre el 2,5–31%, lo que tiene importancia en el pronóstico, ya que retrasa frecuentemente el diagnóstico y el inicio del tratamiento9; en nuestra serie, el porcentaje de hemocultivos negativos fue del 12,1%. Tradicionalmente, el S. viridans era el germen predominante, sin embargo, en varios estudios y revisiones recientes se describe el aumento del S. aureus como agente etiológico; en las EI protésicas es actualmente el germen más frecuente, asociado generalmente a pacientes sometidos a procedimientos invasivos. Las EI por S. aureus se relacionan con un peor pronóstico y con mayor incidencia de embolia, accidente cerebrovascular y muerte12.
La ecocardiografía tiene un valor fundamental en el diagnóstico de la EI. Los criterios de Duke, sin embargo, no definen a qué pacientes y en qué momento se debe solicitar el ecocardiograma. Las pautas de la AHA/ACC/ASECHO, así como las recientes guías para la prevención, el diagnóstico y el tratamiento de la EI de la European Society of Cardiology (ESC, ‘Sociedad Europea de Cardiología’) recomiendan realizar una ETT a todos los pacientes con sospecha clínica de EI13,14. Se han publicado varios estudios que cuestionan esta indicación, poniendo en evidencia que cuando existe una probabilidad baja de EI el ecocardiograma tiene un rendimiento diagnóstico pobre15,16. Greaves et al demostraron que la ausencia de cinco criterios clínicos (fenómenos vasculares o embólicos, acceso venoso central, historia reciente de uso de drogas intravenosas, válvula protésica y hemocultivos positivos) indica una probabilidad igual al 0% de que la ETT muestre evidencia de endocarditis; concluyen que el uso de estos criterios clínicos durante el proceso de decisión para el diagnóstico de EI puede evitar muchos ecocardiogramas innecesarios en pacientes con baja probabilidad clínica de esta afección. Señalan como excepción al paciente con bacteriemia por S. aureus, en el que la ecocardiografía sistemática estaría justificada dada la frecuencia de EI en este contexto, la virulencia del organismo y sus efectos devastadores una vez que la infección intracardíaca se establece. Ahora bien, en población con sospecha de EI, la ETE tiene mayor sensibilidad y especificidad que la ETT para el diagnóstico de EI, así como alto valor predictivo negativo; la ETE mejora la sensibilidad para el diagnóstico de vegetación en el 48,5% adicional y para el diagnóstico de complicaciones en el 80%. La ventaja de la ETE es particularmente evidente para las vegetaciones <10mm y para las válvulas protésicas, así como para la detección de abscesos perivalvulares en los pacientes con EI. No obstante, tiene limitaciones cuando la infección es muy inicial, cuando han embolizado las vegetaciones o cuando existen lesiones valvulares previas, reumáticas o degenerativas, que en ocasiones hacen imposible identificarlas. Si la ETE es negativa pero persiste alta sospecha clínica de EI, se repetirá la exploración en 7 días, o incluso antes en caso de infección por S. aureus. Si este último estudio continúa siendo negativo, se podrá descartar el diagnóstico de EI. Los estudios diagnósticos seriados pueden ser útiles pero, a partir de un tercer estudio negativo que incluya ETE, no mejoran la rentabilidad diagnóstica de la ecocardiografía17–21. Sin embargo, la ecocardiografía de seguimiento sí es obligatoria, con el fin de supervisar las complicaciones y la respuesta al tratamiento.
Las complicaciones en el curso de una EI son frecuentes (40–70%) y pueden dividirse en cardíacas y no cardíacas. Dentro de las primeras, la insuficiencia cardíaca congestiva es la más frecuente y es la causa principal de tratamiento quirúrgico y de mortalidad; se debe fundamentalmente a la destrucción valvular. En las últimas guías de práctica clínica de la ESC se insiste en la necesidad de establecer una valoración pronóstica en el momento del ingreso del paciente. Esta valoración se basaría en las características del paciente, la presencia de complicaciones, el tipo de microorganismo y los hallazgos ecocardiográficos. Esta valoración pronóstica inicial debería ser útil para determinar el tipo de hospital en el que un determinado paciente debería ser atendido22,23.
Entre las complicaciones no cardíacas se encuentran las embolias (20–30%), el 60% de las cuales se ubica en el sistema nervioso central, y el resto puede ubicarse en cualquier otro lugar del árbol arterial (arteria esplénica, renal, hepática). El aneurisma micótico es una complicación rara de la EI debida a la embolización de los vasa vasórum en las zonas de bifurcación arterial. Puede observarse en cualquier terreno arterial, aunque es más frecuente en el sistema nervioso central, donde su rotura provoca una hemorragia subaracnoidea.
Para el tratamiento es fundamental el enfoque multidisciplinario entre cardiólogos, especialistas en enfermedades infecciosas o internistas, y cirujanos cardiovasculares. Un problema importante es que no existen para la toma de decisiones trabajos aleatorizados doble ciego bien diseñados y con suficiente poder estadístico, por lo que la mayoría de las conductas terapéuticas se basan en estudios observacionales y recomendaciones de expertos24,25.
El modelo de riesgo EuroScore nos ayuda a predecir de forma satisfactoria la mortalidad quirúrgica de la EI26. Las principales indicaciones de cirugía son la insuficiencia cardíaca, la infección incontrolada y la prevención de episodios embólicos. Pero la dificultad en el tratamiento quirúrgico es decidir el momento más adecuado; existen datos en la bibliografía que sugieren que si la decisión de operar se establece, la cirugía debe realizarse sin demora27, ya que la adopción de una actitud intervencionista más decidida, menos dubitativa, incluso anticipadora de complicaciones cuando estamos ante gérmenes muy virulentos como, por ejemplo, el S. aureus, puede ser un factor importante. Así lo demuestra la tendencia que se observa en los trabajos publicados en las últimas décadas, donde el número de pacientes intervenidos en la fase activa va en aumento7,28–30.
Pero, por otro lado, el tratamiento quirúrgico durante la fase activa de la enfermedad está asociado a un riesgo importante; la cirugía está justificada en los pacientes con características de alto riesgo, que hacen que la posibilidad de cura con tratamiento antibiótico sea poco probable, y que carezcan de comorbilidades o complicaciones que hagan que la perspectiva de recuperación sea remota. Pero la identificación de los pacientes que precisan cirugía precoz resulta complicada con mucha frecuencia. Las últimas guías de la ESC intentan aclarar las indicaciones y el momento más adecuado para la cirugía, si bien ninguna de las recomendaciones tiene nivel de evidencia A14. En algunos casos, la cirugía debe practicarse de forma emergente (en las primeras 24h) o urgente (en los primeros días), sin tener en cuenta la duración del tratamiento antibiótico; en otros casos, la cirugía puede posponerse para permitir 1–2 semanas de tratamiento antes de que se lleve a cabo el procedimiento quirúrgico electivo. En nuestro estudio, llama la atención que la gran mayoría de las intervenciones se realizaron muy precozmente (el 43,9% con demora <48h vs. el 4,7% con demora >48h); se trataba de pacientes que se encontraban en peores condiciones hemodinámicas que generalmente desarrollan complicaciones severas, lo que puede contribuir a una mayor mortalidad hospitalaria. En la serie de Anguita et al, la tasa de cirugía durante la fase hospitalaria fue del 48%, sin embargo, predominó la cirugía electiva frente a la urgente (el 29 vs. el 19%), observándose una menor mortalidad perioperatoria en los casos de cirugía electiva8. Así, algunos estudios han postulado que una indicación más electiva de cirugía, una vez estabilizado el proceso tras el inicio de la antibioterapia y los fármacos vasoactivos, podría contribuir a mejorar el pronóstico a corto y a largo plazo8.
ConclusionesLa valvulopatía degenerativa ha sustituido a la reumática como principal factor de riesgo, por esto, en nuestra serie la válvula más frecuentemente afectada fue la aórtica y el 37,4% de los pacientes tenía más de 65 años. Casi la mitad de los pacientes no tenían cardiopatía predisponente, pero sí otros factores de riesgo «emergentes» (válvulas protésicas, dispositivos intracardíacos, hemodiálisis crónica, diabetes mellitus); un alto porcentaje de pacientes con cardiopatía predisponente desconocía su presencia.
La ETT y la ETE, junto con la clínica y la presencia de hemocultivos positivos, constituyen la principal forma de diagnóstico precoz de la EI. La ETE constituye una técnica obligada en pacientes con evolución complicada y sospecha de extensión perivalvular.
La mortalidad en la EI, a pesar del tratamiento antibiótico correcto y la frecuente necesidad de intervención quirúrgica, es aún muy elevada. Prácticamente la mitad de los pacientes precisan cirugía precoz durante la fase hospitalaria, con una importante tasa de mortalidad perioperatoria.