A pesar de que la miocardiopatía hipertrófica es una enfermedad relativamente frecuente (con una prevalencia de hasta el 0,23% en adultos), la mayoría de las recomendaciones para su manejo provienen de estudios observacionales y de la opinión de expertos. Algunos aspectos de esta patología siguen siendo controvertidos. Recientemente se han publicado las guías de la European Society of Cardiology (ESC) para el diagnóstico y tratamiento de la miocardiopatía hipertrófica. El objetivo de este trabajo es revisar las novedades aportadas por este documento y analizar las diferencias respecto a las guías publicadas por la American Heart Association (AHA) en 2011.
Despite the relatively high frequency of hypertrophic cardiomyopathy (prevalence up to 0.23% in adults), most of the recommendations are based on observational studies and expert consensus. Some aspects of the disease management remain controversial. Recently, the European Society of Cardiology (ESC) guidelines on diagnosis and treatment of hypertrophic cardiomyopathy have been published. The purpose of this article is to review these recommendations and to compare them with the American Heart Association guidelines published in 2011.
En las guías europeas1, la miocardiopatía hipertrófica se define como «el aumento de grosor de la pared del ventrículo izquierdo que no se explica únicamente por las condiciones de carga». Mientras que las guías americanas2 incluyen en su definición exclusivamente las formas primarias de enfermedad, las guías europeas incluyen también las formas secundarias (en las que la cardiopatía es una manifestación de una enfermedad sistémica).
EtiologíaAmbas guías coinciden en que la principal causa de la enfermedad es la genética. Hasta el 60% de los pacientes presentan mutaciones en los genes sarcoméricos (MYH7, MYBPC3, TNNI3, TNNT2, TPM1 y MYL3). El 5-10% de los casos se explican por alteraciones en otros genes implicados en trastornos metabólicos (como la enfermedad de Fabry), enfermedades neuromusculares y síndromes malformativos. Algunos casos son secundarios a amiloidosis, trastornos endocrinos y drogas.
DiagnósticoAmbas guías recogen que, en el adulto, el diagnóstico se realiza con un grosor ≥15mm medido mediante ecocardiografía o resonancia magnética. En las guías europeas se incluye también el TAC como técnica válida. El espesor de 13-14mm se considera borderline y se debe realizar el diagnóstico diferencial con el «corazón de atleta» y la hipertensión arterial. En el niño, el diagnóstico se realiza cuando existen más de 2 desviaciones estándar de la media (z-score≥2). Los familiares de primer grado con un grosor ≥13mm se consideran afectados.
Electrocardiograma y HolterEn ambas guías se recomienda el electrocardiograma de 12 derivaciones en la evaluación inicial de los pacientes y cuando exista un cambio clínico. El Holter está indicado en la primera visita, con el fin de detectar arritmias, y en el caso de palpitaciones o síncope. Las guías americanas recomiendan el Holter de 24h, mientras que las guías europeas recomiendan ampliar la duración a 48h. En pacientes estables, debería repetirse cada 1-2años.
Holter implantableLas guías europeas establecen su indicación en el caso de síncopes recurrentes de causa desconocida en pacientes con bajo riesgo de muerte súbita y en presencia de palpitaciones recurrentes que no se han podido documentar tras monitorización prolongada.
Ecocardiograma- -
Ecocardiograma 2D y Doppler. Ambas guías lo recomiendan en la evaluación inicial de los pacientes y cuando exista un cambio clínico. Permite determinar el grosor del ventrículo izquierdo, detectar la presencia de obstrucción en el tracto de salida (definida como el gradiente ≥30mmHg en reposo o tras maniobras de provocación), valorar alteraciones de la válvula mitral, determinar el tamaño de la aurícula izquierda y evaluar la función sistólica y diastólica. En pacientes estables, debería ser repetido cada 1-2años.
- -
Ecocardiograma de estrés con ejercicio físico. Ambas guías lo recomiendan en los pacientes sintomáticos con gradiente en el tracto de salida <50mmHg y en casos seleccionados asintomáticos. No se recomienda el uso de dobutamina.
- -
Ecocardiograma transesofágico. Está recomendado en ambas guías cuando no se puede identificar el mecanismo de la obstrucción, se sospechan anomalías de la válvula mitral o el paciente va a someterse a un tratamiento invasivo. Se puede considerar el uso de contraste para evaluar la hipertrofia y aneurisma apicales, así como para guiar el procedimiento de ablación septal.
Las guías europeas proponen la utilización de esta técnica no solo cuando el ecocardiograma no sea concluyente (como las guías americanas), sino en todos los pacientes que cumplan criterios diagnósticos. Es superior al ecocardiograma bidimensional en la valoración de la pared anterolateral, región apical, trombos y aneurismas. Aunque la extensión del realce tardío de gadolinio tiene cierta utilidad en cuanto a predecir la mortalidad cardiovascular, sigue sin existir evidencia de que sea un predictor de muerte súbita. Por otro lado, la resonancia magnética puede ser de utilidad para realizar el diagnóstico diferencial con otras entidades, como la amiloidosis cardíaca y la enfermedad de Fabry.
Prueba de esfuerzoSe recomienda en ambas guías para evaluar la intolerancia al ejercicio, así como los cambios en la presión arterial sistólica. De acuerdo con las guías europeas debe realizarse en los pacientes que van a someterse a un tratamiento invasivo, así como en la evaluación pretrasplante cardíaco. Si está disponible, se recomienda la prueba de esfuerzo cardiopulmonar.
Medicina nuclearMientras que las guías americanas consideraban la realización de SPECT o PET en los pacientes con dolor torácico y baja probabilidad de enfermedad, las guías europeas limitan su uso debido a su escaso valor predictivo. Sí se recomienda la escintigrafía ósea con Tc99 si se sospecha amiloidosis familiar (TTR).
Angiografía y TACSe recomiendan en ambas guías en caso de angina típica con probabilidad intermedia de enfermedad y en los pacientes que van a ser sometidos a un procedimiento invasivo. Según las nuevas guías, la angiografía invasiva está indicada en caso de parada cardíaca, taquicardia ventricular y angina en pacientes con enfermedad coronaria.
Medición invasiva de presionesDe acuerdo con las guías europeas, se debe realizar en la evaluación pretrasplante cardiaco y para evaluar la severidad del gradiente y las presiones de llenado cuando las pruebas no invasivas no son concluyentes.
Estudio electrofisiológicoNo está recomendado su uso en la estratificación de riesgo. Sin embargo, las guías europeas destacan su papel en el tratamiento de arritmias supraventriculares y de la preexcitación ventricular. Además, se puede considerar su uso en pacientes con taquicardia ventricular monomorfa sostenida.
Papel del estudio genéticoAmbas guías reconocen la utilidad del estudio genético en los pacientes diagnosticados de miocardiopatía hipertrófica, con el fin de identificar portadores en riesgo de desarrollar la enfermedad entre los familiares de primer grado (claseiia en las guías americanas y clasei en las europeas, nivelB). Las guías europeas lo recomiendan además cuando se sospeche una causa específica de enfermedad, en pacientes con diagnóstico borderline y si hay confirmación histológica post mortem.
En el caso de que se identifique una mutación patogénica, esta se debe incluir en el estudio de los familiares de primer grado. Se recomienda el seguimiento a largo plazo de los portadores, mientras que los no portadores pueden ser dados de alta y reevaluados en caso de síntomas o información nueva respecto a la familia. Para las variantes de significado incierto es importante el estudio de cosegregación de la variante con la enfermedad familiar, lo que puede ayudar a confirmar o descartar su patogenicidad.
En el niño, el estudio genético se recomienda a partir de los 12años en las guías americanas y a partir de los 10 en las europeas, dado que los eventos son raros antes de la pubertad en pacientes asintomáticos. Se puede considerar adelantarlo en el caso de síntomas o elevados requerimientos de ejercicio, y en familias con fenotipo severo.
En general, las guías europeas desaconsejan el diagnóstico genético prenatal, dada la alta variabilidad en la expresión fenotípica de la enfermedad y su carácter frecuentemente benigno.
TratamientoSolo se recomienda en pacientes sintomáticos. El tratamiento invasivo debe considerarse en pacientes con síntomas refractarios y gradiente obstructivo ≥50mmHg.
Pacientes con miocardiopatía hipertrófica obstructiva- -
Tratamiento médico (similares recomendaciones). El fármaco de primera línea es el betabloqueante. Si no es efectivo, se recomienda añadir disopiramida. Si está contraindicado o no es eficaz, se puede añadir verapamilo (o diltiazem) con una estrecha monitorización del paciente. Los betabloqueantes también se recomiendan en niños y en el edema pulmonar. Se debe tener precaución con el uso de diuréticos.
- -
Tratamiento invasivo. No hay estudios aleatorizados que comparen las distintas técnicas. Las guías americanas establecen la miectomía como tratamiento de elección y reservan la ablación septal para los pacientes con contraindicación o alto riesgo para la cirugía. Las guías europeas destacan que ambos procedimientos mejoran la capacidad funcional con una mortalidad similar. La ablación septal presenta mayor incidencia de bloqueo y sería menos efectiva con fibrosis extensa, hipertrofia severa y grosor menor a 16mm. No se recomienda en niños ni con anomalías valvulares asociadas. El implante de marcapasos se debe considerar en pacientes con contraindicación para ambos procedimientos o con otras indicaciones para el implante, siendo los pacientes mayores de 65años el subgrupo donde se alcanzan mayores beneficios.
- -
Tratamiento médico. Se recomienda el tratamiento con betabloqueantes, verapamilo (o diltiazem) y diuréticos a baja dosis. En pacientes con disfunción ventricular se debe considerar el tratamiento con IECA, antialdosterónicos y digoxina (en presencia de fibrilación auricular).
- -
TRC y trasplante cardíaco. Se recomienda considerar la terapia de resincronización en pacientes con NYHAII-IV, FE<50% y BRIHH con QRS>120ms. El trasplante cardíaco debe ser considerado en pacientes con NYHAIII-IV y disfunción sistólica o diastólica refractarios a tratamiento.
Las guías americanas establecen como factores de riesgo la historia previa de fibrilación ventricular, taquicardia ventricular sostenida o muerte súbita, la historia familiar de muerte súbita, el síncope de causa desconocida, la taquicardia ventricular no sostenida, el grosor ≥30mm y la respuesta tensional anormal al esfuerzo. Las guías europeas proponen un nuevo modelo que surge de un estudio con 3.675 pacientes, incluyendo variables que han sido publicadas en al menos un análisis multivariante. Así, se excluye la respuesta tensional anormal al esfuerzo y se incluyen, además de las anteriores, la edad, el tamaño de la aurícula izquierda y la presencia de obstrucción. El modelo proporciona la probabilidad individual de eventos en 5años y no debe ser utilizado en menores de 16años, en atletas ni en pacientes con enfermedades metabólicas, infiltrativas o sindrómicas.
Manejo de la fibrilación auricularAmbas guías recomiendan administrar antagonistas de la vitaminaK (o nuevos anticoagulantes orales si hay contraindicación) a los pacientes con fibrilación auricular, y considerar la cardioversión si es de reciente comienzo. Se recomienda el uso de amiodarona para el control del ritmo y betabloqueantes y antagonistas del calcio para el control de frecuencia. No se recomienda el uso de dronedarona. La ablación con catéter puede valorarse en pacientes sin dilatación auricular severa refractarios a tratamiento médico. En las guías europeas, el tamaño auricular ≥45mm se establece como predictor de riesgo para el desarrollo de fibrilación auricular e ictus y se recomienda Holter cada 6-12meses.
Manejo del embarazoEn las guías europeas, los betabloqueantes son el fármaco de elección y se recomienda monitorizar el crecimiento fetal. Se recomienda el parto vaginal y la anticoagulación con heparina de bajo peso o antagonistas de la vitaminaK según el momento de la gestación en caso de fibrilación auricular.
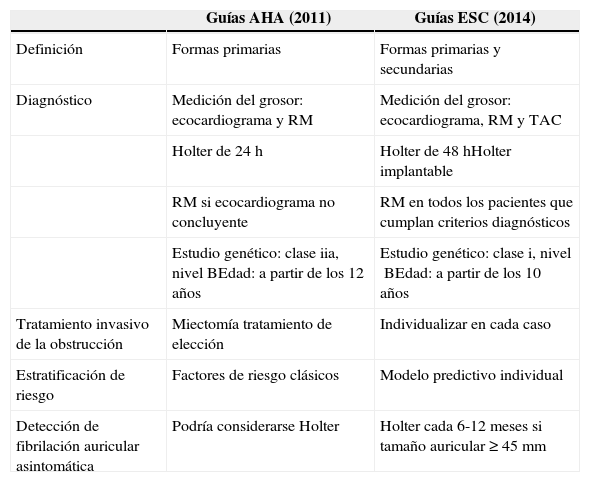
En la tabla 1 se recogen las diferencias fundamentales entre ambas guías.
Aspectos diferenciales más relevantes en las guías americanas y europeas para el manejo de la miocardiopatía hipertrófica
| Guías AHA (2011) | Guías ESC (2014) | |
|---|---|---|
| Definición | Formas primarias | Formas primarias y secundarias |
| Diagnóstico | Medición del grosor: ecocardiograma y RM | Medición del grosor: ecocardiograma, RM y TAC |
| Holter de 24h | Holter de 48hHolter implantable | |
| RM si ecocardiograma no concluyente | RM en todos los pacientes que cumplan criterios diagnósticos | |
| Estudio genético: claseiia, nivelBEdad: a partir de los 12años | Estudio genético: clasei, nivelBEdad: a partir de los 10años | |
| Tratamiento invasivo de la obstrucción | Miectomía tratamiento de elección | Individualizar en cada caso |
| Estratificación de riesgo | Factores de riesgo clásicos | Modelo predictivo individual |
| Detección de fibrilación auricular asintomática | Podría considerarse Holter | Holter cada 6-12meses si tamaño auricular ≥45mm |
AHA: American Heart Association; ESC: European Society of Cardiology.
Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.