Clásicamente, el intervencionismo coronario percutáneo (ICP) se ha centrado en la restauración del flujo coronario epicárdico, relegando a un segundo plano la microcirculación coronaria. Sin embargo, es importante recordar que la obstrucción prolongada del flujo epicárdico condiciona daños «en cascada» sobre la microcirculación, cuya afectación potencia la pérdida del flujo epicárdico en lo que se define como fenómeno de no-reflow (NR). El desarrollo de nuevas técnicas de imagen no invasivas y la constante evolución de la cardiología intervencionista hacia una vertiente mucho más fisiológica han generado un creciente interés en la microcirculación coronaria y la patología inherente a ella. Desde su primera definición en modelos experimentales de cerebros animales en 19681, el término «no reflow» se ha ido empleando cada vez más asiduamente en la literatura científica cardiológica para describir una obstrucción microvascular con flujo miocárdico disminuido tras la apertura de una arteria epicárdica ocluida2.
El objetivo del presente trabajo es realizar una revisión de este fenómeno desde su base fisiopatológica hasta los últimos avances en su manejo.
Magnitud del problemaActualmente, la cardiopatía isquémica sigue siendo la primera causa de morbimortalidad en los países occidentales. En las últimas décadas, la introducción de nuevas estrategias de reperfusión tanto invasivas como farmacológicas ha logrado un notable descenso en la morbimortalidad de los pacientes con infarto agudo de miocardio (IAM). Sin embargo, el objetivo de la revascularización no debe limitarse a la restauración del flujo epicárdico. La incidencia estimada de NR se sitúa en un 2-50% de los pacientes sometidos a ICP tras un IAM con elevación del segmento ST (IAMCEST), con una importante variabilidad en función de los subgrupos de pacientes estudiados y del método empleado para identificar el NR3-6. Su aparición se asocia a un peor pronóstico a corto y a largo plazo, correlacionándose con un riesgo 4-10 veces superior de IAM y muerte7,8. Asimismo, los pacientes que sufren un fenómeno de NR presentan una mayor tasa de complicaciones precoces postinfarto (arritmias, derrame pericárdico, taponamiento cardiaco e insuficiencia cardiaca congestiva), remodelado ventricular izquierdo, reingresos por insuficiencia cardiaca y mortalidad9-14.
FisiopatologíaEl fenómeno de NR podría considerarse la representación más severa de la disfunción microvascular. Inicialmente estudiado en la circulación cerebral de modelos animales15, el NR cardiaco fue publicado por primera vez en modelos experimentales caninos por el grupo de Kloner16, que evidenció que, tras un largo periodo de oclusión artificial, la recuperación del flujo coronario era parcial pese a la eliminación de la obstrucción, lo cual se asociaba con defectos marcados de perfusión subendocárdicos. En dichos modelos el examen posterior del tejido cardiaco mediante microscopia electrónica demostró un importante daño microvascular, con edema celular e intersticial, inflamación endotelial y, en menor medida, depósitos de fibrina y plaquetas. La combinación de todos estos factores conduce a una compresión extrínseca de los capilares, lo cual interfiere con el flujo normal a los miocitos, responsable del fenómeno de NR1.
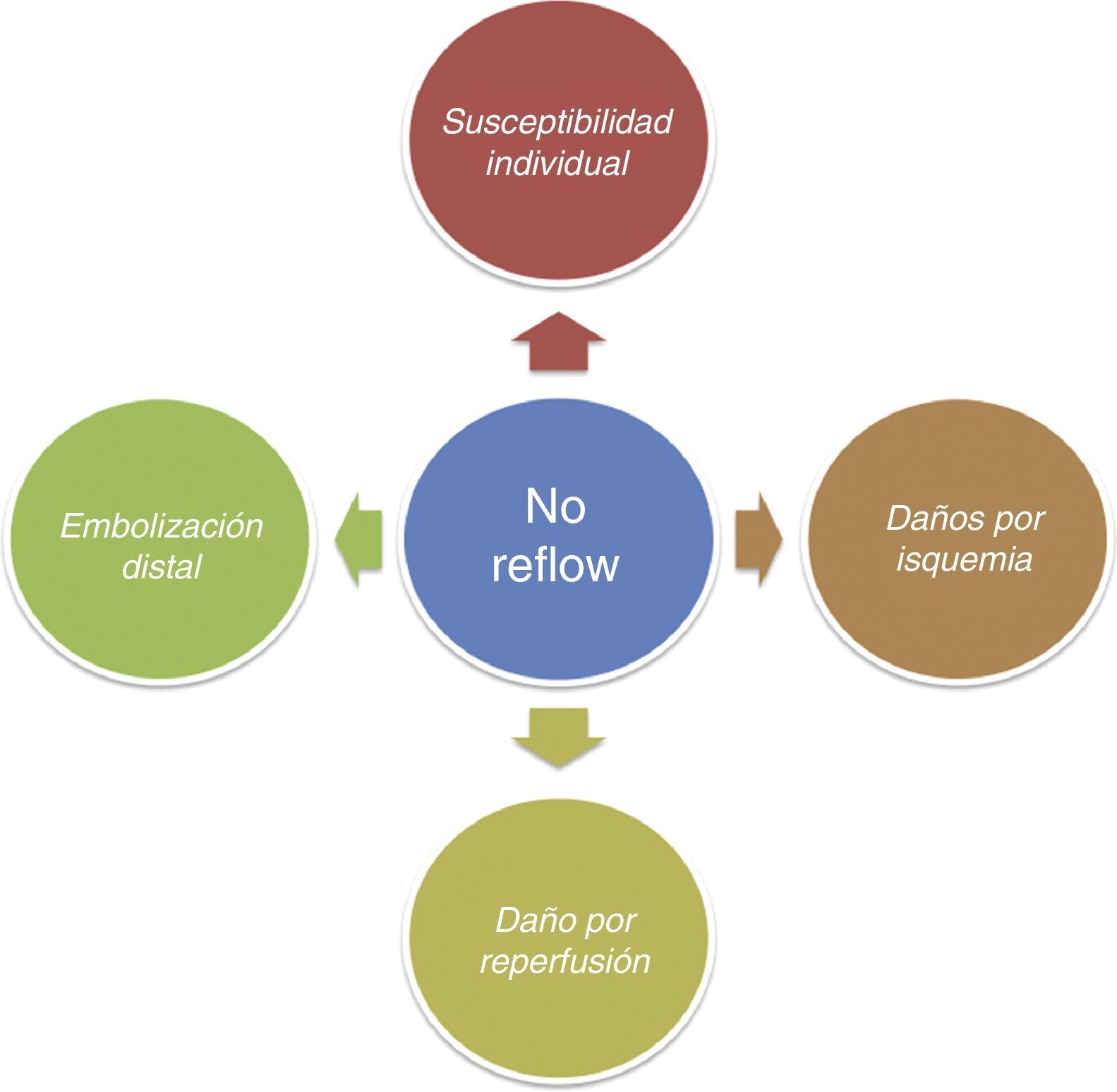
Actualmente, el mecanismo por el que se produce el NR no está completamente aclarado. Se acepta que la fisiopatología del NR se sustenta en 4 pilares (fig. 1), y cada uno de ellos puede jugar un papel diferente en cada paciente2,17,18:
- 1.
Microembolización distal aterotrombótica. El riesgo de microembolización mediada por el ICP está íntimamente relacionado con la carga aterotrombótica de la lesión tratada y la agresividad del procedimiento10-21.
- 2.
Daños por isquemia. Están directamente relacionados con la duración y la extensión de esta. Una isquemia mantenida genera formación de ampollas, protrusión y exudado endotelial. Esto, asociado a un estado protrombótico, condiciona una importante compresión extravascular18. Asimismo, está demostrado que en los casos de oclusión trombótica de la arteria descendente anterior el riesgo de NR es mayor en comparación con otras arterias, debido a una mayor extensión de territorio afectado.
- 3.
Daño por reperfusión. La llegada de oxígeno a territorios sometidos a isquemias prolongadas propicia la liberación de gran cantidad de radicales libres de oxígeno. La restauración del flujo condiciona la llegada de neutrófilos y plaquetas sobre un entorno proinflamatorio y protrombótico, propiciando cambios endoteliales que contribuyen a crear y perpetuar la cascada inflamatoria que finalmente conduce al empeoramiento del NR.
- 4.
Susceptibilidad individual. Puede ser tanto heredada como adquirida. La diabetes parece asociarse a una peor reperfusión microvascular tras ICP, mientras que la hipercolesterolemia se ha asociado en modelos animales a mayor daño por reperfusión.
- 1.
Electrocardiograma. En el contexto del IAMCEST, la ausencia de resolución de la elevación del segmento ST>50% (en algunos estudios >70%) está considerada un marcador establecido de NR22. Algunos estudios han demostrado que la utilización conjunta de 3 datos simples y económicos, como son la resolución del segmento ST en el electrocardiograma, el flujo TIMI y el myocardial blush grade (MBG), mejora ostensiblemente la estratificación del riesgo en estos pacientes14,22,23.
- 2.
Ecocardiografía. Actualmente considerado como el gold standard en el diagnóstico del NR, la ecocardiografía con contraste intravenoso o intracoronario directo puede ser útil en la identificación de zonas de NR. La ausencia de microburbujas en el área afectada o su persistencia paradójica como consecuencia de la afectación microvascular indican la presencia del NR, que puede observarse, con este método, en alrededor del 30% de los pacientes sometidos a técnicas de reperfusio¿n y se correlaciona con mayor disfunción sistólica y una mayor tasa de episodios adversos24-27.
- 3.
Resonancia magnética nuclear cardiaca (RMN-C). Hoy en día, la RMN-C con contraste representa la técnica más sensible y específica para el diagnóstico del NR. No solo permite cuantificar la función y las dimensiones de las diferentes cavidades tras un IAMCEST, sino que mediante secuencias potenciadas en T2 (aumenta la señal de la edematización) es posible identificar el edema en fase aguda del IAM y, con ello, el «área en riesgo». La presencia de hipocontrastación dentro de las áreas de hipercontraste sugiere un daño microvascular persistente. Este daño ha sido definido como obstrucción microvascular y representa el criterio de NR mediante RMN-C28.La presencia de obstrucción microvascular diagnosticada mediante RMN-C tras un IAM ha demostrado ser un importante predictor de episodios adversos mayores, y se asocia a menor recuperación de la contractilidad regional29-30.
- 4.
Coronariografía. Pese a que la ecocardiografía supone el gold standard, en la práctica clínica diaria lo más frecuente es llevar a cabo el diagnóstico de NR mediante coronariografía. Clásicamente se han empleado el grado de flujo TIMI y el MBG (tabla 1). El NR se ha definido por angiografía como un flujo TIMI<3 o un flujo TIMI3 con MBG<231. Durante la valoración de un NR mediante coronariografía es muy importante descartar otras posibles causas de flujo lento o ausente, como la hipotensión arterial sistémica, la disección coronaria o el trombo18. A este respecto, el reciente auge de las técnicas de diagnóstico intracoronario, como el intravascular ultrasound (IVUS) o la optical coherence thomography (OCT) nos permite identificar causas reversibles de flujo enlentecido o ausente; de ahí que su empleo esté cada vez más integrado en los laboratorios de hemodinámica.
Tabla 1.Grados de flujo epicárdico y miocárdico TIMI y BLUSH
Grados de flujo TIMI epicárdico (TIMI) TIMI 0 Ausencia de flujo Ausencia de flujo anterógrado distal a la lesión TIMI 1 Penetración sin perfusión El contraste atraviesa el área de obstrucción, sin llegar a opacar toda longitud de la arteria al final de la inyección TIMI 2 Reperfusión parcial El contraste opaca toda la arteria, pero de forma ostensiblemente más lenta que en el resto de arterias o en los segmentos proximales de dicha arteria TIMI 3 Perfusión completa El contraste entra y sale del lecho distal a la obstrucción con la misma rapidez que en el lecho proximal a la obstrucción o en el lecho arterial coronario contralateral no afectado TIMI 4 Hiperaflujo Flujo anterógrado y vaciado más rápido que en arterias normales Grados de flujo BLUSH miocárdico (MBG) MBG 0 El contraste no entra en la microcirculación MBG 1 Contraste entra lentamente, pero no sale de la microcirculación MBG 2 Retraso en la entrada y la salida del medio de contraste en la microcirculación MBG 3 Entrada y salida del contraste en la microcirculación normales
El uso del doppler intracoronario durante el NR ha permitido definir un patrón de flujo coronario característico con 3 componentes: flujo sistólico reverso, flujo anterógrado disminuido y flujo diastólico retrógrado con pendiente de deceleración rápida. El flujo intramiocárdico severamente reducido como consecuencia de la disfunción microvascular sería el causante de la deceleración brusca diastólica, mientras que la resistencia microvascular aumentada explicaría la onda retrógrada sistólica32.
Otros parámetros han sido validados recientemente en la valoración de obstrucción microvascular:
- a.
Reserva de flujo coronario. Ensayos clínicos han demostrado que, medido directamente después de la angioplastia coronaria transluminal percutánea (ACTP), es un fuerte predictor de episodios cardiacos adversos a largo plazo33.
- b.
Afectación de las resistencias microvasculares. La medida del índice de resistencia microvascular y la resistencia en máxima hiperemia tras intervencionismo coronario están ligadas al daño miocárdico tras un infarto. Predicen el tamaño y la severidad del IAM, correlacionándose con el pico de CPK y de troponina-i, la función ventricular y la viabilidad miocárdica a los 6meses. Además, es un predictor de la recuperación de la función de ventrículo izquierdo33.
Diversos estudios sugieren que estos parámetros podrían identificar a pacientes de alto riesgo de desarrollo de obstrucción microvascular susceptibles de beneficiarse de un tratamiento coadyuvante farmacológico postangioplastia coronaria.
ManejoSin duda alguna, la mejor estrategia en el manejo del NR se basa en la prevención. Es esencial conocer los factores de riesgo y las situaciones que conducen al fenómeno de NR con el fin de llevar a cabo una adecuada estrategia de prevención. Una vez establecido, el tratamiento debe centrarse en lograr la recuperación del flujo y mejorar la perfusión miocárdica.
Prevención del no-reflowEl principal factor asociado al NR en el contexto del síndrome coronario agudo es el tiempo de oclusión arterial. Como ya definieron Reimer y Jennings34 hace más de 30años, el «tiempo es músculo», de ahí que las guías de revascularización miocárdica recomienden cada vez menor tiempo entre la identificación del IAMCEST y la apertura de la arteria. Resulta crucial identificar y tratar los IAMCEST con rapidez, dado que a mayor área en riesgo y mayor tiempo de isquemia, mayor es el riesgo de NR35,36.
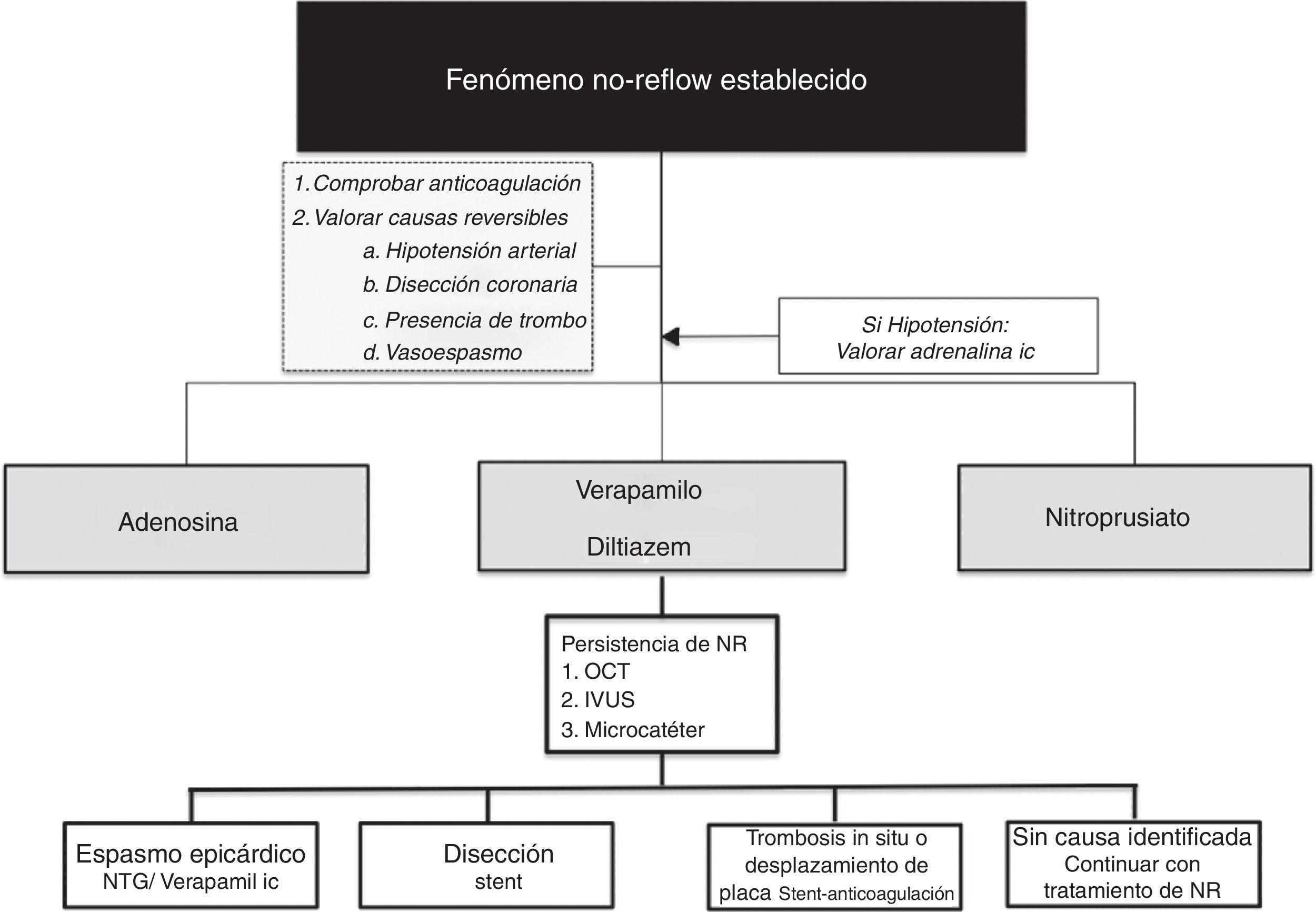
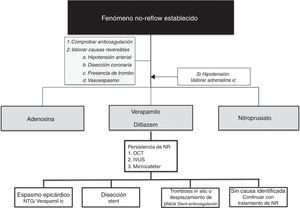
Manejo del no-reflow establecidoDesde un punto de vista práctico, una vez instaurado el NR es recomendable iniciar su manejo asegurándonos la correcta anticoagulación del paciente y descartando vasoespasmo mediante la inyección de nitroglicerina intracoronaria. Una vez descartada la presencia de causas reversibles que justifiquen la ausencia de flujo epicárdico, existen diferentes fármacos que pueden ser empleados en función de la situación hemodinámica del paciente y la experiencia del centro (tabla 2):
- a)
Adenosina. El fármaco más comúnmente empleado, es un nucleo¿tido endo¿geno que disminuye la resistencia arteriolar e inhibe la migración neutrofílica, reduciendo y previniendo la generación de radicales libres. La adenosina intravenosa en el contexto de la cardiopatía isquémica ha sido evaluada en 2 grandes estudios: el AMISTAD y el AMISTADII2. El primero fue un estudio aleatorizado con 236 pacientes sometidos a fibrinólisis en el que se evaluó adenosina intravenosa versus placebo con el fin de reducir el tamaño del infarto por SPECT miocárdico. Se objetivó una reducción significativa del 33% del tamaño del infarto en el grupo de adenosina a altas dosis (70μg/kg/min durante 3h). El AMISTADII fue un ensayo aleatorizado que comparaba la incidencia de insuficiencia cardiaca congestiva y muerte en el IAM anterior en 3 grupos: placebo y adenosina a dosis de 50 y 70μg/kg/min. No hubo diferencias significativas entre los 3 grupos en el objetivo primario, si bien en un análisis retrospectivo posterior se objetivó una disminución del tamaño del IAM con la dosis alta, concordante con el AMISTAD.
- b)
Verapamilo. Como bloqueador de los canalesl de calcio, el verapamilo mejora la disfunción de la microcirculación previniendo el espasmo microvascular y regulando la función endotelial. El efecto del verapamilo en la prevención y el tratamiento del NR ha sido evaluado en múltiples estudios. En un metaanálisis reciente realizado por el grupo de Su et al.37 en el que se incluían 7 estudios aleatorizados con más de 500 pacientes, se objetivó que la administración de verapamilo intracoronario fue beneficiosa en la prevención del NR, mejorando significativamente parámetros de flujo intracoronario y reduciendo los MACE intrahospitalarios y a los 2 meses de la revascularización. Sin embargo, el uso de verapamilo no se asoció a una mejoría adicional de la FEVI posterior.
- c)
Abciximab. Este inhibidor de la glucoproteína iib/iiia ha demostrado mejorar la reperfusión miocárdica tras el ICP. Generalmente se emplea en los casos con alta carga trombótica o con embolización trombótica tras la revascularización. Puede ser administrado tanto por vía intracoronaria como por vía venosa periférica, aunque algunos estudios han demostrado menor obstrucción microvascular y reducción en el tamaño del infarto con la administración intracoronaria38.
- d)
Nitroprusiato. Actúa como un donador de óxido nítrico, generando una potente vasodilatación mediada por la activación de la guanililciclasa. Su rápido inicio de acción asociado a su potente capacidad de relajación del músculo liso le confieren una excelente capacidad de regulación de la microcirculación coronaria. Su uso en el NR ha sido evaluado en diferentes estudios. El grupo de Hillegass39 fue el primero que demostró en una cohorte de 19 pacientes consecutivos con NR que la administración intracoronaria de nitroprusiato conducía a una rápida y muy significativa mejoría en el flujo coronario en ausencia de episodios adversos o hipotensiones significativas.
- e)
Adrenalina. La adrenalina, además de poseer un efecto cronotrópico e inotrópico positivo sobre el corazón, genera un potente efecto vasodilatador coronario a través de la activación de los receptores B2, mejorando el flujo coronario. El empleo de agentes vasopresores sistémicos en el contexto del fenómeno de NR ha sido descrito en la literatura científica de forma puntual. Skelding et al.40 describieron en 2002 el uso de adrenalina en los casos de fenómenos de NR refractarios al tratamiento convencional, logrando una mejoría estadísticamente significativa en el flujo coronario en el 93% de los pacientes. En dicho estudio, los autores realizan un subanálisis de los casos de NR con hipotensión, lográndose una mejoría de las cifras tensionales en el 90% de ellos, sin detectar casos de arritmias severas.
- f)
Otros.
- a.
Empleo de microcatéteres. Dado que las arterias afectas por el NR presentan flujo nulo o muy enlentecido, algunos autores postulan el empleo de microcatéteres como vía para hacer llegar el fármaco a emplear a la circulación distal.
- b.
Sistemas de protección distal y tromboaspiración. Los sistemas de protección distal y la tromboaspiración podrían resultar beneficiosos en el manejo de lesiones con alta carga trombótica, aunque los diferentes estudios publicados han mostrado resultados contradictorios18.
- a.
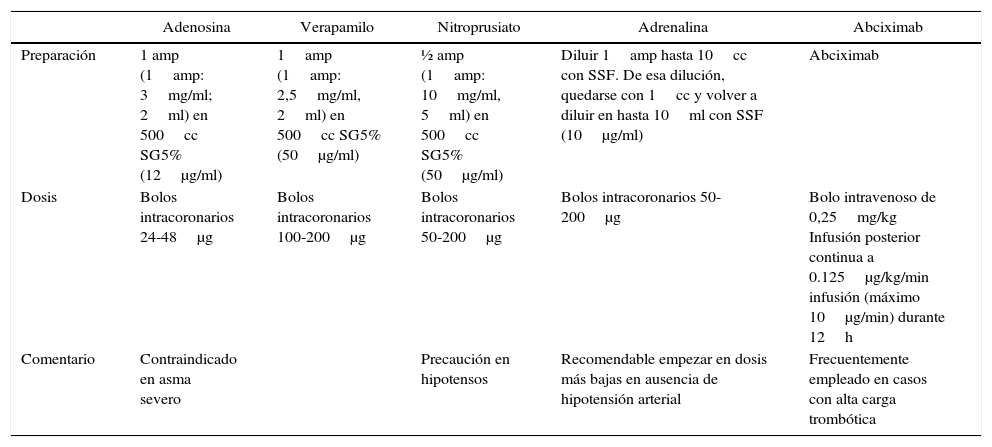
Fármacos más comúnmente empleados en el NR
| Adenosina | Verapamilo | Nitroprusiato | Adrenalina | Abciximab | |
|---|---|---|---|---|---|
| Preparación | 1 amp (1amp: 3mg/ml; 2ml) en 500cc SG5% (12μg/ml) | 1amp (1amp: 2,5mg/ml, 2ml) en 500cc SG5% (50μg/ml) | ½ amp (1amp: 10mg/ml, 5ml) en 500cc SG5% (50μg/ml) | Diluir 1amp hasta 10cc con SSF. De esa dilución, quedarse con 1cc y volver a diluir en hasta 10ml con SSF (10μg/ml) | Abciximab |
| Dosis | Bolos intracoronarios 24-48μg | Bolos intracoronarios 100-200μg | Bolos intracoronarios 50-200μg | Bolos intracoronarios 50-200μg | Bolo intravenoso de 0,25mg/kg Infusión posterior continua a 0.125μg/kg/min infusión (máximo 10μg/min) durante 12h |
| Comentario | Contraindicado en asma severo | Precaución en hipotensos | Recomendable empezar en dosis más bajas en ausencia de hipotensión arterial | Frecuentemente empleado en casos con alta carga trombótica |
Con el fin de dilucidar cuál es el fármaco más adecuado en el manejo del NR, algunos estudios de pequeño tamaño ha tratado de comparar la efectividad de los diferentes agentes, entre los que cabe destacar el estudio aleatorizado RECOVER41, que comparó el uso intracoronario de diltiazem, verapamilo y nitroglicerina en el NR establecido en el contexto de la angioplastia primaria en 102 pacientes. Se objetivó una mejoría significativa en el corrected thrombolysis in myocardial infarction frame count (CTFC) en los grupos de los antagonistas del calcio con respecto al grupo de nitroglicerina, así como mayor tasa de resolución del ascenso del ST a las 3h y menor pico de marcadores de necrosis miocárdica. Si bien no se detectaron diferencias entre el verapamilo y el diltiazem, este último parece ser más seguro y condicionar una menor caída de presión arterial y frecuencia cardiaca tras su administración. Actualmente se encuentra en marcha el estudio STEMI-REFLOW. Se trata de un ensayo multicéntrico, prospectivo, aleatorizado y controlado que aleatoriza a pacientes con IAMCEST a los que se trata con bivalirudina y tromboaspiración a 3 grupos de tratamiento farmacológico: adenosina intracoronaria con ICP, nitroprusiato sódico+ICP o grupo control con ICP estándar. Aunque el objetivo primario es el tamaño del infarto medido por RMN-C, uno de los objetivos secundarios es la incidencia pre y posprocedimiento de NR.
Con vistas a facilitar el manejo de este tipo de pacientes, proponemos un algoritmo de estrategia de tratamiento en casos de NR (fig. 2)
ConclusionesEl fenómeno de NR es una entidad relativamente frecuente, con una importante repercusión en términos de morbimortalidad. Se trata de un proceso complejo y multifactorial en el que coexisten alteraciones tanto funcionales como anatómicas sobre una base de susceptibilidad individual. Si bien es cierto que la ecocardiografía con contraste sigue considerándose el gold standard para su identificación, nuevas técnicas, como la RMN-C, surgen como alternativa viable. El manejo sigue siendo controvertido, no existiendo actualmente ningún tratamiento efectivo de forma individual; de ahí que frecuentemente se requieran estrategias combinadas tanto para su resolución como para su prevención.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesNo existe conflicto de intereses.
Los autores del presente trabajo agradecen a la Sociedad Andaluza de Cardiología la concesión del premio a la Mejor Comunicación de Residentes de 2015. Asimismo, agradecen al comité editorial y a los revisores sus aportaciones.