Comparar requerimientos transfusionales intra y postoperatorios inmediatos entre pacientes sometidos a recambio valvular aórtico por miniesternotomía en «J» y por esternotomía media longitudinal.
MétodosEstudiados 655 pacientes sometidos a recambio valvular aórtico entre 2005 y 2013, 498 por abordaje convencional (grupoC) y 120 por abordaje mínimamente invasivo (grupoM). Confeccionados 120 emparejamientos mediante propensity score matching, basado en 18 variables preoperatorias. Analizado número de transfusiones de hemoderivados intraoperatoriamente y hasta 72 h del postoperatorio.
ResultadosNo se encontraron diferencias significativas en variables preoperatorias, incluidos valores de hemoglobina, hematocrito y recuento de plaquetas. El porcentaje de pacientes transfundidos del grupo M fue menor: 52,5% vs. 63,3% (p = 0,089) para concentrado de hematíes 11,6% vs. 24,1% (p = 0,012) para unidades de plaquetas y 14,5% vs. 27,5% (p = 0,011) para plasma fresco congelado. La cantidad de hemoderivados transfundidos también fue menor en el grupo M: 1,74±2,17 vs. 2,23±2,57 (p = 0,112) para concentrado de hematíes; 0,13±0,38 vs. 0,32±0,38 (p = 0,007) para unidades de plaquetas y 0,30±0,77 vs. 0,59±1,12 (p = 0,002) para plasma fresco congelado. El abordaje mínimamente invasivo se presenta como factor protector ante la necesidad transfusional de unidades de plaquetas y plasma fresco congelado: OR 0,414 (0,206-0,832) p = 0,013 y OR 0,435 (0,227-0,834) p = 0,012. En el análisis de morbimortalidad, la transfusión de plasma fresco congelado se presenta como factor de riesgo positivo: OR 4,182 (1,287-13,588), p = 0,017.
ConclusiónEl abordaje mínimamente invasivo disminuye las necesidades transfusionales de hemoderivados y de esta manera las complicaciones asociadas a las mismas.
To compare intraoperative and postoperative transfusion requirements in patients undergoing aortic valve replacement by mini-sternotomy in “J” vs conventional sternotomy.
MethodsThe study included 655 patients who underwent aortic valve replacement between 2005 and 2013, with 498 patients by the conventional approach (groupC) and 120 by a minimally invasive approach (groupM). A propensity score matching was performed to find 120 matched pairs based on 18 preoperative variables. An analysis was made of the number of blood units transfused intraoperatively and up to 72hours postoperatively.
ResultsNo significant differences were found in preoperative variables, including hemoglobin, hematocrit, and platelet count. The percentage of transfused patients in group M was lower: 52.5% vs 63.3% (P=.089) for packed red blood cells (RBC); 11.6% vs 24.1% (P=.012) for platelet pool, and 14.5% vs 27.5% (P=.011) for fresh frozen plasma (FFP). The number of units of blood transfused was also lower in the M group: 1.74±2.17 vs 2.23±2.57 (P=.112) for RBC; 0.13±0.38 vs 0.32±0.38 (P=.007) for platelet units and 0.30±0.77 vs 0.59±1.12 (P=.002) for FFP. The minimally invasive approach shows to be a protective factor for platelets and FFP transfusion: OR 0.414 (0.206 to 0.832), P=.013 and OR 0.435 (0.227 to 0.834), P=.012, respectively. In the analysis of mortality, FFP transfusion was a risk factor for mortality: OR 4.182 (1.287 to 13.588) P=.017.
ConclusionThe minimally invasive approach reduces blood transfusion requirements and thus the complications related to it.
Desde el inicio de los abordajes mínimamente invasivos en cirugía cardíaca descritos por Cosgrove y Sabik1, diferentes grupos fueron presentando su experiencia con diversas técnicas para el abordaje de la patología valvular aórtica2-7. Además de demostrar la seguridad de estos abordajes con respecto a la técnica estándar utilizada habitualmente8, sin aumentar la morbimortalidad del procedimiento, se han propuesto otras posibles ventajas más allá del resultado estético, como una mejor y más rápida recuperación de la función respiratoria asociada a menor dolor postoperatorio, reduciendo todo esto la estancia hospitalaria de los pacientes, tanto en Unidad de Cuidados Intensivos (UCI) como en sala8. Sin embargo, muchos estudios presentan resultados controvertidos9-18. Uno de los beneficios que podría considerarse más importante es la posibilidad de reducir la necesidad de transfusión de hemoderivados en pacientes sometidos a abordajes mínimamente invasivos19, justificado por la menor agresión y traumatismo a los tejidos del organismo con estas técnicas.
Luego de casi 10 años de experiencia en este tipo de abordaje en nuestro servicio, presentamos nuestros resultados en cuanto a las necesidades transfusionales comparando a los pacientes sometidos a recambio valvular aórtico aislado por abordaje mínimamente invasivo frente al abordaje estándar por esternotomía media longitudinal.
Materiales y métodosPresentamos un estudio retrospectivo compuesto por pacientes intervenidos en un solo centro. Para obtención de los datos fueron utilizadas la base de datos informática tanto del Servicio de Cirugía Cardíaca, como del Centro de Transfusiones del Servicio de Hematología. En los casos en que las bases informáticas no proporcionaron los datos requeridos, se procedió a la revisión de las historias clínicas de los pacientes.
En un período de 8 años (2005-2013), 655 pacientes fueron intervenidos de sustitución valvular aórtica aislada. Se excluyó a pacientes intervenidos con carácter urgente, las reintervenciones y los pacientes sometidos a otro procedimiento concomitante en la misma intervención.
A pesar de que la proporción de procedimientos por abordaje mínimamente invasivo no es la misma para todos los cirujanos del staff del servicio, todos han realizado las intervenciones por ambas técnicas durante este período.
Dentro de esta muestra, se identificó a todos los pacientes en los que se tuvo acceso al registro de transfusiones en el banco de sangre del hospital, obteniéndose un grupo de 618 pacientes con una edad media ± desviación estándar de 68,50±10,46 años, de los cuales 498 (80,5%) fueron intervenidos por abordaje convencional y 120 (19,5%) por abordaje mínimamente invasivo, todos distribuidos de forma homogénea en el mismo período.
Se diseñó un propensity score matching para identificar y emparejar casos controles apropiados dentro del grupo de abordaje convencional mediante un modelo de regresión logística binaria basada en 18 variables preoperatorias, obteniéndose 2 grupos similares y comparables con 120 pacientes intervenidos mediante abordaje convencional (grupoC) y 120 pacientes intervenidos mediante abordaje mínimamente invasivo (grupoM).
Se tuvieron en cuenta las transfusiones recibidas de concentrados de hematíes (CH), unidades de plaquetas (UP) y plasma fresco congelado (PFC), tanto intraoperatoriamente como hasta las 72 h del postoperatorio.
Se diseñó un análisis de regresión logística, tanto uni como multivariante, para identificar predictores significativos para las variables de necesidades transfusionales y su asociación a la morbimortalidad tanto intra como postoperatoria.
Anestesia y técnica quirúrgicaTodos los pacientes recibieron el mismo régimen de anestesia y monitorización. Las intervenciones se realizaron con circulación extracorpórea (CEC) e hipotermia ligera (32-34°C), canulación central y pinzamiento aórtico estándar. Para protección miocárdica, se utilizó cardioplejía hemática fría a 4° C. Excepto la incisión y la canulación venosa, el resto de la técnica quirúrgica fue similar en ambos grupos. En el grupo C se realizó una incisión en piel de 20-25cm, seguida de una esternotomía completa longitudinal; la canulación venosa se realizó en la orejuela derecha con cánula venosa de 32 Fr. En el grupo M se realizó una incisión en piel de 8cm, partiendo del ángulo de Louis hacia el extremo caudal, seguida de una miniesternotomía en «J» desde la horquilla esternal hasta el cuarto espacio intercostal derecho. La canulación venosa fue a través de la vena cava superior en dirección a la aurícula derecha y vena cava inferior, con una cánula venosa de doble estadio de 29 Fr. En el grupo M se utilizó infusión continua de CO2 en el campo quirúrgico durante el tiempo de CEC, para facilitar el purgado de aire de las cavidades cardiacas, a diferencia del grupo C, en el que no se utilizó de rutina. Cuando fue necesario desfibrilar el corazón tras liberar la pinza aórtica, se utilizaron palas de desfibrilador internas convencionales para los casos del grupo C y palas de tamaño pediátrico para el grupo M. La elección del abordaje fue criterio exclusivo de cada cirujano. Los criterios de extubación fueron los mismos en ambos grupos, así como los de transfusión de hemoderivados y retirada de drenajes, a consideración de los anestesistas en los días de estancia en UCI y del equipo de cirugía cardíaca durante su estancia en sala.
Análisis estadísticoLos datos se analizaron con el paquete software SPSS (versión 12.0). Los valores se expresan en porcentajes y medias±desviación estándar. El test de Student fue utilizado para los análisis estadísticos cuantitativos y la prueba χ2de Pearson para los cualitativos. Se consideraron significativas las diferencias con p<0,05.
ResultadosEn la tabla 1 se ilustran las características prequirúrgicas de la totalidad de la muestra. Los pacientes del grupo del abordaje mínimamente invasivo presentaron una media de edad y EuroScore logístico de riesgo ligeramente mayor al grupo de abordaje convencional, sin alcanzar la significación estadística; 69,47±9,98 vs. 68,27±11,18 (p = 0,281) y 6,05±4,36 vs. 5,82±4,47 (p = 0,618). La distribución por sexo y la incidencia de factores de riesgo cardiovascular, así como la situación clínica preoperatoria de los pacientes, también fueron similares. No se encontraron diferencias significativas en cuanto a los valores de hemoglobina, hematocrito y recuento de plaquetas en la analítica realizada el día previo a la intervención.
Características preoperatorias de la totalidad de la muestra
| Total | Grupo C | Grupo M | p | |
|---|---|---|---|---|
| n | 618 | 498 | 120 | |
| Edad (media ± DE) | 68,50±10,96 | 68,27±11,18 | 69,47±9,98 | 0,281 |
| Sexo (masculino) (%) | 59,4% | 56,7% | 0,580 | |
| EuroScore Logístico (media ± DE) | 5,86±4,45 | 5,82±4,47 | 6,05±4,36 | 0,618 |
| Hemoglobina (media ± DE) | 13,10±1,44 | 13,52±1,33 | 13,01±1,24 | 0,898 |
| Hematocrito (media ± DE) | 39,01±4,90 | 39,78±5,01 | 38,90±4,77 | 0,865 |
| Plaquetas (media ± DE) | 202±70 | 200±80 | 205±66 | 0,708 |
| Tabaquismo (%) | 32,5% | 31,1% | 38,3% | 0,130 |
| Obesidad (%) | 15,7% | 15,5% | 16,7% | 0,745 |
| HTA (%) | 62,6% | 62,4% | 63,3% | 0,857 |
| Dislipidemias (%) | 43,7% | 42% | 50,8% | 0,079 |
| EPOC (%) | 16% | 16,1% | 15,8% | 0,951 |
| Diabetes mellitus (%) | 25,2% | 25,1% | 25,8% | 0,868 |
| IR (%) | 4,4% | 4% | 5,8% | 0,382 |
| Arteriopatía periférica (%) | 4,7% | 5% | 3,3% | 0,433 |
| HTP (%) | 5% | 5,4% | 3,3% | 0,347 |
| FEVI (eco) (media ± DE) | 54,90±8,22 | 55,09±8,22 | 54,13±8,22 | 0,252 |
| Grado NYHA (%) | I | 5% | 1,7% | ns |
| II | 29,1% | 26,7% | ||
| III | 60,4% | 63,3% | ||
| IV | 5,4% | 8,3% | ||
| ACV (%) | 1% | 1% | 0,8% | 0,905 |
ACV: accidente cerebrovascular; DE: desviación estándar; EPOC: enfermedad pulmonar obstructiva crónica; FEVI: fracción de eyección del ventrículo izquierdo; HTA: hipertensión arterial; HTP: hipertensión pulmonar; IR: insuficiencia renal; ns: no significativo; NYHA: New York Heart Asociation.
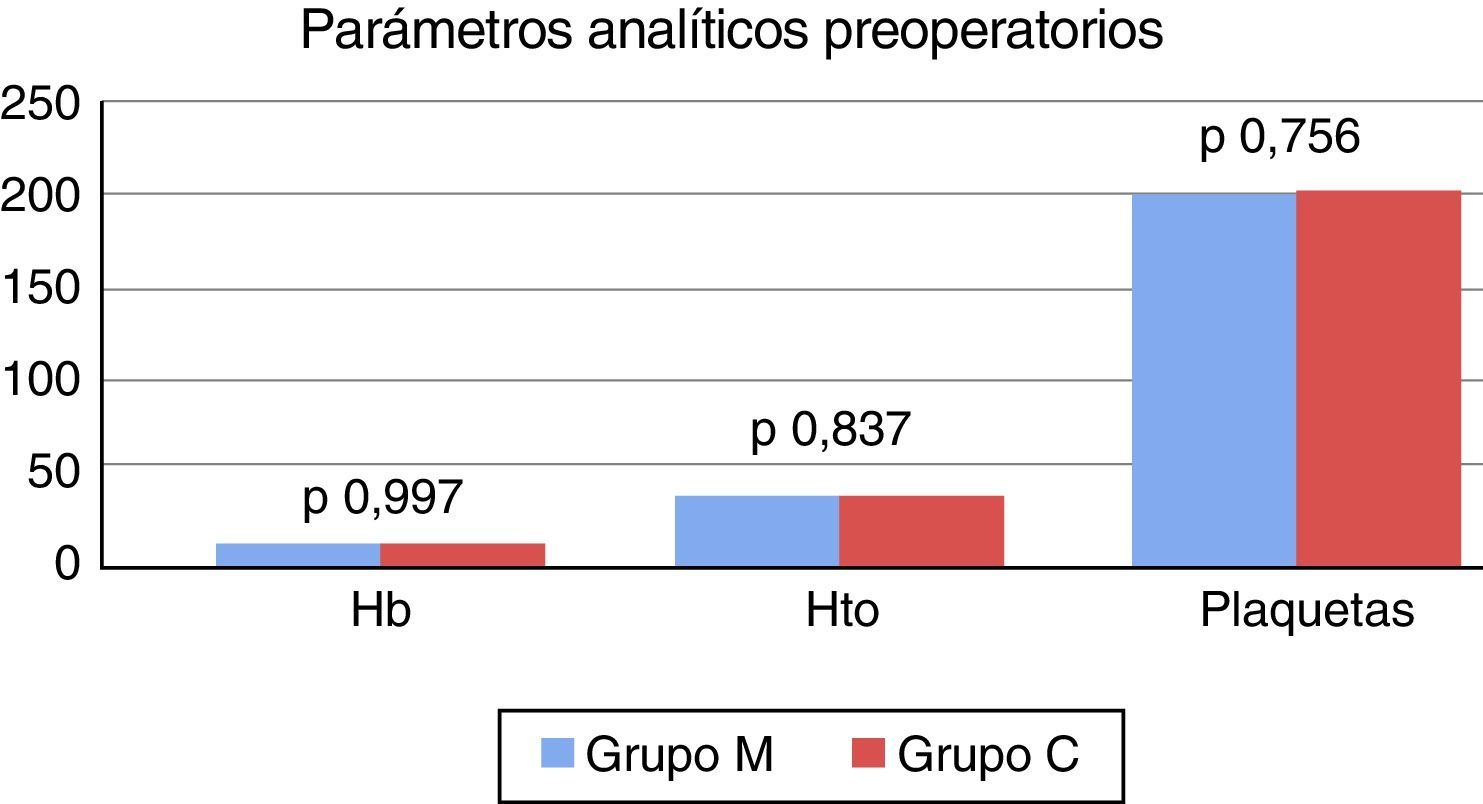
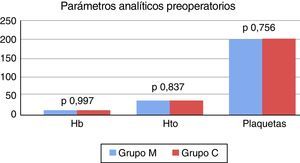
Luego del emparejamiento mediante propensity score, la tendencia se mantuvo, no encontrándose diferencias significativas en las características demográficas, los estudios preoperatorios y la incidencia de factores de riesgo cardiovascular entre ambos grupos (tabla 2). Tampoco se registraron diferencias significativas en los valores de hemoglobina: 13,27±1,60 vs. 13,27±1,75 (p = 0,997); hematocrito: 39,49±4,61 vs. 39,36±4,93 (p = 0,837) y recuento de plaquetas 204.000±77.000 vs. 206.000±58.000 (p = 0,756) entre el grupo M y C, respectivamente (fig. 1).
Características preoperatorias tras emparejamiento
| Grupo C | Grupo M | p | |
|---|---|---|---|
| n | 120 | 120 | |
| Edad (años) (media ± DE) | 70,85±8,50 | 69,47±9,98 | 0,251 |
| Sexo (masc.) (%) | 55% | 56,7% | 0,795 |
| EuroScore (media ± DE) | 6,43±4,41 | 6,05±4,36 | 0,496 |
| Hemoglobina (media ± DE) | 13,27±1,75 | 13,27±1,60 | 0,997 |
| Hematocrito (media ± DE) | 39,36±4,93 | 39,49±4,61 | 0,837 |
| Plaquetas (media ± DE) | 206±58 | 204±77 | 0,756 |
| Tabaquismo (%) | 36,7% | 38,3% | 0,790 |
| Obesidad (%) | 22,5% | 16,7% | 0,255 |
| HTA (%) | 68,3% | 63,3% | 0,414 |
| Dislipidemia (%) | 47,5% | 50,8% | 0,606 |
| EPOC (%) | 16,7% | 15,8% | 0,861 |
| Diabetes mellitus (%) | 20% | 25,8% | 0,282 |
| IR (%) | 4,2% | 5,8% | 0,554 |
| Art. periférica (%) | 3,3% | 3,3% | 1 |
| HTP (%) | 0,8% | 3,3% | 0,175 |
| FEVI (eco) (media ± DE) | 54,81±7,59 | 54,13±8,22 | 0,508 |
| ACV (%) | 0% | 0,8% | 0,316 |
| Grado NYHA (%) | |||
| I | 0,8% | 1,6% | ns |
| II | 30,8% | 26,6% | |
| III | 60% | 63,3% | |
| IV | 8,3% | 8,3% | |
ACV: accidente cerebrovascular; DE: desviación estándar; EPOC: enfermedad pulmonar obstructiva crónica; FEVI: fracción de eyección del ventrículo izquierdo; HTA: hipertensión arterial; HTP: hipertensión pulmonar; IR: insuficiencia renal; NYHA: New York Heart Asociation; ns: no significativo.
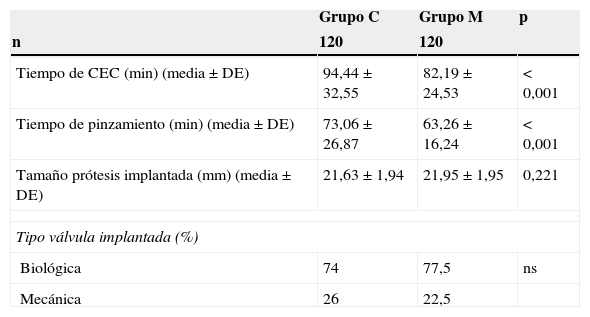
Entre los datos intraoperatorios (tabla 3), se debe destacar un tiempo de CEC y de pinzamiento aórtico significativamente menor en el grupo M, 82,19±24,53 vs. 94,44±32,55 (p < 0,001) y 63,26±16,24 vs. 73,06±26,87 (p < 0,001), respectivamente. No se encontraron diferencias significativas entre el tipo y el tamaño de válvulas implantadas entre ambos grupos.
Variables intraoperatorias
| Grupo C | Grupo M | p | |
|---|---|---|---|
| n | 120 | 120 | |
| Tiempo de CEC (min) (media ± DE) | 94,44±32,55 | 82,19±24,53 | < 0,001 |
| Tiempo de pinzamiento (min) (media ± DE) | 73,06±26,87 | 63,26±16,24 | < 0,001 |
| Tamaño prótesis implantada (mm) (media ± DE) | 21,63±1,94 | 21,95±1,95 | 0,221 |
| Tipo válvula implantada (%) | |||
| Biológica | 74 | 77,5 | ns |
| Mecánica | 26 | 22,5 | |
CEC: circulación extracorpórea; DE: desviación estándar; ns: no significativo.
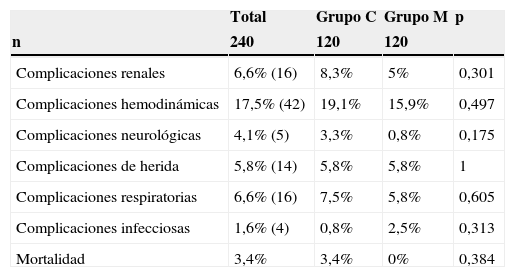
El grupo M presentó menor mortalidad intrahospitalaria pero sin alcanzar significación estadística, 0% vs. 2,5% (p = 0,081). La incidencia de complicaciones hemodinámicas, respiratorias, infecciosas, renales, de herida y neurológicas fueron similares entre ambos grupos (tabla 4).
Complicaciones postoperatorias y mortalidad
| Total | Grupo C | Grupo M | p | |
|---|---|---|---|---|
| n | 240 | 120 | 120 | |
| Complicaciones renales | 6,6% (16) | 8,3% | 5% | 0,301 |
| Complicaciones hemodinámicas | 17,5% (42) | 19,1% | 15,9% | 0,497 |
| Complicaciones neurológicas | 4,1% (5) | 3,3% | 0,8% | 0,175 |
| Complicaciones de herida | 5,8% (14) | 5,8% | 5,8% | 1 |
| Complicaciones respiratorias | 6,6% (16) | 7,5% | 5,8% | 0,605 |
| Complicaciones infecciosas | 1,6% (4) | 0,8% | 2,5% | 0,313 |
| Mortalidad | 3,4% | 3,4% | 0% | 0,384 |
Los datos entre paréntesis corresponden al número de pacientes afectos por las complicaciones.
Mayor incidencia de reintervenciones por sangrado en el grupo C, 5% vs. 1,7%.
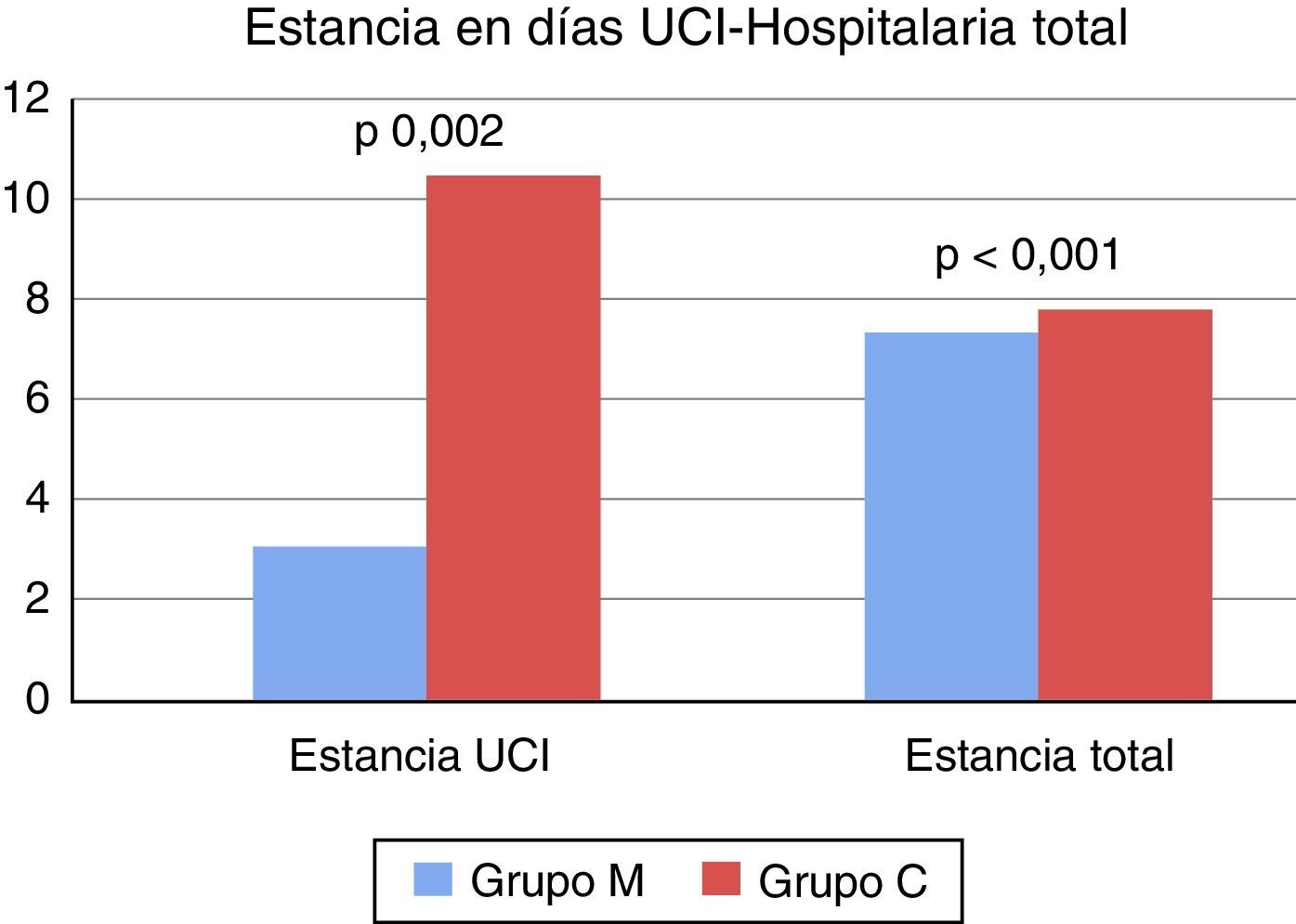
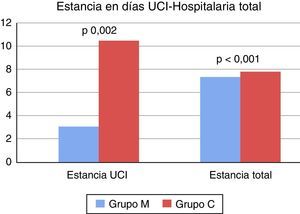
El grupo M presentó una estancia menor tanto en la UCI como hospitalaria total, 3,09±1,69 vs. 4,61±6,92 (p = 0,002) y 7,35±3,21 vs. 10,51±7,82 (p < 0,001) (fig. 2).
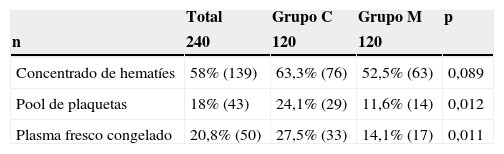
Necesidades transfusionalesEl grupo M recibió globalmente menos transfusiones de todos los hemoderivados (tabla 5), solo alcanzando la significación estadística para UP; 11,6% vs. 24,1% (p = 0,012) y PFC 14,5% vs. 27,5% (p = 0,011), respectivamente. Para CH, la diferencia no fue significativa, 52,5% vs. 63,3% (p = 0,089).
Porcentaje de pacientes que recibieron transfusiones de hemoderivados
| Total | Grupo C | Grupo M | p | |
|---|---|---|---|---|
| n | 240 | 120 | 120 | |
| Concentrado de hematíes | 58% (139) | 63,3% (76) | 52,5% (63) | 0,089 |
| Pool de plaquetas | 18% (43) | 24,1% (29) | 11,6% (14) | 0,012 |
| Plasma fresco congelado | 20,8% (50) | 27,5% (33) | 14,1% (17) | 0,011 |
Los datos entre paréntesis corresponden a la cantidad de pacientes transfundidos.
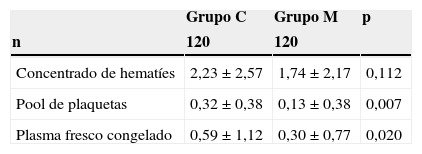
En cuanto a la cantidad de hemoderivados transfundidos, la tendencia se mantuvo (tabla 6) con 1,74±2,17 CH transfundidos en el grupo M vs. 2,23±2,57 en el grupo C (p = 0,112), así como 0,13 ±0,38 vs. 0,32±0,38 (p = 0,007) para UP y 0,30±0,77 vs. 0,59±1,12 (p = 0,002) para PFC.
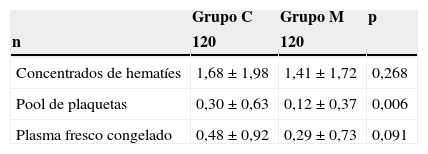
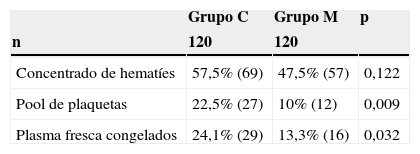
Teniendo en cuenta solo el día de la intervención, también fue menor el porcentaje de pacientes transfundidos en el grupo M, 43,5% vs. 57,5% (p = 0,122) para CH, 10% vs. 22,5% (p = 0,009) para UP y 13,3% vs. 24,1% (p = 0,032) para PFC, respectivamente. También la cantidad de hemoderivados transfundidos en las primeras 24 h fue menor en el grupo M: 1,41±1,72 vs. 1,68±1,98 (p = 0,268) para CH, 0,12±0,37 vs. 0,30±0,63 (p = 0,006) para UP y 0,29±0,73 vs. 0,48±0,92 (p = 0,091) para PFC (tablas 7 y 8).
Porcentaje de pacientes transfundidos en las primeras 24 h
| Grupo C | Grupo M | p | |
|---|---|---|---|
| n | 120 | 120 | |
| Concentrado de hematíes | 57,5% (69) | 47,5% (57) | 0,122 |
| Pool de plaquetas | 22,5% (27) | 10% (12) | 0,009 |
| Plasma fresca congelados | 24,1% (29) | 13,3% (16) | 0,032 |
Los datos entre paréntesis corresponden a la cantidad de pacientes transfundidos.
El análisis univariante nos muestra que tanto el aumento del tiempo de CEC como el de pinzamiento aórtico son factores de riesgo aumentando la necesidad de transfusión de unidades de plaquetas: β 0,012, OR 1,012 (1,002-1,023), p = 0,013, y β 0,014, OR 1,014 (1,001-1.027), p = 0,038, respectivamente, y de plasma fresco congelado β 0,017, OR 1,017 (1,007-1,027), p = 0,001, y β 0,019, OR 1,020 (1,006-1,033), p = 0,004, respectivamente. El abordaje mínimamente invasivo se presenta como factor protector ante la necesidad transfusional de unidades de plaquetas: β –0,881, OR 0,414 (0,206-0,832), p = 0,013, y de plasma fresco congelado: β –0,832, OR 0,435 (0,227-0,834), p = 0,012.
En el análisis de morbimortalidad la transfusión de plasma fresco congelado se presenta como factor predictor positivo de riesgo: β 1,431, OR 4,182 (1,287-13,588), p = 0,017.
En el multivariante el abordaje mínimamente invasivo se mantiene como factor protector ante la necesidad transfusional de unidades de plaquetas: β –0,765, OR 0,465 (0,228-0,952), p = 0,036, y plasma fresco congelado: β –0,066, OR 0,517 (0,263-1,015), p = 0,055, aunque perdiendo significación estadística para este último.
La transfusión de plasma fresco congelado persiste como factor de riesgo positivo: β 1,83, OR 6,276 (1,282-30,722), p = 0,023.
DiscusiónSi bien la anemia preoperatoria está asociada a mayor morbimortalidad postoperatoria20, los riesgos asociados a la transfusión de hemoderivados son bien conocidos21, desde la transmisión de enfermedades infecciosas, como hepatitis B y C, y virus de la inmunodeficiencia humana, hasta las reacciones no infecciosas, tanto agudas como de aparición retardada.
En cirugía cardíaca, las transfusiones se han asociado a un aumento de la morbimortalidad, bien asociada a reacciones adversas inherentes a la transfusión22, o bien a unos peores resultados posquirúrgicos y de supervivencia de los pacientes intervenidos.
Se han identificado predictores prequirúrgicos relacionados con la necesidad transfusional durante el intra y postoperatorio. Lako et al., en un estudio en pacientes sometidos a cirugía de revascularización coronaria, identificaron la edad, el número de injertos realizados, la combinación de procedimientos en la misma intervención, el hematocrito prequirúrgico y el uso de CEC como factores predictores positivos de necesidad transfusional tanto en el intra como postoperatorio23.
En nuestro estudio, si bien se trata de una población más homogénea, ya que no están incluidos los pacientes en los que se realizaron procedimientos concomitantes al recambio valvular aórtico, y todos fueron sometidos a CEC, identificamos como factores predictivos positivos de necesidades transfusionales de PP y PFC la cirugía convencional y el tiempo de CEC. Además, la transfusión de estos hemoderivados fue un factor predictivo de aumento de la morbimortalidad postoperatoria.
Diversos estudios relacionan las necesidades transfusionales con un aumento tanto de la morbimortalidad intrahospitalaria como con una disminución de la supervivencia a largo plazo en diferentes tipos de cirugía incluida la cardíaca24-28.
Complicaciones como fracaso renal, insuficiencia cardíaca, infecciones, accidentes cerebros vasculares y fibrilación auricular están fuertemente relacionados con la transfusión de CH peroperatorio29-31.
Riera et al. asocian la transfusión de 1 a 2 CH peroperatoriamente con un aumento de la morbimortalidad a 30 días, sin hallar repercusión en la mortalidad a largo plazo27.
Liu et al. no encontraron asociación entre la transfusión de CH y PFC y la aparición de complicaciones como la injuria aguda pulmonar, relacionándola más bien con la edad de los pacientes y el tiempo de CEC25.
Si bien en el estudio AUITY32 reportan un aumento significativo de la mortalidad en pacientes sometidos a revascularización coronaria solo con la transfusión de 4 o más CH, otros autores reportan un aumento de la misma a partir de la transfusión de 1 CH30.
Alceu dos Santos et al. reportan un aumento de la mortalidad directamente proporcional al número de CH transfundidos, con una OR de 1,42 (p = 0,165), 1,94 (p = 0,005), 4,17, 4,22, 8,70 y 33.33 (p<0,001) para transfusiones de 1, 2, 3, 4, 5, 6 o más CH, respectivamente28.
Actualmente, existe tendencia a la aplicación de protocolos de terapia restrictiva de transfusiones con el fin de reducir las complicaciones asociadas a las mismas dentro de la cirugía cardíaca.
Diversos trabajos han demostrado excelentes resultados y una disminución importante de la morbimortalidad intra y postoperatoria con la aplicación de dichos protocolos33-35.
Desde un principio, los abordajes mínimamente invasivos fueron asociados a una disminución del sangrado intraoperatorio y, por esto, a una reducción de las necesidades transfusionales, al considerarse menos traumáticos ya que la disección de los tejidos es menor en relación con los abordajes convencionales.
Yaffee et al. asocian el abordaje mínimamente invasivo en cirugía valvular aórtica con una disminución significativa del riesgo de transfusión35.
En nuestra serie, encontramos resultados muy interesantes con respecto a las ventajas de la cirugía mínimamente invasiva para el recambio valvular aórtico en cuanto a la disminución de las necesidades transfusionales.
Los pacientes del grupo M requirieron proporcionalmente menor necesidad de transfusión de PP y PFC tanto en el intra como en el postoperatorio inmediato. Si bien para los CH la diferencia no fue significativa, el grupo M requirió proporcionalmente menor necesidad de transfusión, lo cual no es despreciable teniendo en cuenta la asociación entre la transfusión de 1 CH con el aumento de la morbimortalidad presentada por algunos autores28,30.
Otro dato a tener en cuenta es el resultado del análisis uni y multivariante, que sitúa el abordaje mínimamente invasivo como factor protector en cuanto a necesidades transfusionales, tanto de PP como de PFC, y asociando a estas necesidades con un aumento de la morbimortalidad peroperatoria.
LimitacionesSi bien se trata de un estudio retrospectivo realizado en un solo centro y los criterios de transfusión no están establecidos, ya que no contamos con un protocolo estricto a seguir, creemos que existe una clara tendencia a la disminución de las necesidades transfusionales con este tipo de abordaje.
ConclusiónConocidos y demostrados los riesgos y las complicaciones asociadas a las transfusiones de hemoderivados en cirugía cardíaca y la tendencia a la utilización de terapias restrictivas transfusionales, creemos que con el abordaje mínimamente invasivo existe una clara tendencia a la disminución de las necesidades transfusionales en pacientes sometidos a recambio valvular aórtico aislado. Se necesitarían posteriores estudios prospectivos aleatorizados para confirmar o desmentir esta impresión.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.