Analizar los resultados de la sustitución valvular aórtica (SVA) a través de esternotomía parcial superior (EPS).
MétodoEntre enero de 2011 y diciembre de 2016, 507 pacientes fueron sometidos a SVA simple, 306 mediante esternotomía convencional media (ECM) y 201 por EPS. Se usó el índice de propensión para comparar los resultados de ambas técnicas en 201 pares de pacientes.
ResultadosLa edad media fue de 70±11,5 años, el 60% eran varones y el 58% tenían estenosis aórtica. El EuroSCORE II mediano fue del 1,58% (0,99-2,46). La mediana del tiempo de isquemia y circulación extracorpórea para EPS y ECM fue de 82min (72-92) y 102min (90-114) vs. 66min (55-75) y 87min (75-101), respectivamente (p<0,05). Los pacientes con ECM presentaron mayor sangrado postoperatorio y requerimiento de transfusión de hemoderivados que los pacientes con EPS (p<0,05). No hubo diferencias significativas en la incidencia de eventos adversos cardiovasculares y cerebrovasculares mayores en el postoperatorio entre ambos grupos. La mortalidad hospitalaria fue del 3,7% (p>0,05). La supervivencia a los 5 años fue del 83%. Tras la intervención quirúrgica el 96% de los pacientes estaban en clase funcional NYHA I o II y tenían una media de índice de salud EQ-5D® de 0,81 independientemente del grupo.
ConclusiónLa SVA por EPS es una técnica segura con resultados a corto, mediano y largo plazo comparables a la ECM. Se asocia con menor sangrado y requerimientos de transfusión de hemoderivados en el postoperatorio; pero con un mayor tiempo de isquemia y de circulación extracorpórea.
To analyse the results of aortic valve replacement (AVR) through partial upper sternotomy (PUS).
MethodologyBetween January 2011 and December 2016, 507 patients underwent simple AVR: 306 through conventional median sternotomy (CMS) and 201 through PUS. The propensity score was used to compare the results of both techniques in 201 patient pairs.
ResultsThe average age was 70±11.5 years. Sixty percent were men and 58% had aortic stenosis. The median EuroSCORE II was 1.58% (.99-2.46). The median time of ischaemia and extracorporeal circulation for PUS and CMS was 82 minutes (72-92) and 102 minutes (90-114), vs 66 minutes (55-75) and 87 minutes (75-101), respectively (P<.05). Patients with CMS presented with greater postoperative bleeding and need for blood product transfusion than patients with PUS (P<.05). There were no significant differences between the two groups in the incidence of major adverse cardiovascular and cerebrovascular events in the postoperative period. Hospital mortality rate was 3.7% (P>.05). Five-year survival rate was 83%. After surgery, 96% of the patients were in NYHA functional class I or II and had a mean EQ-5D® health index of .81, regardless of group.
ConclusionsAVR by PUS is a safe technique with short-, medium- and long-term results comparable to CMS. It is associated with less postoperative bleeding and need for blood product transfusion, but with a longer duration of ischaemia and extracorporeal circulation.
Desde los comienzos de la cirugía cardíaca, la esternotomía convencional media (ECM) ha sido la vía de abordaje más utilizada para la cirugía de sustitución valvular aórtica (SVA)1. El acceso mínimamente invasivo por medio de la esternotomía parcial superior (EPS)2, ha supuesto un cambio de paradigma en la estrategia quirúrgica de la SVA. Al principio, los cirujanos desestimaron este nuevo procedimiento, por considerarlo poco seguro respecto a la clásica ECM. La razón principal de esta refutación se basaba en considerarla poco segura debido a la reducida exposición quirúrgica en comparación con el abordaje estándar. Sin embargo, su posterior desarrollo, la innovación conseguida, el empleo de instrumental quirúrgico más apropiado, la experiencia acumulada y los programas de formación ofrecidos a las nuevas generaciones de cirujanos, han conseguido que esta nueva estrategia haya sido aceptada3,4. Este estudio clínico compara la cirugía de SVA mediante EPS frente a la ECM, valorando la seguridad y la efectividad del abordaje mínimamente invasivo.
MétodoSe trata de un estudio de cohortes retrospectivo, longitudinal, observacional, analítico y unicéntrico. La asociación univariante se analizó con el test de independencia de la Chi-cuadrado para las variables dicotómicas y el test de Mann-Whitney para las variables continuas. En las asociaciones de variables múltiples se aplicó el índice de propensión (IP), utilizado una regresión logística multivariable. Se ha utilizado el método de emparejamiento del vecino más cercano sin reemplazamiento para estimar el efecto del tratamiento sobre el evento. Se fijó un calibre máximo del 25% de la desviación típica del IP para emparejar a 2 individuos. Se verificaron las diferencias estandarizadas en los grupos de comparación, especificando que estas no fueran mayores en un 10% o máximo de un 25%. Se estimó el efecto medio del tratamiento en los tratados5. No se aplicó el IP cuando el número de eventos era muy reducido, en estos casos se hizo una regresión lineal para las variables continuas y una regresión logística para las variables dicotómicas. Se consideró un nivel de significación estadística correspondiente al error α=0,05 (p-valor). Se aplicó el análisis de Kaplan-Meier para el estudio de mortalidad y supervivencia. El tiempo medio de seguimiento fue de 3,96±2 años, la fecha de cierre fue en marzo de 2018 y se registraron 40 pérdidas. Tras el alta hospitalaria, se evaluó la clase funcional de insuficiencia cardíaca según (NYHA), y la calidad de vida relacionada con la salud aplicando el cuestionario EQ-5D-3L®6. La información se procesó mediante el paquete de software estadístico Stata® (StataCorp.2013b).
Se obtuvo la aprobación del estudio por parte del Comité Ético de Investigación del centro hospitalario donde se recolectó la información. El estudio se ha realizado según los principios y normas éticas de la Declaración de Helsinki (junio 1964), promulgada por la Asociación Médica Mundial en cuanto a los derechos de los pacientes y a la protección de sus datos.
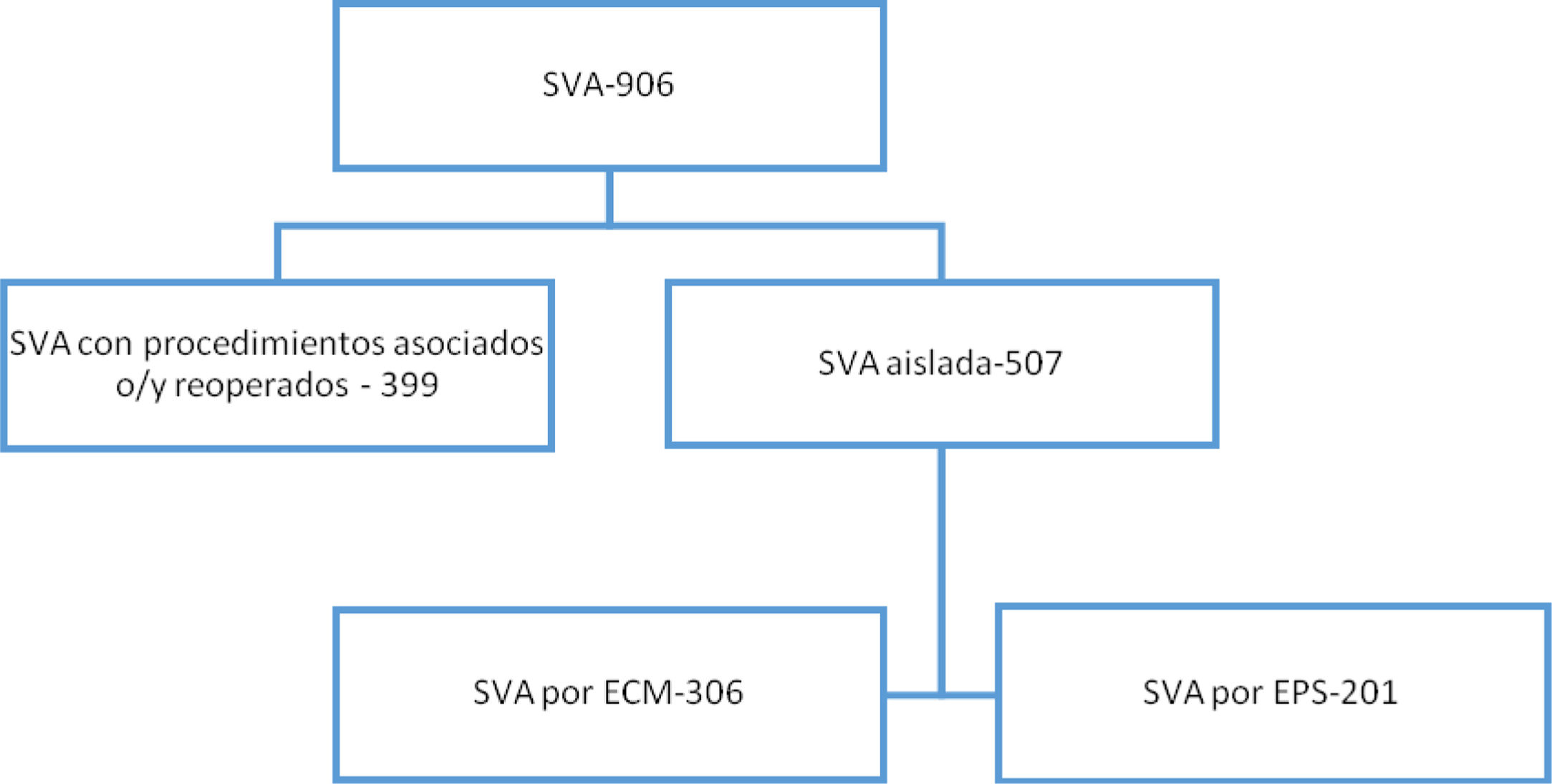
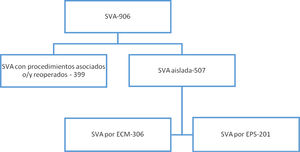
ResultadosDesde el 1 de enero de 2011 y hasta el 31 de diciembre de 2016 se realizaron en nuestro centro 906 procedimientos quirúrgicos de sustitución de la válvula aórtica, 399 casos fueron excluidos por tratarse de intervenciones con procedimientos asociados o en pacientes reintervenidos.
La población estudiada fue de 507 pacientes a los que se les realizó una SVA aislada, de los cuales, 201 se abordaron con técnica mínimamente invasiva a través de una EPS y 306 mediante ECM (fig. 1).
Se realizó la SVA por EPS en forma de «J» o «L» con ampliación sobre el tercer o el cuarto espacio intercostal derechos, y con una incisión cutánea de aproximadamente 7cm de longitud. Se optó por canulación central pura a nivel de la aorta ascendente y la orejuela derecha o la cava superior, teniendo en cuenta la exposición del campo quirúrgico. En la mayoría de los casos fue necesario drenar las cavidades izquierdas a través de la vena pulmonar superior derecha, la cardioplejía se administró por vía anterógrada por la aorta ascendente o a través de ostium coronarios, y en ningún caso se utilizó la vía retrógrada. Se utilizó la ecocardiografía transesofágica como guía para evaluar la funcionalidad del implante, la extracción del aire de las cavidades cardiacas y la monitorización de la desconexión de la circulación extracorpórea.
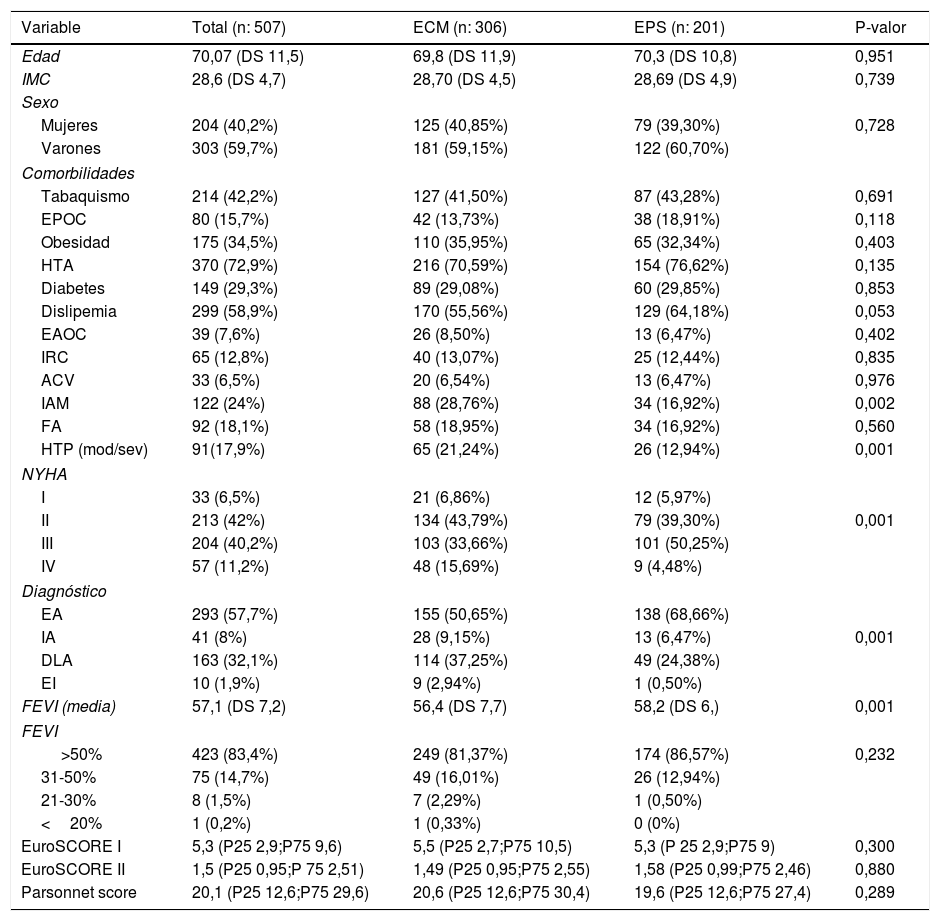
Hemos analizado las características demográficas, las comorbilidades, los parámetros clínicos y la estratificación del riesgo quirúrgico de los pacientes como variables preoperatorias (tablas 1 y 2). No hubo diferencias en cuanto a la distribución por edad o sexo de los pacientes intervenidos de SVA por EPS o ECM. Tampoco se observaron diferencias en la valoración del riesgo quirúrgico con las escalas de EuroSCORE I y II o el Parsonnet score. Las comorbilidades de los pacientes estudiados se repartieron de manera semejante en ambos grupos con la excepción del infarto agudo de miocardio (IAM) y la hipertensión pulmonar clasificada como moderada o severa que se observaron en mayor proporción en los pacientes que recibieron ECM. Los pacientes sometidos a EPS fueron diagnosticados en su mayor proporción de estenosis aórtica que de doble lesión o insuficiencia, en comparación con los pacientes llevados a ECM. La media aritmética de la FEVI fue ligeramente mayor en el grupo de EPS, y finalmente, la clase funcional de insuficiencia cardíaca según la NYHA se distribuyó de forma heterogénea entre ambos grupos.
Distribución de las variables preoperatorias en el total de la población y en los grupos estudiados (ECM y EPS)
| Variable | Total (n: 507) | ECM (n: 306) | EPS (n: 201) | P-valor |
|---|---|---|---|---|
| Edad | 70,07 (DS 11,5) | 69,8 (DS 11,9) | 70,3 (DS 10,8) | 0,951 |
| IMC | 28,6 (DS 4,7) | 28,70 (DS 4,5) | 28,69 (DS 4,9) | 0,739 |
| Sexo | ||||
| Mujeres | 204 (40,2%) | 125 (40,85%) | 79 (39,30%) | 0,728 |
| Varones | 303 (59,7%) | 181 (59,15%) | 122 (60,70%) | |
| Comorbilidades | ||||
| Tabaquismo | 214 (42,2%) | 127 (41,50%) | 87 (43,28%) | 0,691 |
| EPOC | 80 (15,7%) | 42 (13,73%) | 38 (18,91%) | 0,118 |
| Obesidad | 175 (34,5%) | 110 (35,95%) | 65 (32,34%) | 0,403 |
| HTA | 370 (72,9%) | 216 (70,59%) | 154 (76,62%) | 0,135 |
| Diabetes | 149 (29,3%) | 89 (29,08%) | 60 (29,85%) | 0,853 |
| Dislipemia | 299 (58,9%) | 170 (55,56%) | 129 (64,18%) | 0,053 |
| EAOC | 39 (7,6%) | 26 (8,50%) | 13 (6,47%) | 0,402 |
| IRC | 65 (12,8%) | 40 (13,07%) | 25 (12,44%) | 0,835 |
| ACV | 33 (6,5%) | 20 (6,54%) | 13 (6,47%) | 0,976 |
| IAM | 122 (24%) | 88 (28,76%) | 34 (16,92%) | 0,002 |
| FA | 92 (18,1%) | 58 (18,95%) | 34 (16,92%) | 0,560 |
| HTP (mod/sev) | 91(17,9%) | 65 (21,24%) | 26 (12,94%) | 0,001 |
| NYHA | ||||
| I | 33 (6,5%) | 21 (6,86%) | 12 (5,97%) | |
| II | 213 (42%) | 134 (43,79%) | 79 (39,30%) | 0,001 |
| III | 204 (40,2%) | 103 (33,66%) | 101 (50,25%) | |
| IV | 57 (11,2%) | 48 (15,69%) | 9 (4,48%) | |
| Diagnóstico | ||||
| EA | 293 (57,7%) | 155 (50,65%) | 138 (68,66%) | |
| IA | 41 (8%) | 28 (9,15%) | 13 (6,47%) | 0,001 |
| DLA | 163 (32,1%) | 114 (37,25%) | 49 (24,38%) | |
| EI | 10 (1,9%) | 9 (2,94%) | 1 (0,50%) | |
| FEVI (media) | 57,1 (DS 7,2) | 56,4 (DS 7,7) | 58,2 (DS 6,) | 0,001 |
| FEVI | ||||
| >50% | 423 (83,4%) | 249 (81,37%) | 174 (86,57%) | 0,232 |
| 31-50% | 75 (14,7%) | 49 (16,01%) | 26 (12,94%) | |
| 21-30% | 8 (1,5%) | 7 (2,29%) | 1 (0,50%) | |
| <20% | 1 (0,2%) | 1 (0,33%) | 0 (0%) | |
| EuroSCORE I | 5,3 (P25 2,9;P75 9,6) | 5,5 (P25 2,7;P75 10,5) | 5,3 (P 25 2,9;P75 9) | 0,300 |
| EuroSCORE II | 1,5 (P25 0,95;P 75 2,51) | 1,49 (P25 0,95;P75 2,55) | 1,58 (P25 0,99;P75 2,46) | 0,880 |
| Parsonnet score | 20,1 (P25 12,6;P75 29,6) | 20,6 (P25 12,6;P75 30,4) | 19,6 (P25 12,6;P75 27,4) | 0,289 |
ACV: accidente cerebro vascular; DLA: doble lesión aórtica; DS: desviación estándar; EAOC: enfermedad arterial oclusiva crónica; EA: estenosis aórtica; ECM: esternotomía convencional media; EI: endocarditis infecciosa; EPOC: enfermedad pulmonar obstructiva crónica; EPS: esternotomía parcial superior; FA: fibrilación auricular; FEVI: fracción de eyección del ventrículo izquierdo; HTA: hipertensión arterial; IA::insuficiencia aórtica; IAM: infarto agudo de miocardio; IMC: índice de masa corporal; IRC: insuficiencia renal crónica; NYHA: New York Heart Association..
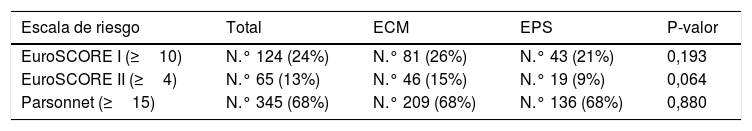
Estratificación del riesgo quirúrgico en el total de la población y en los grupos estudiados (ECM y EPS)
| Escala de riesgo | Total | ECM | EPS | P-valor |
|---|---|---|---|---|
| EuroSCORE I (≥10) | N.° 124 (24%) | N.° 81 (26%) | N.° 43 (21%) | 0,193 |
| EuroSCORE II (≥4) | N.° 65 (13%) | N.° 46 (15%) | N.° 19 (9%) | 0,064 |
| Parsonnet (≥15) | N.° 345 (68%) | N.° 209 (68%) | N.° 136 (68%) | 0,880 |
ECM: esternotomía convencional media; EPS: esternotomía parcial superior.
En 3 de los pacientes que se abordaron por EPS se requirió la conversión a ECM por problemas técnicos en la realización de la SVA (1,5%). En el primer caso la causa fue el hallazgo intraoperatorio de válvula y raíz aórtica extremadamente calcificadas; en el segundo, por desgarro del techo de la aurícula izquierda secundario a calcificación de la aorta con sangrado incontrolable; y finalmente, en el último por desgarro con sangrado activo de la unión aorto-ventricular tras abortar un implante de una prótesis sin sutura.
No hubo diferencias entre los grupos de EPS y ECM, en cuanto a la distribución de la prioridad quirúrgica (89% de las intervenciones fueron electivas, 9% urgentes y 2% emergentes), el tipo de prótesis implantada (60% biológicas), y el uso de BCIA (2%).
Adicionalmente, un 8% pacientes de la población recibió un modelo de prótesis sin sutura con una distribución homogénea en los 2 grupos de estudio, sin que esto influyeran de forma significativa en los tiempos de isquemia o de circulación extracorpórea a favor del grupo de EPS.
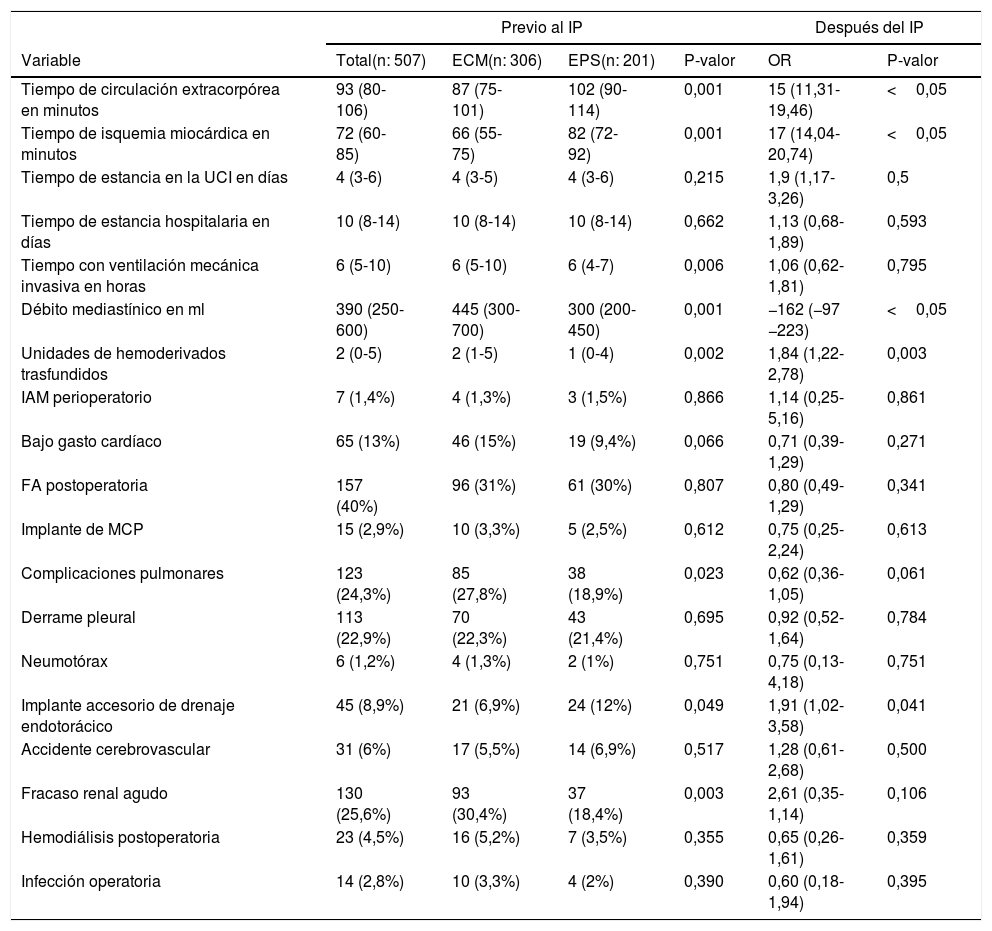
Para el análisis multivariante de las variables, se equipararon las características basales más relevantes de los pacientes para cada uno de los resultados. Se incluyeron como complicaciones pulmonares: la ventilación mecánica mayor a 7 días, reintubación/traqueostomía, ventilación mecánica no invasiva e infección pulmonar. Hubo diferencias significativas en los tiempos de isquemia miocárdica, de circulación extracorpórea y estancia en la UCI a favor del grupo de ECM, al igual que en el tiempo de implante de los drenajes torácicos. Se observó en las primeras 24h de la cirugía un menor debito por los tubos de drenaje mediastínicos, y un menor requerimiento de hemoderivados en el grupo de EPS (tabla 3).
Variables analíticas intraoperatorias y postoperatorias antes y después de aplicar el índice de propensión
| Previo al IP | Después del IP | |||||
|---|---|---|---|---|---|---|
| Variable | Total(n: 507) | ECM(n: 306) | EPS(n: 201) | P-valor | OR | P-valor |
| Tiempo de circulación extracorpórea en minutos | 93 (80-106) | 87 (75-101) | 102 (90-114) | 0,001 | 15 (11,31-19,46) | <0,05 |
| Tiempo de isquemia miocárdica en minutos | 72 (60-85) | 66 (55-75) | 82 (72-92) | 0,001 | 17 (14,04-20,74) | <0,05 |
| Tiempo de estancia en la UCI en días | 4 (3-6) | 4 (3-5) | 4 (3-6) | 0,215 | 1,9 (1,17-3,26) | 0,5 |
| Tiempo de estancia hospitalaria en días | 10 (8-14) | 10 (8-14) | 10 (8-14) | 0,662 | 1,13 (0,68-1,89) | 0,593 |
| Tiempo con ventilación mecánica invasiva en horas | 6 (5-10) | 6 (5-10) | 6 (4-7) | 0,006 | 1,06 (0,62-1,81) | 0,795 |
| Débito mediastínico en ml | 390 (250-600) | 445 (300-700) | 300 (200-450) | 0,001 | −162 (−97 −223) | <0,05 |
| Unidades de hemoderivados trasfundidos | 2 (0-5) | 2 (1-5) | 1 (0-4) | 0,002 | 1,84 (1,22-2,78) | 0,003 |
| IAM perioperatorio | 7 (1,4%) | 4 (1,3%) | 3 (1,5%) | 0,866 | 1,14 (0,25-5,16) | 0,861 |
| Bajo gasto cardíaco | 65 (13%) | 46 (15%) | 19 (9,4%) | 0,066 | 0,71 (0,39-1,29) | 0,271 |
| FA postoperatoria | 157 (40%) | 96 (31%) | 61 (30%) | 0,807 | 0,80 (0,49-1,29) | 0,341 |
| Implante de MCP | 15 (2,9%) | 10 (3,3%) | 5 (2,5%) | 0,612 | 0,75 (0,25-2,24) | 0,613 |
| Complicaciones pulmonares | 123 (24,3%) | 85 (27,8%) | 38 (18,9%) | 0,023 | 0,62 (0,36-1,05) | 0,061 |
| Derrame pleural | 113 (22,9%) | 70 (22,3%) | 43 (21,4%) | 0,695 | 0,92 (0,52-1,64) | 0,784 |
| Neumotórax | 6 (1,2%) | 4 (1,3%) | 2 (1%) | 0,751 | 0,75 (0,13-4,18) | 0,751 |
| Implante accesorio de drenaje endotorácico | 45 (8,9%) | 21 (6,9%) | 24 (12%) | 0,049 | 1,91 (1,02-3,58) | 0,041 |
| Accidente cerebrovascular | 31 (6%) | 17 (5,5%) | 14 (6,9%) | 0,517 | 1,28 (0,61-2,68) | 0,500 |
| Fracaso renal agudo | 130 (25,6%) | 93 (30,4%) | 37 (18,4%) | 0,003 | 2,61 (0,35-1,14) | 0,106 |
| Hemodiálisis postoperatoria | 23 (4,5%) | 16 (5,2%) | 7 (3,5%) | 0,355 | 0,65 (0,26-1,61) | 0,359 |
| Infección operatoria | 14 (2,8%) | 10 (3,3%) | 4 (2%) | 0,390 | 0,60 (0,18-1,94) | 0,395 |
ECM: esternotomía convencional media; EPS: esternotomía parcial superior; FA: fibrilación auricular; IAM: infarto agudo de miocardio; IP: Índice de propensión; MCP: marcapasos; OR: odds ratio; UCI: unidad de cuidados intensivos.
La reintervención por sangrado en el postoperatorio inmediato fue necesaria en 25 pacientes (5%); 16 (5,2%) pertenecientes al grupo de ECM y 9 (4,5%) al grupo de EPS, no existieron diferencias significativas entre ambos grupos (p=0,849).
La mortalidad hospitalaria fue de 19 pacientes (3,7%), sin que existiesen diferencias significativas entre los grupos de estudio (p=0,462); con una media de EuroSCORE I de 17,9, EuroSCORE II de 8,3 y Parsonnet de 34,1. Las causas de muerte fueron; shock séptico (49%), shock cardiogénico (23%), trombosis mesentérica (5,5%), insuficiencia respiratoria (5,5%), encefalopatía hipóxico isquémica (5,5%), arritmia cardíaca maligna (5,5%) y rotura del seudoaneurisma femoral (5,5%).
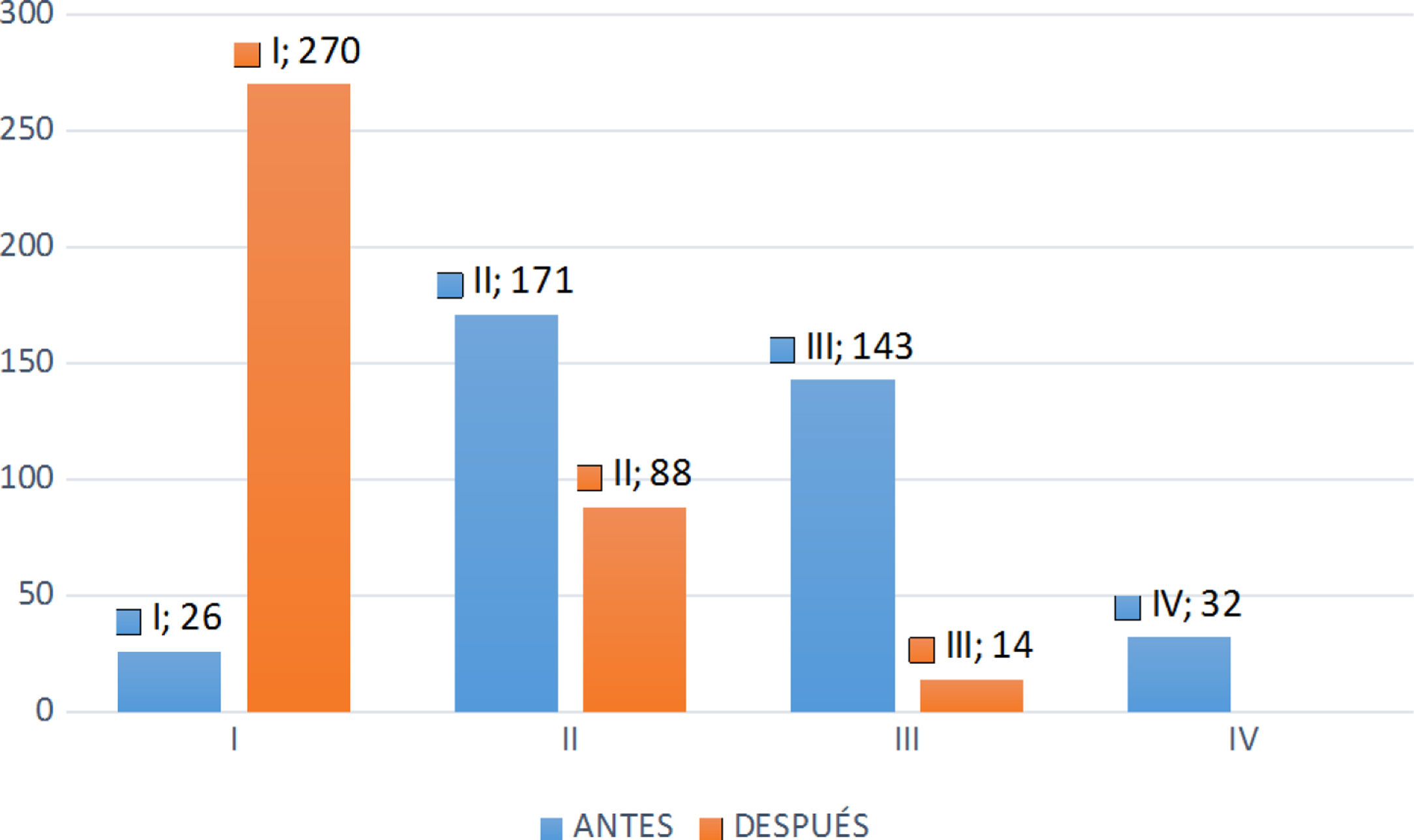
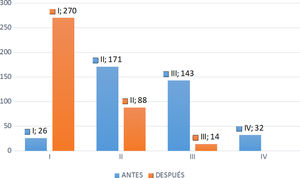
Tras el alta hospitalaria, y una vez incorporados los pacientes a sus tareas habituales, el grado funcional NYHA mejoró en el 82% de los casos, en el 16% se mantuvo igual y en el 2% empeoró (fig. 2). Hubo diferencias significativas en cuanto a la NYHA antes y después de la SVA con independencia del grupo de estudio (p=0,002).
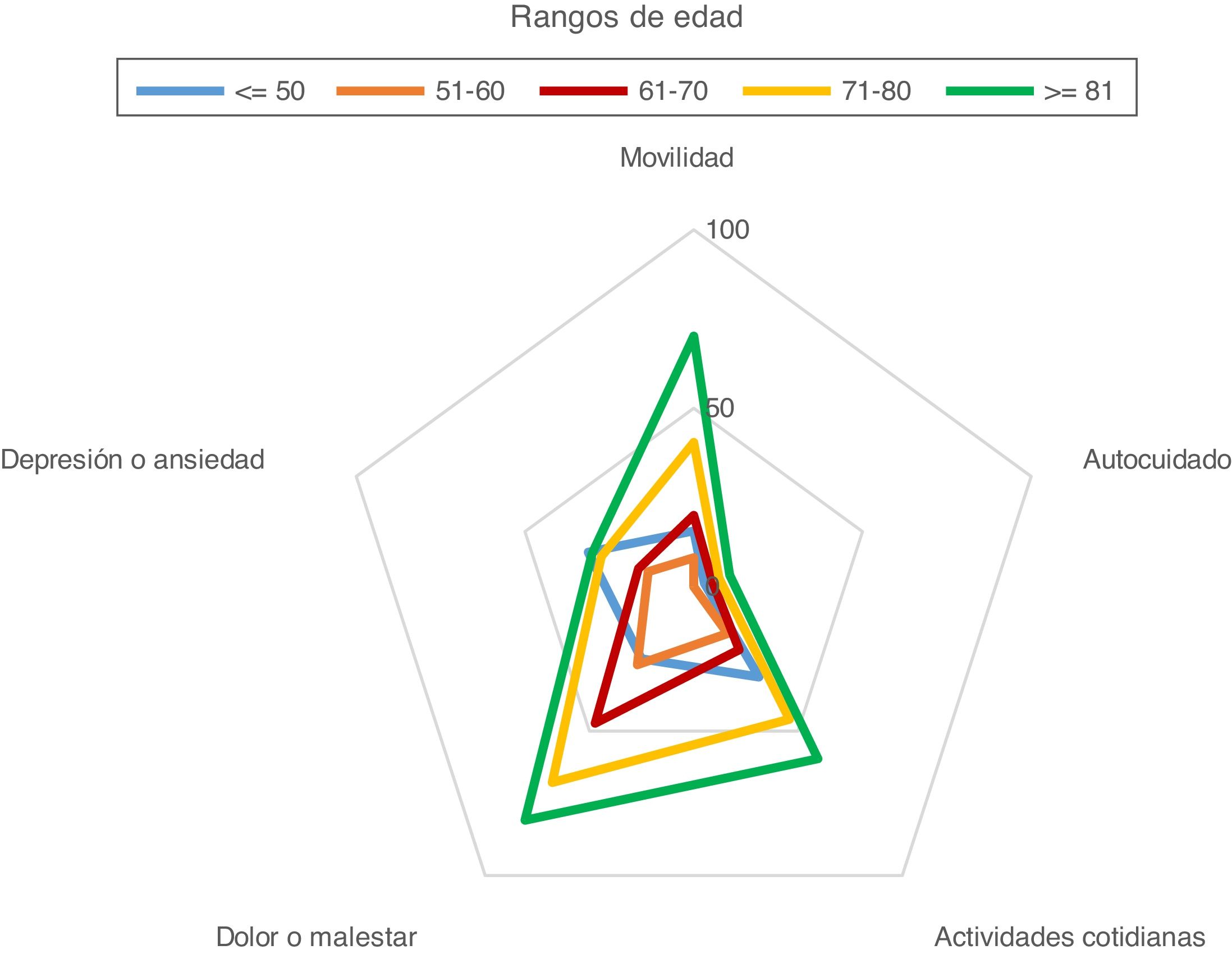
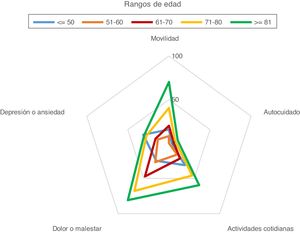
La calidad de vida relacionada con la salud se evaluó por grupos y en la totalidad de la muestra, mediante 5 dimensiones: movilidad, autocuidado, ejecución de las actividades cotidianas, dolor y depresión o ansiedad. No se observaron diferencias en cuanto al género o al tipo de abordaje quirúrgico. A mayor edad más problemas de salud (p=0.003), excepto en los jóvenes, donde las dimensiones de depresión o ansiedad, ejecución de las actividades cotidianas y movilidad no siguieron este patrón. Los pacientes menores de 50 años se quejaron más de problemas de depresión y ansiedad que los de mayor edad (p=0,049) (fig. 3).
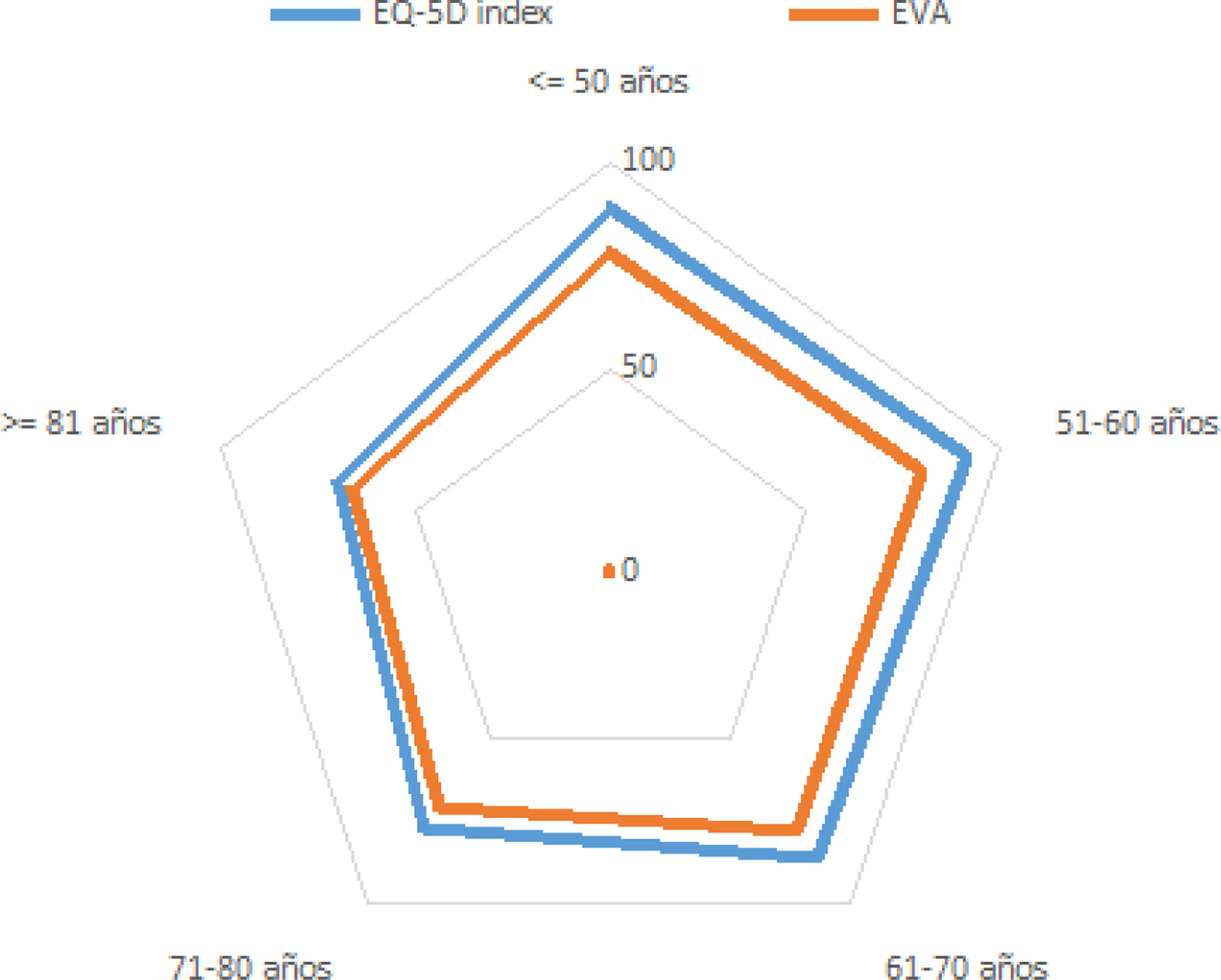
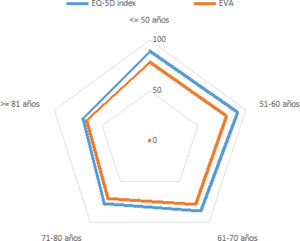
La puntuación media de los pacientes en la escala visual analógica (EVA) fue de 73,8±17,7 (0 es igual al peor estado de salud y 100 al mejor estado de salud). Al aplicar el complementario del índice EQ-5D® la media fue de 81,1±14. En ambos casos no hubo diferencias al comparar los 2 grupos de estudio; los varones puntuaron más que las mujeres (p=0,002), y los valores decrecieron sistemáticamente con la edad (p<0,05), exceptuando los pacientes jóvenes que puntuaron un poco más bajo que los pacientes de mediana edad, sin llegar a las puntuaciones tan bajas referidas por los pacientes ancianos. Se observó que la calificación de la autopercepción del estado de salud de los pacientes (EVA) fue más baja que la puntuación deducida por el índice de salud EQ-5D® (p<0,05) (fig. 4).
DiscusiónLa SVA mediante abordaje mínimamente invasivo no se limita a una incisión cutánea y esternal más reducida, el concepto supone un cambio en la filosofía y en la estrategia quirúrgica global a lo largo de todo el procedimiento, cuyo objetivo final es reducir el grado de «invasión» quirúrgica3. Cosgrove y Sabik7, realizaron la primera intervención de este tipo en 1996, a través de una incisión paraesternal derecha que implicaba sacrificar varios cartílagos costales y la arteria mamaria interna. A lo largo de los años siguientes, el interés por la cirugía cardíaca mínimamente invasiva fue creciendo progresivamente, y se fueron proponiendo diferentes técnicas y accesos para optimizar tanto la cirugía valvular como la coronaria8,9. Varios abordajes quirúrgicos para la SVA se han desarrollado: la miniesternotomía superior, inferior e inversa, y la esternotomía derecha10–14. Estos nuevos enfoques se han asociado con mejores resultados y menor morbilidad perioperatoria en comparación con la ECM15–20. Múltiples series observacionales retrospectivas han demostrado la seguridad del acceso mínimamente invasivo para el reemplazo de la válvula aórtica21.
En la actualidad la EPS en «J» o «L» invertida es la técnica más utilizada para la SVA por vía mínimamente invasiva. El enfoque paraesternal se ha asociado con un mayor riesgo de inestabilidad del tórax, atrofia muscular y hernia pulmonar, dando lugar a un resultado estético deficiente. Las opciones de canulación pueden ser: central y periférica, en el caso de la canulación femoral se ha asociado a complicaciones a nivel inguinal como, hematoma, seroma e infección22.
En ocasiones, es necesario la reconversión intraoperatoria de EPS a ECM, suele ser debida a una exposición quirúrgica inadecuada o a sangrado incontrolable, es una contingencia inherente al acceso mínimamente invasivo, se han reportado tasas de incidencia que oscilan entre el 2-4%21,23, la aportada en nuestra serie fue del 1,5%.
La exposición quirúrgica limitada y el espacio reducido en el que se practica la cirugía aórtica mediante la EPS, incrementa los tiempos de circulación extracorpórea y de isquemia miocárdica en comparación con la cirugía convencional21,23. En el estudio, se obtuvieron en promedio 15 y 17min más de circulación extracorpórea y de tiempo de isquemia, respectivamente, con el abordaje mínimamente invasivo, este tiempo de bypass cardio-pulmonar más largo puede deberse a la mayor demanda técnica de este procedimiento y al periodo de aprendizaje de la técnica22.
Se ha descrito una disminución del tiempo de ventilación mecánica en el postoperatorio de los pacientes intervenidos con EPS, sin embargo, la tasa de reintubación y de insuficiencia respiratoria ha sido similar a la de la cirugía estándar23. En la serie analizada no se encontraron diferencias significativas en el tiempo de ventilación mecánica, la tasa de complicaciones pulmonares, la presencia de derrame pleural o de neumotórax. Sí se observó que los pacientes del grupo de EPS tenían 1,9 veces más probabilidades de implante de drenajes endotorácicos accesorios que los pacientes con ECM, lo cual no se relacionó con la incidencia de derrame pleural o de neumotórax, y que puede explicarse por una conducta anticipatoria del grupo quirúrgico con el fin de prevenir complicaciones pulmonares mayores. Esto puede estar relacionado con dos hechos; el primero a que el calibre de los drenajes mediastínicos implantados al finalizar la intervención por EPS fueron de menor tamaño (28 French) que el de los pacientes con cirugía convencional (34 French), y el segundo a que observamos mayor búsqueda activa con estudios complementarios de complicaciones pleurales o mediastinales en el grupo de EPS al implementar esta técnica mínimamente invasiva.
Varios estudios han comunicado un menor sangrado postoperatorio y menor necesidad de transfusión con el acceso mínimamente invasivo23. Los datos de nuestra serie coinciden con estas observaciones, los pacientes con EPS sangraron 160ml menos que los pacientes con ECM en las primeras 24h de la cirugía. Se comprobó que los pacientes con ECM tienen 1,8 veces más probabilidades de recibir la trasfusión de hemoderivados en el postoperatorio inmediato que los pacientes con EPS (p<0,05).
Debido al menor traumatismo quirúrgico de la EPS, es razonable pensar que se produzca una menor incidencia de reintervenciones por sangrado5. Sin embargo la mayoría de las series describen tasas de reintervención por sangrado similares para ambos accesos, Soltesz y Chon aportan una incidencia de reintervenciones por sangrado del 2,6%24. La excepción fue del grupo de Merk et al. (4,2% en cirugía mínimamente invasiva y 1,5% en cirugía convencional), este hallazgo podría explicarse por la complejidad mayor del cierre esternal con la técnica de EPS debido a que en la mayoría de los casos las fuentes de sangrado se originaron en el esternón23,25. La tasa de reintervención por sangrado en el postoperatorio inmediato en nuestro estudio fue del 5%, similar para ambos grupos.
Existen contradicciones en cuanto al beneficio que ofrece el abordaje mínimamente invasivo en la reducción de la incidencia de fibrilación auricular postoperatoria, algunos grupos informan una tasa menor de está arritmia cardíaca con el acceso mínimamente invasivo, mientras que otros no encuentran asociación23. En nuestra serie, no se encontraron diferencias en relación con la incidencia de esta arritmia en los 2 grupos.
Se ha especulado sobre la dificultad de acceso quirúrgico a las cavidades izquierdas para favorecer la eliminación del aire al finalizar la SVA por EPS, esto podría generar un mayor riesgo de ACV postoperatorio, sin embargo, los estudios que han comparado ambos métodos, han mostrado una incidencia de ACV similar23, cuestión que también se comprobó en nuestro estudio.
No se han demostrado diferencias significativas en relación con el infarto de miocardio y la insuficiencia renal entre el acceso mínimamente invasivo y la esternotomía media para la SVA21. Tampoco ha encontrado asociación entre el tipo de abordaje para la SVA y el implante de marcapasos definitivo en el postoperatorio inmediato26. Los resultados del estudio analizado son congruentes con otros estudios.
Debido a que la EPS conlleva una menor incisión cutánea y una mayor estabilidad esternal, se podría esperar una reducción de las complicaciones infecciosas de la herida quirúrgica, sin embargo, existen estudios a favor y en contra de esta hipótesis23. Los resultados de la serie muestran tasas similares de infección de la herida quirúrgica en la EPS y la ECM.
La mayoría de los estudios comunican una reducción de uno a 2 días en la estancia media hospitalaria de los pacientes con cirugía mínimamente invasiva23, sin embargo, algunas series no han encontrado disminución de la estancia en la unidad de cuidados intensivos con los enfoques mínimamente invasivos para la SVA, otros mostraron una reducción en promedio de entre 6 y 24h23. En nuestro estudio se encontró que los paciente con EPS tenían 1,9 veces más probabilidades de permanecer ingresados en la UCI, más de 72h que los pacientes con ECM. Esto podría estar relacionado con un seguimiento más meticuloso de estos pacientes por parte del equipo de tratamiento durante la fase inicial de la implementación de esta mínimamente invasiva en nuestro centro. Por el contrario, no se encontraron diferencias en el tiempo de ingreso hospitalario total entre la EPS y la ECM en la serie analizada, siendo este en promedio de 10 días.
Diferentes estudios citan la mortalidad hospitalaria de la SVA aislada como un factor independiente de la técnica de abordaje quirúrgico utilizada21,23,27, y la sitúan entre el 3 y el 5%4,10,28. En España la mortalidad global observada para la SVA aislada referida al año 2018 fue del 3,98%, con una media del 7,45% para el EuroSCORE I, y del 6,41% para el EuroSCORE II28,29. En nuestra serie la mortalidad observada fue del 3,7%, un 7% menor de la media del Registro de Intervenciones de la Sociedad Española de Cirugía Torácica-Cardiovascular.
Con relación a la calidad de vida tras la cirugía, los datos encontrados en la literatura son contradictorios, unos reflejan una mejoría de estos parámetros con el acceso mínimamente invasivo, y otros no encuentran diferencias al compararlos con el abordaje convencional21,23. En la cohorte retrospectiva de la serie se evaluó la calidad de vida mediano plazo de los pacientes, encontrando que no había diferencias relacionadas con la vía de abordaje de la SVA. Utilizando la clase funcional de insuficiencia cardíaca según la NYHA, se observó que un 98% de los pacientes había mejorado o se mantenía igual con respecto a su estado preoperatorio.
Al analizar los problemas de salud de los pacientes por rangos de edad se comprobó que a mayor edad más problemas de salud. Los pacientes jóvenes se quejaban más de ansiedad y depresión que los pacientes ancianos. La puntuación total del estado de salud de los pacientes desde el punto de vista subjetivo (EVA) fue menor que la puntuación objetiva dada por la escala de evaluación (EQ-5D índex®). Las mujeres puntuaron menos que los varones. Finalmente, a mayor edad menos puntuación tanto subjetiva como objetiva de la calidad de vida relacionada con la salud.
ConclusionesEl abordaje quirúrgico mediante EPS para la sustitución aislada de la válvula aórtica proporciona ciertas ventajas: disminución del sagrado mediastínico y un menor requerimiento transfusional en las primeras 24h tras la intervención quirúrgica.
Como desventajas de la EPS en comparación con la ECM estarían: un mayor tiempo de CEC y de isquemia miocárdica determinado por la mayor complejidad del procedimiento y por la curva de aprendizaje; y una mayor probabilidad de necesidad de implante de nuevos drenajes torácicos en el postoperatorio inmediato, debido posiblemente al menor calibre de los tubos de drenaje.
La calidad de vida de los pacientes en términos de clasificación funcional de la insuficiencia cardíaca (NYHA) antes y después de la intervención quirúrgica mejoró en la mayoría de los casos, independientemente del tipo de abordaje quirúrgico que se realizara para la SVA. Se comprobó que a mayor edad más problemas de salud y menor puntuación tanto subjetiva como objetiva del estado de salud global de los pacientes.
La cirugía de SVA aislada por abordaje mínimamente invasivo es una intervención segura; con una morbilidad, mortalidad hospitalaria, y supervivencia a corto, mediano y largo plazo semejante al abordaje convencional.
FinanciaciónEl presente artículo ha sido financiado por los propios autores.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.