La oxigenación por membrana extracorpórea (extracorporeal membrane oxygenation, ECMO) es un sistema extracorpóreo de asistencia cardiorrespiratoria cuya utilización se ha visto incrementada en la última década. La insuficiencia respiratoria, el shock postcardiotomía y el fallo primario del injerto cardíaco o pulmonar son complicaciones que pueden requerir la utilización de asistencia mecánica cardiorrespiratoria y, en este escenario, el conocimiento de las peculiaridades perioperatorias médicas y quirúrgicas es fundamental.
A pesar de la evolución tecnológica en el área de la asistencia extracorpórea, la morbimortalidad de estos pacientes continúa siendo elevada, por lo tanto, la decisión del implante de la ECMO como la de su retirada debe establecerse dentro de un equipo multidisciplinar experto en el área.
El presente documento de consenso pretende unificar conocimientos y aportar recomendaciones basadas tanto en la bibliografía reciente como en la experiencia de los principales centros nacionales implantadores de ECMO con el objetivo final de mejorar la atención integral al paciente.
ECMO is an extracorporeal cardiorespiratory support system whose use has been increased in the last decade. Respiratory failure, postcardiotomy shock, and lung or heart primary graft failure may require the use of cardiorespiratory mechanical assistance. In this scenario perioperative medical and surgical management is crucial.
Despite the evolution of technology in the area of extracorporeal support, morbidity and mortality of these patients continues to be high, and therefore the indication as well as the ECMO removal should be established within a multidisciplinary team with expertise in the area.
This consensus document aims to unify medical knowledge and provides recommendations based on both the recent bibliography and the main national ECMO implantation centers experience with the goal of improving comprehensive patient care.
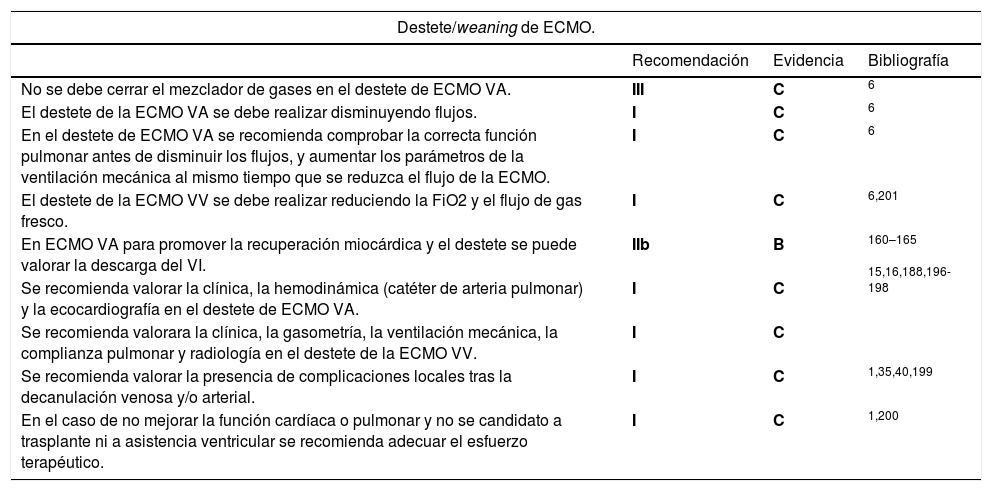
La ECMO (extracorporeal membrane oxygenator) es un dispositivo de asistencia circulatoria y respiratoria indicado en el shock cardiogénico y/o la insuficiencia respiratoria refractarios al tratamiento médico convencional. Se puede utilizar en espera a la recuperación cardíaca y/o pulmonar, la transferencia a un dispositivo de asistencia ventricular de medio/largo plazo, trasplante cardíaco o pulmonar o puente a la decisión. La mortalidad de los pacientes portadores de este dispositivo es elevada llegando a ser del 50-60% en determinados contextos y por lo tanto la selección del paciente, el tratamiento previo y la evaluación multidisciplinar son fundamentales1-5.
Desde la Sociedad Española de Anestesiología, Reanimación y Terapéutica del Dolor (SEDAR) y la Sociedad Española de Cirugía Cardiovascular y Endovascular (SECCE) se ha creado un Comité de Asistencia Circulatoria en el que participan anestesiólogos y cirujanos cardiovasculares de diferentes centros nacionales con amplia experiencia en el manejo de la ECMO en el contexto perioperatorio. Este Comité ha elaborado el presente documento de consenso cuyo objetivo es estandarizar y mejorar la atención del paciente portador de ECMO. El shock postcardiotomía, la donación de órganos, el fallo primario del injerto cardíaco y el perioperatorio del trasplante pulmonar son ámbitos especialmente relacionados con los campos de la anestesiología, los cuidados críticos perioperatorios y la cirugía, en los que el uso de la ECMO se ha visto incrementado. El manejo de la ECMO en este contexto implica conocer la fisiopatología tanto quirúrgica como médica, y la interacción entre la anestesiología y la cirugía es por lo tanto imprescindible.
2. Metodología de trabajoA través del convenio firmado entre la SEDAR y la SECCE se elaboraron comités de trabajo con diferentes representantes de anestesiología y cirugía cardiovascular. El objetivo del comité de ECMO fue elaborar un documento revisado por los componentes de dicho comité que ayudará a unificar la práctica clínica dada la amplia heterogeneidad en este ámbito. Dentro del comité se organizaron diferentes áreas de trabajo para elaborar los documentos que posteriormente fueron revisados entre todos los miembros del comité con el fin de establecer recomendaciones generales: indicaciones y contraindicaciones, canulación, consideraciones especiales: en shock postcardiotomía, en la donación de órganos, en la disfunción primaria del injerto (DPI) cardíaco, en el perioperatorio de trasplante pulmonar, cirugía no cardíaca, complicaciones y weaning o destete. Dada la situación actual de pandemia producida por el virus SARS-CoV-2 se incluyeron las recomendaciones generales en este contexto y en el manejo del síndrome de distrés respiratorio agudo. Así mismo se realizó una encuesta relativa a las recomendaciones y el nivel de evidencia de las mismas. Se estableció un nivel de recomendación cuando se llegó a un consenso de al menos el 75% de los componentes del comité. En los casos en los que en primera instancia no se llegó a un acuerdo, se discutió la indicación de forma individual hasta alcanzarlo. En el ámbito de la COVID-19 no se realizó encuesta ni se estableció un grado de recomendación dada la baja incidencia de necesidad de ECMO en esta patología en la mayoría de los centros, pero se establecieron recomendaciones generales con base en la práctica de los centros con más número de casos y las actuales publicaciones.
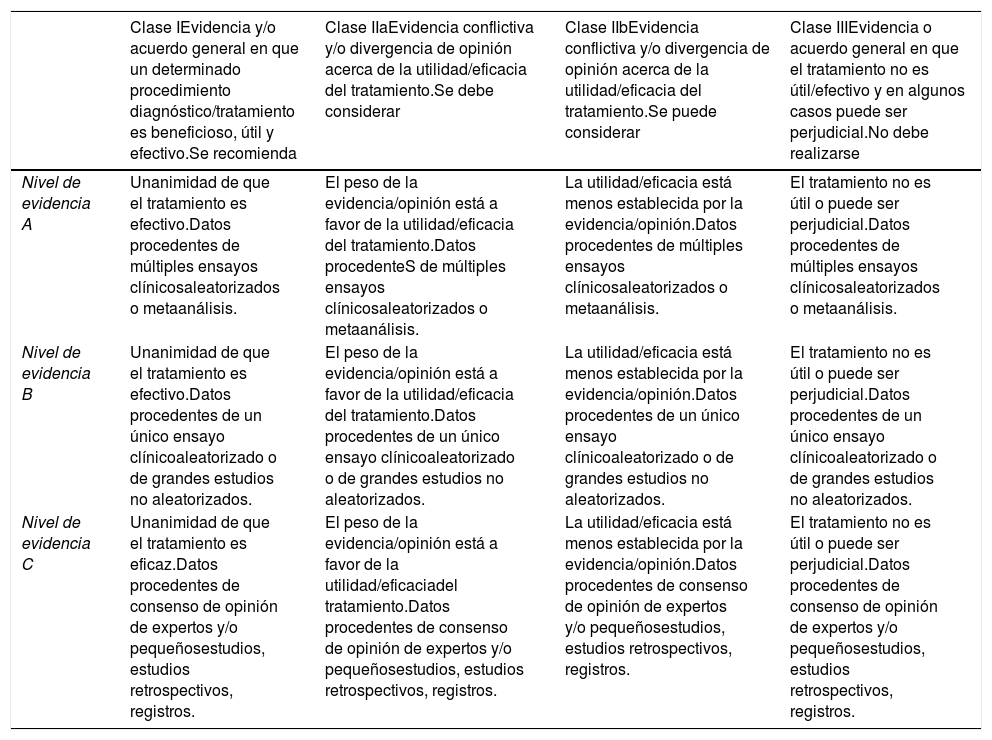
El sistema de recomendación se basó en el sistema GRADE (tabla 1). Una recomendación con nivel de evidencia B o C no implica que la recomendación sea débil. Algunos puntos de manejo abordados en el documento no son objeto de ensayos clínicos o estudios lo cual no quiere decir que el consenso del comité permita establecer un grado de recomendación i.
Sistema Grade
| Clase IEvidencia y/o acuerdo general en que un determinado procedimiento diagnóstico/tratamiento es beneficioso, útil y efectivo.Se recomienda | Clase IIaEvidencia conflictiva y/o divergencia de opinión acerca de la utilidad/eficacia del tratamiento.Se debe considerar | Clase IIbEvidencia conflictiva y/o divergencia de opinión acerca de la utilidad/eficacia del tratamiento.Se puede considerar | Clase IIIEvidencia o acuerdo general en que el tratamiento no es útil/efectivo y en algunos casos puede ser perjudicial.No debe realizarse | |
|---|---|---|---|---|
| Nivel de evidencia A | Unanimidad de que el tratamiento es efectivo.Datos procedentes de múltiples ensayos clínicosaleatorizados o metaanálisis. | El peso de la evidencia/opinión está a favor de la utilidad/eficacia del tratamiento.Datos procedenteS de múltiples ensayos clínicosaleatorizados o metaanálisis. | La utilidad/eficacia está menos establecida por la evidencia/opinión.Datos procedentes de múltiples ensayos clínicosaleatorizados o metaanálisis. | El tratamiento no es útil o puede ser perjudicial.Datos procedentes de múltiples ensayos clínicosaleatorizados o metaanálisis. |
| Nivel de evidencia B | Unanimidad de que el tratamiento es efectivo.Datos procedentes de un único ensayo clínicoaleatorizado o de grandes estudios no aleatorizados. | El peso de la evidencia/opinión está a favor de la utilidad/eficacia del tratamiento.Datos procedentes de un único ensayo clínicoaleatorizado o de grandes estudios no aleatorizados. | La utilidad/eficacia está menos establecida por la evidencia/opinión.Datos procedentes de un único ensayo clínicoaleatorizado o de grandes estudios no aleatorizados. | El tratamiento no es útil o puede ser perjudicial.Datos procedentes de un único ensayo clínicoaleatorizado o de grandes estudios no aleatorizados. |
| Nivel de evidencia C | Unanimidad de que el tratamiento es eficaz.Datos procedentes de consenso de opinión de expertos y/o pequeñosestudios, estudios retrospectivos, registros. | El peso de la evidencia/opinión está a favor de la utilidad/eficaciadel tratamiento.Datos procedentes de consenso de opinión de expertos y/o pequeñosestudios, estudios retrospectivos, registros. | La utilidad/eficacia está menos establecida por la evidencia/opinión.Datos procedentes de consenso de opinión de expertos y/o pequeñosestudios, estudios retrospectivos, registros. | El tratamiento no es útil o puede ser perjudicial.Datos procedentes de consenso de opinión de expertos y/o pequeñosestudios, estudios retrospectivos, registros. |
El circuito de la ECMO está compuesto de los siguientes elementos1,6,7:
- •
Cánulas y líneas: cánula y línea de drenaje o venosa (inflow) y cánula y línea de retorno o arterial (outflow). Tanto en ECMO veno-venoso (VV) como en ECMO veno-arterial (VA) hablamos de cánula arterial refiriéndonos a la cánula que proporciona la sangre arterializada (oxigenada). Las diferentes casas comerciales proporcionan estas cánulas revestidas de heparina o del componente molecular de la membrana celular (fosforilcolina), lo cual reduce los requerimientos de anticoagulación y las complicaciones hemorrágicas, y disminuye la reacción inflamatoria. La línea venosa no debe ser nunca manipulada y/o abierta al aire ambiental por el riesgo de entrada masiva de aire.
- •
Bomba: el tipo de bomba utilizada suele ser una bomba centrífuga de flujo continuo. Es importante que en el momento de regular el flujo de la ECMO tengamos en cuenta que lo que modificamos son las revoluciones por minuto (rpm) de esta centrífuga. Así, el flujo administrado será variable a determinadas revoluciones dependiendo de la precarga y de la poscarga del paciente. Manteniendo constantes las rpm, las bombas centrífugas generan un aumento de flujo cuando aumenta la precarga o disminuye la poscarga, y viceversa, lo cual impide el cálculo de flujo teniendo solo en cuenta las rpm; por tanto, se debe incorporar un medidor de flujo en la línea arterial.
- •
Membrana oxigenadora: los oxigenadores que se utilizan actualmente en la ECMO son de larga duración y están provistos de fibras de polimetilpenteno, impermeables al plasma. Estas fibras alargan la vida del oxigenador varias semanas, manteniendo un intercambio gaseoso de calidad.
- •
La consola es la encargada del control hemodinámico del sistema ECMO: 1) suministra fuerza electromotriz a la bomba sanguínea y regula su potencia, y 2) registra la información aportada por los sensores hemodinámicos, bioquímicos y de seguridad implantados en el circuito.
- •
Mezclador de oxígeno-aire: regula la proporción de oxígeno/aire y el flujo de esta mezcla de gases que entra en la fase gaseosa del oxigenador.
- •
Intercambiador de calor: permite enfriar o calentar el sistema.
Dada la alta complejidad de los pacientes candidatos a ECMO, la decisión del implante debe realizarse por parte de un equipo multidisciplinar integrado por diferentes especialistas (anestesiología, cirugía cardiovascular, cardiología, cirugía torácica, neumología, unidades de trasplante, cuidados críticos, enfermería). Se recomienda el manejo del dispositivo en centros de referencia con experiencia en su uso y con capacidad para resolver los problemas derivados del mismo8,9. Tanto en el territorio español como en otros países europeos se han creado equipos móviles de ECMO formados por diferentes especialistas (cirujanos cardiovasculares, especialistas en perfusión, anestesiólogos, especialistas en cuidados críticos, enfermería) cuyo objetivo es valorar a los candidatos a ECMO, realizar su implante si procede y trasladar al paciente al centro de referencia9-11.
El momento del implante, tanto en el caso de ECMO VV como VA, es difícil de establecer pero debe realizarse una vez implementados y optimizados los tratamientos previos; la decisión debe estar basada en una monitorización hemodinámica y respiratoria precisa y debe realizarse antes de que se establezca el fracaso multiorgánico12-14. La determinación de parámetros como el gasto cardíaco (GC), la saturación venosa mixta de oxígeno (SVO2), la presión arterial pulmonar y la presión capilar pulmonar (PCP) son parámetros hemodinámicos que guían tanto la optimización de la volemia como la contractilidad del ventrículo izquierdo (VI) y del derecho. El catéter de arteria pulmonar permite tipificar la causa fundamental de la disfunción miocárdica, izquierda y/o derecha, pudiendo de esta forma optimizar el tratamiento de forma dirigida (vasodilatadores pulmonares en el caso de hipertensión pulmonar y fallo derecho) siendo de ayuda en el diagnóstico diferencial de entidades como el síndrome de respuesta inflamatoria cuyo manejo difiere del shock cardiogénico. Como se mencionará en apartados posteriores, también permite detectar complicaciones durante el soporte con ECMO VA y en el destete del dispositivo. Así mismo, la ecocardiografía a pesar de tratarse de un sistema de monitorización no continuo es un elemento clave tanto en el diagnóstico diferencial de la hipotensión como en la indicación, monitorización y destete de ECMO. Ambos métodos de monitorización ofrecen un perfil hemodinámico preciso del paciente candidato a asistencia cardiorrespiratoria, por lo que se recomienda su utilización en el manejo de estos pacientes15,16.
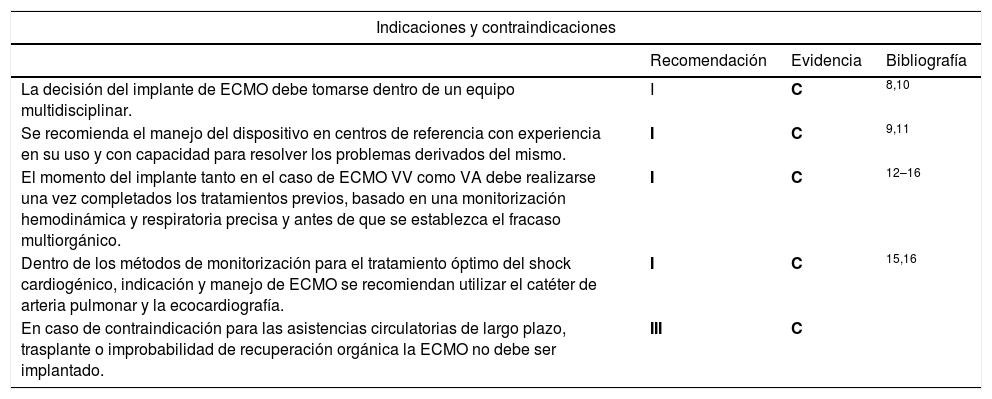
En el caso de contraindicación para las asistencias ventriculares de largo plazo, trasplante o improbabilidad de recuperación orgánica, la ECMO no debe ser implantada (tabla 2).
Indicaciones y contraindicaciones ECMO
| Indicaciones y contraindicaciones | |||
|---|---|---|---|
| Recomendación | Evidencia | Bibliografía | |
| La decisión del implante de ECMO debe tomarse dentro de un equipo multidisciplinar. | I | C | 8,10 |
| Se recomienda el manejo del dispositivo en centros de referencia con experiencia en su uso y con capacidad para resolver los problemas derivados del mismo. | I | C | 9,11 |
| El momento del implante tanto en el caso de ECMO VV como VA debe realizarse una vez completados los tratamientos previos, basado en una monitorización hemodinámica y respiratoria precisa y antes de que se establezca el fracaso multiorgánico. | I | C | 12–16 |
| Dentro de los métodos de monitorización para el tratamiento óptimo del shock cardiogénico, indicación y manejo de ECMO se recomiendan utilizar el catéter de arteria pulmonar y la ecocardiografía. | I | C | 15,16 |
| En caso de contraindicación para las asistencias circulatorias de largo plazo, trasplante o improbabilidad de recuperación orgánica la ECMO no debe ser implantado. | III | C | |
El implante de ECMO VV o VA se debe realizar teniendo en cuenta la función cardíaca, tanto del VI como del ventrículo derecho (VD). En el caso de insuficiencia respiratoria aislada, la ECMO VV es de elección, mientras que si existe disfunción ventricular se optará por la ECMO VA.
Las patologías en las que la ECMO puede ser considerada como soporte vital son las siguientes1,6,17-30:
- •
Shock cardiogénico tras infarto agudo de miocardio (IAM).
- •
Miocarditis fulminante.
- •
Miocardiopatía descompensada.
- •
Shock postcardiotomía.
- •
Fallo primario del injerto tras trasplante cardíaco o pulmonar.
- •
Tromboembolismo pulmonar con disfunción ventricular derecha.
- •
Embolia de líquido amniótico.
- •
Perioperatorio del trasplante pulmonar.
- •
Insuficiencia respiratoria: síndrome de distrés respiratorio agudo (SDRA), traumatismo torácico, estatus asmático, fístula broncopleural.
- •
Asistencia procedimientos quirúrgicos: cirugía traqueal, grandes tumores torácicos, obstrucción de vía aérea, reparación de hernia diafragmática, trasplante hepático, donación de órganos, intervencionismo coronario o en procedimientos de ablación de arritmias.
- •
Miocardiopatía asociada a sepsis.
- •
Intoxicaciones reversibles.
- •
Parada cardíaca presenciada y con etiología potencialmente reversible.
- •
Hipotermia grave accidental.
Son contraindicaciones absolutas las siguientes situaciones6:
- •
Enfermedad crónica terminal.
- •
Neoplasia maligna activa.
- •
Daño neurológico irreversible.
- •
Sepsis con fracaso multiorgánico.
- •
Insuficiencia aórtica grave en el caso de ECMO VA.
- •
Disección aórtica no corregida en el caso de ECMO VA.
Las contraindicaciones relativas se citan a continuación:
- •
Edad: la utilización de la ECMO en pacientes de edad avanzada es controvertida pero la indicación, la situación funcional del paciente, así como los resultados de cada centro pueden determinar el implante de la ECMO31.
- •
Obesidad: no existe actualmente una contraindicación absoluta respecto al implante de ECMO en los pacientes con obesidad, aunque su manejo puede ser más complejo tanto en el implante como a lo largo del soporte32,33.
- •
Contraindicaciones para la anticoagulación con heparina.
- •
Arteriopatía periférica en el caso de ECMO VA.
La sangre se drena desde la aurícula derecha (con canulación central o periférica) y es reinfundida oxigenada en el sistema arterial (periférico o central)6,34 (tabla 3).
- •
Canulación central: se puede considerar en el shock postcardiotomía con imposibilidad de separación de la circulación extracorpórea35. En este tipo de configuración el flujo de la ECMO es anterógrado (desde el corazón a la periferia) y evita el síndrome del Arlequín (ver apartado de complicaciones). La cánula venosa se coloca en la aurícula derecha y la cánula arterial en la aorta ascendente. A pesar de que en los pacientes con shock postcardiotomía existe una esternotomía con posibilidad de canulación central, la canulación periférica es más frecuente por la menor incidencia de hemorragia en esta última modalidad36.
- •
Canulación periférica: mediante acceso percutáneo o quirúrgico. El acceso femoral es el de elección por su accesibilidad y rapidez. Se debe considerar este acceso en el caso de shock cardiogénico refractario a catecolaminas y/o balón de contrapulsación intraaórtico (BCPIA) en el postoperatorio inmediato de cirugía cardíaca, shock cardiogénico (síndrome coronario agudo, miocarditis, reagudización de insuficiencia cardíaca crónica) o en el fallo primario del injerto cardíaco/pulmonar. La mayoría de las series optan por la canulación abierta respecto a la percutánea con menor número de complicaciones en la serie de la canulación abierta, incluso se ha reportado mayor supervivencia en esta última35,37,38. Un abordaje mixto exponiendo los vasos femorales quirúrgicamente y tunelizando las cánulas a través de una contraincisión permite el cierre de la incisión femoral reduciendo el riesgo de hemorragia e infección del acceso. Alternativamente, la canulación de la arteria femoral puede realizarse a través de un injerto de dacrón suturado en la arteria en disposición término-lateral. Cuando se procede a la decanulación, en ocasiones puede ser necesario realizar reparación y plastia de la arteria femoral39,40.
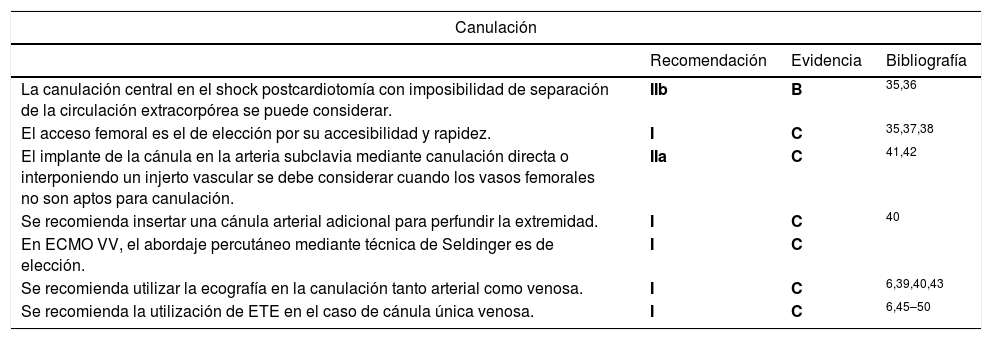
Recomendaciones para la canulación
| Canulación | |||
|---|---|---|---|
| Recomendación | Evidencia | Bibliografía | |
| La canulación central en el shock postcardiotomía con imposibilidad de separación de la circulación extracorpórea se puede considerar. | IIb | B | 35,36 |
| El acceso femoral es el de elección por su accesibilidad y rapidez. | I | C | 35,37,38 |
| El implante de la cánula en la arteria subclavia mediante canulación directa o interponiendo un injerto vascular se debe considerar cuando los vasos femorales no son aptos para canulación. | IIa | C | 41,42 |
| Se recomienda insertar una cánula arterial adicional para perfundir la extremidad. | I | C | 40 |
| En ECMO VV, el abordaje percutáneo mediante técnica de Seldinger es de elección. | I | C | |
| Se recomienda utilizar la ecografía en la canulación tanto arterial como venosa. | I | C | 6,39,40,43 |
| Se recomienda la utilización de ETE en el caso de cánula única venosa. | I | C | 6,45–50 |
ETE: Ecografía transesofágica.
El implante de la cánula en la arteria subclavia mediante canulación directa o interponiendo un injerto vascular es de elección cuando los vasos femorales no son aptos para canulación. La canulación arterial subclavia y venosa yugular, mediante una cánula venosa avanzada a la aurícula derecha, ofrece también la ventaja de permitir a los pacientes en ECMO una movilización temprana, rehabilitación activa y se evita el síndrome de Arlequín (ver apartado de complicaciones)41,42.
Dado que la cánula arterial femoral puede comprometer la perfusión de la extremidad en la que se ha implantado, debe insertarse una cánula arterial adicional (∼ 10 Fr) para perfundir la extremidad40.
La utilización de la ecografía en la canulación percutánea puede ayudar a descartar anomalías anatómicas y evitar complicaciones vasculares, así como ser de ayuda para decidir el tamaño de las cánulas a implantar, por lo que se recomienda su uso en el momento del implante6,39,43.
5.2. ECMO VVEn la ECMO VV, el abordaje percutáneo mediante técnica de Seldinger es de elección (tabla 3).
- •
Técnica de doble cánula:
Femoroyugular: la sangre se drena desde vena cava inferior (VCI) con una cánula multiperforada introducida a través de vena femoral y se reinfunde la sangre oxigenada en aurícula derecha mediante una cánula en vena yugular interna derecha.
Femorofemoral: la sangre se drena desde VCI mediante una cánula venosa multiperforada, habitualmente implantada en vena femoral izquierda y con el extremo situado 10 cm por debajo de la unión cavoauricular, y se reinfunde mediante una cánula venosa introducida en la vena femoral contralateral, con un único orificio distal situado en la aurícula derecha44.
- •
Técnica de cánula única:
La cánula de doble luz Avalon® se inserta a través de la vena yugular interna derecha. Tiene dos luces, por una de las luces drena la sangre de la cava superior e inferior (a través de dos orificios) y por la otra luz la reinfunde oxigenada a la aurícula derecha orientándose hacia la válvula tricúspide. Las ventajas son: punto único de canulación, posiblemente menor recirculación y movilización precoz del paciente. Las desventajas: implante más difícil, flujos más limitados y posibilidad de lesión cardíaca45.
Se recomienda la utilización de ecografía transesofágica (ETE) para el posicionamiento de las cánulas en el caso de la técnica de doble cánula, siendo imprescindible en el caso de cánula única (ver apartado de ecografía en ECMO)6,45-50.
6. ECMO VV en el síndrome de distrés respiratorio agudoEn los últimos años, intervenciones específicas como las maniobras de reclutamiento, el uso de bloqueadores neuromusculares y la ventilación en posición prono, han demostrado mejorar la oxigenación de los pacientes con SDRA grave y reducir la mortalidad de los mismos51. En este contexto, el subgrupo de enfermos que a pesar de todas las intervenciones antes mencionadas permanece con un grave trastorno del intercambio gaseoso tiene una mortalidad esperada superior al 80%. El ensayo clínico CESAR (Efficacy and economic assessment of conventional ventilatory support versus extracorporeal membrane oxygenation for severe adult respiratory failure) mostró mejores resultados en pacientes con SDRA tratados con ECMO frente al tratamiento convencional52. Sin embargo, este estudio presentó algunos problemas metodológicos que hacen difícil la recomendación con un nivel de evidencia suficiente. La controversia del beneficio del tratamiento del SDRA con ECMO VV en los pacientes más graves ha proseguido en el EOLIA (ECMO to Rescue Lung Injury in Severe ARDS) en el que entre los pacientes con SDRA muy grave, la mortalidad a los 60 días no fue significativamente menor con ECMO que con una estrategia de ventilación mecánica (VM) convencional, aunque en este último grupo se incluyó la ECMO como terapia de rescate14. En estos pacientes con SDRA grave, la ECMO permite brindar un soporte respiratorio prolongado, y a su vez mantener una estrategia de ventilación protectora, en espera de la recuperación de la función pulmonar53,54.
La ECMO está considerada como «terapia de rescate» en insuficiencia respiratoria refractaria tras el fracaso de otras medidas que deben incluir siempre el uso de ventilación mecánica protectora y plantear al menos un cambio a decúbito prono, salvo contraindicación6,51,54-57 (tabla 4):
- •
PaO2/FiO2 < 60 durante seis horas o persistencia de PaO2/FiO2 < 50 durante tres horas, pH < 7,2 y PaCO2 > 80 mmHg a lo largo seis horas (FiO2 100%).
- •
En el caso de la insuficiencia respiratoria hipercápnica, las indicaciones serán PaCO2 > 80 mmHg o imposibilidad para ventilar manteniendo una presión meseta < 30 cmH2O o retención de CO2 a pesar de presión meseta > 30 cmH2O.
- •
Paciente en VM protectora (volumen tidal 6 mL/kg ideal) con presión diferencial (presión meseta-PEEP) < 15 cmH2O con PEEP óptima.
- •
Insuficiencia respiratoria refractaria a bloqueo neuromuscular en infusión continúa, fracaso de la VM en posición prono.
- •
Reconsiderar/revaluar que la causa de la insuficiencia respiratoria sea potencialmente reversible.
- •
Score de Murray > 36.
Recomendaciones para el implante de ECMO en el SDRA
| ECMO en SDRA | |||
|---|---|---|---|
| Recomendación | Evidencia | Bibliografía | |
| La ECMO debe ser considerada como terapia de rescate en insuficiencia respiratoria refractaria tras el fracaso de otras medidas que deben incluir siempre el uso de VM protectora y plantear al menos un cambio a decúbito prono salvo contraindicación. | IIa | B | 6,14,51,52,54–57,60 |
| Una vez iniciado el soporte con ECMO se recomienda mantener ventilación protectora oultraprotectora. | I | B | 51,58–60 |
Una vez iniciado el soporte con ECMO se recomienda el mantenimiento de una ventilación protectora o ultraprotectora51,58-60.
Las contraindicaciones relativas para ECMO VV en el SDRA son6:
- •
VM > siete días con presiones en vía aérea > 30 cmH20 y FiO2 > 90%.
- •
Edad avanzada (> 65 años).
- •
Índice de masa corporal > 45.
- •
Contraindicación para anticoagulación.
- •
Hemorragia del sistema nervioso central.
- •
Estado de inmunodeficiencia severa.
La infección por el virus SARS-CoV-2 presenta una evolución grave en un 15-20% de los casos, requiriendo ingreso en una Unidad de Cuidados Críticos entre el 5-15% dependiendo de las series61-65. La necesidad de ECMO VV comunicada durante la primera ola de la pandemia es baja (entre un 3 y 4% de los pacientes ingresados en Unidades de Críticos) y el uso de la ECMO VA se ha reportado en casos puntuales. En la actualidad, la mortalidad de pacientes con COVID-19 y SDRA refractario tratados con ECMO parece elevada, alcanzando hasta un 82,3% en series publicadas en China65,66.
En comparación con otros síndromes respiratorios, como el SDRA severo y el síndrome respiratorio de Oriente Medio, la COVID-19 se ha asociado con una mayor incidencia de complicaciones cardiovasculares como el IAM, miocarditis fulminante, arritmias ventriculares o tromboembolismo pulmonar61,67,68. Aunque actualmente tanto la experiencia como la evidencia científica es baja, se han elaborado diferentes documentos que recomiendan el uso de ECMO VV y VA en pacientes COVID-19 con SDRA/shock refractario69.
El uso de ECMO en pacientes COVID-19 en situación de pandemia requiere una evaluación continua de la situación. Entre los factores a tener en cuenta y que pueden condicionar el número de los dispositivos implantados están:
- •
La presión asistencial.
- •
Disponibilidad de personal entrenado y de dispositivos ECMO.
- •
Política de gestión de los centros.
Ante la previsión de una limitación de recursos durante la pandemia parece razonable dar prioridad a aquellos pacientes más jóvenes y con menos comorbilidades que puedan limitar su pronóstico y aplicar las contraindicaciones absolutas estándar de la ECMO VV en el SDRA señaladas en el EOLIA y la ELSO (Extracorporeal Life Support Organization)69.
El personal implicado en la implantación y manejo de la terapia ECMO en pacientes COVID-19 debe seguir las recomendaciones y precauciones establecidas por la Organización Mundial de la Salud para prevenir la transmisión de la infección70.
Respecto a los centros con capacidad de implante de ECMO, se recomienda concentrar a los pacientes en hospitales de alto volumen y experiencia, y estos centros proporcionar atención a centros secundarios. La ELSO recomienda no comenzar nuevos programas de ECMO con el único propósito de tratar pacientes con COVID-19. La complejidad de la ECMO requiere un equipo bien cualificado en el manejo de esta terapia, por lo tanto, su uso debe limitarse a centros expertos de alto volumen, y más en situación de pandemia en la que la disponibilidad de recursos puede ser limitada69. Las indicaciones de esta terapia, así como la retirada de la misma, pueden diferir en situaciones de limitación de recursos y, por lo tanto, los centros implantadores deben estar preparados para adaptarse a los diferentes escenarios. La finalización de la terapia con ECMO según las recomendaciones, debería plantearse cuando se objetive una ausencia de recuperación cardíaca y/o pulmonar tras aproximadamente 21 días, siendo especialmente relevante en época de saturación de recursos (tabla 5)66,71,72.
Recomendaciones generales para manejo de ECMO en COVID-19
| Adecuada planificación y provisión de recursos de ECMO en centros con experiencia. |
| Cuidadosa selección de los pacientes candidatos. |
| Atención en centros especializados de ECMO. |
| Ratio de enfermería 1:1 |
| Control ecográfico antes, durante el implante y en el seguimiento de estos pacientes. |
| Vigilancia estricta del nivel de anticoagulación adecuado debido al estado protrombótico asociado a esta patología. |
| Disponer de check-list y protocolo de manejo de ECMO. |
| Establecer un protocolo de desconexión tanto en casos de mejoría como de no recuperación en un periodo de tiempo razonable siguiendo las recomendaciones de la ELSO. |
| Formación continuada del personal sanitario. |
La ELSO recomienda la utilización de los criterios del ensayo EOLIA para la indicación de la ECMO VV en pacientes con SDRA refractario con menos de siete días de VM. Se recomienda que en los pacientes que cumplan los criterios antes descritos no se retrase el implante de ECMO.
7.2. ECMO VACuando existe compromiso circulatorio secundario a disfunción cardíaca refractaria a las medidas habituales puede considerarse el implante de ECMO VA. Deben seguirse las indicaciones habituales de ECMO VA teniendo en cuenta que se han comunicado factores de riesgo asociados a escaso beneficio o mala evolución en pacientes con COVID-1971:
- •
Edad avanzada.
- •
Sepsis.
- •
Shock mixto o predominantemente vasopléjico.
- •
Estado protrombótico.
- •
SDRA concomitante.
- •
Fracaso multiorgánico.
- •
Scores pronósticos de alto riesgo (SOFA, SAVE).
Debido al estado de hipercoagulabilidad de estos pacientes se puede considerar fijar un objetivo de tiempo de coagulación activado (TCA) en los límites altos respecto a los objetivos habituales en ECMO (∼ 180). Ante la ausencia de grandes series no puede recomendarse la administración sistemática de antiagregantes, pero ante escenarios de recambios frecuentes de membrana y/o presencia de trombos puede considerarse posible. La ecocardiografía en este contexto es fundamental para determinar el diagnóstico cardiovascular y descartar trombos intravasculares e intracavitarios asociados a esta infección71.
8. ECMO en el shock postcardiotomíaEl shock postcardiotomía con imposibilidad de desconexión de la circulación extracorpórea (CEC) conlleva una alta mortalidad40,73,74. La desconexión de la CEC puede ser dificultosa entre el 10 y el 45% de los pacientes y, aproximadamente el 1% de los pacientes presenta shock cardiogénico refractario75,76. A pesar del implante de ECMO VA, las tasas de supervivencia publicadas varían entre el 16% y el 52% y, en general, en la mayor parte de los centros la supervivencia es inferior al 40%36. En un análisis reciente de ECMO como terapia para el shock postcardiotomía, la mortalidad alcanzaba el 60%, siendo la más alta de todas las indicaciones de ECMO VA77. Se han desarrollado múltiples scores como el SAVE (Survival after VA ECMO)78 creado específicamente para pacientes con ECMO VA, y el REMEMBER (Predicting Mortality in Patients Undergoing Venoarterial Extracorporeal Membrane Oxygenator after Coronary Artery Bypass Grafting)79 para pacientes portadores de ECMO VA sometidos a revascularización coronaria, que pretenden predecir la supervivencia de los pacientes sometidos a ECMO VA y de esta manera poder realizar una selección de personas que se beneficiarían con el implante del dispositivo. Es importante señalar que los scores publicados hasta el momento han sido elaborados en una población específica (no cirugía cardíaca, IAM, cirugía coronaria aislada) que pueden hacer no extrapolables los resultados a la población afectada por shock postcardiotomía.
A pesar de los numerosos estudios publicados, aún no existen criterios uniformes en la definición del shock postcardiotomía y en consecuencia para decidir el momento de la indicación de ECMO VA80,81. De la misma manera, en la literatura no se ha descrito la dosis máxima de soporte inotrópico para el implante de una ECMO en este contexto, y el momento de implantar un dispositivo de asistencia mecánica varía entre diferentes autores. A pesar de la ausencia de consenso entre los diferentes centros, los vasoactivos e inotropos mantenidos durante más de 24 horas se han asociado con la mortalidad intrahospitalaria tras la cirugía cardíaca82-85. Recientemente se ha formulado el VIS-score (Vasoactive-inotropic score), que a través de las dosis máximas de inotropos y vasoactivos en las primeras 24 horas clasifica a los pacientes en bajo, moderado y alto riesgo de mortalidad86. Las nuevas líneas de investigación tratan de conocer el valor predictivo del VIS-score para indicar de forma precoz el implante de una ECMO VA y así reducir las dosis de inotropos con el objetivo de mejorar los resultados de mortalidad intrahospitalaria87.
Basándonos en nuestra experiencia y en diferentes publicaciones que han intentado unificar criterios respecto a la definición y manejo del síndrome de bajo gasto cardíaco y el shock postcardiotomía, definimos el shock postcardiotomía refractario cuando, una vez controlados los factores de temperatura, ritmo, alteraciones iónicas y reposición de volumen, persiste una disfunción uni o biventricular con imposibilidad de desconexión de la CEC o shock cardiogénico postoperatorio que cursa con: índice cardíaco (IC) < 2 L/min/m2 e hipotensión definida como presión arterial sistólica (PAS) < 90 mmHg o presión arterial media (PAM) < 60 mmHg, a pesar de una reposición de volumen adecuada, altas dosis de agentes inotrópicos (dobutamina > 20 mcg/kg/min; noradrenalina > 1 mcg/kg/min; adrenalina > 0,15 mcg/kg/min), balón de contrapulsación intraaórtico (BCPIA) y que produce repercusión orgánica con oliguria y/o lactato elevado88-90. Respecto al uso de BCPIA cabe señalar que recientes publicaciones no recomiendan el implante de BCPIA en el shock postcardiotomía si éste retrasa el implante de la ECMO, especialmente en el caso de disfunción severa biventricular, imposibilidad de separación de CEC y, muy en particular, en el caso de la disfunción ventricular derecha grave91 haciendo énfasis en el implante de la ECMO antes de que se produzca el fracaso multiorgánico. Así mismo, ante la presencia de hipotensión en el postoperatorio inmediato es fundamental descartar complicaciones como el taponamiento cardíaco, el síndrome de respuesta inflamatoria sistémica, la obstrucción dinámica del tracto de salida del VI y/o la hipovolemia. Para poder descartar estas complicaciones y caracterizar de forma precisa el shock postcardiotomía (disfunción VI, VD, valvulopatías, diámetros de cavidades) se recomienda utilizar diferentes métodos de monitorización como la ecocardiografía transtorácica o transesofágica, el catéter de arteria pulmonar o la dilución transpulmonar15,16,90-92.
La ECMO VA por lo tanto puede ser considerada una terapia de soporte puente a la decisión, a la recuperación, al trasplante o al implante de asistencias ventriculares de media o larga duración en el shock postcardiotomía1,7,19,36 (tabla 6). En este contexto, la canulación central permite aportar flujos elevados con la ventaja de evitar el aumento de poscarga al VI y el síndrome de Arlequín y se puede implantar manteniendo la canulación de la cirugía. El principal inconveniente de esta canulación es la elevada incidencia de hemorragia que puede llegar a alcanzar el 100% de necesidad de reintervención; por este motivo la canulación periférica, incluso con antecedentes de esternotomía, es más frecuente en las series descritas en la literatura35-38. La canulación periférica presenta menor incidencia de hemorragia y de reintervención permitiendo también una extubación precoz. Por otro lado presenta complicaciones derivadas de la canulación de los vasos femorales (infección, linfocele, isquemia arterial, trombosis venosa) y mayor aumento de la poscarga del VI1,36. Así la decisión en el postoperatorio inmediato respecto al tipo de canulación se debe establecer basándonos en el momento del shock cardiogénico (desconectado o no de la CEC o en el postoperatorio 24-48 horas postoperatorias), calidad de los vasos arteriales periféricos y experiencia del centro1 (tabla 6).
Recomendaciones para el implante de ECMO en el shock postcardiotomía
| ECMO en shock postcardiotomía | |||
|---|---|---|---|
| Recomendación | Evidencia | Bibliografía | |
| En el shock postcardiotomía refractario al tratamiento se recomienda la ECMO puente a la decisión, a la recuperación, al trasplante o al implante de asistencias ventriculares de media o larga duración. | I | B | 1,7,19,36 |
| La decisión sobre el tipo de canulación en el postoperatorio inmediato se debe establecer basándonos en el momento del shock cardiogénico, calidad de los vasos arteriales periféricos y experiencia del centro. | I | C | |
Actualmente la preservación de los órganos abdominales con perfusión normotérmica en el contexto de la donación en asistolia se considera la técnica de elección. Ha demostrado mejores resultados en cuanto a función del injerto, menor número de complicaciones postrasplante, menor estancia hospitalaria y mejor supervivencia del injerto que otras técnicas de preservación93,94. Esta modalidad de preservación de órganos abdominales ofrece la posibilidad de valoración intraoperatoria, realización de biopsia, permite la perfusión de los órganos durante periodos de tiempo de hasta varias horas para mejorar los efectos deletéreos de la isquemia-reperfusión y por lo tanto ayuda a mejorar función de los injertos abdominales. Teniendo en cuenta las diferencias entre la donación en asistolia controlada y la no controlada, cuyo abordaje en profundidad no es el objeto del presente documento de consenso, se pueden establecer puntos clave a la hora del implante y manejo de la ECMO en este contexto94.
El empleo de la ECMO en la donación en asistolia controlada se limita al ECMO VA. Las peculiaridades de la ECMO en la donación de órganos se enumeran a continuación:
- 1.
Tanto en la donación en asistolia controlada como en la no controlada debe implantarse un balón de Fogarty en la aorta supracelíaca para evitar la reperfusión coronaria y cerebral al iniciar la preservación normotérmica con ECMO.
- 2.
Se recomienda canalizar la arteria radial izquierda para comprobar el correcto posicionamiento e hinchado del balón de forma que una vez producido el fallecimiento y tras los cinco minutos de espera establecidos en la legislación española para determinar el fallecimiento, se procede a hinchar el Fogarty y a perfundir con la ECMO obteniendo en la línea femoral presión continua producida por la ECMO y ausencia de flujo en la arteria radial izquierda95.
- 3.
Tanto en la donación en asistolia controlada como en la no controlada la canulación de la ECMO puede realizarse a cielo abierto o mediante técnica percutánea. El lugar en el que se realizará la canulación en el caso de la donación en asistolia controlada se ha de definir en el protocolo de cada centro, quirófano o unidad de críticos.
- 4.
La dosis inicial de heparina es de 3 mg/kg, se debe controlar el TCA siendo en ocasiones necesario reheparinizar.
- 5.
La duración de la perfusión de los órganos en la donación en asistolia controlada es controvertida y puede variar entre 90-120 min pudiendo alargarse hasta seis horas en la donación en asistolia no controlada. A lo largo de este proceso se recomienda monitorizar los flujos y las presiones de la ECMO, la temperatura, el hematocrito y los iones, además de extracción cada 20 minutos de analíticas de perfil hepático y renal94.
- 6.
Los flujos necesarios para perfundir las vísceras abdominales son menores que en la ECMO terapéutica y habitualmente flujos de 1,7-2,5 L/min/m2 son suficientes para mantener una adecuada perfusión visceral94 (tabla 7).
Tabla 7.Recomendaciones para el uso de ECMO VA en la donación de órganos
ECMO VA en la donación de órganos Recomendación Evidencia Bibliografía Se recomienda la preservación de los órganos abdominales con perfusión normotérmica en el contexto de la donación en asistolia. I B 93,94 Se recomienda canalizar la arteria radial izquierda para comprobar el correcto posicionamiento del balón de Fogarty. I C 95 Tanto en la donación en asistolia controlada como en la no controlada, se recomienda la canulación de la ECMO a cielo abierto o mediante técnica percutánea según la experiencia del centro. I C Se recomienda monitorizar los flujos y las presiones, el TCA, la temperatura, el hematocrito y los iones, además de extracción cada 20 minutos de analíticas de perfil hepático y renal. I C 93,94 TCA: Tiempo de coagulación activado.
La disfunción primaria del injerto (DPI) es una complicación que ocurre en el postoperatorio inmediato del trasplante cardíaco, presenta una incidencia entre el 3-30% y una mortalidad que alcanza el 40-50%96,97. La DPI puede ser del VI, VD o ambos. En el caso de DPI grave refractaria a tratamiento con inotrópicos, vasoconstrictores y vasodilatadores pulmonares se debe considerar el implante de ECMO98 (tabla 8).
Recomendaciones para el implante de ECMO en disfunción primaria del injerto cardíaco
| ECMO en la disfunción primaria del injerto cardíaco | |||
|---|---|---|---|
| Recomendación | Evidencia | Bibliografía | |
| En el caso de DPI grave refractaria a tratamiento con inotrópicos, vasoconstrictores y vasodilatadores pulmonares se recomienda el implante de ECMO. | I | B | 99–101 |
DPI: Disfunción primaria del injerto.
La ventaja de la ECMO sobre la asistencia ventricular es que se implanta fácilmente, presenta menor tasa de fallo renal e incluso se han reportado mejores resultados clínicos99. Los resultados en términos de supervivencia son esperanzadores con resultados a un año similares a aquellos pacientes que no presentaron DPI100. Incluso, la mortalidad es menor cuando se implanta una ECMO por un DPI (51,6%) que por cualquier otra etiología (69,1%)24,101.
11. ECMO en el trasplante pulmonar11.1. ECMO pretrasplanteA pesar de las sofisticadas técnicas de VM, la hipoxemia y/o hipercapnia pueden ser refractarias en los pacientes en lista de espera de trasplante pulmonar102,103. Existe una experiencia creciente en el soporte de pacientes en ventilación espontánea y ECMO con una mayor supervivencia en comparación con pacientes sometidos a VM102,104-107, dado que la participación activa en la fisioterapia previa al trasplante mejora el resultado posterior al trasplante.
Teniendo en cuenta la patología basal la ECMO puede ser indicada (tabla 9):
- •
ECMO VV: hipoxemia severa o hipercapnia que resulta en acidosis respiratoria.
- •
ECMO VA: insuficiencia ventricular derecha, hipertensión pulmonar persistente a pesar de la adecuada terapia antihipertensiva (pulmonar) y/o insuficiencia cardíaca.
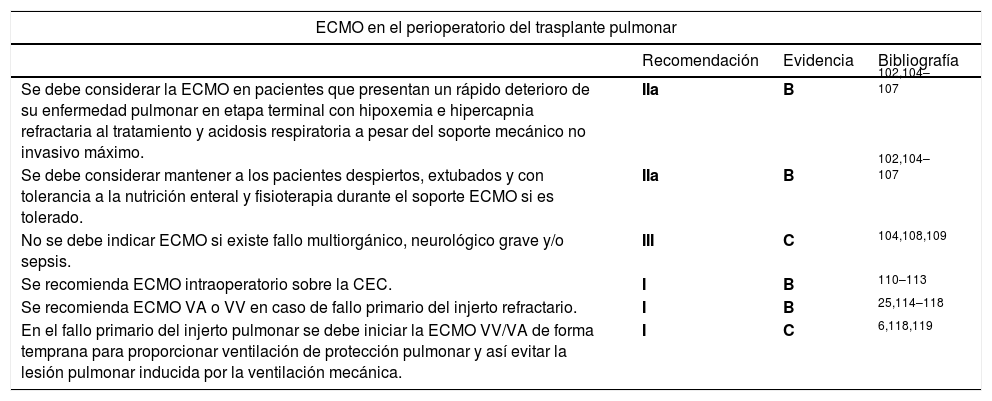
Recomendaciones para el implante de ECMO en el perioperatorio de trasplante pulmonar
| ECMO en el perioperatorio del trasplante pulmonar | |||
|---|---|---|---|
| Recomendación | Evidencia | Bibliografía | |
| Se debe considerar la ECMO en pacientes que presentan un rápido deterioro de su enfermedad pulmonar en etapa terminal con hipoxemia e hipercapnia refractaria al tratamiento y acidosis respiratoria a pesar del soporte mecánico no invasivo máximo. | IIa | B | 102,104–107 |
| Se debe considerar mantener a los pacientes despiertos, extubados y con tolerancia a la nutrición enteral y fisioterapia durante el soporte ECMO si es tolerado. | IIa | B | 102,104–107 |
| No se debe indicar ECMO si existe fallo multiorgánico, neurológico grave y/o sepsis. | III | C | 104,108,109 |
| Se recomienda ECMO intraoperatorio sobre la CEC. | I | B | 110–113 |
| Se recomienda ECMO VA o VV en caso de fallo primario del injerto refractario. | I | B | 25,114–118 |
| En el fallo primario del injerto pulmonar se debe iniciar la ECMO VV/VA de forma temprana para proporcionar ventilación de protección pulmonar y así evitar la lesión pulmonar inducida por la ventilación mecánica. | I | C | 6,118,119 |
CEC: Circulación extracorpórea.
Los pacientes que presentan o desarrollan fallo multiorgánico, especialmente insuficiencia hepática, tienden a tener un resultado desfavorable y la indicación de un soporte extracorpóreo debe ser valorada en el seno de un equipo multidisciplinar especializado en el perioperatorio del trasplante pulmonar104,108,109 (tabla 9).
11.2. ECMO intraoperatoriaTradicionalmente el bypass cardiopulmonar se utilizó durante la hipoxemia/hipercapnia y la inestabilidad hemodinámica que pueden suceder durante la ventilación unipulmonar. Actualmente la ECMO ha demostrado menor necesidad transfusional, menor tiempo de ventilación, menor estancia en las Unidades de Cuidados Críticos y una menor mortalidad a los tres meses que el bypass cardiopulmonar83,110-112. Además, el uso de la ECMO en el intraoperatorio es más versátil y permite un manejo perioperatorio integral del paciente113. La reperfusión del pulmón puede retrasarse y controlarse, disminuyendo la presión de reperfusión y reduciendo la DPI112 y permite la VM protectora con una supervivencia similar a los pacientes sometidos a trasplante pulmonar sin soporte circulatorio111 (tabla 9).
Las indicaciones de ECMO intraoperatorio son:
- •
Hipoxemia refractaria (PaO2/FiO2 < 80 mmHg).
- •
Inestabilidad hemodinámica (IC < 1,8-2 L/m/m2, PCP > 20 mmHg, PAS < 90 mmHg).
- •
Presiones de arteria pulmonar suprasistémicas.
- •
Imposibilidad de ventilación de protección pulmonar.
La presencia de complicaciones como la DPI, el rechazo hiperagudo y las alteraciones hemodinámicas son las principales causas de implante de ECMO. Se considera indicado cuando los tratamientos convencionales (VM, óxido nítrico) no son efectivos25,114-118.
Se recomienda iniciar la ECMO VV de forma temprana para proporcionar ventilación de protección pulmonar y así evitar la lesión pulmonar inducida por la VM. En caso de que exista afectación hemodinámica grave pese al tratamiento adecuado se deberá instaurar ECMO VA6,118,119 (tabla 9).
12. ECMO en cirugía no cardíacaEl desarrollo tecnológico, la experiencia en su uso y las diferentes estrategias de canulación han permitido que la ECMO pueda ser empleada como asistencia cardiorrespiratoria en diferentes procedimientos al margen de la cirugía cardíaca como la cirugía torácica, la cirugía abdominal e incluso el manejo de complicaciones obstétricas. A pesar de que la utilización de la ECMO en estos contextos es aún escasa en comparación con el campo de la cardiología o la cirugía cardíaca, los profesionales a cargo de estos casos deben tener en cuenta que si bien las recomendaciones están basadas en series de pacientes, la ECMO puede ser utilizada con seguridad aplicando los estándares de monitorización y manejo que se desarrollan posteriormente.
- •
Cirugía torácica: la cirugía traqueal, la cirugía de grandes tumores mediastínicos o pulmonares, los traumatismos torácicos penetrantes graves, la obstrucción y/o hemorragia de la vía aérea entre otras representan un reto en el manejo tanto cardiovascular como respiratorio y por lo tanto teniendo en cuenta el soporte requerido (respiratorio o cardiorrespiratorio) puede emplearse la modalidad VV o VA respectivamente120,121.
- •
Cirugía abdominal: en la cirugía abdominal destaca la utilización de la ECMO en la realización de trasplante hepático en pacientes con dificultades técnicas, mala tolerancia a la técnica clásica (pinzamieno total de cava inferior) o en pacientes con alteraciones cardiorrespiratorias tanto en el intraoperatorio como en el postoperatorio. En estos pacientes a la canulación VV (yugular y femoral) se le puede añadir una cánula en Y a nivel de la cánula femoral que recoja el flujo portal122,123.
- •
Obstetricia: la utilización de la ECMO en el campo de la obstetricia se ha descrito en series de pacientes con diagnóstico de SDRA, embolia de líquido amniótico, miocardiopatía del embarazo o agudización de cardiopatía preexistente. En este ámbito, la cesárea es de elección y la utilización de la anestesia neuroaxial está relativamente contraindicada121,124.
El implante y manejo de la ECMO debe ser evaluado por un equipo multidisciplinar que además de los cirujanos torácicos, digestivos/hepáticos, obstetras y anestesiólogos del área implicada, incluya a cirugía cardíaca, anestesiología cardíaca, especialistas en perfusión y neonatología121. El manejo postoperatorio debe realizarse en Unidades de Cuidados Críticos postoperatorios con experiencia en ECMO.
El manejo de la anticoagulación en estos pacientes es complejo y deben tenerse en cuenta peculiaridades como el aumento de riesgo de coagulación intravascular diseminada en el caso de embolia de líquido amniótico121 o el riesgo de hemorragia grave, traumatismo craneoencefálico o lesión medular en el caso del politraumatismo125 (tabla 10).
ECMO en cirugía no cardíaca
| ECMO en cirugía no cardíaca | |||
|---|---|---|---|
| Recomendación | Evidencia | Bibliografía | |
| La ECMO VV y la ECMO VA se pueden considerar en cirugía torácica: tumores, trauma, hemorragia/obstrucción de vía aérea. | IIb | C | 120,121 |
| La ECMO VV y VA se pueden considerar en el perioperatorio del trasplante hepático. | IIb | C | 122,123 |
| La ECMO VV y VA se pueden considerar en patología obstétrica: embolia de líquido amniótico, miocardiopatías, SDRA. | IIb | C | 121 |
| El implante y manejo de ECMO deben ser evaluados por un equipo multidisciplinar. | I | C | |
Los pacientes sometidos a ECMO VV o VA pueden presentar procesos intercurrentes a lo largo de su ingreso como cirugía abdominal, torácica, traqueostomía o endoscopia.
Antes de proceder al traslado del paciente (si fuera necesario para el procedimiento) se debe comprobar una adecuada posición de las cánulas, los accesos vasculares y la vía aérea. Así mismo, se debe confirmar que la batería del dispositivo y el suministro de oxígeno es suficiente para realizar el traslado. Ya sea durante el traslado del paciente o a lo largo del posicionamiento en la mesa quirúrgica o durante la intervención, las principales complicaciones que se pueden presentar son las siguientes (tabla 11):
- •
Riesgo de decanulación por el traslado y posicionamiento en quirófano. Es fundamental una adecuada colocación del paciente que evite acodamiento y tensión de las cánulas. Si el paciente va a estar colocado en decúbito lateral y/o anti-Trendelenburg, se considerará la administración de un bolo de fluidos para prevenir la disminución de la precarga y con ello la disminución de flujo. La ECMO no contraindica de forma absoluta la posición de decúbito prono pero el riesgo de decanulación, hemorragia en puntos de inserción, acodamiento de las tubuladuras o incidencias en la vía aérea o en los accesos vasculares es mayor126. En caso de cirugía laparoscópica se comenzará con el neumoperitoneo de manera lenta y progresiva.
- •
Se recomienda personal en número suficiente y entrenado para realizar los cambios de posición. En el caso de decanulación accidental se deben pinzar las cánulas, ventilar al paciente y administrar catecolaminas y vasopresores mientras se procede a purgar otro sistema y se canula de nuevo.
- •
Riesgo de trombosis y/o hemorragia postoperatoria. Se debe suspender la heparina no fraccionada cuatro horas antes de la cirugía, manteniendo flujos altos (> 2 L/min) para minimizar el riesgo de trombosis. No se recomienda la administración de vitamina K, plasma fresco ni complejo protrombótico para la reversión de la anticoagulación, excepto si el riesgo de sangrado de la cirugía es muy elevado. Se debe corregir la cifra de plaquetas con base en el riesgo hemorrágico y reservar hematíes, plasma y plaquetas. En general no se recomienda reiniciar la anticoagulación hasta al menos 6-8 horas tras la cirugía. Se mantendrá en un rango bajo inicialmente y siempre balanceando el riesgo/beneficio, dependiendo de la localización y agresión quirúrgica127.
- •
Riesgo de infección. Si el paciente se encuentra en el momento de la cirugía con tratamiento antibiótico iniciado, se recomienda continuar con la misma pauta, ampliando el espectro si no fuera suficiente. El volumen de distribución de estos pacientes está incrementado y por lo tanto se debe considerar aumentar las dosis de carga de los fármacos128.
- •
Alteraciones hemodinámicas y/o respiratorias. El objetivo hemodinámico en la ECMO VA es mantener una PAM > 60 mmHg (ver apartado monitorización de la perfusión, oxigenación y ventilación). Realizaremos una anestesia general, garantizando una correcta profundidad anestésica puesto que la estimulación quirúrgica es la principal causa de hipertensión arterial intraoperatoria en estos pacientes y se recomienda monitorizar la profundidad anestésica mediante índice biespectral. Aunque la anestesia locorregional no está contraindicada, no es recomendable puesto que estos pacientes están bajo los efectos de fármacos anticoagulantes. No hay ningún fármaco de elección para la inducción de anestesia general; lo más apropiado es la utilización de aquellos que menos vasodilatación produzcan, realizándose una inducción lenta y cuidadosa. La administración de vasoconstrictores tras la inducción puede ser necesaria.
- •
Las arritmias pueden generar alteraciones hemodinámicas a pesar del soporte de ECMO, por lo que se deben tratar tanto farmacológica como eléctricamente en caso necesario. En caso de parada cardiorrespiratoria se debe proceder a reanimación según las recomendaciones de las guías y se debe tener en cuenta que durante estas maniobras las cánulas pueden movilizarse.
- •
Se realizará una monitorización continua que incluya la medición del gasto cardíaco. En paciente con ECMO VA se recomienda la monitorización continua con ETE durante toda la cirugía.
- •
Se mantendrán los parámetros de VM de protección pulmonar establecidos previamente y se modificarán según gasometrías seriadas. En el caso de deterioro hemodinámico con ECMO VV debe valorarse la adecuada función ventricular ya que la función cardiovascular en esta modalidad de soporte no se encuentra asistida.
- •
Alarmas de la consola. En el caso de precarga disminuida (hemorragia, posición, esfuerzos espiratorios del paciente, compresiones en maniobras quirúrgicas, excesivas revoluciones, acodamiento/trombosis de la cánula venosa) la presión negativa puede generar episodios de succión en la cánula venosa. En estos casos se deben disminuir las rpm del dispositivo y administrar fluidos/vasoconstrictores/cambiar la postura y tras conseguir una adecuada precarga elevar de nuevo las revoluciones. Hay que asegurarse de conectar el dispositivo a la red eléctrica y las tomas de oxígeno y aire a la torre de gases. Las presiones arteriales del sistema también pueden aumentar en el caso de acodamiento/trombosis o hipertensión arterial significativa. Ante cualquier variación de presiones en la consola, lo primero que debe verificarse son los puntos de entrada de las cánulas y su posición. La alarma de burbujas se activará si durante la intervención se produce entrada de aire en el circuito (llaves, decanulación, vía central) y si la entrada es masiva se debe pinzar el dispositivo, asistir de forma completa a nivel respiratorio y cardiovascular al paciente y mantener posición anti-Trendelenburg. Se recomienda la presencia de especialistas de terapia ECMO (especialistas en perfusión/cirugía cardiovascular/especialistas en cuidados críticos) durante el traslado y la intervención6.
Recomendaciones generales para la cirugía/procedimientos en el paciente portador de ECMO
| Comprobar batería del dispositivo para el traslado. |
| Comprobar nivel de O2 para el transporte. |
| Comprobar accesos vasculares venosos y arteriales. |
| Suspensión de heparina 4 horas antes de la cirugía. |
| Reserva de hemoderivados en banco de sangre. |
| Comprobar posición de las líneas y las cánulas. |
| Personal suficiente para las maniobras de posicionamiento. |
| Personal especialista en ECMO en el momento del traslado y procedimiento. |
| Adecuado posicionamiento de las líneas, cánulas y consola en la mesa de quirófano. |
| Conectar a la red eléctrica y a la torre de gases medicinales el dispositivo. |
| Inducción anestésica suave y adecuada profundidad. |
| Monitorización continua con ETE y/o catéter de arteria pulmonar. |
| Reintroducción de la heparina 6-8 horas tras la cirugía en ausencia de hemorragia. |
| Disponer de otro sistema de forma inmediata ante eventual urgencia. |
| Atención a la hemodinámica del paciente y las alarmas de la consola ECMO. |
ETE: Ecocardiografía transesofágica.
Además de las complicaciones habituales del paciente crítico, como la disfunción orgánica (renal, hepática) y las complicaciones infecciosas, los pacientes portadores de ECMO presentan las siguientes peculiaridades que deben tenerse en cuenta:
14.1. Anticoagulación: hemorragia y trombosisAunque los circuitos actuales están recubiertos de heparina, y, por tanto, son superficies menos trombogénicas, es necesario establecer una pauta de anticoagulación. Por otro lado, aunque la canulación femoral ha reducido notablemente la incidencia de hemorragia (35%)129, ésta sigue siendo la complicación más frecuente en la ECMO en el shock postcardiotomía y puede comprometer la vida del paciente130. (tabla 12)
Recomendaciones para la anticoagulación y la prevención de trombosis en ECMO
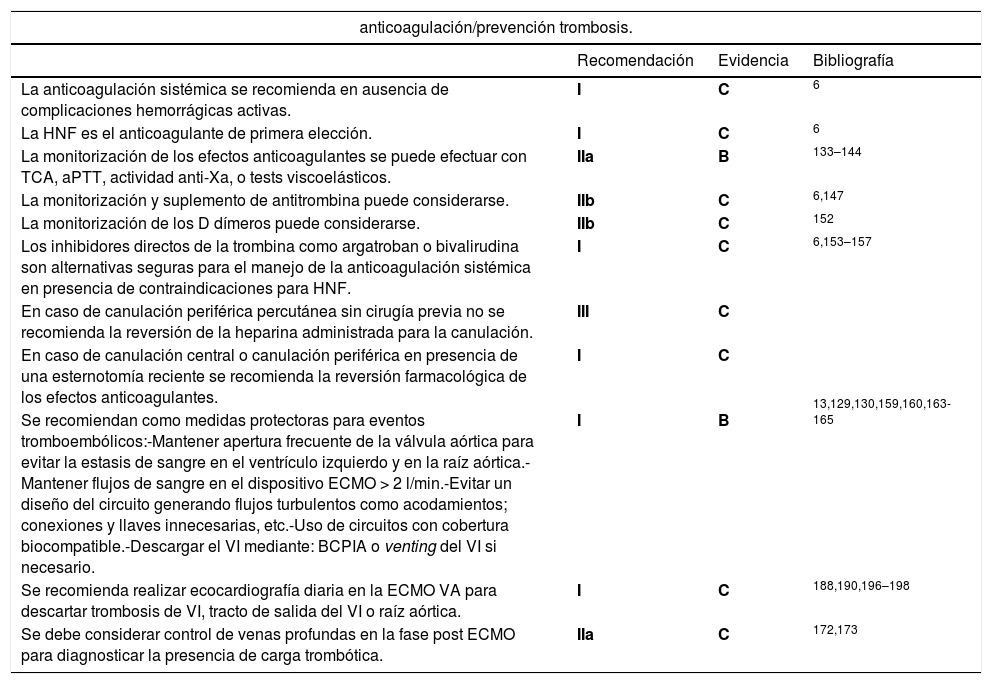
| anticoagulación/prevención trombosis. | |||
|---|---|---|---|
| Recomendación | Evidencia | Bibliografía | |
| La anticoagulación sistémica se recomienda en ausencia de complicaciones hemorrágicas activas. | I | C | 6 |
| La HNF es el anticoagulante de primera elección. | I | C | 6 |
| La monitorización de los efectos anticoagulantes se puede efectuar con TCA, aPTT, actividad anti-Xa, o tests viscoelásticos. | IIa | B | 133–144 |
| La monitorización y suplemento de antitrombina puede considerarse. | IIb | C | 6,147 |
| La monitorización de los D dímeros puede considerarse. | IIb | C | 152 |
| Los inhibidores directos de la trombina como argatroban o bivalirudina son alternativas seguras para el manejo de la anticoagulación sistémica en presencia de contraindicaciones para HNF. | I | C | 6,153–157 |
| En caso de canulación periférica percutánea sin cirugía previa no se recomienda la reversión de la heparina administrada para la canulación. | III | C | |
| En caso de canulación central o canulación periférica en presencia de una esternotomía reciente se recomienda la reversión farmacológica de los efectos anticoagulantes. | I | C | |
| Se recomiendan como medidas protectoras para eventos tromboembólicos:-Mantener apertura frecuente de la válvula aórtica para evitar la estasis de sangre en el ventrículo izquierdo y en la raíz aórtica.-Mantener flujos de sangre en el dispositivo ECMO > 2 l/min.-Evitar un diseño del circuito generando flujos turbulentos como acodamientos; conexiones y llaves innecesarias, etc.-Uso de circuitos con cobertura biocompatible.-Descargar el VI mediante: BCPIA o venting del VI si necesario. | I | B | 13,129,130,159,160,163-165 |
| Se recomienda realizar ecocardiografía diaria en la ECMO VA para descartar trombosis de VI, tracto de salida del VI o raíz aórtica. | I | C | 188,190,196–198 |
| Se debe considerar control de venas profundas en la fase post ECMO para diagnosticar la presencia de carga trombótica. | IIa | C | 172,173 |
HNF: Heparina no fraccionada, VI: Ventrículo izquierdo, BCPIA: Balón de contrapulsación intraaórtico.
Para reducir o evitar la hemorragia y la coagulopatía, se recomienda retrasar el inicio de heparina a las 12-48 horas postoperatorias y no iniciarla cuando exista sangrado, siempre que se mantengan flujos altos (> 2-2,5 L/min) para evitar la formación de coágulos en el sistema13,129,130. En el caso de hemorragia severa que comprometa la vida del paciente se debe interrumpir la anticoagulación84,131-133, transfundir hemoderivados por objetivos con base en un protocolo de transfusión134-136 y, en el caso de hemorragia incoercible que amenace la vida del paciente, se puede administrar complejo protrombínico y factor VIIa aunque se han reportado trombosis del sistema después de su uso137,138 (tabla 13).
Recomendaciones para el manejo de hemorragia en ECMO
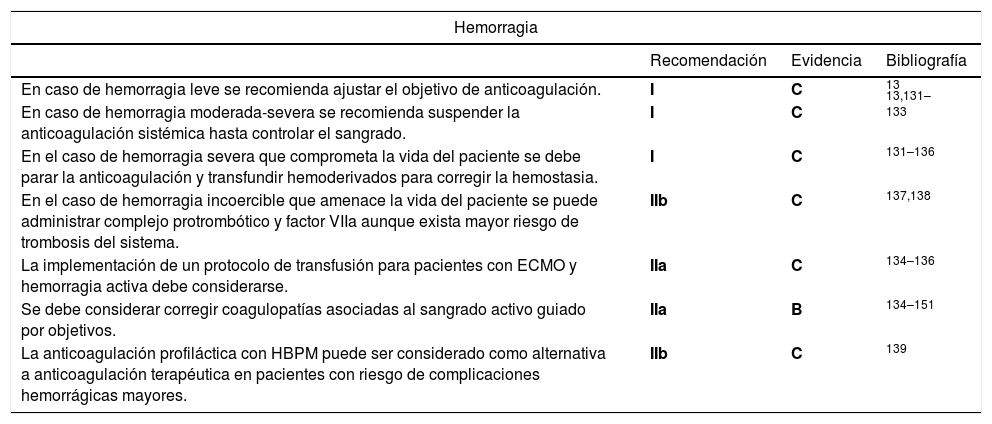
| Hemorragia | |||
|---|---|---|---|
| Recomendación | Evidencia | Bibliografía | |
| En caso de hemorragia leve se recomienda ajustar el objetivo de anticoagulación. | I | C | 13 |
| En caso de hemorragia moderada-severa se recomienda suspender la anticoagulación sistémica hasta controlar el sangrado. | I | C | 13,131–133 |
| En el caso de hemorragia severa que comprometa la vida del paciente se debe parar la anticoagulación y transfundir hemoderivados para corregir la hemostasia. | I | C | 131–136 |
| En el caso de hemorragia incoercible que amenace la vida del paciente se puede administrar complejo protrombótico y factor VIIa aunque exista mayor riesgo de trombosis del sistema. | IIb | C | 137,138 |
| La implementación de un protocolo de transfusión para pacientes con ECMO y hemorragia activa debe considerarse. | IIa | C | 134–136 |
| Se debe considerar corregir coagulopatías asociadas al sangrado activo guiado por objetivos. | IIa | B | 134–151 |
| La anticoagulación profiláctica con HBPM puede ser considerado como alternativa a anticoagulación terapéutica en pacientes con riesgo de complicaciones hemorrágicas mayores. | IIb | C | 139 |
HBPM: Heparina de bajo peso molecular.
Para prevenir la trombosis, tanto del sistema como de las cavidades cardíacas, la heparina no fraccionada es el anticoagulante más utilizado y su control a través del tiempo de coagulación activado (TCA) (160-180) y del tiempo parcial de tromboplastina activado (TTPA) (1,5-2 veces el basal) es la pauta recomendada6. En caso de canulación periférica percutánea sin cirugía previa no está indicada la reversión de la heparina administrada para la canulación. En caso de canulación central o canulación periférica en presencia de una esternotomía recién cerrada se recomienda la reversión farmacológica de los efectos anticoagulantes.
Se han descrito series de pacientes anticoagulados con heparina de bajo peso molecular (HBPM) y su monitorización con Anti Xa139. La combinación de un test específico para los efectos de la heparina en plasma (anti Xa, TTPA) con tests globales de sangre completa (TCA, trombelastometría) posiblemente es superior al uso de un único test133,140-151.
En los casos en los que no se alcance el TCA/TTPA objetivo se pueden monitorizar de forma rutinaria los niveles de antitrombina cuyo objetivo será 80-120% y en el caso de déficit se puede suplementar6,147. Así mismo y fundamentalmente según se alarga el soporte, debe monitorizarse la presencia de hemólisis debida a trombosis del sistema que obligue a realizar el cambio de la centrífuga y del oxigenador6. La monitorización diaria con dímeros D puede ser útil para reconocer una elevada actividad trombogénica y, por lo tanto, necesidad de cambios de membrana de oxigenación152.
En el caso de presentar trombocitopenia inducida por heparinas (HIT) los inhibidores directos de la trombina (IDT) como argatroban o bivalirudina son alternativas seguras para el manejo de la anticoagulación6,153-157.
14.2. Monitorización del sistema: cánulas, membrana oxigenadora, conexiones14.2.1. Entrada de aire. La entrada de aire en el circuito puede proceder de las conexiones, las llaves del circuito o a través de la membrana oxigenadora. Si se detectan burbujas en el sistema arterial debe inspeccionarse el circuito, pinzar las cánulas si la entrada de aire es masiva, aumentar el soporte respiratorio y hemodinámico con catecolaminas y colocar al paciente en posición de Trendelenburg para promover la migración de aire al nivel superior y evitar la lesión neurológica.
14.2.2. Chattering (movimientos) de las cánulas. Generalmente se produce a nivel de la cánula venosa y va acompañada de presiones muy negativas en el inflow. Estas situaciones se deben a hipovolemia, taponamiento cardíaco, neumotórax, aumento de la presión intraabdominal, malposicionamiento, acodamiento, trombosis o diámetro insuficiente de la cánula venosa.
14.2.3. Trombosis. Se debe inspeccionar de forma rutinaria el oxigenador, las cánulas y cualquier conexión en la que se produzcan flujos lentos y/o turbulentos con el consiguiente riesgo de trombosis y la posibilidad de embolismos cerebrales. La transiluminación de la membrana oxigenadora con linterna puede revelar el depósito de trombos que conduzca a un déficit de oxigenación e incluso hemólisis. El funcionamiento adecuado de la membrana oxigenadora se puede comprobar a través de la determinación de una muestra de gases en la línea arterial que por lo general tiene valores de PaO2 > 300 mmHg6. En el caso de presencia de trombos se debe aumentar el objetivo de la anticoagulación o incluso se pueden añadir antiagregantes y/o proceder al cambio de la membrana oxigenadora.
14.3. Monitorización de la poscarga y descompresión del VI: dilatación y trombosis de cavidades cardíacasEsta complicación se produce en situaciones de disfunción ventricular muy grave con ausencia de apertura de la válvula aórtica y estasis sanguínea a nivel del VI o de la raíz aórtica. Sucede fundamentalmente en casos de asistencia con ECMO VA femorofemoral por el aumento de poscarga del VI provocado por el flujo de la ECMO. Aboca a la distensión ventricular izquierda y edema pulmonar y por lo tanto ausencia de recuperación miocárdica y posibilidad de embolismos sistémicos158. En estos casos, la descarga del VI está indicada para evitar complicaciones y promover la recuperación miocárdica y el destete (tabla 14).
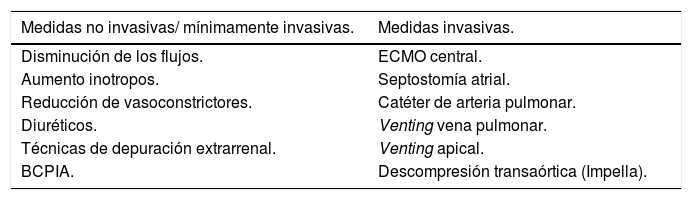
Técnicas para la descompresión del VI
| Medidas no invasivas/ mínimamente invasivas. | Medidas invasivas. |
|---|---|
| Disminución de los flujos. | ECMO central. |
| Aumento inotropos. | Septostomía atrial. |
| Reducción de vasoconstrictores. | Catéter de arteria pulmonar. |
| Diuréticos. | Venting vena pulmonar. |
| Técnicas de depuración extrarrenal. | Venting apical. |
| BCPIA. | Descompresión transaórtica (Impella). |
BCPIA: Balón de contrapulsación intraaórtico.
Las estrategias para prevenir y/o tratar la distensión ventricular izquierda son múltiples y dentro de las menos invasivas se encuentran: disminución de los flujos de la ECMO si es tolerado, aumento de los inotropos, reducción de los vasoconstrictores, disminución del volumen intravascular a través del uso de diuréticos o técnicas de depuración extracorpórea o implante de un BCPIA159,160. El implante de BCPIA de forma rutinaria y universal junto con la ECMO es controvertido y actualmente no existen ensayos clínicos que hayan demostrado la superioridad de una estrategia con BCPIA respecto a ECMO sin BCPIA161,162.
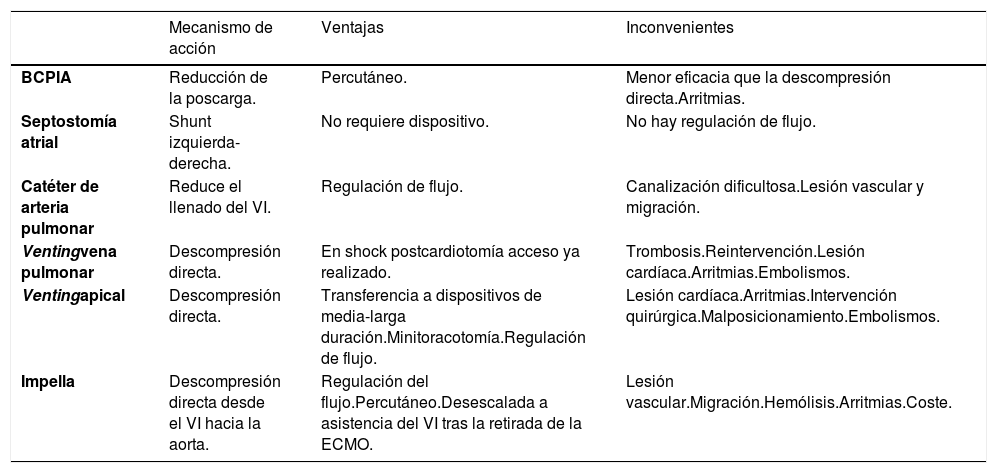
La presión de enclavamiento de la arteria pulmonar, la radiografía o ecografía pulmonar, la presión de pulso, las dimensiones del VI, la presencia de ecocontraste espontáneo y la apertura de la válvula aórtica son los parámetros que se deben monitorizar para descartar esta complicación. Aunque en la literatura no se ha establecido un criterio unánime para ninguno de estos parámetros, a partir del cual sea necesario descargar el VI, la monitorización ecocardiográfica y el aumento de la presión de enclavamiento pulmonar son los métodos más utilizados para basar la indicación y la eficacia de la descompresión del VI159. Teniendo en cuenta las ventajas y los inconvenientes de cada técnica debe estratificarse el grado de distensión ventricular para poder indicar la técnica más eficaz con el menor riesgo posible, por lo que los pacientes con presión capilar pulmonar > 25 mmHg, presión de pulso arterial < 15 mmHg, distensión ecocardiográfica del VI, presencia de ecocontraste espontáneo, ausencia de apertura de válvula aórtica y patrón radiológico de redistribución vascular pueden ser candidatos a maniobras más agresivas como la descompresión directa del VI (cánula apical/venting a través de vena pulmonar superior derecha/Impella®), la septostomía auricular o ECMO central (tabla 15)163-167.
Técnicas invasivas para la descompresión del VI: riesgos y beneficios
| Mecanismo de acción | Ventajas | Inconvenientes | |
|---|---|---|---|
| BCPIA | Reducción de la poscarga. | Percutáneo. | Menor eficacia que la descompresión directa.Arritmias. |
| Septostomía atrial | Shunt izquierda-derecha. | No requiere dispositivo. | No hay regulación de flujo. |
| Catéter de arteria pulmonar | Reduce el llenado del VI. | Regulación de flujo. | Canalización dificultosa.Lesión vascular y migración. |
| Ventingvena pulmonar | Descompresión directa. | En shock postcardiotomía acceso ya realizado. | Trombosis.Reintervención.Lesión cardíaca.Arritmias.Embolismos. |
| Ventingapical | Descompresión directa. | Transferencia a dispositivos de media-larga duración.Minitoracotomía.Regulación de flujo. | Lesión cardíaca.Arritmias.Intervención quirúrgica.Malposicionamiento.Embolismos. |
| Impella | Descompresión directa desde el VI hacia la aorta. | Regulación del flujo.Percutáneo.Desescalada a asistencia del VI tras la retirada de la ECMO. | Lesión vascular.Migración.Hemólisis.Arritmias.Coste. |
BCPIA: Balón de contrapulsación intraaórtico.
Además del grado de distensión y la invasividad de la técnica resulta fundamental plantearse la posibilidad de transferir al paciente a una asistencia ventricular de media o larga duración. En este supuesto, la colocación de una cánula de descarga apical conectada a la línea venosa de la ECMO que nos permita posteriormente transferir al paciente a una asistencia ventricular izquierda es una opción eficiente y puede plantearse de forma precoz. Así mismo, se debe valorar el momento del postoperatorio en el que nos encontremos, de esta forma si el diagnóstico de distensión ventricular izquierda se realiza en quirófano, la ECMO central, el venting pulmonar, la septostomía auricular o el drenaje de la arteria pulmonar pueden ser factibles; mientras que si se realiza en el postoperatorio inmediato, el Impella® o la cánula apical mediante una minitoracotomía pueden estar indicados, valorando de forma individualizada el coste beneficio166–168.
14.4. Vasos periféricos venosos y arteriales: complicaciones relacionadas con la canulación14.4.1. Isquemia de la extremidad inferior (ipsilateral a la canulación arterial en caso de ECMO periférica). Su frecuencia ha disminuido notablemente desde que se ha generalizado el empleo de una cánula de perfusión arterial distal169. La monitorización continua de la oxigenación en la extremidad mediante la saturación regional de oxígeno (NIRS) puede ayudar en la detección precoz de isquemia en el caso de ECMO periférica170,171.
14.4.2. Trombosis venosa profunda o edema de la extremidad inferior. Estas complicaciones son secundarias a la obstrucción del retorno venoso por la cánula venosa femoral. El edema se puede resolver asociando una cánula distal en la vena femoral conectada en Y con la línea venosa, cambiando la cánula venosa femoral por otra de menor diámetro, o bien cambiando a canulación central.
Tras la retirada de la ECMO se ha reportado mayor incidencia de trombosis venosa profunda y tromboembolismo, por lo que se debe considerar realizar ecografía Doppler de venas profundas tras la retirada de la ECMO para diagnosticar la presencia de carga trombótica172,173.
14.5. Complicaciones neurológicasLas complicaciones neurológicas representan una situación grave durante la terapia con ECMO y con frecuencia tienen consecuencias devastadoras. La incidencia es variable y la hemorragia intracraneal es la entidad más frecuente174,175.
Además de los accidentes cerebrovasculares, tanto isquémicos como hemorrágicos, la miopatía y la polineuropatía del paciente portador de ECMO hacen que el pronóstico funcional tanto motor como cognitivo en soportes prolongados resulte desesperanzador176. Así mismo, como hemos mencionado anteriormente, la monitorización de la saturación regional de oxígeno cerebral puede ser de ayuda para el diagnóstico y tratamiento precoz de la hipoperfusión cerebral.
14.6. Perfusión, oxigenación y ventilaciónA lo largo de la terapia de soporte con ECMO la monitorización de los siguientes parámetros debe ser interpretada en relación con la modalidad de ECMO utilizado y el momento del soporte en el que nos encontremos (tabla 16):
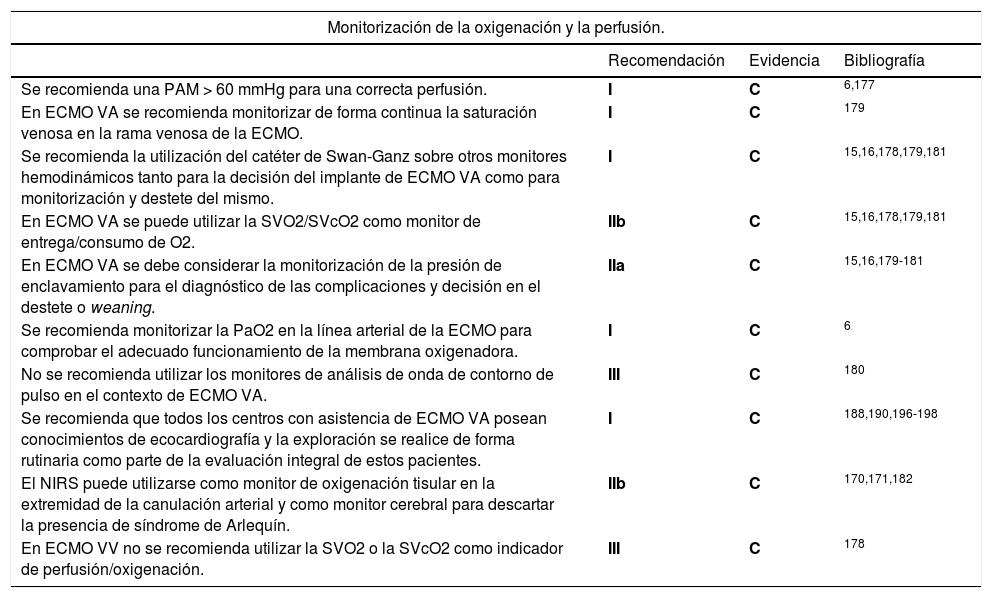
Monitorización de la oxigenación y la perfusión
| Monitorización de la oxigenación y la perfusión. | |||
|---|---|---|---|
| Recomendación | Evidencia | Bibliografía | |
| Se recomienda una PAM > 60 mmHg para una correcta perfusión. | I | C | 6,177 |
| En ECMO VA se recomienda monitorizar de forma continua la saturación venosa en la rama venosa de la ECMO. | I | C | 179 |
| Se recomienda la utilización del catéter de Swan-Ganz sobre otros monitores hemodinámicos tanto para la decisión del implante de ECMO VA como para monitorización y destete del mismo. | I | C | 15,16,178,179,181 |
| En ECMO VA se puede utilizar la SVO2/SVcO2 como monitor de entrega/consumo de O2. | IIb | C | 15,16,178,179,181 |
| En ECMO VA se debe considerar la monitorización de la presión de enclavamiento para el diagnóstico de las complicaciones y decisión en el destete o weaning. | IIa | C | 15,16,179-181 |
| Se recomienda monitorizar la PaO2 en la línea arterial de la ECMO para comprobar el adecuado funcionamiento de la membrana oxigenadora. | I | C | 6 |
| No se recomienda utilizar los monitores de análisis de onda de contorno de pulso en el contexto de ECMO VA. | III | C | 180 |
| Se recomienda que todos los centros con asistencia de ECMO VA posean conocimientos de ecocardiografía y la exploración se realice de forma rutinaria como parte de la evaluación integral de estos pacientes. | I | C | 188,190,196-198 |
| El NIRS puede utilizarse como monitor de oxigenación tisular en la extremidad de la canulación arterial y como monitor cerebral para descartar la presencia de síndrome de Arlequín. | IIb | C | 170,171,182 |
| En ECMO VV no se recomienda utilizar la SVO2 o la SVcO2 como indicador de perfusión/oxigenación. | III | C | 178 |
- •
Presión arterial sistémica. Tras iniciar la ECMO la presión de pulso arterial se reducirá. El objetivo inicial es mantener una presión de pulso de al menos 10 mmHg para mantener flujos pulmonares y aórticos y una PAM > 60 mmHg que será suficiente para una correcta perfusión6,177.
- •
Saturación venosa mixta (SVO2) y saturación venosa central (SVcO2). Dado que la sangre oxigenada es infundida en el sistema arterial, no existe mezcla sanguínea a nivel del sistema venoso y, por lo tanto, la SVO2 y la SVcO2 conservan su validez en el escenario de ECMO VA178,179. La saturación venosa puede ser determinada a través de catéter central o catéter de arteria pulmonar, además de poder monitorizarse en forma continua en la rama venosa de la ECMO179.
- •
Contorno de onda de pulso. Los monitores de análisis de contorno de onda de pulso no calibrados no están validados en el contexto de ECMO VA. Sus valores pueden verse interferidos por las arritmias y el BCPIA180, por lo tanto no se recomienda su uso como sistema de monitorización hemodinámico.
- •
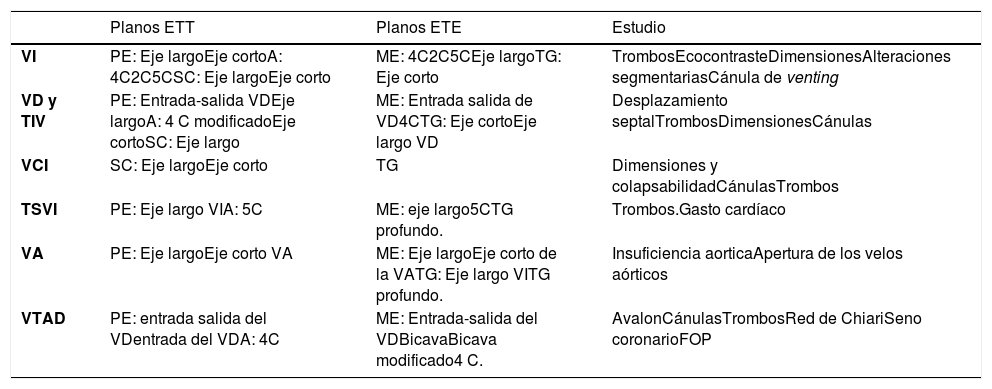
Dilución pulmonar/transpulmonar y presiones pulmonares. Los métodos basados en la dilución de un indicador (térmico o litio) en el sistema venoso para el cálculo de gasto cardíaco (GC) y los parámetros derivados del mismo, pueden conducir a una interpretación errónea de la perfusión global ya que se debe tener en cuenta el flujo aportado por el circuito, el efecto que la ECMO puede generar en la circulación pulmonar y sistémica y la insuficiencia tricúspide. En el caso del catéter de arteria pulmonar es necesario verificar que tanto la posición del filamento térmico como del catéter no se vean interferidos por la cánula venosa de la ECMO. Las presiones pulmonares se deben interpretar con relación al flujo pulmonar y por lo tanto en función del flujo de la ECMO. La presión de enclavamiento pulmonar no se encuentra artefactada y se trata de un parámetro fundamental en la monitorización de la distensión ventricular izquierda. A pesar de sus limitaciones, el catéter de arteria pulmonar junto con la ecocardiografía (ver apartado 15) son los métodos de monitorización más precisos tanto para la indicación de ECMO VA como para el diagnóstico de las complicaciones y decisión en el destete de la ECMO VA15,16179,181.
- •
Saturación regional de oxígeno cerebral. Una disminución en su valor puede reflejar una disminución en la perfusión global y puede ayudar a establecer estrategias tempranas como el aumento del GC (cambio de flujos, fluidos o catecolaminas), cambio en la estrategia de ventilación o transfusión182. El síndrome de Arlequín es la situación en la que el hemicuerpo superior está hipoxémico (hipoxia cerebral y coronaria), mientras que el hemicuerpo inferior está bien oxigenado. Ocurre durante la asistencia con ECMO VA generalmente periférica femorofemoral y es el resultado de la función cardíaca parcialmente conservada asociada a una mala función pulmonar. Para evitar esta complicación, la saturación arterial de oxihemoglobina debe ser monitorizada en la extremidad superior derecha y se considera monitorizar la oxigenación cerebral a través de la saturación regional de oxígeno a nivel cerebral. El tratamiento consiste en mejorar los parámetros de VM, reevaluar la función cardíaca y valorar si es posible la retirada de ECMO, si la función pulmonar está muy comprometida cambio a ECMO VV o añadir una cánula arterial a nivel de la arteria subclavia o cambiar a canulación central1.
- •
Ventilación mecánica. En la asistencia VA tras fijar los flujos óptimos y siempre que no exista compromiso respiratorio grave ajustaremos los parámetros del respirador para realizar una ventilación mecánica de protección pulmonar que evite la sobredistensión alveolar y el atelectrauma. Fijaremos una frecuencia respiratoria < 11 respiraciones por minuto, aumentaremos el tiempo inspiratorio, se reducirá el aporte de oxígeno lo máximo posible, mantendremos una presión meseta inferior a 25 cmH2O y fijaremos un nivel de PEEP entre 5-15 cmH2O aportando con estos parámetros un volumen tidal de 1-5 cc/kg. En el momento de iniciar el destete debe aumentarse el soporte respiratorio de forma simultánea6.
- •
SVO2 y SVcO2. La determinación de la saturación venosa en la cánula de drenaje en el caso de ECMO VV puede verse invalidada por la recirculación sanguínea. Si la cánula de drenaje y la de retorno se encuentran relativamente cerca se puede producir recirculación de la sangre oxigenada con determinaciones elevadas de saturación venosa, y se apreciará una ausencia de diferencia de coloración entre la sangre oxigenada y la no oxigenada178. En este caso, las cánulas deben movilizarse y separarse manteniendo la de drenaje en cava inferior y la de retorno en aurícula derecha con la ayuda de la ecocardiografía6. Esta fracción de recirculación que se produce en mayor o menor medida en ECMO VV puede determinarse a través de diferentes fórmulas teniendo en cuenta la oxigenación premembrana, la postmembrana y la SVO2: fracción de recirculación = (SO2 premembrana- SvO2)/(SO2 postmembrana-SvO2) x 100 (ésta última determinada mediante el cierre momentáneo de los gases si el paciente lo tolera)179.
- •
Contorno de onda de pulso. Este tipo de monitores hemodinámicos no calibrados y mínimamente invasivos no se ven afectados por el ECMO VV más allá de sus limitaciones generales178.
- •
Dilución pulmonar/transpulmonar. Estos métodos pueden conducir a resultados erróneos del GC debido a la interferencia del marcador con el circuito183. Así mismo, la SVO2 no reflejará de forma real el balance entrega/consumo de oxígeno ya que se tratará de una mezcla de sangre oxigenada de la ECMO y el retorno venoso179.
- •
Ventilación mecánica. En el caso de insuficiencia respiratoria severa que motiva ECMO VV, el descenso de los parámetros ventilatorios hacia una ventilación de protección pulmonar debe realizarse de forma progresiva, el objetivo es disminuir el aporte de oxígeno y poder mantener presiones meseta < 25cmH2O. Se realizarán maniobras de reclutamiento alveolar siempre que la fase inflamatoria pulmonar haya disminuido, pudiendo utilizar la ecografía pulmonar y los cambios en la distensibilidad pulmonar como monitorización de dichas maniobras. Cuando se inicie la recuperación pulmonar debe promoverse la ventilación espontánea a través de la extubación o las traqueostomía y se podrán aplicar periodos intermitentes de ventilación mecánica no invasiva184-186.
A lo largo de la evolución del paciente respiratorio pueden ocurrir eventos como el neumotórax o el derrame pleural con necesidad de toracocentesis. Dado que el paciente está siendo oxigenado a través de la ECMO, estas situaciones, fundamentalmente si no son de una cuantía importante, no son emergentes. Se debe valorar el riesgo/beneficio de la toracocentesis debido al riesgo hemorrágico que puede implicar la heparinización187.
15. Ecografía en ECMOLa ecocardiografía transtorácica y transesofágica son métodos de monitorización fundamentales en el manejo de la ECMO VA, en la decisión del implante, durante la canulación, a lo largo del mantenimiento y en el destete6,188,189 por lo que se recomienda que todos los centros con asistencia de ECMO VA posean conocimientos de ambas modalidades de ecocardiografía y la exploración se realice de forma rutinaria como parte de la evaluación integral de estos pacientes190.
La ecografía vascular y pulmonar son así mismo herramientas fácilmente reproducibles y accesibles a pie de cama que contribuyen a realizar una evaluación global, facilitan el manejo del paciente portador de ECMO y reducen la necesidad de traslado a Unidades de Radiología6,191.
El objetivo de este apartado es por lo tanto señalar de forma sistemática los parámetros a monitorizar en este contexto y que la ecografía pueda ser incluida por los equipos asistenciales como una técnica de rutina en el paciente portador de ECMO.
Cabe señalar que el manejo de ecocardiografía en ámbitos como el perioperatorio del trasplante pulmonar presenta peculiaridades que deben ser abordadas de forma específica.
En la tabla 17 se resumen los planos ecocardiográficos recomendados por diferentes publicaciones92,192-194 en los que pueden explorarse diversas estructuras y objetivarse complicaciones.
Planos ecocardiográficos
| Planos ETT | Planos ETE | Estudio | |
|---|---|---|---|
| VI | PE: Eje largoEje cortoA: 4C2C5CSC: Eje largoEje corto | ME: 4C2C5CEje largoTG: Eje corto | TrombosEcocontrasteDimensionesAlteraciones segmentariasCánula de venting |
| VD y TIV | PE: Entrada-salida VDEje largoA: 4 C modificadoEje cortoSC: Eje largo | ME: Entrada salida de VD4CTG: Eje cortoEje largo VD | Desplazamiento septalTrombosDimensionesCánulas |
| VCI | SC: Eje largoEje corto | TG | Dimensiones y colapsabilidadCánulasTrombos |
| TSVI | PE: Eje largo VIA: 5C | ME: eje largo5CTG profundo. | Trombos.Gasto cardíaco |
| VA | PE: Eje largoEje corto VA | ME: Eje largoEje corto de la VATG: Eje largo VITG profundo. | Insuficiencia aorticaApertura de los velos aórticos |
| VTAD | PE: entrada salida del VDentrada del VDA: 4C | ME: Entrada-salida del VDBicavaBicava modificado4 C. | AvalonCánulasTrombosRed de ChiariSeno coronarioFOP |
ETT: Ecocardiografía transtorácica, ETE: Ecocardiografía transesofágica, VI: Ventrículo izquierdo, VD: Ventrículo derecho, TIV: Tabique interventricular, VCI: Vena cava inferior, TSVI: Tracto de salida del ventrículo izquierdo, VA: Válvula aórtica, VT: Válvula tricúspide, PE: Paraesternal, A: Apical, SC: Subcostal, ME: Medioesofágico, TG: Transgástrico, FOP: Foramen oval permeable, C: cámaras.
La evaluación ecocardiográfica preimplante resulta imprescindible en el diagnóstico etiológico del estado de shock, ayuda a descartar alteraciones anatómicas que puedan suponer una contraindicación relativa o absoluta de ECMO, contribuye a la selección del tipo de ECMO a utilizar (VV, VA) y ayuda a la predicción de reversibilidad según la gravedad. La valoración del paciente postquirúrgico puede ser dificultosa a través de ecografía transtorácica (ETT) por lo que ante la presencia de dudas diagnósticas se debe practicar un estudio transesofágico.
- •
Ventrículo izquierdo
Función sistólica y alteraciones segmentarias de la contractilidad. La determinación de la función ventricular a través de un método cuantitativo (fracción eyección, cambio fraccional de área) puede ser complejo en el postoperatorio inmediato de cirugía cardiotorácica, por lo que se puede hacer una estimación subjetiva por un operador con experiencia. La determinación del GC a través de doppler pulsado a nivel del tracto de salida del VI (TSVI) o del VD (volumen sistólico = integral velocidad tiempo (IVT) TSVI x πr2) es un método que puede ser utilizado en el caso de disponer de una buena ventana acústica. La IVT del TSVI es una medida reproducible y validada en el diagnóstico y monitorización de pacientes con síndrome de bajo gasto cardíaco postoperatorio92.
- •
Ventrículo derecho
Función sistólica, morfología y dimensión. La valoración de la función del VD a través de parámetros como el TAPSE (tricuspid annular plane systolic excursion), el doppler tisular del anillo tricúspide o la valoración subjetiva pueden ser utilizados. En muchas ocasiones, la función del VD será la única causa de la inestabilidad hemodinámica. Existen signos que pueden ayudar al diagnóstico etiológico del fracaso del VD: la hipertrofia de la pared libre y la dilatación del VD orientan a un origen crónico, el signo de McConnell (adinamia basal con hiperdinamia del tracto de salida) hace suponer tromboembolismo pulmonar.
- •
Tabique interventricular (TIV). El desplazamiento del TIV a derecha o a izquierda indica aumento de presión en cámaras izquierdas o derechas respectivamente.
- •
Valvulopatías y prótesis valvulares.
- •
Insuficiencia aórtica. La presencia de IAo severa supone una contraindicación absoluta de ECMO salvo que sea reparada ya que al aumentar la poscarga en la aorta debido a la cánula arterial, el flujo retornará al VI produciendo dilatación del mismo con el consiguiente aumento de las presiones intracavitarias y pulmonares.
- •
Regurgitación tricúspide y presiones pulmonares. La determinación de la presión de la arteria pulmonar (PAP) mediante el gradiente transtricuspídeo en situación de shock cardiogénico debido a fracaso ventricular derecho puede dar lecturas falsamente disminuidas o normales debido a la severidad de la disfunción del VD (flujo disminuido).
- •
Prótesis valvulares. Debido a una disminución de flujo a través de la válvula aórtica y mitral el riesgo trombótico es más elevado, fundamentalmente en el caso de prótesis mecánicas.
- •
Taponamiento cardíaco. Es una de las principales complicaciones postoperatorias en cirugía cardíaca que cursa con bajo gasto cardíaco. En este contexto tanto la mala ventana acústica como las características del derrame (pequeñas cantidades de fluido que pueden generar compromiso) hacen el diagnóstico más complejo.
- •
Foramen oval permeable (FOP). La presencia de FOP incrementa el riesgo de embolismo paradójico. Además, aunque durante la terapia ECMO no producirá problemas de oxigenación, en el caso de no producirse la recuperación miocárdica y considerarse el paciente candidato a asistencia ventricular izquierda, debe descartarse su presencia por el riesgo de shunt derecha-izquierda y consiguiente hipoxemia.
- •
Vena cava inferior. La determinación del tamaño y la colapsabilidad nos facilitará el cálculo de la volemia junto con otros métodos hemodinámicos.
- •
La red de Chiari es un vestigio embrionario con una prevalencia estimada en un 2-3% de la población general. En casos con red de Chiari muy desarrollada, ésta puede dificultar el posicionamiento de la cánula venosa dirigiendo la misma hacia el tabique interauricular. Así mismo, puede dar una imagen poco clara durante la terapia ECMO pudiendo ser confundida con vegetaciones y/o trombos.
- •
Seno coronario. La dilatación del seno coronario es debida fundamentalmente a la disfunción del ventrículo derecho e hipertensión pulmonar crónica. También puede deberse a la presencia de una cava superior izquierda persistente.
- •
Vascular. Trombosis, disección, ateromatosis. Antes de iniciar la terapia se debe descartar la presencia de trombos en VI o en aurícula izquierda, la disección aórtica y la presencia de ateromatosis grave que pueda complicar la canulación arterial.
- •
Tamaño de cánulas. La ecografía vascular puede ayudar a decidir el tamaño de cánula a utilizar y a minimizar las posibles complicaciones de la canulación6 (tamaño de la cánula en French = 3 x diámetro del vaso en mm). Debe descartarse la presencia de enfermedad arterial significativa tanto a nivel femoral como a nivel aórtico.
- •
Visualización de las guías y las cánulas. La posición de la cánula venosa es de vital importancia. En el caso de canulación periférica, la posición de la guía venosa puede confirmarse mediante ETE, en el plano ME bicava en la aurícula derecha y en el caso de ETT en plano paraesternal tracto entrada-salida del VD o en el plano eje largo subcostal. La cánula venosa en el caso de ECMO VA debe situarse ligeramente por encima de la unión cavoauricular para evitar la succión sobre las paredes de la VCI. No debe introducirse en exceso en la aurícula derecha por el riesgo de lesión de las estructuras cardíacas. Durante la canulación de las cavidades derechas, tanto en el caso de ECMO VV como en el de VA, se deben monitorizar las posibles complicaciones como la perforación tabique interauricular, la canulación accidental del seno coronario, o la perforación cardíaca y el consiguiente derrame pericárdico. La guía arterial puede observarse en aorta descendente no siendo visible mediante ETT o ETE, su posición puede confirmarse mediante ecografía vascular a nivel de la arteria ilíaca o aorta abdominal.
- •
Alteraciones del flujo. En el caso de presentarse alteraciones de flujo con presiones venosas excesivamente negativas la ecocardiografía y la ecografía pulmonar pueden orientar al diagnóstico etiológico: taponamiento, hipovolemia, neumotórax, trombosis.
- •
Gasto cardíaco. El gasto cardíaco global se calculará teniendo en cuenta el flujo aportado por la ECMO y el volumen sistólico eyectado a través de la válvula aórtica.
- •
Presiones pulmonares. La asistencia con ECMO VA reduce el flujo pulmonar por lo que la cifra del gradiente transtricuspídeo debe ser interpretada teniendo en cuenta el flujo de la ECMO.
- •
Función, tamaño ventricular, presencia de trombos. En el caso de dilatación del VI podremos observar ecocontraste espontáneo en VI o aurícula izquierda, presencia de trombos y en caso de prótesis aórticas/mitrales mayor posibilidad de trombosis de las mismas195.
- •
Posición de las cánulas de la ECMO y/o de las cánulas o dispositivos de descarga del VI.
- •
Volemia. La volemia en el caso de ECMO VA no puede estimarse exclusivamente con base en el tamaño de las cavidades cardíacas ya que éstas se encuentran descomprimidas por el bypass cardiopulmonar parcial que se alcanza con el dispositivo.
En la ECMO VA tras 48 horas de asistencia completa y estabilización clínica se debe iniciar el destete disminuyendo el flujo de forma progresiva. Una vez que nos encontremos a flujos bajos (< 2 L/min), se disminuye la ECMO a flujo de 1-1,5 L/min durante 30 minutos y se deben valorar algunos de los siguientes parámetros, que junto con los referentes clínicos, nos pueden ayudar a la decisión de retirar la asistencia188,196-198:
- •
Fracción de eyección del VI ≥ 25%. En el caso de mala visualización de los bordes endocárdicos, una IVT del TSVI del VI > 12 cm o un doppler tisular lateral S’ > 6 cm/s son parámetros favorables para la retirada de ECMO.
- •
Función VD, FAC > 25%.
- •
Pulmón. Se debe asegurar una correcta función pulmonar. La ecografía pulmonar puede ser de utilidad en estos pacientes191.
- •
Ausencia de taponamiento.
A pesar de que a través de la asistencia con ECMO VV se puede producir una mejoría de la función biventricular, especialmente del VD con la mejoría de la oxigenación y disminución de la poscarga del mismo, solo se debe elegir este acceso si tenemos la certeza de una correcta función cardíaca.
15.2.2. Evaluación ecográfica durante la canulaciónAdemás de lo señalado en la canulación de ECMO VA, en la ECMO VV se deben tener en cuenta las siguientes consideraciones:
- •
ECMO VV doble cánula. En el caso de ECMO VV con cánula yugular-cava inferior se deben mantener suficientemente alejadas entre sí para evitar la recirculación de la sangre.
- •
ECMO VV cánula única Avalon®. La canalización de la cánula de Avalon® puede ocasionar diferentes complicaciones, como la lesión de la vena cava superior, migración de la cánula al VD, VCI, vena hepática, lesión del ventrículo derecho y taponamiento. Para conseguir un adecuado posicionamiento, su implante debe guiarse mediante ETE con/sin fluoroscopia. En los planos bicava, bicava modificado y medioesofágico cuatro cámaras (4C) se valorarán los siguientes aspectos: 1) La punta de la cánula se avanza sobre la guía introducida en la AD hasta la unión cavoauricular (VCI). 2) Con doppler color debemos observar que el flujo de salida u outflow se orienta hacia la válvula tricúspide (plano bicava modificado). 3) Se debe observar un flujo laminar en doppler color hacia la válvula tricúspide, ya que la existencia de un flujo turbulento puede suponer que el outflow no se encuentre totalmente dirigido hacia el centro de la válvula tricúspide y esta situación puede ocasionar recirculación75.
- •
Función y tamaño ventricular. En el caso de desestabilización hemodinámica se debe valorar la función cardíaca, fundamentalmente el VD (puede fracasar en el caso de SDRA) ya que su deterioro nos obligaría a cambiar a una asistencia VA si no existe contraindicación.
- •
Posición de cánulas. Dado que los pacientes pueden movilizarse, cualquier alteración del flujo debe descartarse mediante la comprobación de la posición de las cánulas y evitar la recirculación por posicionamiento cercano de las cánulas de inflow y outflow.
- •
Trombos. Se debe monitorizar la presencia de trombos alrededor de las cánulas, las cavidades o prótesis valvulares.
- •
Ecografía pulmonar. Valorar la presencia de derrame pleural, redistribución vascular, atelectasia, consolidación o neumotórax.
La ECMO VV por lo general no precisa de ecocardiografía para el destete, aunque sí es recomendable verificar una correcta función del VD y la ausencia de complicaciones como los trombos que pueden ser movilizados en el momento de la decanulación.
Tras la decanulación tanto en ECMO VA como VV una de las principales complicaciones es la presencia de trombos en aurícula derecha, aurícula izquierda o cava40,199, por lo que se debe realizar un seguimiento clínico y radiológico de estos pacientes.
16. Destete16.1. ECMO VALa duración de la ECMO es directamente proporcional a la tasa de mortalidad, puesto que a mayor duración mayor riesgo de que aparezcan complicaciones165,200. Aunque los protocolos de destete o weaning de ECMO difieren en algunos aspectos, en términos generales éste debe iniciarse tras 48 horas de asistencia completa y mejoría hemodinámica. La recuperación ventricular debe valorarse a través de la clínica y los datos derivados del catéter de arteria pulmonar y la ecocardiografía. Se recomienda monitorizar la presión de enclavamiento pulmonar, la presión de pulso arterial y la necesidad de catecolaminas. Es necesario comprobar la correcta función pulmonar antes de disminuir los flujos, y aumentar los parámetros de la VM al mismo tiempo que se reduce el flujo sanguíneo. No se debe cerrar el mezclador de gases en el destete de ECMO VA. Reduciremos los flujos 0,5 L/min cada 8-12 horas a lo largo de 24 horas, hasta alcanzar 2-2,5 L/min. Mantendremos el flujo durante 12-24 horas más a 1,5-2 L/min, y si se mantiene la estabilidad hemodinámica (IC ≥ 2,2 L/min/m2, PAM ≥ 65 mmHg, PVC ≤ 18 mmHg y SVO2 ≥ 70%15, con noradrenalina < 0,5 mcg/kg/min y/o dobutamina ≤ 5 mcg/kg/min) y los datos ecocardiográficos son favorables, se procederá a la decanulación.
Hay que recordar que con flujos de < 1,5 L/min, es preciso aumentar la dosis de heparina. Una vez evaluada la función ventricular y la hemodinámica con flujos de 1 L/min podemos aumentar el flujo a ∼ 2 L/min para disminuir el riesgo de trombosis si la decanulación no es inmediata (tabla 18).
Recomendaciones para el destete de ECMO
| Destete/weaning de ECMO. | |||
|---|---|---|---|
| Recomendación | Evidencia | Bibliografía | |
| No se debe cerrar el mezclador de gases en el destete de ECMO VA. | III | C | 6 |
| El destete de la ECMO VA se debe realizar disminuyendo flujos. | I | C | 6 |
| En el destete de ECMO VA se recomienda comprobar la correcta función pulmonar antes de disminuir los flujos, y aumentar los parámetros de la ventilación mecánica al mismo tiempo que se reduzca el flujo de la ECMO. | I | C | 6 |
| El destete de la ECMO VV se debe realizar reduciendo la FiO2 y el flujo de gas fresco. | I | C | 6,201 |
| En ECMO VA para promover la recuperación miocárdica y el destete se puede valorar la descarga del VI. | IIb | B | 160–165 |
| Se recomienda valorar la clínica, la hemodinámica (catéter de arteria pulmonar) y la ecocardiografía en el destete de ECMO VA. | I | C | 15,16,188,196-198 |
| Se recomienda valorara la clínica, la gasometría, la ventilación mecánica, la complianza pulmonar y radiología en el destete de la ECMO VV. | I | C | |
| Se recomienda valorar la presencia de complicaciones locales tras la decanulación venosa y/o arterial. | I | C | 1,35,40,199 |
| En el caso de no mejorar la función cardíaca o pulmonar y no se candidato a trasplante ni a asistencia ventricular se recomienda adecuar el esfuerzo terapéutico. | I | C | 1,200 |
La recuperación miocárdica por causas reversibles suele suceder en menos de 7-10 días. En el caso de que esto no suceda se debe considerar si el paciente es candidato a trasplante cardíaco o a asistencia ventricular. En el caso de no cumplir criterios para trasplante o asistencia se debe proceder a la adecuación del esfuerzo terapéutico en el caso de que la retirada de la ECMO no sea tolerada1,200 (tabla 18).
16.2. ECMO VVLa recuperación pulmonar se valorará a través de: la radiología (TAC/Rx/ecografía pulmonar), la distensibilidad pulmonar, la PaO2/FiO2, la PaCO2 y los parámetros de la VM (ventilación con FiO2 50%). Para el destete de la ECMO VV no es necesario reducir el flujo de la ECMO más allá de 2 L/min, ni aumentar la anticoagulación. En su lugar se disminuye progresivamente la FiO2 y el flujo del mezclador de oxígeno-aire que alimenta el oxigenador de la ECMO hasta la detención del flujo del mezclador; si el paciente se mantiene estable durante 12-24 h, se retirará la ECMO6,201 (tabla 18).
17. LimitacionesDada la extrema gravedad y mortalidad de los pacientes portadores de ECMO, tanto VV como VA, y la ausencia de grandes ensayos clínicos aleatorizados en este tipo de pacientes el nivel de evidencia científica es bajo. Aunque este hecho no debe por sí solo limitar la indicación de las actuaciones médicas basadas en la fisiopatología, es necesario esperar a resultados de ensayos multicéntricos para poder recomendar diferentes actuaciones con mayor nivel de evidencia.
18. ConclusionesLa ECMO es una terapia de soporte vital altamente compleja y con elevada morbimortalidad que debe ser instaurada antes de que se produzca el fracaso multiorgánico, pero siempre como último escalón terapéutico y con una indicación sustentada en una monitorización objetiva. Su implante debe realizarse en centros con experiencia, que posean la capacidad de resolver las complicaciones derivadas del mismo. Las decisiones respecto a su implante y su retirada son complejas y deben ser tomadas por un equipo multidisciplinar.
Artículo publicado previamente en Revista Española de Anestesiología y Reanimación (https://doi.org/10.1016/j.redar.2020.12.011) con el consentimiento de los autores y editores.