
La válvula mitral no es un elemento aislado, sino un conjunto de estructuras denominado «complejo mitral» formado por el anillo, los velos mitrales, las cuerdas tendinosas y los músculos papilares, relacionados con el miocardio de la aurícula y ventrículo izquierdos.
La patología de la válvula mitral es cada vez más frecuente en el mundo occidental a expensas del aumento de las patologías degenerativa e isquémica. El conocimiento de su anatomía funcional es indispensable para entender su fisiopatología y aplicar el tratamiento más adecuado. En los últimos años se ha ido perfeccionando este conocimiento a través de la aplicación integrada de nuevas técnicas diagnósticas. En el presente manuscrito se actualizan estos conocimientos para su aplicación a la cirugía de la válvula mitral.
The Mitral valve complex is a group of interrelated structures. It includes anulus, leaflets, chordae tendinae, papillary muscles and also the ventricular and auricular myocardium.
The incidence of mitral valve pathology is increasing in the western countries due to degenerative and ischemic diseases. Knowledge of the functional anatomy is mandatory to understand its physiopathology and apply the most appropiate treatment. In recent years, the use of new imaging techniques has improved their knowledge. This manuscript reviews the surgical anatomy of mitral valve.
La válvula auriculoventricular sistémica es la válvula mitral1. Su patología es cada vez más frecuente en el mundo occidental constituyendo la segunda valvulopatía en frecuencia2 (debido al incremento de las patologías degenerativa e isquémica). El conocimiento de su anatomía funcional es indispensable para entender su fisiopatología y aplicar el tratamiento más adecuado. El diagnóstico por imagen integrado ha cobrado una importancia fundamental para conocer estos mecanismos patológicos, establecer su severidad y consecuencias hemodinámicas3. Con el avance e incorporación clínica de nuevas técnicas y tratamientos (entre ellos los mínimamente invasivos y transcatéter), la aplicación de la imagen multimodal se ha hecho fundamental en su planeamiento, realización y control posquirúrgico.
Funciones de la válvula mitralLa válvula mitral separa la aurícula izquierda del ventrículo izquierdo y, por lo tanto, el sistema de baja presión pulmonar del sistema de alta presión sistémico, soportando una de las diferencias de presión mayores del organismo4. No lo hace de forma pasiva, sino adaptándose a los distintos movimientos y fuerzas del ciclo cardíaco1. En diástole favorece el paso de la sangre desde la aurícula izquierda al ventrículo izquierdo a baja presión. En sístole desempeña dos papeles: se cierra evitando el reflujo de la sangre, a altas presiones, del ventrículo izquierdo hacia la aurícula, y el velo anterior dirige el flujo sanguíneo hacia la aorta formando parte del tracto de salida ventricular izquierdo (porción lisa de su cara ventricular).
Anatomía de la válvula mitralPara desempeñar estas funciones la válvula mitral actúa como un conjunto coordinado de estructuras denominadas «complejo valvular mitral»5,6. Este complejo consta de:
- •
Anillo valvular mitral
- •
Velos mitrales
- •
Cuerdas tendinosas
- •
Músculos papilares
- •
Miocardio auricular y ventricular.
Histológicamente las fibras auriculares se entrelazan íntimamente con el anillo valvular mitral, sobre todo en su pared libre. En los últimos años se ha profundizado en la asociación entre dilatación auricular (en pacientes con fibrilación auricular) e insuficiencia mitral conocida como «insuficiencia mitral funcional auricular», con una prevalencia estimada del 4-7% de los pacientes con fibrilación auricular persistente7,8. En estos pacientes la dilatación auricular conduce a dilatación y aplanamiento del anillo mitral (a pesar de tener función ventricular conservada), pero con alturas de tenting (desplazamiento ventricular de la línea de coaptación respecto al anillo que remeda a una tienda de campaña) significativamente menores (para un mismo grado de dilatación) que los pacientes con IM secundaria a disfunción ventricular (3,5±1,5mm vs. 8,1±2,4mm; p<0,001) en el análisis 3D9. Esta dilatación es compensada inicialmente por el crecimiento de los velos y es menor que la originada por la fibrilación auricular en la válvula tricúspide, al tener un esqueleto fibroso más denso. También la ecocardiografía 3D ha demostrado, en estos pacientes, una rotación y ascenso auricular del velo posterior, similar al observado en las aurículas gigantes reumáticas10.
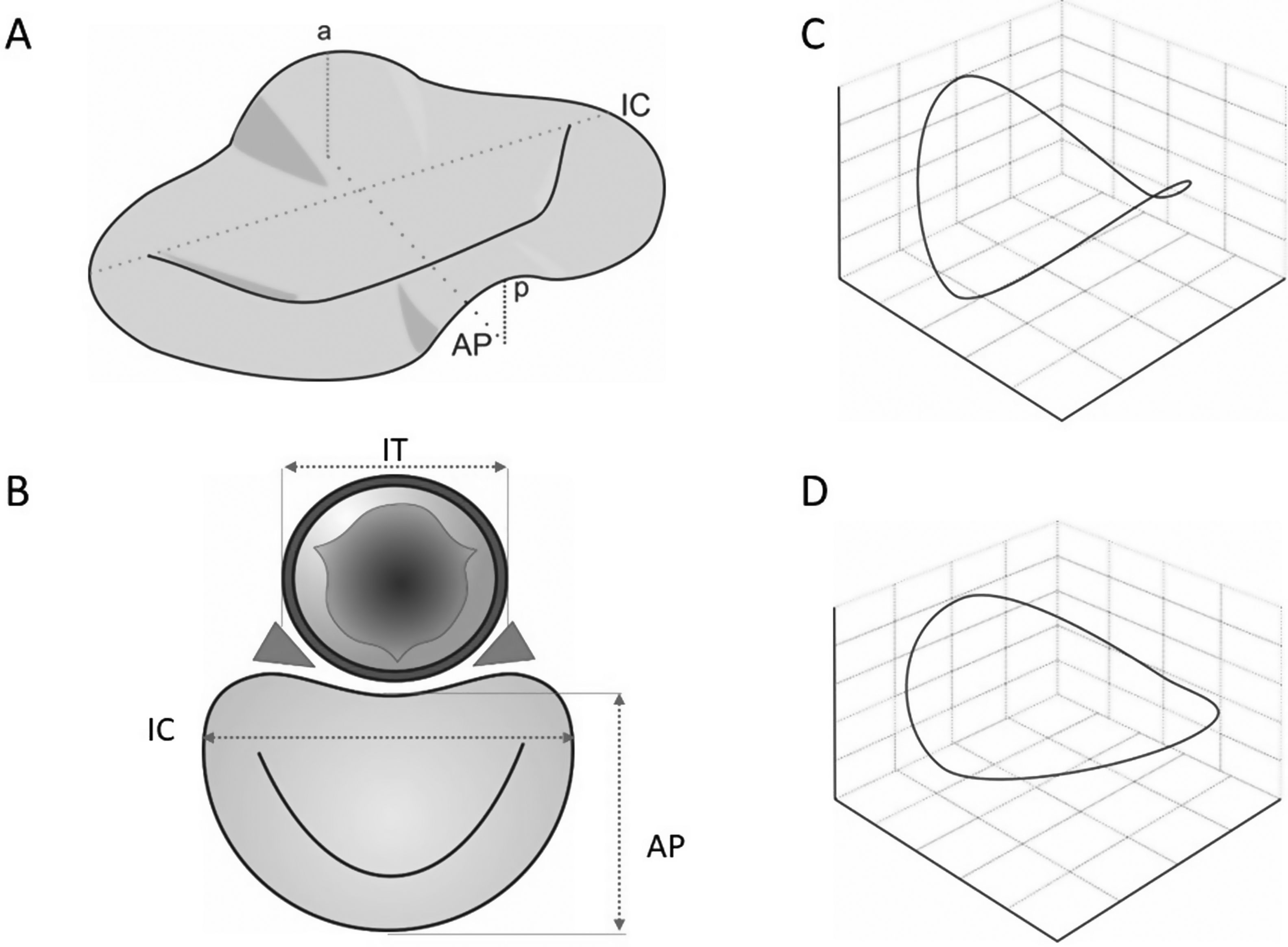
Anillo mitralEl anillo mitral se define como la intersección entre la aurícula, el ventrículo y los velos mitrales. Su proyección bidimensional tiene forma de riñón o «D». Se pueden trazar dos ejes o diámetros perpendiculares, uno longitudinal o mayor (a nivel de las comisuras) y otro altitudinal o menor. Anatómicamente el eje mayor tiene una inclinación en sentido laterosuperior-inferomedial, aunque desde el punto de vista quirúrgico, el decúbito supino del enfermo y la tracción de las estructuras hacen que este eje mayor sea prácticamente horizontal. Las mediciones por técnicas no invasivas deben realizarse en telesístole, siendo más precisas en ETE 3D y cardioTC.
El borde anterior del anillo es casi constantemente fibroso, está comprendido entre los dos trígonos del esqueleto fibroso del corazón, formando parte de este. Este borde está en íntima relación con el anillo valvular aórtico.
El borde posterior es más débil, con una delimitación más difusa de la unión auriculoventricular, entremezclándose las fibras musculares auriculares con el tejido fibroso, que es más escaso. Hay una amplia variabilidad interindividual en su contenido fibroso y extensión. Un anillo fibroso completo solamente se encuentra en menos del 10% de los individuos. Esta zona es más propicia a dilatación y calcificación (siendo el cardioTC la mejor técnica para ver esta última).
El anillo mitral tiene una conformación tridimensional similar a una silla de montar con los puntos más bajos a nivel de las comisuras (eje mayor) y los más elevados en la parte media de los velos (eje menor) (fig. 1)11. Esta conformación disminuye el estrés de los velos12. Para cumplir su función en protosístole (contracción isovolumétrica) se acorta en sentido AP (donde pueden jugar un papel las células musculares observadas en el anillo e inicio de velos), acentuando la silla de montar, acercando los velos, y disminuyendo el área valvular hasta en un 25% antes del aumento de presiones intraventriculares13–15; además de realizar un movimiento de desplazamiento apical. Los cambios en diástole son más sutiles, tiende a aplanarse y adoptar una forma más circular. En situaciones patológicas como la insuficiencia mitral (IM) isquémica, se ha observado la pérdida de esta flexibilidad, un mayor aplanamiento del anillo y falta de función esfinteriana16, así como una dilatación mayor en sentido anteroposterior respecto a otros pacientes con la misma disfunción ventricular, pero sin IM14.
Estructura y diámetros del anillo mitral. (A) Conformación en silla de montar. (C) Conformación tridimensional normal. (D) Conformación tridimensional en disfunción tipo I. a: elevación del anillo anterior.
AP: distancia antero-posterior; IC: distancia intercomisural; IT: distancia intertrigonal; p: elevación del anillo posterior. Fuente: modificado de Oliveira et al.39.
En estos procesos dinámicos participan los distintos músculos del aparato mitral (ventrículo y músculos papilares, aurícula, fibras musculares del anillo e incluso fibras de los velos y cuerdas tendinosas). Existe inervación del anillo y vasos, que se extiende hacia la porción basal de los velos.
Relaciones anatómicasDe especial interés para la cirugía y técnicas percutáneas son las relaciones del anillo valvular con las estructuras cardíacas más próximas:
- •
En la cara anterior, entre ambos trígonos se relaciona con la válvula aórtica, con el velo coronario izquierdo y el no coronariano, situándose la comisura entre ambos a nivel de la mitad del velo anterior mitral. El tejido fibroso que separa ambas estructuras es la denominada continuidad o cortina fibrosa mitroaórtica. Esta región ocupa ¼ del perímetro mitral (más estrecha que la zona intercomisural o base del velo anterior).
- •
Cerca del trígono derecho pasa el haz de His.
- •
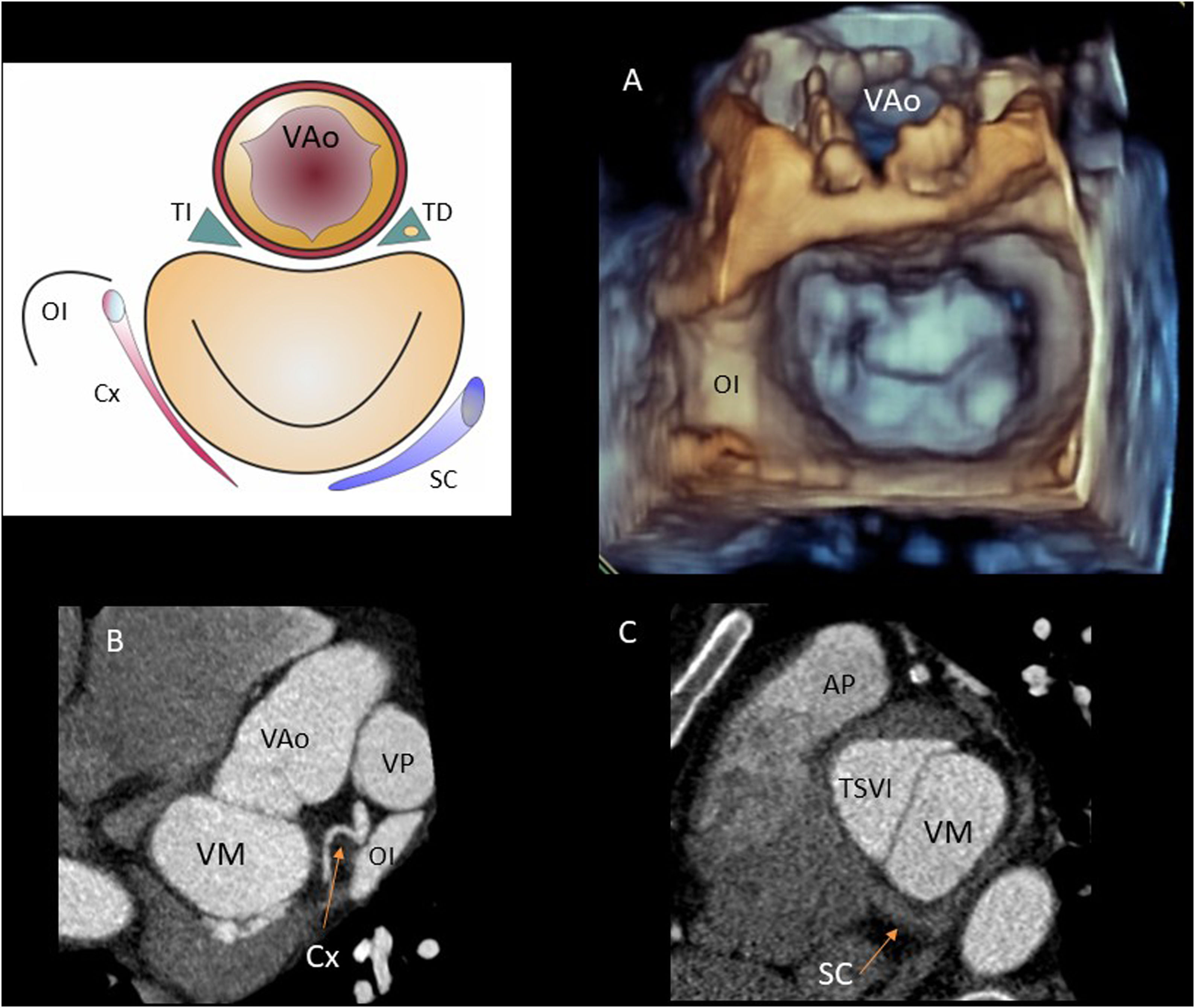
El velo posterior se encuentra en estrecha relación con el seno coronario y la arteria circunfleja. Estas estructuras son visibles en cardioTC o cardioRM. Se ha observado que el seno coronario suele estar desplazado hacia la aurícula respecto al plano del anillo mitral y que la circunfleja se interpone entre ellos en el 68-80% de los pacientes12. Esto explica que muy pocos pacientes sean candidatos favorables a anuloplastia percutánea (fig. 2).
Figura 2.Relaciones del anillo mitral. Reconstrucciones con (A) ETE 3D, (B) CardioTC a nivel de base ventricular y (C) CardioTC a nivel de seno coronario.AP: arteria pulmonar; Cx: arteria circunfleja; OI: orejuela izquierda; SC: seno coronario; TD: trígono derecho y haz de His; TI: trígono izquierdo; TSVI: tracto de salida del ventrículo izquierdo; VAo: válvula aórtica; VM: válvula mitral; VP: válvula pulmonar.
(0.51MB).
Es importante destacar que en cirugía la posición de anillo mitral se reconoce bajo visión directa, pero en cardioTC y ecocardiografía se suele incluir la cortina mitroaórtica, ya que no hay un límite claro17.
Velos valvularesLa válvula mitral consta de dos velos1 y dos festones comisurales (anterolateral y posteromedial) en su zona de unión. Estos velos son el anterior, aórtico o septal (que no es septal, ni puramente anterior por la posición oblicua de la válvula); y el velo posterior, mural o ventricular.
El velo anterior tiene forma de vela triangular, su base ocupa 1/3 del perímetro anular. Es el que realiza mayor recorrido actuando como cortina en el tracto de entrada y salida del ventrículo izquierdo, es el más largo y grueso. Es por ello que un crecimiento septal asimétrico puede crear una aceleración de la sangre con succión y tracción del velo anterior mitral por el efecto Venturi, el denominado movimiento sistólico anterior (SAM) con IM.
Al velo posterior corresponden los 2/3 restantes del perímetro, realizando un recorrido menor. Su función es la de asegurar el contacto con el velo anterior para disminuir la tensión de este a modo de airbag. De forma rectangular es más fino y flexible, adopta forma de semiluna gracias a dos indentaciones que lo dividen en tres festones. Estas indentaciones no llegan al anillo en los velos normales12. Basado en ellas, Carpentier et al.18 dividen los velos en tres trazando dos líneas desde la parte media del anillo anterior a las hendiduras entre los festones posteriores, denominándose de lateral-medial: A1-A2-A3 en el velo anterior, P1-P2-P3 en el velo posterior. Su estudio es fundamental para el diálogo entre especialistas y en la estrategia quirúrgica. Existen protocolos para su identificación en ecocardiografía transtorácica, transesofágica (2D, 3D) y cardioTC (con la mejor resolución espacial), y en cardioRM. Estas técnicas, sobre todo la ETE 3D, son especialmente útiles para el estudio de las regiones comisurales. En la degeneración fibroelástica el festón posterior medial (P2) suele ser el más afectado, siendo redundante y engrosado, mientras las cuerdas finas suelen sufrir roturas. La degeneración mixoide (Barlow), sin embargo, suele afectar a varios segmentos y ambos velos, con gran cantidad de tejido redundante; el anillo está dilatado en todos sus diámetros, aplanado y más circular, en mayor medida que la derivada de la IM, lo que indica que es parte de la afectación primaria de la enfermedad.
El área del velo posterior es igual a la del anterior5 y la suma de ambos es aproximadamente el doble del orificio valvular (relación 1,5-214), por lo que existe una amplia superficie de coaptación. La medición de los velos debe hacerse en mesodiástole, en el plano de 3 cámaras (ecocardiográfico o CT). La coaptación se mide en mesosístole, con una longitud de coaptación que debe ser mayor de 8mm y altura de coaptación (distancia de velos al plano anular) de unos 4-6mm, pudiéndose medir el área de tenting y la angulación de los velos, cuya severidad se ha correlacionado con la durabilidad en la reparación de IM funcionales19.
El implante de las cuerdas tendinosas en la cara ventricular de los velos sirve para diferenciar varias zonas:
- 1.
Zona rugosa: se distingue en ambos velos. Es la zona de anclaje de las cuerdas tendinosas y corresponde al borde de coaptación de los velos.
- 2.
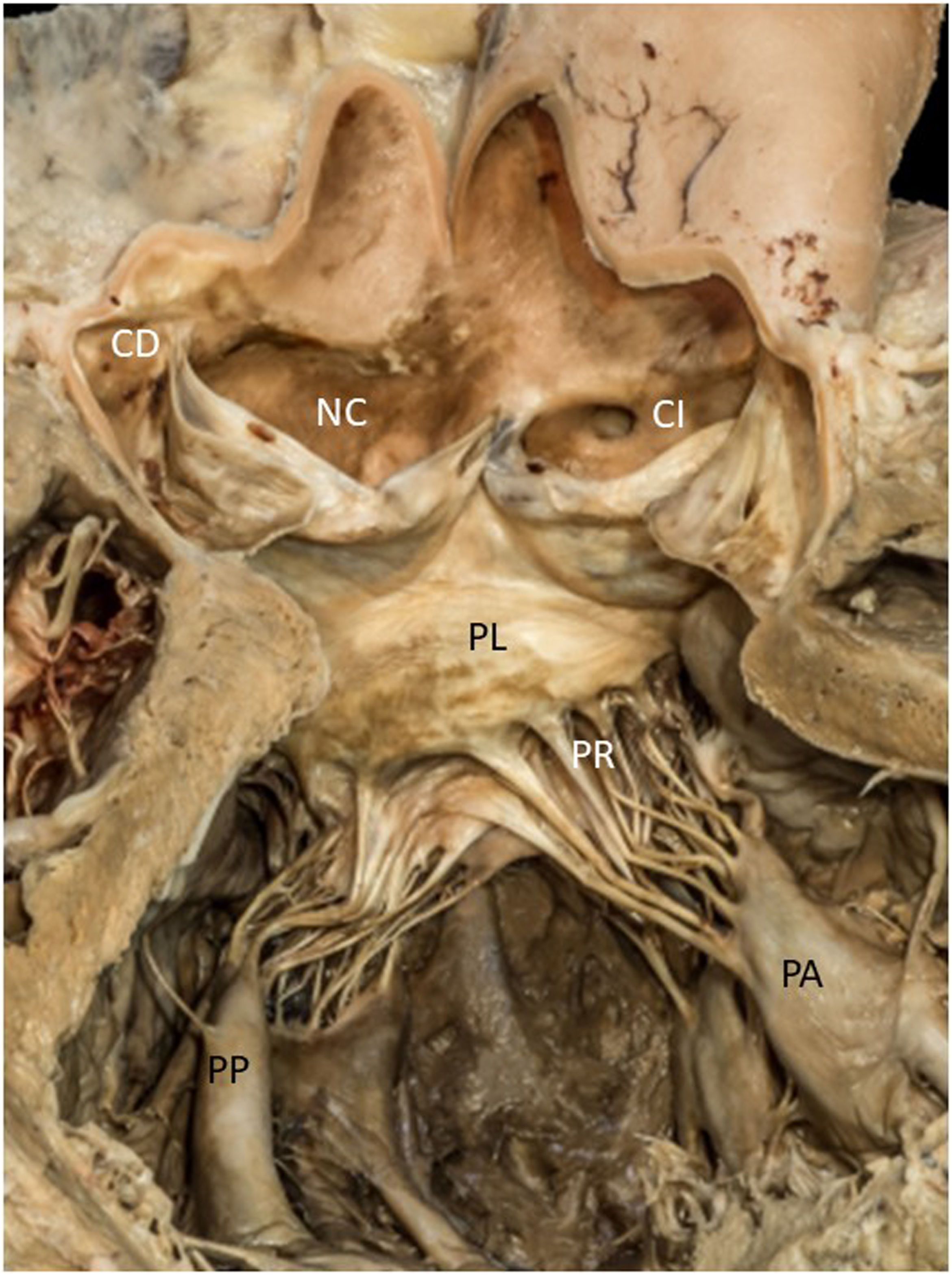
Zona lisa: libre de cuerdas, es la de mayor superficie, protruye en sístole hacia la aurícula por la presión intraventricular (fig. 3).
Figura 3.Imagen anatómica del tracto de salida ventricular izquierdo.CD: ostium coronario derecho; CI: seno coronario y ostium izquierdo; NC: seno no coronariano; PA: músculos papilares anteriores; PL: velo anterior porción lisa; PP: músculos papilares posteriores; PR: velo anterior porción rugosa. (Imagen cedida por la Faculat de Medicina, área de Anatomia y Embriologia Humana, Universitat de les Illes Balears [UIB].)
(0.58MB). - 3.
Zona basal: exclusiva del velo posterior, aquí se anclan las cuerdas basales.
Histológicamente se distinguen 4 capas de aurícula a ventrículo. La capa atrialis contiene colágeno (particularmente colágeno tipo I20 y elastina, recubierta con endotelio). La capa spongiosa es la intermedia, con menos colágeno, rica en proteínas hidrofílicas a modo de colchón; es la mayor en el borde libre y decrece hacia el anillo. La fibrosa en la cara ventricular, rica en colágeno, da estabilidad mecánica, se extiende desde el anillo a 2/3 proximales y no existe en el borde libre. La ventricularis, recubierta de células endoteliales y matriz de colágeno y elastina. El velo anterior, que soporta más carga, está compuesto en su mayoría de fibrosa. El estrés excesivo de los velos activa las células intersticiales e induce el crecimiento de los velos en las patologías que dilatan el anillo21.
La evaluación de la movilidad de los velos en la IM nos permite catalogarla según la clasificación de Carpentier22. La cuantificación se realiza mediante métodos Doppler de ecocardiografía y velocidad en la secuencia de fases de la cardioRM. La cardioTC es útil para la planimetría.
Cuerdas tendinosasLas cuerdas tendinosas son extensiones fibrosas (colágeno y elastina) del endocardio que unen los músculos papilares, o pared posterolateral del ventrículo, con los velos, actuando como tensores en el cierre valvular y sostén ventricular. Mantienen su longitud a lo largo del ciclo cardíaco (unos 20mm).
En su origen se distinguen de 4 a 22 cuerdas que luego se ramifican hasta en 5 ocasiones, por lo que alcanzan los velos entre 12 y 80 de ellas. Cada velo recibe cuerdas de ambos músculos papilares23.
Atendiendo a su forma de anclaje se han desarrollado varias clasificaciones:
- •
Clasificación de Tandler:
- ∘
Cuerdas de primer orden: se anclan en el borde libre de los velos (las más numerosas).
- ∘
Cuerdas de segundo orden: se anclan en la zona rugosa.
- ∘
Cuerdas de tercer orden: cuerdas basales de la pared libre ventricular a la zona basal del velo posterior.
- •
Clasificación de Toronto24:
- ∘
Cuerdas basales: equivalentes a primer orden de Tandler.
- ∘
Cuerdas de la zona rugosa: las del velo posterior suelen ser más cortas y gruesas. Se distinguen dos especialmente gruesas que se anclan en el velo anterior, las cuerdas estructurales, se creen vitales para la conformación ventricular (su rotura suele originar una IM severa), pueden originarse de una cabeza separada del músculo papilar.
- ∘
Cuerdas comisurales: únicas con ramificación en abanico.
- ∘
Cuerdas de cleft: exclusivas del velo posterior, son minicuerdas comisurales entre festones.
- •
Clasificación de Victor-Nayak25: distingue entre grupos posteromedial y anterolateral según procedan de uno u otro músculo papilar (dividen ambos velos por la mitad).
Funcionalmente las cuerdas de primer orden transmiten la contracción ventricular y aseguran la coaptación evitando la eversión. Las cuerdas de segundo orden, más ricas en elastina, permiten un inflado controlado de los velos que, junto con la conformación tridimensional, reducen el estrés. Las cuerdas estructurales por su parte ayudan a mantener el ángulo aórtico-mitral y la geometría ventricular. Al igual que los velos, pueden adaptarse a situaciones patológicas. Suelen elongarse en la degeneración fibroelástica y colagenopatías, y pueden sufrir retracción en las enfermedades inflamatorias como la fiebre reumática.
Músculos papilaresA diferencia de la válvula tricúspide, no hay ningún papilar desde el septo ventricular. Se originan desde los 2/3 distales de la pared libre ventricular1.
El músculo anterolateral es único en el 70-75% de los casos5, generalmente mayor y con un riego doble desde la descendente anterior y ramas de la circunfleja15,26.
El músculo posteromedial (en la pared inferior) suele ser (60%) bicéfalo o multicéfalo, con cabezas de menor tamaño e irrigadas en la mayoría de los casos por la coronaria derecha (85%) o ramas posterolaterales de la circunfleja (10-15%), lo que explica que sea el más frecuentemente implicado en la IM isquémica aguda y el riesgo de rotura sea el cuádruple que el anterior. Además, existe mucha variabilidad, sobre todo en individuos con enfermedad mixoide19. Se han establecido diversas clasificaciones con un interés más anatómico que práctico.
Funcionalmente el aparato subvalvular asegura la adecuada movilidad de los velos y la contracción de los papilares debe ser coordinada con la ventricular. Durante la protosístole la contracción ventricular genera un movimiento apical del anillo mitral que se acerca a los papilares a la vez que los velos se desplazan a la aurícula, manteniendo la distancia constante entre las cabezas de los papilares y los velos, que juntamente con la contracción anular favorecen el cierre. Posteriormente, en meso- y telesístole, la contracción de los papilares tensa las cuerdas en el momento de aumento de la presión evitando el prolapso y las desplaza ligeramente hacia atrás previniendo el movimiento sistólico anterior del velo anterior14.
En pacientes con disfunción ventricular disminuye la aproximación anular protosistólica, pero aquellos sin IM conservan la distancia entre el papilar y el anillo de forma simétrica, disminuyendo la tracción de músculos papilares y cuerdas o tethering mesosistólico. En los pacientes con IM IIIb se observa, por contra, un desplazamiento asimétrico del músculo posteromedial en mesosístole, lo que aumenta el tethering.
La cardioTC es especialmente útil en el estudio de los músculos papilares. La distancia interpapilar es marcador de dilatación ventricular.
Ventrículo izquierdoLa pared ventricular juega un papel fundamental en la coaptación valvular mitral. En la miocardiopatía dilatada idiopática o en infartos extensos anteriores, la dilatación ventricular suele ser global originando una tracción (tethering) y tenting simétrico que ocasiona una falta de coaptación central. En la cardiopatía isquémica más habitual, los procesos de remodelado ventricular de la escara originan un desplazamiento asimétrico y tracción lateral con una fuga generalmente a nivel de P327.
Imagen multimodal en los procedimientos mitrales transcatéter: anatomía aplicada a la clínicaEn lo que respecta a la válvula mitral, la imagen cardiovascular multimodal es parte clave de los procedimientos intervencionistas, tanto en la reparación percutánea borde a borde (que remeda a la técnica de Alfieri) como en el reemplazo de válvula mitral transcatéter (RVMT), técnica esta última sobre la que nos centraremos para explicar, en base a nuestra experiencia, los elementos clave de la imagen para la planificación y éxito de los procedimientos.
El RVMT representa actualmente una opción terapéutica para pacientes inoperables o de muy alto riesgo (indicación IIb en las guías europeas), cuando en estos pacientes la reparación percutánea borde a borde no sea posible28. Los diferentes escenarios clínicos donde actualmente podemos plantear esta alternativa terapéutica son cuatro: degeneración de bioprótesis previamente implantada, que conocemos como valve-in-valve (ViV); fallo de una reparación quirúrgica previa, que conocemos como valve-in-ring (ViR); pacientes con muy severa calcificación anular, que conocemos como valve-in-MAC (ViMAC); y por último en pacientes inoperables o de muy alto riesgo, sobre válvula nativa sin MAC29.
Sabemos, por la experiencia acumulada recogida en distintos estudios observacionales, que debido a su mayor complejidad técnica y peor sellado en la zona de anclado de la prótesis, los resultados del ViR y ViMAC son peores (respecto a IM residual y mortalidad) cuando los comparamos con el ViV mitral, que es la indicación de RVMT que se encuentra más establecida y con la que se ha acumulado más experiencia internacionalmente29.
En el registro multicéntrico publicado por Yoon et al. se incluyen 521 pacientes de alto riesgo quirúrgico sometidos a RVMT, siendo 322 ViV, 141 ViR y 58 ViMAC. En el 90% de los casos se empleó la prótesis Edwards Sapien (Edwards Lifesciencies; Irvine, California, Estados Unidos), siendo el abordaje transapical en el 60% de los pacientes y transeptal en el 40%. Se vio que, a los 30 días, hubo IM significativa residual más frecuente en ViR (18,5%) y ViMAC (13,8%) con respecto al ViV (5,6%); lo que se relaciona con un peor sellado en la zona de anclaje de la prótesis cuando no hay una prótesis biológica previa. Además, la mortalidad a un año fue más alta en el ViMAC (62,8%), reflejo de pacientes con mayor comorbilidad, en particular renal, con respecto a los procedimientos de ViR (mortalidad a un año 30,6%) y ViV (donde se obtienen los mejores resultados: mortalidad a un año 14%)30. Sin embargo, la experiencia reciente con la prótesis específicamente diseñada para posición mitral Tendyne (Abbott Vascular, Roseville, Minnesota) ha mostrado unos resultados superiores tanto en anatomía nativa como en ViMAC, teniendo en cuenta que se trata de pacientes y centros altamente seleccionados. Por ello, en el momento actual el ViMAC se plantea de forma altamente selectiva, mientras aumenta la experiencia y a la espera de resultados de registros como el Tender con la prótesis Tendyne31.
Nuestra experiencia como departamento con el RVMT, en línea con la mayor parte de la experiencia acumulada internacionalmente y publicada en la bibliografía, es con la prótesis Sapien 3 (Edwards Lifesciencies; Irvine, California, Estados Unidos)29. Establecemos el acceso transapical a través de una minitoracotomía anterior izquierda, de forma similar a otros procedimientos transcatéter como la TAVI aórtica, cuya experiencia acumulada nos facilita la optimización de resultados. La prótesis se avanza a través del orificio mitral, apoyada en una guía de alto soporte alojada en una vena pulmonar, empleando la proyección del arco de radioscopia perpendicular al plano anular, así como la guía con ecocardiografía transesofágica (ETE) que nos muestra la posición y profundidad de la prótesis, y nos guía su navegación para evitar la posibilidad de traccionar inadvertidamente del aparato subvalvular mitral, algo que no podemos valorar únicamente con la radioscopia.
El objetivo cuando empleamos para el RVMT la prótesis Sapien 3 (diseñada para posición aórtica) es posicionar el 20-30% de la altura de la misma en posición auricular, y el 70-80% en el ventrículo izquierdo. De este modo, la falda externa de la prótesis queda ajustada justo por encima de la zona de anclado, evitando la IM residual por fuga periprotésica. De forma general, podemos afirmar que, si tendemos a posicionarla más hacia la aurícula, tendremos menos riesgo de obstrucción del tracto de salida del ventrículo izquierdo (OTSVI) a costa de una peor hemodinámica y peor sellado; y de forma inversa, si la posicionamos más hacia ventricular, aumentamos el riesgo de obstrucción de tracto, pero aseguramos una mejor hemodinámica. El ajuste fino de la posición de la prótesis previo a la expansión es guiado mediante la ETE intraoperatoria, aunque debe ser planeado previamente de forma individualizada, en función del escenario clínico, ya que no será lo mismo un ViR sobre un anillo rígido que una ViV donde no tenemos velo anterior, y de la anatomía de cada paciente según la TC29.
Aspectos más relevantes de la imagen en el RVMTAdemás de la ecocardiografía transtorácica, los pilares son el ecocardiograma transesofágico (ETE) y la tomografía computarizada con contraste y sincronización cardíaca.
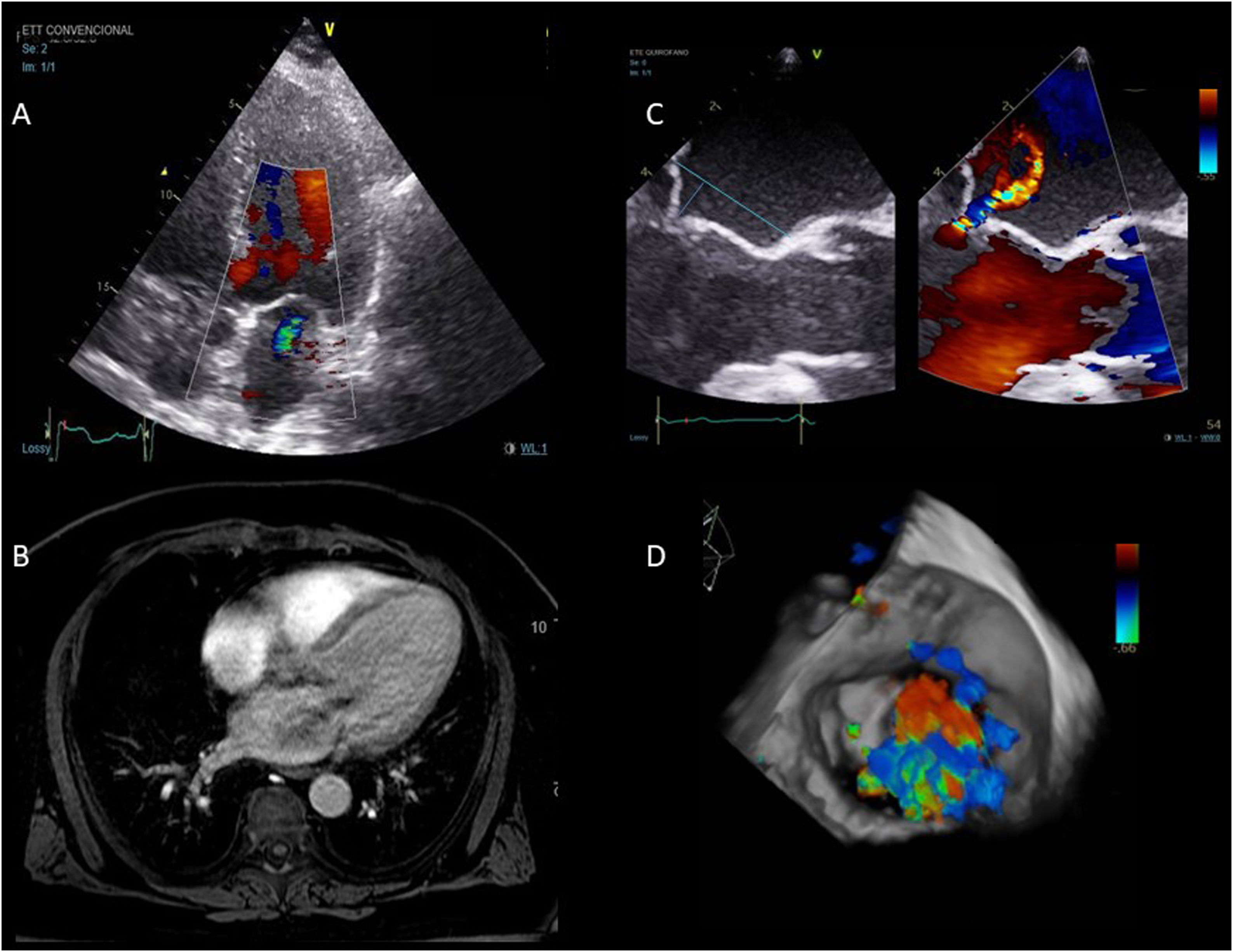
Durante el procedimiento de implante, la ETE (junto con la imagen de radioscopia) es la guía del cirujano, proporcionando información constante sobre la posición de guías, prótesis, posición relativa de esta con respecto al plano de anclado de la prótesis, etc. Una vez hecho el implante nos da la valoración inmediata de gradientes, posible fuga periprotésica o presencia de obstrucción del tracto de salida. Utilizamos habitualmente dos imágenes ortogonales para la navegación y posicionamiento, así como la reconstrucción 3D para la posición de la prótesis y la valoración tras la expansión de la misma, además por supuesto del Doppler y el Doppler color para valoración de gradientes, tracto de salida y evaluar la posibilidad de fugas periprotésicas.
La TC (con contraste y sincronización) es el estudio esencial y condición sine qua non para la indicación y planificación de la RVMT. Los puntos más importantes a considerar son:
- -
Caracterización de los velos: altura, presencia de calcificación, relación del velo anterior-septo interventricular.
- -
Caracterización del anillo mitral: área, perímetro, diámetros, distancia intertrigonal, calcificación del anillo (tipo, distribución, severidad).
- -
Caracterización del tracto de salida: ángulo entre los planos mitral y aórtico, área en sístole y diástole; y el más importante es la estimación del «neo-tracto de salida» tras el implante virtual.
- -
Otros datos importantes: identificación del punto óptimo para el acceso intercostal, el ángulo de entrada, el punto óptimo punción en el ápex, así como la proyección adecuada del arco de radioscopia32.
Como se ha mencionado, una de las complicaciones más graves del RVMT es la aparición de una OTSVI, debida al desplazamiento del velo anterior mitral hacia el septo interventricular de forma permanente por la prótesis, creando un «neo-tracto de salida» más estrecho y alargado, lo cual genera una estenosis subaórtica aguda y permanente. Por ello, es menor el riesgo en caso del ViV con respecto al ViR o ViMAC, aunque es posible que se genere OTSVI en un procedimiento de ViV en pacientes con un tracto de salida nativo muy pequeño y/o un ángulo o cavidad ventricular desfavorables, ya que la parte no recubierta del stent de la prótesis transcatéter quedará cubierta por los velos de la bioprótesis previa32.
La OTSVI puede dar lugar a un colapso hemodinámico inmediato, frecuentemente irreversible y con muy alta mortalidad. Se ha comunicado una incidencia en torno al 8-10% de los implantes, siendo más frecuente en el VIMAC y reduciéndose con la experiencia acumulada del equipo, la selección del paciente y la planificación meticulosa.
Los factores asociados a la OTSVI son múltiples, siendo los más relevantes: la presencia de un ventrículo izquierdo pequeño (DTD<48mm) o hipertrófico (masa indexada >105g/m2), la función ventricular preservada, un velo mitral anterior alargado (>25mm), engrosado o con una calcificación severa, la hipertrofia septal (>15mm o una distancia del septo interventricular al anillo mitral <17,8mm), la presencia de un ángulo <110° entre los planos mitroaórtico, o la calcificación severa del aparato subvalvular mitral33.
Predecir y prevenir la OTSVI es parte clave de la planificación preoperatoria de los procedimientos de RVMT, y la mejor herramienta para ello es el «implante virtual» mediante el procesado en un software específico como puede ser el 3mensio Mitral Valve (Pie Medical Imaging BV, Maastricht, Holanda) de la TC del paciente. Con este implante virtual, vemos cómo quedará el «neo-tracto de salida» del ventrículo izquierdo (la zona más estrecha entre la prótesis virtual y el septo interventricular en meso/telesístole); si esta área es <200mm2, existe riesgo significativo. Un área <170mm2 se ha asociado a OTSVI de manera altamente sensible y específica32,33.
Se han descrito intervenciones previas al implante para reducir la probabilidad de OTSVI en pacientes con alto riesgo, como la ablación septal con alcohol o la técnica LAMPOON (laceración con catéteres de radiofrecuencia del velo anterior para dividirlo)34.
Los datos de imagen multimodal que necesitamos de forma más específica, según el tipo de procedimiento a planificar son, a modo de resumen, los siguientes29,32:
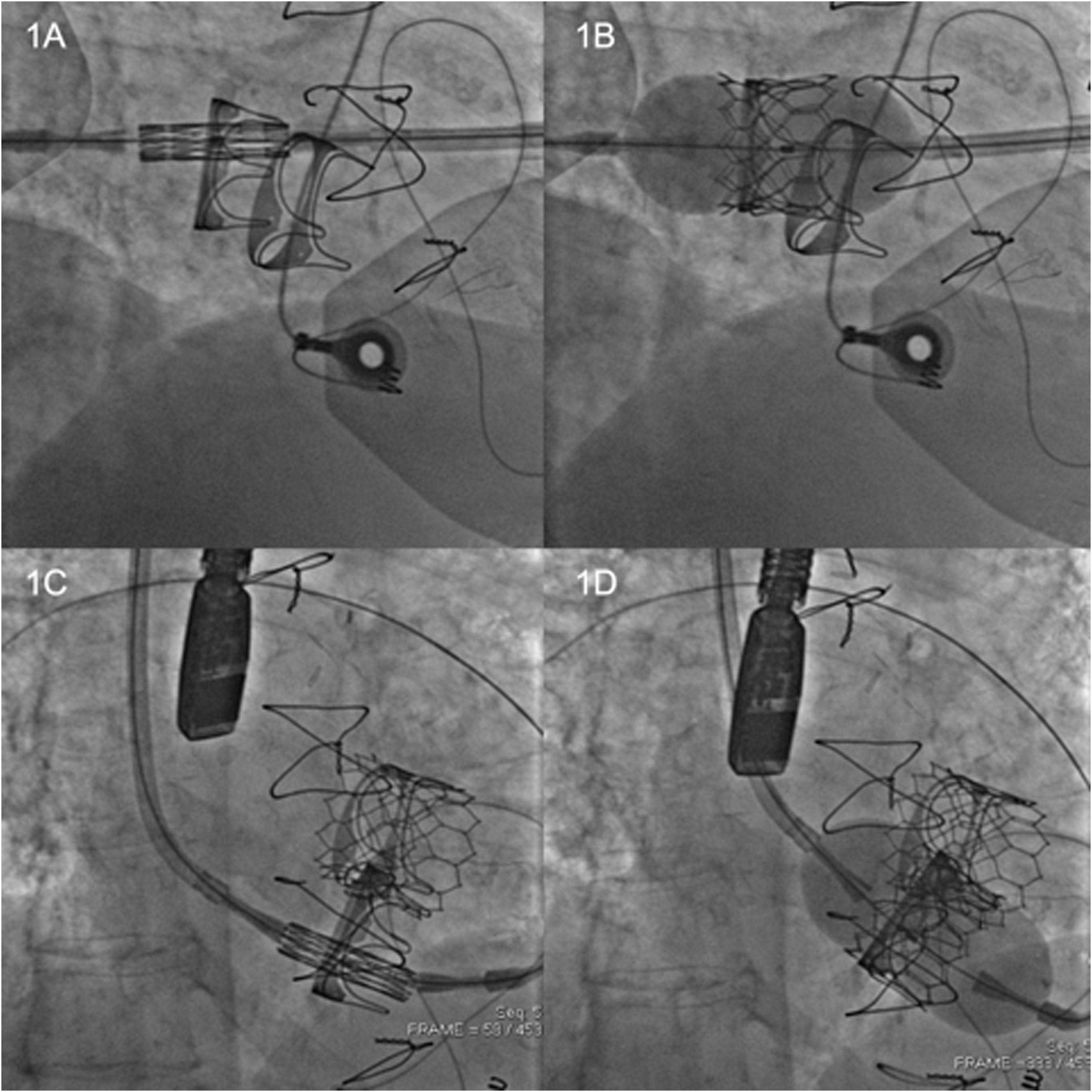
Para el ViV: tipo y tamaño de la prótesis implantada (si no disponemos de datos de la intervención previa nos puede ayudar la TC, aunque se debe considerar que el diámetro interno medido será menor que el real debido a la propia degeneración estructural de la bioprótesis) para guiar la selección del tamaño de la prótesis a implantar; y para la decisión de qué prótesis transcatéter emplear, nos podemos ayudar de la información recogida en la aplicación multiplataforma Valve in Valve desarrollada por Bapat35. También es de ayuda conocer el tipo de stent de la bioprótesis, para definir las referencias de radioscopia para el posicionamiento y anclado de la prótesis transcatéter. Otros parámetros, como el grado y morfología de la calcificación de los velos degenerados, o la presencia de pannus, que identificaremos con el ETE o TC, han de ser también tenidos en cuenta para la selección de la prótesis y detalles del implante como el volumen de inflado del balón o la eventual necesidad de una valvuloplastia previa. En la figura 4 podemos ver la secuencia de posición e inflado en un doble caso de ViV mitral y tricúspide que realizamos en nuestro centro hace 3 años, con buen resultado angiográfico y clínico36.
Para el ViR: el tipo y tamaño del anillo, si se trata de un anillo rígido o flexible, el tamaño del velo anterior, el cálculo del «neo-tracto de salida» del ventrículo izquierdo, así como la presencia y grado de calcificación de los velos. Las bandas o anillos incompletos tienen más riesgo de fuga paravalvular o embolización de la prótesis por peor sellado. Los anillos rígidos, en general empleados en la IM funcional, no se adaptan a la morfología de la prótesis transcatéter adecuadamente, lo que se asocia a una mayor incidencia de fuga paravalvular o central, así como a gradientes aumentados. El escenario más favorable para el ViR son los anillos semirígidos a partir de 27-28mm.
Para el ViMAC: en este caso la evaluación es más compleja y requiere mayor experiencia para indicar el implante. La valoración de la calcificación incluye su distribución, intensidad y características de dureza. La calcificación limitada focal contraindica el procedimiento. Se recomienda la presencia de calcificación posterior y al menos en la zona de las comisuras (algunos autores recomiendan una calcificación de al menos 270°) para asegurar un buen anclado y sellado de la prótesis; así, la calcificación del anillo anterior no es imprescindible. La intensidad de la calcificación determinará el sobredimensionado de la prótesis, siendo mayor a menos intensidad de calcificación, situación donde también podemos aumentar el llenado del balón 2 a 3mL para forzar una mayor apertura. Se ha propuesto un score para evaluar el riesgo de embolización durante el procedimiento según la severidad de la calcificación37.
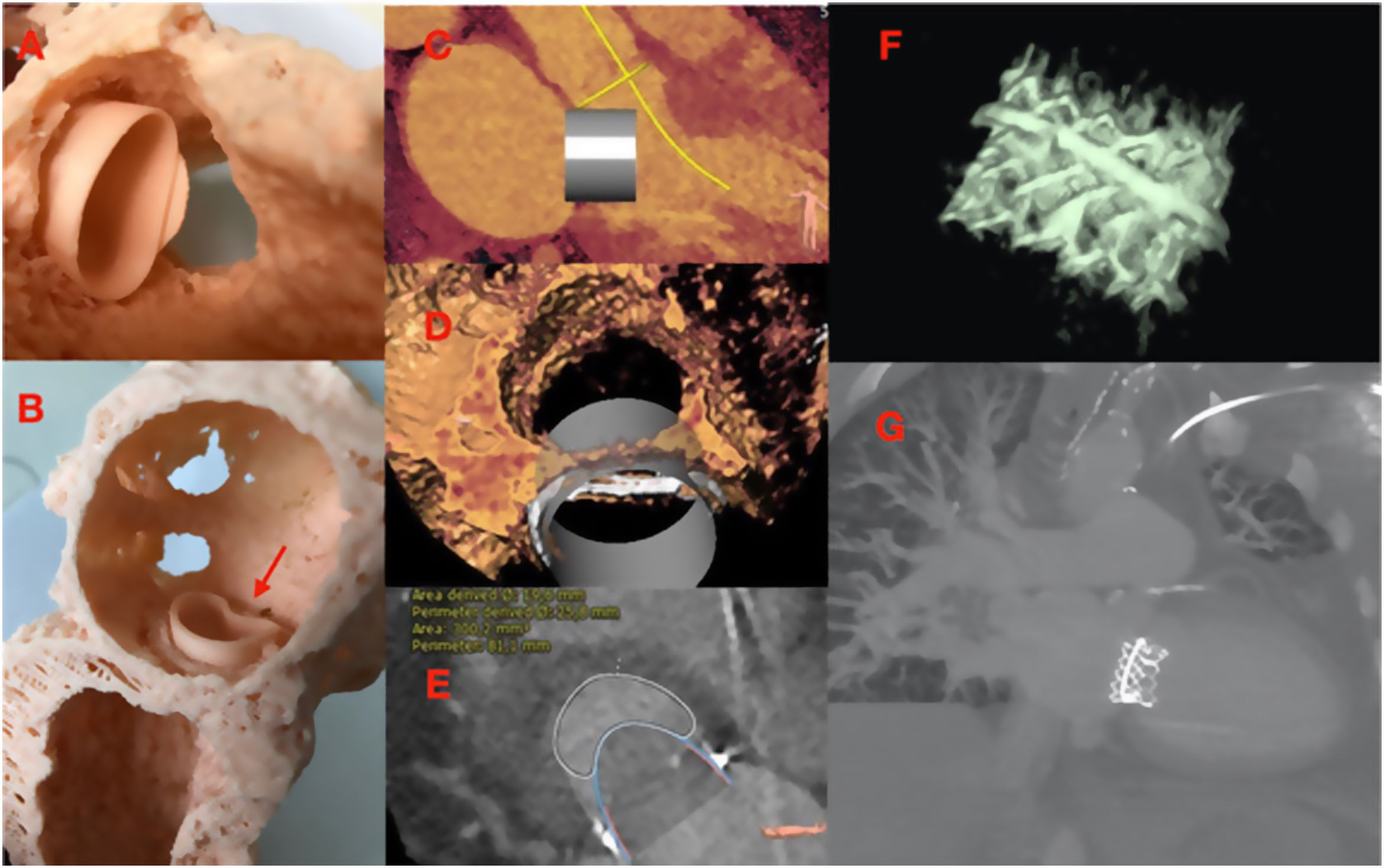
Otra herramienta que podemos emplear en la selección y planificación del implante es el uso de la impresión de modelos 3D a partir de los datos de TC38. Con esta técnica conseguimos una réplica física de la anatomía cardíaca del paciente, más directa y realista de la misma, valorando de forma real el anclado, las zonas de contacto en MAC, la OTSVI, la expansión o posibles zonas de fuga paravalvular. Cuando generamos el modelo tridimensional con el software de segmentación, podemos truncar la aorta y/o parte de la cavidad ventricular, conservando el anillo mitral y el tracto de salida, para así poder valorar mejor las relaciones anatómicas, y ayudándonos de modelos impresos de las prótesis a emplear (utilizando las medidas del fabricante), valorar el impacto que tanto los distintos tamaños posibles como la posición final de la prótesis puedan tener sobe el riesgo de OTSVI, en particular en pacientes con características anatómicas de dificultad. Además, nos puede servir para formación y entrenamiento de todo el personal del equipo y para mejorar la explicación del procedimiento al paciente. En nuestro centro tenemos la fortuna de disponer de un departamento de simulación con el equipamiento de segmentación e impresión adecuados y con personal entrenado en su manejo, con lo que podemos obtener modelos muy fieles a la anatomía real del paciente, como en el caso de la figura, que se trataba de un ViR sobre un anillo rígido IMR (Edwards Lifesciences; Irvine, California, Estados Unidos) en el que disponer del modelo con réplicas de diferentes tamaños de la prótesis nos ayudó en la planificación de un caso poco favorable de ViR sobre anillo rígido Edwards IMR 28mm (fig. 5).
Neo-TSVI en modelo 3D a partir de la TC con modelo de Sapien 3 23mm y velo anterior (A). Mismo modelo 3D con la prótesis infraexpandida en anillo rígido IMR 28mm (B). Neo-TSVI en software específico 3-mensio (C). Neo-TSVI en 3-mensio visto desde la aorta (D). Cálculo del área Neo-TSVI con 3-mensio; bajo riesgo de OTSVI (E). Imágenes reconstruidas en TAC de control postoperatorio con la prótesis normofuncionante bien posicionada (F y G).
La válvula mitral no es una estructura única sino un conjunto de elementos interrelacionados que forman parte del aparato valvular mitral, estrechamente relacionado en la base cardíaca con el denominado esqueleto fibroso del corazón. Debemos conocer la interdependencia de los distintos elementos valvulares con vistas al tratamiento quirúrgico, ya sea reparador o de sustitución valvular, procurando mantener el complejo mitral lo más intacto posible.
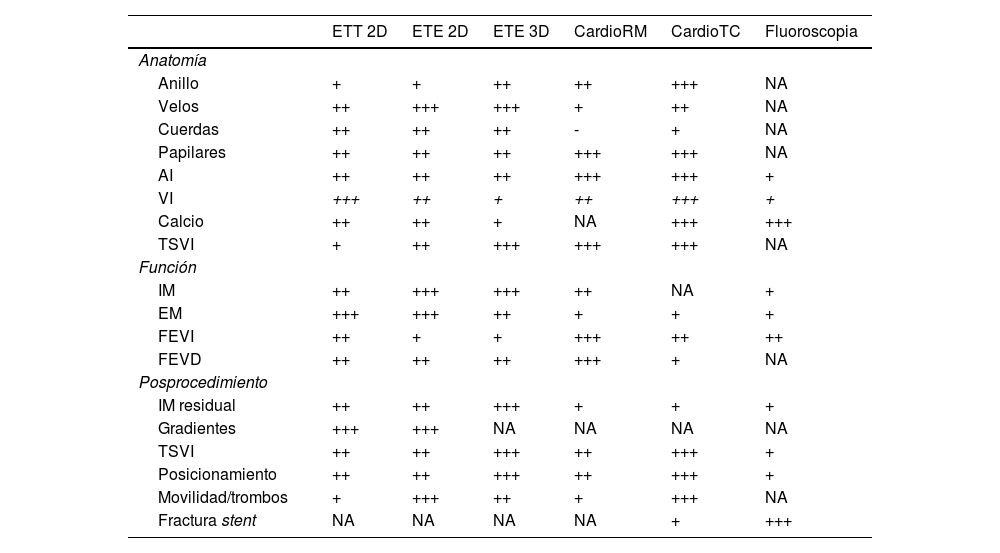
Las técnicas de imagen cardiovascular multimodal deben aportarnos información sobre la etiología, el proceso lesional y el tipo de disfunción (tabla 1). Son clave en la selección de pacientes y la planificación de los procedimientos (y en el RVMT, imprescindibles). En líneas generales los índices morfológicos valvulares nos van a orientar respecto de la reparabilidad en la patología mitral orgánica, y los índices geométricos, de la severidad y reparabilidad en la patología funcional.
Utilidad de las distintas técnicas de imagen multimodal
| ETT 2D | ETE 2D | ETE 3D | CardioRM | CardioTC | Fluoroscopia | |
|---|---|---|---|---|---|---|
| Anatomía | ||||||
| Anillo | + | + | ++ | ++ | +++ | NA |
| Velos | ++ | +++ | +++ | + | ++ | NA |
| Cuerdas | ++ | ++ | ++ | - | + | NA |
| Papilares | ++ | ++ | ++ | +++ | +++ | NA |
| AI | ++ | ++ | ++ | +++ | +++ | + |
| VI | +++ | ++ | + | ++ | +++ | + |
| Calcio | ++ | ++ | + | NA | +++ | +++ |
| TSVI | + | ++ | +++ | +++ | +++ | NA |
| Función | ||||||
| IM | ++ | +++ | +++ | ++ | NA | + |
| EM | +++ | +++ | ++ | + | + | + |
| FEVI | ++ | + | + | +++ | ++ | ++ |
| FEVD | ++ | ++ | ++ | +++ | + | NA |
| Posprocedimiento | ||||||
| IM residual | ++ | ++ | +++ | + | + | + |
| Gradientes | +++ | +++ | NA | NA | NA | NA |
| TSVI | ++ | ++ | +++ | ++ | +++ | + |
| Posicionamiento | ++ | ++ | +++ | ++ | +++ | + |
| Movilidad/trombos | + | +++ | ++ | + | +++ | NA |
| Fractura stent | NA | NA | NA | NA | + | +++ |
La ecocardiografía continúa siendo la técnica de elección para conocer la anatomía y función de la válvula mitral. La ecocardiografía 3D aporta información adicional, en especial de los segmentos y anillo, pero es dependiente de la calidad de la imagen 2D y tiene menor resolución temporo-espacial que ella. La TC tiene una excelente resolución para el estudio morfológico valvular, subvalvular, las coronarias y estructuras torácicas para la planificación quirúrgica; pero expone al paciente a radiaciones ionizantes y contraste iodado. La cardioRM es útil en la evaluación del funcionamiento mitral (sobre todo cuando existe mala ventana acústica), la función ventricular, y las estructuras que rodean el anillo (junto con la TC); pero tiene baja resolución espacial para el estudio morfológico y requiere de experiencia del operador (fig. 6).
Nos podemos ayudar también, si disponemos de la tecnología, de la impresión de modelos 3D para la planificación y entrenamiento del equipo. Aunque existen situaciones que pueden contraindicar el ViV en bioprótesis degeneradas, es poco frecuente, y donde más meticulosos debemos ser y más pacientes no candidatos vamos a encontrar, es en los procedimientos de ViMAC y en menor medida en los ViR.
Conflicto de interesesNo hay conflicto de intereses.
AgradecimientosAgradecimiento especial por proporcionar el excelente material audiovisual a Dra. Laura Vidal (Servicio de Cirugía Cardíaca del HUSE), Dra. Rosa González (Servicio de Cardiología HUSE), Dr. Leandro Brogi (Centro de Simulación y Unidad 3D HUSD) y Sr. Mariano Izquierdo (Facultad de Medicina UIB).







![Imagen anatómica del tracto de salida ventricular izquierdo.CD: ostium coronario derecho; CI: seno coronario y ostium izquierdo; NC: seno no coronariano; PA: músculos papilares anteriores; PL: velo anterior porción lisa; PP: músculos papilares posteriores; PR: velo anterior porción rugosa. (Imagen cedida por la Faculat de Medicina, área de Anatomia y Embriologia Humana, Universitat de les Illes Balears [UIB].) Imagen anatómica del tracto de salida ventricular izquierdo.CD: ostium coronario derecho; CI: seno coronario y ostium izquierdo; NC: seno no coronariano; PA: músculos papilares anteriores; PL: velo anterior porción lisa; PP: músculos papilares posteriores; PR: velo anterior porción rugosa. (Imagen cedida por la Faculat de Medicina, área de Anatomia y Embriologia Humana, Universitat de les Illes Balears [UIB].)](https://static.elsevier.es/multimedia/11340096/00000030000000S1/v1_202308100556/S113400962300044X/v1_202308100556/es/main.assets/thumbnail/gr3.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)




