La insuficiencia mitral (IM) isquémica crónica es una patología frecuente y compleja, consecuencia del remodelado ventricular y anular mitral asimétrico que acontece tras el infarto de miocardio. El anillo protésico Carpentier-McCarthy-Adams IMR ETlogix® (Edwards Lifesciences Corporation) actúa específicamente sobre esta deformación geométrica. Analizamos nuestros resultados tras 10 años realizando esta técnica.
MétodosNoventa pacientes con IM isquémica crónica grado ≥ 2 fueron sometidos consecutivamente a anuloplastia mitral con anillo IMR ETlogix® desde 2005 hasta 2015; 75 (83,3%) presentaban clase funcional NYHA III-IV. Sesenta y seis (73,3%) fueron intervenidos con carácter urgente. En 73 (81,1%) asociamos otro procedimiento cardíaco. Obtuvimos seguimiento clínico y ecocardiográfico periódico de todos los pacientes que superaron la cirugía.
ResultadosMediana de seguimiento 62 meses (12-129). Mortalidad hospitalaria de 1 paciente (1,1%); 16 pacientes fallecidos en el seguimiento (7 de causa cardíaca). El ecocardiograma de control tardío objetivó recidiva significativa (IM grado ≥ 2) en 6 pacientes (2 de ellos IM grado>2), con una reintervención por dehiscencia anular. No hubo incremento significativo en el gradiente medio transmitral. El análisis univariado objetivó la altura de tenting preoperatoria como mejor predictor de recidiva de la IM en nuestra serie, con un punto de corte en 10,65mm (sensibilidad 100%, especificidad 93%, área bajo la curva ROC 0,97).
ConclusionesLa anuloplastia con anillo IMR ETlogix® es una técnica segura y eficaz para corregir la IM isquémica crónica, fundamentalmente en pacientes con una altura de tenting preoperatoria inferior a 10,65mm.
Chronic ischaemic mitral regurgitation (IMR) is a frequent and complex condition, resulting from ventricular and asymmetric mitral annular remodelling after myocardial infarction. The Carpentier-McCarthy-Adams IMR ETlogix Annuloplasty Ring (Edwards Lifesciences Corporation) acts specifically on this geometric deformation. An analysis is presented of our results after ten years performing this procedure.
MethodsA prospective study was conducted on 90 patients with chronic IMR grade ≥ 2, who consecutively underwent annuloplasty with IMR ETlogix® ring from 2005 to 2015. The majority (75, 83.3%) of patients were in NYHA functional class iii-iv. Urgent surgery was performed on 66 (73.3%) patients. Another associated procedure was performed on 73 cases (81.1%). All patients completed follow-up.
ResultsThe median follow-up was 62 months (12-129). In-hospital mortality was 1.1% (1 patient). There were 16 deaths during follow-up, of which, 37.5% (n=7) were cardiac-related. Recurrence of significant mitral regurgitation was observed in 6 patients. There was one annular dehiscence that required re-operation. There was no significant increase in average trans-mitral gradient. In the univariate analysis, it was found that the pre-operative tenting height was the best predictor of mitral regurgitation recurrence in our series, with a cut-off value of 10.65mm (sensitivity 100%, specificity 93%, and area under the ROC curve 0.97).
ConclusionsSurgical repair of chronic IMR with the asymmetric IMR ETlogix annuloplasty ring is a safe and effective technique. In our experience, it provides good clinical and echocardiographic medium-long term outcomes, mainly in patients with a pre-operative tenting height less than 10.65mm.
La insuficiencia mitral (IM) isquémica crónica (IMIC) es una patología ventricular, que se produce como consecuencia del remodelado ventricular y los cambios en el aparato subvalvular postinfarto, en presencia de una válvula mitral estructuralmente normal, implicando una historia natural de mal pronóstico1. Debe diferenciarse de la regurgitación mitral de otra etiología en que la enfermedad coronaria es un hallazgo concomitante y de la IM de causa isquémica que se presenta en la fase aguda del infarto de miocardio tras la rotura del músculo papilar, de pronóstico muy grave y que requiere cirugía emergente2.
La IMIC aparece en un 20-30% de los pacientes que presentan infarto de miocardio. Aproximadamente un tercio presentan una regurgitación al menos moderada3,4. La IMIC tras el infarto de miocardio acorta la supervivencia y empeora la clase funcional de los pacientes con respecto a los que presentan enfermedad coronaria sin IMIC2,3,5-8, incluso en aquellos en que la IMIC es ligera4,6,9.
Estudios recientes con ecocardiografía tridimensional revelan que el patrón de dilatación anular y el tethering de los velos mitrales son asimétricos en estos pacientes, predominando en el aspecto medial10,11, llevando al desarrollo del anillo protésico Carpentier-McCarthy-Adams IMR ETlogix® (Edwards Lifesciences, Irvine, CA, EE. UU.), que actúa no solo sobre la dilatación anular, sino también sobre la asimetría y la angulación de los segmentos P2 y P3. Comparado con los anillos simétricos convencionales, este dispositivo aumenta la coaptación de los velos gracias a una marcada reducción del diámetro anteroposterior1.
Nuestra experiencia inicial con este anillo protésico en pacientes con IMIC presentó resultados prometedores a corto y medio plazo12. En la actualidad contamos con una serie más amplia y un mayor tiempo de seguimiento. Analizamos los resultados clínicos y ecocardiográficos a largo plazo e identificamos posibles factores predictores de recidiva de la regurgitación en nuestra serie.
MétodosPacientesEstudiamos prospectivamente a 90 pacientes con IMIC intervenidos consecutivamente en nuestro centro mediante anuloplastia con anillo mitral protésico Carpentier-McCarthy-Adams IMR ETlogix desde junio del 2005 hasta febrero del 2015. Mediante un registro informático se recogieron los datos desde el comienzo de la serie.
Estudio ecocardiográficoLos pacientes fueron sometidos a un ecocardiograma transtorácico (ETT) preoperatorio 2D, confirmándose en la totalidad de casos un mecanismo de la IM III B de la clasificación funcional de Carpentier; 21 pacientes (23,3%) presentaron también dilatación anular (mecanismo i+iii B). El ETT basal cuantificó el grado de regurgitación, siguiendo las recomendaciones de la Sociedad Europea de Ecocardiografía13,14, y analizó la geometría del aparato valvular mitral (diámetro anteroposterior del anillo, altura de tenting [distancia mínima entre el punto de coaptación de los velos y el plano anular] y área de tenting [superficie formada por el plano del anillo y ambos velos mitrales al cierre], obtenidas ambas en mesosístole en el plano paraesternal eje largo). La localización y la extensión de la disfunción ventricular global y segmentaria se analizaron en los planos habituales (paraesternal eje largo y eje corto y apical 2, 3 y 4 cámaras). El remodelado ventricular global se cuantificó mediante los volúmenes ventriculares. Tanto la fracción de eyección ventricular izquierda (FEVI) como los volúmenes ventriculares (telesistólico y telediastólico) fueron calculados mediante el método biplanar de Simpson. Se realizó la medición de la longitud del velo anterior mitral (A2) en el plano paraesternal eje largo.
Se realizó ecocardiografía transesofágica (ETE) intraoperatoria a todos los pacientes. Desde el año 2009 disponemos sistemáticamente de ecocardiografía 3D intraoperatoria, que aporta información adicional acerca de la anatomía valvular mitral. La ETE postoperatoria evaluó el resultado de la reparación intraoperatoriamente.
CirugíaEn todos los casos se realizó mediante esternotomía media, bajo circulación extracorpórea. El abordaje mitral fue en un 92% de los casos a través de auriculotomía izquierda estándar y en el 8% restante mediante auriculotomía derecha y abordaje transeptal. La exploración intraoperatoria de la válvula mitral confirmó los hallazgos ecocardiográficos en todos los casos. El anillo protésico Carpentier-McCarthy-Adams IMR ETlogix® se implantó mediante la técnica descrita por Filsoufi et al.1. El tamaño del anillo a implantar se decidió conjuntamente con la medición intraoperatoria habitual de la distancia intercomisural y la superficie del velo anterior mediante el medidor Carpentier Edwards, y la medición ecocardiográfica preoperatoria de la longitud del velo anterior mitral.
En los casos de cirugía de revascularización coronaria concomitante, el injerto de elección fue la doble arteria mamaria interna esqueletizada según técnica de Tector15.
Seguimiento postoperatorioLa morbimortalidad hospitalaria y durante el seguimiento se expresó siguiendo las recomendaciones de las guías de reporte de morbimortalidad tras cirugía cardíaca valvular16.
Todos los pacientes recibieron antiagregación oral con 100mg de ácido acetilsalicílico y anticoagulación oral con Sintrom® (INR 2,5-3,5) desde el segundo día postoperatorio, salvo aquellos que presentaron sangrado excesivo perioperatorio, en cuyo caso se individualizó el momento de inicio. La anticoagulación se mantuvo durante 3 meses, tras los cuales se suspendió en aquellos que presentaban ritmo sinusal normal y FEVI>30%.
En todos los casos se realizó un ETT de control previo al alta hospitalaria. La primera revisión postoperatoria en consulta se realizó al mes del alta. Posteriormente, realizamos una revisión clínica anual y un ETT de control bianual.
Análisis estadísticoSe realizó un análisis descriptivo de todas las variables incluidas en el estudio. Las variables cuantitativas se expresaron como media (desviación estándar) o mediana (rango). Las variables cualitativas se expresaron como valor absoluto (n) y porcentaje. La comparación de medias se realizó por medio de la t de Student o test de Mann-Whitney, según procedió. La diferencia entre variables preoperatorias y postoperatorias se analizó mediante el test t Student para datos pareados. La asociación de variables cualitativas se estimó por medio del estadístico chi al cuadrado o Fisher. Un valor de p<0,05 se consideró estadísticamente significativo. Se empleó el paquete informático SPSS (versión 19.0; SPSS Inc., Chicago, Illinois, EE. UU.) para el análisis estadístico.
Se empleó la regresión logística para determinar predictores de recidiva de IM entre un conjunto de variables clínicas y ecocardiográficas preoperatorias de los pacientes: clase funcional de la New York Heart Association (NYHA), FEVI, diámetros y volúmenes ventriculares telesistólicos y telediastólicos, altura y área de tenting, presiones pulmonares y severidad de la IM. La capacidad de estas variables para predecir eventos en el seguimiento se estudió mediante curvas ROC.
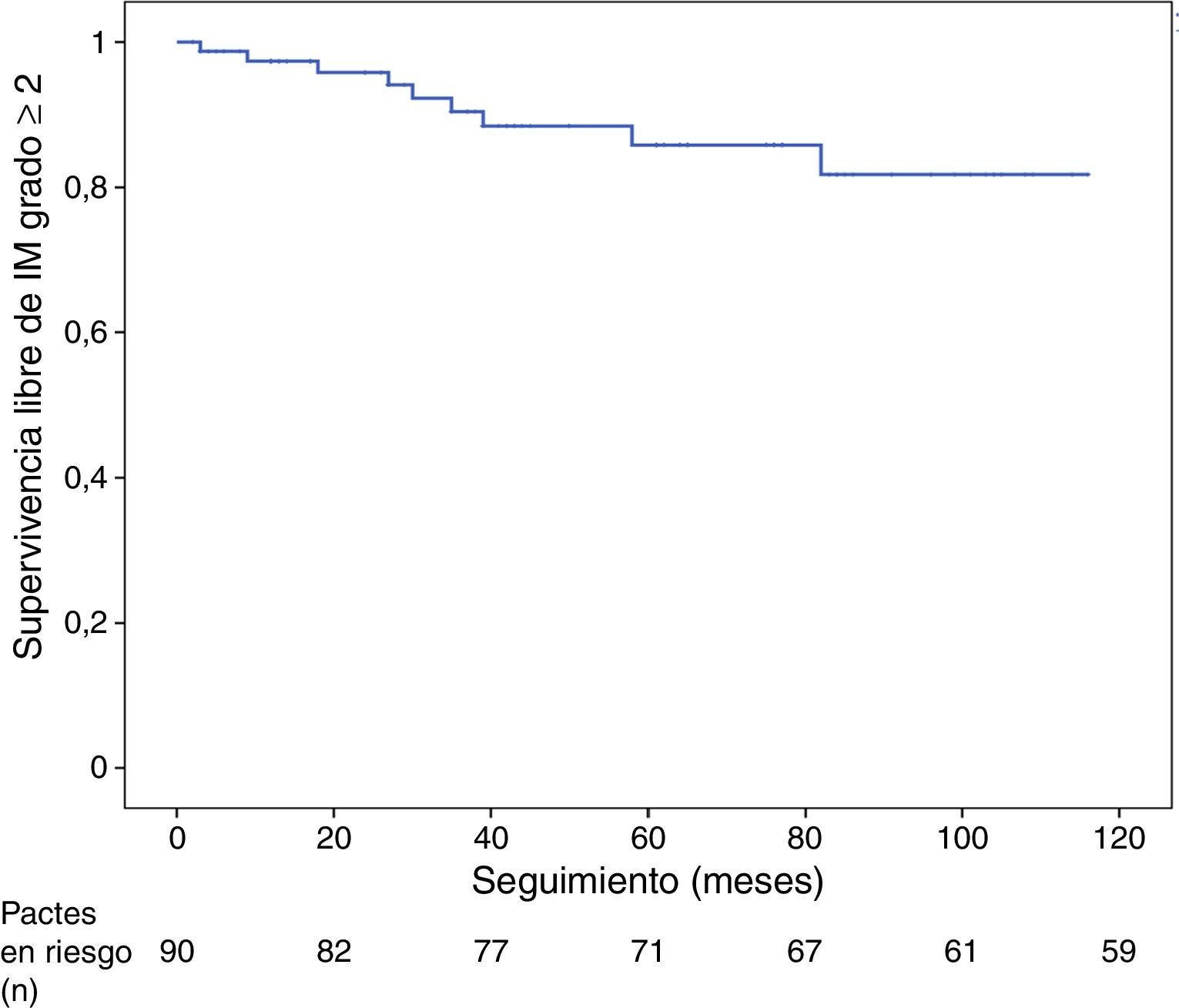
La supervivencia actuarial y la supervivencia libre de eventos se determinaron mediante el método de Kaplan-Meier.
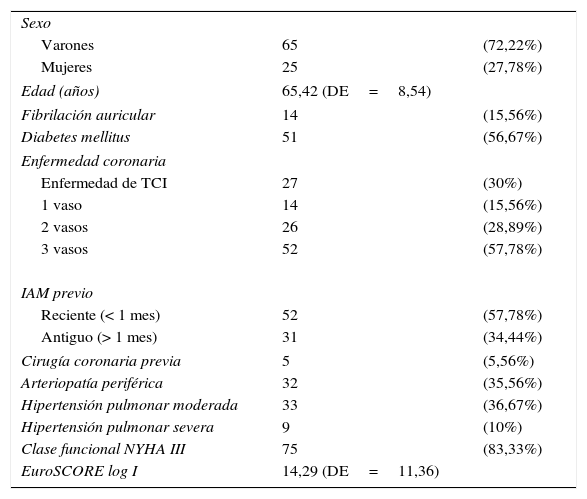
ResultadosEn cuanto a las características preoperatorias de los pacientes, la edad media fue de 65,42 (DE=8,54) años. El 83,3% de los pacientes (n=75) se encontraba en clase funcional iii-iv de la NYHA y un 16,67% (n=15) en clase funcional ii. El 100% de los pacientes (n=90) presentaban una IM basal grado ≥ 2, de los cuales un 72,22% (n=65) presentaban IM>2 (48,89% de los pacientes [n=44] IM grado=3 y un 23,33% [n=21] IM grado=4). El estudio hemodinámico prequirúrgico mostró enfermedad coronaria significativa en todos los pacientes. Un 57,78% de los pacientes (n=52) presentaban un infarto de miocardio reciente (< 30 días) en el momento de someterse a cirugía y un 34,44% (n = 31) infarto de miocardio antiguo (> 30 días). El European System for Cardiac Operative Risk Evaluation (EuroSCORE) log i promedio fue de 14,29 (DE=11,36).
Un 82,22% de los pacientes (n=74) presentaban ritmo sinusal, un 15,56% (n=14) fibrilación auricular y un 2,22% (n=2) marcapasos intravenoso. En un 73,33% de los casos (n=66) la cirugía se realizó con carácter urgente y en el 26,67% (n=24) fue electiva (tabla 1).
Características basales de los pacientes (n=90)
| Sexo | ||
| Varones | 65 | (72,22%) |
| Mujeres | 25 | (27,78%) |
| Edad (años) | 65,42 (DE=8,54) | |
| Fibrilación auricular | 14 | (15,56%) |
| Diabetes mellitus | 51 | (56,67%) |
| Enfermedad coronaria | ||
| Enfermedad de TCI | 27 | (30%) |
| 1 vaso | 14 | (15,56%) |
| 2 vasos | 26 | (28,89%) |
| 3 vasos | 52 | (57,78%) |
| IAM previo | ||
| Reciente (< 1 mes) | 52 | (57,78%) |
| Antiguo (> 1 mes) | 31 | (34,44%) |
| Cirugía coronaria previa | 5 | (5,56%) |
| Arteriopatía periférica | 32 | (35,56%) |
| Hipertensión pulmonar moderada | 33 | (36,67%) |
| Hipertensión pulmonar severa | 9 | (10%) |
| Clase funcional NYHA III | 75 | (83,33%) |
| EuroSCORE log I | 14,29 (DE=11,36) | |
EuroSCORE: European System for Cardiac Operative Risk Evaluation; IAM: infarto agudo de miocardio; NYHA: New York Heart Association; TCI: tronco coronaria izquierda.
Los datos expresan n (%) o media (desviación estándar).
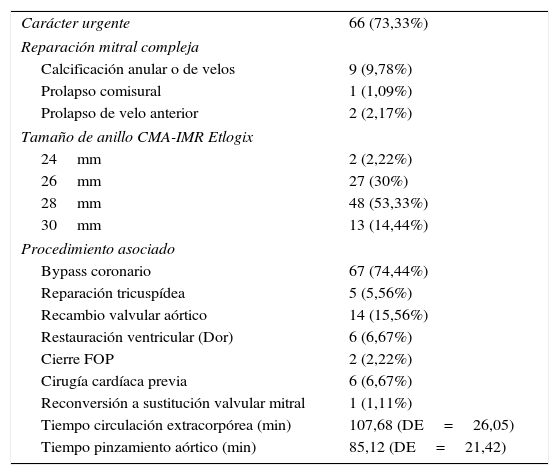
En cuanto al tamaño del anillo implantado, en un 53,33% (n=48) fue 28mm, en un 30% (n=27) 26mm, en un 14,44% (n= 13) 30mm y en un 2,22% (n=2) 24mm. En un 74,44% de los pacientes (n=67) se realizó cirugía coronaria concomitante, con una mediana de 2 injertos por paciente1-4; en un 15,56% (n=14) se asoció sustitución valvular aórtica; en un 6,67% (n=6) se realizó cirugía de restauración ventricular concomitante y en un 5,56% (n=5) se añadió anuloplastia tricuspídea (3 con anillo y 2 de Vega). En un 2,22% de los pacientes (n=2) se cerró un foramen oval permeable. Un 6,67% (n=6) tenía cirugía previa, de los cuales un 83,3% (n=5) presentaba cirugía coronaria previa y un 16,7% (n=1) anuloplastia mitral previa disfuncionante con anillo flexible (tablas 2 y 3).
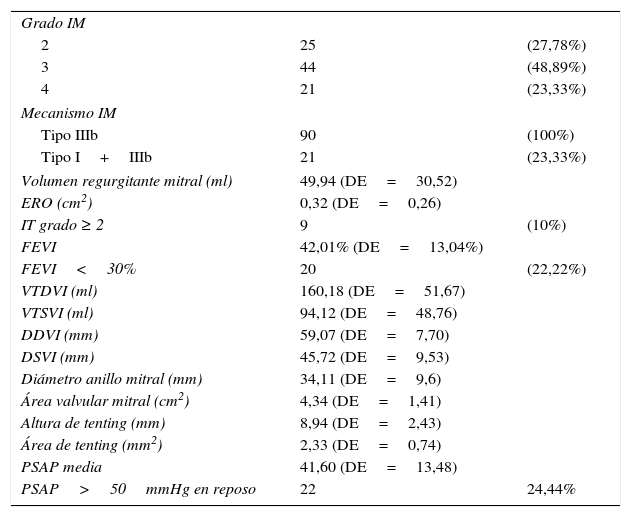
Características ecocardiográficas preoperatorias (n=90)
| Grado IM | ||
| 2 | 25 | (27,78%) |
| 3 | 44 | (48,89%) |
| 4 | 21 | (23,33%) |
| Mecanismo IM | ||
| Tipo IIIb | 90 | (100%) |
| Tipo I+IIIb | 21 | (23,33%) |
| Volumen regurgitante mitral (ml) | 49,94 (DE=30,52) | |
| ERO (cm2) | 0,32 (DE=0,26) | |
| IT grado ≥ 2 | 9 | (10%) |
| FEVI | 42,01% (DE=13,04%) | |
| FEVI<30% | 20 | (22,22%) |
| VTDVI (ml) | 160,18 (DE=51,67) | |
| VTSVI (ml) | 94,12 (DE=48,76) | |
| DDVI (mm) | 59,07 (DE=7,70) | |
| DSVI (mm) | 45,72 (DE=9,53) | |
| Diámetro anillo mitral (mm) | 34,11 (DE=9,6) | |
| Área valvular mitral (cm2) | 4,34 (DE=1,41) | |
| Altura de tenting (mm) | 8,94 (DE=2,43) | |
| Área de tenting (mm2) | 2,33 (DE=0,74) | |
| PSAP media | 41,60 (DE=13,48) | |
| PSAP>50mmHg en reposo | 22 | 24,44% |
DDVI: diámetro diastólico ventricular izquierdo; DSVI: diámetro sistólico ventricular izquierdo; ERO: orificio regurgitante efectivo; FEVI: fracción de eyección ventricular izquierda; IT: insuficiencia tricuspídea; PSAP: presión sistólica arterial pulmonar; VTDVI: volumen telediastólico ventricular izquierdo; VTSVI: volumen telesistólico ventricular izquierdo.
Los datos expresan n (%) o media (desviación estándar).
Datos quirúrgicos de los pacientes (n=90)
| Carácter urgente | 66 (73,33%) |
| Reparación mitral compleja | |
| Calcificación anular o de velos | 9 (9,78%) |
| Prolapso comisural | 1 (1,09%) |
| Prolapso de velo anterior | 2 (2,17%) |
| Tamaño de anillo CMA-IMR Etlogix | |
| 24mm | 2 (2,22%) |
| 26mm | 27 (30%) |
| 28mm | 48 (53,33%) |
| 30mm | 13 (14,44%) |
| Procedimiento asociado | |
| Bypass coronario | 67 (74,44%) |
| Reparación tricuspídea | 5 (5,56%) |
| Recambio valvular aórtico | 14 (15,56%) |
| Restauración ventricular (Dor) | 6 (6,67%) |
| Cierre FOP | 2 (2,22%) |
| Cirugía cardíaca previa | 6 (6,67%) |
| Reconversión a sustitución valvular mitral | 1 (1,11%) |
| Tiempo circulación extracorpórea (min) | 107,68 (DE=26,05) |
| Tiempo pinzamiento aórtico (min) | 85,12 (DE=21,42) |
Dor: cirugía de Dor (restauración ventricular); FOP: foramen oval permeable.
Los datos expresan n (%) o media (desviación estándar).
El tiempo medio de circulación extracorpórea fue 107,68 (DE=26,05) min y el tiempo medio de pinzamiento aórtico fue 85,12 (DE=21,42) min.
La ETE postoperatoria comprobó en un 84,44% de los pacientes (n=76) la ausencia de insuficiencia valvular mitral residual. En un 14,44% (n=13) se objetivó una IM trivial. Un paciente presentó IM grado>2, decidiéndose reconversión a sustitución valvular protésica.
Resultados precocesMorbimortalidad hospitalariaLa mediana del tiempo de hospitalización postoperatoria fue de 8 (1-63) días.
Un paciente falleció en los 30 días iniciales de postoperaorio (1,1%) debido a fracaso multiorgánico tras sangrado excesivo y politransfusión.
Un 3,33% de los pacientes (n=3) requirieron reintervención por sangrado excesivo en el postoperatorio inmediato. Un 2,22% (n=2) presentó infección de herida quirúrgica, tratándose de infección profunda (mediastinitis) en un paciente; un 3,33% (n=3), accidente cerebrovascular; un 5,56% (n=5), deterioro reversible de la función renal, de los cuales un 40% (n=2) requirió hemofiltración durante el ingreso en cuidados intensivos; un 6,67% (n=6), insuficiencia respiratoria con necesidad de ventilación mecánica prolongada (> 48h); un 2,22% (n=2) requirió implante de marcapasos definitivo, y un 10% (n=9) presentó fibrilación auricular de nueva aparición, consiguiéndose en un 77,78% (n=7) cardioversión farmacológica a ritmo sinusal (tabla 4).
Morbimortalidad hospitalaria (n=90)
| Mortalidad hospitalaria | 1 (1,11%) |
| Accidente cerebrovascular | 3 (3,33%) |
| Insuficiencia renal agudaa | 5 (5,55%) |
| Insuficiencia respiratoriab | 6 (6,67%) |
| Implante marcapasos definitivo | 2 (2,22%) |
| Fibrilación auricular de nueva apariciónc | 9 (10%) |
| Reintervención por sangrado | 3 (3,33%) |
| Mediastinitis | 1 (1,11%) |
| Estancia postoperatoria en UCI (días) | 4 (1-29) |
| Estancia postoperatoria total (días): días de postoperatorio en UCI + días de postoperatorio en planta | 8 (1-63) |
El grado de IM se redujo de forma significativa en todos los pacientes (p<0,001). En un 78,89% (n = 71) se constató ausencia de IM; en un 18,89% (n=17) se observó IM trivial/grado=1; un 2,22% (n=2) presentó IM grado=2 al alta.
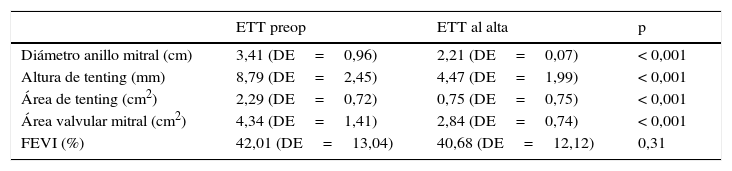
Comprobamos una reducción significativa al alta en los siguientes parámetros con respecto al ETT preoperatorio: el diámetro del anillo mitral se redujo de 3,41 (DE=0,96) a 2,21 (DE=0,07)cm, la altura de tenting de 8,79 (DE=2,45) a 4,47 (DE=1,99)mm, el área de tenting de 2,29 (DE=0,72) a 0,75 (DE=0,75) cm2 y el área valvular mitral de 4,34 (DE=1,41) cm2 a 2,84 (DE=0,74) cm2 (p<0,001). No obtuvimos diferencias significativas entre la FEVI preoperatoria y al alta (42,01% [DE=13,04%] a 40,68% [DE=12,12%]; p=0,31). El gradiente transmitral máximo y medio al alta fueron 11,98 (DE=3,8)mmHg y 4,72 (DE=1,61)mmHg, respectivamente (tabla 5).
Resultados ecocardiográficos al alta
| ETT preop | ETT al alta | p | |
|---|---|---|---|
| Diámetro anillo mitral (cm) | 3,41 (DE=0,96) | 2,21 (DE=0,07) | < 0,001 |
| Altura de tenting (mm) | 8,79 (DE=2,45) | 4,47 (DE=1,99) | < 0,001 |
| Área de tenting (cm2) | 2,29 (DE=0,72) | 0,75 (DE=0,75) | < 0,001 |
| Área valvular mitral (cm2) | 4,34 (DE=1,41) | 2,84 (DE=0,74) | < 0,001 |
| FEVI (%) | 42,01 (DE=13,04) | 40,68 (DE=12,12) | 0,31 |
La mediana de seguimiento fue de 62 meses (12-129). Se produjeron 16 muertes tardías en el seguimiento, de las cuales 7 fueron de causa cardíaca, 3 de causa cerebrovascular y 6 de otras causas (3 oncológicas, una por enfermedad neurológica degenerativa, una de causa neumónica y otra en el postoperatorio de una cirugía abdominal). El ETT de control tardío constató ausencia de IM o IM grado<2 en 73 pacientes; 9 pacientes presentaron IM grado ≥ 2, de los cuales 6 presentaban IM grado=2 y 3 pacientes presentaban IM grado=3. Se produjo un caso de dehiscencia anular que requirió reintervención para resutura del anillo mitral a nivel P2-P3.
El gradiente medio transmitral y el área valvular promedio en el ETT de control tardío fueron 3,87 (DE=1,43)mmHg y 2,63 (DE=0,75) cm2, respectivamente.
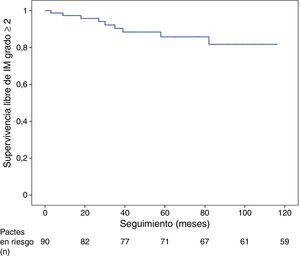
La supervivencia libre de recidiva de IM grado ≥ 2 fue del 95,8% a los 24 meses y del 81,7% a los 60 y a los 123 meses de seguimiento (fig. 1).
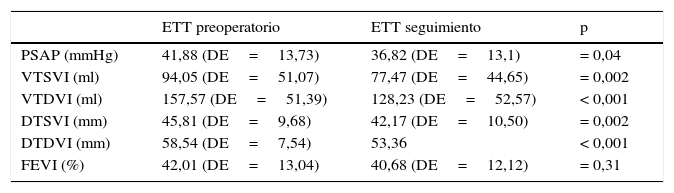
El ETT de control tardío objetivó una disminución estadísticamente significativa en los siguientes parámetros ventriculares con respecto al ETT preoperatorio: el volumen telesistólico medio del VI disminuyó de 94,05 (DE=51,07)ml a 77,47 (DE=44,65)ml (p=0,002); el volumen telediastólico medio del VI disminuyó de 157,57 (DE=51,39)ml a 128,23 (DE=52,57)ml (p<0,001); el diámetro telesistólico medio del VI se redujo de 45,81 (DE=9,68)mm a 42,17 (DE=10,50)mm (p=0,002) y el diámetro telediastólico medio del VI se redujo de 58,54 (DE=7,54)mm a 53,36mm (p<0,001). Observamos una reducción significativa en la presión sistólica arterial pulmonar media con respecto a la preoperatoria, disminuyendo de 41,88 (DE=13,73) a 36,82 (DE=13,1)mmHg (p=0,004). No observamos diferencia estadísticamente significativa en la FEVI media en el control tardío con respecto al preoperatorio (tabla 6).
Resultados ecocardiográficos seguimiento tardío
| ETT preoperatorio | ETT seguimiento | p | |
|---|---|---|---|
| PSAP (mmHg) | 41,88 (DE=13,73) | 36,82 (DE=13,1) | = 0,04 |
| VTSVI (ml) | 94,05 (DE=51,07) | 77,47 (DE=44,65) | = 0,002 |
| VTDVI (ml) | 157,57 (DE=51,39) | 128,23 (DE=52,57) | < 0,001 |
| DTSVI (mm) | 45,81 (DE=9,68) | 42,17 (DE=10,50) | = 0,002 |
| DTDVI (mm) | 58,54 (DE=7,54) | 53,36 | < 0,001 |
| FEVI (%) | 42,01 (DE=13,04) | 40,68 (DE=12,12) | = 0,31 |
DTDVI: diámetro telediastólico medio del VI; DTSVI: diámetro telesistólico medio del VI; PSAP: presión sistólica arterial pulmonar media; VTDVI: volumen telediastólico medio del VI; VTSVI: volumen telesistólico medio del VI.
En cuanto a la clase funcional de los pacientes, en las revisiones postoperatorias constatamos mejoría clínica significativa con respecto al preoperatorio (p<0,005). De los pacientes que preoperatoriamente presentaban clase NYHA II (n=16; 17,78%), un 77% presentó clase funcional i al seguimiento y un 23% se mantuvo en clase NYHA II; de los que presentaban preoperatoriamente clase funcional iii-iv (n=74; 82,2%), un 48,33% presentó clase funcional i, un 43,33% clase funcional ii y un 8,33% clase funcional iii postoperatoriamente. Dos pacientes que se mantuvieron en clase funcional NYHA III fueron estudiados para trasplante cardíaco.
En el análisis univariado obtuvimos 2 parámetros ecocardiográficos predictores de recidiva de la regurgitación mitral en nuestra serie: la altura de tenting preoperatoria (p=0,003) y la altura de tenting postoperatoria en el ecocardiograma al alta (p=0,001). Los puntos de corte se establecieron en 10,65mm (sensibilidad 100%, especificidad 93% y área bajo la curva ROC 0,97) para la altura de tenting preoperatoria y en 5,4mm (sensibilidad 100%, especificidad 86% y área bajo la curva ROC 0,95) para la altura de tenting en el ecocardiograma al alta.
DiscusiónEl mecanismo fisiopatológico de la IMIC hay que buscarlo en el remodelado que sufre el miocardio ventricular tras el infarto, perdiendo su forma elíptica y adquiriendo esfericidad, con un adelgazamiento de la pared necrosada y un desplazamiento apical y posterior de los músculos papilares. El desplazamiento muscular conlleva el de sus cuerdas tendinosas, lo que tracciona (tethering) de los velos valvulares, disminuyendo y progresivamente anulando su superficie de coaptación (IM tipo iiib, clasificación funcional de Carpentier)9-11. La sobrecarga de volumen ventricular que acompaña al paciente con IM y disfunción ventricular causa dilatación del anillo mitral y movimiento restrictivo de los velos mitrales en sístole (predominantemente el posterior), pérdida de la superficie de contacto y coaptación por debajo del plano anular (área de tenting aumentada), encontrándonos en el estadio más avanzado del paciente con IMIC (tipo i+iiib de la clasificación funcional de Carpentier)12.
El tratamiento estándar de la IMIC severa ha sido cirugía coronaria combinada con sustitución o reparación mitral. Este procedimiento se asoció a una elevada mortalidad hospitalaria, decidiendo muchos grupos quirúrgicos realizar cirugía combinada únicamente en casos de estricta severidad de la IM y confiar, en casos de regurgitación moderada, en que la revascularización miocárdica mejorase la disfunción valvular17.
Históricamente, el manejo de la IMIC ha sido controvertido. Las dudas tradicionales de si hemos de sustituir o reparar la válvula mitral, cómo reparar, si en IMIC moderada hemos de realizar cirugía valvular concomitante a la revascularización o en qué casos el intervencionismo percutáneo desempeña un papel no han sido suficientemente dilucidadas por parte de las guías europeas y americanas hasta la actualidad18,19. La dificultad para obtener consenso en el manejo de esta patología es debida probablemente al escenario clínico tan complejo de estos pacientes y a la escasez de estudios al respecto hasta la era reciente.
Smith et al. publicaron los resultados iniciales de un ensayo aleatorizado que incluyó a 301 pacientes con IMIC moderada sometidos a cirugía coronaria aislada vs. cirugía coronaria más reparación mitral20. El objetivo principal fue determinar el volumen telesistólico del VI indexado a un año y a 2 años como marcador de regresión del remodelado ventricular posquirúrgico, sin obtener diferencias significativas. Tampoco observaron diferencias significativas en la supervivencia entre ambos grupos al año y a 2 años. En el grupo de reparación disminuyó la prevalencia de regurgitación moderada o severa, pero los pacientes presentaron más eventos adversos arrítmicos y neurológicos. Será preciso más tiempo de seguimiento para determinar si reparar la IMIC moderada aporta beneficios clínicos a largo plazo con respecto a no repararla. Si bien en nuestro estudio no disponemos de un grupo control (pacientes con IMIC moderada sometidos a cirugía coronaria aislada) ni de estudios de viabilidad miocárdica en la totalidad de los pacientes, sí evidenciamos a medio-largo plazo diferencia estadísticamente significativa en la regresión de los volúmenes telesistólicos y telediastólicos del VI y en los diámetros ventriculares en el ecocardiograma de control tardío con respecto al ecocardiograma preoperatorio.
Referente a la técnica quirúrgica, la mayoría de IMIC tipo iiib y tipo i+iiib se corrigen mediante anuloplastia. Se han obtenido diferentes resultados con diferentes técnicas de anuloplastia según la época y las preferencias de los grupos. El objetivo principal de la reparación y que más se correlaciona con resultados precoces satisfactorios y con durabilidad es la consecución de una adecuada superficie de coaptación entre ambos velos mitrales. La anuloplastia con anillo Carpentier-McCarthy-Adams ETlogix®, rígido, completo, con reducido diámetro anteroposterior y morfología tridimensional con desplazamiento hacia el ápex de P3 para compensar el desplazamiento del músculo papilar posterior, demostró un acercamiento del punto de cierre de la válvula al anillo (< altura de tenting) y una disminución del área de tracción del aparato subvalvular. Desde 2005 se ha venido implantando este anillo por diversos autores, con excelentes resultados a corto plazo1,12. No obstante, resultados a largo plazo escasean en la literatura. Recientemente, Gatti et al.21 reportaron su serie de 190 pacientes con un seguimiento medio de 4,8±2,1 años, obteniendo una supervivencia actuarial a 7 años y una ausencia de IM grado ≥ 2 y ausencia de reoperación del 62, el 93,1 y el 97,6%, respectivamente, resultados comparables con los obtenidos en nuestro estudio.
Aquellos casos en que se objetive un tethering muy aumentado, la asociación de técnicas de reparación que actúen sobre el aparato subvalvular debe tenerse en cuenta, si bien deberían ser realizadas por manos expertas en centros con amplia experiencia reparadora22.
Algunos estudios han reportado superioridad de la reparación mitral frente a sustitución valvular, con mejores tasas de supervivencia a corto plazo23,24. Acker et al. presentaron recientemente los resultados de un ensayo aleatorizado que incluyó a 251 pacientes con IMIC severa sometidos a sustitución vs. reparación mitral25. El objetivo principal fue analizar el comportamiento del volumen telesistólico del VI indexado al año y a 2 años tras la cirugía como marcador de regresión del remodelado ventricular, sin encontrar diferencias significativas entre ambos grupos. Tampoco obtuvieron diferencias significativas en la supervivencia ni en la clase funcional. Sin embargo, objetivaron mayor recurrencia de IM en el grupo de reparación frente al de sustitución al año (32,6% vs. 2,3%, p<0,001) y a 2 años (58,8% vs. 3,8%, p<0,001). Esta interpretación ha de ser cautelosa, debido, en primer lugar, a la brevedad del seguimiento, dado que los pacientes portadores de prótesis valvulares mitrales no están exentos de complicaciones en el seguimiento a largo plazo26,27 y, en segundo lugar, a que no se consideraron los factores predictores de recidiva de la regurgitación, de modo que la aleatorización de los pacientes pudo verse sesgada. Como apuntan Díaz et al., una inapropiada selección de pacientes en el grupo sometido a reparación puede propiciar la obtención de mejores resultados en el grupo sometido a sustitución valvular28.
Tradicionalmente, los predictores de resultado desfavorable de la reparación son cuantificados en el ecocardiograma preoperatorio y se han identificado como aquellos factores que favorecen un incremento del tethering: área y altura de tenting, diámetros y volúmenes ventriculares, altura de coaptación de los velos respecto al anillo mitral y ángulo que forman el velo posterior y el velo anterior con el plano anular valvular mitral29,30.
En nuestra serie observamos en el análisis univariado que el factor ecocardiográfico preoperatorio que mejor predice la recidiva de la regurgitación mitral es la altura de tenting (p=0,003), con un punto de corte en 10,65mm (sensibilidad 100%, especificidad 93% y área bajo la curva ROC 0,97).
A la luz de los resultados del estudio de Acker et al.25, en los pacientes con IMIC que presentan factores ecocardiográficos preoperatorios predictores de mal pronóstico de la reparación la sustitución valvular se consideraría como técnica de elección.
ConclusionesSobre la base de los resultados a medio-largo plazo de nuestro centro, consideramos la reparación mitral mediante anuloplastia con anillo protésico Carpentier-McCarthy-Adams IMR ETlogix® como la técnica quirúrgica de elección en la IMIC en aquellos pacientes que presentan una altura de tenting en el ecocardiograma preoperatorio inferior a 10,65mm.
Limitaciones del estudioSe trata de un estudio prospectivo unicéntrico de 90 pacientes, no aleatorizado, en el que no disponemos de grupo de control con pacientes sometidos a cirugía de revascularización aislada, lo cual adquiriría especial relevancia en los casos de IMIC moderada grado 2, que representa un número de pacientes nada desdeñable en nuestra serie (n=25) y que no todos los grupos de trabajo son partidarios de tratar, dadas las múltiples controversias que existen al respecto en la literatura.
Serán también necesarios nuevos estudios para identificar grupos de pacientes con IMIC que se beneficiarían a largo plazo de anuloplastia mitral aislada frente a técnicas de reparación del aparato subvalvular mitral y frente al reemplazo valvular mitral.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.