El uso del soporte mecánico circulatorio como puente al trasplante es una terapia ampliamente consolidada a nivel internacional y respaldada por las guías de práctica clínica que mejora la supervivencia y calidad de vida de pacientes en espera de un trasplante y permite a aquellos con contraindicaciones reversibles disponer del tiempo y la oportunidad de convertirse en adecuados candidatos. En la última década se ha producido un significativo aumento anual de implantes que responde a las crecientes necesidades poblacionales junto a los mejores resultados y reducción progresiva de la tasa de complicaciones. El número de trasplantes con asistencia previa ha aumentado también de manera exponencial y los resultados con dispositivo de larga duración izquierdos son ya equiparables a los del trasplante en ausencia de soporte previo. Los factores que más han influido en este progreso son los dispositivos de flujo continuo, una mejor selección de pacientes y una mayor experiencia de los equipos especializados. Aun así, todavía existen muchas limitaciones para la aplicación de esta tecnología como el coste, su durabilidad y complicaciones a medio-largo plazo, cuya resolución es imprescindible para permitir su progresiva e infrenable expansión.
The use of mechanical circulatory support as a bridge to transplantation is an established practice worldwide with clear support of the international clinical guidelines. It has shown to improve the survival and quality of life of patients on the heart transplant waiting list. It also provides those with reversible contraindications for transplantation with the time and opportunity to become appropriate candidates for that treatment. In the last decade the number of implants has increased significantly due to the growing heart failure population requirements, the achievement of better outcomes, and the gradual reduction of complications. The number of heart transplants performed with a previous left ventricular assist device has also increased, and the outcomes no longer show significant differences with routine transplantation. These accomplishments are mainly due to the continuous flow devices, a significant improvement in the selection of optimal candidates, and the experience acquired by specialised centres. However, this technology still has limitations such as the cost, durability, and medium-long term complications that must be resolved in order to allow its progressive and unstoppable expansion.
La insuficiencia cardiaca (IC) se conoce ya globalmente como la epidemia cardiovascular del siglo xxi1, una realidad atribuible fundamentalmente a los avances en el tratamiento de la cardiopatía isquémica y la consecuente reducción de su mortalidad2. A pesar de la carencia de estudios poblacionales exhaustivos, su prevalencia se estima por encima del 2%, aumentando exponencialmente con la edad y alcanzando valores superiores al 10% entre los mayores de 70 años3,4. Estos datos se traducen en cifras de 5 millones de personas con IC en Estados Unidos y casi 900.000 nuevos diagnósticos anuales5. En España, registros más limitados estiman una prevalencia del 5% y destacan un aumento significativo del número de ingresos hospitalarios por esta causa en las últimas décadas6.
Aunque esta patología persiste como una de las fundamentales causas de mortalidad y morbilidad en nuestro medio, una mejor adherencia y estandarización de las guías de tratamiento7, junto a una mayor prevención de muerte súbita8, han reducido la mortalidad en estadios iniciales y, por tanto, incrementado el número de pacientes con IC avanzada al que debemos hacer frente. El trasplante cardiaco (TC) sigue siendo el tratamiento de elección en esta población7. Sin embargo, la escasez de donantes llegó a provocar una reducción progresiva del número de trasplantes realizados entre 1993 y 2004, tendencia que afortunadamente se estabilizó en la década posterior9. En los últimos años las cifras parecen haber repuntado ligeramente en algunos países, pero todavía se encuentran lejos de hacer frente a las crecientes necesidades, creando un desequilibrio que contribuye al progresivo aumento de las listas de espera en todo el mundo10,11.
De ahí que el soporte mecánico circulatorio (SMC) como puente al trasplante (bridge to transplant o BTT) se haya consolidado ya como una terapia estándar. Estos dispositivos ofrecen una alternativa para aquellos pacientes con IC avanzada en espera de un trasplante, permitiendo mejorar su calidad de vida y frenar un progresivo o súbito deterioro clínico que en ocasiones supondría la suspensión de la lista o fallecimiento en la misma12-14. Así mismo, representan una oportunidad única para una subpoblación con contraindicaciones al trasplante, que pueden ser potencialmente solventadas por y/o durante el SMC, y cuya única alternativa sería el tratamiento paliativo15.
Historia, desarrollo y tecnología actual del soporte mecánico circulatorio como puente a trasplanteLa experimentación con SMC en animales se remonta ya a los años 3016. Sin embargo, el primer implante en humanos de un dispositivo de estas características no ocurrió hasta 1966 y se disputa entre una asistencia de soporte parcial implantada a nivel aórtico por Kantrowitz17 y el primer implante exitoso de una asistencia ventricular (VAD) propiamente dicha, en este caso paracorpórea, realizado por DeBakey en el mismo año como puente a recuperación tras cirugía cardiaca18. Posteriormente, en 1969, se realizaba en Houston el primer implante de un corazón artificial total (Liotta Heart) que tras 64 horas recibió un TC, convirtiéndose en la primera experiencia de SMC como BTT19, aunque el paciente no sobrevivió al mismo.
Después de estos hitos se sucedieron décadas de investigación e inversión en la búsqueda de dispositivos artificiales completamente implantables y duraderos20. En 1984, Novacor implantaba su primera asistencia ventricular izquierda (left ventricular assist device [LVAD]) intracorpórea de largo plazo como BTT21 y en 1985 se realizaba el primer BTT exitoso con un corazón artificial tipo Jarvik 722.
Comenzaba entonces la era de las llamadas asistencias de primera generación, todas de flujo pulsátil y muchas de las cuales recibieron la CE Mark, pero solo algunas la aprobación de la FDA como BTT. Dentro de este grupo se desarrollaron 3 subtipos fundamentales: 1) de tipo soporte izquierdo intracorpóreo, siendo el paradigma el Thoratec IP LVAS, un dispositivo neumático que fue el primero en demostrar la eficacia y seguridad como BTT en 199523; posteriormente, se lanzaría el mítico Heartmate VE/XVE, que constaba de un plato pulsátil impulsado eléctricamente24; 2) dispositivos paracorpóreos, con capacidad de soporte uni o biventricular y de mecanismo neumático, entre los que destacamos el Thoratec PVAD25 o el todavía activo Excor Pediatric (Berlin Heart) que no recibiría aprobación de la FDA como BTT hasta 2011 y solo para uso pediátrico; 3) dispositivos tipo total artificial heart (TAH), destacando el Cardiowest (modificación del originario Jarvik 7 y actualmente conocido como Syncardia), que se utiliza oficialmente como BTT desde 2004.
La tecnología pulsátil demostró clara superioridad frente al tratamiento médico de la IC avanzada cuando el estudio aleatorizado REMATCH daba a conocer una impactante reducción de mortalidad del 48% tras 12 meses de seguimiento26. Sin embargo, aquellos dispositivos eran excesivamente grandes para algunos subgrupos poblacionales de menor superficie corporal, difíciles de implantar por su tamaño y con una tasa de complicaciones como eventos neurológicos, sangrados severos (42% en 6 meses) o infecciones (24% en el primer año), difícilmente aceptable26. Más del 60% precisaban además ser recambiados en 2 años, haciendo también los costes inasumibles27.
Se buscaron posteriormente dispositivos más duraderos, de menor tamaño y con menor tasa de complicaciones, que permitieran implementarlos como terapia destino (destination therapy [DT]), pero también consolidar su papel como BTT. Así aparece la segunda generación de dispositivos que se centró en la creación de bombas de flujo continuo y axial como el Jarvik 2000, Heart Assist 5 o Incor de Berlin Heart. El Heartmate II, que fue aprobado como BTT en 2008 y DT en 2010, supuso sin duda la revolución en este campo, demostrando su clara superioridad con respecto a los dispositivos pulsátiles (supervivencia a dos años 58% vs. 24%, p=0,008)28 y su efectividad como soporte hemodinámico de larga duración en espera de un TC, mejorando además la calidad de vida y la clase funcional de dichos pacientes29. Sigue siendo a día de hoy el dispositivo de larga duración con el que existe más experiencia a nivel mundial con más de 20.000 implantes.
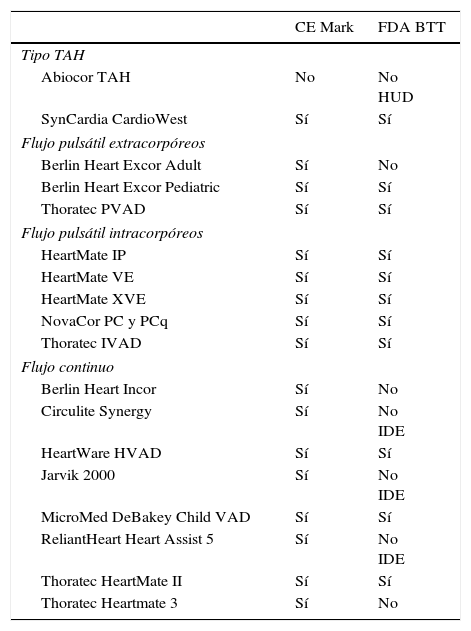
En los últimos años se ha desarrollado la tercera generación de asistencias, dispositivos que mantienen el flujo continuo pero de tipo centrífugo, con rotores magnética o hidrodinámicamente levitados para evitar al máximo la fricción. Entre múltiples prototipos de diferentes marcas, destacó el Heartware, una asistencia más pequeña y ligera que el Heartmate II, de implantación intrapericárdica y que demostró una supervivencia del 84% al año en BTT, recibiendo su aprobación para esta indicación por la FDA en 2012, y habiéndose convertido desde entonces en la segunda asistencia de largo plazo más utilizada con este propósito30. En 2015 finalizó el reclutamiento de pacientes del ENDURANCE 2, estudio destinado a evaluar el Heartware como DT, y cuyos resultados determinarán la aprobación de la FDA con esta indicación. En 2015 recibía la CE Mark un nuevo dispositivo de características muy similares al previo, el Heartmate 3, también intrapericárdico, de rotor magnéticamente levitado y flujo continuo, que ofrece un cierto grado de pulsatilidad sobreañadida. Los estudios preliminares destacan su hemocompatibilidad y baja incidencia de trombosis del dispositivo con respecto al Heartmate II o Heartware. Sin embargo, la experiencia es todavía escasa, no dispone de certificación por la FDA y el estudio comparativo con el Heartmate II, MOMENTUM 3, se encuentra todavía en proceso de reclutamiento. El resumen de los dispositivos de medio-largo plazo con posible uso como BTT se recoge en la tabla 1.
Resumen de los dispositivos de medio-largo plazo más frecuentemente utilizados en las últimas décadas como SMC
| CE Mark | FDA BTT | |
|---|---|---|
| Tipo TAH | ||
| Abiocor TAH | No | No HUD |
| SynCardia CardioWest | Sí | Sí |
| Flujo pulsátil extracorpóreos | ||
| Berlin Heart Excor Adult | Sí | No |
| Berlin Heart Excor Pediatric | Sí | Sí |
| Thoratec PVAD | Sí | Sí |
| Flujo pulsátil intracorpóreos | ||
| HeartMate IP | Sí | Sí |
| HeartMate VE | Sí | Sí |
| HeartMate XVE | Sí | Sí |
| NovaCor PC y PCq | Sí | Sí |
| Thoratec IVAD | Sí | Sí |
| Flujo continuo | ||
| Berlin Heart Incor | Sí | No |
| Circulite Synergy | Sí | No IDE |
| HeartWare HVAD | Sí | Sí |
| Jarvik 2000 | Sí | No IDE |
| MicroMed DeBakey Child VAD | Sí | Sí |
| ReliantHeart Heart Assist 5 | Sí | No IDE |
| Thoratec HeartMate II | Sí | Sí |
| Thoratec Heartmate 3 | Sí | No |
HUD: humanitarian use device; IDE: investigational device exemption.
Respecto al SMC de corto plazo, los avances han sido menos prolíficos y significativos. Esta tecnología precisa de dispositivos que puedan ser implantados fácil y rápidamente por ser necesarios en situaciones agudas. Con ellos se busca la estabilización como puente a decisión, recuperación, implante de otro dispositivo de largo plazo o al trasplante31. Sin embargo, su duración limitada suele acompañarse de mayor mortalidad y complicaciones que los dispositivos de largo plazo, así como la imposibilidad de permitir movilización independiente, alta hospitalaria o calidad de vida sostenida. Todo ello, hace que las asistencias de corto plazo tengan un papel más limitado en el BTT, menor evidencia científica y solo sean realmente aplicables en países con listas de espera de corta duración o pacientes de subgrupos rápidamente trasplantables. Algunos de los más utilizados han sido los Abiomed AV y BVS 5000, de carácter pulsátil y extracorpóreo, aunque las experiencias más extensas describían soportes menores a 10 días32. Algunos dispositivos pulsátiles que nacieron originalmente como larga duración, han sido relegados progresivamente a un papel de corto-medio plazo, debido a su imposibilidad de competir con las más modernas asistencias de flujo continuo, tales como el Thoratec PVAD o el Excor Berlin Heart. Este último se ha consolidado principalmente como alternativa a la membrana de oxigenación extracorpórea (ECMO) en el BTT pediátrico, permitiendo una alta tasa de trasplantes exitosos, cercana al 64%, en algunos estudios33. Quizás el Centrimag haya sido el hito más reciente en este campo, con un rotor de flujo continuo y centrífugo que permite soporte uni o biventricular en posible combinación con ECMO. A pesar de no estar oficialmente reconocida para puente a trasplante, su uso puede extenderse hasta 30 días y son múltiples las experiencias que avalan su éxito en este campo34,35. En cuanto a la ECMO como BTT, a pesar del incremento en su uso en la última década, su alta tasa de complicaciones y reducidos resultados postrasplante han defraudado las expectativas incluso en el ámbito pediátrico donde su aplicación había sido más generalizada36.
Por último, debemos mencionar las asistencias de corto plazo percutáneas, tales como el Tándem Heart, el Impella 2.5/5 o el reciente HeartMate PHP system, que nacieron intentando reducir y facilitar el implante con respecto a los dispositivos previos, pero cuya limitada duración y uso durante horas o días, minimiza a experiencias aisladas su aplicación en el BTT37,38.
Elección de dispositivo en la actualidad: tipo de flujo y soporteEl último informe del registro americano Interagency Registry for Mechanically Assisted Circulatory Support (INTERMACS) recoge ya 13.286 dispositivos implantados entre 2006 y 2014, de los cuales solo un 2,3% son TAH, un 7,2% de flujo pulsátil y el 90,5% de flujo continuo. En el año 2014, solo un 1% de los implantes fueron dispositivos paracorpóreos pulsátiles, no se realizaron implantes intracorpóreos pulsátiles, un escaso 2,2% fueron TAH, un 29% de flujo continuo centrífugo y un 67,5% de flujo continuo axial39. El primer informe del registro europeo (EUROMACS) se publicaba recientemente recogiendo 741 implantes realizados entre 2011 y 2013, donde también destacan los dispositivos de flujo continuo, que representan más del 90% de los implantes40.
La mayoría de los casos realizados en la historia en EE. UU., en torno a un 94%, han sido ya dispositivos univentriculares izquierdos, menos del 1% asistencias derechas aisladas (Right Ventricular Assist Device, RVAD) y en torno a un 6% biventriculares39. En nuestro medio europeo siguen destacando los dispositivos aislados izquierdos, que suponen más del 80% de los casos40. Si nos centramos en los datos del reciente registro internacional IMACS (The ISHLT Mechanically Assisted Circulatory Support Registry), confirmamos también que entre 2013 y 2014 el 93% fueron soporte izquierdo univentricular, no hubo implantes derechos primarios y el 6% fue soporte biventricular incluyendo TAH41. Estos datos responden a los mejores resultados obtenidos con SMC izquierdo que se comentan posteriormente.
Selección de pacientesLos pacientes candidatos a SMC se incluyen dentro de la definición de IC avanzada, que clásicamente engloba a aquellos con IC crónica en situación funcional NYHA III-IV a pesar de tratamiento médico óptimo y a aquellos en IC aguda que no responden a las medidas de estabilización médicas habituales. Esta descripción incluye un espectro de pacientes demasiado amplio y de ahí que el grupo INTERMACS definiera 7 estadios para subclasificar los pacientes NYHA IIIb-IV (tabla 2), siendo los grupos 1-3 aquellos con los que existe más experiencia42. Los pacientes en INTERMACS 1 y 2 solo deben considerarse para soporte de largo plazo cuando es improbable la recuperación espontánea de la función ventricular o estabilidad hemodinámica, sean dependientes de soporte de corto plazo y exista ausencia irreversible de órgano diana. Los pacientes en INTERMACS 3, inotropo dependientes, son probablemente los que más se benefician del implante con menor riesgo que los perfiles previos, ya que la clasificación INTERMACS se correlaciona inversamente con la mortalidad postimplante43. De ahí que en los últimos años haya habido una progresiva tendencia a un menor número de casos en estadio 1, realizándose en la actualidad el mayor número en estadios 2 y 341. El beneficio en INTERMACS 4 tiene menor evidencia pero los buenos resultados clínicos han promovido un significativo aumento de los implantes en esta franja, siendo actualmente una práctica habitual que en algunos registros supone más del 15% de los dispositivos. En pacientes ambulatorios está todavía por definir el beneficio real en supervivencia o calidad de vida, ajustado por la posible tasa de complicaciones con respecto al tratamiento médico convencional, pero ya existen estudios activos que nos permitirán definir esta indicación en los próximos años. El ROADMAP comparaba por primera vez tratamiento médico vs. LVAD en pacientes ambulatorios no inotropo dependientes y no candidatos a TC, mostrando una mayor supervivencia con mejor clase funcional al año de seguimiento44. A día de hoy no existen todavía estudios que comparen tratamiento médico vs. LVAD en el subgrupo de BTT. En este perfil, la estratificación del riesgo de mortalidad anual con modelos como el Seattle Heart Failure Model o el Heart Failure Survival Score son útiles a la hora de definir a aquellos candidatos que se beneficiarán del SMC45. Las guías europeas de IC recogen también un listado de criterios prácticos para realizar esta selección (tabla 2)7.
Clasificaciones para facilitar la selección en indicación de SMC
| Clasificación INTERMACS42 |
|---|
| 1. Shock cardiogénico rápidamente progresivo a pesar de aumento de soporte inotrópico 2. Deterioro progresivo a pesar de aumento de soporte inotrópico 3. Estable pero inotropo dependiente 4. Síntomas en reposo 5. No síntomas de reposos. Intolerancia a la actividad física incluidas mínimas actividades de la vida diaria 6. Actividad física limitada a actividades de la vida diaria y esfuerzo mínimo añadido 7. Clase NYHA III avanzada, capacidad para desarrollar actividades de bajo esfuerzo |
| Criterios de selección de pacientes para VAD de la Sociedad Europea de Cardiología47 |
|---|
| Pacientes con síntomas durante más de 2 meses a pesar de tratamiento médico óptimo y dispositivos si indicados, más una de las siguientes características: 1. Fracción de eyección del ventrículo izquierdo < 25% y pico de consumo de oxígeno < 12 ml/kg/min 2. Tres hospitalizaciones en los meses previos sin desencadenante identificado 3. Inotropo dependiente 4. Deterioro progresivo de función de órgano periférico: deterioro renal o hepático, PCP ≥ 20mmHg y PAS ≤80-90mmHg o IC ≤ 2 l/min/m2 5. Ausencia de disfunción derecha con insuficiencia tricuspídea severa |
PAS: presión arterial sistólica; PCP: presión capilar pulmonar.
Independientemente de las características del paciente, es importante recordar que cualquier candidato a soporte de largo plazo debe haber sido valorado previamente para TC45, pues dicha decisión definirá la estrategia del implante y la toma de decisiones final.
Estrategia Bridge to Transplant (Puente al Trasplante)El número de implantes de VAD ha seguido aumentando año tras año, con una clara tendencia al incremento de los procedimientos realizados como DT que en algunos países como EE. UU. ya suponen casi el 50% de los casos. También se ha producido un repunte reciente de los casos implantados como BTT y existe una tendencia a la reducción de los realizados como puente a candidatura.
En el contexto del BTT, podríamos definir 3 subgrupos de poblaciones objetivo:
- 1.
Pacientes con IC avanzada en situación crónica o aguda, ya valorados para TC y sin contraindicaciones irreversibles para el mismo. Dentro de esta clasificación se englobarían aquellos pacientes ya incluidos en la lista de espera, donde se estima que el dispositivo puede potencialmente mejorar sus síntomas y calidad de vida, reducir el número de hospitalizaciones, el riesgo de muerte súbita y prolongar su supervivencia en lista de espera13. Suelen ser pacientes con deterioro progresivo funcional, disfunción de órgano diana incipiente46, ingresos frecuentes o descompensación significativa causando dependencia de fármacos inotropos. Podríamos incluir también a aquellos pacientes con IC avanzada que están siendo evaluados por primera vez para TC y que, sin tener ninguna contraindicación, estimamos que se beneficiarían de una VAD como BTT por algunos de los motivos indicados previamente.Las actuales guías europeas incluyen este primer grupo y recogen la indicación de una asistencia uni o biventricular como BTT con nivel de recomendación y evidencia iia C47. Así mismo, las guías americanas, donde el uso de estos dispositivos está ampliamente establecido, determinan un nivel de indicación iia B para el BTT en el mismo grupo poblacional48.
- 2.
Pacientes con IC aguda refractaria y en deterioro progresivo sin posibilidad de valoración para trasplante. En este caso el soporte de corto plazo sería la opción más adecuada como puente a una decisión que posteriormente podría reconvertirse a un BTT, pero nunca debería ser la estrategia inicial49.Las guías Americanas limitan el uso del soporte de corto plazo a casos seleccionados y como puente a decisión (iia B), no directamente a trasplante, en correlación con los problemas de durabilidad que ya hemos mencionado previamente. Aunque las guías europeas mencionan el mismo manejo, establecen un grado de recomendación iib C para este contexto.
- 3.
Pacientes con contraindicaciones reversibles para trasplante y que pueden ser potencialmente solventadas durante el SMC. Se enmarcarían en la estrategia llamada puente a candidatura, sin clara indicación todavía en la guías de práctica clínica50. Algunos de los ejemplos más frecuentes y relevantes serían:
- a.
Hipertensión pulmonar: múltiples estudios avalan la eficacia tanto de dispositivos pulsátiles como de flujo continuo en la reducción significativa de hipertensión pulmonar no reversible durante el primer año de soporte, sin que los valores iniciales contribuyan a un aumento significativo de la mortalidad postrasplante51-54.
- b.
Obesidad: mientras que las guías establecen un límite de índice de masa corporal en torno a 35 para la cirugía de implante de LVAD, el límite habitual aceptado para trasplante sería 31. En ese margen podría plantearse el implante de una asistencia como puente a pérdida de peso, tema todavía controvertido y con resultados dispares que parecen ser más exitosos con los antiguos dispositivos pulsátiles55,56.
- c.
Neoplasias: el antecedente tumoral sigue siendo polémico a la hora de indicar el TC, aunque los nuevos tratamientos han modificado claramente la supervivencia y pronóstico de estas enfermedades por lo que el tiempo libre de recurrencia debe ser individualizado en cada caso57. Aunque no existen directrices claras al respecto, el implante de SMC de largo plazo como puente a la consecución de un tiempo libre de enfermedad aceptable para trasplante es una estrategia que cada vez se plantea más frecuentemente en la práctica clínica.
- a.
Los datos de mortalidad han mejorado progresivamente en la última década, algo presumiblemente atribuible a la mejor selección de candidatos, la mayor durabilidad de los nuevos dispositivos, las reducciones de complicaciones y también la experiencia acumulada por los centros especializados58. La supervivencia a largo plazo se ha estabilizado en la era de las asistencias de flujo continuo, con valores a los 12 y 24 meses del implante del 80 y el 70%, respectivamente. Estos datos son claramente más favorables en aquellos casos realizados como BTT, donde la supervivencia al año se estima en casi el 85%, siendo el valor casi un 10% menor en la DT.
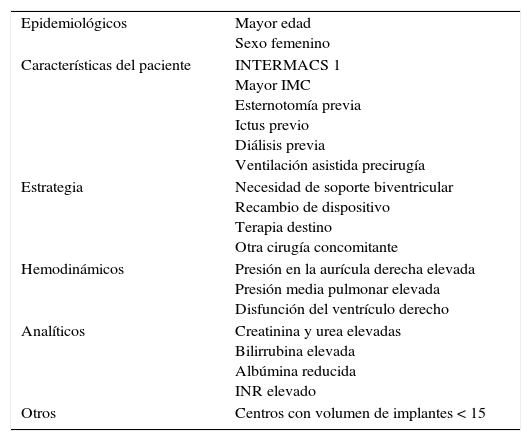
Las causas de mortalidad en el primer mes siguen siendo mayoritariamente el fallo multiorgánico, los eventos neurológicos y la disfunción de ventrículo derecho. A largo plazo, los sangrados e infartos cerebrales se convierten en la causa más significativa, seguidos del fallo multiorgánico y las infecciones. La necesidad de asistencia biventricular es el predictor de mortalidad más determinante (50% de mortalidad al año del implante), seguido por el perfil de paciente en INTERMACS 1 o la necesidad de diálisis previa. Así mismo, el recambio de asistencia sigue causando una aumento de la mortalidad del 25-30% con respecto al primer implante, tanto a corto como largo plazo41. Otros factores de riesgo significativo se recogen la tabla 3.
Factores de riesgo que han demostrado aumentar la mortalidad tras el implante de LVAD
| Epidemiológicos | Mayor edad Sexo femenino |
| Características del paciente | INTERMACS 1 Mayor IMC Esternotomía previa Ictus previo Diálisis previa Ventilación asistida precirugía |
| Estrategia | Necesidad de soporte biventricular Recambio de dispositivo Terapia destino Otra cirugía concomitante |
| Hemodinámicos | Presión en la aurícula derecha elevada Presión media pulmonar elevada Disfunción del ventrículo derecho |
| Analíticos | Creatinina y urea elevadas Bilirrubina elevada Albúmina reducida INR elevado |
| Otros | Centros con volumen de implantes < 15 |
En el ámbito pediátrico, el número de implantes sigue siendo todavía más reducido, pero con un incremento que en el año 2014 llegó a ser cercano al 50%. Entre la población menor de 6 años, los dispositivos pulsátiles siguen predominando y en concreto el EXCOR Berlin Heart supone más del 50% de los implantes. En la franja de edad superior a 6 años, domina ya la tecnología de flujo continuo, especialmente en las edades más cercanas a la mayoría de edad. En estos casos la supervivencia al año es superior a los adultos, acercándose al 90%, y afortunadamente en este periodo se trasplantan también más frecuentemente, un 66%39.
Los eventos adversos de morbilidad tras el implante se han reducido progresivamente año tras año, aunque siguen teniendo un impacto significativo en el seguimiento de estos pacientes41. Las infecciones sistémicas del dispositivo son una de las más frecuentes causas de ingresos y mortalidad, aunque la infección del driveline parece haber disminuido con la llegada de los actuales dispositivos que disponen de drivelines de menor diámetro. Los eventos de sangrado inmediatamente posquirúrgicos son causa de reintervención en un 20% de los casos59. Aun así, también se han reducido significativamente en la última era, probablemente gracias a la optimización de la anticoagulación inmediata tras la cirugía y a largo plazo. Sin embargo, los sangrados gastrointestinales sí han aumentado con la llegada de los dispositivos de flujo continuo, efecto atribuible al factor de von Willebrand adquirido y las malformaciones de tipo angiodisplasia desarrolladas en esta población60,61. Las arritmias supra y ventriculares, a pesar de ser frecuentemente toleradas hemodinámicamente, son también una causa frecuente de morbilidad e ingreso por riesgo de descompensación o inducción de fallo del ventrículo derecho. El fallo respiratorio y el deterioro renal son la disfunción de órgano periférico más frecuentes, pero son sin duda los temidos eventos neurológicos los que tiene un mayor impacto en la mortalidad del paciente y su calidad de vida62. A pesar de la búsqueda continua de factores de riesgo (sexo femenino, edad, hipertensión arterial, diabetes) e intentos de optimización de los rangos de anticoagulación, los sangrados e infartos isquémicos cerebrales siguen siendo uno de los talones de Aquiles de la modernas asistencias, sin que todavía ningún dispositivo haya podido demostrar una clara mejoría de la incidencia, que persiste en rangos en torno al 12-20%30,41,62. La temida disfunción del ventrículo derecho ha sido objeto de múltiples estudios a fin de definir su incidencia y evitar su ocurrencia63,64. Su frecuencia ha disminuido en los últimos años en probable relación con una mejor selección de pacientes, optimización de la velocidad del dispositivo y manejo médico más agresivo39. Sigue siendo una causa significativa de mortalidad en el periodo posquirúrgico, pero su impacto es menor en el soporte a largo plazo12.
Las tasas de disfunción del dispositivo han mejorado significativamente con las modernas asistencias de flujo continuo, aunque siguen siendo una frecuente causa de mortalidad (3.5%). Finalmente, la trombosis del dispositivo es posiblemente la disfunción más frecuente y temida, aunque su tasa actual se estima en torno al 5%.
Trasplante con soporte mecánico circulatorioAproximadamente un tercio de los implantes realizados se trasplantan durante el primer año, siendo la proporción un 10% menor entre aquellos no listados en el momento de la cirugía39.
El registro de la Sociedad Internacional de Trasplante Cardiaco y Pulmonar (ISHLT) publicaba recientemente un número creciente de TC en 2013, con un total de 4.477 pacientes (6,3% más que el año previo), de los cuales un 42% tenía una LVAD previamente. Si tuviéramos que destacar un cambio demográfico en los receptores de TC en la última era, este sería sin duda el exponencial aumento de pacientes trasplantados con SMC, mayoritariamente a expensas de implantes de LVAD como BTT. Esta estrategia es más frecuente cuanto menor es la edad del paciente, aunque el aumento relativo en las últimas eras ha sido superior en los pacientes de mayor edad, probablemente por una creciente tendencia a utilizar las asistencias como puente a candidatura en pacientes de edad más avanzada65. Entre 1992 y 2003, el 22% de los trasplantes cardiacos se realizaron con SMC previo, de los cuales el 13,2% tenía una LVAD y el 0,3% una ECMO. En la era de las primeras asistencias de flujo continuo, 2004-2008, todos los parámetros aumentaron con un 26% de procedimientos realizados en pacientes con SMC. En la actualidad, 2009-2014, los datos se han incrementado de nuevo hasta un 46% de cirugías realizadas con SMC: LVADS 36,6%, RVAD 3,2%, TAH 1,4% y ECMO 1,2%66.
Tradicionalmente se había considerado el SMC como factor de mal pronóstico postrasplante, una realidad que en la era de los dispositivos de flujo continuo se ha disipado, ya que los últimos datos muestran ausencia de diferencias significativas en las curvas de supervivencia entre los pacientes trasplantados con una LVAD, sin LVAD pero con inotropos o sin ninguna de ambas opciones. El retrasplante con un LVAD es infrecuente, pero sí empeora claramente la supervivencia con respecto a un retrasplante en ausencia de SMC o un trasplante primario con LVAD9. La necesidad de SMC derecho asociado al izquierdo es también un factor de riesgo de mortalidad y morbilidad al año del trasplante. Es destacable la clara correlación entre soporte de corto plazo, específicamente ECMO, y el aumento de mortalidad postrasplante así como fallo temprano del injerto, un fenómeno que se ha mantenido durante las últimas décadas y a pesar de lo cual es curioso y paradigmático el incremento de trasplantes en ECMO detectado recientemente (33%).
En la población pediátrica, el uso de SMC es menos frecuente, 34%, pero también se ha incrementado en los últimos años67. El porcentaje de trasplantes en TAH o LVAD ha aumentado a expensas de un mayor número con asistencias biventriculares (6,1%), que a día de hoy son ya más frecuentes que el trasplante pediátrico en ECMO (4,4%), un fenómeno que probablemente obedece a las exitosas experiencias publicadas en BTT con dispositivos biventriculares tipo Berlin Heart Excor (Pediatrics)33,68, con mortalidad postrasplante similar a pacientes sin asistencia previa. Al igual que en adultos, la supervivencia postrasplante con LVAD no difiere significativamente con respecto a los trasplantes realizados sin SMC. El trasplante pediátrico en ECMO, a pesar de estar más extendido, sigue ofreciendo resultados pobres con una mayor mortalidad a 3-4 años (aproximadamente 35% vs. 14% sin SMC)36,69.
Análisis de costesA pesar de la efectividad clínica ampliamente demostrada por las VAD, es un tratamiento todavía no coste-eficiente en relación con los estándares actuales70. Sin embargo, los datos son extremadamente variables entre diferentes estudios que muestran costes por años de vida ajustados por calidad (AVAC), que varían desde los 48.000 a los 400.000 dólares, dependiendo del tipo de estrategia y el dispositivo analizado71,72. Los costes con respecto al TC son aproximadamente un 25% superiores al año de vida a expensas de mayor número de reingresos y estancia hospitalaria73.
Sin embargo, sí parece claro que las modernas asistencias de flujo continuo han supuesto una clara mejoría en términos de coste-efectividad con respecto a las pulsátiles, reduciendo los costes por AVAC en casi un 75%, principalmente gracias a los más favorables resultados de supervivencia, complicaciones, estancia hospitalaria y menores costes de implante74,75. Un estudio reciente en el Reino Unido mostraba un incremento de coste por AVAC de aproximadamente 85.000 dólares con respecto al tratamiento médico en pacientes implantados como BTT, siendo ya solo un 15% superior a los estándares aceptados por las guías NICE76.
Aun así, la carencia de estudios de alta calidad al respecto, el continuo desarrollo y cambiante tecnología y la ausencia de estudios epidemiológicos sobre la incidencia real de la IC avanzada impiden todavía realizar estudios de costes realistas77.
Controversia españolaEl recientemente presentado informe del registro ESPAMACS nos permite realizar una primera valoración objetiva de la actividad española en cuanto a MCS como BTT78. Mientras el perfil de paciente, las complicaciones o el resultado postasistencia no difieren significativamente de las series internacionales, sí destacan algunas particularidades con respecto a otros países.
La primera y más significativa es el persistente predominio del flujo pulsátil en el implante de asistencias de medio-largo plazo, a pesar del reciente incremento de dispositivos de flujo continuo. Esta realidad contrarresta con el abandono progresivo y significativo de la tecnología pulsátil a nivel internacional en la última década39. El mayor beneficio del flujo continuo en el BTT reside en la durabilidad, la menor incidencia de complicaciones y la mejoría de la calidad de vida, características que quizás cobren menos importancia en entornos con más donantes y menores listas de espera para TC como es el caso de España. En este contexto, el menor precio de los dispositivos pulsátiles puede contrarrestar sus carencias respecto a los dispositivos de flujo continuo.
Es también llamativa la reducida indicación como DT de las asistencias de largo plazo, especialmente en un país con una significativa tradición y relevancia internacional en cuanto al tratamiento de la IC avanzada. De nuevo, la amplia experiencia y fidelización de la comunidad española al TC y la reciente crisis económica pueden ser parte de la justificación que ha ralentizado la incorporación de España a este campo79. Aun así, la creciente población de pacientes con IC avanzada cuya edad o comorbilidades contraindican el trasplante pero cuya calidad de vida exige alternativas terapéuticas, la necesidad de un soporte más prolongado para conseguir el puente a candidatura y el progresivo aumento de las listas de espera80 hacen imparable el uso de esta tecnología para mantener los estándares de calidad en la atención a la población con IC.
Es también llamativa en la realidad española la amplia distribución de centros con actividad reciente en el implante de LVAD, pero con volúmenes anuales muy escasos. Esta dispersión se justifica probablemente por el amplio número de centros con unidades de IC avanzada con respecto a otros países europeos y la compartimentación del sistema nacional de salud en comunidades autónomas. Mientras el aumento de implantes en los 2 últimos años responde a una necesidad clínica, el bajo volumen de algunos centros dificulta todavía la valoración de los resultados inter e intrahospitalariamente. El incremento del volumen, experiencia y personal especializado en el manejo de estos dispositivos es imprescindible para poder equiparar y comparar los resultados con los datos internacionales58,81.
El futuroMuchos son los retos tecnológicos a los que se enfrentan los dispositivos del futuro buscando mejores resultados en cuanto a durabilidad, menores complicaciones y mejoría de calidad de vida. Controladores de menor peso y tamaño, variabilidad de flujo adaptable a las necesidades del paciente o transmisión y control de información remota son algunas de las características buscadas por los dispositivos en estudio82. Sin duda la desaparición del driveline mediante tecnología wireless es uno de los centros de atención y ya existen diferentes compañías que trabajan en proyectos de estas características, sin que podamos todavía visualizar su materialización a corto plazo83. La reducción de los eventos tromboembólicos especialmente a nivel neurológico es también una necesidad de primer nivel que pasa por buscar materiales más biocompatibles y reducir las necesidades de tratamiento anticoagulante.
En cuanto al uso y la expansión de las asistencias como BTT, no cabe duda de que el reto se encuentra ahora en valorar los beneficios de estos dispositivos en etapas más tempranas del desarrollo de la IC avanzada, estadios INTERMACS 5, 6 y 7, donde todavía es incierta su indicación.
ConclusionesEl uso del SMC como BTT es una terapia ampliamente consolidada a nivel internacional y respaldada por la guías de práctica clínica. Su expansión es infrenable con un significativo aumento anual de implantes que responde a las crecientes necesidades poblacionales junto a la consecución en la última década de mejores resultados en supervivencia a corto y largo plazo, calidad de vida y reducción progresiva de la tasa de complicaciones. Dichos beneficios no solo aportan una alternativa a pacientes en espera de un TC, sino que también permiten a aquellos con contraindicaciones reversibles disponer del tiempo y la oportunidad de convertirse en adecuados candidatos.
Los factores que más han influido en este progreso son los dispositivos de flujo continuo, una mejor selección de pacientes evitando a aquellos «demasiado inestables o avanzados» y, por supuesto, el aumento de la experiencia en el implante quirúrgico y el manejo médico de complicaciones tempranas y tardías.
Aun así, todavía son muchas las limitaciones de esta tecnología, como el coste, su durabilidad, complicaciones y aplicabilidad a un espectro de pacientes limitado. De ahí que la recomendación actual sea su implementación solo en centros con personal de enfermería, médico y quirúrgico especializado47. Una mejoría progresiva de la tecnología para solventar las complicaciones, la mayor experiencia de los equipos en el manejo de las mismas y su generalización para permitir un coste más reducido contribuirán en el futuro a seguir consolidando y definiendo su papel en la IC avanzada.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesA. Suarez-Barrientos ha recibido remuneración por participar en grupos de trabajo de Heartware y ha participado en presentaciones y ponencias educativas no remuneradas para Heartware; Mercé V. Electromedicina ha recibido financiación para gastos de viajes académicos y educativos.
El resto de los autores declaran no tener ningún conflicto de intereses.