El manejo conservador con inotrópicos y vasopresores en el shock cardiogénico ha mostrado ser insuficiente en muchos pacientes para mantener una perfusión adecuada y prevenir el fallo multiorgánico irreversible, lo que ha llevado a la mejora y a la utilización cada vez mayor de diferentes dispositivos de asistencia mecánica circulatoria de corta duración (balón intraaórtico de contrapulsación, TandemHeart, Impella, oxigenación de membrana extracorpórea [ECMO] y CentriMag Levitronix). Por ser la ECMO el dispositivo más versátil —capaz de proporcionar soporte a pacientes con fallo cardíaco, fallo respiratorio o fallo combinado cardiopulmonar durante días a semanas—, sus indicaciones se han ido diversificando, con un uso e interés en adultos creciente durante los últimos años, gracias también al progreso tecnológico y a la mejora en sus resultados. Es por ello esencial familiarizarse con la fisiología, las indicaciones, las estrategias de canulación, los principios de manejo y la evidencia sobre esta terapia, en la que enfatizaremos especialmente en esta revisión.
Medical therapy with inotropes and vasopresors in the treatment of cardiogenic shock has failed in many patients to maintain adequate perfusion and to prevent irreversible end-organ failure, leading to improvement and increasing utilization of temporary mechanical circulatory support devices (intra-aortic balloon pump, TandemHeart, Impella, extracorporeal membrane oxygenation [ECMO] and CentriMag Levitronix). ECMO provides days to weeks of support for patients with respiratory, cardiac, or combined cardiopulmonary failure, and its use in adults is increasing as well as indications have expanded, due to advances in technology and improved outcomes. In this article specific emphasis is placed on physiology, clinical indications, cannulation techniques, management and evidence for ECMO, as it is essential to become familiar with this device.
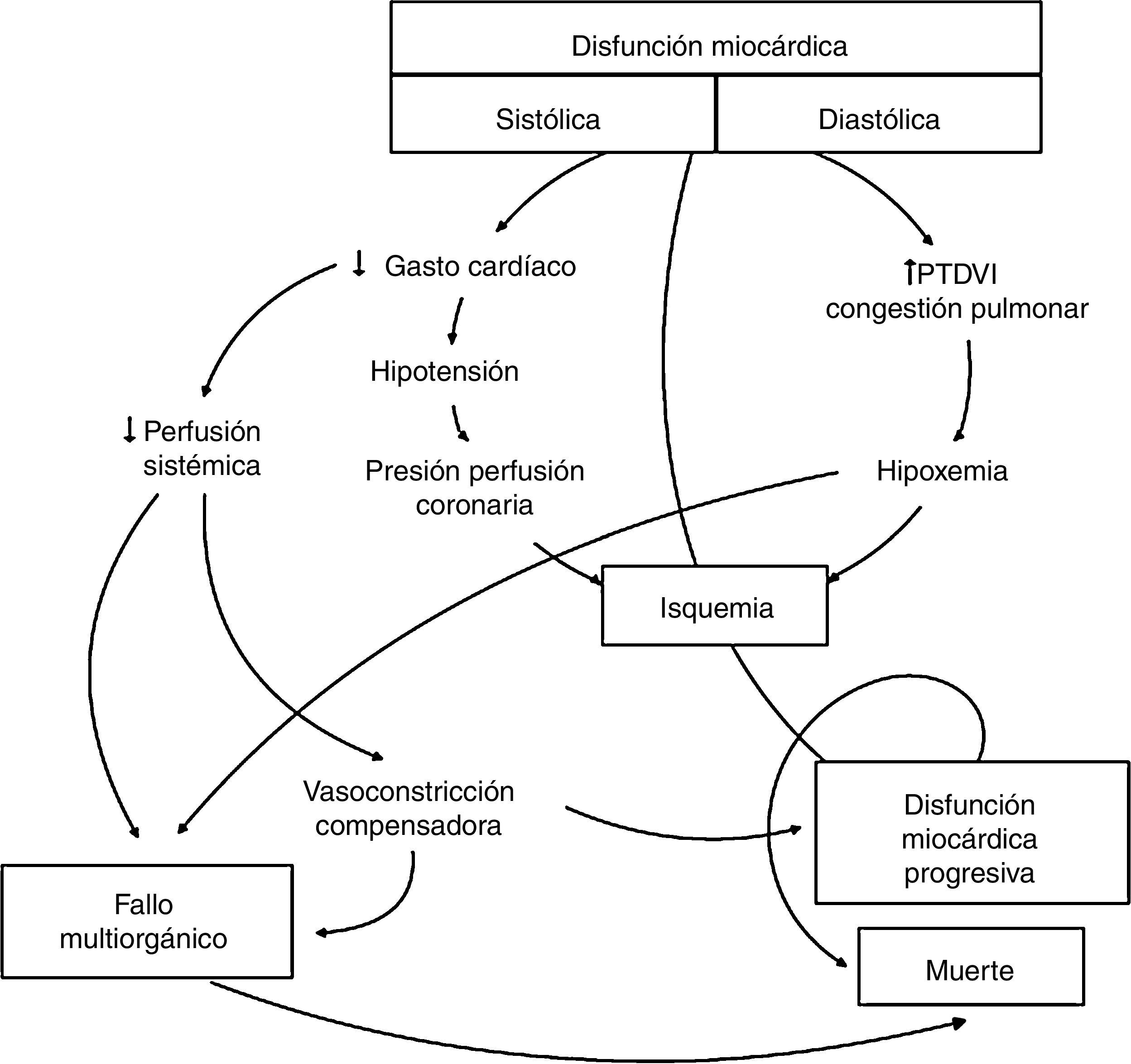
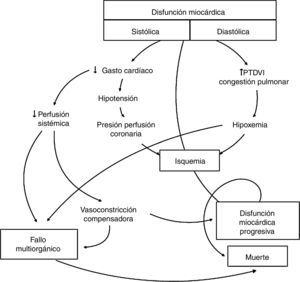
El shock cardiogénico, definido como disfunción miocárdica contráctil, bajo gasto cardíaco e hipoperfusión tisular1, puede ser consecuencia de lesiones isquémicas agudas o procesos no isquémicos, con o sin insuficiencia cardíaca crónica subyacente. El manejo conservador del shock cardiogénico con inotrópicos y vasopresores está asociado a serias limitaciones, incluyendo arritmias, aumento del consumo miocárdico de oxígeno, isquemia miocárdica y compromiso de la microcirculación tisular, siendo en muchos casos insuficiente para dar un soporte circulatorio adecuado (fig. 1), con alta tasa de mortalidad (la mortalidad del shock cardiogénico refractario al tratamiento convencional supera el 80%3). La mejora de la supervivencia depende en gran medida de conseguir un soporte hemodinámico para mantener una perfusión sistémica adecuada, compensando el mecanismo de bombeo del corazón disfuncionante y evitando así el desarrollo de un fallo multiorgánico irreversible, de ahí que la asistencia mecánica circulatoria (AMC) sea una opción terapéutica cada vez más extendida4. El implante a tiempo de un dispositivo de AMC resulta en una rápida estabilización y mejoría hemodinámica, disminuyendo la necesidad de inotrópicos, vasopresores y diuréticos, y disminuyendo el riesgo de fallo multiorgánico progresivo.
Fisiopatología del shock cardiogénico. Modificado de Harrison's Principles of Internal Medicine2.
PTDVI: presión telediastólica del ventrículo izquierdo.
El otro objetivo de la AMC es descargar el ventrículo disfuncionante (reduciendo así el consumo de oxígeno y promoviendo un remodelado favorable). Sin embargo, en el caso de los dispositivos de AMC de corta duración, la eficacia para promover la recuperación miocárdica es limitada.
La AMC de corta duración (también conocida como AMC temporal) se refiere a un grupo de dispositivos normalmente usados durante menos de 30días, entre los que destacan: balón intraaórtico de contrapulsación (BIACP), TandemHeart, Impella, oxigenación de membrana extracorpórea (ECMO) y CentriMag Levitronix.
IndicacionesEl rápido desarrollo y mejora de los distintos dispositivos ha permitido extender sus indicaciones, que ya no se limitan al tratamiento de pacientes con shock cardiogénico refractario de diversa índole (perfil Interagency Registry for Mecanically Assisted Circulatory Support [INTERMACS]5 1, «crash and burn»), sino también a su uso como soporte profiláctico en procedimientos de cardiología intervencionista de alto riesgo (aquellos con alta probabilidad de compromiso hemodinámico). Ha permitido también promover su uso más precoz (INTERMACS 2, deterioro progresivo a pesar de soporte inotrópico), antes de que se establezca el círculo de shock progresivo con compromiso de la función de órgano diana y activación de la respuesta inflamatoria sistémica2. El inicio temprano de la AMC minimiza además los efectos deletéreos de las catecolaminas a dosis altas (la alteración de la microcirculación predice pobres resultados en los pacientes con shock cardiogénico6).
En el caso de la ECMO, las indicaciones se amplían, puesto que también da soporte respiratorio (tabla 1).
Indicaciones de la oxigenación de membrana extracorpórea (ECMO)
| Cardíaco (ECMO VA) | Respiratorio (ECMO VV) |
|---|---|
| Shock cardiogénico | SDRA |
| Postinfarto agudo de miocardio | Neumonía bacteriana o viral grave |
| Tormenta arrítmica refractaria | Síndromes de aspiración |
| Cardiomiopatía asociada a sepsis | Proteinosis alveolar |
| Miocarditis fulminante | Fallo respiratorio hipercápnico |
| Intoxicación aguda por fármacos cardiodepresores | Trasplante pulmonar: |
| Shock poscardiotomía | Fallo primario del injerto postrasplante pulmonar |
| Fallo primario del injerto tras trasplante cardíaco | Puente al trasplante pulmonar |
| Miocardiopatía crónica: puente al trasplante cardíaco o implante de dispositivo de asistencia | ECMO intraoperatorio |
| Prevención y/o tratamiento de fallo ventricular derecho tras implante de DAVI | Corrección quirúrgica de obstrucción crítica de la vía aérea (papiloma traqueal) |
| Soporte periprocedimiento en intervencionismos cardíacos percutáneos de alto riesgo | Hernia diafragmática congénita, aspiración de meconio (ECMO pediátrico) |
| Hipertensión pulmonar | |
| Resucitación cardiopulmonar extracorpórea |
DAVI: dispositivo de asistencia ventricular izquierda; SDRA: síndrome de distrés respiratorio agudo.
La insuficiencia cardíaca aguda puede deberse a fallo ventricular izquierdo, derecho o ambos. La descompensación de la función ventricular izquierda puede ocurrir de forma aguda debido a múltiples eventos, incluyendo shock poscardiotomía, miocarditis, infarto agudo de miocardio (IAM), enfermedad valvular (p.ej., insuficiencia mitral aguda). Por otro lado están los pacientes con insuficiencia cardíaca crónica, en los que la descompensación aguda puede estar precipitada por isquemia, arritmias, disfunción renal o pulmonar, aunque no suele encontrarse un desencadenante claro. El fallo ventricular derecho aislado puede ser secundario a eventos pulmonares graves (tromboembolismo pulmonar, neumonía o distrés respiratorio agudo) o a infarto ventricular derecho, pero también puede ser secundario a la disfunción ventricular izquierda.
La AMC de corta duración en el manejo del shock cardiogénico ofrece varias posibilidades7: puente a la recuperación (p.ej., en shock poscardiotomía, miocarditis o shock post-IAM), puente al trasplante o a un dispositivo de AMC de larga duración8 (estrategia esta última conocida como «puente al puente») y puente a la decisión (en aquellos pacientes en los que existen dudas sobre el estado neurológico o sobre la reversibilidad del fallo multiorgánico, en los que la AMC permite tiempo para una evaluación clínica completa y/o la potencial recuperación).
ContraindicacionesAntes de iniciar la AMC es importante considerar aquellas situaciones en las que el paciente no se va a beneficiar de la AMC (tratamiento fútil), como enfermedades preexistentes que afectan a la calidad de vida o al pronóstico vital (p.ej., daño neurológico irreversible o enfermedad neoplásica diseminada). De igual modo, deberíamos descartar el inicio de la AMC cuando la lesión cardíaca sea irrecuperable y el paciente no sea candidato al trasplante cardíaco o a otro dispositivo de AMC como terapia destino, ya que en esos casos no disponemos de estrategia de salida. La contraindicación para la anticoagulación es generalmente también una contraindicación para el implante de un dispositivo de AMC.
Hay además contraindicaciones más específicas para cada dispositivo, como la presencia de trombos intracavitarios o prótesis aórtica mecánica para los dispositivos tipo Impella, o la enfermedad vascular periférica severa para los dispositivos de implante periférico (sobre todo si el implante es percutáneo).
En la tabla 2 se resumen las contraindicaciones para la ECMO, que pueden extrapolarse casi en su totalidad al resto de dispositivos de AMC de corta duración.
Contraindicaciones para la oxigenación de membrana extracorpórea (ECMO)
| Contraindicaciones absolutas |
| Lesión cardíaca no recuperable y no candidato a trasplante cardíaco o terapia destino con DAVI |
| Enfermedad neoplásica diseminada |
| Daño neurológico irreversible |
| Parada cardíaca no presenciada |
| RCP prolongada sin perfusión tisular adecuada |
| Disección de aorta no reparada |
| Insuficiencia aórtica severa |
| Enfermedad crónica irreversible de órgano diana (enfisema, cirrosis, enfermedad renal en diálisis, demencia) |
| Fracaso multiorgánico establecido e irreversible (pacientes que han estado demasiado tiempo con tratamiento convencional) |
| Ventilación mecánica >7 días |
| Contraindicaciones relativas |
| Contraindicación para anticoagulación |
| Alto riesgo de sangrado |
| Enfermedad vascular periférica |
| Edad avanzada(?) |
| Obesidad |
| Sepsis |
DAVI: dispositivo de asistencia ventricular izquierda; RCP: reanimación cardiopulmonar.
Los dispositivos de asistencia pueden distinguirse según el método de implante (percutáneo o quirúrgico, pudiendo ser este último a su vez periférico o central), el tipo de soporte circulatorio (ventricular izquierdo, ventricular derecho o biventricular), o si se combinan con una membrana de oxigenación. También pueden diferenciarse según su disposición con respecto al corazón, encontrando así dispositivos que trabajan en serie (dispositivos de flujo axial) y dispositivos que asisten en paralelo (bombas centrífugas).
La forma más común de soporte circulatorio usada hasta la actualidad ha sido el BIACP, pero estudios recientes cuestionan su beneficio en supervivencia en el shock cardiogénico (el estudio aleatorizado IABP-shockII9 ha mostrado que el BIACP no reduce la mortalidad a 30días en pacientes con shock cardiogénico tras IAM). Esto ha resultado en el uso cada vez mayor de formas avanzadas de AMC, fundamentalmente dispositivos de asistencia ventricular de implante periférico. Sin embargo, ni Impella ni TandemHeart han demostrado superioridad al BIACP en pequeños ensayos aleatorizados controlados10. Aunque faltan estudios que demuestren su superioridad frente a los otros dispositivos, parece que la ECMO es la que ofrece mayores ventajas, destacando frente al resto por su rapidez de implante, la posibilidad de asistir ambos ventrículos a altos flujos y el potencial de asistir pacientes con daño pulmonar concomitante cuando es necesario, lo que deriva en su gran versatilidad.
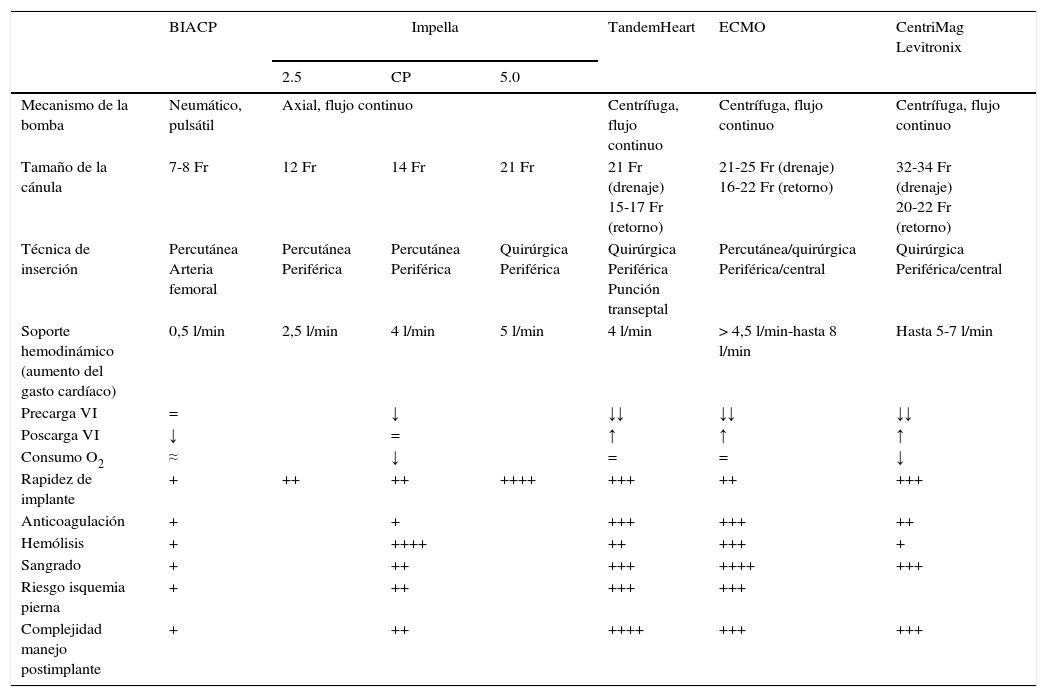
En la tabla 3 se resumen las características de los dispositivos de AMC de corta duración más utilizados en la actualidad.
Comparación de los dispositivos de asistencia mecánica circulatoria
| BIACP | Impella | TandemHeart | ECMO | CentriMag Levitronix | |||
|---|---|---|---|---|---|---|---|
| 2.5 | CP | 5.0 | |||||
| Mecanismo de la bomba | Neumático, pulsátil | Axial, flujo continuo | Centrífuga, flujo continuo | Centrífuga, flujo continuo | Centrífuga, flujo continuo | ||
| Tamaño de la cánula | 7-8 Fr | 12 Fr | 14 Fr | 21 Fr | 21 Fr (drenaje) 15-17 Fr (retorno) | 21-25 Fr (drenaje) 16-22 Fr (retorno) | 32-34 Fr (drenaje) 20-22 Fr (retorno) |
| Técnica de inserción | Percutánea Arteria femoral | Percutánea Periférica | Percutánea Periférica | Quirúrgica Periférica | Quirúrgica Periférica Punción transeptal | Percutánea/quirúrgica Periférica/central | Quirúrgica Periférica/central |
| Soporte hemodinámico (aumento del gasto cardíaco) | 0,5 l/min | 2,5 l/min | 4 l/min | 5 l/min | 4 l/min | > 4,5 l/min-hasta 8 l/min | Hasta 5-7 l/min |
| Precarga VI | = | ↓ | ↓↓ | ↓↓ | ↓↓ | ||
| Poscarga VI | ↓ | = | ↑ | ↑ | ↑ | ||
| Consumo O2 | ≈ | ↓ | = | = | ↓ | ||
| Rapidez de implante | + | ++ | ++ | ++++ | +++ | ++ | +++ |
| Anticoagulación | + | + | +++ | +++ | ++ | ||
| Hemólisis | + | ++++ | ++ | +++ | + | ||
| Sangrado | + | ++ | +++ | ++++ | +++ | ||
| Riesgo isquemia pierna | + | ++ | +++ | +++ | |||
| Complejidad manejo postimplante | + | ++ | ++++ | +++ | +++ | ||
El BIACP se implanta de manera percutánea a través de la arteria femoral, con el balón emplazado en la aorta descendente proximal. El inflado del balón en diástole induce una mayor presión de perfusión diastólica en las arterias coronarias, mejorando la perfusión miocárdica, mientras que el desinflado activo en sístole descarga el corazón al disminuir la poscarga del ventrículo izquierdo (VI). Con esto se consigue un aumento del gasto cardíaco discreto, de hasta 0,5l/min. A pesar de que no hay evidencia probada de su beneficio7, dada la familiaridad con su uso, su fácil implante y manejo, así como la falta de otras alternativas en muchos centros, el BIACP sigue siendo el dispositivo de AMC más usado hoy en día.
ImpellaLos dispositivos Impella (Abiomed Inc, Danvers, MA, EE.UU.) son bombas intravasculares de flujo axial implantadas sobre un catéter, que se colocan a través de la válvula ventriculoarterial (aórtica o pulmonar), impulsando la sangre desde el ventrículo a la aorta/arteria pulmonar, consiguiendo mejorar el gasto cardíaco a la vez que descargan el ventrículo. Existen varias versiones: para asistencia ventricular izquierda, Impella 2.5 y CP —de implante percutáneo— e Impella 5.0 para un mayor soporte, de hasta 5l/min —de implante quirúrgico a través de la arteria femoral o axilar—; Impella RP —de implante percutáneo a través de la vena femoral— está indicada para asistencia ventricular derecha, consiguiendo flujos >4l/min. La mayor desventaja de estos dispositivos es la hemólisis. Su uso está contraindicado en presencia de defectos septales y trombos intracavitarios. Estas bombas están diseñadas para su uso durante menos de 6días (excepto Impella RP, que puede mantenerse hasta 14días), de ahí que su mayor uso sea como soporte en procedimientos de cardiología intervencionista de alto riesgo11,12. Impella RP es una alternativa para el tratamiento del fallo ventricular derecho postimplante de un dispositivo de asistencia ventricular izquierda (DAVI).
TandemHeartEl TandemHeart (Cardiac Assist, Pittsburgh, PA, EE.UU.) utiliza una cánula colocada desde la vena femoral en aurícula izquierda para drenar la sangre oxigenada (descargando también el VI), reinfundiéndola en la aorta abdominal distal o en las arterias ilíacas a través una cánula implantada en la arteria femoral, mediante una bomba centrífuga de flujo continuo que permite hasta 4l/min de soporte. La complejidad de su inserción dada la necesidad de realizar una punción transeptal (con control fluoroscópico) limita su uso. Este dispositivo también puede utilizarse como asistencia ventricular derecha13.
Oxigenación de membrana extracorpóreaLa ECMO es el dispositivo que tiene mayor potencial para un uso clínico más amplio, y por ello vamos a centrarnos más en sus peculiaridades en el siguiente apartado.
Centrimag LevitronixEl CentriMag (Thoratec Corp, Pleasanton, CA, EE.UU.) es un sistema de AMC de corta duración que utiliza una bomba centrífuga, paracorpórea, con la peculiaridad de que funciona por levitación magnética, un diseño para minimizar la fricción y la generación de calor y, con ello, disminuir la hemólisis. Permite asistencia ventricular izquierda, ventricular derecha o biventricular dependiendo del emplazamiento de las cánulas. El CentriMag puede también utilizarse como parte de un circuito de ECMO. En teoría, puede mantenerse la asistencia con esta bomba hasta 30días, pero se han descritos casos en la literatura de uso por encima de los 30días con aceptable supervivencia y sin aumento de las complicaciones relacionadas con el dispositivo14. En nuestro entorno, es una buena alternativa para realizar puente al trasplante en pacientes con insuficiencia cardíaca crónica descompensada.
Elección del dispositivoPara seleccionar el dispositivo deben considerarse: si la función pulmonar es adecuada para un correcto intercambio gaseoso, el grado de soporte hemodinámico requerido y si se trata de un fallo uni o biventricular.
Así, la elección inicial del dispositivo depende de si se precisa asistencia hemodinámica aislada o si se necesita soporte cardiopulmonar; en este último caso, el dispositivo de elección sería la ECMO con configuración venoarterial.
La segunda consideración a tener en cuenta es que, a mayor compromiso de la función cardíaca y de la perfusión sistémica, mayor grado de soporte estará indicado. El BIACP es el dispositivo más fácil de implantar, pero requiere un trigger para sincronización con el ciclo cardíaco (y, por tanto, un ritmo estable) y da poco soporte sistémico, por lo que es insuficiente cuando el compromiso hemodinámico es muy severo. En muchos laboratorios de hemodinámica y electrofisiología el sistema Impella se ha convertido en el dispositivo de elección, dada su facilidad de implante (menor calibre y punto único de canulación) y su efectividad para mantener una adecuada perfusión sistémica cuando no se precisa un soporte hemodinámico a altos flujos (uso profiláctico en muchos casos para intervencionismos de alto riesgo).
En caso de fallo biventricular (que además es el más frecuente en situación de shock cardiogénico refractario), cuando hay que realizar el implante del dispositivo de AMC de forma urgente o emergente, las opciones se limitan prácticamente al ECMO.
Además de las consideraciones clínicas enumeradas, hay que tener en cuenta también los recursos disponibles (muchas veces hay que realizar el implante de manera emergente, sin posibilidad de control fluoroscópico y/o ecocardiográfico, requerido para el implante de algunos dispositivos) y qué experiencia tiene el equipo; siempre será mejor manejar un pequeño número de dispositivos correctamente, que intentar abarcarlos todos cuando no hay un volumen suficiente de casos que permita alcanzar experiencia. Además, la evidencia indica que la experiencia en el manejo de los pacientes con ECMO es un factor determinante en los resultados15, por lo que debería plantearse la creación de centros de referencia a los que transferir los pacientes con este tipo de terapia para su manejo.
Oxigenación de membrana extracorpóreaEvolución de la oxigenación de membrana extracorpóreaLa ECMO, cuyo origen se remonta a la técnica de circulación extracorpórea (Gibbon, 1953)16, ha estado disponible desde hace décadas como un tratamiento de soporte para la enfermedad cardiopulmonar severa; sin embargo, su uso estaba asociado a altas tasas de complicación y malos resultados (hasta el 90% de mortalidad). Pero la ECMO ha evolucionado en diseño, tecnología, selección de pacientes, técnicas de inserción, dispositivos y manejo; la mejora consecuente en sus resultados ha llevado a que sus indicaciones se hayan extendido17,18. Desde que el uso de la ECMO se describió por primera vez en 1974, la Extracorporeal Life Support Organization (ELSO) ha registrado más de 73.000 implantes de ECMO, con más de 19.000 en pacientes adultos19. El uso de la ECMO en adultos se ha expandido (más de un 400% de 2006 a 2011 en EE.UU.)20 debido a varios factores, entre los que destacan: la publicación del estudio CESAR21 en 2009, que mostró la mejora en la supervivencia en adultos con síndrome de distrés respiratorio agudo (SDRA) aleatorizados a la consideración de ECMO comparados con los pacientes tratados convencionalmente; la pandemia de gripe H1N1 de 2009 y 2010, que resultó en un aumento significativo del uso de la ECMO en el tratamiento del fallo respiratorio severo (con excelentes resultados, tasas de supervivencia del 68-77%)22, y por último, la mejora tecnológica (oxigenadores de polimetilpentano, bombas centrífugas de segunda generación y cánulas con diseño específico).
Hoy en día es un arma imprescindible y coste-efectiva para el manejo de los pacientes con fallo cardiorrespiratorio refractario, cuyo desenlace sin ECMO es fatal en la mayoría de casos. Entre sus ventajas frente a otros dispositivos de AMC de corta duración destacan: la rapidez y facilidad de implante —a pie de cama si es necesario, incluso mientras se realizan maniobras de reanimación cardiopulmonar—, permite soporte circulatorio biventricular, y la ECMO rápidamente mejora la oxigenación tisular en situaciones de shock cardiogénico con edema pulmonar severo.
Sin embargo, los resultados siguen siendo moderadamente satisfactorios (según datos recientes de la ESLO: 60% supervivencia hospitalaria en fallo respiratorio y 45% en fallo cardíaco)19.
Indicaciones de oxigenación de membrana extracorpórea y resultadosLa ECMO está indicada en la insuficiencia cardíaca y/o respiratoria que no responde al tratamiento convencional; por tanto, se establece normalmente de manera urgente o emergente cuando otras modalidades de tratamiento han fallado. Se usa como asistencia temporal (días/semanas), esperando la recuperación de órganos o como puente a una terapia más permanente o al trasplante18. En la tabla 1 se resumen las indicaciones de la ECMO, tanto para fallo cardíaco como para fallo respiratorio.
Indicaciones de oxigenación de membrana extracorpórea para fallo cardíacoLa ECMO está indicada en el shock cardiogénico refractario de diversa índole, definido como índice cardíaco <2l/min/m2 e hipotensión (presión arterial sistólica <90mmHg) a pesar de adecuado volumen intravascular, 2 fármacos inotrópicos a altas dosis, y BIACP (premisa esta última que no siempre se cumple); en la parada cardíaca que no responde a las maniobras de reanimación cardiopulmonar, y en arritmias ventriculares malignas refractarias.
Shock cardiogénico tras infarto agudo de miocardioEn un estudio retrospectivo observacional donde se compararon 219 pacientes con shock cardiogénico post-IAM tratados con intervencionismo coronario percutáneo y ECMO entre 2002 y 2009 con un grupo de control histórico de 115 pacientes tratados entre 1993 y 2002 sin ECMO, la supervivencia a 30días en el grupo ECMO fue del 60%, frente al 35% del grupo sin ECMO (p=0,003)23.
Miocarditis fulminanteEn casos de miocarditis fulminante, la ECMO puede ser tan eficaz como un dispositivo de asistencia ventricular, presentado además la ventaja de ser menos invasiva. En un estudio que comparaba la ECMO con dispositivos de asistencia biventricular paracorpóreos pulsátiles, los que recibieron ECMO tuvieron tasas comparables de destete de la terapia y supervivencia al alta sin necesidad de trasplante (83% vs 80%), así como mejoría más rápida de los parámetros de función hepática y renal, a pesar de tener mayor severidad de la disfunción orgánica y peor función ventricular antes del implante del dispositivo24. Otra pequeña serie (14 pacientes) describe un 71% de destete exitoso de la ECMO en pacientes con miocarditis fulminante (tiempo medio de soporte 130h, con un máximo de asistencia de 12días), sobreviviendo todos los pacientes destetados a largo plazo (50meses de seguimiento medio)25, lo que sugiere que los pacientes van bien si sobreviven a la lesión inicial.
Cardiomiopatía asociada a sepsisLa depresión miocárdica es una consecuencia conocida del shock séptico severo. Hay estudios26,27 que sugieren que la ECMO puede asistir estos pacientes que desarrollan fallo cardíaco refractario, si bien hacen falta estudios que determinen si el beneficio de la ECMO supera el riesgo, especialmente en casos con coagulopatía severa.
Nuestra experiencia en el tratamiento del shock cardiogénico no quirúrgico con ECMO incluye pacientes con miocardiopatía dilatada descompensada (46 casos), shock 6post-IAM (44), miocarditis (10), rechazo crónico de TC (6), tormenta arrítmica (3), miocardiopatías valvulares y congénitas (3), toxicidad aguda por fármacos cardiodepresores (1) y asistencia en intervencionismos percutáneos de alto riesgo (2). La supervivencia hospitalaria de la serie es del 57,5% (datos no publicados).
Shock poscardiotomíaLa mortalidad de los pacientes que requieren ECMO por shock poscardiotomía sigue siendo alta28-30 (supervivencia en las distintas series entre el 25 y el 42%), pero la ECMO es una buena alternativa cuando el paciente no puede ser destetado del bypass cardiopulmonar en quirófano. Además, parece que la supervivencia a largo plazo es excelente cuando el paciente sobrevive al período perioperatorio agudo.
En nuestra serie, la supervivencia hospitalaria de los pacientes con shock poscardiotomía tratados con ECMO es del 33% (datos no publicados).
Fallo primario del injerto tras trasplante cardíacoAunque la supervivencia global de los pacientes con fallo primario del injerto (FPI) que requieren ECMO es menor que la de los que no desarrollan FPI, los pacientes con FPI asistidos con ECMO que sobreviven en el período postrasplante precoz tienen supervivencia a largo plazo comparable a la de los receptores sin FPI31,32.
En nuestra serie, sobreviven el 50% de los pacientes que desarrollan FPI que precisa tratamiento con ECMO, de un total de 24 pacientes tratados con ECMO entre diciembre de 2006 y marzo de 2016 (datos no publicados).
Puente al trasplante cardíaco o al implante de un dispositivo de asistencia ventricularLa ECMO también se ha usado como puente al trasplante cardíaco33,34 o al implante de un dispositivo de asistencia ventricular (DAV) —estrategia conocida como «puente al puente»— o como puente a la decisión cuando el pronóstico es incierto35. Sin embargo, dado lo limitado de la duración de este tipo de asistencia, el trasplante o la transición a otro DAV debe realizarse con urgencia, una vez estabilizado el paciente.
Un análisis de la base de datos de la United Network for Organ Sharing desde el 2000 al 2010 mostró que el puente directo con ECMO incrementa el riesgo de muerte tras el trasplante, pero pacientes inicialmente asistidos con ECMO que son transferidos a un DAV izquierda (DAVI), tienen supervivencia postrasplante comparable a la de los pacientes que se asisten únicamente con un DAVI36. A la vista de este estudio y del estudio de Pagani et al.37, parece que el papel apropiado de la ECMO en el puente al trasplante cardíaco es la estabilización inicial de los pacientes antes del implante de un DAVI en aquellos que son candidatos. En pacientes en INTERMACSI y II el implante de un DAVI se asocia a alta mortalidad, por lo que estabilizar el paciente con ECMO permite recuperar la función de órgano diana y disminuir el riesgo perioperatorio8.
Pero parece que el éxito del puente directo al trasplante con ECMO puede radicar en gran medida en la disponibilidad de órganos. La alta tasa de donantes en España y la prioridad nacional en la lista de espera para los pacientes asistidos con ECMO (código cero) nos ha permitido durante un tiempo realizar la estrategia de puente directo al trasplante con ECMO; sin embargo, los tiempos de espera cada vez mayores para un trasplante38 suponen una importante limitación para esta estrategia, que se suma a otras limitaciones bien conocidas del puente directo al trasplante en estos pacientes críticamente enfermos, como el mantenimiento de la ventilación mecánica y la inmovilización, que hacen que la recuperación funcional en el período postrasplante sea difícil.
Desde que se inició la asistencia con ECMO en nuestro hospital (diciembre de 2006) hasta marzo de 2016, se ha implantado la ECMO con la intención de puente al trasplante en un total de 68 pacientes, falleciendo en ECMO antes del trasplante cardíaco el 15% de los pacientes (10 casos); la supervivencia hospitalaria postrasplante cardíaco de la serie fue del 77,5% (lo que supone una supervivencia total del 66% de los pacientes) (datos no publicados).
Fallo ventricular derecho postimplante de dispositivo de asistencia ventricular izquierdaTanto en la prevención como en el tratamiento del fallo ventricular derecho postimplante de DAVI se han utilizado con éxito la ECMO. Hay grupos que describen dejar la ECMO periférica VA39,40 (esta estrategia puede resultar de difícil manejo, al impedir un adecuado llenado del DAVI), mientras que otros proponen reconfigurar el circuito de la ECMO como una asistencia exclusivamente derecha, dejando la cánula de drenaje venosa femoral in situ y recolocando la cánula de retorno en arteria pulmonar, bien de manera directa mediante un injerto de dacrón (esta técnica permite el cierre esternal, con el conducto de dacrón tunelizado a través del margen subcostal, permitiendo su ligadura a nivel cutáneo sin necesidad de reapertura una vez destetada la asistencia)41, o de forma percutánea42. En este escenario, la ECMO permite un tiempo para que el ya comprometido ventrículo derecho (VD) se acostumbre al aumento de la precarga, evitando así la distensión y el fallo ventricular derecho que llevaría a una disminución del llenado del DAVI. El uso del CentriMag está más extendido en esta indicación que la ECMO.
Hipertensión pulmonarLa ECMO está empezando a usarse en pacientes con hipertensión pulmonar descompensada con fallo ventricular derecho concomitante, especialmente cuando se trata de un proceso agudo reversible (p.ej., tromboembolismo pulmonar masivo) o cuando se plantea el trasplante pulmonar43. En esta indicación se requiere normalmente configuración venoarterial para bypasear la alta resistencia del árbol pulmonar y descomprimir el VD, pero se están utilizando configuraciones alternativas para evitar la canulación femoral (cánula de drenaje en vena yugular interna y reinfusión en arteria subclavia)44 y permitir la movilización del paciente.
Resucitación cardiopulmonar extracorpóreaEntre los nuevos usos de la ECMO, destaca el interés creciente por la extracorporeal cardiopulmonary resuscitation (ECPR), término utilizado para describir el inicio de la asistencia para restablecer la circulación durante la parada cardíaca. La ECPR tiene el potencial de mejorar la supervivencia libre de secuelas neurológicas en pacientes con parada cardíaca45. Aunque los estudios observacionales sugieren una mayor supervivencia del ECPR frente a la reanimación cardiopulmonar convencional, la supervivencia global sigue siendo baja (29-31% para paradas cardíacas intrahospitalarias46,47, y 15-28% para paradas extrahospitalarias48) y la incidencia de secuelas neurológicas alta, por lo que su uso no debe extenderse y debe limitarse a pacientes seleccionados (cuando se presume etiología de la parada cardíaca potencialmente reversible) y a equipos especializados, según reflejan las recientes guías de Reanimación Cardiopulmonar de la Asociación Americana de Cardiología49.
Indicaciones de la oxigenación de membrana extracorpórea para fallo respiratorioLa ECMO venovenosa (VV) proporciona soporte respiratorio a pacientes con hipoxia o hipercapnia graves debidas a mala función pulmonar. Aunque existen diversos criterios gasométricos para indicar la ECMO, los que la ELSO recomienda en sus guías clínicas50 para el inicio de la ECMO son: PaO2/FiO2 inferior a 100 con FiO2>90% y/o puntuación en la escala Murray51 3-4 y/o hipercapnia con pH<7,2 a pesar de ventilación mecánica óptima o presión meseta >30cmH2O.
Síndrome de distrés respiratorio agudoLa indicación respiratoria más estudiada de la ECMO es el síndrome de distrés respiratorio agudo (SDRA, o acute respiratory distress syndrome [ARDS]), siendo la única indicación en la que existen ensayos clínicos aleatorizados21. En circunstancias en las que la ventilación mecánica es necesaria para asegurar el intercambio gaseoso, la ventilación con presión positiva puede potenciar el daño pulmonar. La única estrategia de ventilación que ha demostrado reducir la mortalidad en el SDRA es una estrategia de ventilación con presiones y volumen limitados. La ECMO tiene el potencial de mejorar los resultados en pacientes con SDRA al permitir una oxigenación adecuada al tiempo que facilita una estrategia de ventilación de protección al corregir los niveles insostenibles de hipercapnia y acidosis respiratoria que acompañan la ventilación con bajo volumen tidal.
En el caso de la ECMO en pacientes con daño pulmonar agudo por infección por gripe H1N1, la mortalidad hospitalaria publicada por los diferentes grupos oscila entre el 8 y el 65%52, dependiendo fundamentalmente de las características basales del paciente (edad y puntuación en el Sequential Organ Failure Assesment Score [SOFA] previa al implante de la ECMO).
Puente al trasplante pulmonarLa ECMO se ha considerado tradicionalmente una contraindicación relativa para el trasplante pulmonar, pero estudios más recientes han mostrado una excelente supervivencia postrasplante53. Puede considerarse una estrategia de ECMO sin intubación54 en algunos candidatos a trasplante pulmonar que en otro caso serían dependientes del ventilador, una población con pobres resultados relacionados con las complicaciones de la ventilación mecánica55. En este escenario se utiliza tanto la ECMOVV como la ECMO venoarterial (VA), dependiendo de la situación hemodinámica del paciente y la presencia de hipertensión pulmonar.
Fallo primario del injerto tras trasplante pulmonarEn el caso de disfunción primaria del injerto severa, principal causa de muerte tras trasplante pulmonar56, la ECMO permite mantener el intercambio gaseoso mientras el injerto se recupera57.
Fallo respiratorio hipercápnicoVarias pequeñas series de casos han mostrado la posibilidad de evitar o de realizar un destete rápido de la ventilación mecánica invasiva con eliminación extracorpórea de dióxido de carbono (ECCO2R) en la enfermedad pulmonar obstructiva crónica58,59.
Nuestra experiencia con la ECMOVV en el mismo período referido previamente es de 36 casos, con una supervivencia hospitalaria del 51,5% (18 casos) (datos no publicados).
Uso no emergente de la oxigenación de membrana extracorpóreaLa expansión de su uso ha ido de la mano de la aparición de nuevas indicaciones, muchas de ellas no emergentes60. Así, actualmente se usa también como profilaxis en pacientes de muy alto riesgo sometidos a implante de válvula aórtica transcatéter (TAVI)61, intervencionismo percutáneo de alto riesgo62, implante de dispositivo de asistencia ventricular izquierda (DAVI)40 o resecciones pulmonares de tumores que invaden los grandes vasos y/o la aurícula izquierda63 o cirugía traqueobronquial mayor64. También para el manejo de complicaciones del TAVI65 (sangrado severo del ápex —al descomprimir facilita una reparación segura—, malperfusión coronaria, dehiscencia periprotésica). Incluso algunos centros han sustituido ahora el uso del bypass cardiopulmonar convencional por ECMO en pacientes durante el trasplante pulmonar66; en teoría, al ser la ECMO un circuito miniaturizado de circulación extracorpórea, presenta las ventajas con respecto al bypass cardiopulmonar de menor requerimiento de anticoagulación, potencial menor coagulopatía y menor respuesta inflamatoria sistémica67.
También se está usando para la obtención de órganos de donantes a corazón parado, con el objetivo de mejorar la calidad de los órganos explantados. Sin embargo, esto puede plantear un dilema ético en ocasiones.
Contraindicaciones para la oxigenación de membrana extracorpóreaEn la tabla 2 se muestran las contraindicaciones para la ECMO. Especial mención requiere la insuficiencia aórtica en el caso de la ECMOVA; el inicio de la asistencia aumenta la poscarga del VI y, por tanto, la severidad de cualquier regurgitación aórtica preexistente empeorará, generando mayor dilatación del VI, edema pulmonar y riesgo de isquemia subendocárdica secundaria al aumento del consumo de oxígeno y el estrés de pared.
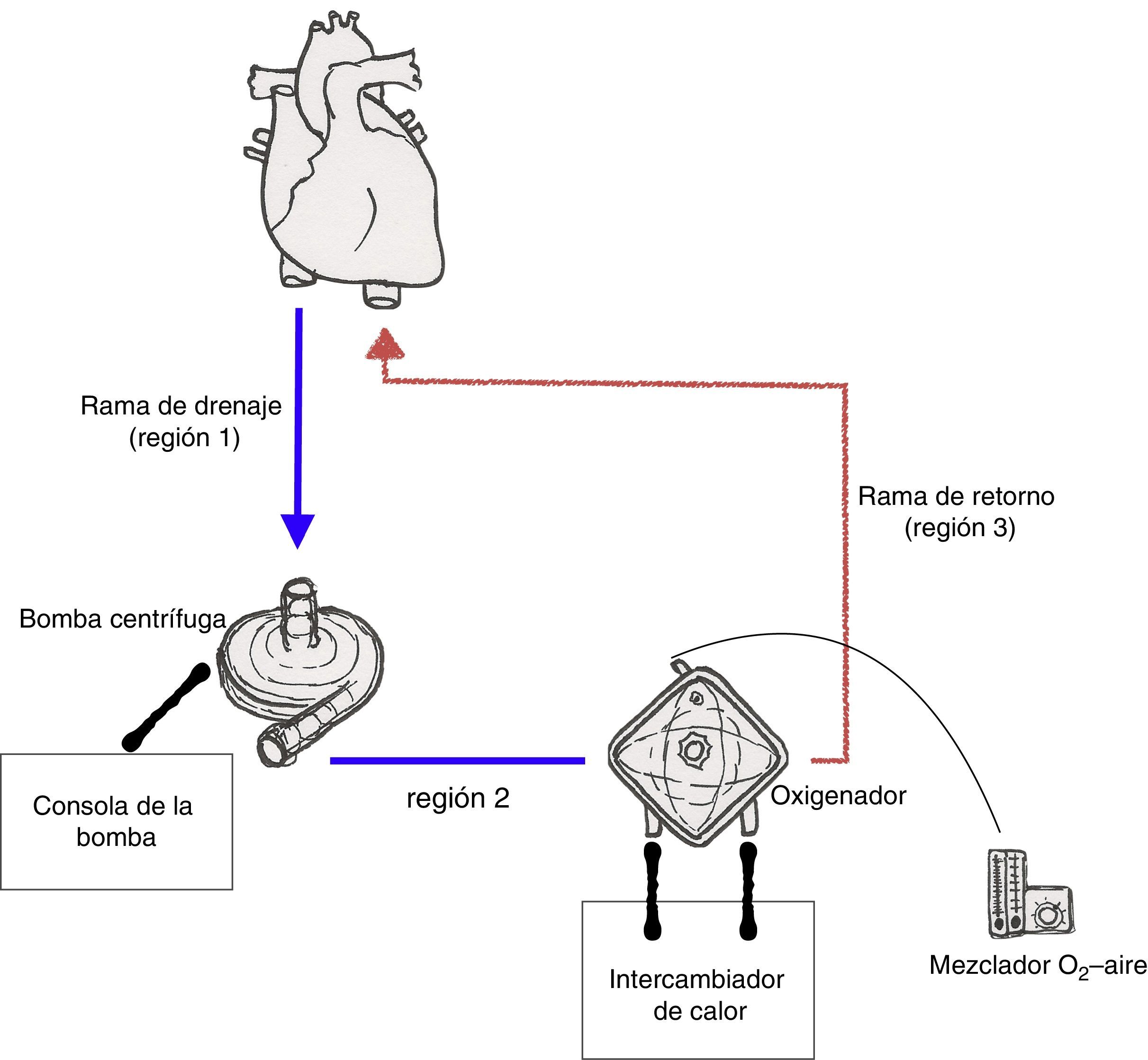
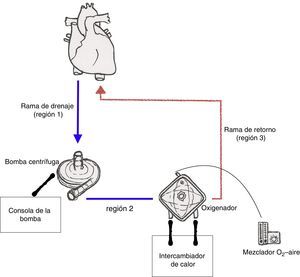
Circuito de la oxigenación de membrana extracorpóreaEl circuito básico de ECMO consiste en un bomba centrífuga, un oxigenador de membrana, tubuladuras, cánula de drenaje y cánula de retorno. Además del circuito, se requieren el motor de la bomba y su consola correspondiente, un mezclador de gases y un intercambiador de calor.
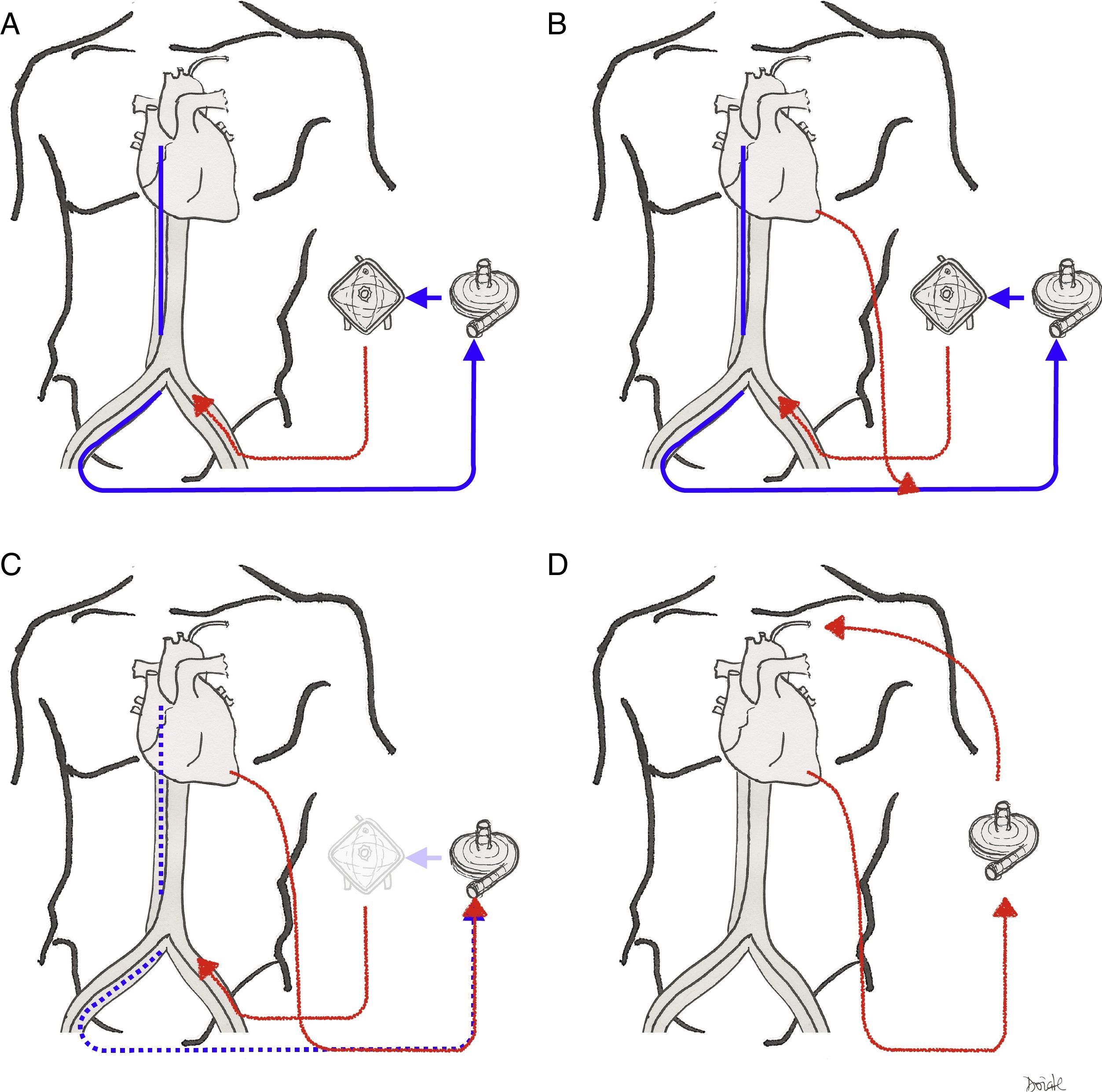
El circuito de ECMO puede ser dividido en 3 ramas funcionales (fig. 2):
- 1)
La rama de drenaje, que se extiende desde la cánula de drenaje hasta la bomba.
- 2)
La rama entre la salida de la bomba y el lado venoso del oxigenador (preoxigenador).
- 3)
La rama de retorno, que va desde el lado arterial del oxigenador (postoxigenador) hasta la cánula de retorno.
En la rama de drenaje existe una presión negativa, generada por la bomba centrífuga (entre −10mmHg y −60mmHg en condiciones normales). Por contra, a la salida de la bomba las presiones son muy positivas (desde 150mmHg hasta >300mmHg, dependiendo del flujo y de la resistencia del circuito). Hay una caída de presión de 30 a 60mmHg al atravesar el oxigenador, por la resistencia que este ofrece al flujo.
El registro de las presiones en las distintas zonas del circuito de ECMO68 nos proporciona importante información acerca del estado del paciente (volemia, sospecha de taponamiento cardíaco…), las cánulas (acodaduras u obstrucciones), la bomba (fallo mecánico) y el oxigenador (disfunción o trombosis).
OxigenadoresLos actuales oxigenadores de polimetilpentano (Quadrox PLS, Maquet Cardiovascular; Medos Hilite 7000 LT) son menos propensos a la fuga de plasma, por lo que tienen mayor durabilidad, tasas menores de trombosis y hemólisis y menores requerimientos transfusionales69.
En la ECMO se pueden ajustar de manera relativamente independiente la oxigenación y el lavado de dióxido de carbono. La oxigenación depende fundamentalmente de la fracción inspiratoria del oxígeno (FiO2) de la ECMO (y del ratio flujo sanguíneo a través del circuito de la ECMO en relación al gasto cardíaco del paciente en el caso de la ECMOVV), mientras que la eliminación del CO2 depende del flujo de aire a través del oxigenador70. Los circuitos extracorpóreos son muy eficientes en la eliminación de dióxido de carbono, pudiendo hacerlo con flujos mucho menores de los que se necesitan para conseguir una adecuada oxigenación. Por tanto, cuando el objetivo es la eliminación extracorpórea de dióxido de carbono (ECCO2R)71, pueden usarse cánulas de menor tamaño.
Bombas centrífugasLas bombas que se utilizan para la ECMO son centrífugas; son pequeñas, fáciles de cebar y requieren poco volumen de cebado. Son pre y poscarga dependientes y, por tanto, no tienen una relación fija entre velocidad y flujo. De ahí que sea necesario un sensor de flujo en el circuito. Si la bomba se para, puede invertirse el flujo en el circuito, por lo que el circuito siempre debe pinzarse antes de detener la bomba (debe pinzarse distalmente a la bomba, para evitar la cavitación que podría producirse al generar grandes presiones negativas en la línea de drenaje si esta se pinzase con la bomba en funcionamiento).
Una de las principales preocupaciones durante la asistencia prolongada con bombas centrífugas es la hemólisis. La hemólisis se produce principalmente por turbulencias inducidas por trombos en la bomba, pero puede exacerbarse por obstrucción o turbulencia en cualquier otra localización del circuito. La hemólisis también está influida por el diseño de la bomba, siendo menor con las bombas de segunda generación (Rotaflow, Maquet Cardiovascular; CentriMag, Thoratec Corp) que con las de primera generación (Bio-Medicus, Medtronic; Deltrastrem DP2, Medos).
Motor de la bomba y consolaCada bomba funciona con su propia consola: Bio-Medicus Bio-Console (Medtronic), Medos Deltastream, Maquet Rotaflow y Maquet Cardiohelp, esta última con un especial diseño que facilita el uso para traslados interhospitalarios de pacientes en ECMO72 (fig. 3).
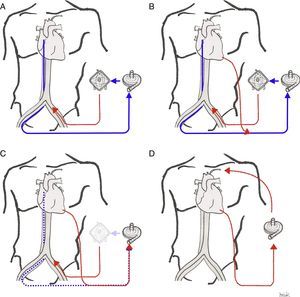
Configuraciones de la oxigenación de membrana extracorpórea y canulaciónLas 2 configuraciones de la ECMO actualmente usadas son la ECMOVV, para soporte respiratorio, y la ECMOVA, para soporte cardiorrespiratorio. La ECMOVV no da soporte cardíaco directamente; sin embargo, la mejoría de la hipoxemia y de la hipercapnia severas disminuye las resistencias vasculares pulmonares, disminuyendo la poscarga del VD y mejorando la función del VD; esto debería aumentar el llenado del VI. Además, el inicio de la ECMOVV normalmente resulta en una reducción de las presiones de vía aérea (parámetros agresivos de ventilación previos), lo que también disminuye la poscarga del VD. Esto supone normalmente una mejoría hemodinámica al iniciar la asistencia con ECMOVV.
La canulación de la ECMO se realiza normalmente por cirujanos cardiovasculares, a pie de cama del paciente. Sin embargo, hay una tendencia general hacia los abordajes percutáneos, llevados a cabo en ocasiones por intensivistas. De cualquier modo, es fundamental que el manejo se realice por equipos multidisciplinares.
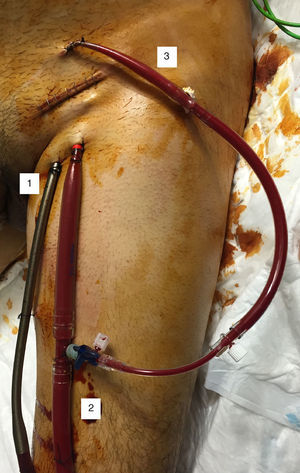
Oxigenación de membrana extracorpórea venoarterialLa sangre desoxigenada se drena desde el sistema venoso, y la sangre oxigenada se reinfunde en la circulación arterial. La canulación puede ser central (la sangre se drena desde la aurícula derecha y se reinfunde en aorta ascendente proximal; este tipo de canulación se utiliza en algunos casos de shock poscardiotomía) o, más comúnmente, periférica, mediante acceso percutáneo o quirúrgico. El acceso femoral es el de elección, pues es menos invasivo y permite un inicio rápido de la terapia. La cánula de drenaje colocada en la vena femoral debe posicionarse en la unión vena cava inferior-aurícula derecha o incluso en la aurícula derecha; la cánula de retorno se inserta en la arteria femoral, con la punta posicionada en la arteria ilíaca o en la aorta descendente distal.
Nuestra técnica de elección es la canulación quirúrgica. Las ventajas de esta técnica sobre el abordaje percutáneo son la rapidez (muchas veces es difícil la inserción percutánea en situación de shock cardiogénico, con pulso femoral disminuido o ausente) y la valoración adecuada del tamaño de los vasos (el tamaño de la cánula de drenaje venoso y de la cánula de retorno arterial son un determinante mayor del flujo de la ECMO y, por tanto, la intención será insertar la cánula mayor posible) y del punto de canulación (canular siempre la arteria femoral común, valorar zonas con menos afectación en caso de enfermedad arterial periférica). Cuando el drenaje venoso sea inadecuado y limite el flujo de la ECMO, el primer paso será añadir otra cánula de drenaje venoso a través de una vena diferente, pues, como ya hemos dicho, el tamaño de la cánula venosa es uno de los mayores limitantes del flujo de la ECMO; en caso de que la presión en la rama de retorno sea muy elevada, habrá que añadir otra cánula de retorno arterial a través de una arteria diferente.
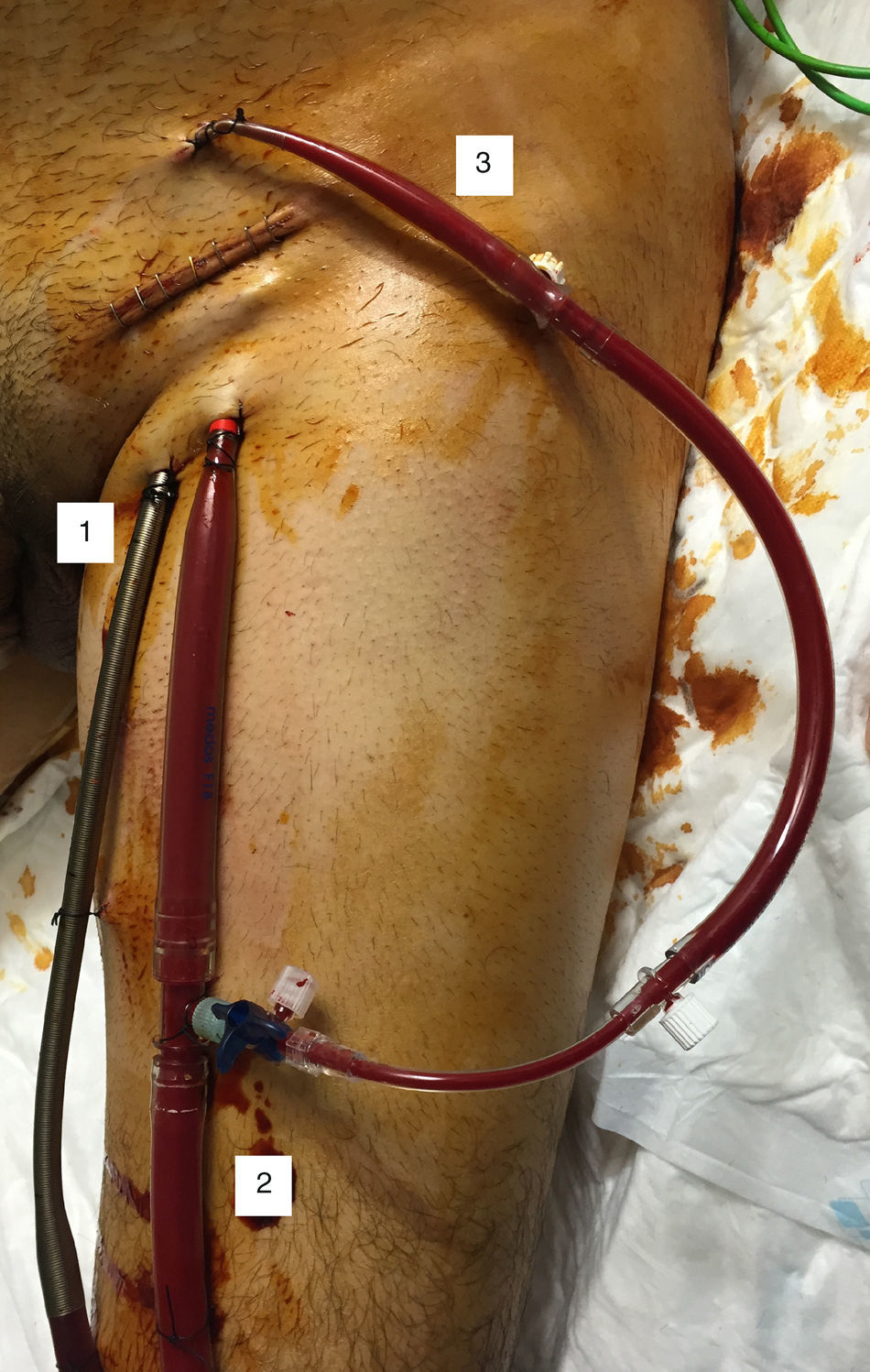
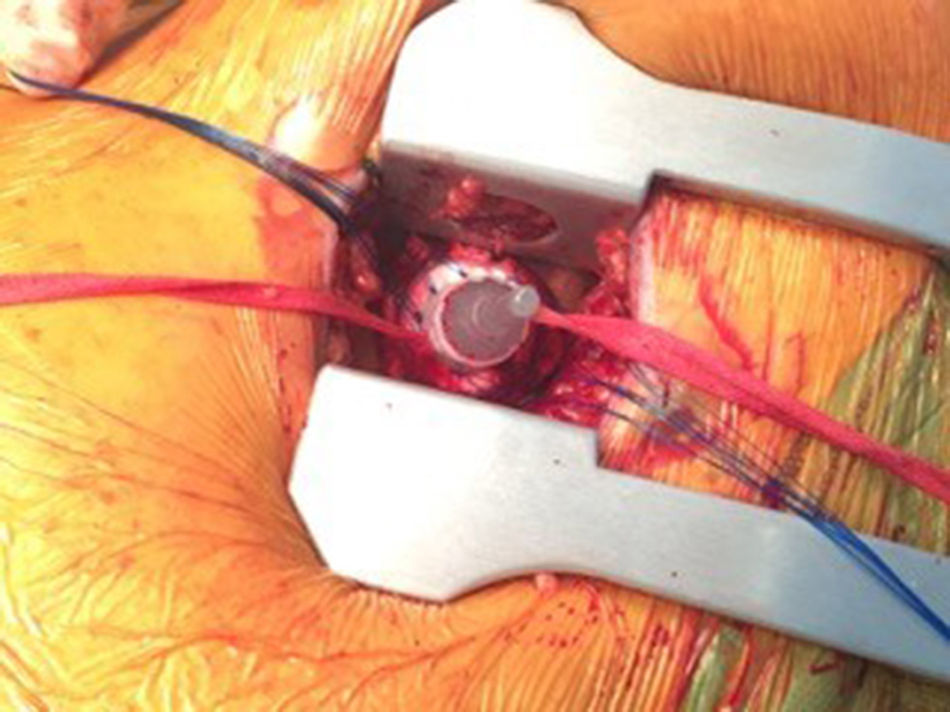
Las peculiaridades de nuestra técnica de inserción quirúrgica son: exposición quirúrgica de los vasos, sin disección de estos; inserción de las cánulas a través de contraincisiones cutáneas mediante técnica de Seldinger —las cánulas se aseguran en el punto de inserción mediante bolsas de tabaco y torniquetes—, y cierre de la herida sobre las cánulas (fig. 4).
La probabilidad de isquemia en el miembro inferior puede disminuirse insertando una cánula arterial adicional para perfundir la extremidad distal73. Alternativamente, la canulación puede realizarse a través de un injerto de dacrón suturado al vaso en disposición terminolateral y conectado a las tubuladuras de la ECMO; sin embargo, el uso de un injerto puede producir hiperperfusión del miembro correspondiente, algo que es más frecuente en la arteria axilar y que puede resolverse realizando un banding distal de la arterial.
La configuración de la ECMO con cánula de retorno en la arteria subclavia (canulación directa o con un injerto de dacrón) tiene la ventaja sobre la ECMOVA femorofemoral de que asegura la liberación de sangre oxigenada al arco aórtico y, por tanto, a la vasculatura cerebral y coronaria, evitando una de las complicaciones de la ECMOVA periférica (ver más adelante «síndrome del arlequín»). Esta configuración es de elección cuando los vasos femorales no son aptos para canulación (enfermedad arterial periférica oclusiva o reconstrucción femoral previa), y para resolver complicaciones de la canulación femoral (isquemia crítica de miembro inferior y síndrome del arlequín). La canulación arterial axilar y venosa yugular ofrece también la ventaja de permitir a los pacientes en ECMO una movilización temprana y rehabilitación activa74, de particular importancia en los pacientes candidatos a trasplante, para evitar el desacondicionamiento físico.
Oxigenación de membrana extracorpórea venovenosaEn la ECMOVV la sangre se drena y se reinfunde en el sistema venoso del paciente (por tanto, el circuito de la ECMO está conectado en serie al corazón y los pulmones, a diferencia de la ECMOVA, donde funciona en paralelo). Tras oxigenarse y decarboxilarse, la sangre se reinfunde en la aurícula derecha (AD) y es eyectada en la circulación pulmonar por la propia función cardíaca del paciente.
La ECMOVV en el fallo respiratorio puro evita 2 importantes desventajas asociadas al ECMOVA: la necesidad de canulación arterial y la hipoxemia del hemicuerpo superior (ver síndrome del arlequín).
En la ECMOVV, el abordaje percutáneo mediante técnica de Seldinger es de elección (presenta la ventaja de que minimiza el sangrado pericánula).
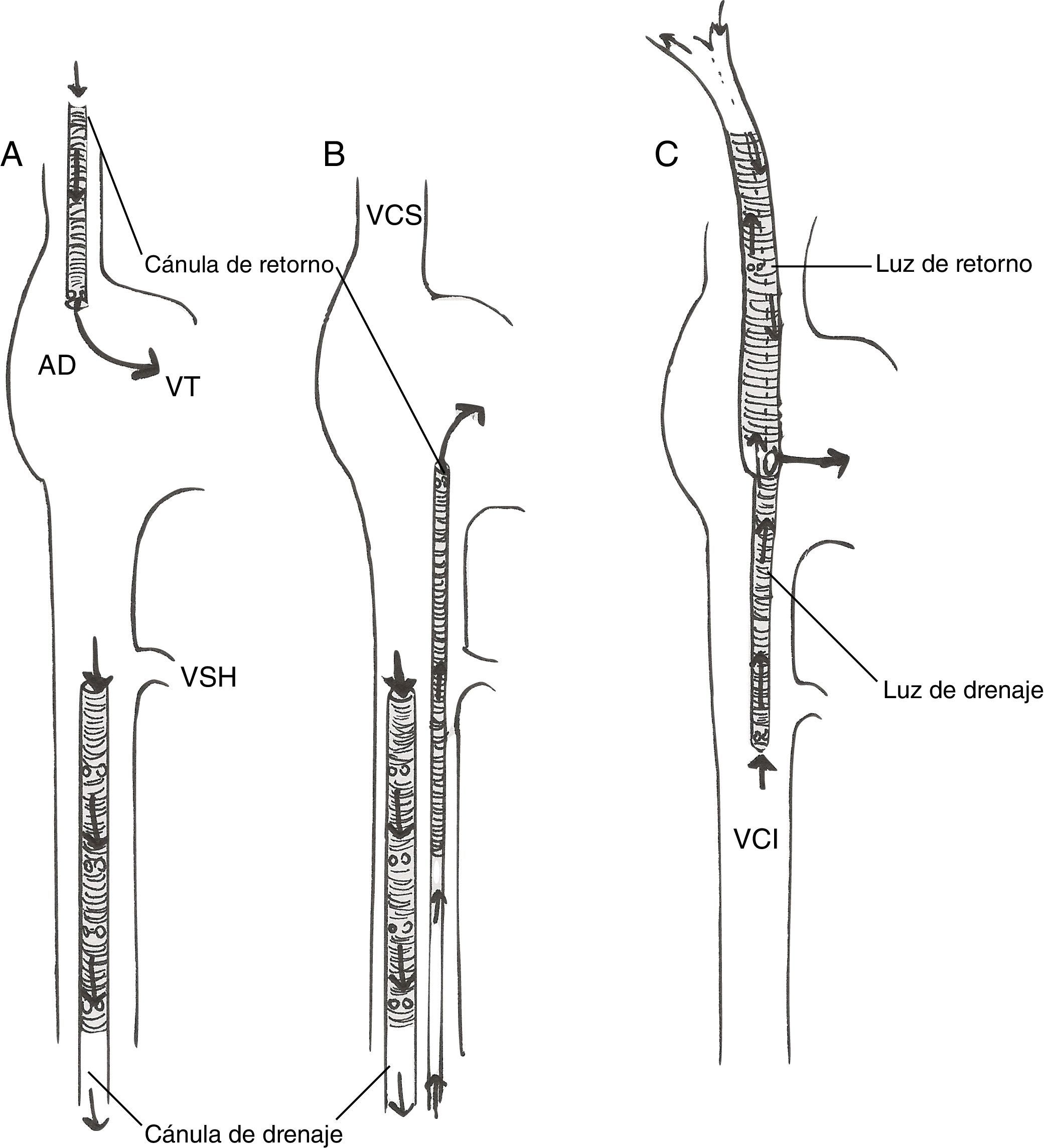
Existen diferentes configuraciones de cánula posibles (fig. 5).
- -
Técnicas de dos cánulas:
- ∘
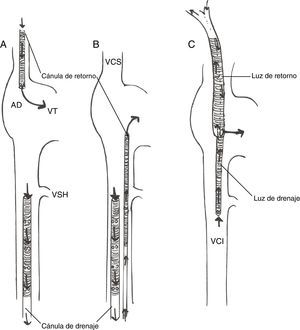
Femoroyugular: la sangre se drena de la vena cava inferior (VCI) mediante una cánula introducida desde la vena femoral, con la punta 5-10cm por debajo de la unión AD-VCI; la sangre se reinfunde en la AD mediante una cánula insertada en la vena yugular interna, con la punta avanzada hasta la unión AD-vena cava superior. Esta es nuestra técnica de elección.
- ∘
Femorofemoral. La sangre se drena de la VCI mediante una cánula venosa femoral y se reinfunde mediante una cánula introducida en la vena femoral (normalmente contralateral) y avanzada hasta la AD.La cánula de drenaje suele ser una cánula multiperforada (con orificios laterales y en la punta) de 21-25Fr, mientras que para reinfusión se utiliza una cánula de 17-21Fr, con orificios solo en la punta.
- ∘
- -
Técnicas de cánula única: la cánula única de doble luz (Avalon Elite, Maquet) se inserta a través de la vena yugular interna derecha y está diseñada para drenar sangre de ambas venas cavas y retornar sangre oxigenada a la AD, con el flujo dirigido hacia la válvula tricúspide. Las ventajas son punto único de canulación y menor probabilidad de recirculación75, así como el potencial de poder movilizar al paciente. La visualización ecocardiográfica de la guía en el vaso correcto es fundamental para una canulación segura76.
Una vez iniciada la asistencia con ECMO, el objetivo es preservar la función de todos los órganos y recuperar la de los que estén dañados. El flujo de la ECMO debe ajustarse a las necesidades particulares de cada paciente. Por un lado, el flujo debe ser suficiente para mantener una buena perfusión sistémica (valorada mediante gasto urinario, niveles de ácido láctico y saturación venosa mixta); pero por otro, el flujo de la ECMO no debe ser tan alto como para impedir la circulación pulmonar, ayudando así a la recuperación pulmonar y evitando el desarrollo de trombos pulmonares. Por tanto, el soporte completo no debe mantenerse durante largos períodos de tiempo.
Sedación y analgesia durante la canulaciónLa mayoría de los pacientes están ya sedados y conectados a ventilación mecánica; en estas circunstancias, deben administrarse un relajante muscular y un opiáceo antes de canular. Sin embargo, hay circunstancias en las que la canulación debe realizarse con el paciente despierto: pacientes a los que se les implanta un ECMOVV para resección quirúrgica de una vía aérea obstruida, y pacientes en situaciones críticas en las que la inducción de la anestesia puede precipitar una parada cardíaca (como p. ej., en pacientes con hipertensión pulmonar y disfunción severa de VD). En estos casos, la canulación se realizará bajo anestesia local (p.ej., lidocaína 1% sin adrenalina) y bajo sedación no consciente.
AnticoagulaciónLa anticoagulación de los pacientes en ECMO se realiza con heparina no fraccionada (en situaciones especiales, como la trombocitopenia inducida por heparina, pueden utilizarse alternativamente bivalirudina77 o argatrobán), pero no hay un consenso claro en cuando a objetivos terapéuticos y se utilizan protocolos propios en la mayoría de centros. Se administra una dosis de inducción de 100-150U/kg de heparina antes de proceder a la canulación. El objetivo es mantener un tiempo de coagulación activado (ACT) de 160-180s, para lo que se realizarán controles de ACT cada 2h (al menos hasta que se consigan niveles terapéuticos estables). El control también puede realizarse con tiempo de tromboplastina parcial activada (TTPA), en cuyo caso el objetivo es 60-80s. Hay que prestar especial atención a la anticoagulación en el momento del destete; cuando el flujo de la ECMO sea <1,5l/min, el ACT deberá mantenerse por encima de 200s.
Si hay problemas de coagulación o sangrado, pueden medirse los niveles de anti-Xa, que nos dan una medición directa de la actividad de la heparina (nivel deseado 0,3-0,6). Si la dosis requerida de heparina es alta (>20U/kg/h), hay que medir los niveles de antitrombinaiii (ATIII); un nivel de ATIII por debajo del 50% del normal, sumado a alto requerimiento de heparina, es indicación de tratamiento con plasma fresco o ATIII recombinante. Durante las primeras 48h de soporte con ECMO el objetivo es mantener el recuento plaquetar por encima de 100.000/m3, nivel que puede después reducirse a >50.000 si no hay sangrado78. Algunos grupos abogan también por asociar tratamiento antiagregante en el mantenimiento de los pacientes con ECMO.
Ventilación mecánicaUna vez iniciada la asistencia con ECMO y conseguida una SaO2 adecuada, los parámetros del ventilador deben ajustarse para evitar la lesión pulmonar (ventilación de protección pulmonar): FiO20,4, positive end-expiratory pressure (PEEP) ≤10cmH2O, peak inflation pressure (PIP) 20cmH2O, frecuencia respiratoria ≤10respiraciones/min79.
MonitorizaciónLa monitorización específica de un paciente con ECMO incluye exploración física minuciosa (con especial atención a los signos de isquemia en el miembro donde se implanta la cánula arterial), inspección del circuito, monitorización hemodinámica y de parámetros de laboratorio, incluyendo gases arteriales y coagulación.
- -
Gases arteriales. Los parámetros del oxigenador (FiO2 y flujo de aire) se ajustarán de acuerdo a los gases arteriales. En la ECMOVA periférica es fundamental monitorizar la oxigenación tan lejos como sea posible del sitio de reinfusión, idealmente en el brazo derecho (punto arterial más cercano a la raíz aórtica); los gases medidos cerca del sitio de reinfusión no reflejan necesariamente los gases en el resto del cuerpo, ya que el edema pulmonar puede comprometer la función pulmonar y, con ello, la oxigenación del hemicuerpo superior. En la ECMOVV, puesto que la sangre oxigenada de la cánula de retorno se mezcla con la sangre desoxigenada del sistema venoso del paciente, normalmente no es posible conseguir una SaO2 normal durante la asistencia, sobre todo si los pulmones no contribuyen al intercambio gaseoso; el objetivo de SaO2 durante el soporte con la ECMOVV es 86-92%.
- -
PaO2 postoxigenador. Para monitorizar el funcionamiento del oxigenador y detectar disfunción del mismo.
- -
Parámetros de laboratorio. Nos permiten verificar la recuperación orgánica y evaluar si se mantiene una adecuada perfusión.
- -
Saturación venosa mixta. Permite valorar el aporte de oxígeno en relación con el consumo de O2 (representa DO2/VO2) en la ECMOVA, no siendo así en la ECMOVV.
- -
Ecocardiograma (tabla 4). La ecocardiografía juega un papel fundamental en cada paso de la asistencia con ECMO80. De entrada, puede confirmar el diagnóstico y ayudar en la elección entre ECMOVV y ECMOVA. Puede ayudar a reducir las complicaciones (permite la identificación de la formación de trombos en las cánulas) y guiar en el manejo diario de estos complejos pacientes, así como asistir en el momento de la canulación para la correcta colocación de las cánulas. Su papel es imprescindible para evaluar la recuperación ventricular y determinar la posibilidad de destete. Por tanto, la monitorización diaria del paciente con ecocardiograma es fundamental, siendo el eco transtorácico la modalidad de elección por su no-invasividad y su disponibilidad a pie de cama, reservando la ecografía transesofágica para aquellos pacientes con mala ventana acústica o cuando se requiere una valoración más precisa (detectar shunts, trombos intracardíacos…). Su limitación fundamental es en el diagnóstico de taponamiento cardíaco, que es todo un reto, incluso en presencia de derrame pericárdico, ya que la modificación de las presiones en AD y VD impide el análisis apropiado del colapso de las cámaras y su significación clínica, por lo que ante la sospecha —sobre todo en el caso del shock poscardiotomía— se debe realizar una revisión quirúrgica del mediastino.
Tabla 4.Parámetros ecocardiográficos en la oxigenación de membrana extracorpórea (ECMO)80
Monitorización en ECMO Tamaño y función biventricular Tamaño biauricular Evolución de la patología preexistente Regurgitación aórtica/mitral Ecocontraste espontáneo intracavitario/trombo intracavitario Trombo aórtico Posición de las cánulas Derrame pericárdico Tamaño y colapso de la VCI Destete de ECMO (medidas basales y en cada escalón de descenso de flujo) FEVI LVOT VTI Onda S en anillo lateral Función y tamaño de VD (TAPSE, onda S’) Insuficiencia tricúspide FEVI: fracción de eyección ventrículo izquierdo; LVOT VTI: left ventricular outflow tract velocity time integral; TAPSE: tricuspid anular plane systolic excursion; VCI: vena cava inferior; VD: ventrículo derecho.
- -
BIS (índice biespectral). Para monitorizar la oxigenación cerebral81.
Es una complicación bastante frecuente durante la asistencia con ECMOVV75. Se debe al drenaje de la sangre oxigenada que acaba de ser reinfundida. Como consecuencia, el paciente sigue hipoxémico a pesar de flujo adecuado de la ECMO. Puede evitarse confirmando la adecuada posición de las cánulas por ecocardiografía, fluoroscopia o mediante mediciones en la radiografía de tórax. En las técnicas de doble cánula, las puntas de ambas deber distanciarse al menos 10cm; en el caso de una cánula única de doble luz es importante verificar que el sitio de reinfusión se dirige directamente hacia la válvula tricúspide.
Síndrome del arlequínDescribe la situación en la que el hemicuerpo superior está hipoxémico (cianótico), mientras que el inferior está bien oxigenado. Ocurre durante la asistencia con ECMOVA periférica femorofemoral, y es el resultado de la función cardíaca parcialmente conservada con mala función pulmonar. La sangre oxigenada del circuito de la ECMO perfunde preferentemente el hemicuerpo inferior, pero sangre desoxigenada —que pasa a través de los pulmones disfuncionantes y se eyecta por el VI— perfunde el hemicuerpo superior (arterias coronarias y circulación cerebral), con el potencial de provocar isquemia miocárdica y cerebral. Para su manejo es necesario cambiar la cánula arterial a la arteria axilar o realizar una canulación central.
Distensión ventricular izquierdaAunque la respuesta hemodinámica a la ECMO es compleja y variable entre pacientes, la ECMO por sí misma no descarga el VI. Así, cuando la función ventricular izquierda se encuentra gravemente deprimida, el VI puede ser incapaz de eyectar el volumen de sangre que recibe a través de la circulación pulmonar, efecto magnificado por el aumento de la postcarga del VI que produce el ECMO. El aumento de la presión telediastólica del VI puede provocar distensión de VI (reduciendo la posibilidad de recuperación miocárdica), con aumento de la presión capilar pulmonar y riesgo de edema pulmonar y hemorragia pulmonar, así como formación de trombos intracardíacos y en raíz aórtica por la estasis sanguínea.
Es una complicación grave que requiere una solución inmediata82. Hay distintas posibilidades para conseguir la descarga del VI:
- -
Reducir el flujo de la ECMO para mantener la apertura valvular aórtica y la pulsatilidad (esto solo es posible en pacientes con una función cardíaca parcialmente recuperada).
- -
Aumentar del soporte inotrópico.
- -
Implantar un balón intraaórtico de contrapulsación.
Si estas estrategias resultan insuficientes, será necesaria la descarga activa del VI:
- -
Atrioseptostomía (para permitir el shunt izquierda-derecha).
- -
Asociar un dispositivo tipo Impella.
- -
Implante quirúrgico de una cánula de drenaje en VI (o en aurícula izquierda en caso de trombo intraventricular), que se conecta a la línea venosa de la ECMO.
El implante de una cánula en el ápex de VI puede realizarse mediante un abordaje quirúrgico mínimamente invasivo con una minitoracotomía anterior izquierda (fig. 6). Esta estrategia permite además la transición progresiva desde una ECMO periférica a un DAVI paracorpóreo de duración intermedia (CentriMag) sin necesidad de esternotomía media83, siempre y cuando la función ventricular derecha sea aceptable. La combinación de la cánula de drenaje apical con la canulación axilar y la retirada de la cánula venosa (previo pinzamiento progresivo) y el oxigenador del circuito permiten la transformación de un ECMOVA periférico en un DAVI paracorpóreo de media duración (fig. 7). Al evitar la esternotomía, tiene la ventaja de reducir el riesgo de una cirugía posterior en caso de que la función cardíaca no se recupere (trasplante cardíaco o implante de un DAVI de larga duración).
Paso de ECMOVA periférico a DAVI paracorpóreo tipo CentriMag Levitronix.
A: ECMOVA femorofemoral; B: canulación apical del ventrículo izquierdo y descarga del ventrículo izquierdo (conexión a la línea de drenaje de la ECMO); C: retirada de cánula venosa femoral de drenaje (asegurar recuperación función ventricular derecha) y del oxigenador del circuito; D: canulación de la arteria axilar para facilitar la movilización y el cambio de la bomba por una de tipo Levitronix.
Las estrategias de destete son altamente variables y centro-dependientes, sin protocolos estándar bien definidos84-86. El destete es un proceso gradual que se realiza durante varios días, si bien procesos de destete con flujos bajos mantenidos durante más de 4h deben evitarse para evitar complicaciones trombóticas. En la práctica clínica, una vez que los pacientes recuperan la pulsatilidad de la curva arterial y están hemodinámicamente estables con dosis bajas de inotropos o vasopresores, con intercambio gaseoso estable, el flujo de la ECMO se reduce bajo estrecho control ecocardiográfico, tras optimizar los parámetros del ventilador. Tras un ensayo de destete exitoso, normalmente los pacientes se mantienen con soporte parcial (2-3l/min) y la ECMO se retira en las siguientes 24h. Hasta que la ECMO se detiene por completo, es difícil predecir con certeza si el weaning será exitoso, ya que la disfunción de VD puede estar enmascarada incluso con mínimos flujos de la ECMO. Según un estudio reciente87, los pacientes destetados con éxito de la ECMOVA presentaban los siguientes parámetros ecocardiográficos con flujo bajo de la ECMO: velocity-time integral del tracto de salida del VI (VTI) ≥10cm, FEVI >20-25% y TDSa (velocidad sistólica pico en el anillo lateral de la válvula mitral) ≥6cm/s.
ComplicacionesLas complicaciones durante la terapia con ECMO son frecuentes y se asocian con un incremento significativo de la morbimortalidad, por lo que es fundamental su reconocimiento y su tratamiento precoces. La tasa de complicaciones varía de acuerdo con la experiencia del centro y la selección de pacientes. En un metaanálisis reciente que incluye 1.866 pacientes de 20 estudios con ECMO para el tratamiento del shock cardiogénico o la parada cardíaca entre 2000 y 201288, las tasas de complicación descritas fueron las siguientes: isquemia de miembro inferior, 16,9%; fasciotomía por síndrome compartimental, 10,3%; amputación de miembro inferior, 4,7%; infarto cerebral, 5,9%; sangrado mayor, 40,8%; reintervención por sangrado poscardiotomía o taponamiento cardíaco, 41,9%; infección, 30,4%. Poco se sabe sobre las complicaciones a largo plazo y la calidad de vida de los pacientes que han sido tratados con ECMO. Si bien hay múltiples casos referidos de recuperación completa, algunos estudios refieren disfunción neurocognitiva en casi el 50% de los casos89.
Predicción de resultados en pacientes tratados con oxigenación de membrana extracorpóreaEl implante precoz de la ECMO en una población menos enferma puede presentar un perfil riesgo/beneficio favorable, al dar soporte antes de la instauración de fallo multiorgánico, según lo reflejan algunos de los últimos estudios publicados. Estos estudios apoyan la hipótesis de que mejorar la hemodinámica puede no ser suficiente para prevenir la muerte si el fallo multiorgánico precede el inicio del tratamiento. Así, una puntuación más baja del SOFA (sistema de puntuación diseñado para describir la extensión del fallo orgánico de los pacientes: respiratorio, cardiovascular, hepático, coagulación, renal y neurológico) en el momento del implante está asociada con mayor supervivencia90. Investigaciones recientes91,92 han identificado la determinación seriada de niveles de lactato en sangre en el período agudo de 24h tras el inicio de la ECMO como una herramienta fiable para monitorizar la inadecuada perfusión tisular, que parece ser un marcador fuerte de mortalidad. Además, puntuaciones como la del Survival After Veno-arterial ECMO (SAVE)93 pueden ayudar a predecir la supervivencia de pacientes que reciben ECMO por shock cardiogénico refractario, pudiendo resultar de utilidad a la hora de manejar estos pacientes.
ConclusionesLa utilización de la AMC de corta duración ha aumentado significativamente en los últimos años. Hoy en día estamos equipados con una variedad de dispositivos usados tanto para tratar como para prevenir el compromiso hemodinámico en escenarios clínicos diversos. La selección del dispositivo está guiada en gran parte por la disponibilidad de dispositivos, siendo la ECMO la que va a usarse para una población cada vez más amplia y diversa de pacientes críticos, dada su versatilidad (permite tratar fallo cardíaco, respiratorio o ambos), rapidez de implante, escasa invasividad y coste/eficacia. Es, por tanto, esencial familiarizarse con el manejo de esta terapia y sus complicaciones asociadas. Un abordaje multidisciplinar, con comunicación fluida entre intensivistas, anestesistas, cirujanos cardíacos, enfermeras y otros especialistas, es fundamental para el éxito.
El empleo agresivo de la descarga ventricular izquierda ante sospecha de distensión ventricular izquierda (ausencia de pulsatilidad, imposibilidad de extubación, distensión VI en ecocardiograma o edema de pulmón en la radiografía) y la estrategia de puente al puente precoz y progresivo, son técnicas que pueden ayudar a mejorar los resultados del ECMO VA como soporte cardíaco. Por otro lado, la canulación con cánula única de doble lumen, el implante con antestesia local del ECMO VA en casos de hipertensión pulmonar y disfunción severa de VD, y el ECMO “ambulatorio” (vena yugular-arteria axilar), podrían mejorar los resultados del ECMO como soporte respiratorio.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.