La técnica quirúrgica óptima para el tratamiento de la enfermedad aneurismática extensa de la aorta torácica no está claramente establecida. Las opciones incluyen un procedimiento en estadios, por esternotomía media, habitualmente incorporando una trompa de elefante, en el primero, seguido por toracotomía izquierda para completar el procedimiento. Una segunda opción es un procedimiento en un estadio realizado mediante ester-notomía media exclusivamente, o bien, esternotomía media extendida mediante incisión a través de un espacio intercostal, o bien, toracotomía anterior bilateral (incisión clamshell).
The optimal surgical technique for the treatment of extensive aneurysmal disease of the thoracic aorta is not clearly established. Options include a staged approach, commonly incorporating an elephant trunk in the first stage performed through a median sternotomy, followed by a left thoracotomy to complete the procedure. A second option is a one-stage procedure performed through a median sternotomy alone, a median sternotomy with an extension through a left intercostal space, or a bilateral anterior thoracotomy (clamshell incision). The surgical techniques are described.
La sustitución del cayado aórtico conlleva problemas de planteamiento.
Vía de abordajeProcedimiento en estadios, que comprende esternotomía media, en el primero, seguido, al cabo de varias semanas, de toracotomía izquierda para completar el procedimiento. Procedimiento en un estadio realizado mediante esternotomía media exclusivamente, o esternotomía media extendida con una incisión a través de un espacio intercostal, o bien, toracotomía anterior bilateral (incisión clamshell).
Protección frente a la isquemia cerebral, cardíaca, medular y visceralEl tiempo límite de seguridad de isquemia cerebral bajo parada circulatoria con hipotermia profunda (PCHP) es 30min a 15 °C1. Si es probable que este intervalo se sobrepase es obligatorio restaurar el flujo cerebral asociando perfusión cerebral anterógrada o retrógrada. La capacidad de irrigación y aporte de oxígeno cerebral por vía retrógrada ha sido cuestionada por algunos estudios2,3. Los resultados de esta cirugía han mejorado con el empleo de perfusión cerebral anterógrada hipotérmica4,5. Sin embargo, la tolerancia de la isquemia hipotérmica de médula espinal, riñón e hígado es mayor, y pueden recuperar una función normal después de al menos 60min de PCHP6,7.
Circuito de circulación extracorpóreaLugar de canulación arterial, necesidad o no de múltiples derivaciones de línea arterial, necesidad o no de varias bombas.
Anastomosis de los troncos supraaórticos y distal incómoda, aumentando los tiempos de isquemia y el riesgo de hemorragiaLa muy probable presencia de enfermedad en la pastilla conteniendo las arterias carótidas y subclavias expone a complicaciones técnicas de realización de la sutura y riesgo de complicaciones tromboembólicas.
A pesar de todo ello, es posible simplificar la técnica y abordar los problemas que presenta con seguridad, de forma que pueda ser realizada sin mayor complejidad que otros tipos de procedimientos dentro del arsenal de nuestra especialidad.
Indicación de cirugíaEnfermedad aneurismáticaSe entiende por aneurisma de arco aórtico la dilatación patológica de la aorta intratorácica que compromete la porción horizontal de la misma. Juvonen, et al.8 informaron que la media del diámetro aórtico de los aneurismas de aorta torácica en el momento de la rotura era 5,8cm, y que el riesgo de rotura se duplicaba por cada centímetro de aumento del diámetro. Por lo tanto, existiría indicación quirúrgica en los aneurismas del arco aórtico que alcanzan 5,5–6cm de diámetro. En los pacientes con síndrome de Marfan o similares habría indicación quirúrgica con un diámetro de 5cm.
Disección de aorta tipo IExiste indicación de sustitución total del arco aórtico en caso de9,10:
- –
Rotura de la íntima en arco aórtico o aorta descendente proximal. Las roturas de la íntima que sólo afectan a la curvatura menor únicamente precisan resecar la porción inferior del arco, alargando la anastomosis distal utilizada en la sustitución de la aorta ascendente (sustitución hemiarco aórtico). De igual forma, pequeñas roturas de la íntima a cualquier nivel en arco aórtico pueden resolverse exclusivamente mediante sutura directa reforzada con parche y cola biológica.
- –
Disección o hematoma masivos del arco aórtico.
- –
Rotura contenida del arco aórtico.
- –
Aneurisma o dilatación del arco aórtico mayor de 5cm.
- –
Arteriosclerosis del arco aórtico.
- –
Conectivopatías con afectación del arco aórtico, como el síndrome de Marfan.
Hay autores que en estos casos aconsejan realizar una anastomosis distal en trompa de elefante para facilitar la trombosis de la falsa luz9.
Examen preoperatorio de la circulación cerebralEn situaciones no urgentes, la realización de una angiorresonancia magnética nuclear (ARM) preoperatoria es imprescindible, ya que es esencial analizar el estado de los vasos del cuello y la circulación intracraneal. Una estenosis grave de una arteria carótida extracraneal puede provocar isquemia cerebral durante el periodo de perfusión anterógrada cerebral selectiva mientras se realiza la cirugía del arco aórtico. Estaría indicado resolver esta estenosis carotídea antes de proceder con la cirugía del arco, o bien, durante el desarrollo de la misma. Por otra parte, un polígono de Willis insuficiente puede entrañar isquemia cerebral contralateral en caso de perfusión selectiva aislada de una carótida. Se ha identificado un polígono de Willis incompleto en un 8% de casos11.
En casos de urgencia como rotura de aneurisma o disección, la realización de una angiotomografía axial (ATC) suministra información suficiente de la circulación cerebral extracraneal para afrontar con lógica la intervención.
Técnica quirúrgica: procedimiento en un estadioPara la sustitución de aorta ascendente, arco aórtico y aorta descendente proximal, la vía de abordaje es una esternotomía media prolongada hacia el borde interno del músculo esternocleidomastoideo izquierdo. Si se requiere una resección más amplia de aorta descendente, se coloca al paciente en decúbito supino con el hemitórax izquierdo elevado entre 20–45°. Se realiza esternotomía media y toracotomía anterior izquierda por el cuarto o sexto espacio intercostal, o bien, una toracotomía anterior bilateral por el cuarto espacio intercostal (incisión clamshell). Para estas resecciones tan amplias, la intubación de la vía aérea con una cánula de doble luz permite el colapso del pulmón izquierdo, y facilita la disección de la aorta descendente y la realización de la anastomosis distal.
En primer lugar, se diseca el tronco arterial braquiocefálico (TBC) hasta su bifurcación, y se valora la posibilidad de establecer la canulación arterial de la circulación extracorpórea (CEC) a nivel de la continuidad del TBC con la subclavia derecha. La segunda opción para canulación arterial de la CEC es la arteria axilar derecha (AAD). En caso de imposibilidad o riesgo de canulación del TBC o arteria axilar derecha, otras opciones son la arteria axilar izquierda o la arteria femoral, siempre y cuando no haya riesgo manifiesto de embolización retrógrada.
Después de la administración de heparina, se canula directamente el TBC o la AAD con una cánula arterial de 18–20 Fr. Si la AAD es pequeña, es preferible interponer un injerto vascular de 10mm entre la línea arterial y la AAD para su canulación. Se canula la aurícula derecha y se inicia la CEC. Se coloca un catéter de aspiración en ventrículo izquierdo y una cánula de cardioplejía en aorta ascendente, si no existe insuficiencia aórtica, y otra en seno coronario.
En CEC, y mientras se realiza hipotermia hasta 28–31 °C, se procede a la disección de la aorta torácica de los tejidos de alrededor, se disecan las zonas previstas de anastomosis proximal y distal, y se rodea con una cinta el tejido celulograso que envuelve los nervios vago y frénico izquierdos a nivel de arco aórtico distal. Durante estas maniobras, hay que ser cuidadoso al retraer el pulmón izquierdo para evitar el riesgo de hemorragia parenquimatosa.
Cuando la temperatura corporal desciende a 28–31 °C, se pinza la aorta ascendente y se administra una dosis de inducción (1.000ml) de cardioplejía, habitualmente por vía anterógrada, repitiendo una dosis de mantenimiento (400ml) transcurridos 20min, habitualmente por vía retrógrada. Se secciona la aorta ascendente en el nivel que se considera adecuado, y se selecciona una prótesis vascular con tres ramas de un diámetro 2mm menor que el diámetro de la aorta ascendente. Se hace corresponder las tres ramas del injerto con los troncos supraaórticos y se secciona proximalmente el injerto, sobrepasando unos 5–10mm el borde de sección de la aorta ascendente. Estos 5–10mm que sobran de injerto son evertidos. Se colocan dos suturas de polipropileno 4/0 entre la reflexión del manguito (de fuera adentro) y el remanente de aorta por encima de los ostium de las arterias coronarias izquierda y derecha (de dentro afuera), y luego se pasan a través de una tira de teflón en el exterior de la aorta. El injerto es transportado, por medio de estas suturas en U, al interior de la aorta. Entonces, la aorta es anastomosada al manguito, con una sutura continua de polipropileno 4/0, incorporando la tira de teflón (Fig. 1). Es una sutura altamente hemostática debido a la inclusión del injerto dentro de la aorta (anastomosis telescopada), con el consiguiente aumento del área de contacto entre ellos, y al efecto de autotensado de la sutura con el restablecimiento del flujo sanguíneo. Otra ventaja de esta sutura es la facilidad para la colocación de puntos de sutura adicionales en los sitios de fuga sanguínea, una vez restablecido el flujo arterial, por la presencia de este espacio entre el injerto y la línea de sutura, donde las paredes del injerto y aorta se hallan superpuestas12.
En esta fase se enfría el paciente hasta 18 °C. Se empaqueta la cabeza en hielo y se administran 10mg/kg de tiopental y metilprednisolona. A continuación se pinza primero la línea venosa y luego la arterial. Acto seguido, se pinzan los tres troncos supraaórticos lejos del origen aórtico y en zona libre de ateroma. Se inicia perfusión cerebral anterógrada por la cánula de TBC o AAD a un flujo de 10ml/kg/min y temperatura de 20 °C, de momento sólo a través de las arterias vertebral y carótida derechas. La presión de perfusión puede monitorizarse en arteria radial derecha si se ha canulado el TBC, o bien, en arteria subclavia derecha proximal o TBC si se ha canulado la AAD, y se mantiene entre 50–70mmHg. Se monitoriza la saturación de oxígeno cerebral con espectroscopia de infrarrojos (Somanetics NIRS-INVOS).
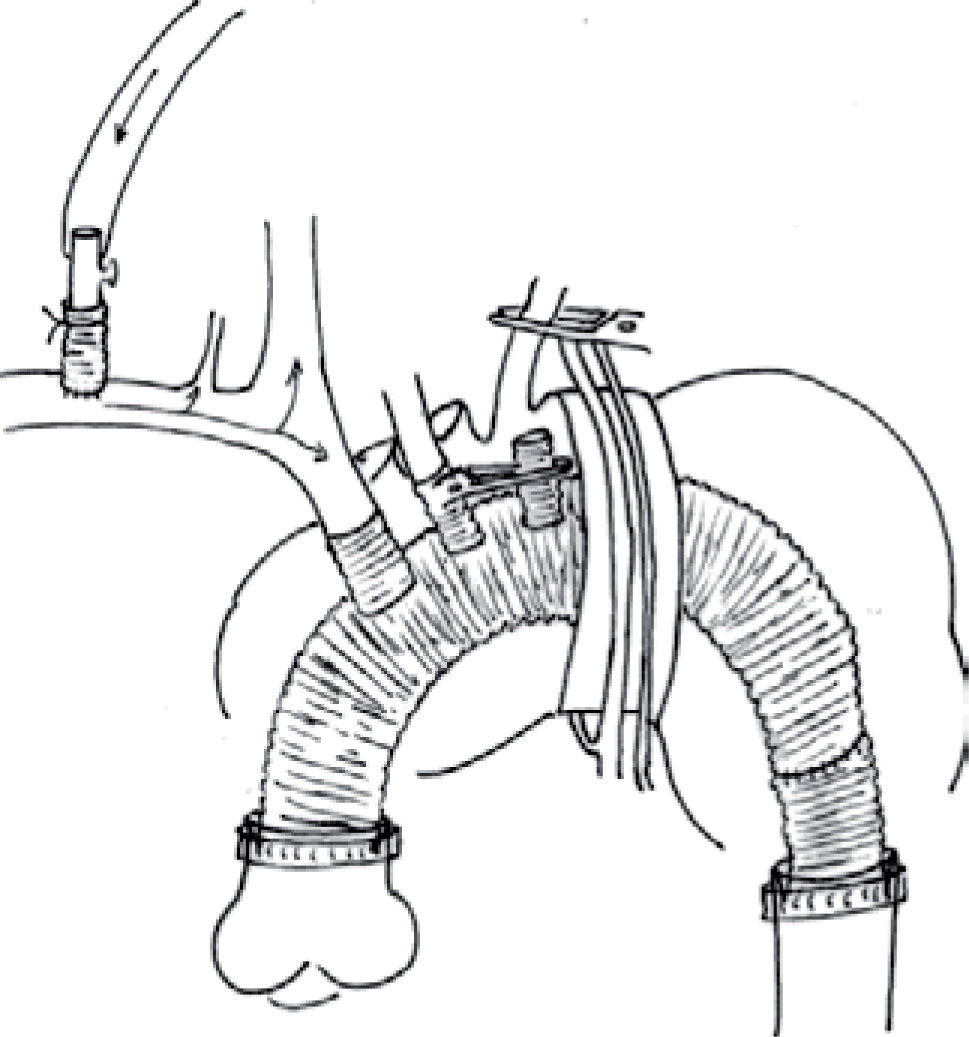
La superficie anterior de aorta ascendente y cayado aórtico es seccionada hasta el nivel del nervio frénico izquierdo, y se realiza otra incisión en la cara anterior de aorta descendente lateral al nervio vago izquierdo. Los orificios de salida de las ramas intercostales, esofágicas y bronquiales son suturados sin penetrar profundamente para evitar lesionar el esófago. Se acomoda el injerto dentro de la aorta torácica y se seccionan el TBC y (arteria carótida interna) ACI en un nivel apto para la anastomosis. En primer lugar, la ACI se anastomosa a la segunda rama del injerto y a continuación se anastomosa el TBC a la rama proximal del injerto con polipropileno 5/0 (Fig. 2).
Se coloca un catéter de aspiración en el injerto de aorta ascendente, y se purga el corazón de aire. Se despinza la ACI y se rellena el injerto con sangre hasta que fluye por su extremo distal. Se despinza el TBC, se aumenta el flujo a 15ml/kg/min y se inicia la reperfusión cardíaca y perfusión por las dos carótidas (Fig. 3). En un tiempo aproximado de 15–20min desde el inicio de la PCHP y perfusión cerebral por una carótida a una temperatura de 20 °C, conseguimos perfusión anterógra-da de ambas carótidas, sin necesidad de canulación directa de las mismas y el riesgo que ello conlleva de movilización de placas de ateroma. Podríamos llamar a esta técnica de perfusión cerebral, derivada de la técnica arch first13, perfusión cerebral secuencial de ambas carótidas.
Si la aorta ascendente no pudo ser pinzada por enfermedad arteriosclerótica, se procede con su sustitución, según la técnica descrita anteriormente, tras la reimplantación de la ACI y TBC y establecimiento de perfusión cerebral por dos troncos supraaórticos, asociando a las pinzas vasculares descritas arriba otra pinza proximal a la ramificación del TBC.
Es posible reimplantar los troncos supraaórticos mediante una pastilla de aorta, la cual puede englobar los tres troncos o sólo el TBC y ACI, dejando la implantación de la arteria subclavia izquierda (ASI) al final del procedimiento mediante anastomosis directa terminolateral entre ASI y ACI, o bien, interponiendo un injerto vascular de 8–10mm anastomosado proximalmente en el injerto de aorta y distalmente en ASI. Esta técnica presenta varios inconvenientes: el tejido de la pastilla aórtica suele ser patológico, con riesgo aumentado de embolia, malperfusión y hemorragia en la sutura. Parece una anastomosis técnicamente más difícil y de acceso complicado a la cara posterior en caso de hemorragia.
Antes de anastomosar la ASI, realizamos la anastomosis distal en aorta descendente para ahorrar tiempo de isquemia medular y visceral. Si es necesario, se gira la mesa 30° hacia el lado derecho. La aorta descendente se secciona en el nivel apropiado. Para hacer esta anastomosis más cómoda, es recomendable utilizar de forma separada una prótesis vascular de 10cm de longitud con un diámetro 2mm menor que la aorta descendente, el cual es evertido, a partir de uno de los extremos, en la mayor parte de su longitud. Esta prótesis se pliega a lo largo de su eje longitudinal, se introduce en la aorta descendente y se realiza una anastomosis, con sutura continua de polipropileno 4/0, entre el extremo evertido del injerto y la aorta descendente14, reforzada con una tira externa de teflón (Fig. 4). Tras finalizar la sutura, el injerto es extraído de la luz aórtica, adoptando la anastomosis una forma similar a la realizada previamente en la aorta ascendente y con las mismas ventajas de rapidez, hemostasia y facilidad para la colocación de puntos en posibles zonas de fuga.
La prótesis de tres ramas se pasa por detrás del pedículo conteniendo los nervios vago y frénico izquierdos y queda enfrentado con la prótesis de aorta descendente. Se recortan oblicuamente los extremos de ambos injertos, para adecuarse a la curvatura de la aorta a este nivel, y se realiza, con facilidad, una anastomosis entre injertos con polipropileno 4/0, empezando primero con la aguja de fuera adentro en uno de los injertos y de dentro afuera en el otro, uniendo de este modo las caras internas de los injertos y añadiendo pegamento biológico al finalizar la sutura. El purgado de esta última anastomosis es sencillo. Antes de finalizar la anastomosis, se pinza, si es posible, la aorta descendente, se reduce el flujo de CEC, se retira la pinza del injerto ramificado y se permite el purgado de aire mientras se finaliza la anastomosis (Fig. 5).
Alternativamente, la anastomosis entre el injerto ramificado y la aorta descendente, si parece accesible con facilidad, puede realizarse directamente; aconsejamos telescopar la anastomosis entrando con la aguja en el injerto de fuera adentro, y en la aorta de dentro afuera. De esta forma la anastomosis adquiere una forma similar a la realizada en aorta ascendente. Aproximadamente, a los 30–40min de PCHP se reinicia la perfusión sistémica y recalentamiento del paciente.
Por último, se realiza la anastomosis entre la tercera rama del injerto y la ASI. En algunos pacientes, el tamaño del cayado aórtico desplaza la ASI hacia arriba, izquierda y posterior, haciendo difícil su acceso desde la esternotomía. Si esta dificultad se sospecha por ATC, puede ser aconsejable realizar previamente una derivación subclaviocarotídea izquierda con ligadura de ASI.
Ventajas- –
Sencillez: una sola cánula arterial, sin necesidad de modificarla de sitio, y un circuito convencional de CEC con una bomba sanguínea, un medidor de flujo y sin ramificaciones en la línea arterial.
- –
Perfusión cerebral de dos carótidas sin necesidad de canulación endoluminal, evitando lesionar la íntima.
- –
Pinzar la aorta ascendente y empezar por la reparación proximal reduce el tiempo de isquemia medular y visceral, y permite reperfundir precozmente el corazón, disminuyendo el tiempo de isquemia cardíaca.
- –
Anastomosis de los troncos supraaórticos distal al arco aórtico mediante las tres ramificaciones del injerto, evitando incluir en esta anastomosis tejido patológico del techo del arco aórtico: placas de ateroma, tejido disecado, conectivopatía (síndrome de Marfan).
- –
Técnica de anastomosis proximal y distal cómoda y hemostática.
- –
Necesidad de hipotermia profunda inferior a 20 °C debido al empleo de parada circulatoria sistémica e isquemia hipotérmica de la mitad inferior del cuerpo por ausencia de una segunda cánula arterial distal al arco aórtico para perfusión medular y visceral, aunque la técnica permite asociar esta segunda cánula, si se desea.
- –
Empleo de una sutura adicional injerto con injerto, aunque de fácil realización.
Cuando existe arteriosclerosis grave de la aorta ascendente, ésta no puede ser pinzada y, con la técnica descrita, el tiempo de parada circulatoria e isquemia hipotérmica medular y visceral es mayor. En estos casos existen dos opciones para disminuir el tiempo de PCHP:
- –
Además de la perfusión anterógrada a través de la AAD, asociar perfusión retrógrada por arteria femoral y pinzamiento de la aorta descendente mientras se realizan las anastomosis de los troncos supraaórticos y de la aorta ascendente.
- –
Realizar primero la anastomosis de los troncos supraaórticos y perfundir el cerebro a través de la cánula en AAD mediante dos pinzas en el injerto aórtico proximal y distal a la trifurcación; luego realizar la anastomosis distal en aorta descendente y reperfundir el territorio sistémico, retirando la pinza distal a la ramificación del injerto, y por último proceder con la anastomosis proximal en aorta ascendente. Esta técnica conlleva un mayor tiempo de isquemia cardíaca.
El procedimiento descrito por Strauch, et al.15 conjuga eficacia, adaptabilidad y facilidad técnica, y su dictado en inglés Keep it simple, safe, and versatile la define.
La razón que argumentan estos autores para realizar la sustitución de aorta ascendente, cayado aórtico y aorta descendente en dos estadios es que las resecciones extensas de la aorta torácica conllevan una mayor morbilidad, mientras que varios procedimientos menos agresivos son mejor tolerados, incluso en pacientes ancianos.
Describiremos el estadio I de sustitución del arco aórtico, que incluye la técnica de la «trompa de elefante», la cual se realiza a través de una esternotomía media extendida al espacio supraclavicular izquierdo. El estadio II consistiría en la sustitución de la aorta descendente mediante una toracotomía, que se llevaría a cabo cuando el paciente se hubiera recuperado mental y físicamente de la primera intervención.
La disección de los troncos supraaórticos, canulación arterial, establecimiento de la CEC y sustitución de la aorta ascendente se realizan del mismo modo y siguiendo los mismos pasos indicados en el procedimiento en un estadio visto anteriormente. El establecimiento de la PCHP y la técnica de perfusión cerebral anterógrada también son las mismas que las ya descritas, pero la reimplantación de los troncos supraaórticos se realiza mediante una prótesis vascular trifurcada independiente de la utilizada para sustituir el cayado aórtico. Se trata de una prótesis de 12–14mm sobre la que se anastomosan, con una angulación de 45°, dos prótesis de 8–10mm (Hemashield Vascular Grafts, Boston Scientific, Natick, MA, USA). Las ramas laterales se recortan a la distancia menor posible y se anastomosan a la ASI y ACI. Finalmente, la prótesis que hace de tronco principal se recorta a la distancia apropiada y se anastomosa al TBC. A continuación se pinza en su base y se restablece la perfusión cerebral por ambas carótidas y subclavia izquierda desde la cánula arterial en TBC o AAD. Es posible también dejar la implantación de la ASI al final del procedimiento, como se ha descrito en la técnica anterior en un estadio.
Durante PCHP y perfusión cerebral selectiva se realiza la anastomosis distal en trompa de elefante (Fig. 6)16. Al elegir el mejor sitio para la sutura de la anastomosis distal hemos de tener en cuenta intentar realizarla en zona no aneurismática, en tejido no calcificado, resistente y elástico, y proximal al pedículo que contiene los nervios frénico y vago izquierdos. Esto a menudo implica realizar la anastomosis en trompa de elefante en una zona proximal en arco aórtico, lo que obliga a suturar el origen de uno o más troncos supraaórticos y modificar la longitud de la trompa de elefante. La ubicación de esta línea de sutura no influye para nada en la realización del estadio II. Cuando la sutura de la trompa de elefante está finalizada, la prótesis es evertida hacia atrás y anastomosada a la aorta ascendente. La prótesis trifurcada se anastomosa en la cara lateral de la aorta ascendente y se inicia el recalentamiento (Fig. 7).
Técnica de la trompa de elefante modificada: se invierten los primeros 5cm proximales de una prótesis vascular de 10–15cm esta prótesis, así invertida, se introduce en el interior del cayado aórtico y se sutura al cuello del aneurisma; posteriormente, se extrae la porción invertida hacia el exterior del cayado aórtico, quedando enfrentada con la prótesis de aorta ascendente.
Sustitución de aorta ascendente y arco aórtico, utilizando para la reimplantación de los troncos supraaórticos la técnica de la prótesis trifurcada separada. En este caso se empleó una prótesis prefabricada de 16×8, donde el cuerpo de 16cm se anastomosó a la prótesis de aorta ascendente, y las dos ramas de 8cm en la ASI y ACI; otra rama de 10cm se interpuso entre la prótesis de 16cm y el TBC.
- –
Sencillez: procedimiento menos agresivo mediante esternotomía media, mejor tolerado por el paciente, en especial ancianos. Una sola cánula arterial (arteria axilar), sin necesidad de modificarla de sitio y un circuito convencional de CEC.
- –
Pinzar la aorta ascendente y empezar por la reparación proximal reduce el tiempo de isquemia medular y visceral.
- –
Anastomosis individual de los troncos supraaórticos mediante las tres ramificaciones del injerto, evitando incluir en esta anastomosis tejido patológico del techo del arco.
- –
Perfusión cerebral anterógrada simple y total con la cánula arterial y la bomba de perfusión de CEC, no dificultando la técnica quirúrgica ni lesionando los vasos con catéteres endoluminales de perfusión cerebral.
- –
Es la única técnica realizada en estadios con la posibilidad de implantar la prótesis en «trompa de elefante» proximalmente en arco aórtico, a nivel del cuello del aneurisma y, por lo tanto, con buen tejido para soportar la sutura.
- –
Recomendable para cirujanos que eventualmente realizan esta cirugía.
- –
Riesgo de complicaciones evolutivas entre estadio I-II.
- –
- –
Isquemia hipotérmica de la mitad inferior del cuerpo con imposibilidad de pinzar aorta descendente distal por esternotomía.
- –
Empleo de una sutura adicional entre prótesis vasculares, aunque de fácil realización.
- –
Aplastamiento o acodadura de la prótesis trifurcada.