La cirugía de la taquicardia ventricular (TV) tiene una alta efectividad, habiendo mejorado en la actualidad su mortalidad, aunque por su complejidad sigue limitada a pocos grupos quirúrgicos. Aporta una alternativa real y en ocasiones única en algunos pacientes, y por ello no puede ser considerada como una alternativa terapéutica es desuso sin indicaciones. Su indicación debe de ser individualizada según el caso, tipo de arritmia y experiencia del equipo medicoquirúrgico. La técnica está sujeta a protocolos de actuación pre e intraoperatorios, variables para las diversas etiologías y mecanismos.
Surgery for ventricular tachycardia is highly efficient, having improved its mortality at present, though is still limited to a few surgical groups. It provides a real alternative, and sometimes represents a unique therapy in some patients; therefore, these procedures cannot be considered obsolete without indications. Indications must be individualized according to the type of arrhythmia and experience of medical and surgical equipment. Technique is submitted to pre and intraoperative protocols, variable depending aetiology and mechanisms.
La cirugía de las arritmias ventriculares tuvo su esplendor a mediados del siglo pasado, cuando cirujanos y electrofisiólogos estudiaron conjuntamente los mecanismos y sustratos de estas arritmias. De este trabajo surgieron las actuales técnicas quirúrgicas, la mayoría aún vigentes, en algunos casos mejorados con los nuevos instrumentos de ablación y mapeo quirúrgico.
En este capítulo revisamos el tratamiento quirúrgico del sustrato de la TV, como forma más frecuente de indicación, con comentarios adicionales para otras formas de arritmias ventriculares. Por lo tanto, estos comentarios aplicables a la TV monomórfica con un solo sustrato también lo son a otras formas de TV polimórficas producidas por la presencia de dos o más sustratos.
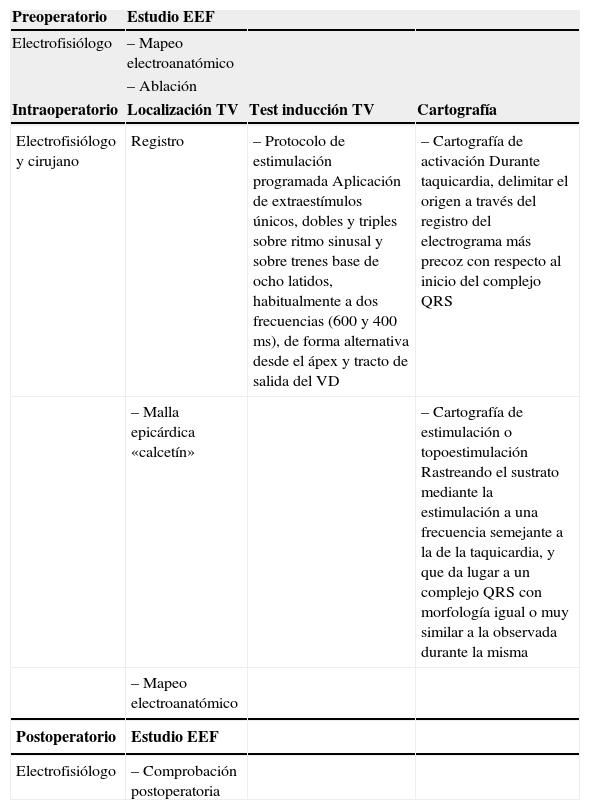
Técnica quirúrgica para la taquicardia ventricularEl objetivo del tratamiento quirúrgico es la eliminación del sustrato, y con ello la arritmia y el riesgo de su recurrencia. Este tratamiento consta de una serie de estadios, previos a la cirugía, durante y posteriores a la misma (Tabla I). Dependiendo del tipo de arritmia ventricular disponemos de diferentes procedimientos. El más habitual es la ablación o resección del foco/sustrato arritmogénico (Fig. 1), otros son la aneurismectomía y la simpatectomía cardíaca. Aunque para la ablación intraoperatoria hay diversas fuentes de energía, en la cirugía ventricular la crioablación sigue siendo la más habitual por su seguridad y simplicidad.
Estadios en la ablación quirúrgica de la tv
| Preoperatorio | Estudio EEF | ||
| Electrofisiólogo | – Mapeo electroanatómico | ||
| – Ablación | |||
| Intraoperatorio | Localización TV | Test inducción TV | Cartografía |
| Electrofisiólogo y cirujano | Registro | – Protocolo de estimulación programada Aplicación de extraestímulos únicos, dobles y triples sobre ritmo sinusal y sobre trenes base de ocho latidos, habitualmente a dos frecuencias (600 y 400 ms), de forma alternativa desde el ápex y tracto de salida del VD | – Cartografía de activación Durante taquicardia, delimitar el origen a través del registro del electrograma más precoz con respecto al inicio del complejo QRS |
| – Malla epicárdica «calcetín» | – Cartografía de estimulación o topoestimulación Rastreando el sustrato mediante la estimulación a una frecuencia semejante a la de la taquicardia, y que da lugar a un complejo QRS con morfología igual o muy similar a la observada durante la misma | ||
| – Mapeo electroanatómico | |||
| Postoperatorio | Estudio EEF | ||
| Electrofisiólogo | – Comprobación postoperatoria |
TV: taquicardia ventricular; EEF: estudio electrofisiológico.
Esquema de las diferentes técnicas quirúrgicas en el tratamiento de la TV. El foco y sustrato está representado en el centro del miocardio. A: aislamiento del foco mediante ventriculotomía endocárdica circular, de Harridan, et al., 197829. B: resección endocárdica completa del foco y sustrato arritmogénico, de Josephson y Harken, 197930. C: ablación del foco y sustrato arritmogénico, de Josephson y Harken, 197930
El estudio electrofisiológico (EEF) preoperatorio es obligatorio, salvo contraindicación, ya que además de mapear la TV y orientar topográficamente al cirujano, puede darse la circunstancia de que no pueda ser inducida durante la cirugía, lo que sucede entre un 15–30% de casos.
Desde el punto de vista electrofisiológico, la mayoría de arritmias ventriculares responde a un foco ectópico o automático, o a una reentrada, ambas formas de sustrato susceptibles de ablación. Con frecuencia la TV tiene un origen endocárdico, aunque el circuito de algunas taquicardias también puede ser epicárdico, por lo que debe realizarse un mapeo cuidadoso en ambas zonas. En ocasiones puede haber discrepancias importantes entre el origen endocárdico y epicárdico, en especial cuando la taquicardia es de origen septal.
El clásico mapeo intraoperatorio requiere de un polígrafo multicanal y de una malla ventricular con múltiples electrodos («calcetín») para el registro electrocardiográfico simultáneo de un solo latido. Esta malla flexible, con un número variable de electrodos (entre 36–160), permite registrar simultáneamente los electrogramas unipolares y bipolares, y obtener así una secuencia de activación epicárdica global a partir de un solo latido1. El mapa se ha de realizar antes que el resto de procedimientos asociados, en especial de la ventriculotomía, ya que puede impedir la inducibilidad de la TV. En ocasiones, si el foco no es registrado desde el epicardio, o en los casos en que se requiera de una mayor precisión anatómica, puede realizarse un mapeo endocárdico del aneurisma, siempre que la TV siga siendo inducible una vez realizada ventriculotomía.
En la actualidad el mapeo de malla puede ser sustituido por un estudio electroanatómico quirúrgico2. Los sistemas de navegación pueden integrar el estudio electrofisiológico con imágenes preoperatorias de tomografía computarizada (TC) y resonancia magnética (RM), obteniéndose una reconstrucción 3D de gran precisión desde un punto de vista anatomicoquirúrgico y electro-fisiológico. La experiencia quirúrgica inicial con estos sistemas permite augurar la no necesidad de los clásicos mapeos intraoperatorios, tanto pre como postablación2.
Los diferentes criterios durante el mapeo convencional que localizan el sitio de origen de la arritmia son:
- –
Cartografía de activación. El sitio de activación más precoz durante la taquicardia (en relación con el comienzo del QRS en el electrocardiograma (ECG). Durante taquicardia, se delimita el origen a través del registro del ECG más precoz con respecto al inicio del complejo QRS.
- –
Cartografía de estimulación o topoestimulación o pace-mapping. Localización mediante estimulación ventricular del punto epicárdico/endocárdico. Estando el paciente con su propio ritmo intrínseco, la estimulación ventricular, punto a punto, acota el sustrato a través de la obtención de QRS con morfología y eje lo más parecidos posible a los de la TV (Fig. 2). La topoestimulación intraoperatoria puede tener valor limitado por la distorsión del corazón y la apertura del tórax, a no ser que hayamos inducido la TV clínica durante la cirugía. Debido a que el infarto y el aneurisma distorsionan la anatomía ventricular y la propagación endocárdica del impulso, la cartografía de estimulación no es una técnica tan útil en la cardiopatía estructural como lo es en la TV asociada a corazón sano.
Figure 2.Ablación de TV focal septal. Cartografía de estimulación. A: estudio electrofisiológico preoperatorio para localizar un área/sustrato con cartografía de estimulación (topoestimulación) sistema Carto® y electrogramas intracavitarios. El área de fibrosis fue identificada previamente por RM cardíaca, que orientó en la búsqueda electrofisiológica. La estimulación ventricular en la zona del sustrato reproduce la imagen ECG de TV monomórfica del paciente (240 ms longitud ciclo, e imagen de bloqueo completo de rama derecha), situándola en la zona ventricular posterior medioseptal, a 2cm del anillo mitral. Además, son registrados potenciales tardíos en el área de fibrosis, lo que sugiere la existencia de conducción retardada dentro del área de fibrosis por mecanismos de reentrada. B: la información se traslada al cirujano para localizar el sustrato. La cartografía electroanatómica permite localizar en imagen 3D el punto a tratar con crioablación intraoperatoria. En este caso la localización septal del foco requirió del abordaje intracavitario a través de la válvula tricúspide.
(0.25MB). - –
Un intervalo prolongado entre el artificio de estimulación y el QRS resultante, lo que sugiere que el catéter está en el área de conducción lenta del circuito de reentrada. Si ese criterio se obtiene durante la TV y con idéntica morfología entre QRS estimulado y QRS en TV hablamos de entrainment oculto.
- –
El registro de potenciales mesodiastólicos y la confirmación de que éstos son componentes del circuito de reentrada no disociables con maniobras de estimulación durante la taquicardia.
Completado el proceso de ablación se comprueba su efectividad con la aplicación de una estimulación eléctrica programada induciendo de nuevo la arritmia. Si todavía lo es se repite la ablación, y en el supuesto de seguir con la misma TV tras el segundo intento de ablación, practicaremos de nuevo un mapeo seguido de una nueva ablación sobre el sustrato residual. Si la arritmia no es inducible, la probabilidad de que la ablación sea permanente es del 98%. Finalizado el proceso de ablación se completa el procedimiento quirúrgico asociado (revascularización, reparación ventricular, valvuloplastia, etc.).
En las TV por cardiopatía isquémica, en especial con antecedentes de infarto de miocardio, el sustrato suele ser áreas no homogéneas de extensa fibrosis que predisponen a diferentes reentradas, a menudo con TV de múltiples morfologías en el EEF. En estos casos hay que buscar la ablación de los sustratos desencadenantes de las diversas TV atendiendo a sus diferentes morfologías. Si en la ablación eliminamos una TV de una sola morfología, el resultado final será parcial y paliativo, necesitando complementarlo con un desfibrilador automático implantable (DAI) y/o fármacos.
La mayor experiencia está descrita con la crioablación de NO2 a –60 °C durante 2min3,4. El argón es un nuevo gas criogénico más rápido, que genera lesiones más profundas y homogéneas, y que alcanza los –170 °C. La crioablación es una lesión térmica que respeta bastante el endotelio, las arterias coronarias, válvulas cardíacas, y permite realizar criomapping, es decir, lesión reversible a –30 °C de miocardio5. Con el resto de energías existe poca experiencia en ablación quirúrgica ventricular6,7.
El EEF de control postoperatorio se realiza a partir de la primera semana, aunque es recomendable pasados 40 días de la cirugía. El éxito en el control es la ausencia de arritmia inducible.
Taquicardia ventricular isquémicaEl sustrato anatómico de esta arritmia es complejo, y algunas veces de gran tamaño (Figs. 3 y 4). Las zonas críticas de conducción anormal suelen ser subendocárdicas, aunque pueden ser intramurales o subepicárdicas. En estos sustratos la efectividad de la ablación con catéter es del 76%, y las complicaciones mayores del procedimiento del 6%, incluyendo una mortalidad del 1,5% (rango: 0–5%)8–11.
Ablación de TV en aneurisma basal posterior. A: aneurisma ventricular isquémico de localización basal posterior, con abundante material trombótico en su luz. B: línea de crioablación entre el cuello del aneurisma y el anillo mitral. C: palpación e identificación, a corazón latiendo, del cuello del aneurisma para su posterior ablación. D: crioablación del perímetro del cuello del aneurisma, con apoyo del criodo sobre la zona de transición entre el miocardio sano y el saco fibrótico. La ablación necrosa el tejido, de forma homogénea, destruyendo los islotes de tejido vital localizados en la zona de transición.
Ablación de TV en seudoaneurisma basal lateral. A: imagen ecocardiográfica de seudoaneurisma gigante de cara lateral ventricular, con trombo recubriendo todo su saco. B: imagen quirúrgica tras la resección de las paredes del seudoaneurisma. Crioablación de un lateral del cuello quirúrgico (2min, –100 °C). En este caso la aplicación del criodo apoya sobre el anillo mitral, con lo que no es necesaria una línea adicional entre el cuello aneurismático y el surco auriculoventricular. Esta crioablación se realizó a corazón latiendo sin clampaje aórtico en normotermia.
La TV sintomática, refractaria al tratamiento farmacológico y percutáneo, tiene poca prevalencia entre los pacientes candidatos a cirugía coronaria con aneurisma ventricular. Jones, et al. comunican en la cirugía coronaria un 5,8% de prevalencia de aneurisma ventricular, de los cuales en tan sólo un 6% se indicó cirugía de la TV, es decir, la prevalencia de este tipo de cirugía es en la cirugía coronaria menor del 0,5%12.
La ablación en este tipo de arritmias debe ser contemplada como un procedimiento asociado a la revascularización miocárdica13. Como se indica y recomienda en las actuales guías, la revascularización es esencial y debe anteceder a cualquier otro procedimiento, incluida la ablación con catéter14. El estudio CABG-PATCH, multicéntrico aleatorizado para la prevención primaria de arritmias ventriculares en pacientes revascularizados quirúrgicamente con fracción de eyección del ventrículo izquierdo (VI) menor del 35% y un seguimiento de 48 meses, demostró el efecto beneficioso antiarrítmico de la propia revascularización, con similar mortalidad entre los pacientes control (revascularización) respecto a aquellos en los que se implantó además un DAI (revascularización y DAI)15. Si comparamos además los resultados de este estudio con otros similares con implantación de DAI pero sin revascularización asociada, la mortalidad a los 24 meses fue en el estudio MADIT del 32% y en el AVID del 24%, superiores al 18% del CABG-PATCH15–17. Por todo ello, es necesario, y deseable a ser posible, en los pacientes con cardiopatía isquémica obstructiva y arritmias ventriculares proceder siempre en un primer paso a su revascularización13,14. No obstante, si la arritmia espontánea es una TV monomórfica, su mecanismo va a depender con alta probabilidad de una escara y, por lo tanto, no desaparecerá únicamente con la revascularización, por lo que habrá que asociar un procedimiento de ablación de sustrato.
Las TV asociadas a cardiopatía isquémica se localizan, por lo general, en zonas vecinas al aneurisma ventricular, que pueden ser sometidas a ablación por medio de una simple, inocua y rápida crioablación de 2min y/o mediante resección endocárdica de las zonas fibrosas.
La técnica quirúrgica en estos pacientes dependerá de la localización del sustrato (Tabla II):
- –
En aneurismas y/o áreas acinéticas-discinéticas resecables de localización anteroseptal. La técnica quirúrgica es mediante una ventriculotomía con resección y escarectomía del tejido fibrótico, y crioablación del anillo perimetral del área resecada. En este anillo, o zona de transición entre el miocardio sano y el tejido fibrótico, se suele hallar el sustrato de la arritmia. La intervención de Dor, con el remodelado ventricular y exclusión con parche de las áreas acinéticas y cicatriciales, se asocia con la crioablación o escarectomía en los casos con arritmias ventriculares18.
- –
En aneurismas y/o áreas acinéticas-discinéticas resecables de localización basal posteroinferior, basal lateral. Ventriculotomía con resección y escarectomía del tejido fibrótico. Y crioablación del anillo perimetral del área resecada, más crioablación lineal entre la ventriculotomía y el anillo mitral.
- –
Sustrato de reentrada en área quirúrgicamente no identificable, intramiocárdico. El área puede ser anatómicamente resecable, o irresecable. Crioablación endocárdica y/o epicárdica del área miocárdica. Siempre es preferible la crioablación a la resección para evitar la cicatriz posterior de la ventriculotomía.
Tipo y localización de la lesión foco de la tv y su técnica quirúrgica
| Tipo lesión | – Aneurisma y/o área acinética-discinética resecable | – Aneurisma y/o área acinética-discinética resecable | – Área quirúrgica no identificable Intramiocárdico (resecable, o irresecable) |
| Localización | – No basal anteroseptal | – Basal posteroinferior, lateral | – Cualquier zona tracto salida |
| – Ventrículos | |||
| – Antigua ventriculotomía | |||
| Técnica quirúrgica | – Ventriculotomía con resección y escarectomía del tejido fibrótico | – Ventriculotomía con resección y escarectomía del tejido fibrótico | – Crioablación endocárdica y/o epicárdica del área miocárdica |
| – Crioablación del anillo perimetral del área resecada | – Crioablación del anillo perimetral del área resecada, con crioablación lineal entre la ventriculotomía y el anillo AV | ||
| Estudio previo | – EEF preoperatorio no imprescindible, pero recomendable | – EEF preoperatorio no imprescindible, pero recomendable | – EEF preoperatorio imprescindible |
| Limitaciones ablación con catéter | – Riesgo ACV | – Riesgo ACV | – Bajo riesgo ACV |
| – Baja efectividad | – Baja efectividad | – Mayor efectividad | |
| – Sustrato amplio en el cuello aneurisma | – Sustrato amplio en el cuello aneurisma | – Sustrato focal | |
| Esquema técnica quirúrgica |
AV: auriculoventricular; EEF: estudio electrofisiológico; ACV: accidente cerebrovascular.
En ocasiones no se puede disponer de EEF preoperatorio, bien por contraindicación ante la presencia de trombos, la extensión del aneurisma, la inestabilidad hemodinámica de la arritmia, o la poca efectividad de la ablación percutánea para estos casos. En el supuesto tercero, el mapeo intraoperatorio previo a la cirugía es imprescindible. En los supuestos primero y segundo, es recomendable, aunque muchos grupos no lo realizan, asumiendo que la reentrada asienta en el cuello del aneurisma3,19,20. En la experiencia de Dor, et al., el probable mecanismo antiarrítmico de la técnica no es la crioablación o resección endocárdica de las zonas fibróticas sino la reducción de la tensión de pared mediante el remodelado morfológico del ventrículo. Este concepto contradice la actual evidencia, a favor de la búsqueda y ablación del foco-sustrato, aunque reafirma la práctica habitual quirúrgica de no realizar los estudios de mapeo pre e intraoperatorios20,21.
La efectividad de la ablación quirúrgica, en la etapa pre-DAI y ablación percutánea, fue del 95%, aunque con una mortalidad operatoria del 14%3. En estas series la tasa de muerte súbita fue del 0,7% anual, y la supervivencia global a 5 años del 70%, similar a la de los pacientes con cardiopatía coronaria isquémica y disfunción ventricular moderada-grave sin TV. Sin embargo, aunque existe menos experiencia en la etapa post-DAI y ablación percutánea, la actual mortalidad quirúrgica hospitalaria es inferior al 4%, la tasa de curación de la arritmia del 84–97%, mínima incidencia de muerte súbita durante el seguimiento19,22,23, y un pronóstico a largo plazo dependiente de la gravedad de la enfermedad coronaria y el grado de disfunción ventricular izquierda (diámetros telesistólico y telediastólico)21,24.
Taquicardia ventricular no isquémicaLa displasia arritmogénica de ventrículo derecho (VD) puede presentar diversas formas de arritmias dependiendo de la localización, extensión y el número de áreas con sustrato de miocardio arritmogénico. El procedimiento quirúrgico consiste en aislar eléctricamente estas áreas del resto de corazón. La técnica depende de la localización, tamaño y número de sustratos:
- –
Taquicardia ventricular focal bien localizada: según el tamaño del área, se puede practicar la ablación focal, la resección del área de forma similar a la TV por reentrada isquémica, o el aislamiento eléctrico de la zona.
- –
Taquicardia ventricular que afecta a toda la pared del VD originando múltiples tipos morfológicos de TV. El abordaje mejor puede ser el trasplante cardíaco.
- –
Taquicardia ventricular que afecta al septo interventricular: el abordaje es la crioablación del área.
En el síndrome del QT largo congénito el tratamiento quirúrgico es la simpatectomía cervicotorácica izquierda, con escisión del ganglio estrellado y los tres o cuatro primeros ganglios simpáticos torácicos izquierdos25,26. La experiencia ha mostrado que este procedimiento es efectivo sólo a medio plazo con recurrencia tardía, y como resultado se recomienda la implantación del DAI antes de la cirugía. La cirugía está indicada en los pacientes con sintomatología recurrente (síncope y/o muerte súbita cardíaca) con DAI y tratamiento ß-loqueador efectivo, o en aquellos que no toleran los fármacos.
Las arritmias asociadas a ventriculotomías son frecuentes en la cirugía de las cardiopatías congénitas, en especial la tetralogía de Fallot. Las ventriculotomías y los parches aislados son la causa más frecuente de TV por reentradas en estos pacientes27. El tratamiento quirúrgico consiste en la ablación de la cicatriz y su unión lineal a algún punto eléctricamente silente, por ejemplo los anillos auriculoventriculares o los ventriculoarteriales pulmonar y aórtico. Una técnica inicial apropiada puede prevenir estas arritmias, por ejemplo prolongando mediante ablación uno de los extremos de la ventriculotomía a estructuras barrera, como los antes mencionados, y evitando una excesiva atrición de los bordes de la incisión miocárdica.
Las TV focales (no reentrantes) son principalmente por un automatismo anormal en los casos de corazón sano con TV monomórfica (TV idiopática). Tienen morfología de bloqueo de rama izquierda cuando se localizan en el VD (TV de Gallavardin), y de rama derecha cuando están en el VI. Cuando el origen es del VD, la mayoría de casos asienta en el infundíbulo derecho debajo de la arteria pulmonar. Las de VI suelen tener origen en el septo medio o distal inferior o en la pared libre. Aunque la ablación percutánea tiene una efectividad mayor del 90%28, en los casos refractarios o de riesgo de perforación puede indicarse la ablación quirúrgica focal guiada por mapeo pre e intraoperatorio.
La TV rama-rama se suele asociar a miocardiopatía dilatada con disfunción ventricular, y de forma concomitante con enfermedad del sistema de conducción de His-Purkinje. La reentrada se establece entre las ramas izquierda y derecha del sistema His. La simple ablación por catéter de la rama derecha tiene efectividad próxima al 100% de los casos.