El tratamiento quirúrgico de la fibrilación auricular (fA) es un procedimiento eficaz, simplificado en los últimos años con el empleo de la ablación intraoperatoria. En esta revisión recordamos las distintas técnicas quirúrgicas y sus resultados, y actualizamos las recomendaciones para su indicación en la fA persistente y de larga duración (permanente).
Surgical treatment of atrial fibrillation is an efficient procedure, which has been simplified in recent time by intraoperative ablation systems. we herein review a variety surgical techniques and its results and update the current clinical recommendations for ablation of persistent and longstanding persistent atrial fibrillation.
La técnica del laberinto o Maze es el patrón oro en el tratamiento curativo de la FA. Las tasas de éxito se sitúan por encima del 80%, pero su complejidad técnica ha hecho que su aplicación no se haya extendido de manera generalizada. En la actualidad disponemos de fuentes de energía alternativas a la incisión quirúrgica que permiten reproducir las lesiones de una manera más sencilla y rápida, por lo que en los últimos años se ha producido un resurgimiento de esta cirugía como parte fundamental del arsenal terapéutico frente a la FA.
La técnica del laberinto-mazeEvolución históricaLa primera técnica fue el aislamiento de la aurícula izquierda1, descrita por Cox en 1980. Mediante incisiones quirúrgicas se aislaba eléctricamente la aurícula izquierda del resto del corazón. La aurícula izquierda, por lo tanto, seguía en FA, pero la aurícula derecha recuperaba el ritmo sinusal, de manera que el gasto cardíaco mejoraba, y la frecuencia cardíaca era rítmica. Al continuar la aurícula izquierda en FA, persistía la estasis sanguínea y, por lo tanto, el riesgo de embolia, con la necesidad de anticoagulación.
Otra técnica es la ablación del nodo auriculoventricular (AV), seguida del implante de un marcapasos VVI2.
La fibrilación queda confinada en las aurículas, obtenién-dose un ritmo cardíaco regular a través de la estimulación permanente del ventrículo derecho. La estasis sanguínea persiste, así como la ausencia del latido auricular.
La técnica del corredor o pasillo fue descrita por Guiraudon en 19853. Consistía en aislar una banda de miocardio auricular que conecta el nodo sinusal con el AV a través del septo interauricular, de manera que el impulso eléctrico sinusal se transmite directamente al nodo AV sin pasar por las aurículas, que permanecen en FA pero eléctricamente aisladas del resto del corazón. De esta forma sólo se conseguía corregir el ritmo irregular, pero la ausencia del latido auricular y la estasis sanguínea continuaban.
Partiendo de la hipótesis de que la FA era consecuencia de macrorreentradas alrededor de las venas pulmonares y de la orejuela izquierda, el grupo de Cox estudió distintas posibilidades técnicas con diversas incisiones en la aurícula izquierda en un modelo canino4. La primera técnica desarrollada fue el aislamiento de las venas pulmonares, que curiosamente no tuvo ningún efecto en dicho modelo experimental. Diversas modificaciones del patrón de incisiones llevaron a la llamada transección auricular. Ésta consistía en realizar una incisión por el techo de ambas aurículas desde el anillo mitral lateral hasta el anillo tricúspide por la pared lateral de la aurícula derecha y con una prolongación a través del septo interauricular hasta el tendón de Todaro. Aunque los resultados fueron excelentes, en el modelo animal no sucedió lo mismo en su aplicación clínica.
Recomendaciones sobre la información a incluir en la comunicación de resultados de la cirugía de la fa, según la sts89
| Información sobre la arritmia |
|
| Características del paciente |
|
| Procedimiento quirúrgico |
|
| Patrón de lesiones (señalar las realizadas) |
|
| Técnica utilizada para crear las lesiones |
|
| Fuentes de energía utilizadas |
|
| Protocolo de manejo postoperatorio |
|
| Protocolo de seguimiento del ritmo |
|
| Resultados |
|
El gran número de datos y resultados de las distintas técnicas de ablación motivó que la STS publicara en 2007 un documento de consenso con los estándares y guías para comunicar los resultados del tratamiento quirúrgico de la FA84. Esto permite comparar de manera más fiable los resultados y así mejorarlos. FA: fibrilación auricular; ACV: accidente cerebrovascular; STS: Society of Thoracic Surgeons.
Los estudios experimentales y clínicos con mapeo epicárdico biauricular del grupo de Cox mostraron que en todas las FA y flutter subyacía un mecanismo de macrorreentrada. En ninguno de los casos, con los medios de mapeos de aquellos años, se encontraron microrreentradas ni automatismo como mecanismos iniciadores ni perpetuadores de la arritmia. Además, dichos circuitos de macrorreentrada eran fugaces e imposibilitaban realizar la cirugía guiada con registros online, por lo que el objetivo de la técnica quirúrgica debía ser impedir el establecimiento de cualquiera de los teóricos circuitos. Esto se consiguió dividiendo la aurícula en pequeñas secciones, permitiendo además que el nodo sinusal tomara el ritmo del corazón y despolarizara ambas aurículas, recuperando la función de transporte de las mismas y evitando la estasis sanguínea. Las aurículas se convertían en un auténtico laberinto (maze) para el impulso eléctrico, con una única salida que impedía el establecimiento de la arritmia.
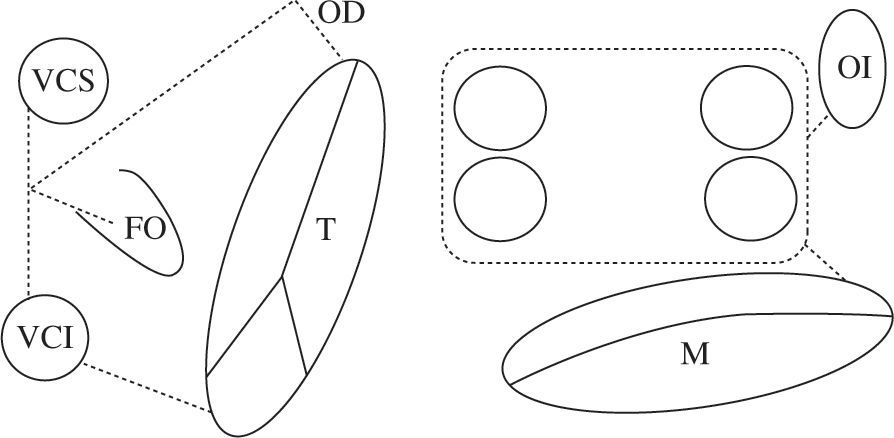
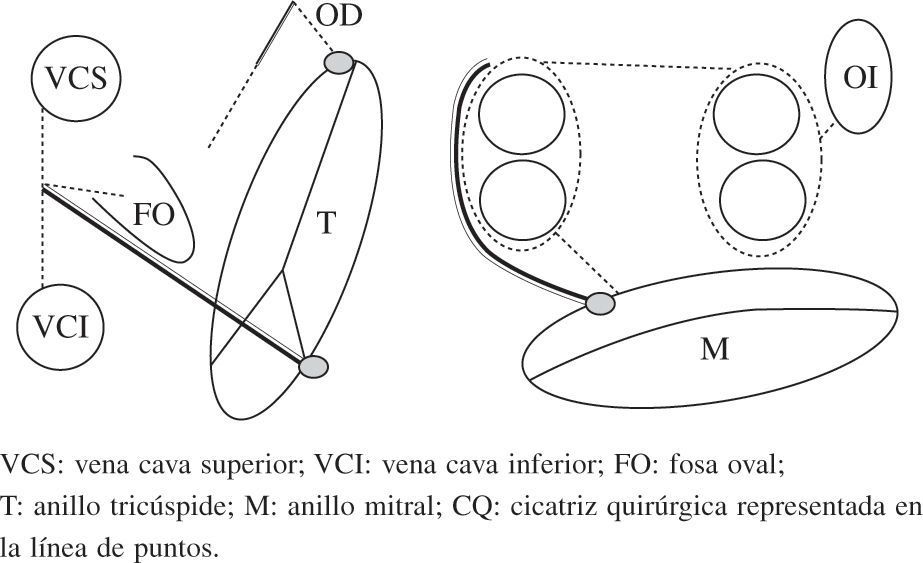
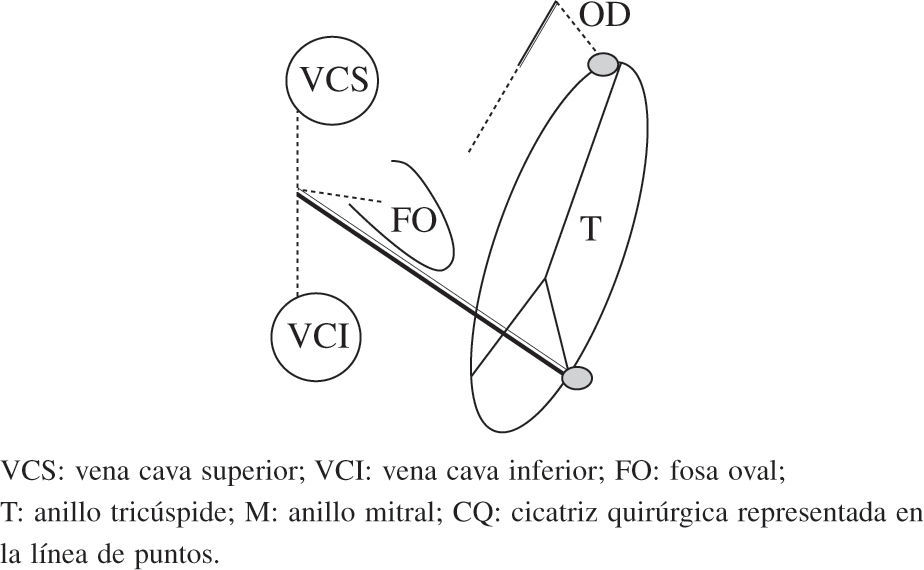
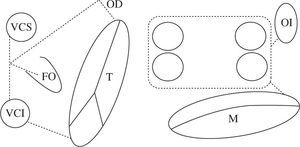
Tras comprobar la eficacia de la técnica en el mode-lo canino para abolir tanto la FA como el flutter, se aplicó por primera vez a un paciente el 25 de septiembre de 19875. La técnica original se llamó Maze I, pero hubo de modificarse al causar una disminución importante de la respuesta cronotropa y un retraso de la activación auricular izquierda con respecto a la derecha (llegaba a los 140ms cuando lo normal es 40) que la hacía coin-cidir prácticamente con la ventricular. Los estudios electrofisiológicos realizados mostraron la existencia de un área en torno al nodo sinusal anatómico llamada complejo de marcapasos auricular. Se trata de una porción de miocardio auricular de 2–5cm desde la que se origina el impulso auricular. En función de la frecuencia cardíaca y del estímulo, el punto desde el que se origina el ritmo sinusal cambia, siendo cada vez más alto según la frecuencia cardíaca va siendo mayor. La respuesta cronotropa anormal era consecuencia de que una de las incisiones pasaba por delante de la cava superior, a través de esta área. El retardo en la conducción interauricular se debía a que la incisión en el septo era muy anterior y afectaba al haz de Bachmann, vía de conducción interauricular preferencial. Las modificaciones realizadas dieron lugar al Maze II. Aunque se resolvió el problema, era bastante más complejo desde el punto de vista técnico (obligaba a seccionar completamente la cava superior), por lo que hubo de modificarse nuevamente dando lugar al Maze III, que es la técnica actual de referencia en el tratamiento quirúrgico de la FA6 (Fig. 1). Hoy en día hablamos de Maze IV para referir el Maze III realizado con radiofrecuencia en vez de con incisiones (Fig. 2).
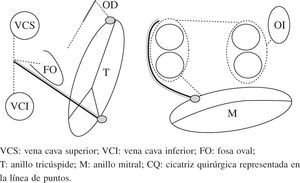
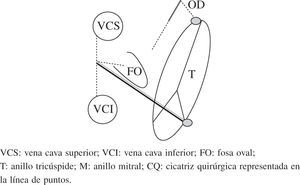
Esquema del patrón de lesiones del Maze III. En esquema están representadas ambas aurículas. Las incisiones están dispuestas con línea de puntos. Ambas orejuelas son escindidas en el procedimiento Maze III. VCS: vena cava superior; VCI: vena cava inferior; FO: fosa oval; T: anillo tricúspide; M: anillo mitral; CQ: cicatriz quirúrgica representada en la línea de puntos.
Esquema del patrón de lesiones del Maze IV. En esquema el Maze IV, descrito por Damiano, et al.90 y Gillinov. et al.91, que combina la incisión quirúrgica con la ablación. La línea continua doble (
El grupo de Cox, con 308 pacientes operados, tiene una mortalidad hospitalaria del 2,9%, estando el 98% de los pacientes en ritmo sinusal (RS) a los 8 años7. La complicación postoperatoria más frecuente son las arritmias supraventriculares, que sucedieron en el 37% de los pacientes. En el postoperatorio inmediato la inflamación local y otros factores determinan que los periodos refractarios auriculares sean temporalmente más cortos, de manera que los circuitos de reentrada pueden ser más pequeños y caber así entre las incisiones del maze. Ésta es una de las razones por la que los resultados son peores en aurículas muy grandes, de manera que parece aconsejable en estos casos asociar alguna técnica de reducción auricular para que las incisiones estén lo suficientemente próximas como para impedir el establecimiento de los circuitos de macrorreentrada8,9. Aunque en el 15% de los pacientes ha sido necesaria la implantación de un marcapasos, la mayoría de ellos presentaban una enfermedad del seno de base.
Al comparar los resultados distinguiendo entre FA aislada y FA asociada a valvulopatía los resultados han sido similares con un 98 y 96% en RS a los 5 años. Además del mantenimiento del ritmo sinusal la incidencia de accidente cerebrovascular (ACV) en el seguimiento es prácticamente nula, con un 0,1%/año10. Los principales predictores de recurrencia de la FA son la duración de la misma y el tamaño auricular izquierdo. Así, los pacientes con FA de menos de 5 años tienen un 93% de RS a los 5 años frente a un 70% de los pacientes cuya FA preoperatorio era mayor de 20 años11.
Una de las causas por las que prácticamente ningún grupo ha podido reproducir los excelentes resultados del grupo de Cox posiblemente sea el que se trate de una serie muy seleccionada; durante un intervalo de tiempo algo mayor de 10 años se han valorado más de 3.000 pacientes, y la técnica sólo se ha aplicado a unos 300; son pacientes jóvenes, el 60% presentan FA paroxística y sólo el 40% presentan cardiopatía estructural. En general, la mayoría de los grupos obtiene peores resultados en los pacientes con FA asociada a enfermedad mitral (70–80% de ritmo sinusal) frente a los pacientes con FA aislada12–14.
Los estudios de contracción auricular en el seguimiento han mostrado transporte biauricular en el 60–90% de los casos15,16. Los principales predictores para la recuperación de la función auricular son el tamaño auricular, la duración de la FA y la función ventricular. Cuando el análisis es cuantitativo se encuentra que, aunque la contracción auricular existe, ésta es un 30–50% menor que en sujetos sanos17. Esta contracción auricular más débil es consecuencia de que se aísla mecánicamente la pared posterior auricular entre las venas pulmonares (supone aproximadamente un 30% de la pared auricular), las incisiones determinan una contracción discordante y a veces se seccionan arterias auriculares. Posiblemente, la menor contractilidad auricular tras el Maze desempeña su papel en la recurrencia de la FA en el seguimiento. El mantenimiento en el tiempo de una sobrecarga auricular (mayor tensión de la pared) como consecuencia de la menor contractilidad perpetúa los mecanismos de remodelado anatómico que facilitan la recidiva. Intentando evitar este problema el mismo grupo de Cox diseñó la variante técnica radial18, en la que no se aislaba la pared posterior de la aurícula, preservándose mejor la contracción auricular.
Tratamiento quirúrgico. alternativas a la intervención de cox-mazeEl Maze es un procedimiento muy eficaz (cura más del 90% de las FA) pero técnicamente complejo y poco extendido entre la comunidad cardioquirúrgica. De su complejidad técnica se deriva una curva de aprendizaje que puede ser larga, un tiempo de isquemia y de circulación extracorpórea (CEC) significativamente más prolongados y una morbimortalidad asociada mayor en manos poco expertas. El resurgimiento de la cirugía de la FA en los últimos años se debe fundamentalmente al desarrollo de dispositivos que utilizando distintas fuentes de energía permiten reproducir las lesiones del maze sin necesidad de realizar incisiones y suturas largas, a veces en zonas de acceso muy difícil.
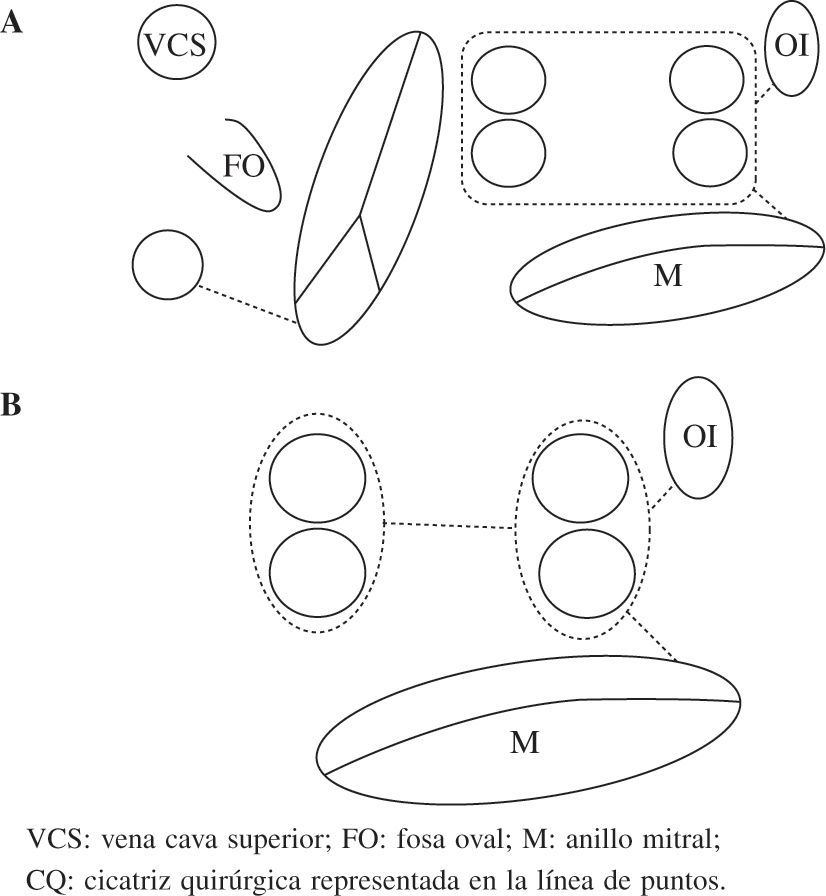
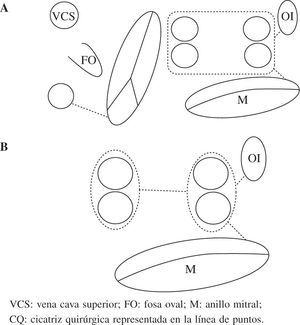
El patrón de lesionesAunque se han publicado múltiples patrones de lesiones, los que más se aproximan al maze son los que mejores resultados obtienen, independientemente del tipo de FA. Los más aceptados en la actualidad son el mini-Maze (Fig. 3), y el Maze derecho (Fig. 4). Como norma general, a patrón de lesiones más extenso, mejor resultado19. Aislando sólo las venas pulmonares podemos curar en torno al 80% de las FA paroxísticas y menos del 50% de las permanentes y persistentes. Podemos aceptar el aislamiento exclusivo de las venas pulmonares en aquellos casos con FA paroxística de corta duración, con aurícula izquierda no dilatada y que no es necesario o no queremos abrir la aurícula izquierda durante la cirugía. En el resto de pacientes el patrón de lesiones debe incluir al menos el aislamiento de las venas pulmonares (incluyendo la cara posterior de la aurícula izquierda), la conexión de éstas con el anillo mitral y la ligadura/aislamiento de la orejuela izquierda20.
Esquema del patrón de lesiones del mini-Maze. Dos esquemas de mini-Maze con diferentes formas de aislar las venas pulmonares. a: exclusión conjunta de todas las venas pulmonares (box-lesion). B: aislamiento circunferencial (selectivo) de las venas pulmonares con una lesión que conecta ambos lados. Abreviaturas similares a las empleadas en anteriores figuras. VCS: vena cava superior; FO: fosa oval; M: anillo mitral; CQ: cicatriz quirúrgica representada en la línea de puntos.
El limitar el Maze a la aurícula izquierda produce un aumento de la incidencia de flutter auricular derecho hasta 10%, pero de manejo percutáneo sencillo, y pare-ce que disminuye el éxito a largo plazo.
Si eliminamos la lesión de istmo izquierdo (porción de miocardio auricular comprendido entre las venas pulmonares y el anillo mitral, incluyendo el seno coronario) o bien realizamos ésta u otras lesiones de manera incompleta aumenta la incidencia de flutter auricular izquierdo. Se trata de una arritmia mal tolerada y de manejo percutáneo complejo, ya que precisaría de abordaje transeptal con frecuencia en presencia de una prótesis mitral. En una serie de 50 pacientes, Golovchiner, et al. comunican que seis pacientes (12,5%) presentaron en el seguimiento flutter, siendo cinco de ellos flutter atípico21. En cinco pacientes se realizó estudio electrofisiológico (sólo registro auricular derecho), correspondiendo el patrón de activación en cuatro de ellos a flutter izquierdo.
Otro debate es la comparación del Maze III (biauricular) con el mini-Maze (ablación izquierda e istmo cavotricuspídeo). En un metaanálisis sobre 5.885 pacientes, Barnett y Ad comprueban que los pacientes con maze biauricular tienen mayor libertad de FA que los pacientes con sólo lesiones en la aurícula izquierda (a 3 meses y 3 años 92 y 87% vs 86 y 73%)13. Khargui, et al.14 revisan 48 estudios retrospectivos sobre 3.832 pacientes y no encuentran diferencias en la incidencia de ritmo sinusal (77,5% en el grupo de ablación izquierda frente a 83,2% en el grupo de ablación biauricular). Recientemente, se ha publicado un estudio prospectivo aleatorizado con 299 pacientes comparando la ablación auricular izquierda frente a la biauricular22. Con un seguimiento medio de 28 meses, no hubo diferencia en la incidencia de RS entre ambos grupos (85,2% en el grupo de ablación izquierda frente a 84,1% en el grupo biauricular).
Algunos grupos discuten la necesidad de ligar/escindir la orejuela izquierda por su función endocrina, función reservorio para amortiguar los incrementos de presión intraauriculares en los latidos ventriculares prematuros, y sobre todo por su contribución al latido auricular23. Estudios fundamentalmente realizados en animales indican que su eliminación puede interferir con el mecanismo de la sed en situaciones de hipovolemia, disminuir la respuesta a las sobrecargas de volumen y de presión, disminuir el gasto cardíaco y aumentar la incidencia de insuficiencia cardíaca en el seguimiento. Los pacientes sometidos a Maze tienen disminuidos los niveles de péptido natriurético atrial tanto en el postoperatorio inmediato como en el seguimiento. En cualquier caso, no debemos olvidar que la principal fuente de émbolos en los pacientes en FA es la orejuela izquierda (91% en la FA no reumática y 57% en la reumática24), de manera que aunque se fracase en el mantenimiento del ritmo sinusal sí se consigue disminuir el riesgo de fenómenos tromboembólicos en el seguimiento, por lo que la mayoría de los grupos son partidarios de su ligadura/escisión. El único estudio prospectivo para valorar el efecto de la oclusión de la orejuela izquierda en pacientes quirúrgicos se ha realizado en 77 pacientes sometidos a cirugía coronaria, y no ha demostrado ningún beneficio a medio plazo, con una incidencia del 2,6% de tromboembolismo con 13 meses de seguimiento medio en ambos grupos25. Es importante señalar que la exclusión de la orejuela debe realizarse bien, pues la oclusión parcial aumenta su trombogenicidad y, por lo tanto, el riesgo embólico. El grupo de Gillinov26 estudió con ecocardiografía transesofágica 137 orejuelas excluidas durante la cirugía, observando que sólo en el 40% de los casos el procedimiento había sido efectivo (no flujo remanente y fondo de saco residual menor de 1cm). Casi el 80% de las orejuelas cerradas mediante sutura y el 100% de las ocluidas con dispositivos de sutura automática no estaban excluidas completamente. La técnica más eficaz fue la escisión quirúrgica, aunque en un 27% de los casos quedaba un remanente de orejuela mayor de 1cm de profundidad. En este estudio del grupo de Gillinov, a los 8 meses de seguimiento, presentaron accidente cerebrovascular el 11% de los pacientes con cierre efectivo de la orejuela y el 15% de los que tenían cierre incompleto, sin diferencias entre ambos grupos26. Sin embargo, recientemente, el estudio PROTECT-AF ha mostrado de forma prospectiva en pacientes no quirúrgicos que la oclusión de la orejuela izquierda tiene similar efectividad en la prevención de ACV que la anticoagulación27, con independencia del tipo de FA e inclusive para pacientes con más de un criterio CHADS2.
Otro aspecto que está cobrando importancia en los últimos años es el papel del sistema nervioso autónomo en la inducción/mantenimiento de la FA. El corazón recibe inervación tanto del sistema nervioso vegetativo simpático como del parasimpático28,29,30. Los nervios autonómicos alcanzan el corazón por la cara ventral y dorsal de los troncos supraaórticos y el cayado, aunque en el lado derecho predominan ventralmente. En la superficie del corazón existen múltiples ganglios nerviosos interconectados entre sí a través de una complicada red de nervios, localizándose principalmente en cara superior y posterior de la aurícula derecha, caras superior, posteromedial y posterolateral de la aurícula izquierda, raíz aórtica, origen de arterias coronarias y sus principales ramificaciones. El ligamento de Marshall es una estructura rica en fibras nerviosas que se localiza junto a la vena pulmonar superior izquierda, por encima de la orejuela31. Consta de tejido fibroso, pequeños vasos, fibras nerviosas autonómicas y fibras musculares que conectan con el seno coronario y la pared de la aurícula izquierda. La activación, tanto del sistema simpático como del parasimpático, produce una serie de cambios en la electrofisiología auricular que facilitan la inducción de FA. Durante la disección de las venas pulmonares se suele seccionar el ligamento de Marshall, y se diseca la grasa epicárdica, por lo que parte de la eficacia de la técnica podría venir derivada de la destrucción de tejido nervioso autónomo a dicho nivel. Existen grupos que están asociando a la ablación auricular la destrucción selectiva de los ganglios nerviosos próximos a las venas pulmonares, intentando aumentar la eficacia del procedimiento32–34.
Fuentes de energía alternativas a la incisión quirúrgicaEstán empleándose distintas fuentes de energía con las que reproducir las lesiones del maze con el objeto de conseguir el bloqueo eléctrico de una manera más rápida y más segura que con las incisiones35–44. Las más utilizadas han sido la radiofrecuencia (RF), las microondas y el frío, existiendo menos experiencia con el láser y los ultrasonidos. Khargui, et al.14, en la revisión retrospectiva encontraron similar efectividad de las actuales fuentes de energía comparada con la incisión quirúrgica.
Las fuentes de energía que actúan por calor buscan como objetivo alcanzar al menos 50 °C, que es la temperatura a partir de la cual se produce el daño celular y el bloqueo eléctrico irreversible. No deberán alcanzarse los 100 °C por el riesgo de producir perforación del tejido. Para producir el bloqueo eléctrico irreversible con el frío la temperatura deberá descender al menos hasta –50 °C durante 2min. Cualquiera que sea la fuente de energía utilizada, los aspectos más importantes son: la transmuralidad y continuidad de la lesión (bloqueo efectivo del impulso eléctrico), la posibilidad de aplicación epicárdica (sin CEC), efecto rápido y directo (sin necesidad de disecar la grasa epicárdica), sin riesgo de lesiones colaterales y que sea aplicable en cualquier región anatómica del corazón. Recientemente, se ha puesto en duda la necesidad de la transmuralidad como condición indispensable para el éxito de la técnica45. Existen discrepancias entre los resultados electrofisiológicos e histológicos tanto en fase aguda como crónica, de manera que la eficacia de la técnica podría estar más mediada por la modificación del sustrato eléctrico y anatómico, la denervación, la sección del ligamento de Marshall, etc., que por la transmuralidad de las lesiones.
La vía de aplicación endocárdica es más sencilla, y probablemente la eficacia sea similar con las distintas fuentes, como apuntan Khargui, et al.14. El corazón está parado y vacío, y la energía se aplica directamente. La vía epicárdica tiene dos limitaciones: la grasa epicárdica y la sangre. La grasa epicárdica actúa como aislante y separa la fuente de energía del epicardio, en especial la radiofrecuencia. Además, la aplicación de la energía con el corazón latiendo hace que la sangre que circula por el interior del corazón amortigüe su efecto, en especial la crioablación. Además, existen algunas lesiones que son complicadas de hacer desde el epicardio, como por ejemplo la conexión de las venas pulmonares con el anillo mitral, o la ablación del istmo cavotricuspídeo.
Un aspecto importante a considerar es el riesgo de lesiones colaterales con las distintas fuentes de energía. La principal lesión colateral en el corazón es la lesión de una arteria coronaria. Salvo los ultrasonidos, el resto de energías pueden producirla, aunque el conocimiento preoperatorio de la anatomía coronaria nos permite modificar el patrón de lesiones de manera que ninguna lesión pase sobre una arteria importante46. Otro aspecto importante es el daño a estructuras vecinas, siendo la más importante el esófago, que pasa a escasos milímetros de la pared posterior de la aurícula izquierda. Son pocos los casos publicados de perforación esofágica, pero su mortalidad es de al menos el 25%47. La clínica suele tardar varios días en aparecer tras un postoperatorio inicialmente normal. Suele consistir en un cuadro séptico, con odinofagia y dolor torácico y a veces ACV por embolia aérea. Aunque los casos publicados correspondían a ablaciones con radiofrecuencia monopolar, el resto de energías no están exentas del riesgo. Aupperle, et al., en un estudio experimental realizado en ovejas, compararon la afectación esofágica con RF monopolar, RF bipolar, crioablación, microondas y láser48. Con todas las fuentes de energía hubo mayor o menor grado de afectación esofágica, aunque las lesiones de mayor gravedad (destrucción de la capa muscular con necrosis de miocitos) aparecieron sobre todo en la RF monopolar endocárdica.
RadiofrecuenciaLa RF es una corriente alterna de unos 500 kHz establecida entre dos electrodos metálicos que produce necrosis por coagulación al calentar el tejido por encima de 50 °C como consecuencia de la agitación iónica inducida40. Los dos electrodos entre los que se establece la corriente son indiferentes, creándose la lesión térmica en los puntos donde se localiza la mayor densidad de corriente. Esto sucede en el tejido contiguo a los electrodos de pequeña área (<1cm2), también llamados activos. En la RF unipolar uno de los electrodos es el activo, de pequeño tamaño, que se sitúa sobre la zona que se quiere lesionar, y el otro electrodo, de grandes dimensiones, es el dispersivo o pasivo, y se sitúa gene-ralmente en la espalda del paciente. El daño directo no alcanza una profundidad mayor de 1–2mm (zona de mayor densidad de corriente), siendo el resto del daño consecuencia de la transmisión del calor al tejido adyacente. El grosor y composición de la pared auricular es muy variable, por lo que también lo serán sus propiedades eléctricas y, por lo tanto, la lesión inducida puede variar de un individuo a otro. La transmuralidad no está garantizada, sobre todo en la aplicación epicárdica, al actuar la sangre circulante como refrigerante, y existe el riesgo de inducir lesiones colaterales35,37–39. Los dispositivos irrigados disminuyen la impedancia y evitan el sobrecalentamiento del tejido contiguo al electrodo, consiguiendo mayor profundidad de la lesión con menos riesgo de lesiones a estructuras adyacentes. Los sistemas de RF bipolar funcionan a través de un sistema de pinza atraumática, donde los dos electrodos son del mismo tamaño y, por lo tanto, activos, liberando la energía entre las dos ramas del mismo, siendo el riesgo de lesiones asociadas mucho menor y estando la transmuralidad más garantizada40,41. Son más rápidos y permiten el abordaje epicárdico y sin CEC. Algunos dispositivos son capaces de monitorizar la transmuralidad de la lesión a través de la medición de la impedancia durante la ablación. Su principal problema es que no permiten hacer todas las lesiones, como por ejemplo la de istmo izquierdo, de manera que obliga a combinarlo con otro tipo de energía o a no hacerlas.
CrioablaciónLa crioablación induce la muerte celular a través del enfriamiento rápido del tejido mediante un catéter que libera freón, CO2, nitrógeno o argón comprimido. El agente es almacenado a muy alta presión, y al liberarse por el aplicador y disminuir la presión pasa a fase gaseosa, proceso fuertemente endotérmico que extrae calor del tejido contiguo44. La muerte celular sucede a –50–60 °C, con la ventaja de que se preserva mejor la arquitectura tisular que con los sistemas de calor. Es más lento que los sistemas de RF y es muy difícil producir lesiones transmurales con la aplicación epicárdica42. Como la lesión no es irreversible hasta –50 °C, permite comprobar el efecto electrofisiológico antes de crear una lesión definitiva. El desarrollo de sistemas tipo clamp posiblemente mejore su eficacia.
MicroondasLas microondas son radiaciones electromagnéticas de alta frecuencia (2,45GHz) que actúan a través del calentamiento consecuencia de la oscilación inducida en las moléculas de agua de los tejidos44. Crea lesiones más profundas que la RF, sin sobrecalentamiento, y es menos sensible a la posición del aplicador en comparación con la RF. Las lesiones son transmurales, sobre todo en la aplicación endocárdica, y la interferencia con la grasa en la aplicación epicárdica, aunque existe, es menor que con la RF43.
LáserEl láser produce las lesiones por el calentamiento consecuencia de la inducción de oscilación armónica en las moléculas de agua. La longitud de onda utilizada se sitúa en el espectro del infrarrojo, que penetra de mane-ra eficaz en el tejido cardíaco y produce ablación directa de hasta 4mm de profundidad44. En los estudios
iniciales parece que la interferencia con la grasa epicárdica es escasa. Aunque se trata de la energía más direccional, el daño esofágico es posible.
UltrasonidosLos ultrasonidos actúan a través del calentamiento consecuencia de la energía mecánica. Se aplican de manera que la energía se concentra en un pequeño espacio, produciendo lesiones transmurales desde el epicardio, sin interferir con la grasa, y en pocos segundos35,36,44.
Abordaje de mínima invasiónAlgunos sistemas permiten tratar la FA aislada a través de toracoscopia/minitoracotomía, sin CEC, aunque el tamaño, forma y flexibilidad de los dispositivos disponibles todavía limitan bastante su aplicación. En aquellos pacientes con FA asociada a cardiopatía estructural (fundamentalmente mitral) se está realizando también la ablación por métodos miniinvasores, combinando técnicas tipo port-access y robótica. Todavía no es fácil realizar un patrón de lesiones extenso con estas tecnologías, siendo sólo posible en la mayoría de los casos aislar las venas pulmonares y ligar la orejuela izquierda. La experiencia con estas técnicas todavía es escasa, pero no hay duda de que es un campo que crecerá de manera importante en los próximos años49–53.
Resultados de las técnicas alternativasExiste una gran cantidad de publicaciones en los últimos años sobre distintas alternativas al Maze clásico, aunque no demasiadas superan el centenar de pacientes y el año de seguimiento51–62, siendo excepcionales los estudios prospectivos y aleatorios. Además, existe una gran heterogeneidad no sólo en cuanto a la fuente de energía y parámetros utilizados, sino también en cuanto al patrón de lesiones realizado. Otra causa que hace difícil la comparación es que no han existido hasta hace poco criterios bien definidos y universalmente aceptados en cuanto a, por ejemplo, qué se considera fracaso de la técnica o simplemente cómo se define el ritmo del paciente. En la mayoría de los casos se hace con un electrocardiograma (ECG) aislado o incluso mediante contacto telefónico, cuando lo apropiado debería ser el Holter de 24h o incluso de 7 días, señalando la carga de FA. A pesar de esa enorme heterogeneidad, el porcentaje de pacientes en ritmo sinusal al año de seguimiento se sitúa en torno al 70–80%, siendo los principales factores de riesgo para el fracaso de la técnica el tamaño de la aurícula izquierda (>60mm), la duración de la FA y la etiología reumática51.
También empieza a estar claro que el analizar los datos durante los primeros 3–6 meses es poco significativo, pues es precisamente a partir de ese momento cuando el ritmo se estabiliza y la aurícula cicatriza. Los datos sobre el ritmo deberían acompañarse del análisis de la función biauricular, del porcentaje de pacientes que precisan fármacos antiarrítmicos y de algún método de análisis de la calidad de vida y capacidad funcional. En el capitulo previo en generalidades de la FA está recogido el actual consenso de expertos en ablación, quedando definidos todos aquellos aspectos necesarios para una correcta praxis63.
Khargi, et al. revisan los trabajos más importantes sobre tratamiento quirúrgico de la FA publicados desde 199514. Reúnen 48 estudios que incluyen 3.832 pacientes, 2.279 pertenecen al grupo de fuentes de energía alternativas (RF, microondas y crioablación) y 1.553 al grupo del Maze clásico. Ningún estudio era aleatorizado y no había grupos control. En el seguimiento el 85% de los pacientes con Maze clásico y el 78% de los pacientes tratados con técnicas alternativas estaban en ritmo sinusal. Los pacientes en los que se realizó Maze clásico eran pacientes más jóvenes, y con mayor frecuencia presentaban FA paroxística (23 vs 8%) o aislada (19 vs 1,6%). Una vez corregidas estas variables no había diferencias significativas entre ambas técnicas, Maze clásico frente a ablación quirúrgica. Tampoco había diferencias en cuanto a mortalidad hospitalaria (4,2 vs 2,1%) ni morbilidad. El grupo del Barnes-Jewish Hospital, donde Cox realizó la primera intervención del Maze, ha estudiado su experiencia desde 1992 comparando la técnica clásica con la ablación biauricular con RF bipolar64. Sobre 242 pacientes, utilizando análisis mediante score de propensión, obtienen 58 pacientes de cada técnica ajustados para siete variables: edad, sexo, función ventricular, New York Heart Association (NYHA), tipo de FA y tipo de cirugía (FA aislada, coronaria, valvular). No hubo diferencias en la morbimortalidad ni en la incidencia de ritmo sinusal al año de seguimiento.
Impacto clínico de la ablación quirúrgica de la fibrilación auricularDistintos estudios han demostrado el peor pronóstico a largo plazo de los pacientes sometidos a cirugía cardíaca en FA frente a los pacientes en RS. Los pacientes en FA tienen menor supervivencia y mayor incidencia de ACV y de eventos cardíacos tardíos65–68. Aunque un paciente en FA se mantenga correctamente anticoagulado, la incidencia de ACV es del 2–5%/año.
Teóricamente, el restablecimiento del ritmo sinusal tras la cirugía permitiría la recuperación del latido auricular, produciendo así la mejora del gasto cardíaco y la eliminación de la estasis sanguínea, teniendo como consecuencias a largo plazo mejor calidad de vida, mayor supervivencia y menor incidencia de ACV y de eventos cardíacos. Al revisar la evidencia científica disponible, encontramos que la mayoría de la información se deriva fundamentalmente de estudios observacionales y de una sola institución69–84. Está claro que los pacientes a los que se realiza cirugía de la FA tienen mayor incidencia de ritmo sinusal en el seguimiento y menor incidencia de ACV, pero no existe información concluyente relativa al impacto de esta cirugía en la supervivencia. Bando, et al. analizan 812 pacientes consecutivos sometidos a cirugía mitral con prótesis mecánica demostrando que el principal factor de riesgo para ACV en el seguimiento medio a 5 años no es la prótesis sino la FA, es decir, la no realización del Maze, con un 9% de ACV en el grupo en ritmo sinusal frente al 26% en el grupo en FA85. Este mismo grupo, sobre una serie de más de 1.000 pacientes procedentes de tres hospitales distintos con cirugía reparadora mitral, comprueban que los pacientes que en el seguimiento continuaban en FA presentaron mayor incidencia de ACV, mayor mortalidad cardiovascular y menor supervivencia69. Los pacientes con FA preoperatoria a los que se asoció el Maze presentaron menor incidencia de ACV, mayor disminución del tamaño de la aurícula izquierda, menor diámetro telesistólico de ventrículo izquierdo (VI) y menor mortalidad cardiovascular a los 8 años, aunque esta última no alcanzó significación estadística. Cuando se analizan los pacientes en función del éxito de la ablación se observa que aquellos en los que el Maze fue efectivo (ritmo sinusal a los 3 meses de la cirugía) la supervivencia es mayor y la incidencia de ACV y mortalidad cardíaca son menores en el seguimiento a largo plazo86.
Reston, et al.87 realizan un metaanálisis que incluye cuatro estudios aleatorizados (152 pacientes) y seis retrospectivos controlados (905 pacientes), comparando cirugía mitral con cirugía mitral asociada a ablación de FA (Maze clásico o variantes). Por el sesgo potencial de los estudios retrospectivos, tanto la mortalidad como la incidencia de ACV y de FA se analizaron utilizando sólo los estudios aleatorizados. No hubo diferencias en la mortalidad en el seguimiento, presentando el grupo de ablación mayor incidencia de ritmo sinusal (80,7 vs 17,3%), menor incidencia de ACV (0 vs 5,8%) y mayor necesidad de marcapasos (3,9 vs 1,5%). No está bien definido si la mayor necesidad de marcapasos es consecuencia de una mayor incidencia de enfermedad del tejido de conducción o es causada por la propia técnica de ablación.
En el metaanálisis de Barnett y Ad, basado en 69 estudios con diferentes energías, 25% de ellos prospectivos, con 5.885 pacientes (3.841 ablación y 2.044 control), comprueban, curiosamente, que la supervivencia a los 3 años es significativamente mayor en el grupo control, 92,5% ablación y 95,1% control13. Y el metaanálisis de Wong y Mak, basado en siete estudios controlados-macheados y cuatro aleatorizados, con 1.499 pacientes (829 Maze vs 670 control), no encuentran diferencias respecto a la incidencia de ACV, marcapasos y supervivencia88.