La cirugía endovascular se impone en el tratamiento de un número sustancial de casos de enfermedad de aorta descendente. No obstante, la afectación del arco aórtico ha supuesto una frontera natural de este tratamiento hasta el reciente desarrollo de la llamada «cirugía híbrida», en la que, además de tratar el cayado con endoprótesis, se asocian derivaciones quirúrgicas de troncos supraaórticos. Potencialmente, este tipo de abordajes evitaría intervenciones más agresivas en una población cada vez más añosa, ofreciendo una alternativa a la circulación extracorpórea y la parada circulatoria.
La presente revisión propone un abordaje sistemático de la enfermedad del cayado aórtico, dividiendo éste en «zonas de anclaje proximal». Se describen las distintas estrategias y los resultados iniciales de esta aún joven modalidad terapéutica.
Thoracic endovascular aneurysm repair (TEVAR) has evolved in the past years to be considered the first line treatment for most diseases of the descending thoracic aorta. When the aortic arch is involved, open surgery with circulatory arrest and antegrade cerebral perfusion is still considered the “gold standard”. However alternative approaches to the treatment of the aortic arch have been developed in recent years, aiming at offering a relatively less aggressive option to an ever ageing patient population.
In this review, a systematic approach to the socalled “hybrid” treatment of the aortic arch, dividing it according to “proximal landing zones” is presented. The different strategies and initial results are described for this still young treatment option.
Entendemos por enfermedad del cayado aórtico las alteraciones de la aorta que afectan de forma total o parcial a la salida de los troncos supraaórticos. Dentro de las posibles etiologías, discutiremos las referentes a la Tabla I. El tratamiento quirúrgico de estas enfermedades ha supuesto históricamente un verdadero reto, siendo las primeras intervenciones, descritas hacia 1955 por DeBakey, de connotaciones ciertamente épicas1.
Situaciones frecuentes con afectación del arco aórtico
|
El desarrollo de la circulación extracorpórea (CEC), la hipotermia profunda y la parada circulatoria (HPPC) hizo posible el abordaje de dichas enfermedades, alcanzándose niveles de mortalidad aceptables en grupos mundiales más modestos2. Sin embargo, las secuelas neurológicas en forma de disfunción transitoria o accidente cerebrovascular siguen siendo relativamente frecuentes, con incidencias que rondan hasta el 30%, incluso en centros de alto volumen. Las alteraciones neurológicas se correlacionan de forma directa con la duración de la parada y la edad de los pacientes3.
De esta forma, se han desarrollado métodos de protección cerebral, imponiéndose últimamente la perfusión cerebral anterógrada durante el tiempo de parada como método más seguro para llevar a cabo estas intervenciones4. Pese a que estas y otras medidas han reducido significativamente la morbimortalidad, existen todavía tasas de accidente cerebrovascular, insuficiencia renal, paraplejía y muerte prohibitivas en centros de bajo volumen, especialmente en pacientes ancianos.
En 1994, Dake, et al. publicaron la primera serie de tratamiento endovascular de disecciones tipo B5. Los resultados iniciales fueron el detonante de un extraordinario interés por el desarrollo de la cirugía endovascular de la enfermedad de la aorta torácica. La afectación del cayado aórtico supuso la frontera anatómica para la incursión de las endoprótesis en aorta ascendente y transversa. La progresiva utilización de estos dispositivos en enfermedades cada vez más complejas ha llevado en los últimos años al empleo de endoprótesis fuera de límites.
Entendemos por cirugía híbrida cualquier tipo de intervención que requiera una cirugía abierta con la realización de derivaciones de troncos supraaórticos o bien intervenciones «clásicas» de cayado aórtico que asocian además la utilización de endoprótesis montadas en nitinol o acero inoxidable. Existen procedimientos híbridos «menores» (v. g. derivación carotidosubclavia) y otros «mayores» (transposición completa de troncos supraaórticos)6, así como otros que podrían llamarse intermedios. No discutiremos en esta revisión la llamada frozen elephant trunk7, ni los procedimientos híbridos a nivel toracoabdominal8.
Para desarrollar los distintos escenarios ante los cuales podemos encontrarnos seguiremos una clasificación anatómica introducida por Zipfel, donde se identifican las zonas de anclaje proximal de la endoprótesis9 (Fig. 1).
Zona 4Los procesos que afectan a la aorta descendente de forma aislada y a distancia del origen de la arteria subclavia izquierda (ASI) rara vez requieren la oclusión de ésta a la hora de su reparación endovascular. Sin embargo, sí es posible que la tortuosidad de la lesión aconseje emplear al menos un free-flow que permita una mayor fijación incluso a través del ostium de la ASI.
Zona 3Al igual que en la zona 4, normalmente no se plantea ocluir la ASI. Sin embargo, hoy sabemos que la causa más frecuente de endofuga proximal y de colapso pro-tésico10,11 son la mala aposición de la endoprótesis en el cayado aórtico, siendo frecuentes los llamados «picos de flauta» (Fig. 2). Para evitar esta situación recomendamos desplegar al máximo el cayado aórtico, realizando proyecciones en oblicua anteroizquierda de 30–60° (Fig. 3), así como acudir a las reconstrucciones tridimensionales de volume rendering de la angiografía - tomografía computarizada (angio-TC) para planificar el caso adecuadamente. En caso de que se sospeche dicha eventualidad, debe considerarse ocluir la ASI con o sin revascularización.
Zona 2Cuando nuestra zona de anclaje proximal se sitúa entre carótida izquierda y ASI, se plantea la disyuntiva de revascularizar o no. La ASI es el origen de la arteria vertebral izquierda, emergiendo de ésta la rama izquierda de la arteria espinal anterior. Por este motivo, la oclusión de la ASI se ha asociado a accidentes cerebrovasculares en territorio posterior así como a paraplejía.
La experiencia de la mayoría de los implantadores hace pensar que es relativamente seguro ocluir con impunidad este ostium en la mayoría de los casos12. Sin embargo, el análisis de grandes series13 refiere una incidencia de isquemia cerebral izquierda del 11 frente al 5% en pacientes previamente revascularizados, y una incidencia de isquemia del brazo (si bien ésta es relativamente benigna) del 25% en los no revascularizados. Aunque la isquemia franca del miembro superior izquierdo es relativamente rara, la claudicación no lo es tanto, siendo frecuente especialmente en personas jóvenes con actividad física más o menos intensa. Esta situación es frecuente en la eventualidad de transección traumática de la aorta, con frecuencia tratada de forma endovascular de urgencia sin revascularizar y en personas jóvenes14. Dicha claudicación puede mejorar, pero a veces lo hace a costa de convertir en sintomático el robo vertebrobasilar (que, de todas formas, ocurre hemodinámicamente en todos los casos). La tabla II recuerda las indicaciones más frecuentes de revascularización preoperatoria de la ASI.
Indicaciones absolutas y relativas de revascularización de arteria subclavia izquierda
|
En situaciones de urgencia como disección tipo B aguda o transección de aorta, consideramos justificado ocluir sin más la ASI si es necesario para un correcto sellado. En estas situaciones podemos permitirnos «esperar y ver», realizando una derivación carotidosubclavia si es necesario en un segundo tiempo (claudicación del miembro, síndrome vertebrobasilar…).
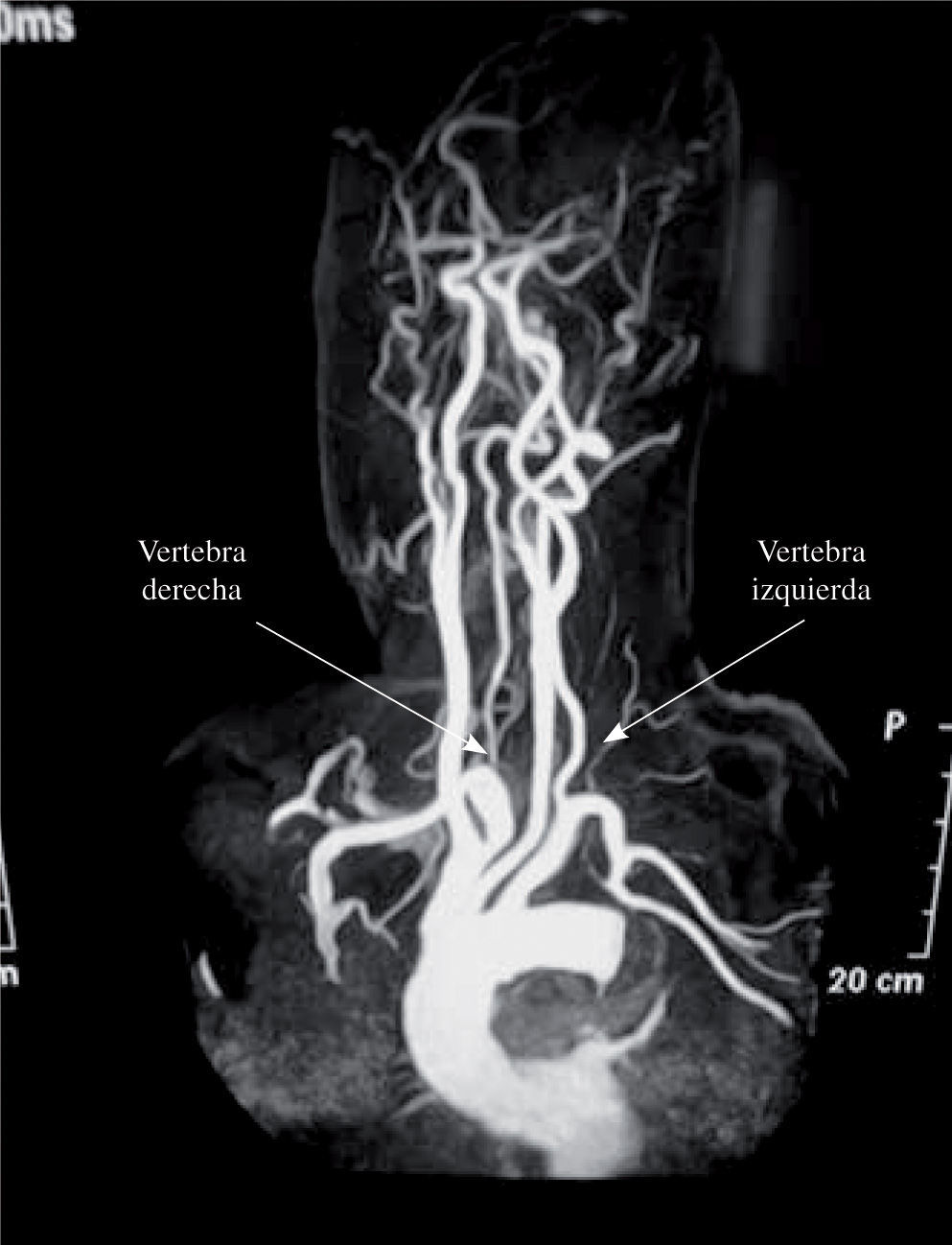
En los casos electivos creemos necesaria al menos la realización de rutina de un estudio completo (angio-TC o angiorresonancia magnética [angio-RM]) de troncos supraaórticos y polígono de Willis. Con relativa frecuencia podemos encontrar una oclusión de la vertebral derecha o más a menudo un hipodesarrollo con respecto a la izquierda, lo que debe inclinar la balanza hacia la revascularización preendoprótesis (Fig. 4).
En estas situaciones recomendamos la realización de una transposición carotidosubclavia o derivación carotidosubclavia con prótesis anillada15 (Figs. 5 y 6). Como detalles técnicos recomendamos la monitorización ence-falográfica o al menos con oximetría hemisférica durante la oclusión carotídea, empleando una derivación interna, si es necesario, para construir la anastomosis.
La oclusión proximal de ASI para evitar una endofuga tipo 2 merece un comentario adicional. En casos en los que el sellado sea amplio, con un diámetro al nivel del ostium relativamente pequeño, consideramos que es seguro realizar la derivación y posteriormente implantar la endoprótesis (en nuestro medio, por motivos logísticos, en un segundo tiempo) sin más. En caso de encontrar una fuga en la TC de control se corregirá por vía endovascular, con la implantación de coils o dispositivos tipo Amplatz. La ligadura quirúrgica al tiempo de la realización de derivación carotidosubclavia puede en ocasiones ser técnicamente complicada, ante la necesidad de aproximarse a su mismo origen, evitando lógicamente la salida de la mamaria interna y la vertebral. Además, el origen es próximo a la desembocadura del conducto linfático torácico, por lo que debemos extremar la cautela en la disección de la zona. No obstante, si se considera necesario, puede realizarse con ligadura simple o bien realizando una transposición carotidosubclavia (intervención también más demandante que la derivación con prótesis).
Zona 1Cuando el anclaje proximal se sitúa entre carótida izquierda y tronco braquiocefálico, es necesario revascularizar la carótida izquierda. Para esto podemos realizar una derivación carotidocarotídea con prótesis anillada de 8–10mm. La disposición óptima de la misma es también motivo de controversia, recomendando algunos autores la implantación retroesofágica. De esta manera, se evita la alteración estética y no se proscribe la posibilidad de realizar una traqueostomía, si fuera necesaria en el futuro, realizando además una derivación más corta.
Otra alternativa, algo más agresiva pero quizás más adecuada especialmente en pacientes jóvenes, es la recomendada por Czerny16. Tras la realización de una mi-niesternotomía superior en «T» o en «J», ampliando la incisión por el borde del esternocleidomastoideo izquierdo, puede disecarse adecuadamente la salida de los troncos supraaórticos. Hecho esto, se recomienda la anastomosis terminolateral de carótida izquierda a tronco braquioce-fálico, y posteriormente de ASI a carótida izquierda (si se estima necesaria su preservación). Esta técnica permite evitar el empleo de material protésico, y permite flujo cerebral más directo.
Zona 0Existen casos en los cuales el cayado está afecto en toda su extensión, respetándose el diámetro de aorta ascendente y descendente (Fig. 7). En estos casos proponemos la realización de una transposición completa de troncos supraaórticos, siempre y cuando las comor-bilidades del paciente desaconsejen una sustitución del arco con HPPC.
Existen varias alternativas, como emplear una prótesis vascular bifurcada invertida de 14×7mm, realizando anastomosis proximal en el origen de la aorta ascendente, y distal en terminoterminal al tronco braquiocefálico y a la carótida izquierda, interponiendo otra tercera rama a ASI si el acceso es adecuado. El empleo de este tipo de prótesis supone disponer de una gran longitud de aorta ascendente sana, ya que la anastomosis proximal puede alcanzar los 20mm al biselar el injerto. Por otro lado, sería necesario construir otra rama lateral proximal de 10mm si se plantea la liberación anterógrada de la endoprótesis. Otra alternativa es emplear una prótesis vascular de 10mm para conectar aorta ascendente y tronco braquiocefálico en terminoterminal, realizando la anastomosis a ascendente en laterolateral, de manera que disponemos de una prolongación del injerto a través de la cual poder implantar la endoprótesis en sentido anterógrado. A su vez, de él pueden extraerse una o dos prótesis vasculares de 8–10mm para revascularizar la carótida izquierda y la ASI (Fig. 8).
Para liberar la prótesis en sentido anterógrado o retrógrado (si el acceso femoral es bueno y no existe enfermedad aórtica abdominal) se recomienda marcar la anastomosis a aorta ascendente con algún tipo de material radiopaco, como un alambre de sutura esternal, un electrodo de marcapasos o, de forma «artesanal», el hilo plomado que incorporan las compresas quirúrgicas marcadas. Si la revascularización ASI se considera necesaria y no es posible técnicamente acceder a su origen (al encontrarse en la cara posterior del cayado), se puede realizar una tunelización extratorácica hasta la arteria en su posición infraclavicular.
DiscusiónLas primeras series de casos híbridos han sido publicadas en los últimos años17–19. Los resultados iniciales son, por lo general, superiores a los obtenidos en los procedimientos híbridos a nivel toracoabdominal20, ofreciendo una alternativa válida a la sustitución de arco convencional. No obstante, los resultados publicados en centros de alto volumen en los que se realiza el tratamiento abierto del cayado, normalmente con perfusión cerebral anterógrada y empleando distintas estrategias21, demuestran que este tipo de intervenciones puede realizarse con una morbimortalidad asociada baja (mortalidad <5%, accidente cerebrovascular <5%), además de proporcionar una solución «definitiva», con bajas tasas de complicaciones a largo plazo.
El tratamiento híbrido se enfrenta a nuevas posibles complicaciones, además de tratarse de una cirugía mayor. Han sido descritas diversas complicaciones a medio plazo, como el colapso agudo de la endoprótesis con muerte súbita22, así como intervenciones de rescate realizadas en el mismo acto quirúrgico ante la imposibilidad de conseguir un correcto sellado a nivel del arco23. En estos casos se ha descrito la conversión a HPPC, terminando el procedimiento como trompa de elefante modificada.
Además, hay que recordar que no se conoce la evolución a largo plazo de estas nuevas alternativas de tratamiento, pero es previsible que tengan mayor tasa de reintervenciones que los procedimientos «estándar». Por estos motivos, y especialmente en los casos de zona 0, se aconseja una cuidadosa selección de los pacientes, reservándola a aquellos de mayor edad o que presenten comorbilidades importantes.
Por otro lado, la dilatación de la raíz aórtica y aorta ascendente, así como la afectación de la aorta descendente son la regla, más que la excepción, en pacientes con enfermedad del arco aórtico. Ante estos casos se hacen necesarias intervenciones quirúrgicas con CEC abiertas con trompa de elefante que pueden terminarse o no con una endoprótesis a nivel de aorta descendente a la hora de realizar el segundo tiempo.
La mayoría de las endoprótesis disponibles tienen unos diámetros máximos de 45–46mm. Este hecho limita también el tratamiento a aorta ascendente y descendente de no más de 44mm de diámetro, siendo un ajuste insuficiente responsable de la mayoría de complicaciones descritas previamente. Las marcas comerciales disponibles en España (a excepción de E-vita Open Plus® [Jotec, Hechingen, Alemania] para la realización de «trompas de elefante congeladas») están diseñadas para su implantación retrógrada a través de vasos ilíacos o femorales. Por este motivo, por lo general, creemos conveniente la liberación estándar cuando el acceso o la enfermedad de aorta toracoabdominal concomitante lo permita.
Cuando la liberación se realiza de forma anterógrada, debemos recordar que ésta se realiza de diafragma a cayado, y no al revés, como estamos acostumbrados. Así, la segunda endoprótesis (raramente se consigue una exclusión completa del cayado con una sola) queda telescopada dentro de la primera, que debe ser de menor tamaño para evitar fugas.
En casos de enfermedad toracoabdominal concomitante que requiera también un procedimiento híbrido a nivel visceral, se están desarrollando estrategias para conseguir flujo visceral anterógrado, directamente desde aorta ascendente a través del diafragma, a la vez que se realiza la transposición a nivel supraaórtico24. También se está trabajando experimentalmente para implantar la endoprótesis en el arco y seguidamente fenestrarla, implantando stents recubiertos desde los troncos supraaór-ticos hacia la aorta25.
Por último, la experiencia acumulada en la implantación de válvulas aórticas por vía transapical está abriendo camino a la posibilidad de tratar casos seleccionados de disección tipo A, a través del ápex del ventrículo izquierdo con corazón latiendo26.
ConclusionesLa cirugía endovascular de la aorta torácica descendente se ha impuesto como tratamiento de primera línea. La afectación del arco debe hacernos plantear la estrategia cuidadosamente, especialmente en los casos más frecuentes de oclusión de ASI. El tratamiento abierto con perfusión cerebral anterógrada y HPPC sigue siendo el patrón oro del tratamiento del cayado aórtico, si bien los tratamientos híbridos suponen una alternativa a priori con menos complicaciones perioperatorias en pacientes de alto riesgo, ya que evitamos la CEC. Creemos que la planificación preoperatoria es el punto clave para llevar con éxito la intervención, siendo la parte técnica relativamente accesible, incluso para centros de bajo volumen. El tratamiento «a medida» con endoprótesis fenestrada en el arco está en desarrollo, de forma que es posible que en el futuro veamos soluciones con abordajes completamente endovasculares.
Por otro lado, y tras la experiencia acumulada en implantación de prótesis valvulares aórticas por vía transapical, no es descabellado plantear un tratamiento endovascular transapical en casos seleccionados de disección aórtica tipo A.
En conclusión, presentamos nuevas alternativas a antiguos retos quirúrgicos, con resultados iniciales prometedores, pero con unos resultados a largo plazo aún por definir.