El aneurisma de la aorta abdominal presenta una incidencia elevada en la población mayor de 60 años, y supone una importante causa de mortalidad. Los nuevos tratamientos endovasculares han permitido disminuir dicha mortalidad, además de tratar a mayor número de pacientes. Los resultados de la técnica endovascular (EVAR), tanto a nivel infrarrenal como suprarrenal, presenta menor morbimortalidad inicial con respecto a la cirugía abierta clásica (OR), sin embargo, las cifras se igualan a medio plazo, precisando la primera de un mayor seguimiento. Hacen falta más estudios rigurosos para determinar cuál de ambas técnicas es más coste/eficiente.
Abdominal aorta aneurysms present a high incidence in elderly population and are an important cause of morbi-mortality. The new endovascular aproach (EVAR) has allowed to treat an increasing number of patients, some of them not candidates for conventional surgery. Althouhg initial mortality with EVAR, in supra or infrarenal position, has been reduced, mid-term results are similar with both techniques. Larger and better registries are needed to determine the most cost/effective technique.
Los aneurismas de la aorta abdominal siguen siendo hoy en día una enfermedad con una considerable prevalencia (entre el 4 y el 8% de los varones de más de 50 años en nuestro medio)1, que ocasiona una importante mortalidad en caso de rotura, a pesar de haberse visto reducida en los últimos 20 años. Esta reducción ha sido posible gracias tanto a la mejora en los diagnósticos precoces como a la continua evolución de los tratamientos, sobre todo endovasculares, que ha permitido tratar a cada vez más pacientes, antes inoperables, sin llegar a la temida rotura.
A continuación se presenta una revisión del abordaje actual del problema, así como una breve descripción de los últimos dispositivos incorporados al arsenal terapéutico de la enfermedad aneurismática aórtica.
Abordaje del paciente con aneurisma de la aorta abdominalIndicaciones de tratamientoUna vez diagnosticado un paciente con aneurisma de la aorta abdominal (AAA) se debe determinar si tiene indicación quirúrgica o se debe proceder a una vigilancia estrecha. En su gran mayoría los pacientes van a ser asintomáticos. En ellos las indicaciones actuales son:
- -
Diámetro medido en TAC o RMN de 5,0cm o más. En España se sigue considerando este tamaño pese al progresivo aumento de la media de altura y peso de la población. No obstante, en los pacientes de pequeño tamaño o superficie corporal, como por ejemplo en algunas mujeres, se puede plantear la intervención programada con tamaños menores, aunque no deja de ser una recomendación en las guías clínicas2. Como es bien sabido, en la literatura anglosajona y en sus guías clínicas más importantes, el límite es de 5,5cm.
- -
En caso de que la morfología del aneurisma sea sacular y no fusiforme, se debería intervenir al paciente con menor diámetro, dado su mayor riesgo de rotura.
- -
En caso de detectar un crecimiento rápido de al menos 0,5cm en 6 meses o 1cm en un año en un AAA pequeño respecto del anterior control de imagen, estaría indicado su tratamiento pese a que no llegue a 5cm. De la misma manera, en pacientes con aneurismas entre 4 y 5cm que vayan a ser sometidos a quimioterapia, radioterapia o trasplante de algún órgano sólido, es recomendable plantearse su abordaje (nivel de recomendación 2 y evidencia B).
- -
En los estudios y ensayos clínicos realizados en pacientes con AAA de pequeño tamaño, entre 4 y 5cm, no se ha demostrado beneficio de la intervención temprana en comparación con la vigilancia3.
En el caso de pacientes con aneurisma que presenten dolor que no pueda ser atribuible a otra enfermedad deberán ser intervenidos de forma preferente o con la máxima prontitud. En caso de datos clínicos de rotura o indicios radiológicos de la misma, deberá procederse a intervención urgente.
Seguimiento y control del paciente durante el periodo de vigilanciaNumerosos trabajos han demostrado que dejar el hábito tabáquico es el factor preventivo de rotura y crecimiento del aneurisma más importante y el único con un nivel de recomendación 2B4.
El control de los factores de riesgo cardiovascular es importante en tanto que mantiene al paciente en buena situación para ser intervenido, pero no se ha demostrado de forma independiente que reduzca el riesgo de rotura o expansión. Es el caso de estatinas o de betabloqueantes. En el caso de los antihipertensivos, concretamente de los inhibidores de la ECA, se ha comprobado que su interrupción sí que redunda en un incremento del riesgo de rotura5.
El ejercicio físico moderado no precipita la rotura ni favorece el aumento del diámetro, aunque el ejercicio isométrico de alta intensidad (p, ej., levantamiento de pesas), sí que está relacionado con mayor riesgo6.
En cuanto a la prueba de imagen, desaconsejable seguimiento con ecografía-doppler aorto-ilíaca hasta un tamaño de 4 o 4,5cm, pasando posteriormente a controles de TAC.
Decisión de cuándo intervenirLos pacientes con un aneurisma conocido que presenten datos clínicos que sugieran rotura deben someterse a TAC urgente o bien ser intervenidos de inmediato si la inestabilidad es crítica. En caso de que se trate de un aneurisma sintomático, pero no roto, es recomendable dar tiempo a disponer de las pruebas y condiciones necesarias y más favorables para su intervención (anestesia, equipo quirúrgico, radiológico, reserva de sangre y hemoderivados), pero sin por ello retrasarlo más de unas horas.
Lo más habitual es que nos encontremos ante un paciente con un aneurisma de más de 5cm y asintomático. Entre 5 y 7cm de diámetro el riesgo de rotura anual se establece en un 10%, mientras que, de superar los 7cm, es de más de un 33%, incrementándose de forma lineal7. Por ello, la recomendación es no diferir mucho el momento de la intervención, pero demostrar al paciente y a su familia dar el tiempo necesario para realizar todas las pruebas preoperatorias necesarias, así como optimizar al máximo la condición médica del paciente. Un ejemplo claro sería el estudio cardiológico en caso de historia previa o actual de tabaquismo.
Predicción de riesgo operatorio y expectativa de vidaVarios estudios realizados en los últimos 20 años han permitido desarrollar modelos de predicción de riesgo ante un AAA8,9, sobre todo desde la introducción del tratamiento endovascular (EVAR: EndoVascular Aortic Repair).
Los factores de riesgo y comorbilidades que han demostrado ser predictivos de mortalidad perioperatoria tanto para EVAR como para cirugía abierta (OR: Open Repair) son: edad, insuficiencia renal, insuficiencia cardiaca avanzada, sexo femenino y tener antecedente de enfermedad vascular periférica o cerebral. En alguno de estos modelos se otorga una puntuación en función de la presencia o no de estos factores o de su grado de manifestación (fig. 1). La puntuación total alcanzada supone una probabilidad de mortalidad, riesgo bajo, medio alto o prohibitivo, por encima del 30%.
Tabla extraída de Chaikof et al.29.
En el ensayo EVAR 2, los pacientes con aneurismas de 65mm de diámetro máximo, añosos y de alto riesgo intervenidos con EVAR tenían una supervivencia a 5 años del 46%, mientras que en los de mayor tamaño fue del 28%, por otro lado, en otro estudio con la misma población la supervivencia a 2 años de los pacientes que rechazaron la intervención fue del 35%, es decir, que no hay una significación estadística en el beneficio de tratar mediante EVAR a estos pacientes10.
Tratamiento endovascular de los aneurismas de la aorta abdominalDesde el primer implante, hace más de 30 años, la expansión de la endoprótesis ha sido imparable, y ya hay datos que afirman que han disminuido las muertes por aneurisma, tanto electivo como roto, al menos en EE. UU., donde han sido publicados11.
Parte de este éxito se ha debido a la continua mejora en los materiales y el desarrollo de nuevos dispositivos que han permitido implantes eficaces, seguros y duraderos. Un avance muy importante ha sido la utilización de introductores de más bajo perfil, lo que ha permitido el acceso percutáneo en muchos casos, aunque a expensas de disminuir la fuerza radial de los stents. Pese a lo que pudiera pensarse, no se han demostrado mayores tasas de fugas o de migraciones. Ya hay estudios randomizados que comparan ambos abordajes que muestran similar seguridad y efectividad12.
El tipo de fijación, como se verá con posterioridad, puede ser infra o suprarrenal, con un stent libre de tela por encima del plano renal. Los defensores de la fijación suprarrenal defienden que se pueden abordar cuellos cortos, con mala calidad (trombo mural o calcificación) angulación importante o forma cónica invertida, todo ello sin deterioro de la función renal, como Miller demuestra en un metaanálisis13. No obstante, las recomendaciones de cuello de al menos 15mm de longitud, libre de calcio y trombo, de menos de 32mm de diámetro y con angulación menor de 60°, siguen estando en todas las instrucciones para el empleo (IFU: Instruction For Use) de todos los fabricantes.
En los casos en que los aneurismas afectan a una o ambas ilíacas comunes, puede ser necesario sellar la prótesis en ilíaca externa, y para evitar la endofuga tipo II por reflujo de la ilíaca interna o hipogástrica, embolizarla bien con tapones (plugs) endovasculares o con coils. La recomendación más aceptada (1A)14 es intentar salvar al menos una de ellas, si es preciso empleando prótesis de diámetro grande para la ilíaca común o bien utilizando prótesis con rama para la hipogástrica (Iliac Branch). De esta forma, minimizamos los riesgos más importantes asociados a la oclusión bilateral de las hipogástricas, como la claudicación glútea persistente (16-80%, según las series), disfunción eréctil (9%),o complicaciones más graves como la colitis isquémica o la isquemia medular. La claudicación tras embolización unilateral es frecuente, más del 40%, pero tiende a remitir con el tiempo y el ejercicio. Otro detalle que puede ayudar a reducir los efectos adversos es limitarse a ocluir el tronco principal del vaso, evitando dañar las ramas principales como la arteria pudenda o la glútea, de esta forma se favorece el desarrollo de colaterales con mayor prontitud.
Otro aspecto a tener en cuenta cuando se plantea un tratamiento endovascular de un aneurisma infrarrenal es qué hacer con la enfermedad vascular concomitante, sobre todo de vasos intraabdominales, ya que es frecuente la presencia de estenosis renal significativa entre el 20 y el 40%, 15% en el tronco celíaco o en el 20-30% en la arteria mesentérica superior15. Con un nivel de evidencia bajo, se recomienda realizar angioplastia y stent de la mesentérica superior en casos de estenosis de alto grado cuando se va a sacrificar la arteria mesentérica inferior durante el tratamiento endovascular del aneurisma. Del mismo modo, en casos de arteria renal accesoria de calibre mayor de 3mm o que supongan la vascularización de un tercio de un riñón, se debe plantear su preservación, incluso si ello conlleva realizar cirugía abierta16. Las lesiones concomitantes de arterias ilíacas o femorales suelen requerir tratamiento simultáneo para facilitar el éxito del EVAR.
Mortalidad intrahospitalaria y a 30 díasYa desde los primeros registros prospectivos y randomizados que comparan EVAR con cirugía abierta (OR: Open repair) como EVAR 1, Dutch Randomized Endovascular Aneurysm Management (DREAM), US Veterans Affairs Open versus Endovascular Repair (OVER) o European Registry Of Stent graft Techniques for Aneurysm Repair (EUROSTAR)17 se ha demostrado un beneficio significativo para EVAR en cuanto a mortalidad, 1,4 vs. 4,2% en OR. En recientes metaanálisis, la tendencia se mantiene (1,6 vs. 5,2%). El volumen mínimo anual por centro para alcanzar estas cifras es de 8-10 casos, al igual que influye la experiencia de cada cirujano.
Morbilidad perioperatoriaTanto la pérdida de sangre como las complicaciones mayores como neumonía, insuficiencia renal o isquemia intestinal son bajas con EVAR. La media de ingreso fue de 2 días (7 en OR) y la tasa de reconversión a cirugía abierta disminuyó del 2,2% en 2001 al 0,3%, actualmente. No obstante, como es bien conocido, existen una serie de complicaciones características de esta técnica:
- -
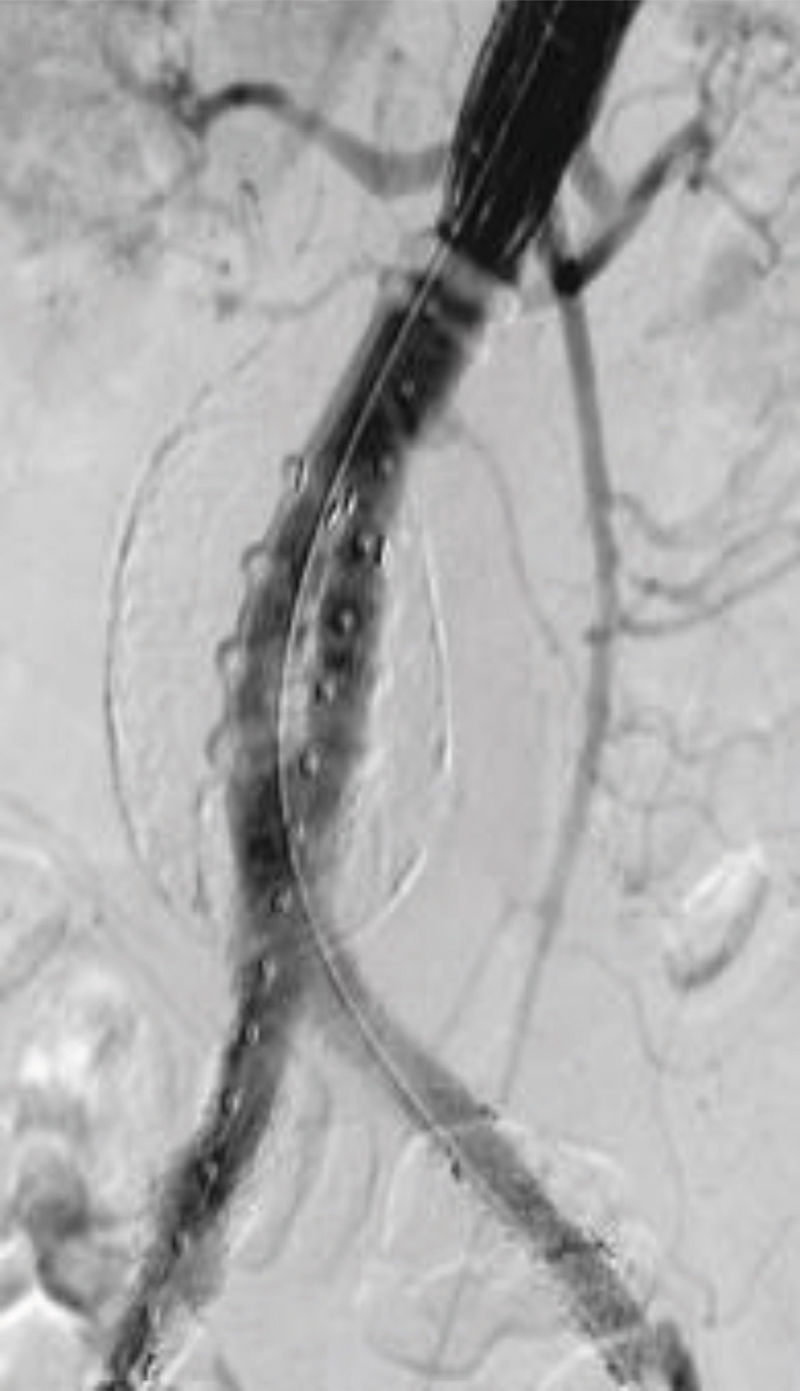
Endofuga: Un 6% de casos pueden quedar con una endofuga tipo IA en el momento del implante, debido a mala calidad del cuello o bien a mala selección del diámetro de la prótesis. Un porcentaje grande de estos casos quedan resueltas con medidas como la sobredilatación con balón, extensión con Cuff proximal o simplemente con la reversión del efecto de la heparina. Los casos de nueva aparición pueden necesitar otras medidas como endoprótesis fenestradas, chimeneas (CHEVAR: Chimney EndoVascular Aortic Repair), o el empleo de coils o sellantes percutáneos. No hay datos que demuestren la superioridad de una de estas técnicas sobre las demás. Las endofugas IB (fig. 2), al igual que las de tipo III, se reparan con cierta facilidad con dilatación con balón o extensión protésica, pudiendo necesitar embolizar la arteria hipogástrica en las primeras. Hasta en un 20% de casos podemos tener una endofuga II persistente en el control al mes del implante, no siendo necesario su tratamiento salvo que con el tiempo se compruebe un crecimiento significativo del saco18.
- -
Complicaciones del acceso quirúrgico: Se ha reportado recientemente un estudio multicéntrico que asegura la superioridad del acceso percutáneo sobre la exposición abierta de la arteria femoral. Es cierto que, en caso de éxito, hay menos complicación de la herida y puede acortar la estancia hospitalaria, pero es difícil de creer las cifras de 96% de éxito19. El control quirúrgico puede solventar complicaciones como sangrado, rotura de ilíaca o femoral, trombosis, embolia distal. En cualquier caso, el acceso y cierre percutáneo se debe limitar a arterias de calibre apropiado, no intervenidas y libres de calcificación.
- -
Isquemia aguda por oclusión de rama protésica: Puede suceder de forma aguda en un 2% de casos, causado por tortuosidad de la ilíaca, estenosis no tratada o lesión intimal del vaso. Puede resolverse de forma endovascular con trombectomía. En caso extremo puede precisar una revascularización extraanatómica con bypass femoro-femoral.
- -
Síndrome inflamatorio postimplante: Reacción inflamatoria por liberación de reactantes de fase aguda, autolimitada con fiebre de 24-48h de duración. Bastante común (25-30%), suele ser indicativo de una correcta exclusión del saco aneurismático.
- -
Colitis isquémica: Poco frecuente (˂1%). Sobre todo, en casos de oclusión de la arteria mesentérica inferior y de una o ambas hipogástricas. Se recomienda mantener la permeabilidad de las arterias circunflejas femorales e ilíacas, para disminuir el riesgo.
A continuación, se enumeran y describen los principales dispositivos comerciales disponibles:
- a.
Endoprótesis con fijación suprarrenal para AAA infrarrenales con cuello:
- 1.
Endurant II® (Medtronic plc, Minnesotta, EE. UU.): heredera de los dispositivos Talent y AneuRx, es un sistema modular compuesto de una tela de poliéster multifilamento con un armazón de stents de nitinol. Dispone de un stent proximal con unos pequeños pinchos de anclaje intimal, libre de tela para la fijación suprarrenal. Es ampliamente utilizada en Europa y en EE. UU. donde en el ensayo inicial para su aprobación mostró una supervivencia del 99% a 5 años, una tasa de endofuga incluyendo tipo II, del 8,4% y un crecimiento del saco únicamente en un 6% de pacientes20. Es importante resaltar su buen comportamiento en cuellos cortos en longitud, lo que ha permitido al fabricante recomendar su empleo incluso con cuellos de solo 1cm. El empleo asociado del sistema de endotornillos Heli-FX® Endoanchor, ha contribuido también a estos buenos resultados21 (fig. 3).
- 2.
Zenith Alpha® (Cook Group Incorporated, Bloomington, Indiana EE. UU.): prótesis modular que precisa como mínimo de 3 componentes, un cuerpo y 2 segmentos para las arterias ilíacas. Compuesto de Dacron® y stents de nitinol, a diferencia de su predecesora la Zenith Flex® (todavía en el mercado), cuyo stent es de acero inoxidable. Las ramas ilíacas presentan un stent en espiral que presenta unas tasas de oclusión e isquemia de la extremidad muy bajas. Los últimos estudios de resultados a largo plazo muestran porcentajes de pacientes libres de reintervención u conversión a cirugía abierta del 98,9, 88,9 y 86,7 y 57,9% a 1, 3, 5 y 10 años, respectivamente22. También es un dispositivo ampliamente empleado en todo el mundo (fig. 4).
- 3.
Treovance® (Terumo Aortic, Tokyo, Japón): es un dispositivo trimodular compuesto de Dacron® y nitinol, con un stent suprarrenal con ganchos de anclaje intimal. Ofrece una fijación a varios niveles, distribuyendo la fijación a nivel tanto supra como infrarrenal. Su gran aportación es que el fabricante ofrece una plataforma de configuración de dispositivos a medida, con diferentes formas, conicidad, diámetros, y posibilidad de asociar fenestraciones o ramas, todo ello para posibilitar soluciones a casos complejos.
- 4.
Incraft® (Cordis Medical Development Corporation, Santa Clara, California, EE. UU.): dispositivo trimodular de fijación suprarrenal caracterizado por tener un perfil muy bajo, de manera que su cuerpo principal puede navegar a través de un introductor de 14 F, lo que hace que se emplee el acceso percutáneo con gran éxito. Su ensayo inicial INNOVATION permitió recomendar su uso en cuellos de 15mm de longitud, y en bifurcaciones aórticas de 18mm o menos, lo que hace de esta endoprótesis un arma muy útil en casos de aortas de pequeño tamaño23 (fig. 5).
- 5.
E-Tegra® (Jotec GmbH, Hechingen, Alemania): prótesis bimodular compuesta de poliéster y nitinol, con un sistema de liberación que otorga seguridad en el posicionamiento, aunque sea algo complejo. Concepto muy similar al de Endurant II®, ofrece una doble fijación activa supra e infrarrenal. Permite emplear simultáneamente el dispositivo de rama para ilíaca interna, para casos de afectación de la ilíaca común en que se desee salvar la hipogástrica.
- b.
Endoprótesis para AAA con fijación infrarrenal convencional:
- 1.
Excluder® (Gore Medical, Newark, Delaware, EE. UU.): se trata de una prótesis modular autoexpandible hecha de politetrafluoroetileno (PTFE) con un esqueleto de stents de nitinol. Se caracteriza por una gran flexibilidad, facilidad para adaptarse a anatomías complejas y tortuosas sin por ello acodarse. Además, tiene un perfil bajo que permite el empleo de introductores pequeños. Su sistema de liberación es muy sencillo y la última actualización del dispositivo presenta un mecanismo para poder reposicionar la prótesis en caso de que no se haya liberado en el sitio deseado (Active Control System). Tiene varios ensayos clínicos publicados con porcentajes de pacientes libres de complicaciones a 10 años del 90%24.
- 2.
AFX2® (Endologix, California, EE. UU.): nueva versión de la clásica AFX consistente en un dispositivo de PTFE bifurcado con un esqueleto de stents de cromo-cobalto. El stent proximal tiene un sistema de fijación activa y ofrece una gran ventaja que facilita la canulación de la rama ilíaca contralateral, ya que los segmentos ilíacos del cuerpo principal son muy cortos y simétricos lo que permite que se apoye en la bifurcación aórtica, minimizando así el riesgo de migración. Por otro lado, su bajo perfil y la resistencia a la oclusión de las ramas ilíacas que ofrece ha permitido su empleo en enfermedad oclusivo aorto-íliaca con buenos resultados25.
- c.
Endoprótesis para AAA con cuello infrarrenal con otro tipo de fijación:
- 1.
Aorfix® (Lombard Medical Limited, Oxfordshire, UK): se trata de una endoprótesis bimodular compuesta por un único stent en espiral de nitinol con un tejido de poliéster. Dicho stent confiere una gran flexibilidad y adaptabilidad a grandes angulaciones, por ello está aprobado su empleo en angulaciones de cuello proximal de 90°, cuando el resto se limitan a un máximo de 60. Otra característica es su forma en boca de pez proximal con valles para alojar los ostia renales, ganando así superficie de fijación parcialmente suprarrenal. Por otro lado, tiene 4 ganchos de anclaje intimales que hace muy improbable su migración. El registro Pythagoras en pacientes con cuello angulado mostró ausencia de endofugas tipos I o III, una supervivencia del 96% y una ausencia de complicaciones por el dispositivo del 86% a 5 años26 (fig. 6).
- 2.
ALTO® (Endologix, California, EE. UU.): es una nueva versión de la prótesis Ovation®, del mismo fabricante. Su característica fundamental es que la fijación se realiza infrarrenal mediante dos anillos inflables de polímero consecutivos, que permite tratar cuellos de 7mm de longitud, siempre y cuando a esa distancia de las renales el diámetro no supere los 30mm. El polímero se inyecta desde el introductor una vez posicionada y al cabo de unos minutos se solidifica adaptándose al contorno del cuello. Los resultados iniciales son prometedores y hay en marcha un registro multicéntrico con el objeto de mostrar resultados a 5 años (fig. 7).
- 3.
Anaconda® (Terumo Aortic, Tokio, Japón): prótesis con el mismo concepto que Aorfix®, stent en espiral, cuello en boca de pez con ganchos para fijación, gran flexibilidad y posibilidad de abordar angulaciones importantes. Ofrece la posibilidad de diseñar a medida para tratar aneurismas yuxtarrenales con fenestraciones para los vasos viscerales.
- d.
Endoprótesis para tratar aneurismas yuxta o suprarrenales.
- 1.
Endoprótesis fenestradas (FEVAR: Fenestrated EndoVascular Aneurysm Repair): suelen componerse de varios módulos, precisando una fijación a diferentes niveles de la aorta torácica, por lo que pueden necesitar un primer componente torácico o bien directamente sellar con el módulo que incorpora las fenestraciones, que pueden ser 2, para las renales, 3 o 4 si se afectan el tronco celíaco o la mesentérica superior. A continuación, se aplica un módulo bifurcado más corto de lo habitual y ramas ilíacas como un caso convencional. A través de las fenestraciones se cateterizan los vasos viscerales y se aplican stents recubiertos a medida de los mismos. La endoprótesis Zenith Fenestrated AAA endovascular device (ZFEN) es la más empleada y estudiada. Una revisión de 11 estudios incluyendo 660 procedimientos concluyó que, siendo más frecuente la doble fenestración, incluso con 4, el éxito en la permeabilidad de los vasos fue del 90,5%27. En el mayor de dichos estudios, con 134 casos, la mortalidad perioperatoria del 2%, la necesidad de diálisis del 4% y la tasa de endofugas persistentes del 8%. Hay que destacar que la influencia del volumen de intervenciones que se realizan en un centro, la experiencia del equipo y la disponibilidad de un quirófano híbrido son factores que implican mejores resultados para una técnica muy compleja. Una revisión de la American College of Surgeons National Surgical Quality Improvement Programe, comparó 181 casos de aneurismas yuxta o suprarrenales con 220 intervenidos con FEVAR y evidenció mejores resultados en cuanto a mortalidad perioperatoria, insuficiencia renal y complicaciones en general, cifras similares a las encontradas con EVAR convencional28. E-vita® de Jotec es otro dispositivo empleado con similares conceptos y esperanzadores resultados.
- 2.
Endoprótesis con ramas («Branched grafts»): se emplean en casos más complejos y frecuentemente suprarrenales, en los cuales algún ostium, si no todos están en zona aneurismática, o bien, por angulaciones u orientación de los vasos. Al ser fabricadas a medida en su gran mayoría, pueden combinar fenestraciones y ramas. Las ramas pueden disponerse para ser cateterizadas desde el acceso femoral o bien desde un acceso superior, en el brazo o en la arteria axilar. Hay 2 opciones de diseño de las ramas: las que se originan de un módulo y toda su longitud va por fuera de éste, y aquellas en que la rama tiene un canal interno dentro del módulo, lo que facilita su cateterización. Incluso hay modelos denominados «precargados», en los que se incorpora un catéter adherido a la rama dentro del sistema introductor que facilita más la cateterización, solo precisando posteriormente dirigirse a cada ostium con la guía, para a su través, introducir los stents recubiertos. Los modelos de Cook®, Zenith® T-Branch® y de Jotec®, E-nside® para el modelo de ramas internas y E-xtra® para las ramas externas, son los dispositivos más empleados (fig. 8).
Figura 8.Endoprótesis con ramas y fenestraciones. Se puede apreciar que presenta 4 ramas para ambas renales, tronco celíaco y mesentérica superior y una fenestración para una arteria intercostal de gran diámetro (4mm), en la que se aplicó un stent para minimizar riesgos de isquemia medular.
(0.62MB). - 3.
Endoprótesis con ramas para las arterias hipogástricas: se emplean para aneurismas que afectan a una o dos arterias ilíacas comunes, para evitar ocluir y sacrificar al menos una de las arterias ilíacas internas y disminuir los riesgos citados en apartados anteriores. A un implante convencional de endoprótesis para tratar un AAA, se le asocia un módulo con una rama orientada hacia la hipogástrica y se finaliza sellando en ella distalmente con un stent recubierto, que puede acceder desde la femoral contralateral o bien desde el brazo. De nuevo, los modelos de Cook®, Jotec®, y el Excluder® Iliac Branch de Gore® son los más empleados en el mercado actual en nuestro país.
Vamos a hacer referencia a los aneurismas de la aorta abdominal infrarrenal, ya que la cirugía de los toracoabdominales se ha convertido en muy marginal, dado el avance de las técnicas endovasculares y sus importantes riesgos de morbimortalidad.
IndicacionesTal y como sucede con la gran mayoría de técnicas quirúrgicas clásicas que tienen su alternativa endovascular o intervensionista, quedan relegadas a los casos en los que estas no pueden emplearse. Esto sucede en las indicaciones actuales reflejadas en las guías de las sociedades de cirugía vascular, tanto americana como europea29. Se recomienda el empleo de la cirugía abierta en aquellos casos que no cumplan los criterios anatómicos de EVAR, o bien para solucionar complicaciones como endofugas persistentes o infecciones protésicas. No obstante, hay que tomar en consideración que aquellos pacientes jóvenes con una expectativa de vida superior a 20 años, tras EVAR requerirían una vigilancia casi de por vida, con posibilidad de empleo de contraste iodado y radiación frecuentemente y con un 15-20% de posibilidades de requerir una reintervención, por lo que la cirugía abierta debe considerarse una opción terapéutica de primera línea con ventajas por su durabilidad a largo plazo frente al tratamiento endovascular.
Acceso quirúrgicoEl acceso más habitual es la laparotomía media, pudiéndose emplear la transversa con excelentes resultados y sin diferencias significativas en cuanto a dolor y complicaciones postoperatorias. El acceso retroperitoneal se debería reservar para casos de riñones en herradura, aneurismas inflamatorios o abdomen hostil previo30.
Clampaje aórticoSe debería comenzar clampando el segmento distal, en aorta terminal o ilíacas, para evitar embolización de trombo procedente del saco aneurismático. Posteriormente, a nivel proximal, se debe tener en cuenta preoperatoriamente la distancia a las arterias renales, presencia de trombo o calcio en el cuello, presencia de una vena renal izquierda retroaórtica o de una vena cava izquierda. En caso de precisar de pinzamiento aórtico suprarrenal, es recomendable proteger los riñones con una perfusión de suero salino frío o bien con soluciones de preservación tipo Wisconsin, pese a lo cual se incrementa considerablemente el riesgo de insuficiencia renal y de mortalidad a 30 días31.
Tipo y configuración del injertoNo se han encontrado diferencias en el empleo de los diferentes materiales para la realización de la derivación, frecuentemente Dacron® o PTFE, tampoco se han demostrado ventajas en el empleo de prótesis impregnadas en rifampicina o en plata en términos de resistencia a la infección en los estudios multicéntricos realizados32. El tubo recto es lo más empleado (40-50%) y tiene los mejores resultados, por delante del bifurcado a ilíacas (39%), o a femorales (30%). En estos últimos se presentan más complicaciones como infección de herida.
Mantenimiento de la circulación pélvicaFrecuentemente en estos casos se ponen en peligro la permeabilidad de las arterias mesentérica inferior, hipogástricas, lumbares o circunflejas ilíacas o femorales, lo que puede provocar una isquemia en territorio glúteo o incluso intestinal. Las medidas recomendadas para evitar estas complicaciones son preservar al menos una de las ilíacas internas para evitar isquemia glútea y reimplantar la arteria mesentérica inferior en caso de que haya evidencia de enfermedad oclusiva del tronco celíaco o de la mesentérica superior33.
Manejo de la enfermedad vascular concomitanteLa intervención simultanea sobre las arterias viscerales incrementa considerablemente el riesgo quirúrgico de la intervención y por tanto, es recomendable abordarlo de forma escalonada, preferiblemente endovascular previamente y solo en caso de ser un problema sintomático. Las arterias renales pueden presentar estenosis hasta en un 40% de pacientes con AAA, mientras que TC y AMS solo en un 10%. Otras enfermedades intraabdominales frecuentes son: la colelitiasis, que no es recomendable operarse a la vez porque el riesgo de colecistitis es menor del 1% y los tumores colorectales no complicados que deben intervenirse entre 4 y 6 semanas después del aneurisma.
Resultados de la cirugía abierta de los AAARecientes estudios multicéntricos y randomizados han demostrado una mortalidad perioperatoria en casos electivos del 3-4%, con lo cual, aunque ha mejorado en los últimos años, es mayor que la demostrada por EVAR34. La morbilidad postoperatoria sobre todo cardiaca, respiratoria, renal y gastrointestinal también es mayor, de la misma manera que se ha demostrado que un 20% de pacientes requieren una reintervención de pared abdominal a los 8 años35. Finalmente, la experiencia del cirujano y el volumen tratado en cada centro son muy importantes, se cifra en 18 el volumen mínimo de cirugías anuales por centro para que la mortalidad sea inferior al 5%, llegando al 2,2% si las realiza el mismo cirujano vascular.
Tratamiento de los aneurismas de aorta abdominal rotoCualquier charla, artículo o clase en la facultad de medicina sobre los aneurismas rotos comienza diciendo que aproximadamente la mitad de los pacientes a los que se les rompe un AAA fallecen antes de llegar a un hospital o sin tratamiento. Sigue siendo verdad, sin embargo, se ha podido comprobar que el disponer de un protocolo de actuación y de rápido traslado a un centro bien equipado consigue bajar la mortalidad de aquellos pacientes que son atendidos todavía con vida de un 32 a un 18%36. Pese a estos datos, la mayor parte de autores reportan cifras de mortalidad más cercanas al 30%, tanto tras EVAR como con OR.
Las últimas guías y recomendaciones publicadas, tanto europeas como americanas, aconsejan un tiempo máximo de 90min desde el primer contacto con el paciente hasta el momento en que se interviene en sus arterias de alguna forma (balón de oclusión, incisión quirúrgica, etc.). Este tiempo se divide en 3 periodos: 30min para estabilizar al paciente, colocar una vía, asegurar ventilación, y plantear el diagnóstico inicial, 30min para el traslado y otros 30 para que el equipo especialista evalúe la situación, confirme el diagnóstico, tome la decisión de intervenir y con qué técnica29. En nuestro país, con un sistema sanitario en el que abundan los centros de tercer nivel, debería ser más sencillo alcanzar esta meta, comparado con aquellos en los que tienen pocos centros de referencia, aunque dispongan de mayor volumen de actividad. De hecho, en EE. UU. evaluaron este sistema para el síndrome. coronario agudo, y vieron que solo el 8,6% fue tratado dentro de los primeros 90min, mientras que la media fue de 152min37.
Los predictores de mortalidad más importantes son: edad mayor de 76 años, creatinina mayor de 2mg/dl, pH menor de 7,2 y tensión arterial sistólica inferior a 70 en algún momento. Otras comorbilidades cardiacas o respiratorias también se deben tener en cuenta.
EVAR ha demostrado ser más eficiente en la relación coste/beneficio en estos pacientes, sin embargo, en los estudios comparativos realizados no ha demostrado mayor supervivencia que la cirugía abierta, excepto en aquellos centros bien entrenados y de referencia en técnicas endovasculares.
En cuanto a las complicaciones más características que suelen presentar los pacientes supervivientes, destacan el Sd. compartimental intraabdominal, característico tras EVAR (10-15%), y la colitis isquémica, más habitual tras OR. El primero ocurre por no evacuar el hematoma inicialmente, lo que provoca inestabilidad hemodinámica por disminución del retorno venoso y de la precarga cardiaca. Se soluciona realizando una laparotomía descompresiva y aplicando un sistema de VAC (terapia de presión negativa) durante 48-72h, con cierre diferido. La colitis isquémica con frecuencia se debe a ligadura de arterias lumbares, mesentérica inferior o circunflejas, asociado a hipotensión e inestabilidad. Puede desembocar en hemicolectomía izquierda y afecta al 20-30% de pacientes operados abiertos y es una frecuente causa de mortalidad en los primeros 30 días.
Relación coste/beneficioLa complejidad del tratamiento de un aneurisma de aorta abdominal hace que los costes económicos sean importantes, además de variar de forma significativa según el país. Los costes en material son más elevados con EVAR, que con OR, pero menores en cuanto a hospitalización y complicaciones. A largo plazo precisa más pruebas de imagen y seguimiento, lo que hace que, en conjunto, no haya grandes diferencias en cuanto a costes. La contrapartida al gasto por el tratamiento de un AAA es la supervivencia, en la que no hay diferencias, y es aceptado que EVAR ofrece mejores datos de calidad de vida y recuperación inicial en el primer mes, pero acaba igualándose a la cirugía abierta al año del procedimiento38.
En cambio, en situaciones urgentes, aneurismas rotos, EVAR demuestra ser más beneficiosa en términos de coste/efectividad, dado que, como se ha comentado en apartados anteriores, disminuye la estancia en intensivos y la hospitalización, comparado con OR, pese al mayor gasto en material.
El tratamiento endovascular de aneurismas complejos o de mayor extensión, que requieran prótesis fenestradas, stents y abundante material extra, ha demostrado no ser coste/efectivo, ya que no se ha demostrado mayor supervivencia ni a 30 días ni a medio plazo, comparado con la cirugía abierta, siempre considerando pacientes aptos para ambas técnicas. Del mismo modo, el tratamiento con EVAR de pacientes no candidatos a cirugía abierta por tener edad avanzada o comorbilidades importantes supone procedimientos complejos y anatómicamente poco favorables, con lo que tampoco son coste/efectivos39.
Es de esperar que, con el tiempo, teniendo en cuenta el cada vez mayor número de implantes EVAR que se realizan a nivel mundial, la competencia entre dispositivos y fabricantes y la constante innovación, los costes por material se abaraten, algo que se espera hace años pero que no acaba de producirse. Puede que, en ese hipotético escenario, los análisis de coste/efectividad mostraran resultados más clarificadores.
ConclusionesEl desarrollo de las técnicas endovasculares y la innovación y mejora de los dispositivos ha permitido tratar cada vez más pacientes, que de otra forma no se hubieran intervenido o lo hubieran sido mediante una arriesgada cirugía abierta. Pese a ello, en aquellos pacientes aptos, la cirugía abierta ofrece resultados similares a EVAR en cuanto a supervivencia y calidad de vida a medio y largo plazo, por lo que no debe ser dejada de lado, sobre todo en pacientes jóvenes. Solo en centros expertos con un volumen importante de casos, los complejos procedimientos con fenestraciones o ramas pueden llegar a ser superiores a la cirugía abierta. Es importante ceñirse a las indicaciones existentes y a las recomendaciones de los fabricantes para obtener buenos resultados, teniendo en cuenta que no siempre se consigue una mayor supervivencia de los pacientes muy mayores o con muchas comorbilidades. El abaratamiento de las endoprótesis y un buen protocolo de seguimiento basado en la ecografía harían mucho más eficiente el tratamiento endovascular.
Conflicto de interesesEl autor declara no tener ningún conflicto de intereses.