La miocardiopatía hipertrófica obstructiva es una enfermedad infrecuente, el tratamiento quirúrgico con miectomía septal en grandes centros mejora la clínica y la supervivencia. La miectomía septal y, en ocasiones, el reemplazo valvular mitral son las técnicas fundamentales.
MétodosAnálisis retrospectivo de 30 pacientes con miocardiopatía hipertrófica obstructiva operados en nuestro centro (2007-2017).
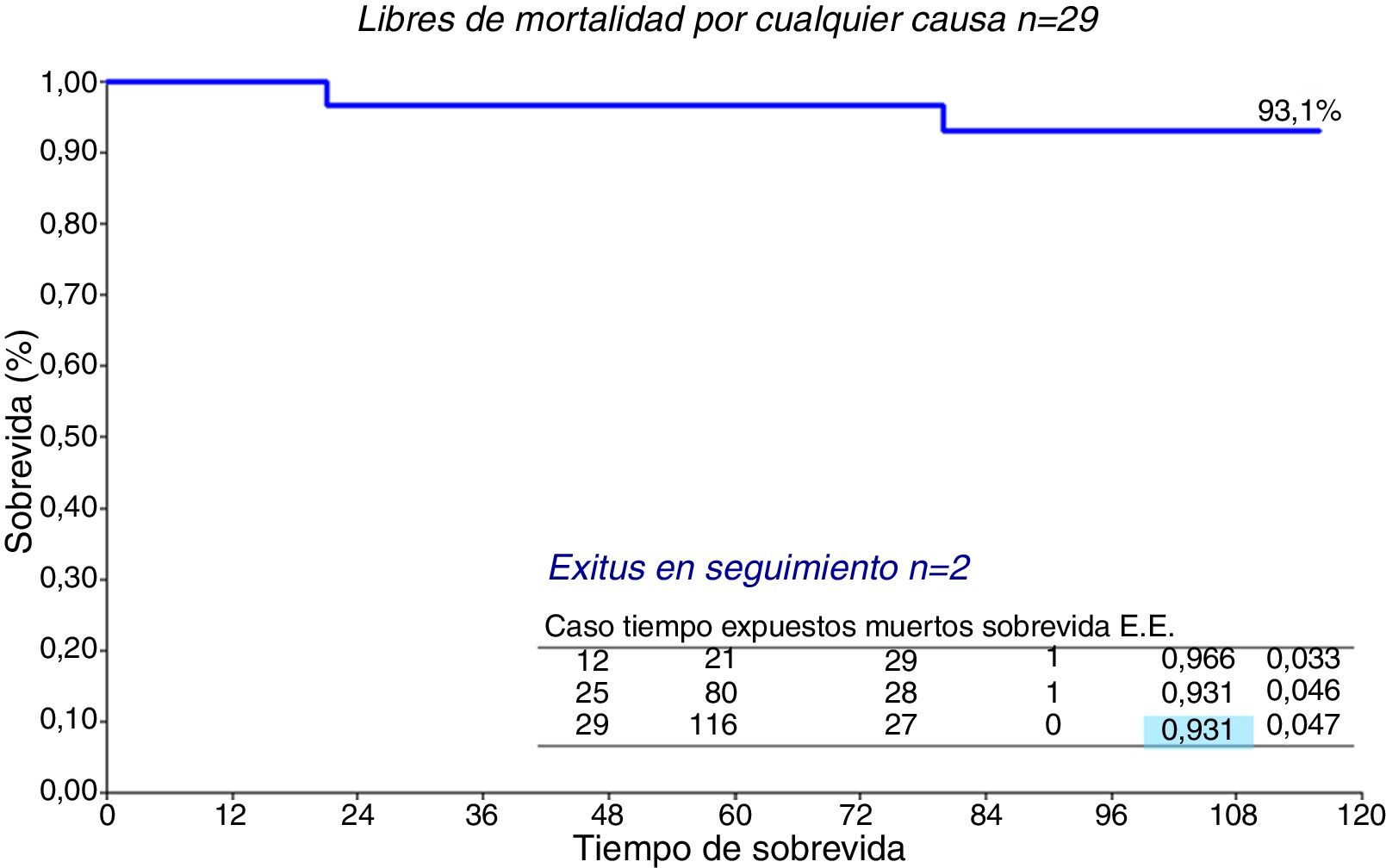
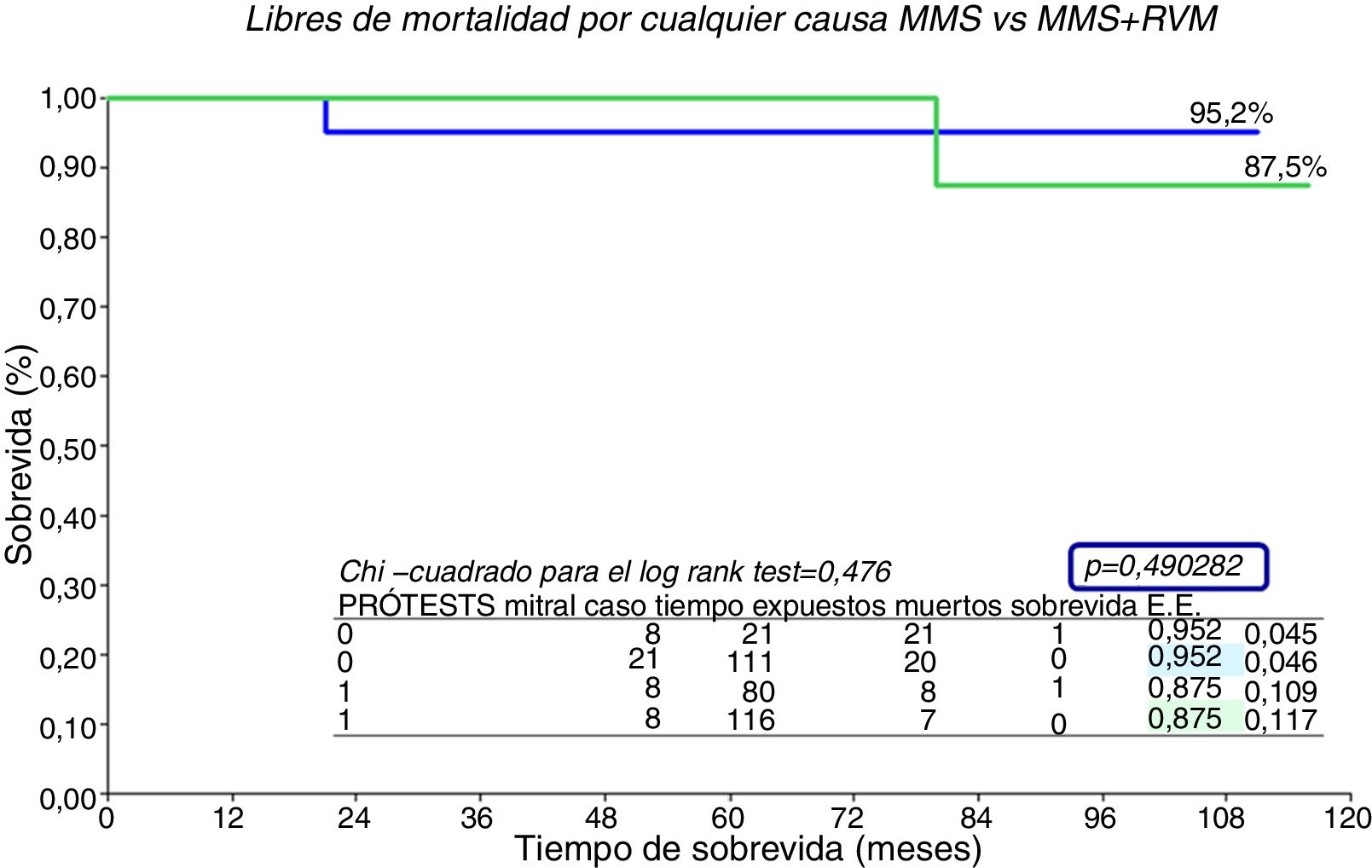
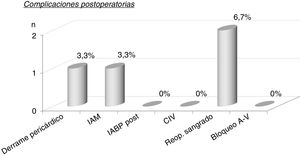
ResultadosEl grupo presentaba: edad (media) 67,3±12 años; el 56,7% mujeres; EuroSCORE-LOGÍSTICO 6,3±4,4; septo interventricular 24,9±2,9mm; movimiento sistólico anterior moderado-severo (43,4%); insuficiencia mitral grado iii (46,7%) y iv (33,3%); enfermedad mitral (calcificación, displasia, prolapso) en 17 (56,7%). Procedimientos: miectomía septal (100%); bypass coronario 8 (26,7%), prótesis aórtica 8 (26,7%). El 26,7% (8) recibió reemplazo valvular mitral por enfermedad valvular y persistencia de insuficiencia mitral. Este grupo tenía insuficiencia mitral más severa y peor grado funcional de forma significativa. Hubo una (3,3%) muerte (hemorragia pulmonar) y 2 (6,7%) reoperados por sangrado. El seguimiento medio fue 43,7±36,3 (mediana 30) meses (máximo 116). El grado funcional pasó de: iv (43,3%) y iii (56,7%) precirugía a ii (24,1%) y i (75,9%) poscirugía (p<0,0001). El gradiente intraventricular descendió de 106,1±27,5mmHg (mediana 104,5) a 11,9±7,2mmHg (mediana 10) (p<0,0001). A 10 años la supervivencia es del 93,1%; del 87,5% si recibieron prótesis mitral y del 95,2% sin prótesis mitral (p=0,49).
ConclusionesLa degeneración valvular mitral obliga con frecuencia a implante protésico mitral, pero con prótesis mitral o sin ella la cirugía en miocardiopatía hipertrófica obstructiva ofrece buena supervivencia y mejoría clínica a largo plazo.
Obstructive hypertrophic myocardiopathy is an uncommon disease. Surgical treatment with septal myectomy in experienced centres improves clinical outcomes and survival. Septal myectomy and, occasionally, mitral valve replacement are the fundamental techniques.
MethodsA retrospective analysis carried out on 30 patients with obstructive hypertrophic myocardiopathy operated in our centre (2007-2017).
ResultsThe group variables were: age (mean) 67.3±12 years; 56.7% women; mean EuroSCORE-Logistic 6.3±4.4; interventricular septum 24.9±2.9mm; moderate-severe septal anterior movement (43.4%); mitral regurgitation grade III (46.7%) and IV (33.3%); mitral disease (calcification, dysplasia, prolapse) in 17 (56.7%). The procedures performed were: septal myectomy (100%); coronary bypass in 8 (26.7%), and aortic valve replacement in 8 (26.7%). The 26.7% (8) that received mitral valve replacement was due to valvular disease and persistence of mitral regurgitation. This group had more severe mitral regurgitation and a significantly worse functional grade. There was one (3.3%) death due to pulmonary haemorrhage, and 2 (6.7%) patients were re-operated due to bleeding. The mean follow-up was 43.7±36.3 (median 30) months (maximum 116). The functional grade went from: IV (43.3%) and III (56.7%) pre-surgery to II (24.1%) and I (75.9%) post-surgery (P<.0001). The intraventricular gradient decreased from 106.1±27.5mmHg (median 104.5) to 11.9±7.2mmHg (median 10) (P<.0001). At 10 years, survival was 93.1%. It was 87.5% if they received a MVR and 95.2% without MVR (P=.49).
ConclusionsMitral valve degeneration often requires an implant, but with or without an mitral valve replacement, surgery in obstructive hypertrophic myocardiopathy offers good survival and long-term clinical improvement.
La miocardiopatía hipertrófica es una enfermedad del sarcómero cardiaco que produce hipertrofia del ventrículo izquierdo y/o derecho, generalmente asimétrica, tiene carácter familiar en la que se han catalogado diferentes genes con expresión y penetrancia variable. Afecta a uno de cada 500 individuos1, con una mortalidad anual entre el 3 y 4%. La miocardiopatía hipertrófica puede cursar de forma no obstructiva2, pero la miocardiopatía hipertrófica obstructiva (MHO) tiene un impacto muy importante en la supervivencia de los pacientes1 por lo que se plantean opciones terapéuticas, siendo el «gold estándar» la miectomía septal (MMS)3,4. La obstrucción del tracto de salida del ventrículo izquierdo (OTSVI) se debe a la existencia de 2 componentes: el septo interventricular (SIV) (hipertrofiado) y la válvula mitral5 (habitualmente elongada, con implantación anormal de las cuerdas) con movimiento sistólico anterior (SAM). La fisiopatología de la MHO se traduce en OTSVI y la presencia de insuficiencia mitral (IM) debido al SAM5. La MMS ha evolucionado desde la miotomía6, por la miectomía de Morrow7 hasta la MMS extendida8, esta evolución ha mejorado los resultados clínicos, con alivio del gradiente y mejora de la IM, y reducido el riesgo quirúrgico (del 0,3 al 1,1%)9 en los centros de referencia norteamericanos con grandes series1,2,9, siendo la MMS un factor independiente asociado con la supervivencia2, recomendación i por guías de práctica clínica 2011 AHA4 y 2014 ESC3. Sin embargo, en ocasiones la válvula mitral está demasiado enferma, persistiendo una IM importante a pesar de la MMS, y en estos casos se recomienda el reemplazo valvular mitral (RVM), que es otra alternativa terapéutica con nivel de recomendación iia y iib por la Guía de práctica clínica de la ESC 2014 sobre el diagnóstico y manejo de la miocardiopatía hipertrófica3. En este artículo nos planteamos conocer los resultados a largo plazo del tratamiento de la MHO con MMS±RVM (cuando sea necesario) realizado en un centro sin el elevado volumen que presentan los grandes centros norteamericanos.
MétodosSe ha llevado a cabo un análisis retrospectivo de 30 pacientes con MHO operados en un único centro entre octubre de 2007 y diciembre de 2017. Aunque el análisis es retrospectivo, los datos han sido recogidos en el momento de la cirugía y durante el seguimiento a los 3 meses por el servicio de cirugía y posteriormente de forma anual por su cardiólogo. En todos los pacientes se realizó MMS, aislada en 22 (73,3%) y asociada a RVM en 8 (26,7%).
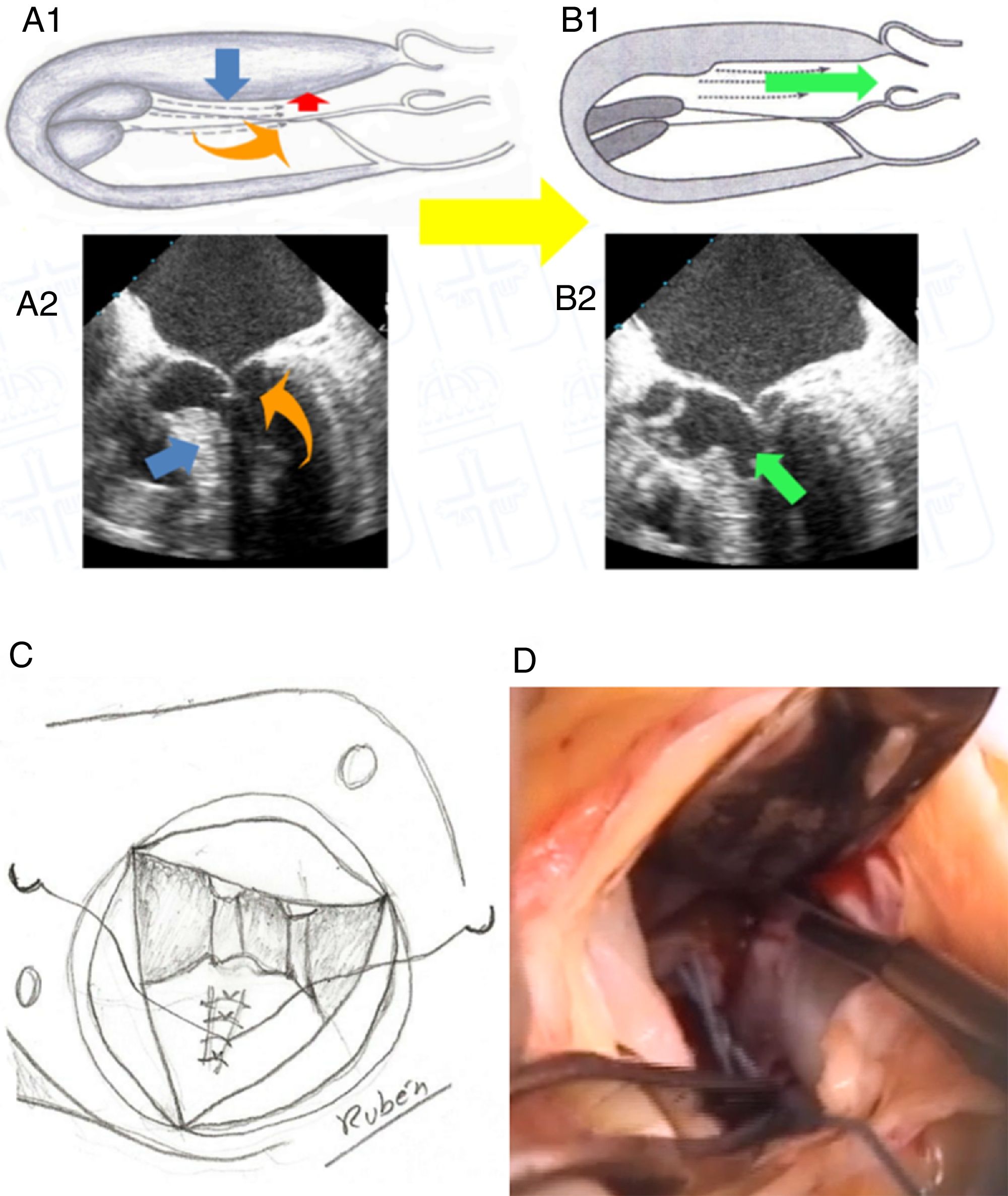
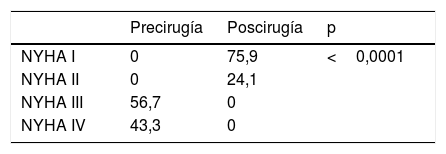
Técnica quirúrgicaLa MMS y procedimientos asociados se han realizado con circulación extracorpórea, hipotermia 32° y parada cardiaca inducida por cardioplejía cristaloide Celsior© (Genzyme Corp., Boston, MA, EE. UU.) vía anterógrada y retrógrada. Para realizar las miectomías se ha utilizado la técnica MMS extendidada8: vía aortotomía, utilizando separador largo para rechazar velo coronario derecho y visualizar SIV, con bisturí frío del n.o 15 incidiendo 5mm debajo del anillo aórtico, con extensión en ancho desde la comisura entre velo coronariano izquierdo-derecho hasta un punto del SIV que coincide con la línea que pasa por el ostium coronario derecho, y extendiendo en profundidad hasta la base de los músculos papilares (MMS extendida) (fig. 1). En los casos que se actuó sobre la válvula mitral, sin implante de prótesis, se realizaron plicaturas del velo anterior fundamentalmente en sentido longitudinal con poliproplileno 4/0 (63,6%) (fig. 1C).
A1 y A2) imagen esquemática y ecocardiográfica, respectivamente, del mecanismo de obstrucción del tracto de salida y de la insuficiencia mitral; B1 y B2) imagen esquemática y ecocardiográfica, respectivamente, del efecto de la miectomía en el alivio de la obstrucción del tracto de salida e insuficiencia mitral; C) dibujo esquemático de la plicatura longitudinal del velo anterior mitral; D) imagen del campo quirúrgico de la miectomía.
El análisis descriptivo de los datos se expresó mediante media±desviación estándar para las variables continuas y frecuencias (porcentajes) para las no continuas. Las comparaciones entre proporciones se realizaron con el test Chi cuadrado y para comparar variables continuas se ha empleado T de student para muestras independientes y U de Mann-Whitney para las que no cumplen características de normalidad. El análisis de supervivencia se realizó con las curvas de sobrevida de Kaplan-Meier y su comparación con el Log Rank Test. El análisis estadístico se realizó con Infostat Software Estadístico para Windows, creado por la universidad de Córdoba, versión 2017, y un valor de p<0,05 (asumiendo bilateralidad) se consideró significativo estadísticamente.
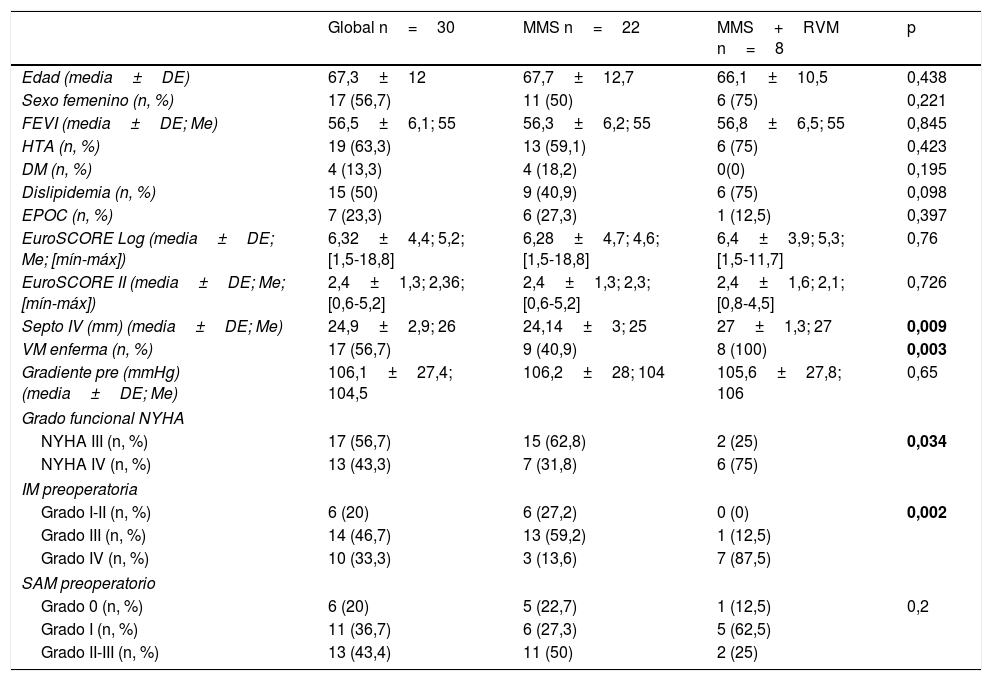
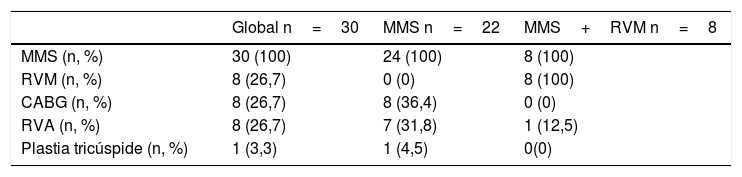
ResultadosLa edad media del grupo era de 67,3±12 años, con un 56,7% de mujeres y un EuroSCORE-LOGÍSTICO medio de 6,3±4,4% y un EuroSCORE II medio de 2,4±1,3%. Las variables clínicas preoperatorias de la serie global y por grupos de MMS aislada y MMS+RVM las podemos ver en la tabla 1, donde observamos que no hay diferencias significativas entre los 2 grupos excepto en el espesor del SIV que fue mayor en el grupo de MMS+RVM (MMS 24,14±3mm vs. MMS+RVM 27±1,3mm, p=0,0009) y la presencia de enfermedad valvular mitral (calcificación, displasia, prolapso) que fue más frecuente en el grupo que precisó recambio valvular (MMS 40,9% vs. MMS+RVM 100%, p=0,003). Todos los pacientes se operaron en grado funcional de la New York Heart Association (NYHA) III y IV, pero el porcentaje de pacientes del grupo MMS en NYHA IV era menor que el del grupo MMS+RVM (31,8 vs. 75%, p=0,034). La IM era más severa (grado iv) en el grupo de MMS+RVM (13,6 vs. 87,5%, p=0,002). No hubo diferencias significativas en el grado de SAM. Se realizaron procedimientos quirúrgicos asociados (tabla 2), revascularización miocárdica, prótesis aórtica y plastia tricúspide, principalmente en el grupo de MMS aislada. En la tabla 3 vemos que no hubo diferencias en el tiempo de pinzamiento ni de circulación extracorpórea, y la ecocardiografía transesofágica intraoperatoria presentaba IM moderada en un paciente del grupo MMS (4,5%), que posteriormente evolucionó a grado I.
Variables clínicas de los pacientes
| Global n=30 | MMS n=22 | MMS+RVM n=8 | p | |
|---|---|---|---|---|
| Edad (media±DE) | 67,3±12 | 67,7±12,7 | 66,1±10,5 | 0,438 |
| Sexo femenino (n, %) | 17 (56,7) | 11 (50) | 6 (75) | 0,221 |
| FEVI (media±DE; Me) | 56,5±6,1; 55 | 56,3±6,2; 55 | 56,8±6,5; 55 | 0,845 |
| HTA (n, %) | 19 (63,3) | 13 (59,1) | 6 (75) | 0,423 |
| DM (n, %) | 4 (13,3) | 4 (18,2) | 0(0) | 0,195 |
| Dislipidemia (n, %) | 15 (50) | 9 (40,9) | 6 (75) | 0,098 |
| EPOC (n, %) | 7 (23,3) | 6 (27,3) | 1 (12,5) | 0,397 |
| EuroSCORE Log (media±DE; Me; [mín-máx]) | 6,32±4,4; 5,2; [1,5-18,8] | 6,28±4,7; 4,6; [1,5-18,8] | 6,4±3,9; 5,3; [1,5-11,7] | 0,76 |
| EuroSCORE II (media±DE; Me; [mín-máx]) | 2,4±1,3; 2,36; [0,6-5,2] | 2,4±1,3; 2,3; [0,6-5,2] | 2,4±1,6; 2,1; [0,8-4,5] | 0,726 |
| Septo IV (mm) (media±DE; Me) | 24,9±2,9; 26 | 24,14±3; 25 | 27±1,3; 27 | 0,009 |
| VM enferma (n, %) | 17 (56,7) | 9 (40,9) | 8 (100) | 0,003 |
| Gradiente pre (mmHg) (media±DE; Me) | 106,1±27,4; 104,5 | 106,2±28; 104 | 105,6±27,8; 106 | 0,65 |
| Grado funcional NYHA | ||||
| NYHA III (n, %) | 17 (56,7) | 15 (62,8) | 2 (25) | 0,034 |
| NYHA IV (n, %) | 13 (43,3) | 7 (31,8) | 6 (75) | |
| IM preoperatoria | ||||
| Grado I-II (n, %) | 6 (20) | 6 (27,2) | 0 (0) | 0,002 |
| Grado III (n, %) | 14 (46,7) | 13 (59,2) | 1 (12,5) | |
| Grado IV (n, %) | 10 (33,3) | 3 (13,6) | 7 (87,5) | |
| SAM preoperatorio | ||||
| Grado 0 (n, %) | 6 (20) | 5 (22,7) | 1 (12,5) | 0,2 |
| Grado I (n, %) | 11 (36,7) | 6 (27,3) | 5 (62,5) | |
| Grado II-III (n, %) | 13 (43,4) | 11 (50) | 2 (25) | |
DE: desviación estándar; DM: diabetes mellitus; EPOC: enfermedad pulmonar obstructiva crónica; FEVI: fracción de eyección de ventrículo izquierdo; Gradiente pre: gradiente precirugía; HTA: hipertensión arterial; IM: insuficiencia mitral; Log: logístico; Me: mediana; mín-máx: mínimo-máximo; mm: milímetros; mmHg: milímetros de mercurio; MMS: miectomía septal; NYHA: New York Heart Association; n: número de pacientes; RVM: reemplazo valvular mitral; SAM: movimiento sistólico anterior; Septo IV: septo interventricular; VM: válvula mitral.
En negrita los resultados estadísticamente significativos.
Procedimientos
| Global n=30 | MMS n=22 | MMS+RVM n=8 | |
|---|---|---|---|
| MMS (n, %) | 30 (100) | 24 (100) | 8 (100) |
| RVM (n, %) | 8 (26,7) | 0 (0) | 8 (100) |
| CABG (n, %) | 8 (26,7) | 8 (36,4) | 0 (0) |
| RVA (n, %) | 8 (26,7) | 7 (31,8) | 1 (12,5) |
| Plastia tricúspide (n, %) | 1 (3,3) | 1 (4,5) | 0(0) |
CABG: cardio artery bypass grafting (revascularización miocárdica); MMS: miectomía septal; n: número de pacientes; RVA: reemplazo valvular aórtico; RVM: reemplazo valvular mitral.
Variables intraoperatorias
| Global n=30 | MMS n=22 | MMS+RVM n=8 | p | |
|---|---|---|---|---|
| Tiempo pinzamiento (min) (media±DE; Me) | 101,5±30,7; 107 | 99,1±32; 102 | 108±28; 103 | 0,57 |
| Tiempo CEC (min) (media±DE; Me) | 124,1±36,7; 124 | 122,4±39,4; 124 | 129±29,8; 123 | 0,69 |
| ECO TE intraop (IM) (n; %) | ||||
| Trivial leve (0-I) | 23 (96,7) | 21 (95,5) | 8 (100) | |
| Mod (II) | 1 (3,3) | 1 (4,5) | 0 (0) | |
CEC: circulación extracorpórea; DE: desviación estándar; ECO TE: ecocardiografía transesofágica; IM: insuficiencia mitral; intraop: intraoperatorio; Me: mediana; min: minutos; MMS: miectomía septal; Mod: moderado; n: número de pacientes; RVM: reemplazo valvular mitral.
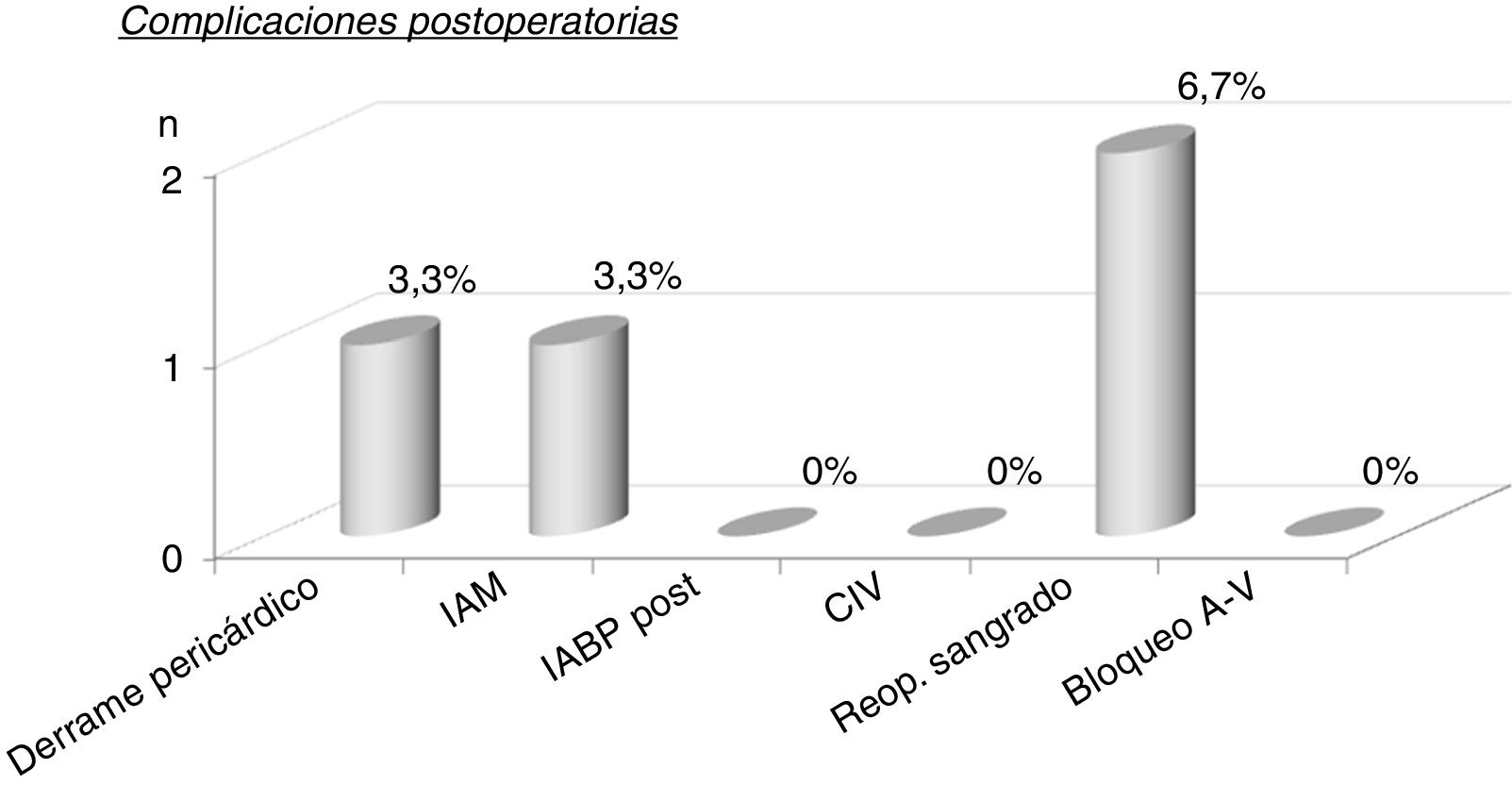
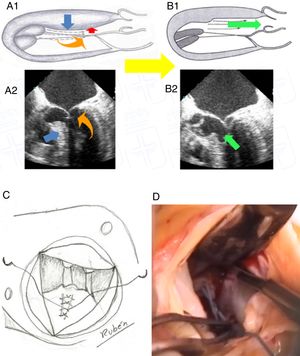
La mortalidad intrahospitalaria fue de un paciente (3,3%) debido a hemorragia pulmonar por el catéter de Swan Ganz (tabla 4), con un índice de mortalidad ajustada al riesgo de 1,37. Las complicaciones postoperatorias las podemos ver en la figura 2. Destacan 2 (6,7%) pacientes con reoperación por sangrado. No hubo comunicación interventricular, ni bloqueo auriculoventricular completo, aunque sí hubo bloqueo de rama izquierda del haz de his en 28/30 (93,3%).
Variables postoperatorias
| Global n=30 | MMS n=22 | MMS+RVM n=8 | |
|---|---|---|---|
| Mortalidad (n; %) | 1; (3,3) | 1; (4,5) | 0; (0) |
| IMAR | 1,37 | 1,87 | 0 |
| Seguimiento medio (meses) (media±DE; Me) | 43,7±36,3; 30 |
DE: desviación estándar; IMAR: índice de mortalidad ajustada al riesgo; Me: mediana; MMS: miectomía septal; n: número de pacientes; RVM: reemplazo valvular mitral.
Complicaciones postoperatorias. Bloqueo A-V: bloqueo auriculoventricular; CIV: comunicación interventricular; IABP post: intraortic ballon pump postoperatorio (balón de contrapulsación intraaórtico postoperatorio); IAM: infarto agudo de miocardio; n: número de pacientes; Reop. sangrado: reoperación por sangrado.
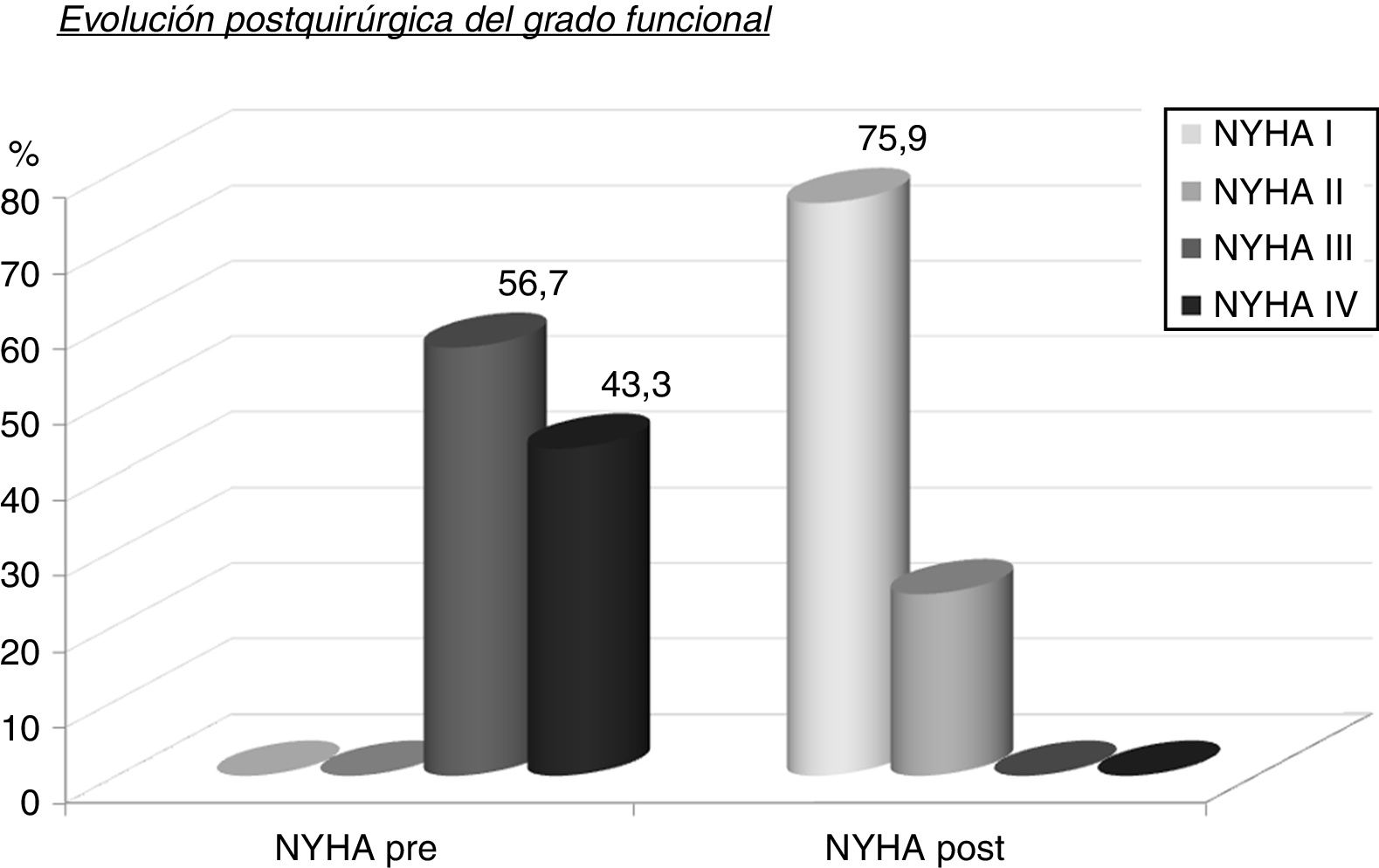
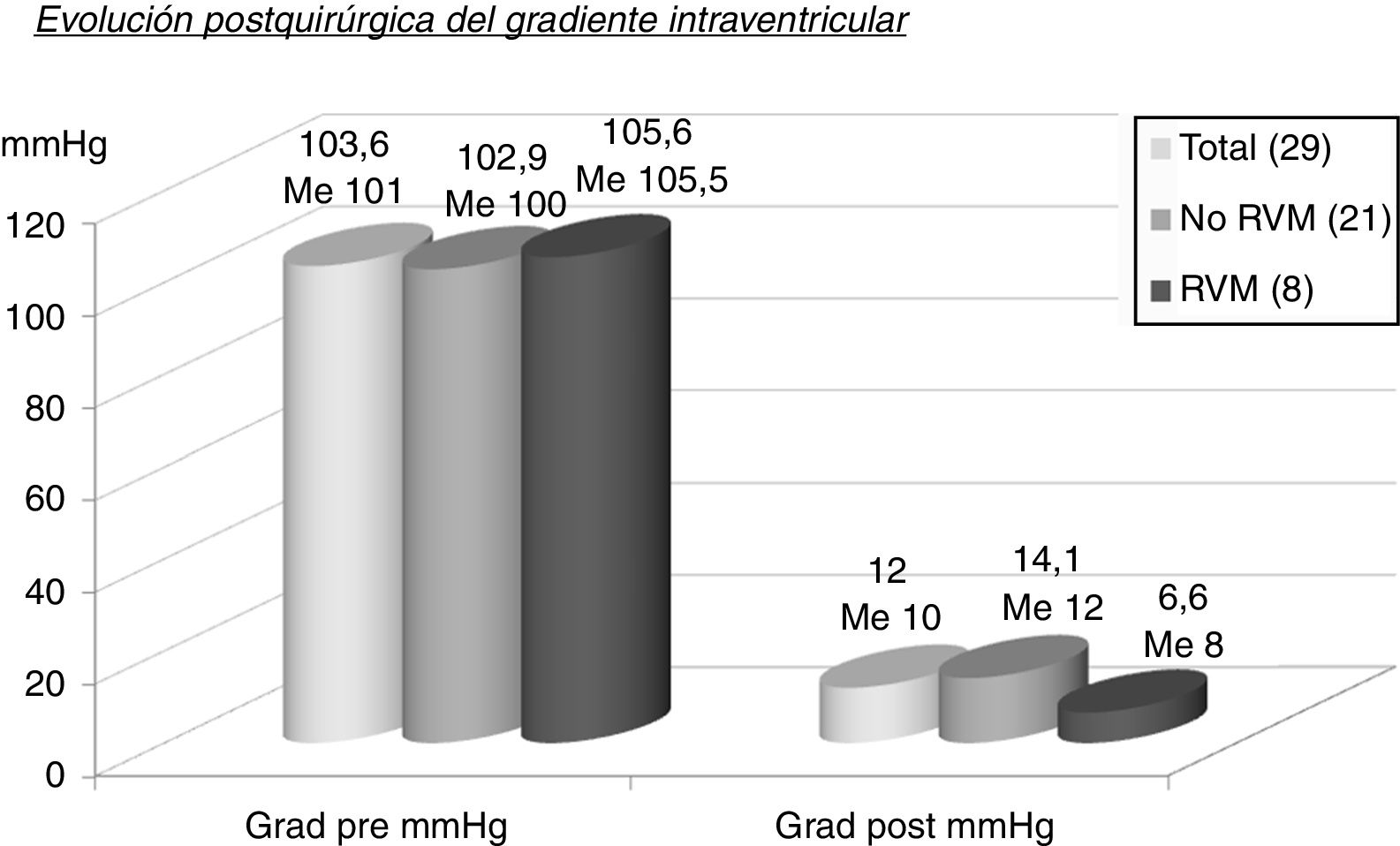
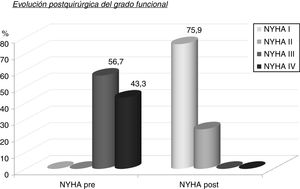
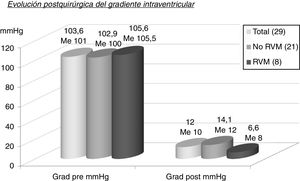
Los 29 pacientes tuvieron un seguimiento medio de 43,7±36,3 meses con mediana de 30 meses. Durante ese tiempo el grado funcional NYHA evolucionó favorablemente (fig. 3 y tabla 5), pasando de NYHA IV (43,3%) y III (56,7%) precirugía a NYHA II (24,1%) y I (75,9%) poscirugía (p<0,0001). El gradiente intraventricular (fig. 4 y tabla 6) descendió de forma significativa pasando en la serie global de 103,6±24,4mmHg (mediana 101,5) a 12±7,3mmHg (mediana 10) (p<0,0001). El descenso fue mayor en el grupo que recibió RVM (MMS 14,1±7,2mmHg, mediana 12 vs. MMS+RVM 6,6±4,2, mediana 8, p=0,0035).
Evolución del gradiente en el seguimiento
| Global n=29 | MMS n=22 | MMS+RVM n=8 | p | |
|---|---|---|---|---|
| Grad pre (mmHg) (media±DE; Me) | 103,6±24,4; 101,5 | 102,9±23,7; 100 | 105,6±27,8; 106 | <0,0001 |
| Grad post (mmHg) (media±DE; Me) | 12±7,3; 10 | 14,1±7,2; 12 | 6,6±4,2; 8 | |
| p=0,0035 | ||||
DE: desviación estándar; Grad post: gradiente poscirugía; Grad pre: gradiente precirugía; Me: mediana; mmHg: milímetros de mercurio; MMS: miectomía septal; n: número de pacientes; RVM: reemplazo valvular mitral.
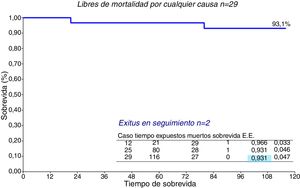
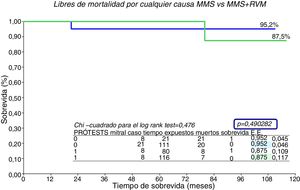
La supervivencia de la serie entera (n=29) (fig. 5) es del 93,1% a 10 años. Por grupos (fig. 6), no hubo diferencias significativas, el grupo de MMS presenta una supervivencia del 95,2% a 10 años frente al 87,5% de MMS+RVM, p=0,49.
La miocardiopatía hipertrófica es una enfermedad del sarcómero cardiaco que anatómicamente se manifiesta con un miocardio hipertrofiado en todas sus partes. Si cursa de forma no obstructiva la supervivencia es parecida a la de la población sana2,10, pero la presencia de hipertrofia asimétrica del SIV produce OTSVI, que es un factor independiente para el desarrollo de síntomas severos y progresión a fallo cardiaco y muerte10. La OTSVI es debida a dos componentes, la asimetría del septo hipertrofiado y el velo anterior mitral, que usualmente en estos pacientes tiene alteraciones sutiles, como ser más largo, tener cuerdas elongadas y con implantaciones anormales5. Este conjunto de alteraciones producen una redirección del flujo que empuja el velo anterior mitral hacia el SIV, es el SAM, y se traduce en OTSVI e IM5. Este mecanismo fisiopatológico explicado por Sherrid et al.5 (fig. 1) desbanca a la explicación de la IM debida al efecto venturi establecido previamente.
El tratamiento de esta enfermedad se puede abordar con diferentes estrategias, farmacológica, marcapasos y terapias de reducción septal (ablación septal con alcohol y MMS)3. El umbral para considerar el tratamiento invasivo es la presencia de un gradiente del TSVI≥50mmHg3, pero solo en aquellos pacientes con síntomas de moderados a graves (clase funcional NYHA III-IV) o síncope de esfuerzo recurrente a pesar de recibir tratamiento farmacológico a las dosis máximas toleradas3. El tratamiento invasivo que sigue siendo el gold estándar3,11 y que es un factor independiente asociado con la supervivencia2,11 es la MMS.
La MMS ha evolucionado desde los primeros intentos de Bigelow et al.6 en 1966, pasando por Morrow et al.7, hasta Messmer8 que realiza resección de músculo del SIV hasta la base de los músculos papilares. Nosotros hemos adoptado esta última técnica de MMS, tratando de extenderla lo máximo posible no solo en el espesor del SIV sino también en toda su longitud hasta llegar a la base de los músculos papilares, pues de acuerdo con la fisiopatología descrita por Sherrid et al.5 creemos que eliminando todo lo posible de SIV en espesor y longitud conseguiremos eliminar la obstrucción y redireccionar el flujo sanguíneo por su camino correcto evitando también el SAM y la consiguiente IM (fig. 1A y B). Nuestra vía de abordaje sigue siendo transaórtica, y aunque en bastantes ocasiones es una vía que reduce la visualización de las partes distales del SIV hemos conseguido buenos resultados. Existen otras vías alternativas como la transmitral; Wehman et al.12 obtienen buenos resultados con esta técnica. Para realizarla hay que seccionar el velo anterior mitral, se gana en visualización del SIV, pero asocia un riesgo de producir una alteración valvular grave donde no la había.
En nuestra serie hemos tenido que actuar en la válvula mitral de diferentes formas. En 14 de los 22 pacientes con MMS aislada (63,6%) se realizó plicatura de la válvula mitral 11 en sentido longitudinal y 3 en sentido transversal. En estos pacientes el velo anterior era redundante y consideramos adecuada su reducción. Los resultados parecen coincidir con los de Balaram et al.13, quienes realizan más plicatura transversal, y que abogan por realizarla en los segmentos elongados y no de forma sistemática, de la misma forma que nuestro grupo. En 8 de los pacientes de toda la serie (26,7%) hubo que proceder al RVM. En 4 se realizó la MMS y tras salida de circulación extracorpórea se comprobó la persistencia de una IM>II por lo que se procedió al RVM; en los otros 4 pacientes se procedió a implante directo de prótesis mitral tras MMS debido las alteraciones estructurales (displasia, calcificación) presentes. Los pacientes con MMS+RVM tenían mayor espesor de SIV (MMS 24,14±3mm vs. MMS+RVM 27±1,3mm, p=0,0009), más presencia de enfermedad valvular mitral (MMS 40,9% vs. MMS+RVM 100%, p=0,003), mayor grado de IM (grado iv) (MMS 13,6% vs. MMS+RVM 87,5%, p=0,002) y peor grado funcional (NYHA IV: MMS 31,8% vs. MMS+RVM 75%, p=0,034). En estos pacientes, la mayor afectación clínica y severidad de la enfermedad valvular mitral condicionó la posibilidad de la corrección de la IM realizando solamente la MMS. Según la Guía de práctica clínica de la ESC 20143 en este tipo de pacientes existe una recomendación iia de RVM. La pregunta que nos hacemos es, sí se hubieran derivado antes a cirugía de reducción septal ¿se habría podido evitar implantar una prótesis mitral? Nuestro grupo considera que algunos pacientes son remitidos para tratamiento quirúrgico en fases muy avanzadas de la enfermedad, esto limita las opciones terapéuticas más conservadoras, debiendo proceder al RVM. Un posible origen de esta situación puede ser el desconocimiento por parte de la cardiología de que la MMS tiene buenos resultados con un riesgo quirúrgico bajo.
En las grades series norteamericanas el riesgo quirúrgico oscila del 0,3 al 1,1%1,9; son centros de referencia donde llevan realizando este procedimiento años. Nuestra mortalidad ha sido de un paciente (3,3%) y aunque el motivo está relacionado con la cirugía, no se debió a un infarto agudo de miocardio, una comunicación interventricular o un sangrado posquirúrgico, sino a una hemorragia pulmonar por el catéter de Swan Ganz. La reoperación por sangrado fue la complicación más frecuente y ocurrió en 2 pacientes (6,7%) en los que el resto del postoperatorio transcurrió sin eventos. Son cifras que están alejadas de las grandes series, pero hay que tener en cuenta nuestro tamaño muestral más reducido. De otra manera, los resultados clínicos y de supervivencia son comparables a los de estos centros. A lo largo de un seguimiento medio de 43,7±36,3 meses la mejoría de la clase funcional ha sido significativa, pasando de NYHA IV (43,3%) y III (56,7%) precirugía a NYHA II (24,1%) y I (75,9%) poscirugía (p<0,0001), así como la reducción del gradiente intraventricular de 103,6±24,4mmHg (mediana 101,5) a 12±7,3mmHg (mediana 10) (p<0,0001). El gradiente se redujo significativamente más en el grupo MMS+RVM; la explicación se debe a la prótesis mitral, esta elimina uno de los componentes que facilitan la obstrucción que es el velo anterior mitral. En ocasiones, con la MMS aislada puede persistir algo de SAM en el borde del velo, y aunque no condiciona IM, sí puede producir cierta aceleración en el TSVI.
La supervivencia global de la serie a 10 años ha sido del 93,1%, solo fallecieron 2 pacientes, uno de cada grupo por causas no cardiológicas. El grupo MMS presenta una supervivencia del 95,2% frente a un 87,5% de MMS+RVM, p=0,49. El hecho de recibir prótesis mitral no tiene impacto en la supervivencia siendo similar a la del otro grupo. No obstante, el tamaño muestral es reducido para sacar conclusiones, pues es sabido que los pacientes portadores de prótesis tienen más riesgo de complicaciones relacionadas con las mismas. Estos resultados de supervivencia son concordantes con los de los centros de gran volumen1,2,9–11. En España no hay muchos centros dedicados al tratamiento quirúrgico de la MHO, por lo tanto las series que encontramos son reducidas en tamaño; Castedo et al.14 y Heredia et al.15 publican series españolas donde los resultados son similares a los presentados por nuestro grupo. Probablemente los centros de referencia tienen un papel beneficioso en la mejora del tratamiento de la MHO, sin embargo, siendo nuestra supervivencia comparable a la de las grandes series norteamericanas con un riesgo aceptable, podemos pensar que aunque la MMS no se realice en un volumen tan grande sí se hace de forma adecuada, aportando beneficios clínicos y de supervivencia importantes para los pacientes.
ConclusionesEl tratamiento quirúrgico de la MHO con MMS tiene un impacto muy beneficioso en la clínica y supervivencia de estos pacientes, sin embargo, la degeneración valvular mitral, en nuestra serie, obliga con frecuencia a implante protésico mitral. Es posible que si los pacientes son remitidos a tratamiento quirúrgico de forma más precoz, se evite encontrar válvulas severamente patológicas, permitiendo su conservación. Puede presuponerse que el RVM debe tener impacto en la supervivencia, pero con o sin prótesis mitral, la cirugía en MHO ofrece buena supervivencia y mejoría clínica a largo plazo.
LimitacionesLas principales limitaciones de este estudio están en el tamaño muestral. Los grandes centros norteamericanos tienen unos resultados excelentes porque tienen un gran volumen de este tipo de cirugías al ser centros de referencia. El tamaño muestral pequeño tiene un impacto grande en la mortalidad, la nuestra es superior a la de las publicaciones norteamericanas, pero la evolución clínica y del gradiente sigue el mismo curso favorable que en estos centros de gran volumen a pesar del tamaño más reducido de nuestra muestra.
FinanciaciónHo hay fuente de financiación
Conflicto de interesesNo tenemos conflicto de intereses.