Existen pocas actuaciones quirúrgicas en la enfermedad cardiovascular cuya contribución a la calidad y duración de la vida del paciente sea tan clara como la corrección de la valvulopatía aórtica. En los países desarrollados, la estenosis aórtica (EAo) es la enfermedad valvular de mayor prevalencia. Al ser una manifestación del envejecimiento, esta valvulopatía es cada vez más frecuente, en tanto que la esperanza de vida de la población aumenta. La EAo grave sintomática es fatal si no se trata quirúrgicamente, por el contrario, si se interviene en su debido momento, el pronóstico es excelente. Existe controversia en distintos temas relacionados con la EAo, como en el manejo médico de la enfermedad, el momento de la intervención en pacientes asintomáticos y en aquellos con enfermedad muy avanzada, y el papel del tratamiento percutáneo. La incidencia de IAo clínicamente significativa aumenta con la edad, con un pico en la cuarta-sexta décadas. La prevalencia de la misma en el estudio Framingham fue del 4,9%, con regurgitación moderada o grave en el 0,5%. En los pacientes jóvenes la primera opción de tratamiento a considerar debe ser la reparación aórtica, seleccionando cuidadosamente la técnica apropiada dependiendo del análisis de la válvula y de la raíz aórtica. El campo de los procedimientos intervencionistas quirúrgicos y/o percutáneos para el tratamiento de la valvulopatía aórtica ha crecido de forma marcada en los últimos años, y es preciso que tanto pacientes como especialistas cardiólogos y cirujanos cardiovasculares estén al tanto de estas nuevas opciones.
There are few cardiovascular disease entities that have as an impressive contribution to improved quality and duration of life as aortic valve disease correction. In developed countries, aortic stenosis (AS) is the most prevalent of all valvular diseases. A manifestation of ageing, this disorder is becoming more frequent as the age of the population increases. Symptomatic severe AS is fatal if left untreated, yet is consistent with a typical lifespan when mechanical relief of the stenosis is provided in a timely manner. Management of mild disease, severe asymptomatic disease, and advanced disease, and the effect of new percutaneous treatments, provide both controversy and promise to care of patients with AS. The incidence of clinically significant aortic regurgitation increases with age, typically peaking in the fourth to sixth decade of life. The prevalence of aortic regurgitation in the Framingham study was reported to be 4.9%, with regurgitation of moderate or greater severity occurring in 0.5%. For younger patients aortic valve repair should be the first choice procedure with careful selection of the appropriate approach based on the analysis of the valve and aortic root anatomy. The scope of procedures for aortic valve disease has increased markedly over the last years, and patients and cardiovascular physicians need to be aware of these newer options. We discuss these issues in this review.
La valvulopatía aórtica constituye la indicación más frecuente de sustitución valvular en nuestro medio, debido sobre todo a las EAo seniles o degenerativas. La EAo es la valvulopatía más frecuente en los países desarrollados. La EAo grave tiene una prevalencia del 2–4% en las personas de más de 75 años de edad1. La etiología más común en nuestro medio es la degenerativa, que en los menores de 70 años suele ocurrir sobre una válvula aórtica bicúspide y en los pacientes más mayores sobre una válvula trivalva.
La insuficiencia aórtica (IAo), sin embargo, es mucho menos frecuente, con una prevalencia de IAo moderada o grave de aproximadamente el 0,5% en el estudio Framingham.
Estenosis aórticaEtiologíaLa causa más frecuente de esta valvulopatía en adultos es la calcificación de una válvula trivalva o de una válvula bicúspide congénita2. Esta calcificación progresa desde la base al borde libre de las valvas causando una disminución en la apertura y movilidad de las mismas, sin fusión comisural. La EAo degenerativa es una enfermedad crónica activa que se caracteriza por el depósito de lípidos, la inflamación y la calcificación de las valvas, proceso similar al de la aterosclerosis, con la que comparte muchos factores de riesgo1. Una etiología mucho menos frecuente en los países desarrollados es la reumática, con fusión y calcificación comisural, y que se acompaña invariablemente de afectación mitral.
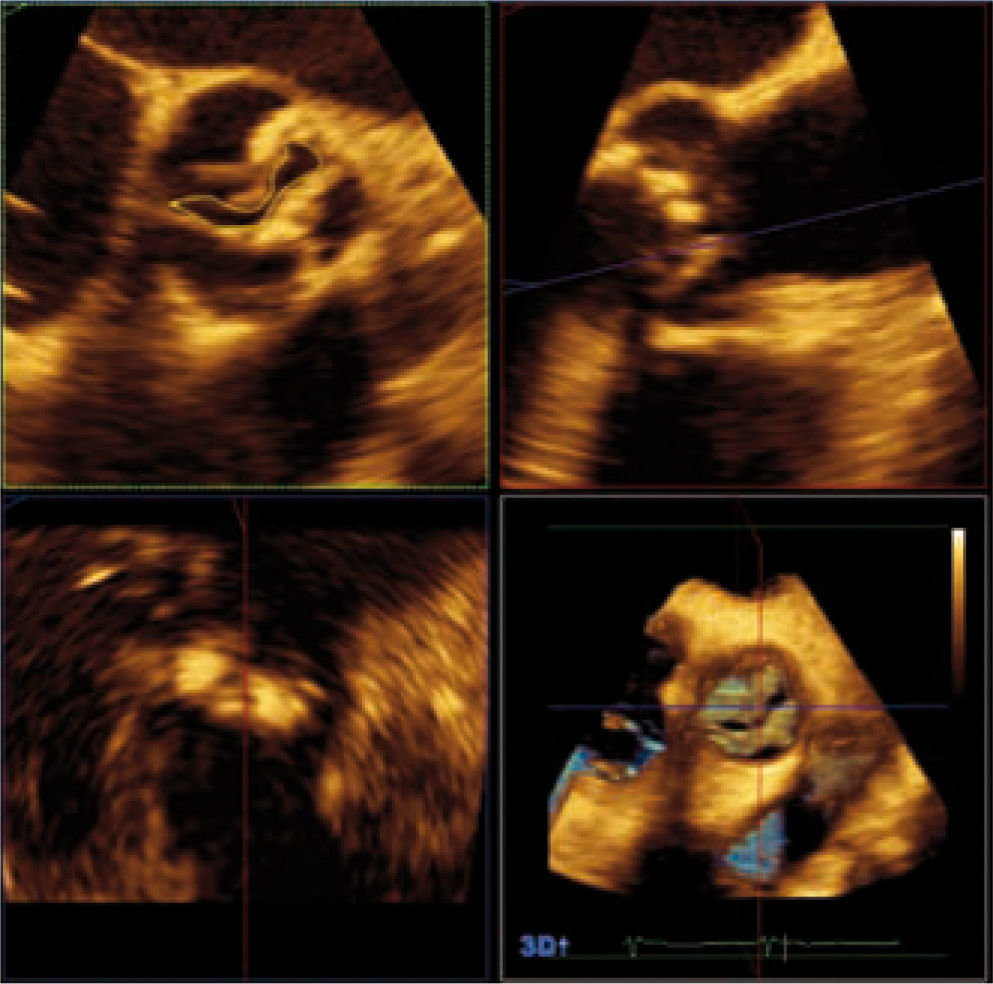
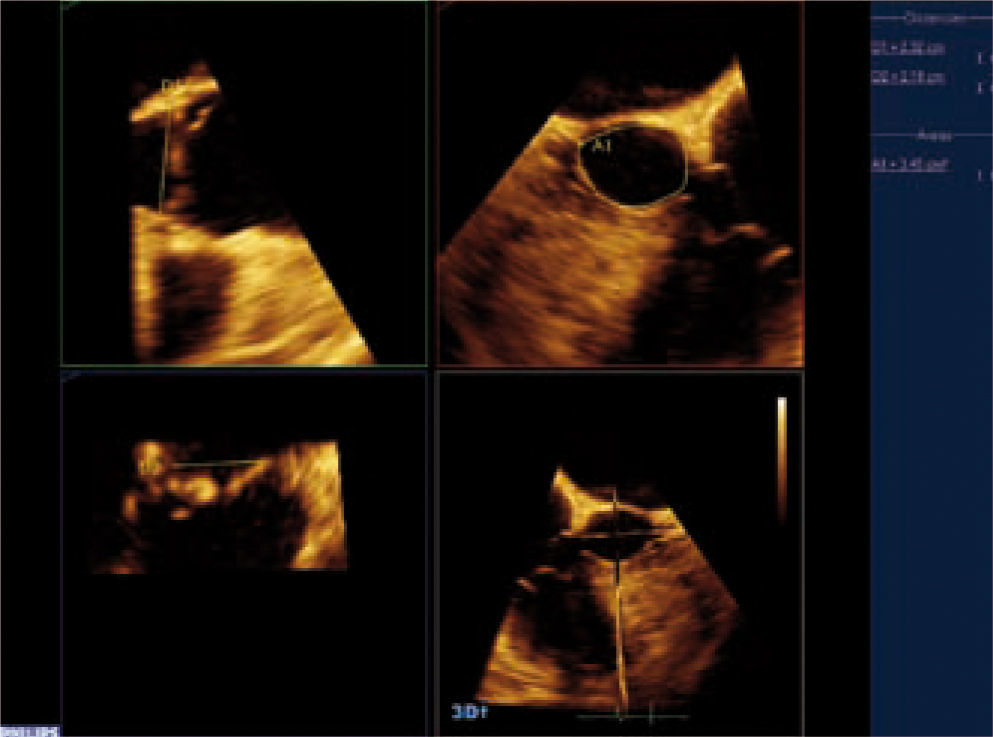
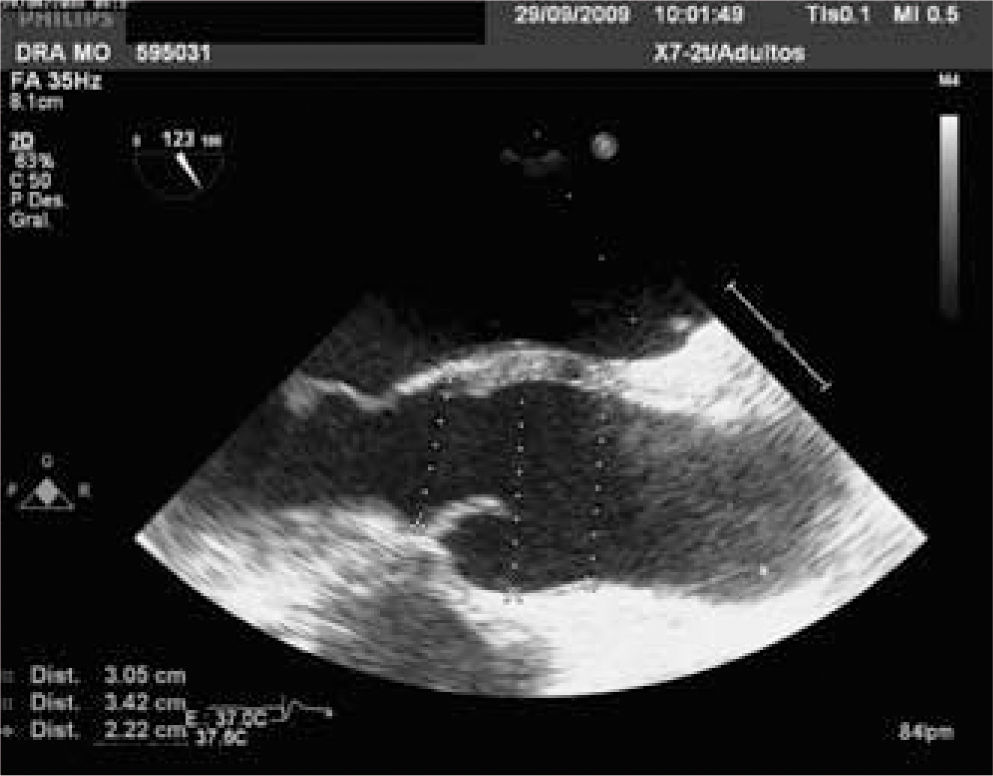
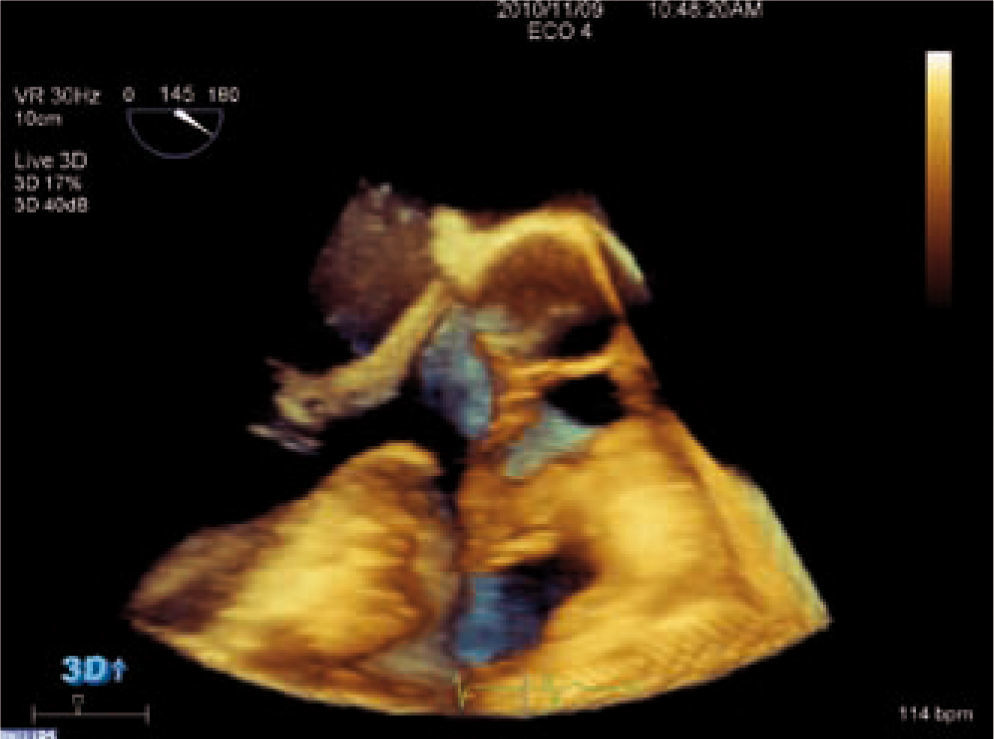
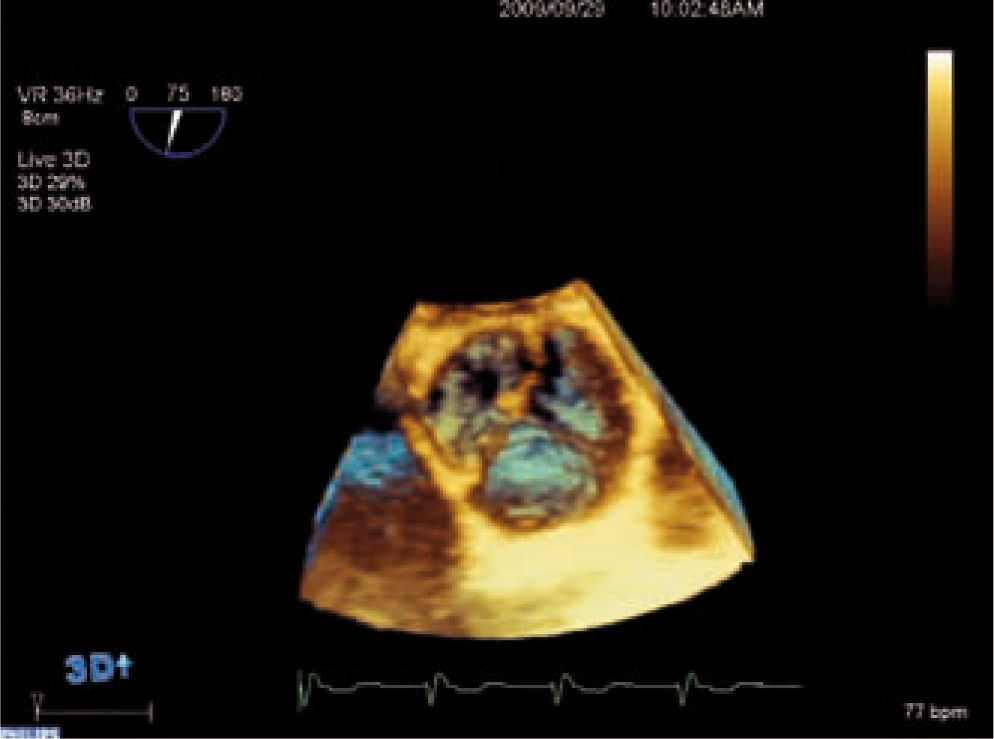
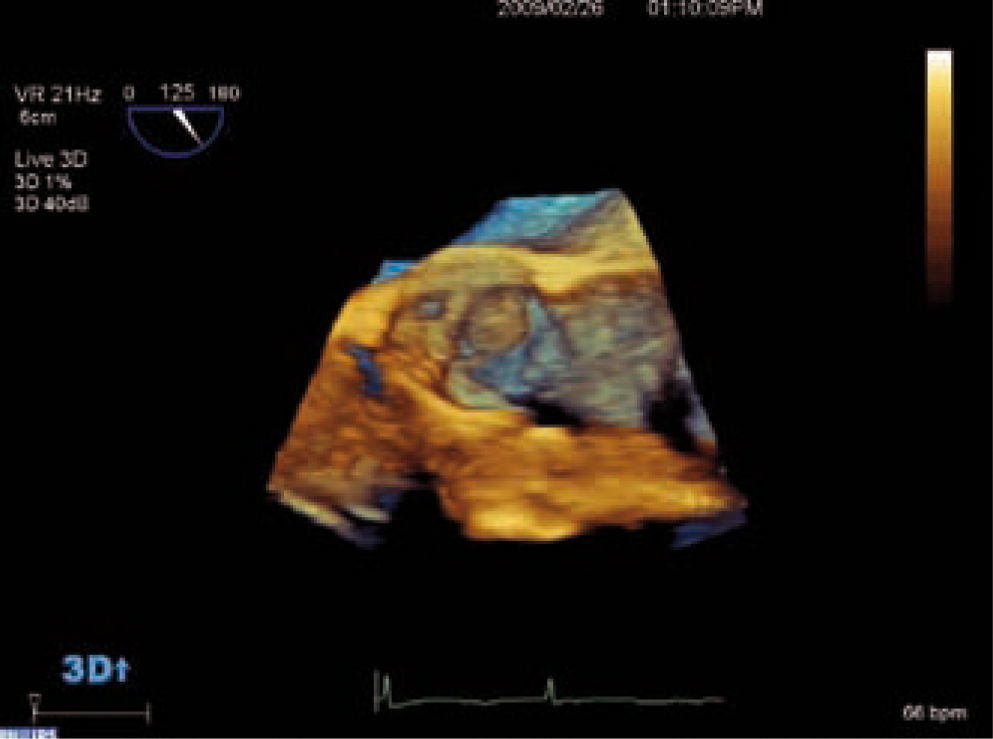
DiagnósticoEl ecocardiograma es la técnica de elección para el diagnóstico de la valvulopatía aórtica, ya que permite valorar anatómicamente la válvula, determinar su gravedad y ver la repercusión hemodinámica sobre el ventrículo izquierdo (VI) de forma rápida, segura y reproducible3. El ecocardiograma transesofágico (ETE) puede ser útil en casos dudosos, ya que permite medir el área valvular siempre que la válvula no esté muy calcificada. Con las nuevas tecnologías podemos valorar la válvula aórtica por ecocardiograma tridimensional, lo que nos aporta más información acerca de su anatomía y gravedad de la estenosis, podemos obtener la válvula en tres planos ortogonales y medir con mayor precisión el área valvular como se muestra en la figura 1.
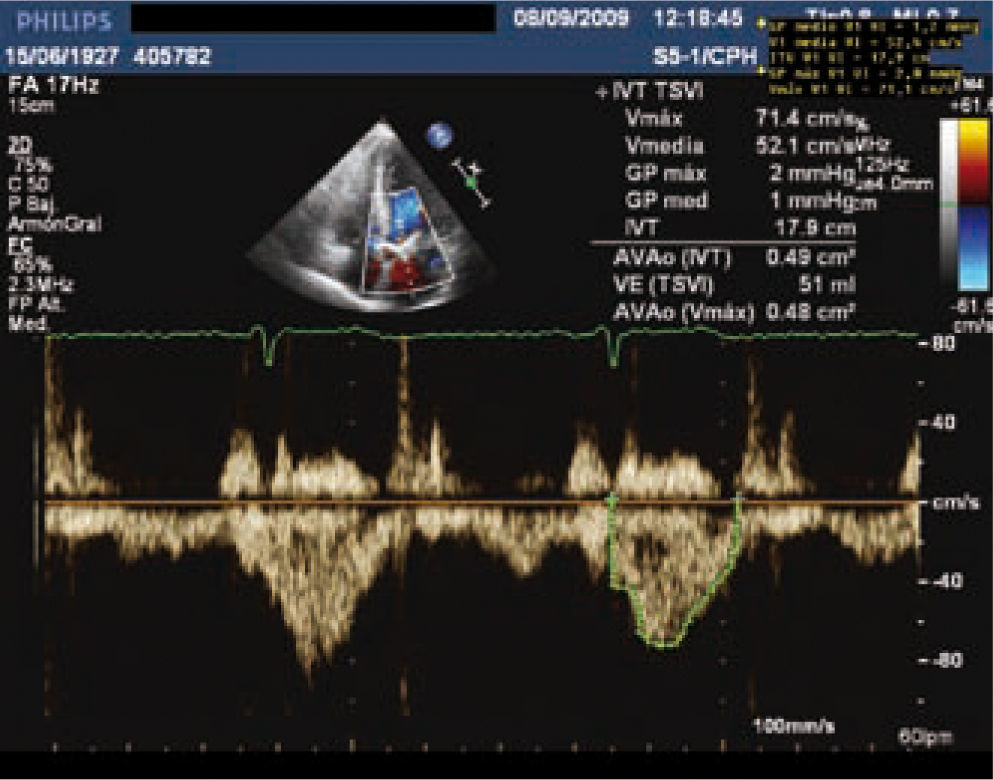
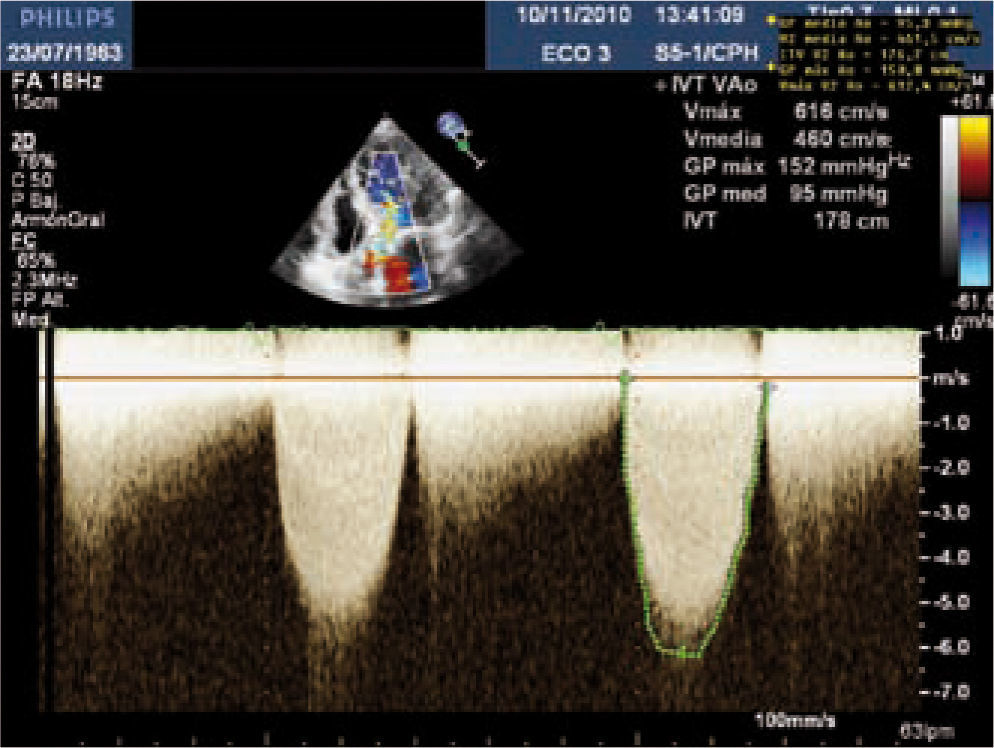
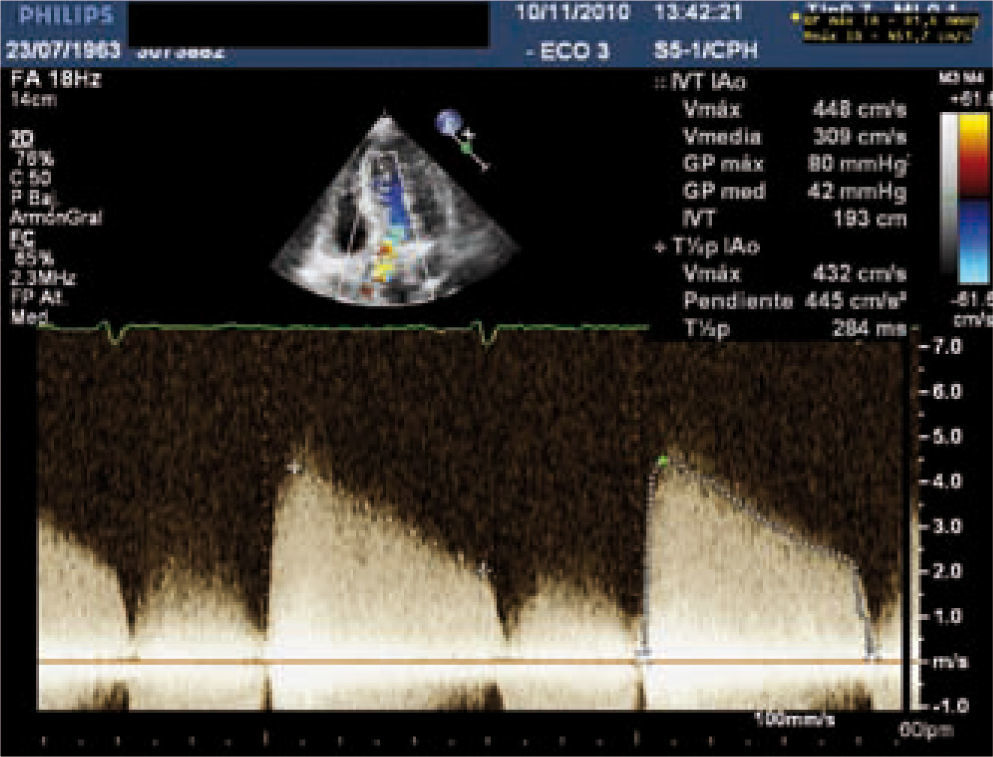
Para diagnosticar una EAo grave debemos aportar tanto el área valvular como medidas de flujo, entre éstas la más validada es el gradiente medio. Una EAo es grave cuando el área valvular es menor de 1cm2 y el gradiente medio transvalvular es mayor de 40mmHg, como se esquematiza en la tabla I. Las mediciones que realizamos habitualmente en la valoración cuantitativa de la EAo se muestran en las figuras 2–5. El ETE 3D es fundamental en la medición del tracto de salida del VI (TSVI) previo al implante de una prótesis por vía percutánea (Fig. 6), además de para guiar estos procedimientos.
Gradación de la eao
| Esclerosis aórtica | Estenosis leve | Estenosis moderada | Estenosis grave | |
| Velocidad máxima del jet (m/s) | ≥ 2,5 | 2,6–2,9 | 3,0–4,0 | > 4 |
| Gradiente medio (mmHg) | < 20 | 20–40 | > 40 | |
| Área valvular (cm2) | > 1,5 | 1,0–1,5 | < 1 | |
| Área valvular indexada (cm2/m2) | > 0,85 | 0,6–0,85 | < 0,6 | |
| Ratio de velocidades | > 0,5 | 0,25–0,5 | < 0,25 |
La realización rutinaria de cateterismo ya no se recomienda; excepto en los raros casos en los que el ecocardiograma no es diagnóstico, la coronariografía prequirúrgica se debe realizar en determinados pacientes (Tabla II).
Indicaciones de coronariografía prequirúrgica en las valvulopatías en general según la sociedad europea de cardiología
| Indicación | Clase |
| Antes de la cirugía en pacientes con valvulopatía grave y cualquiera de los siguientes: | |
| Antecedentes de cardiopatía isquémica | IC |
| Sospecha de isquemia miocárdica por: | IC |
| Clínica de dolor torácico típico o pruebas incruentas sugestivas | |
| Disfunción sistólica del VI | IC |
| Varones ≥ 40 años | IC |
| Mujeres posmenopáusicas | IC |
| Presencia de ≥ 1 FRCV | IC |
VI: ventrículo izquierdo; FRCV: factor de riesgo cardiovascular.
El paciente con EAo no suele presentar sintomatología hasta que la valvulopatía está avanzada. La tríada clásica de síntomas consiste en: angina, disnea y síncope. La mortalidad de la EAo asintomática es baja, sin embargo, cuando se desarrolla la clínica aumenta de forma dramática, presentando un paciente sintomático una mortalidad anual del 25%. La supervivencia media de un paciente con EAo y angina es de 5 años, con síncope 3 años y con disnea 2 años2. Po ello, debe operarse a todo paciente con EAo (salvo contraindicación o rechazo del paciente) en cuanto presente síntomas. La duda es si debemos intervenir a los pacientes asintomáticos y cuándo.
Las razones para remitir a cirugía a un paciente con EAo grave asintomático son múltiples: prevenir la muerte súbita (< 1% anual en pacientes asintomáticos), prevenir el daño miocárdico irreversible en forma de hipertrofia y la evolución a fibrosis del VI y no retrasar la intervención en pacientes que sospechemos que van a tener una peor evolución.
Según recientes publicaciones, un 30% de los pacientes asintomáticos van a desarrollar síntomas en los 2 años siguientes al diagnóstico4. De los que no desarrollan síntomas el riesgo de muerte súbita es del 1%/año. En pacientes asintomáticos el riesgo de la intervención es menor (3% en clase funcional [CF] I–II vs 7% en III-IV), pero ésta también supone una prótesis y sus complicaciones.
Existen distintos factores que se han relacionado con una más rápida progresión de la enfermedad y una peor evolución: la velocidad pico con Doppler continuo a través de la válvula y su progresión en ecocardiogramas seriados, el grado de calcificación de la válvula5, el péptido natriurético auricular (BNP) y la respuesta del paciente al esfuerzo6.
En un artículo clásico5 en el que se siguió a 128 pacientes asintomáticos con EAo grave durante una media de 22meses, la aparición de muerte o sustitución valvular fue significativamente mayor en aquellos pacientes con calcificación valvular moderada o grave (92 vs 60% a 1 año y 75 vs 20% a 4 años; p < 0,001), con mayor velocidad pico transvalvular (≥ 4,5m/s) y mayor tasa de progresión de la misma. Dentro de los pacientes con válvulas moderada o gravemente calcificadas, el 79% de aquellos cuya velocidad pico aumentó más de 0,3m/s al año necesitó intervención o falleció en los 2 años de seguimiento.
La respuesta al ejercicio fue evaluada por Das, et al.6 en 125 pacientes con EAo grave, que demostraron la utilidad de la ergometría para predecir la aparición de síntomas en 12meses: la tercera parte de los pacientes presentaron síntomas durante la prueba, un 23% tuvo una respuesta plana o descendente de la tensión arterial (TA) sistólica, y en un 26% descendió el segmento ST más de 2mm. No hubo muertes en el seguimiento; un 29% desarrollaron síntomas. El descenso de la TA y el del ST no eran buenos predictores de mala evolución, al contrario que el desarrollo de síntomas, principalmente en menores de 70 años con vida activa. Lo más útil fue el valor de la ergometría sin síntomas, que en un 87% de casos predice con seguridad que no van a desarrollarse éstos en el año siguiente.
En un artículo reciente, Monin, et al.7 siguieron a 107 pacientes con EAo grave asintomática durante 24meses y comprobaron que tanto el sexo femenino como los valores de BNP y la velocidad pico transvalvular se relacionaron en el análisis multivariante con una peor evolución.
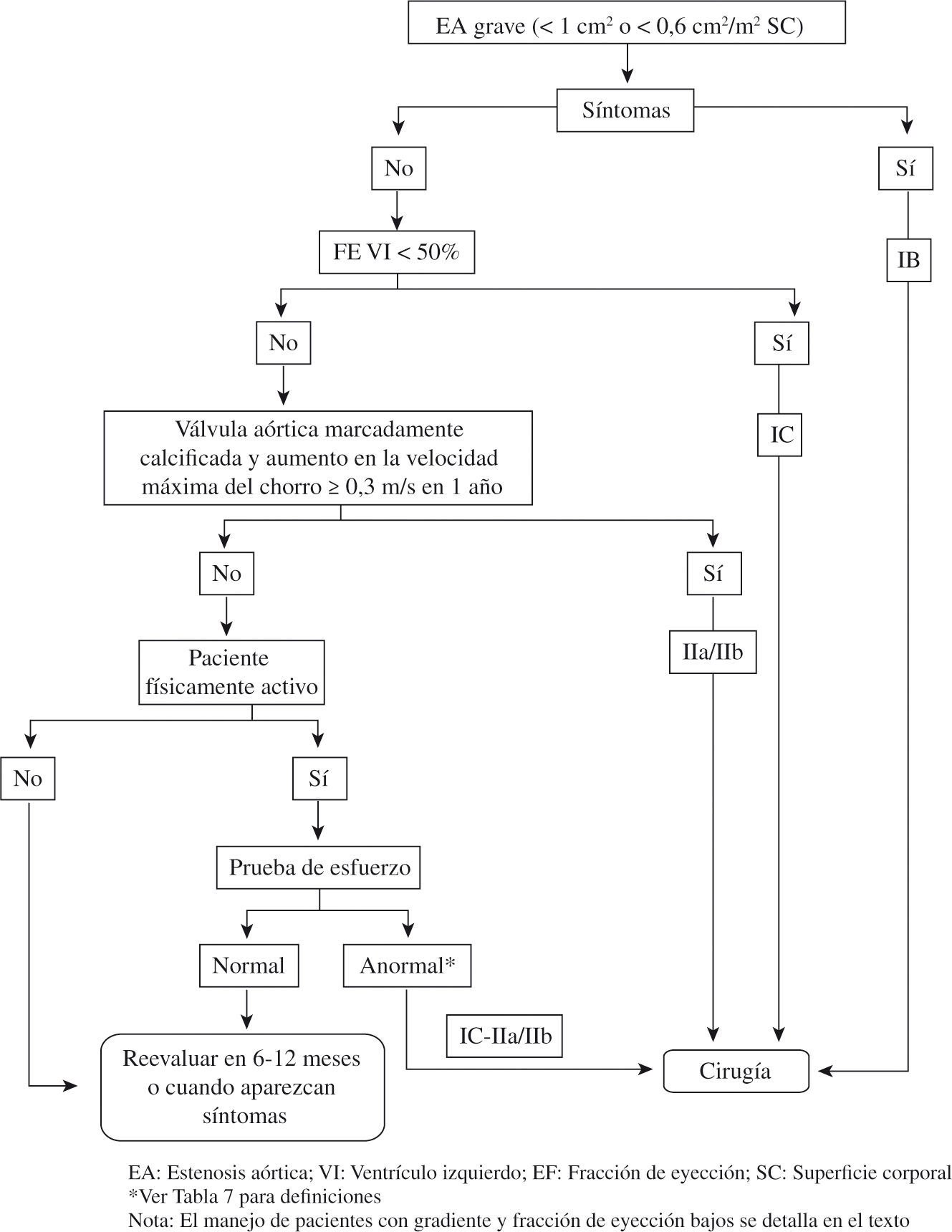
Indicaciones de cirugía de sustitución valvular en la estenosis aórticaLas indicaciones vigentes de las sociedades científicas para la cirugía de la EAo son las que se muestran en la figura 7 y en la tabla III1,8. Una vez que se define la EAo como grave con un área valvular de menos de 1cm2, si el paciente está sintomático la indicación de cirugía es clara (IB). En el caso de pacientes asintomáticos valoraremos la fracción de eyección del ventrículo izquierdo (FEVI); si ésta es inferior a 50% como consecuencia de la EAo, estará indicada la sustitución valvular (IC). Si la FEVI es normal y la válvula está muy calcificada o el pico de velocidad transvalvular aumenta a una tasa de más de 0,3m/s anual la indicación de cirugía es IIaC para las guías europeas y IIbC para las americanas. Si no es así y el paciente es físicamente activo, contemplaremos la realización de una ergometría, que si es anormal (si se desarrollan síntomas atribuibles a la EAo con el esfuerzo IC o si desciende la TA IIaC) indicará la intervención. Si la ergometría es normal reevaluaremos al paciente en 6–12meses salvo que presente alguna otra indicación: si se va a operar de otra intervención valvular, coronaria o de aorta ascendente sería clase IC si la EAo es grave y IIaC si es moderada.
Indicaciones de cirugía en la eao según la sociedad europea de cardiología
| Indicación | Clase |
| EAo grave sintomática | IB |
| EAo grave asintomática que se va a intervenir de otra enfermedad cardíaca | IC |
| EAo grave asintomática con FEVI reducida < 50% no debida a otra causa | IC |
| EAo grave asintomática con síntomas provocados por la ergometría | IC |
| EAo grave asintomática con caída de la TA con respecto a la basal en ergometría | IIaC |
| EAo moderada asintomática que se va a intervenir de otra enfermedad cardíaca | IIaC |
| EAo grave asintomática con calcificación valvular moderada-grave y progresión > 0,3m/s al año | IIaC |
| EAo grave sintomática de bajo gradiente con RC | IIaC |
| EAo grave asintomática con arritmias ventriculares complejas en la ergometría | IIbC |
| EAo grave asintomática con hipertrofia ventricular de ≥ 15mm sin HTA | IIbC |
| EAo grave sintomática de bajo gradiente sin RC | IIbC |
FEVI: fracción de eyección del VI; HTA: hipertensión arterial; RC: reserva contráctil.
Un caso especial lo constituyen los pacientes con EAo grave con área reducida pero con gradiente medio inferior a 40mmHg y disfunción sistólica ventricular izquierda, que representan un 5% del conjunto de las EAo. Estos pacientes presentan de por sí un peor pronóstico que el resto9. Para distinguir entre los casos con una verdadera EAo con gradiente reducido debido a disfunción del VI y la seudoestenosis de una válvula que no está muy afectada pero que no se abre debido a la disfunción sistólica se utiliza el ecocardiograma con dobutamina a bajas dosis. En la EAo verdadera con reserva contráctil (RC) la FEVI aumentará con la dobutamina, el gradiente aumenta y se hace superior a 30mmHg y el área aórtica se queda igual o aumenta menos de 0,3mm2. Sin embargo, si estamos ante una seudo-EAo al mejorar la FEVI con la dobutamina, el área aumenta más de 0,3cm2, y no así el gradiente medio. En el primer caso la solución es la cirugía de sustitución valvular aórtica y en el segundo el tratamiento de su miocardiopatía de base. Existe una tercera posibilidad que es que a pesar de la dobutamina la función ventricular no mejore; estaríamos ante la ausencia de RC, lo que implica el peor pronóstico dentro de este grupo de pacientes. La cirugía de la EAo grave de bajo gradiente con RC sería indicación IIaC en las guías europeas y IIbC para la American Heart Association (AHA).
En un estudio de Monin, et al.10 se dividió a 136 pacientes con EAo grave sintomática con área igual o inferior a 1, gradiente medio igual o inferior a 40 e índice cardíaco reducido, FEVI media 30%, según la presencia o no de RC, definida como presente si el volumen de eyección aumentaba más del 20% con la infusión de dobutamina. La decisión de intervención se dejó en manos de su médico. Se vio que la mortalidad quirúrgica de los pacientes intervenidos era significativamente mayor en aquellos sin RC (32 vs 5%), siendo la ausencia de RC y el gradiente medio inferior a 20mmHg los predictores de mortalidad en el análisis multivariante. Los pacientes con RC que se operaron, además, mejoraron significativamente su clase funcional y la FEVI después de la intervención11.
La mortalidad de la cirugía de sustitución valvular aórtica varía dependiendo del centro y sobre todo de las características del paciente. Globalmente, según se refleja en las guías europeas8, la mortalidad quirúrgica del reemplazo aórtico aislado está entre el 2,7–3,7%, y aumenta si se asocia cirugía de revascularización miocárdica hasta un 4,3–7% dependiendo de las fuentes consultadas. La decisión de realizar la intervención debe tomarse entre el propio paciente, su cardiólogo clínico y el cirujano, individualizando el riesgo de cada paciente. Actualmente disponemos de alternativas válidas a la cirugía en pacientes de riesgo elevado o que son rechazados por distintas razones para la cirugía abierta, como son el implante percutáneo o transapical de una prótesis, con muy buenos resultados en pacientes que, dejados a su evolución natural, presentan una elevada mortalidad a corto-medio plazo.
ConclusionesLa EAo es la valvulopatía más frecuente, y su prevalencia va a seguir aumentando con el envejecimiento de la población. Existen nuevas técnicas de imagen, como el ecocardiograma en 3D, que nos aportan un mayor conocimiento de la enfermedad valvular y una mejor definición de su gravedad.
Actualmente son pocas las razones para no operar a un paciente con EAo grave sintomático, y serán menos con el pleno desarrollo de las nuevas tecnologías de implante percutáneo o transapical. Tendremos que incorporar nuevos predictores de riesgo de evolución en pacientes asintomáticos, como el BNP, en nuestra práctica clínica.
Insuficiencia aórticaEtiologíaLa IAo es una valvulopatía mucho menos frecuente que la EAo, siendo la prevalencia de IAo moderada o grave en el estudio de Framingham alrededor del 0,5%. La etiología puede dividirse en dos grupos1 (dentro de cada uno ordenado por importancia):
- –
La asociada a enfermedad de la aorta:
- •
Dilatación idiopática de la raíz aórtica.
- •
Síndrome de Marfan.
- •
Hipertensión arterial.
- •
Disección aórtica.
- •
- –
La enfermedad propia de la válvula:
- •
Congénita: válvula aórtica bicúspide.
- •
Degenerativa o senil.
- •
Reumática.
- •
Mixomatosa-prolapso.
- •
Endocarditis infecciosa.
- •
Otras causas menos frecuentes incluyen: traumatismo, espondilitis anquilopoyética, aortitis sifilítica, artritis reumatoide, osteogénesis imperfecta, aortitis de células gigantes, síndrome de Ehlers-Danlos, síndrome de Reiter, estenosis subaórtica, comunicación interventricular con prolapso de una valva y algunos fármacos anorexígenos.
La IAo suele presentarse como un proceso crónico de instauración progresiva aunque en ocasiones puede debutar como un proceso agudo como en el caso de la disección aórtica y la endocarditis infecciosa, con clínica de insuficiencia cardíaca grave.
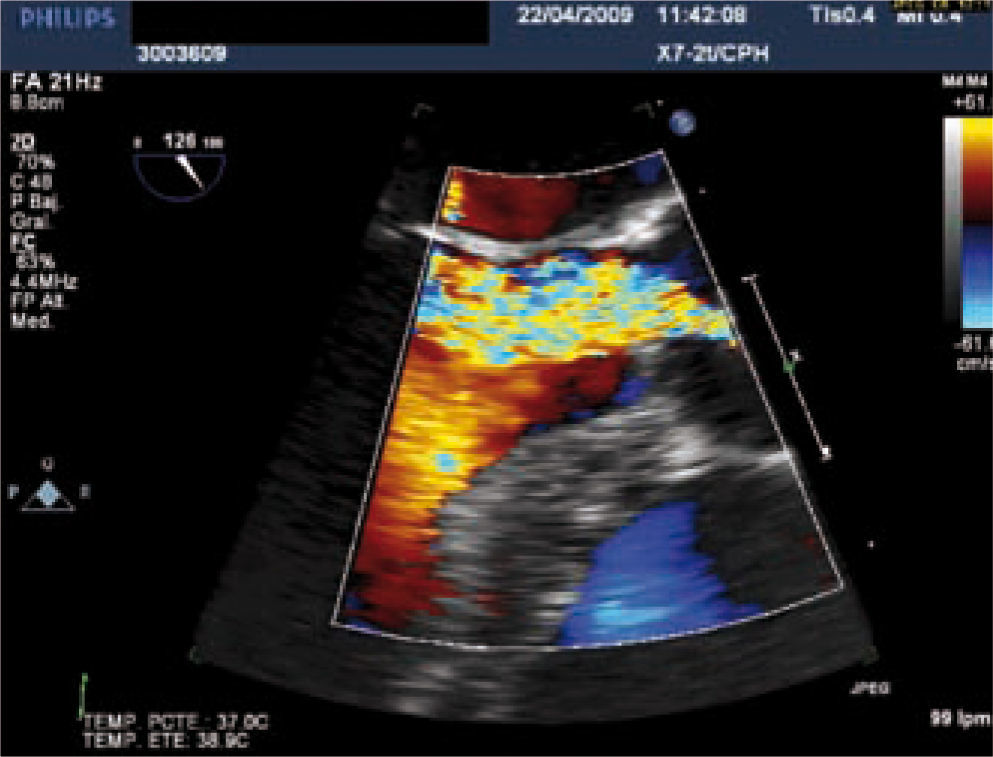
DiagnósticoLa técnica diagnóstica de elección, al igual que en la EAo, es el ecocardiograma (Figs. 8 y 9). Los criterios de gravedad de la IAo se muestran en la tabla IV. El ecocardiograma transtorácico (ETT) nos permite valorar la válvula anatómicamente para definir la causa de la IAo, estimar su gravedad y evaluar su repercusión hemodinámica. La valoración del VI es obligada, ya que su dilatación y/o disfunción traducen repercusión hemodinámica de la IAo y sientan la indicación de intervención quirúrgica. Debemos medir también la aorta ascendente como parte del estudio, ya que en muchos casos su dilatación es la causa de la IAo. En la figura 10 se muestran las medidas rutinarias de la aorta ascendente.
Gradación de la iao1
| Grado de insuficiencia aórtica | |||
| Leve | Moderada | Grave | |
| Cualitativo | |||
| Grado angiográfico | 1+ | 2+ | 3–4+ |
| Anchura del jet por Doppler color | < 25% del TSVI | 25–65% | > 65% del TSVI |
| Vena contracta (cm) | < 0,3 | 0,3–0,6 | > 0,6 |
| Cuantitativo | |||
| Volumen regurgitante | < 30ml | 30–60ml | > 60ml |
| Fracción regurgitante | < 30% | 30–49% | > 50% |
| Orificio de regurgitación (ORE) | < 0,1cm2 | 0,1–0,3cm2 | > 0,3cm2 |
| Criterios adicionales | |||
| Tamaño VI | Aumentado | ||
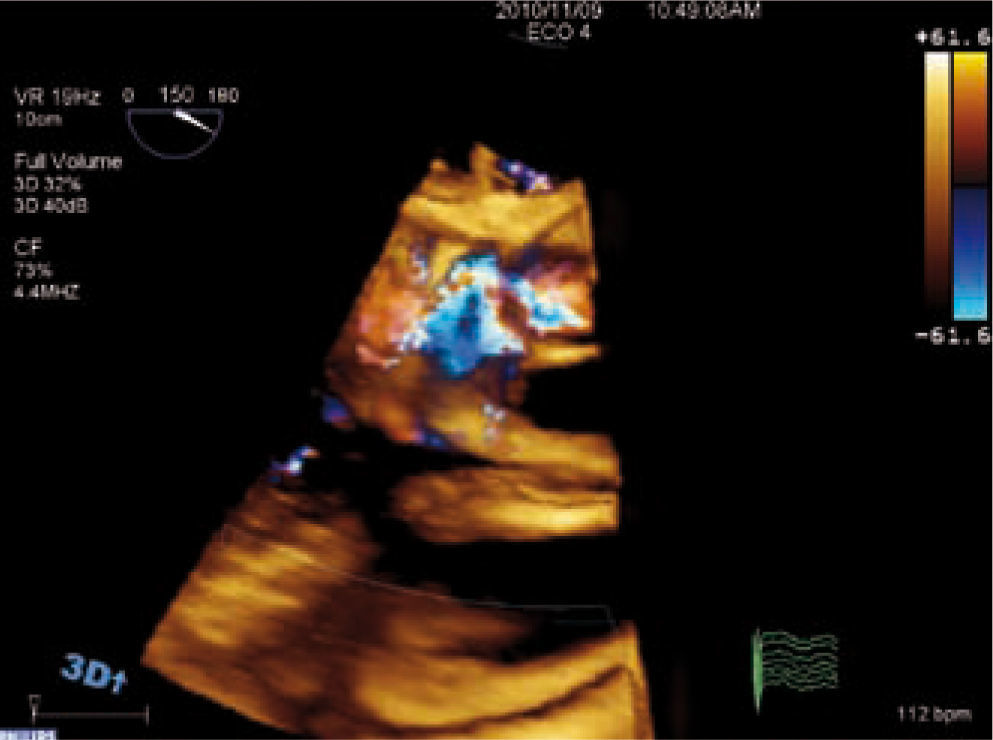
El ETE nos aporta información más detallada de la anatomía valvular y es necesario en casos en los que el ETT no sea diagnóstico. Con el ETE 3D podemos analizar la válvula y el chorro de IAo con mayor precisión (Figs. 11–14).
La gravedad de la IAo se puede valorar también mediante angiografía en los casos dudosos, o en casos en los que se va a hacer coronariografía prequirúrgica (Tabla II); también podemos medir de esta manera la raíz aórtica. Otras técnicas diagnósticas que nos permiten medir de forma más exacta la raíz aórtica y el resto de la aorta son la angiotomografía computarizada y la angiorresonancia magnética, que son las que recomiendan las distintas sociedades científicas para el seguimiento de la dilatación de la aorta ascendente13.
Historia naturalLa IAo supone una sobrecarga crónica de volumen para el VI, que se adapta dilatándose progresivamente y desarrollando hipertrofia excéntrica. La FEVI se mantiene normal hasta estados avanzados de la enfermedad en los que se sobrepasa su capacidad de adaptación y comienza a reducirse. Los pacientes con IAo crónica pueden no presentar síntomas hasta ese momento. El síntoma más común es la disnea, seguido de dolor torácico que puede ser de esfuerzo o de reposo. La IAo aguda suele presentarse como un cuadro de IC aguda con edema agudo de pulmón, en ocasiones shock cardiogénico, con silueta cardíaca muchas veces normal en la radiografía de tórax; el soplo de IAo en estos casos puede ser muy suave, por lo que el diagnóstico no es sencillo.
El conocimiento acerca de la evolución de la IAo está basada en estudios antiguos1,12, 593 pacientes, con un seguimiento medio de 6,6 años. En pacientes asintomáticos con IAo grave y FEVI normal, el número de eventos es escaso:
- –
Desarrollo de disfunción de VI en menos del 1,3% anual.
- –
Muerte súbita inferior al 0,2% anual.
- –
Síntomas, empeoramiento de FEVI o muerte: 4,3% anual.
La edad avanzada, el diámetro telesistólico del VI (DTSVI) superior a 50mm o a 25mm/m2 y la disfunción sistólica del VI son predictores pronósticos. La tasa anual de eventos es del 19% si el DTSVI es superior a 50mm frente a un 6% entre 40–50mm y 0% por debajo de 40mm. La disfunción del VI se asocia a una tasa anual de eventos del 25%. Sin embargo, en pacientes sintomáticos la mortalidad aumenta, siendo de más del 10% anual si el paciente presenta angina y de más del 20% si presenta disnea.
La historia natural del aneurisma de aorta se ha estudiado principalmente en el síndrome de Marfan. Los predictores más potentes de complicación son:
- –
El diámetro de la raíz aórtica a nivel de los senos de Valsalva.
- –
La historia familiar de muerte súbita.
El riesgo de complicaciones es del 4% con 2,75cm/m2, del 8% con 2,75–4,24 y de más del 20% si es superior a 4,24cm.
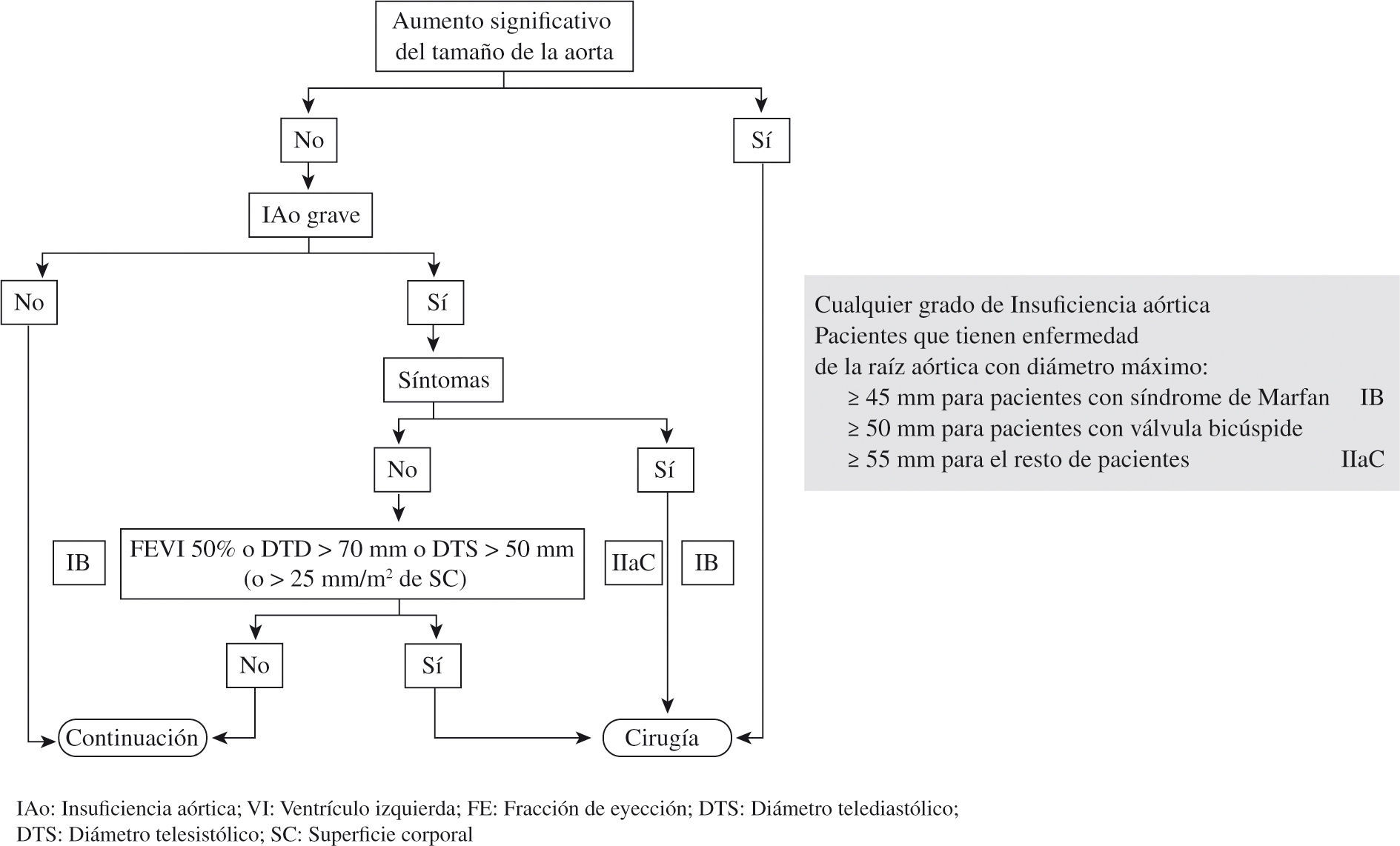
Indicaciones de cirugía de sustitución valvular aórtica en la insuficiencia aórticaLas indicaciones de cirugía en la IAo se resumen en la figura 15 y la tabla V8,13. En esta valvulopatía debemos tener en cuenta, a la hora de decidir la cirugía, no sólo la gravedad de la misma sino también los diámetros de la aorta y del VI. Si el paciente cumple criterios de cirugía por dilatación aórtica y presenta IAo moderada o grave debemos intervenir también sobre la válvula aórtica. Si no existe enfermedad de la aorta pero sí una IAo grave sintomática habrá que realizar reparación o sustitución de la válvula. Si el paciente está asintomático valoraremos la FEVI y los diámetros del VI así como su evolución en ecocardiogramas seriados para ver si tiene indicación de cirugía.
Indicaciones de cirugía en la iao según la sociedad europea de cardiología
| Indicación | Clase |
| IAo grave | |
| Síntomas: disnea o angina clase II, III o IV de la NYHA | IB |
| FEVI reducida ≤ 50% no debida a otra causa | IB |
| Pacientes que van a ser intervenidos de cirugía de revascularización coronaria, de otra valvulopatía o de la raíz aórtica/aorta ascendente | IC |
| Dilatación grave del VI: DTDVI > 70mm o DTSVI > 50mm (o 25mm/m2 de superficie corporal) | IIaC |
| Independientemente de la gravedad de la IAO, dilatación de la raíz aórtica: | |
| – ≥ 45–50mm en el síndrome de Marfan o válvula aórtica bicúspide | IC |
| – ≥ 55mm en el resto | IIaC |
| – Si crecimiento ≥ 0,5cm/año | IIaC |
| – Si ≥ 45mm y se opera de otra enfermedad cardíaca |
FEVI: fracción de eyección del ventrículo izquierdo; DTDVI: diámetro telediastólico del VI; DTSVI: diámetro telesistólico del VI.
La cirugía de sustitución valvular aislada se asocia a una mortalidad de alrededor del 4%; si se asocia a cirugía de revascularización miocárdica ésta aumenta al 6,8%14. Los mejores resultados se dan en los centros de mayor volumen, en pacientes menos sintomáticos y con FEVI normal (mortalidad quirúrgica del 8% si FEVI < 35% vs 2% si > 50%). La disfunción de VI preoperatoria también influye en la evolución y el pronóstico tras la cirugía; los pacientes con una FEVI inferior al 35% presentan una supervivencia a 10 años en torno al 41%, del 56% con FEVI del 35–56%, y del 70% si es superior al 50%15. A pesar de este dato los pacientes con disfunción ventricular no deben ser rechazados para cirugía, ya que generalmente su función sistólica mejora como resultado de una reducción de la poscarga crónica, sobre todo si la disfunción ventricular lleva menos de 1 año y si mejoran clínicamente tras la cirugía.
En pacientes con IAo y aneurisma de la aorta ascendente la cirugía con la implantación de una prótesis vascular aórtica más una prótesis presenta una mortalidad del 1–10%, dependiendo de la gravedad de la IAo, la función del VI y la presentación clínica13. En todo caso, la cirugía mejora el pronóstico en estos pacientes comparada con el tratamiento médico. En pacientes con IAo leve el reemplazo de la aorta ascendente respetando la válvula puede minimizar los riesgos que conlleva a largo plazo el ser portador de una prótesis.
En un estudio retrospectivo realizado en nuestro medio16 se presentaron los resultados de 170 pacientes intervenidos de sustitución valvular por IA grave con un seguimiento de 10 años. Dividieron a los pacientes en dos grupos: el primero de cirugía más precoz y el segundo más tardía. El primer grupo incluyó a los pacientes asintomáticos con grado moderado de disfunción ventricular izquierda (FEVI entre 45–50%) y/o dilatación de VI moderada (DTSVI entre 50–55mm), y a pacientes en CF II de la New York Heart Association (NYHA). El grupo B incluyó a pacientes con sintomatología avanzada (CF III y IV) o con FEVI inferior al 45% o dilatación del DTSVI superior a 55mm. No encontraron diferencias significativas en la mortalidad hospitalaria, sin embargo, la mortalidad a 10 años fue mayor en el grupo de cirugía más tardía basada en esos parámetros (37 vs 12% en el grupo precoz).
Una buena alternativa al implante de prótesis aórtica es la conservación de la válvula nativa con o sin reparación, dependiendo del grado de IAo. Para poder realizar este procedimiento es fundamental la caracterización precisa de la válvula aórtica con ETE que presenta una excelente correlación con la inspección quirúrgica de la válvula y predice su reparabilidad en la mayoría de los casos17. En un estudio con 163 pacientes se obtuvo un acuerdo entre el ETE y la inspección visual del 93%, se pudo realizar reparación valvular en el 77% de los casos y el ETE predijo correctamente el tipo de cirugía en el 86% que se repararon y en el 93% de las que se reemplazaron. Los mecanismos de la IAo se categorizaron en tres grupos según la ETE y la inspección quirúrgica: tipo 1, dilatación aórtica con valvas normales; tipo 2, prolapso de valvas o fenestración con buena calidad del tejido valvular; tipo 3, afectación orgánica de las valvas con restricción al movimiento o por endocarditis. Se repararon fundamentalmente las IAo de tipo 1 y 2, y se obtuvieron mejores resultados en este tipo de válvulas que cuando se realizó reparación de las de tipo 3, tanto en la supervivencia libre de eventos intrahospitalaria como a medio plazo, siendo la tasa de reoperación de los pacientes tipo 3 del 35 frente al 3,7% en los otros dos grupos. Parece que la cantidad de tejido valvular es un dato importante en la decisión de la reparación de la válvula, siendo peores los resultados en aquellos pacientes con válvulas más fibróticas y retraídas que provocan IAo con chorro generalmente central18.
En un registro alemán19 con 600 pacientes intervenidos mediante cirugía de reparación del prolapso de la válvula aórtica empleando distintas técnicas (plicatura central, resección triangular, parche de pericardio) los resultados son también muy buenos, con una supervivencia libre de reoperación a 5 años con todas las técnicas superior al 90%.
Las ventajas de la reparación de la IAo frente a la sustitución valvular son claras, ya que no existe la necesidad de anticoagulación a largo plazo y se preserva relativamente la anatomía valvular; la principal desventaja es la tasa mayor de reintervención (alrededor de un 15% a 10 años), sobre todo debido a un variable grado de experiencia en los distintos centros. Según una revisión reciente de Svensson20 se debe intentar reparar la válvula siempre que sea posible, y esto puede ser así en el 90% de las válvulas trivalvas con dilatación de la raíz aórtica y sin afectación anatómica de las valvas, y en el 80% de las bicúspides sin estenosis. Los motivos que inclinan a no reparar son: grandes perforaciones, prolapso de más de dos valvas o calcificación de grado mayor a leve.
En cuanto al tratamiento médico en la IAo se han utilizado vasodilatadores como el nifedipino y los inhibidores de la enzima convertidora de angiotensina (IECA) para intentar reducir la precarga y mejorar la disfunción y dilatación del VI. Estos fármacos han mostrado utilidad en los distintos estudios en pacientes sintomáticos con mayor grado de dilatación del VI, sin embargo los resultados han sido contradictorios en pacientes asintomáticos con IAo grave, dilatación de VI y función conservada. Las guías americanas los recomiendan como clase I únicamente en pacientes sintomáticos o con disfunción de VI que no vayan a ser intervenidos por contraindicación a la cirugía y como clase IIa en la IAo grave sintomática previa a la cirugía.
ConclusionesAl igual que en el caso de la EAo, las nuevas técnicas de imagen nos aportan un mayor conocimiento de la enfermedad valvular en la IAo y una mejor definición de su gravedad.
Es importante una correcta valoración no sólo de la válvula sino de la raíz aórtica y del VI para indicar la cirugía. Debemos seguir estrechamente a los pacientes para indicar la intervención en el momento adecuado. Las técnicas de reparación valvular ofrecen buenos resultados en manos experimentadas.