La prevalencia de las taquiarritmias es cada vez mayor con el envejecimiento de la población. Los avances en el conocimiento de los mecanismos fisiopatológicos de las arritmias han favorecido el interés creciente actual en su prevención, diagnóstico y tratamiento. En esta revisión abordamos los aspectos epidemiológicos de las taquiarritmias asociadas con la enfermedad cardíaca quirúrgica en pacientes pediátricos y adultos.
The prevalence of tachyarrhythmias is growing by the aging population. Advances in the understanding of the pathophysiological mechanisms of arrhythmias motivate the growing interest in its prevention, diagnosis and treatment. In this review we address the epidemiological aspects of tachyarrhythmias that most often occur in patients, paediatric or adult with heart disease amenable to surgical treatment.
La cirugía de las arritmias ha progresado en los últimos años incrementando su actividad. En la actualidad las taquiarritmias más susceptibles de tratamiento quirúrgico son la fibrilación auricular (FA), el flutter auricular y las taquicardias ventriculares de etiología isquémica.
La prevalencia de estas arritmias es variable según el tipo de cardiopatía, con diferencias entre la población adulta e infantil. A este respecto, aunque las arritmias son las mismas en ambas poblaciones, en los niños son de mayor relevancia los trastornos de la función sinusal y la conducción auriculoventricular (AV), y las arritmias secundarias a las correcciones quirúrgicas.
El objetivo de este capítulo es revisar la epidemiología de las taquiarritmias, con especial hincapié en las asociadas a pacientes candidatos a cirugía cardíaca. El conocimiento de estos aspectos puede ayudar a ponderar su repercusión clínica e identificar las susceptibles de cirugía.
Taquiarritmias supraventricularesPertenecen a este grupo de arritmias las taquicardias por reentrada AV provocadas por vías accesorias, la FA y la taquicardia auricular, diferenciadas entre macro-rreentrante y focal (Tabla I). Con excepción de la FA, la epidemiología de estas arritmias se ha estudiado de forma heterogénea debido a las dificultades en su diferenciación y clasificación. Su prevalencia en las cardiopatías adquiridas es distinta de la de las congénitas y, dentro de estas últimas, con diferencias en función del tipo de malformación (Tabla II).
Clasificación taquiarritmias quirúrgicas
| Supraventriculares |
| – Taquicardias por reentrada auriculoventricular (vías accesorias) |
| – Taquicardia auricular focal o microrreentrante |
– Taquicardia auricular macrorreentrante
|
| – Fibrilación auricular |
| Ventriculares |
| – Taquicardia ventricular focal o microrreentrante |
| – Taquicardia ventricular asociada a miocardiopatía isquémica |
| – Taquicardia ventricular asociada a cardiopatía congénita |
CT: cavotricuspídeo.
Adaptado de Hornero, et al.82.
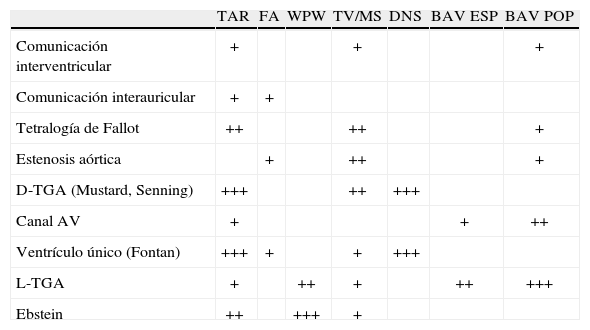
Riesgo relativo de arritmias específicas en las cardiopatías congénitas más comunes
| TAR | FA | WPW | TV/MS | DNS | BAV ESP | BAV POP | |
| Comunicación interventricular | + | + | + | ||||
| Comunicación interauricular | + | + | |||||
| Tetralogía de Fallot | ++ | ++ | + | ||||
| Estenosis aórtica | + | ++ | + | ||||
| D-TGA (Mustard, Senning) | +++ | ++ | +++ | ||||
| Canal AV | + | + | ++ | ||||
| Ventrículo único (Fontan) | +++ | + | + | +++ | |||
| L-TGA | + | ++ | + | ++ | +++ | ||
| Ebstein | ++ | +++ | + |
TAR: taquicardia por reentrada intraauricular (flutter atípico relacionado con cicatriz); FA: fibrilación auricular; WPW: síndrome de Wolff-Parkinson-White; TV: taquicardia ventricular; MS: muerte súbita; DNS: disfunción del nódulo sinusal; BAV ESP: bloqueo auriculoventricular espontáneo; BAV POP: bloqueo auriculoventricular postoperatorio; TGA: transposición de las grandes arterias.
Adaptado de Walsh83.
En estudios poblacionales la prevalencia global de las taquicardias supraventriculares paroxísticas, excluyendo la FA, es del 2,25‰ habitantes, y la incidencia de 0,035‰ personas/año1. En comparación con la FA, las otras formas de taquicardia supraventricular paroxística suelen presentarse en edades más precoces, y con el doble de riesgo entre mujeres1, hasta el punto de que casi el 65% de los ingresos no prolongados por este tipo de taquicardia se atribuyen al sexo femenino2.
Taquicardia supraventricular por reentrada auriculoventricularEl síndrome de Wolff-Parkinson-White (WPW) es poco frecuente, con una incidencia del 0,04‰ casos/año3, y una prevalencia de un patrón electrocardiográfico de preexcitación del 0,1–0,3%4. El 50% de los pacientes están asintomáticos en el momento de su diagnóstico, y sólo el 15–21% desarrollan taquicardias sintomáticas a lo largo del seguimiento3. En el paciente sintomático la probabilidad anual de muerte súbita es del 0,25%, y de un 3–4% a lo largo de toda su vida3. Por lo tanto, existe una clara indicación de ablación de la vía accesoria en estos pacientes, especialmente en los casos en los que el perfil de riesgo es elevado por intervalos RR preexcitados cortos durante los episodios de FA5.
La incidencia de vías accesorias AV en población infantil es similar a la población adulta, con dos excepciones notables: la anomalía de Ebstein de la válvula tricúspide y la L-transposición de grandes vasos. Entre el 6–24% de pacientes con anomalía de Ebstein presentan vías accesorias, fundamentalmente derechas, siendo múltiples en un 15–28% de los casos6. En la práctica quirúrgica habitual también existen casos aislados de síndrome de WPW en pacientes con otras cardiopatías más comunes, como la valvulopatía reumática o la cardiopatía isquémica, que pueden ser tratadas con catéter antes de la cirugía7 o de forma simultánea8,9.
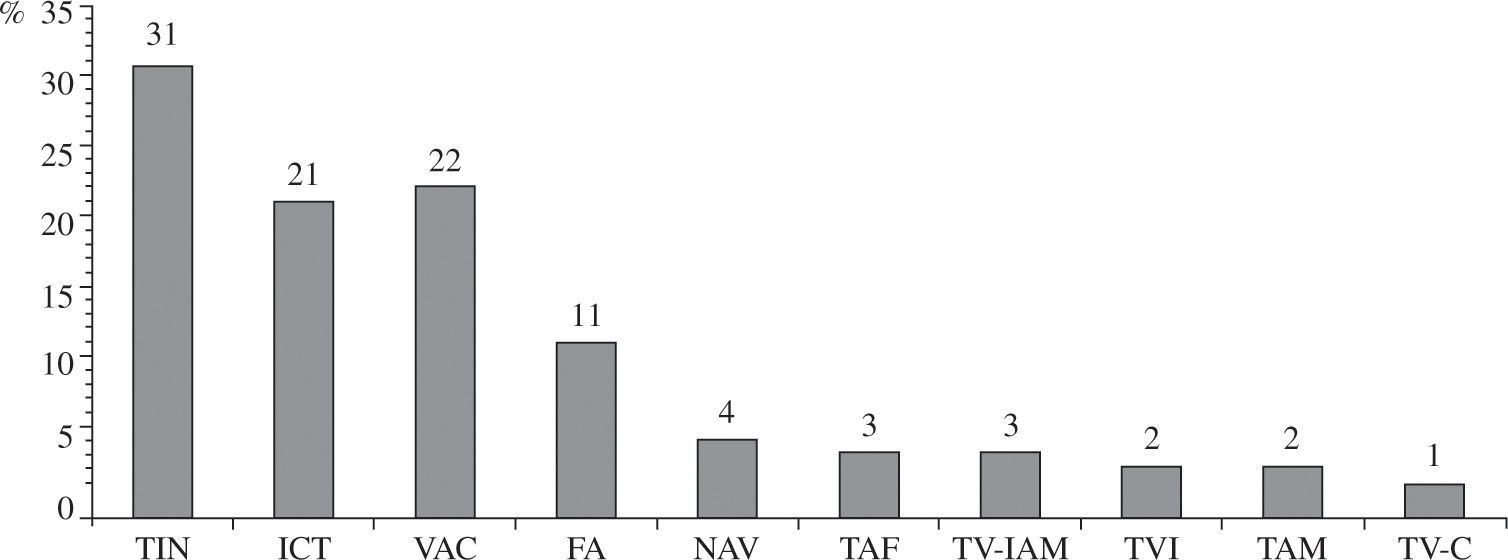
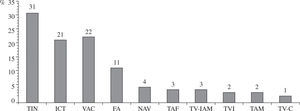
Taquicardia auricular focalLa taquicardia auricular focal, también denominada microrreentrante o taquicardia auricular automática o ectópica, es una arritmia relativamente frecuente, con una prevalencia en varones jóvenes sanos asintomáticos del 0,34%, y en sintomáticos del 0,46%10. Su evolución es predominantemente paroxística en el 75% de los casos, y benigna10. Ocasionalmente, puede originar taquimiocardiopatía secundaria y, en los casos incesantes, tiene una tendencia espontánea al enlentecimiento progresivo de la frecuencia cardíaca. Con frecuencia, su etiología es tóxica o metabólica (intoxicación digitálica, etilismo, alteraciones hidroelectrolíticas, hipoxemia, etc.) o por enfermedad pulmonar crónica11, y por ello el tratamiento de estos trastornos suele controlar la taquicardia. Esta arritmia tan sólo constituye el 5% de las indicaciones de los procedimientos electrofisiológicos por taquicardias supraventriculares12, y el 3% de todos los procedimientos realizados en nuestro país (Fig. 1)13. La mayoría están originadas en la aurícula derecha, el 18% en la izquierda, y en alrededor del 10% de los casos resultan ser multifocales2.
Arritmias tratadas mediante ablación por catéter en España en 2008. FA: fibrilación auricular; ICT: istmo cavotricuspídeo; NAV: nodo auriculoventricular; TAF: taquicardia auricular focal; TAM: taquicardia auricular macrorreentrante/aleteo auricular atípico; TIN: taquicardia intranodal; TV-C: taquicardia ventricular relacionada con cardiopatía; TVI: taquicardia ventricular idiopática; TV-IAM: taquicardia ventricular relacionada con cicatriz postinfarto agudo de miocardio; VAC: vías accesorias. (adaptado de Macías, et al.13).
En la población pediátrica la incidencia de focos auriculares ectópicos y las taquicardias de la unión, raras en pacientes no congénitos, suponen un 10% de las taquiarritmias supraventriculares.
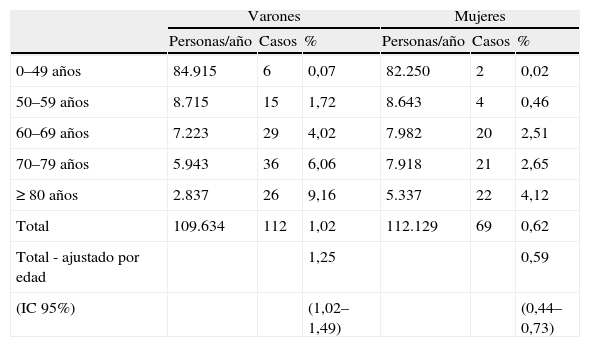
Taquicardia auricular macrorreentranteUn estudio epidemiológico del flutter, con 58.820 individuos, constató una incidencia anual del 0,8‰, la mitad de los cuales tuvieron además algún episodio de FA asociada14. Por lo tanto, se puede estimar que la incidencia anual global del flutter no asociado a FA es del 0,37‰. Como ocurre en la FA, la incidencia de flutter auricular es mayor en los varones, más del doble, y aumenta progresivamente con la edad, independientemente del género (Tabla III). La edad de los pacientes en el momento del diagnóstico supera los 50 años en el 95% de los casos, y la incidencia anual pasa de cinco nuevos casos/100.000 habitantes en personas de 50 años, a 587 nuevos casos/100.000 habitantes en mayores de 80 años. Además de la edad avanzada y el sexo masculino, se identificaron en este estudio poblacional otros factores independientes de riesgo para la arritmia, tales como la insuficiencia cardíaca o la enfermedad pulmonar crónica, que resultaron ser responsables directos del 15,8 y 11,6% de los casos, respectivamente. En este estudio poblacional casi un 60% de los casos de flutter sucedieron durante el primer mes de convalecencia de algún proceso intercurrente (cirugía mayor, neumonía, etc.). Concretamente, un 23% habían sido sometidos a una intervención cardíaca, coronaria o valvular 4 semanas antes de la aparición del flutter14.
Incidencia de flutter auricular en la población general14
| Varones | Mujeres | |||||
| Personas/año | Casos | % | Personas/año | Casos | % | |
| 0–49 años | 84.915 | 6 | 0,07 | 82.250 | 2 | 0,02 |
| 50–59 años | 8.715 | 15 | 1,72 | 8.643 | 4 | 0,46 |
| 60–69 años | 7.223 | 29 | 4,02 | 7.982 | 20 | 2,51 |
| 70–79 años | 5.943 | 36 | 6,06 | 7.918 | 21 | 2,65 |
| ≥ 80 años | 2.837 | 26 | 9,16 | 5.337 | 22 | 4,12 |
| Total | 109.634 | 112 | 1,02 | 112.129 | 69 | 0,62 |
| Total - ajustado por edad | 1,25 | 0,59 | ||||
| (IC 95%) | (1,02–1,49) | (0,44–0,73) | ||||
Adaptado de Granada, et al.14.
La prevalencia preoperatoria de flutter auricular en cirugía cardíaca es mayor que en la población general, y se ha estimado en un 0,09% de los pacientes candidatos a cirugía coronaria aislada15. Por su parte, Berger, et al. comunicaron una prevalencia preoperatoria de flutter del 8,5% en una serie de 211 pacientes mayores de 18 años a quienes se practicó el cierre de una comunicación interauricular, una enfermedad altamente susceptible de asociarse a esta arritmia por la dilatación auricular derecha, máxime cuando es intervenida en la edad adulta16.
- –
Flutter típico. Constituye el 90% de los casos de flutter diagnosticados en la población general14, y entre el 75–80% de todas las taquicardias por macrorreentrada17. Su ablación por catéter representa el 21% de la actividad de los laboratorios de electrofisiología de nuestro país (Fig. 1)13.
- –
Flutter atípico y otras taquicardias auriculares macrorreentrantes. El flutter atípico representa el 10% del total de los casos diagnosticados en la población general14. En nuestro país, tan sólo el 2% de las ablaciones por catéter se hacen por este tipo de arritmia13. Esta proporción es mayor entre los pacientes cardíacos posquirúrgicos y tras la ablación de la FA.
El flutter atípico primario, o no relacionado con cicatrices auriculares, es la forma menos frecuente de flutter auricular17,18. Su baja incidencia hace que sea una entidad de escaso valor epidemiológico y, por lo tanto, con limitadas probabilidades de tratamiento quirúrgico. Las macrorreentradas de localización auricular derecha son raras, y únicamente se encuentran en el 3–4% de los pacientes que son remitidos para ablación de flutter típico19. La mayoría de los flutter atípicos izquierdos son primarios20,21, y su acceso percutáneo es más complejo, por lo que los índices de recidiva son mayores, alrededor del 25–30%, incluso en centros con experiencia20.
El flutter atípico secundario a cicatrices auriculares constituye la forma más frecuente de flutter atípico o taquicardia por reentrada auricular. Se localiza con más frecuencia en la aurícula derecha, como complicación en la cirugía cardíaca congénita22,23. No obstante, también hay casos de reentrada en el lado izquierdo, relacionados con la cirugía de la válvula mitral19 o tras procedimientos ablativos percutáneos23 o quirúrgicos de la FA25,26.
Las macrorreentradas auriculares pueden aparecer como complicación en un 10–30% de los pacientes intervenidos con técnicas de switch auricular (Mustard/ Senning)23, y se han descrito como factores de riesgo para estas arritmias la existencia de una disfunción sinusal asociada (síndrome braditaquicardia) y la edad avanzada en el momento de la intervención. La derivación cavopulmonar de Fontan, en sus diversas variantes quirúrgicas, presenta entre un 25–50% de arritmias auriculares a 10 años de seguimiento, principalmente taquicardias intraauriculares por reentrada. En la corrección de la tetralogía de Fallot son frecuentes el flutter auricular atípico relacionado con cicatrices y fibrosis auriculares (12–35%), y las reentradas por el istmo cavotricuspídeo.
Por lo que respecta a las arritmias secundarias a procedimientos ablativos quirúrgicos, la incidencia de flutter típico es bastante similar entre los grupos quirúrgicos. En la serie de Cox, et al.24, que incluía a 276 pacientes intervenidos mediante la técnica clásica de corte y sutura Maze III, de los cuales en un 60% FA paroxística, un 2,2% precisó ablación postoperatoria por flutter auricular o taquicardia auricular focal. De igual modo, el análisis del Registro Internacional de Cirugía de la FA (Registry of Atrial Fibrillation Surgery [RAFS]), que incluye a 972 pacientes con valvulopatía mitral y ablación, describe un 2–3% de flutter auricular al año de seguimiento25. Los circuitos de reentrada responsables de flutter atípicos o macrorreentradas auriculares postoperatorias se localizan a menudo en la aurícula izquierda, con una incidencia variable entre el 8–16%26,27.
Fibrilación auricularEpidemiología de la fibrilación auricular en la población general. Factores de riesgoEn la actualidad la FA es la arritmia más frecuente en la práctica clínica y quirúrgica. En población general tiene una prevalencia del 0,4–1%, responsable de un tercio de todas las hospitalizaciones por trastornos del ritmo cardíaco28. Los factores de riesgo para el desarrollo de FA son: la edad avanzada, la hipertensión arterial, el infarto agudo de miocardio, la insuficiencia cardíaca y la enfermedad valvular cardíaca29.
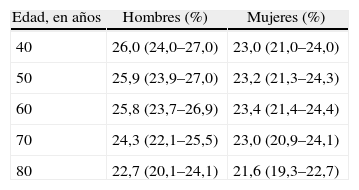
La edad es un factor determinante en su prevalencia, pero no en la incidencia. En el Framingham Heart Study, con 3.999 varones y 4.726 mujeres, la prevalencia de FA comienza a aumentar después de los 40 años, con un brusco incremento a partir de los 65 años. Presenta FA un 2,3% de los mayores de 40 años y un 5,9% de los mayores de 65 años. La edad media de los individuos con FA es aproximadamente de 75 años. El 70% están entre 65–85 años. Un 84% son mayores de 65 años y un 32% son mayores de 80 años. Así, la FA es una enfermedad fundamentalmente del anciano, con las implicaciones terapéuticas que esto conlleva. Sin embargo, el riesgo de padecer FA a lo largo de la vida no varió de forma significativa, es decir, tuvieron la misma probabilidad de presentar la arritmia los pacientes que tenían 40 años al comienzo del estudio, que los que estaban en la novena década de la vida29 (Tabla IV). Ello explica el importante incremento de la prevalencia de la FA que se produce a medida que aumenta la edad del paciente. El aumento progresivo en la longevidad de la población general ha hecho que en la última década se duplique el número absoluto de casos de FA30, y algunos estudios poblacionales ya sugieren que su prevalencia se triplicará para el año 205031. La edad es un factor tan decisivo que en publicaciones con pacientes jóvenes, con 40 años de edad media, reumáticos sometidos a intervención quirúrgica cardíaca polivalvular, la prevalencia de FA preoperatoria es inferior al 50%32.
Riesgo de desarrollar fibrilación auricular a lo largo de la vida
| Edad, en años | Hombres (%) | Mujeres (%) |
| 40 | 26,0 (24,0–27,0) | 23,0 (21,0–24,0) |
| 50 | 25,9 (23,9–27,0) | 23,2 (21,3–24,3) |
| 60 | 25,8 (23,7–26,9) | 23,4 (21,4–24,4) |
| 70 | 24,3 (22,1–25,5) | 23,0 (20,9–24,1) |
| 80 | 22,7 (20,1–24,1) | 21,6 (19,3–22,7) |
Adaptado de Lloyd-Jones, et al.29.
En cuanto a la distribución por sexos, en el Cardiovascular Health Study, con más de 5.000 pacientes, se constató un 4,8% de prevalencia de la FA entre las mujeres y un 6,2% en los varones mayores de 65 años, con un aumento significativo en las mujeres con la edad33. En el estudio de Gammage, et al., con un número similar de pacientes en el mismo rango de edad, se objetivaron prevalencias similares, 6,6% en varones y 3,1% en mujeres, con diferencias significativas en su distribución en cuanto al sexo, siendo más frecuente en varones (odds ratio [OR]: 2,23; p < 0,001)34. Resultados análogos, en cuanto a la distribución por sexo, podemos encontrar en la FA preoperatoria de los pacientes adultos intervenidos de cirugía cardíaca35.
La enfermedad cardiovascular tiene un papel importante en la epidemiología de la FA36,37. El Cardiovascular Health Study señala como factores de riesgo independientes de aparición de FA a la enfermedad valvular (hazard ratio [HR]: 2,42), la cardiopatía isquémica (HR: 1,48), el uso de diuréticos (HR: 1,51), el incremento de la presión arterial sistólica (HR: 1,11/10 mmHg) y la glucemia (HR: 1,08/mmol/l)38. Por el contrario, el uso de β-bloqueadores (HR: 0,61) y el consumo moderado de alcohol (HR: 0,96) resultaron tener un efecto protector contra la aparición de FA (HR: 0,61 y 0,96, respectivamente).
En valvulopatía reumática, especialmente la mitral, la prevalencia de la FA es del 25%38, con un 29% en la estenosis y un 16% en la insuficiencia mitral reumática aislada39. La mitad de los pacientes con enfermedad mitral reumática desarrollarán FA a lo largo de la vida36. En el Framingham Heart Study la prevalencia de FA en los pacientes con insuficiencia cardíaca secundaria a disfunción ventricular izquierda es del 25%40. En el registro CASS, la prevalencia de FA en pacientes con enfermedad coronaria fue del 0,6%. Por su parte, en las miocardiopatías, desarrollan FA el 25–30% de los pacientes con formas dilatadas y el 10–25% de las hipertróficas41. La hipertensión arterial sistémica (controlada con tratamiento o no) es un potente y constante predictor de aparición de la arritmia, sobre todo en individuos de edad avanzada. En efecto, cuando se comparan sujetos con presión arterial basal normal (< 130/85mmHg) con pacientes con presión sistólica mayor de 160mmHg o diastólica mayor de 100mmHg, las posibilidades de aparición de FA a lo largo de la vida pasan de un 17,4 a casi un 30% en pacientes mayores de 70 años y de un 18,2 a un 26,6% en mayores de 80 años29,42.
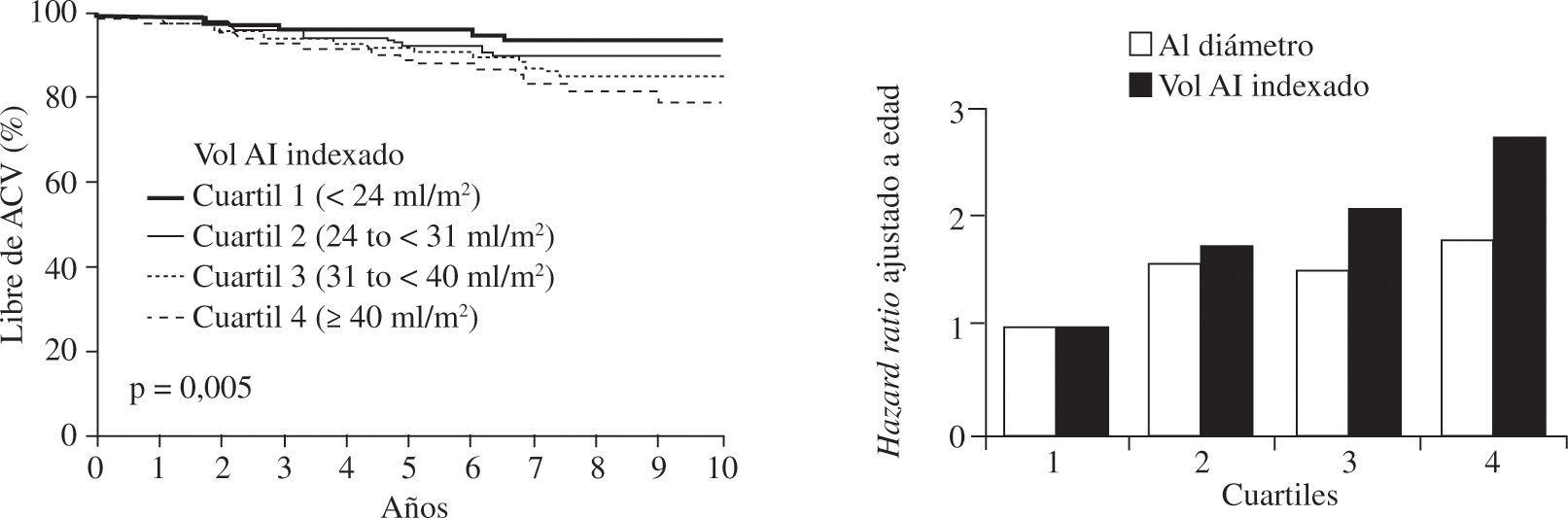
El tamaño de la aurícula izquierda es un potente predictor de aparición de FA en la población general, además de ser un conocido factor de riesgo de recurrencia de la FA en la ablación percutánea43 y quirúrgica44,45. El diámetro auricular izquierdo mayor de 55mm y el volumen superior a 60–70ml (> 32ml/m2) han sido identificados como predictores independientes para el desarrollo de la FA, tanto en población como en pacientes de cirugía cardíaca46,47 (Fig. 2). Además, el tamaño auricular izquierdo es un predictor independiente de mortalidad y de accidente cerebrovascular. Por cada 10mm de incremento del tamaño auricular, el riesgo relativo de accidente cerebrovascular es de 2,4 mayor en varones (IC 95%: 1,6–3,7) y de 1,4 en mujeres (IC 95%: 0,9–2,1), y el de muerte durante el seguimiento de 1,3 mayor en varones (IC 95%: 1–1,5) y de 1,4 en mujeres (IC 95%: 1,1–1,7)48.
Relación entre el volumen aurícula izquierda y el ACV Arriba, curva de Kaplan-Meier para supervivencia libre de ACV, ajustada a edad por cuartiles del volumen de aurícula izquierda indexada a la superficie corporal. Abajo, gráfico del HR de ACV ajustado por edad según las dimensiones de la aurícula izquierda en cuartiles. ACV: accidente cerebrovascular (adaptado de Barnes, et al.84).
Existen otras enfermedades que favorecen la aparición de FA, como el hipertiroidismo –que incluso en su fase subclínica puede duplicar la incidencia de la arritmia34–, la enfermedad pulmonar crónica49, el síndrome de apnea obstructiva del sueño50, la obesidad50,51 o ciertos hábitos tóxicos, como el abuso en el consumo de alcohol51 o el tabaquismo52.
Por lo que respecta a los tipos de FA, en la población general más del 40% son paroxísticaa53. La prevalencia de FA aislada, sin enfermedad cardiovascular asociada, es baja incluso en ancianos, del 1–2% de los individuos mayores de 65 años33. En términos globales, la FA aislada representa el 10–30% de todos los casos diagnosticados de FA36. No obstante, teniendo en cuenta las dificultades existentes para establecer con precisión el diagnóstico de FA paroxística –los eventos asintomáticos son 12 veces más frecuentes que los sintomáticos54–, incluso sometiendo a los pacientes a monitorización electrocardiográfica continua, hace pensar que esta relación porcentual es probablemente muy superior. Aproximadamente, un 30–35% de los pacientes con FA paroxística progresan a su forma permanente55, aunque esta proporción varía considerablemente en función de la cardiopatía de base. Así, los pacientes con estenosis mitral de origen reumático y FA paroxística acaban desarrollando FA permanente en alrededor del 65% de los casos, mientras que en el contexto de la cardiopatía isquémica esa cifra se reduce a un 25–30%53.
En España, el estudio CARDIOTENS56 documentó la frecuencia de la FA permanente, así como sus características clínicas. En este estudio se incluyó a 32.051 pacientes. La gran mayoría de los pacientes en FA superaba los 60 años, y sólo cerca del 20% estaba por debajo de esta edad. Los pacientes con una edad comprendida entre los 70–79 años representaban más del 40% de los pacientes en FA, seguido en número por el grupo entre 60–69 años, que constituía el 30%, aproximadamente. El 19% de la muestra analizada presentaba enfermedad cardiovascular. La FA estaba presente en el 25% de los pacientes con enfermedades cardiovasculares, lo que representa una prevalencia del 4,8%. La FA fue significativamente más frecuente en las mujeres (29%) que en los varones (22%). El 33% de los pacientes con insuficiencia cardíaca y el 12% (387/3.226) de los portadores de cardiopatía isquémica presentaban esta arritmia. El 25% de los pacientes con hipertensión arterial estaba en FA. Sólo el 33% de los enfermos en FA recibían tratamiento anticoagulante, y el fármaco empleado con mayor frecuencia fue la digoxina (36%).
Epidemiología de la fibrilación auricular en la cirugía cardíacaComo hemos comentado antes, las enfermedades cardiovasculares tienen mayor riesgo de FA. Y así, en los pacientes que van a ser sometidos a cirugía cardíaca, la prevalencia de la FA es elevada, aunque con importantes diferencias según la enfermedad de base.
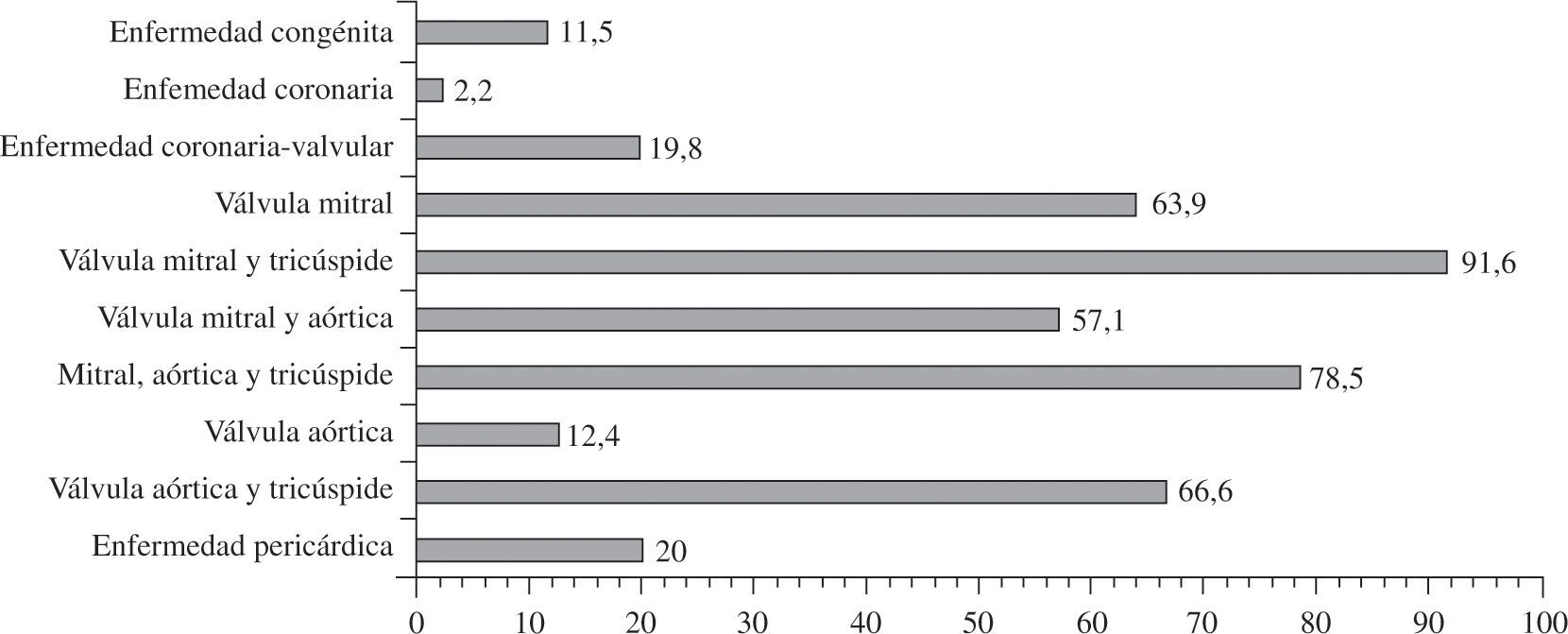
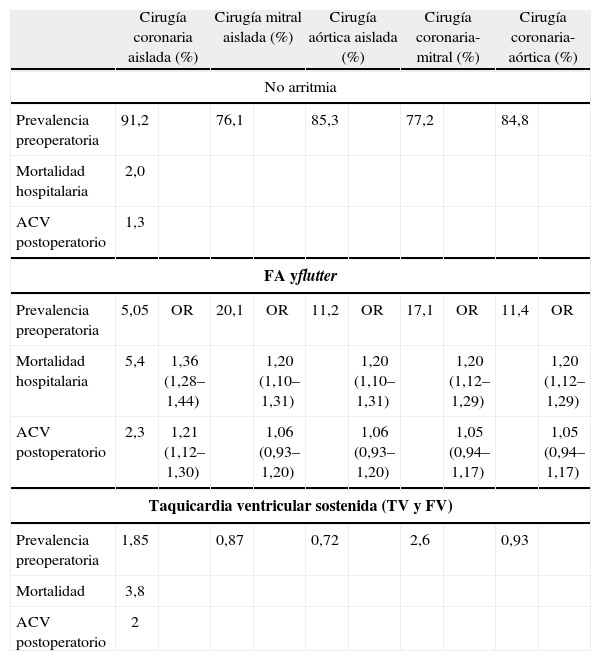
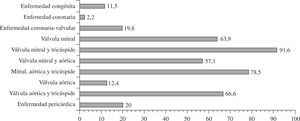
La prevalencia preoperatoria de FA en pacientes sometidos a cirugía coronaria aislada ha sido estimada en el 2–9%57–59. En el registro de 2008 de la Society of Thoracic Surgeons (Tabla V), la prevalencia de FA preoperatoria en cirugía valvular mitral y aórtica, asociada o no a cirugía coronaria, fue del 27 y 14%, respectivamente58. En cirugía combinada mitral y aórtica, el tanto por ciento aumenta hasta un 35–40%60. Hornero, et al.35 describen en los pacientes adultos intervenidos de cirugía cardíaca un 14% de prevalencia preoperatoria de FA permanente, con diferencias entre los diferentes grupos de pacientes, 2,2% de los pacientes de cirugía coronaria aislada, hasta más del 90% en pacientes con cardiopatía polivalvular mitral y tricúspide (Fig. 3). En la serie de Bernal, et al., la incidencia de FA preoperatoria en pacientes mitrales, aórticos o combinados mitroaórticos con actuación sobre la válvula tricúspide la prevalencia de FA preoperatoria fue del 42%61. Como se puede apreciar, entre nuestro medio y el anglosajón existen claras diferencias en la prevalencia de FA preoperatoria, probablemente por la mayor incidencia en valvulopatía reumática36,38,39.
Prevalencia preoperatoria de arritmias según el registro de la society of thoracic surgeons del año 200858
| Cirugía coronaria aislada (%) | Cirugía mitral aislada (%) | Cirugía aórtica aislada (%) | Cirugía coronaria- mitral (%) | Cirugía coronaria- aórtica (%) | ||||||
| No arritmia | ||||||||||
| Prevalencia preoperatoria | 91,2 | 76,1 | 85,3 | 77,2 | 84,8 | |||||
| Mortalidad hospitalaria | 2,0 | |||||||||
| ACV postoperatorio | 1,3 | |||||||||
| FA yflutter | ||||||||||
| Prevalencia preoperatoria | 5,05 | OR | 20,1 | OR | 11,2 | OR | 17,1 | OR | 11,4 | OR |
| Mortalidad hospitalaria | 5,4 | 1,36 (1,28–1,44) | 1,20 (1,10–1,31) | 1,20 (1,10–1,31) | 1,20 (1,12–1,29) | 1,20 (1,12–1,29) | ||||
| ACV postoperatorio | 2,3 | 1,21 (1,12–1,30) | 1,06 (0,93–1,20) | 1,06 (0,93–1,20) | 1,05 (0,94–1,17) | 1,05 (0,94–1,17) | ||||
| Taquicardia ventricular sostenida (TV y FV) | ||||||||||
| Prevalencia preoperatoria | 1,85 | 0,87 | 0,72 | 2,6 | 0,93 | |||||
| Mortalidad | 3,8 | |||||||||
| ACV postoperatorio | 2 | |||||||||
FA: fibrilación auricular; TV: taquicardia ventricular; FV: fibrilación ventricular; ACV: accidente cerebrovascular. La OR está expresada con el 95% del intervalo de confianza.
La prevalencia de FA preoperatoria en los niños con cardiopatías congénitas es menor que de flutter. Por lo que respecta a las cardiopatías congénitas del adulto, la comunicación interauricular es la que con mayor frecuencia se asocia a FA, siendo su prevalencia entre el 11,5–33% de estos pacientes16,35,62–64. La edad del paciente es un determinante clave en la incidencia preoperatoria de FA, siendo prácticamente nula antes de los 40 años y extremadamente frecuente en pacientes mayores de 60 años en el momento de la cirugía, alrededor del 60%.
Taquicardias ventricularesTaquicardia ventricular no asociada a cardiopatía isquémicaTaquicardia ventricular no sostenidaSe puede observar en un 0,8% de la población sin cardiopatía estructural, 0,5% en menores de 20 años y en un 2,2% de los individuos mayores de 50 años4. En estos pacientes su pronóstico es bueno, con una incidencia de muerte súbita igual a la de la población general, incluso en los casos de taquicardias ventriculares no sostenidas (TVNS) frecuentes y complejas65.
Por el contrario, los pacientes con TVNS asociada a cardiopatía estructural son un grupo de riesgo para el desarrollo de insuficiencia cardíaca y muerte súbita. La TVNS es un predictor de riesgo de muerte súbita en pacientes con miocardiopatía dilatada no isquémica, con OR en los metaanálisis entre el 2,1 (1,1–4,0) y 7,7 (2,5–23,9)66. La presencia de TVNS en pacientes jóvenes (< 30 años) con miocardiopatía hipertrófica también se asocia a un incremento significativo de muerte súbita67.
Taquicardia ventricular sostenidaEl origen de la mayoría de las taquicardias ventriculares sostenidas (TVS) idiopáticas se sitúa en el tracto de salida del ventrículo derecho (62%), seguido del tracto de salida del ventrículo izquierdo (30,3%) y del septo interventricular del ventrículo izquierdo –TV idiopáticas fasciculares– (7,6%)68. Las originadas en el tracto de salida del ventrículo derecho son más frecuentes en mujeres, y las del tracto de salida del ventrículo izquierdo en varones, no existiendo diferencias con respecto al sexo en las de origen septal. Por lo que respecta a la edad, las TVS del tracto de salida del ventrículo izquierdo se observan en pacientes más jóvenes que en las del tracto de salida del ventrículo derecho69.
Taquicardia ventricular en la cardiopatía congénitaLa mayor parte de la información disponible al respecto hace referencia a la tetralogía de Fallot. La prevalencia de TV en esta cardiopatía oscila entre el 3–14%, con un riesgo estimado de muerte súbita por década de seguimiento del 2%. Varios estudios69,70 han
puesto de manifiesto los siguientes factores de riesgo para TV, edad avanzada en el momento de la corrección quirúrgica, mayor tiempo de seguimiento, cirugías paliativas previas, alta frecuencia de extrasístoles ventriculares en el estudio Holter, TV inducible en el estudio electrofisiológico, disfunción ventricular derecha y progresivo aumento del ancho del QRS en el ECG.
Taquicardia ventricular asociada a cardiopatía isquémicaDurante la fase aguda del infarto de miocardio la mayoría de eventos por TV ocurren durante las primeras 48 h71. Más allá del tercer día suelen reflejar un sustrato arritmogénico más establecido, con riesgo de arritmias ventriculares recurrentes durante el primer año72.
El riesgo de muerte súbita por arritmias ventriculares malignas durante este periodo aumenta en pacientes con insuficiencia cardíaca, isquemia recurrente o arritmias ventriculares documentadas72. Los pacientes asintomáticos que presenten taquiarritmias ventriculares sostenidas inducibles en el estudio electrofisiológico o que presenten depresión grave de la función ventricular, tienen también un mayor riesgo de muerte súbita, por lo que son candidatos a la implantación de un desfibrilador automático73–75.
La presencia de aneurismas ventriculares constituye un factor de riesgo independiente de muerte súbita tras el infarto de miocardio, sobre todo cuando se observa inestabilidad eléctrica en la monitorización Holter76. La cirugía desempeña un papel cada vez menos relevante en el tratamiento de las arritmias secundarias al infarto de miocardio. Las estrategias de reperfusión miocárdica precoz y el mejor control farmacológico de la tensión arterial y de la poscarga ventricular, fundamentalmente con fármacos β-bloqueadores e inhibidores de la enzima convertidora de la angiotensina (IECA), han supuesto una reducción de la incidencia de los aneurismas ventriculares postinfarto, en cuyo contexto se desarrolló la cirugía de las TV relacionadas con la escaras miocárdicas. Clásicamente, entre un 10–30% de los pacientes con un infarto miocárdico transmural desarrollaban un aneurisma ventricular77,78, de manera que, tan sólo en la Cleveland Clinic Foundation, fueron intervenidos 1.183 pacientes en el periodo de 15 años comprendido entre 1972–198778. En la serie de Jones, et al. de principios de la década de 1980, el 5,8% de los pacientes sometidos a cirugía coronaria presentaban un aneurisma ventricular, y en un 6% de ellos (0,5% del total de la cirugía coronaria) se realizó cirugía antiarrítmica79. Se ha descrito una elevada incidencia de muerte súbita, responsable de casi un 40% de las muertes durante el seguimiento, en pacientes en los que se había practicado una resección de aneurisma ventricular sin cirugía antiarrítmica asociada80. Por tal motivo, algunos autores recomiendan un estudio electrofisiológico a todos los pacientes candidatos a reparación de aneurisma ventricular, así como la práctica de una escarectomía y crioablación en los casos con TVS espontáneas o inducibles. En la serie de Sartipy, et al. se llevaron a cabo 51 procedimientos antiarrítmicos asociados a la cirugía del aneurisma, con una mortalidad hospitalaria del 3,8%, y sólo un 10% de recidiva de taquiarritmias ventriculares durante los 5 años de seguimiento81.