El tratamiento de las arritmias evoluciona con rapidez, y con ello las indicaciones. La ablación con catéter, en los laboratorios de electrofisiología, tiene una gran eficacia y baja morbilidad, siendo actualmente la cirugía una alternativa poco frecuente excepto en la fibrilación auricular. La ablación quirúrgica, en procedimientos asociados o con técnicas mínimamente invasivas, se realiza en numerosos centros, en especial de la fibrilación auricular. Las diversas alternativas terapéuticas deben indicarse de forma gradual atendiendo a su efectividad, invasividad y tipo de arritmia. No son excluyentes entre sí, pues a menudo se combinan en el mismo paciente. El tratamiento exige conocer las actuales indicaciones, aunque siempre ha de ser individualizado según la presentación clínica y experiencia de los grupos medicoquirúrgicos.
The treatment of arrhythmias progresses rapidly and thus the clinical indications. Catheter ablation in the laboratory of electrophysiology has high efficacy and low morbidity; surgery is rarely an option except in atrial fibrillation. Ablation surgery, in procedures associated or with minimally invasive techniques, is widely performed, especially with regards atrial fibrillation. Various types of treatments are listed in a gradual manner according to their effectiveness, invasiveness, and the type of arrhythmia. These are not mutually exclusive, often combined in the same patient. The treatment requires knowledge of current indications, although it must always be individualized according to clinical presentation and experience of medical-surgical groups.
A día de hoy, la mayoría de arritmias tienen un tratamiento percutáneo con catéter en los laboratorios de electrofisiología, pero en ocasiones la cirugía de arritmias es una alternativa para los pacientes inabordables o que necesitan de una cirugía cardíaca por enfermedad concomitante. Es importante esclarecer qué arritmias son tratables con cirugía y en qué situaciones la ablación quirúrgica puede suponer una alternativa terapéutica a la ablación percutánea convencional. La principal ventaja que presenta el tratamiento quirúrgico de las arritmias frente al percutáneo es la posibilidad de realizar lesiones mayores y extensas bajo visión directa de la anatomía cardíaca. Sus mayores limitaciones son dos: su agresión, y precisar de estudio electrofisiológico peroperatorio en ocasiones difícil de realizar en un quirófano.
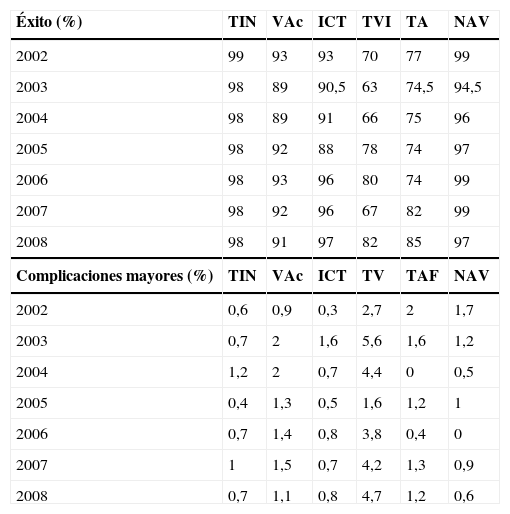
Las tasas de éxito de la ablación con catéter para la mayoría de las arritmias supraventriculares, tales como el flutter típico, la taquicardia por reentrada nodal o la mayoría de las vías accesorias, son superiores al 90%, de acuerdo con los datos presentados en el Registro Español de Ablación con Catéter (Tabla I)1. Sin embargo en otras arritmias la efectividad es menor, como en la fibrilación auricular (FA) o las taquicardias ventriculares (TV) monomorfas en pacientes con cardiopatía isquémica. Aun en estos casos la cirugía no suele estar contemplada entre las opciones terapéuticas de las guías clínicas por diversos motivos, entre los que destacan la falta de estudios comparativos entre técnicas, y el declive de la cirugía ante la electrofisiología.
Evolución en los últimos años del porcentaje de éxito y complicaciones mayores de la ablación con catéter según el sustrato tratado. Registro Español de Ablación con Catéter1
| Éxito (%) | TIN | VAc | ICT | TVI | TA | NAV |
| 2002 | 99 | 93 | 93 | 70 | 77 | 99 |
| 2003 | 98 | 89 | 90,5 | 63 | 74,5 | 94,5 |
| 2004 | 98 | 89 | 91 | 66 | 75 | 96 |
| 2005 | 98 | 92 | 88 | 78 | 74 | 97 |
| 2006 | 98 | 93 | 96 | 80 | 74 | 99 |
| 2007 | 98 | 92 | 96 | 67 | 82 | 99 |
| 2008 | 98 | 91 | 97 | 82 | 85 | 97 |
| Complicaciones mayores (%) | TIN | VAc | ICT | TV | TAF | NAV |
| 2002 | 0,6 | 0,9 | 0,3 | 2,7 | 2 | 1,7 |
| 2003 | 0,7 | 2 | 1,6 | 5,6 | 1,6 | 1,2 |
| 2004 | 1,2 | 2 | 0,7 | 4,4 | 0 | 0,5 |
| 2005 | 0,4 | 1,3 | 0,5 | 1,6 | 1,2 | 1 |
| 2006 | 0,7 | 1,4 | 0,8 | 3,8 | 0,4 | 0 |
| 2007 | 1 | 1,5 | 0,7 | 4,2 | 1,3 | 0,9 |
| 2008 | 0,7 | 1,1 | 0,8 | 4,7 | 1,2 | 0,6 |
TIN: taquicardia intranodal; VAc: vías accesorias; ICT: istmo cavotricuspídeo; TVI: taquicardia ventricular idiopática; TV: taquicardia ventricular; TA: taquicardia auricular; TAF: taquicardia auricular focal; NAV: nodo auriculoventricular.
La comparación entre ambas estrategias, catéter frente a cirugía, no ha lugar en la actualidad por la eficacia y mínima agresión del catéter. El interés por el tratamiento quirúrgico de estas arritmias se debe a su frecuente asociación preoperatorio en la cirugía, y a su eficacia, seguridad, baja morbimortalidad y reducido número de recurrencias tardías. Otro punto importante es el coste económico derivado del tratamiento que, aunque intuitivamente pudiera parecer mayor en la cirugía, está equilibrado o decantado hacia la vertiente quirúrgica. El desarrollo tecnológico experimentado en los últimos años ha supuesto un profundo cambio en las dos técnicas, por un lado el desarrollo de intervenciones mínimamente invasivas, las cuales comportan una menor estancia hospitalaria así como una menor tasa de complicaciones asociadas, y por otro el encarecimiento progresivo de los procedimientos percutáneos, así como la necesidad de repetidos procedimientos por las recurrencias.
De acuerdo con las guías actuales de las principales sociedades cardiológicas, la ablación con catéter es el tratamiento de elección para la arritmia aislada, reservando la opción quirúrgica a un minoritario grupo de pacientes2-5. La cirugía se indica en la mayoría de casos para arritmias asociadas a cardiopatía estructural que precisan de intervención, y en las arritmias con fracaso de la ablación. A continuación son recogidas las recomendaciones actuales para la ablación de arritmias, remarcando el papel de la cirugía.
Arritmias quirúrgicas supraventricularesLas indicaciones clínicas para la ablación de las diversas arritmias supraventriculares están establecidas para la ablación por catéter2 (Tabla II). La opción quirúrgica no es recogida por estas guías, con la excepción de la ablación quirúrgica de la FA. Ello no excluye su indicación, aunque la poca experiencia actual en este tipo de intervenciones hace que se deban individualizar los casos una vez el catéter ha fracasado.
Indicaciones de ablación de las arritmias suprave ntriculares seg ún las guías ac tuales de la ACC/AHA/ESC2
| – Taquicardias mediadas por vías accesorias: |
| • WPW bien tolerado: ablación con catéter (clase I, nivel evidencia B) |
| • WPW mal tolerado o con conducción rápida por la vía accesoria o con FA: ablación con catéter (clase I, nivel de evidencia B) |
| • Episodio único o muy infrecuente de taquicardia reentrante sin preexcitación: ablación con catéter (clase IIa, nivel de evidencia B) |
| • Preexcitación asintomática: ablación con catéter (clase IIa, nivel de evidencia B) |
| • WPW en pacientes sintomáticos con PRAVAcc < 240 ms (clase IIa, nivel de evidencia B) – Taquicardia auricular focal o microrreentrante: |
| • Recurrente sintomática: ablación con catéter (clase I, nivel de evidencia B) |
| • Incesante: ablación con catéter (clase I, nivel de evidencia B) |
| • No sostenida y asintomática: ablación con catéter (clase III, nivel de evidencia C) |
| – Taquicardia auricular macrorreentrante (flutter): |
| • Flutter auricular típico (istmo dependiente) |
| ¿ Primer episodio y bien tolerado: ablación con catéter (clase IIa, nivel de evidencia B) |
| ¿ Recurrente, bien tolerado: ablación con catéter (clase I, nivel de evidencia B) |
| ¿ Mal tolerado: ablación con catéter (clase I, nivel de evidencia B) |
| ¿ Secundario a uso de fármacos antiarrítmicos Ic: ablación con catéter (clase I, nivel de evidencia B) |
| • Flutter atípico (primarias o no relacionadas con cicatriz o bien secundarias a cirugía cardíaca): |
| ¿ Sintomático tras fallo de tratamiento antiarrítmico: ablación con catéter (clase IIa, nivel de evidencia B) |
| – Fibrilación auricular: «la ablación con catéter se considera una alternativa al tratamiento farmacológico razonable para prevenir recurrencias de FA en pacientes sintomáticos con aurícula izquierda no dilatada o poco dilatada (clase IIa, nivel de evidencia C)», siempre que sea refractaria al menos a un fármaco antiarrítmico de clase I o III, en pacientes seleccionados con insuficiencia cardíaca y/o disfunción ventricular izquierda, pudiéndose realizar de entrada en situaciones clínicas inusuales |
WPW: Wolff-Parkinson-White; FA: fibrilación auricular; ACC: American College Cardiology; AHA: American Heart Association; ESC: European Society Cardiology; PRAVAcc: intervalo PR de la vía accesoria.
Inicialmente quirúrgica, en los últimos años el desarrollo de la ablación con catéter permite alcanzar en la mayoría de los casos tasas de éxito superiores al 95%6. En este éxito han influido la utilización de sistemas 3D de mapeo no fluoroscópicos, la realización de venografías de seno coronario para identificar anomalías venosas o de coronariografías para minimizar los riesgos de lesión coronaria durante la aplicación de radiofrecuencia, y la utilización de sistemas de ablación no convencionales tales como catéteres de radiofrecuencia irrigados para las vías profundas o epicárdicas, o la crioablación en el caso de las vías perihisianas. Por ello, los casos que requieren cirugía son excepcionales, habitualmente debidos a la coexistencia de cardiopatías congénitas graves, como la malformación de Ebstein o la L-transposición de grandes arterias, siendo necesaria la colaboración con el equipo de electrofisiología para la localización de la vía accesoria en quirófano y la confirmación eléctrica de la correcta ablación de la misma. La indicación de ablación para estas arritmias está recogida en la tabla II.
Taquicardia por reentrada nodalLa taquicardia por reentrada nodal es la taquicardia paroxística supraventricular (TPSV) más común, representando el 50% de las TPSV en adultos. La ablación percutánea de la vía lenta logra la curación en más del 95% de los casos, con una tasa de complicaciones menor del 0,5%, en su mayoría bloqueos auriculoventriculares completos, que suelen requerir el implante definitivo de un marcapasos. En casos difíciles también existen varias estrategias percutáneas (abordaje izquierdo, empleo de crioablación, etc.). Debido a la buena tolerancia y carácter benigno de esta arritmia no se contempla la ablación quirúrgica de la misma.
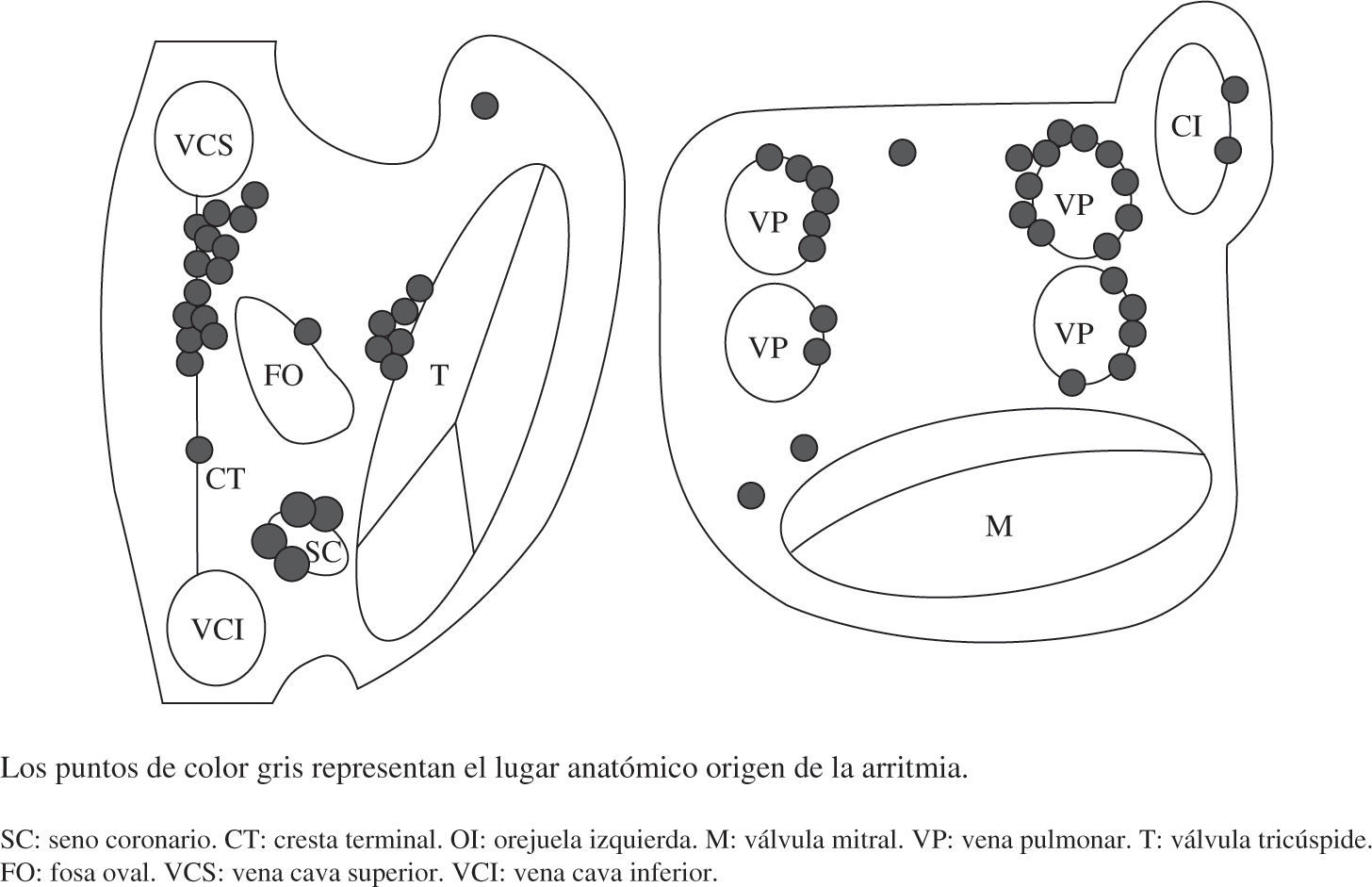
Taquicardia auricular focal o microrreentranteDebida a un foco con automatismo eléctrico localizado a nivel auricular, más frecuentemente en la cresta terminal o en las venas pulmonares (Fig. 1)6. El tratamiento de elección es la ablación percutánea, con una tasa de éxito superior al 75%1, que se ha aumentado gracias a la utilización de sistemas de mapeo 3D (CARTO®, EnSite®, Localisa®), de la ecocardiografía intracardíaca, así como de sistemas de ablación con catéteres irrigados o mediante crioablación. La indicación de cirugía ha quedado reservada para casos aislados refractarios.
Taquicardia auricular macrorreentranteSon taquicardias auriculares cuyo mecanismo es la reentrada alrededor de un obstáculo fijo o funcional. Antes de su ablación se requiere del mapeo de la arritmia mediante el estudio electrofisiológico. Entre las variedades destacamos el flutter auricular típico o istmo dependiente (cuyo circuito se localiza alrededor del anillo tricúspide), que es el más frecuente, y el resto de taquicardia auricular macrorreentrante (TAMR), entre ellas el flutter atípico (no istmo dependiente), cuya distinción es puramente académica ya que tiene poca repercusión en su manejo clínico, aunque sí en la zona en la que se va a realizar la ablación.
Flutter auricular típicoVariedad de TAMR en la que el circuito incluye una zona de conducción lenta a nivel del istmo cavotricuspídeo (CT) así como una zona de bloqueo funcional y/o anatómico, a lo largo de la cresta terminal y cresta eustaquiana, pudiendo circular en sentido horario o antihorario. La erradicación de la arritmia suele lograrse con una línea de ablación en su paso más estrecho, el istmo CT7. Este tratamiento es uno de los más frecuentes en los laboratorios de electro-fisiología, con un porcentaje de éxito 90-95%1,2, y con mínimas complicaciones. Por ello, la indicación de ablación quirúrgica, de fácil realización, quedaría reservada para los pacientes que asociaran esta arritmia a una enfermedad quirúrgica, o a aquellos refractarios a la ablación percutánea con catéter y estén gravemente sintomáticos.
Taquicardia auricular macrorreentrante no istmo dependienteTaquicardia auricular macrorreentrante incisionalEn ellas los circuitos reentrantes se forman alrededor de los obstáculos anatómicos originados por una cirugía cardíaca previa, como son cicatrices o parches auriculares. Pueden aparecer hasta en el 50% de los pacientes con intervención de Fontan8, Senning o Mustard, siendo más frecuentes cuando se realiza una incisión vertical en la pared anterior de la aurícula derecha que no llega a la vena cava inferior. Su respuesta al tratamiento antiarrítmico suele ser escasa, de donde se deriva la necesidad de un tratamiento de ablación. El abordaje percutáneo, a pesar de la complejidad de los circuitos reentrantes, el difícil acceso y la alteración de la anatomía auricular, es el que tiene mayor aceptación9, al poder disponer de diferentes estrategias para facilitar mapeos complejos. El éxito de la ablación dependerá del daño auricular preexistente y del añadido por la técnica quirúrgica realizada, presentando un pronóstico a largo plazo altamente variable10, con una tasa de éxito cercana al 80%, aunque con un alto porcentaje de recurrencias. En este sentido es prioritaria la prevención de la TAMR incisional durante los procedimientos quirúrgicos, reduciendo el número de incisiones, intentando la canulación directa de la vena cava, preservando la integridad de la cresta terminal11, y en los casos de Fontan la asociación de un Maze modificado derecho y la conversión a una conexión cavopulmonar total12.
Taquicardia auricular macrorreentrante no incisionalEngloban los flutter de asa superior, cuyo circuito se forma alrededor de la cresta terminal de la aurícula derecha, así como el flutter izquierdo, especialmente frecuente en pacientes con cardiopatía estructural (valvular mitral o isquémica) y zonas de fibrosis auricular, o tras la ablación de la FA, habitualmente con circuitos girando alrededor del anillo mitral. El tratamiento de elección debido a la necesidad de mapear el circuito en el laboratorio de electrofisiología es la ablación percutánea del mismo (que se suele reservar a casos muy sintomáticos por las dificultades técnicas que representa), siendo excepcional su tratamiento quirúrgico aislado.
Fibrilación auricular aisladaLa estrategia terapéutica a adoptar debe realizarse según la repercusión clínica de la FA sobre el paciente, tiempo de evolución de la arritmia, forma de presentación, y sobre la base de la cardiopatía subyacente. En este sentido podríamos distinguir tres perfiles de pacientes. Por un lado, pacientes habitualmente jóvenes con historia de FA paroxística, con crisis sintomáticas, que van a beneficiarse claramente de un tratamiento de ablación. Frente a aquellos, los pacientes, habitualmente de edad avanzada, con historia de FA persistente de larga evolución, con cardiopatía estructural (valvulopatía mitral, cardiopatía isquémica) y habitualmente nada o poco sintomáticos, en los que el control de frecuencia va a ser una alternativa igualmente válida frente al control del ritmo, tal y como muestran varios estudios13-18. Entre ambos extremos se sitúan los pacientes, la mayo-ría con FA persistente o de larga evolución, muchos de ellos con múltiples factores predictores de recurrencia tras la ablación, como son la dilatación auricular izquierda moderada (diámetro aurícula izquierda > 45 mm), la hipertensión arterial19, o el síndrome de apnea obstructiva del sueño20, en los que no existe un tratamiento consensuado y eficaz, por lo que se deberá llevar a cabo la individualización terapéutica a partir de todos los factores descritos.
En la FA paroxística los episodios recurrentes y cada vez más prolongadas remodelan el tejido auricular generando dilatación y fibrosis en ambas aurículas, que pueden acabar transformando una arritmia inicialmente focal, en la que el aislamiento de las venas pulmonares se acompañaba de una tasa de curación de alrededor del 70% con la ablación percutánea y de casi el 90% con las nuevas técnicas quirúrgicas de mínima invasión, en un trastorno que se mantiene por focos localizados más allá de la unión venoatrial en la que el tratamiento de ablación enfocado únicamente al aislamiento de venas pulmonares alcanza tan sólo el 50% de éxito con el tratamiento percutáneo21, no siendo superior al 60% con las técnicas quirúrgicas de mínima invasión22.
La incorporación en la técnica percutánea de nuevas estrategias dirigidas a la realización de líneas de ablación cada vez más amplias (ablación con líneas que engloben la zona de la unión venoatrial, líneas en el techo, pared posterior e istmo mitral23), así como ablación de focos extrapulmonares (ablación de los electro-gramas auriculares complejos fraccionados24), se ha acompañado de un incremento progresivo del éxito terapéutico. En el caso del tratamiento quirúrgico los esfuerzos han ido dirigidos a la realización de abordajes de mínima invasión, evitando la necesidad de circulación extracorpórea y reduciendo en lo posible la morbimortalidad asociada.
Dado que no hay estudios multicéntricos aleatorizados entre ambas estrategias terapéuticas, los procedimientos no están estandarizados en cada grupo de tratamiento y los estudios con mayor número de pacientes presentan resultados confrontados, no existe un consenso terapéutico claro pese a los esfuerzos de las sociedades científicas en pautar unas guías de tratamiento.
En el año 2007 las nuevas guías de las principales sociedades25, que incluyen prácticamente toda la comunidad electrofisiológica, y con participación de cirujanos de la Society of Thoracic Surgeons, han ampliado las indicaciones de ablación sustancialmente, que se resumen en la tabla III. Cabe destacar que éstas son las primeras guías clínicas que especifican indicaciones para tratamiento quirúrgico de la FA basadas en los últimos estudios que muestran los resultados de las nuevas estrategias quirúrgicas toracoscópicas de ablación de venas pulmonares26-28. En ellas se destaca una tasa de mantenimiento en ritmo sinusal cerca del 90% en los pacientes con FA paroxística, que se compara favorablemente con el registro mun-dial de ablación percutánea, con tasas de éxito del 70%, con más de un procedimiento y mantenimiento de medicación antiarrítmica, y una tasa de complicaciones graves del 5,9%29.
Indicaciones de tratamiento mediante ablación con ca téter o cirugía en la FA. Documento de Consenso de Expertos de las sociedades HRS, EHRA y ECAS, en colaboración con la AHA y la STS 200725
| Indicaciones de ablación percutánea de la FA |
| – FA sintomática refractaria o intolerante a al menos un fármaco antiarrítmico de clases I o III |
| – En situaciones clínicas especiales, puede ser apropiado realizar la ablación como primera línea de tratamiento |
| – En pacientes sintomáticos seleccionados con insuficiencia cardíaca o baja fracción de eyección |
| – La presencia de trombos en la aurícula izquierda contraindica la ablación con catéter en la FA |
| Indicaciones de tratamiento quirúrgico de la FA |
| – Pacientes sintomáticos sometidos a cirugía cardíaca por otra enfermedad |
| – Pacientes asintomáticos seleccionados sometidos a cirugía cardíaca en los que la ablación puede ser realizada con mínimo riesgo |
| – Cirugía de la FA aislada debe ser considerada en pacientes sintomáticos que prefieren el tratamiento quirúrgico, el tratamiento percutáneo ha fallado una o más veces, o no son candidatos a tratamiento percutáneo |
HRS: Heart Rhythm Society; EHRA: European Heart Rhythm Association; ECAS: European Cardiac Arrhythmia Society; AHA: American Heart Association; STS: Society of Thoracic Surgeons; FA: fibrilación auricular.
En la FA secundaria a valvulopatía el mecanismo predominante ya no son los focos ectópicos patológicos, existe un remodelado auricular con aurículas izquierdas dilatadas, con frecuencia mayor de 50 mm de diámetro, no siendo el campo ideal ni siquiera para la cirugía de las arritmias. Sin embargo la cirugía de la FA se encuentra en expansión por varias razones: las nuevas tecnologías de ablación que permiten un menor tiempo de isquemia y evitan largas suturas auriculares30,31, los estudios que han demostrado que los pacientes con FA preoperatoria presentan mayor mortalidad a largo plazo que los pacientes que mantienen el ritmo sinusal32-34, que mantener el ritmo sinusal después de una intervención de Maze o laberinto concomitante mejora la supervivencia comparado con la cirugía cardíaca sin tratamiento de la FA35, además de una menor mortalidad a largo plazo, menor tasa de accidentes cerebrales tromboembólicos36, mejoría significativa de la función sistólica37, y mayor calidad de vida38.
Las únicas indicaciones establecidas hasta la fecha de tratamiento de la FA concomitante están incluidas en la tabla III. Para establecer la indicación de la intervención de Maze se ha de tener en cuenta la morbilidad del procedimiento, y los agentes que influyen de forma negativa a largo plazo en el mantenimiento del ritmo sinusal, tales como la aurícula izquierda dilatada, la antigüedad de la FA, la edad avanzada y otros21,39-43 (Tabla IV). Aunque la relación es lineal, se han establecido como probables puntos de corte predictores de recurrencia las aurículas > 55 mm y la duración de la FA > 5 años (60 meses).
Factores predictores de recurrencia de fibrilación auricular tras la ablación
| Factor | Asociación |
| Duración de la fibrilación auricular | +++ |
| Diámetro de la aurícula izquierda | +++ |
| Edad | ++ |
| Aumento VTD-VI | + |
| Aumento índice de masa VI | + |
| Fracción de eyección reducida | + |
| Onda f de bajo voltaje (< 1 mm) | + |
| Desarrollo de insuficiencia tricúspide | + |
| Uso de fármacos IECA | – |
| Patrón biauricular (Maze III) | – |
| Fibrilación auricular paroxística | – |
VTD-VI: volumen telediastólico de ventrículo izquierdo; IECA: inhibidores de la enzima convertidora de la angiotensina.
En cuanto a la técnica quirúrgica, parece claro que la ablación de venas pulmonares únicamente obtiene resultados en la FA paroxística o persistente de menos de 1 año de evolución21,44. En la fibrilación persistente o persistente de larga evolución/permanente, actualmente tanto la intervención de Maze biauricular como de mini-Maze parecen presentar resultados similares a largo plazo, con tasas de éxito entre 70-84%45,46. Para evitar recurrencias se ha postulado la cirugía precoz, asociar la reducción del tamaño auricular si existe dilatación grave y la corrección de la insuficiencia tricúspide asociada.
Flutter auricular postablación de fibrilación auricularHasta en un 30% de los pacientes tratados con ablación percutánea de FA se describe la aparición de flutter-taquicardia auricular izquierda47. Éste aparece habitualmente por la presencia de gaps en las líneas de ablación, patrones de líneas incompletas (istmos entre las líneas y los obstáculos anatómicos), etc., que son el sustrato perfecto para el establecimiento de nuevos circuitos reentrantes48. Actualmente el tratamiento que se recomienda es la ablación con catéter para completar las líneas, el reaislamiento circunferencial de las venas pulmonares frecuentemente reconectadas por múltiples gaps, etc. En los casos en que el flutter es debido a un circuito estable originado entre las líneas previas de ablación y/u otros obstáculos anatómicos se debe intentar mapear el circuito, realizando una nueva línea a nivel del potencial istmo del mismo.
Arritmias quirúrgicas ventricularesEl 90% de las TV se acompañan de cardiopatía estructural, principalmente isquémica. Con la implantación creciente de los desfibriladores automáticos implantables (DAI), tanto para la prevención primaria como secundaria de la muerte súbita por arritmias ventriculares, las recomendaciones actuales sobre la ablación de las TV, fundamentalmente en el contexto de la cardiopatía isquémica, están dirigidas a reducir el número de choques que reciben los pacientes por el DAI, mejorando así su calidad de vida y muy probablemente su pronóstico. Los efectos deletéreos del DAI están haciendo resurgir en la actualidad la terapia de ablación percutánea de las arritmias ventricu-lares, y quizás la cirugía.
Las indicaciones clínicas actuales para la ablación por catéter están recogidas en las tablas V y VI. La cirugía tan sólo se contempla entre los grupos quirúrgicos con experiencia para los casos de TV recurrente tras cuidadosa selección del paciente4. La resonancia magnética con contraste es una técnica de imagen de gran resolución para definir y localizar las áreas de fibrosis relacionadas con las TV, lo cual es de suma ayuda para el abordaje quirúrgico49,50.
Indicaciones de ablación con catéter de las arritmias ventriculares según las guías actuales de la ACC/AHA/ESC3
| Indicación clase I |
| – Bajo riesgo de muerte súbita cardíaca y TVS predominantemente monomórficas, resistente a fármacos, intolerante, o en pacientes que no desean recibir tratamiento antiarrítmico a largo plazo (nivel de evidencia C) |
| – TV rama-rama (nivel de evidencia C) |
| – TV en pacientes portadores de DAI que reciben múltiples descargas (nivel de evidencia C) Indicación clase IIa |
| – TVMNS sintomática refractaria a tratamiento antiarrítmico, intolerante, o en pacientes que no desean recibir tratamiento antiarrítmico a largo plazo, con bajo riesgo de muerte súbita cardíaca (nivel de evidencia C) |
| – Complejos ventriculares prematuros monomórficos frecuentes sintomáticos, en pacientes resistentes a fármacos, intolerantes, o que no desean recibir tratamiento farmacológico a largo plazo (nivel de videncia C) |
| Indicación clase IIb |
| – Ablación de potenciales de Purkinje en pacientes con tormenta arrítmica provocada por complejos ventriculares prematuros de morfología similar (nivel de evidencia C) |
| – Ablación de complejos ventriculares prematuros muy frecuentes asintomáticos para evitar o tratar una taquimiocardiopatía (nivel de evidencia C) Indicación clase II |
| – Ablación de complejos ventriculares prematuros asintomáticos infrecuentes (nivel de evidencia C) Situaciones especiales |
| – DAVD: TV recurrente pese a tratamiento antiarrítmico: ablación con catéter (clase IIa, nivel de evidencia C) |
| – TVS en pacientes con cardiopatía congénita: ablación con catéter (clase I, nivel de evidencia C) |
| – TV de TSVD: la ablación con catéter resulta razonable |
ACC: American College Cardiology; AHA: American Heart Association; ESC: European Society Cardiology; TVS: taquicardia ventricular sostenida; TVMNS: taquicardia ventricular monomorfa no sostenida; DAVD: displasia arritmogénica ventricular derecha; IM: infarto de miocardio; TV: taquicardia ventricular; FV: fibrilación ventricular; TSVD: tracto salida ventrículo derecho.
Indicaciones para la ablación con catéter de la TV según grupo expertos de la EHRA/HRS4
| Pacientes con enfermedad cardíaca estructural (incluido IM previo, miocardiopatía dilatada, DAVD/D) |
| – Ablación con catéter de TV. Se recomienda: |
| • Para TVMS sintomática, incluyendo TV terminada por un DAI, que se repite a pesar de la terapia con medicamentos antiarrítmicos o cuando los antiarrítmicos no son tolerados o no deseados* |
| • Para el control de la TVMS incesante o tormenta de TV que no se debe a una causa transitoria reversible |
| • Para pacientes con frecuentes complejos ventriculares prematuros, TVNS, o TV que se presume causa disfunción ventricular |
| • Para las TV rama-rama o reentrantes interfasciculares |
| • Para TV polimórfica sostenida recurrente y FV que es refractaria a la terapia antiarrítmica cuando hay una sospecha de que el trigger puede ser objeto de ablación – Ablación con catéter de VT. Se debe considerar: |
| • En pacientes que tienen uno o más episodios de TVMS a pesar de la terapia con uno o más antiarrítmicos clase I o III* |
| • En pacientes con TVMS recurrente por IM previo que tienen fracción de eyección ventrículo izquierdo > 0,30 y expectativa de 1 año de supervivencia, y es una alternativa aceptable al tratamiento con amiodarona* |
| • En pacientes con TVMS hemodinámicamente tolerada debido a IM previo que tienen fracción de eyección razonablemente preservada (> 0,35), incluso si no ha fallado la terapia con fármacos antiarrítmicos* |
| Pacientes sin enfermedad cardíaca estructural |
| – Ablación con catéter de VT. Se recomienda para pacientes con TV idiopática: |
| • Para TV monomórfica que está causando síntomas graves |
| • Para TV monomórfica cuando los fármacos antiarrítmicos no son eficaces, no se toleran, o no desean |
| • Para TV polimórfica sostenida recurrente y VF (tormenta eléctrica), que es refractaria a la terapia antiarrítmica cuando hay una sospecha trigger que puede ser objeto de ablación – Ablación con catéter de VT. Está contraindicada: |
| • En presencia de trombo móvil ventricular (ablación epicárdica puede considerarse) |
| • En complejos ventriculares prematuros y/o TVNS asintomáticos que no son sospechosos de causar o contribuir a la disfunción ventricular |
| • En TV debida a causas transitorias, reversibles, tales como la isquemia aguda, hiperpotasemia, o torsade de pointes inducida por fármacos |
TVNS: taquicardia ventricular no sostenida; TVMS: taquicardia ventricular monomorfa sostenida; DAVD/D: cardiomiopatía/displasia arritmogénica ventricular derecha; DAI: desfibrilador automático implantable; IM: infarto de miocardio; TV: taquicardia ventricular; FV: fibrilación ventricula; HRS: Heart Rhythm Society; EHRA: European Heart Rhythm Association.
Pertenecen a este grupo las TV idiopáticas (de tracto de salida de ventrículo derecho, ventrículo izquierdo, del anillo mitral, del anillo aórtico) y las TV asociadas a cardiopatía estructural no isquémica (displasia arritmogénica de ventrículo derecho, TV por miocardiopatía hipertrófica, por valvulopatía, enfermedad de Chagas, miocarditis, y las asociadas a las reparaciones de cardiopatías congénitas). El tratamiento de la gran mayoría de estas TV es percutáneo. Sin embargo el éxito de la ablación de las TV focales, con o sin cardiopatía asociada, dependerá de la localización de los focos arritmogénicos, existiendo riesgo de perforación alto en los focos subepicárdicos así como en los focos de ventrículo derecho. En estos casos la cirugía puede estar indicada. Aunque la reciente introducción de la ablación epicárdica a través de punción subxifoidea, guiada por ecocardiografía, fluoroscopia y sistemas de mapeo electroanatómico, abre una opción atractiva para el tratamiento en el laboratorio de electrofisiología, pero con resultados diversos por el momento51,52.
La cirugía es una alternativa en pacientes con difícil control de la TV posreparación de la tetralogía de Fallot y en seleccionados pacientes sin cardiopatía isquémica4. La indicación es clase IIb, basada en la experiencia retrospectiva de diversos centros4,53-55.
Taquicardias ventriculares asociadas a cardiopatía isquémicaUna vez descartada la isquemia miocárdica aguda como causa de arritmias ventriculares, y resuelta la revascularización miocárdica56, tenemos las TV debidas a un circuito reentrante que se origina en la región del infarto por escara de fibrosis. En los casos en los que es posible el mapeo de la taquicardia, la ablación en el punto de salida del circuito localizado en el borde del área infartada suele ser curativa. Sin embargo no todas las TV son ablacionables, debido a múltiples factores (focos epicárdicos de difícil acceso o de alto riesgo de complicaciones, inestabilidad hemodinámica, trombo intracavitario, etc.).
La cirugía es una alternativa para pacientes con difícil control de la TV recurrente con infarto previo y aneurisma ventricular, particularmente si precisan de revascularización coronaria4. La indicación es clase IIb, basada en la experiencia retrospectiva de diversos centros4,57-59.
El tratamiento quirúrgico contempla realizar la ablación por vía endomiocárdica de los circuitos previamente localizados en el laboratorio de electrofisiología, debiéndose confirmar en quirófano la ablación correcta de la zona arritmogénica a través de sistemas de estimulación eléctrica y mapeo. En casos de aneurisma ventricular asociado, la resección del aneurisma y la escara endomiocárdica, con la plastia de remodelado ventricular con parche circular (intervención de Dor), ha mostrado tasas de erradicación de la TV del 90%60. Aun con estos resultados y la simplicidad de la técnica de la crioablación quirúrgica, desde la implantación de los DAI, son pocos los centros quirúrgicos que mantienen una gran actividad en el tratamiento de las arritmias ventriculares.