La obstrucción congénita al vaciamiento del ventrículo izquierdo, consistente en el estrechamiento a uno o varios niveles de su porción de salida condicionando sobrecarga de presión, supone el 5-6% del total de las cardiopatías congénitas.
Las posibles manifestaciones clínicas (insuficiencia cardíaca, angina, síncope y/o endocarditis) son variables en frecuencia y momento temporal de presentación, si bien hoy en día la mayoría de pacientes se intervienen estando todavía asintomáticos. Las formas severas de estenosis aórtica valvular son las de debut clínico más precoz. La estenosis aórtica subvalvular es rara en neonatos y lactantes y más frecuente en niños pequeños. En muchas ocasiones se asocia a estenosis aórtica valvular. La estenosis aórtica supravalvular es la más infrecuente de las tres formas de estenosis aórtica congénita, la de presentación clínica más tardía y tiene una fuerte asociación con el síndrome de Beuren-Williams.
La ecocardiografía sigue siendo la prueba diagnóstica de elección en la evaluación pre y postoperatoria de la obstrucción congénita a la vía de salida izquierda.
Se revisan las distintas opciones técnicas quirúrgicas para reparar estas cardiopatías y sus resultados hospitalarios y en seguimiento tardío
Left ventricle congenital outflow tract obstruction consists of a narrowing of one or more levels of the outlet portion that conditions pressure overload, and represents 5–6% of all congenital heart diseases.
Possible clinical manifestations (heart failure, angina, syncope and/or endocarditis) are variable in frequency and temporal onset, although nowadays most patients are asymptomatic at the time of surgery. Severe forms of valvular aortic stenosis are the first to debut clinically. Subvalvular aortic stenosis is rare in neonates and infants and more common in young children, and often associated with aortic valve stenosis. The supravalvular aortic stenosis is the rarest of the three forms of congenital aortic stenosis, and has a strong association with Williams–Beuren syndrome.
Echocardiography remains the diagnostic test of choice in the preoperative and postoperative evaluation of congenital left outflow tract obstruction.
The different surgical repair techniques and in-hospital and subsequent follow-up results are reviewed.
La obstrucción congénita al vaciamiento del ventrículo izquierdo consiste en el estrechamiento a uno o varios niveles de su porción de salida, condicionando una sobrecarga de presión. La localización de la estenosis puede ser:
- –
A nivel valvular, con importante diferencia fisiopatológica según a qué edad se inicie su presentación clínica, pudiendo clasificarse en:
- 1.
Neonatal o del lactante.
- 2.
Del niño pequeño y del adolescente.
- 3.
Presentación tardía en el adulto.
- 1.
- –
A nivel subvalvular, distinguiéndose en este caso otras 2 entidades:
- 1.
Discreta (membrana/rodete fibroso).
- 2.
Tuneliforme.
- 1.
- –
A nivel supravalvular, también con 2 presentaciones diferentes:
- 1.
Forma localizada a nivel de la unión sinotubular aórtica.
- 2.
Forma difusa.
- 1.
- –
Coartación de aorta (CoA)/hipoplasia de arco aórtico.
La CoA con o sin hipoplasia concomitante del arco aórtico, al ser objeto de estudio de otro monográfico, la estenosis aórtica de presentación en el adulto tardía y la miocardiopatía hipertrófica obstructiva, en la que existe un componente dinámico, no considerándose una cardiopatía congénita y que debe diferenciarse de la estenosis subaórtica, no serán tratadas en esta revisión
EpidemiologíaEs difícil precisar la incidencia aislada (entre el 5 y el 6% del total)1 de estas cardiopatías congénitas (CC), frecuentemente asociadas a formas más o menos severas de hipoplasia de cavidades izquierdas o al síndrome de Shone (estenosis mitral+estenosis subaórtica+CoA).
En cualquier caso, la estenosis aórtica (EAo) valvular es la forma más frecuente de obstrucción al tracto de salida del ventrículo izquierdo (TSVI). Es 3 veces más frecuente en varones.
La EAo subvalvular es la segunda causa de obstrucción al TSVI. Supone el 8-30% del total de EAo y su incidencia es también mayor en el sexo masculino.
La EAo supravalvular es la menos frecuente de las 3 formas de obstrucción al TSVI, afecta por igual a ambos sexos y se asocia al síndrome de Beuren-Williams en un 40-60% de los casos2.
Clínica y fisiopatologíaCualquiera de las formas de obstrucción condiciona una sobrecarga de presión sobre el ventrículo izquierdo (VI) que conlleva su hipertrofia concéntrica y fisiología hiperdinámica. La evolución temporal de esta sobrecarga de presión condicionará finalmente la dilatación y la aparición de disfunción ventricular.
A largo plazo, pueden ocurrir situaciones, incluso sin fibroelastosis del VI, de hipertensión pulmonar secundaria a disfunción diastólica severa, con importante elevación de la presión telediastólica ventricular, a pesar de estar la función sistólica conservada.
Las manifestaciones clínicas son variables en frecuencia y en momento temporal de presentación. Pueden darse una o varias entre todas las siguientes: insuficiencia cardíaca (ICC) hasta shock, angina, síncope y/o endocarditis. La posibilidad de muerte súbita es anecdótica y solo si el gradiente pico es superior a 100mmHg.
Las formas severas de EAo valvular son las de comienzo más precoz (período neonatal o lactancia precoz) y con más frecuente asociación a hipoplasia de cavidades izquierdas.
La EAo subvalvular es rara en neonatos y más frecuente en niños pequeños. A veces se ha considerado una lesión evolutiva más que una CC presente al nacer. Esto explicaría su aparición en el seguimiento tardío de otras cardiopatías congénitas reparadas, como, por ejemplo, tras la corrección de algunas comunicaciones interventriculares (CIV3,4).
La EAo supravalvular suele ser la que más tardíamente produce síntomas de las 3 formas de EAo y presenta una fuerte asociación con el síndrome de Williams.
DiagnósticoSe realiza mediante ecocardiografía. Proporciona información sobre la tipología de la obstrucción, su severidad medida en forma de gradiente instantáneo y gradiente medio de presión, el grado de hipertrofia y/o dilatación del VI y su funcionalidad. Permite también medir la presión pulmonar y descartar lesiones asociadas. La tomografía computarizada (TC) o el cateterismo raramente son necesarios, siendo la primera la prueba diagnóstica de elección si existen dudas sobre el arco aórtico o la anatomía coronaria, y el segundo, gracias a la medida directa de presiones, para confirmar la severidad de la lesión o cuando coexisten lesiones a varios niveles.
Estenosis aórtica valvularEs la malformación congénita de los velos de la válvula aórtica, que se encuentran fusionados y frecuentemente engrosados, condicionando obstrucción severa en etapas precoces de la vida.
Morfología valvularLo más frecuente es que las válvulas malformadas sean bicomisurales (65% de los casos). Sin embargo, la mayoría tienen 3 triángulos intercomisurales subvalvulares. Son tricomisurales el 30% y unicomisurales solo un 5%. El anillo (unión aorto-ventricular) suele ser hipoplásico y en las formas severas el VI puede presentar fibrosis subendocárdica y placas extensas de fibroelastosis endocárdica.
Anomalías cardíacas asociadasSe han descrito grados variables de hipoplasia de cavidades izquierdas, anomalías de la válvula mitral, CIV, persistencia del ductus, además de EAo subvalvular y/o supravalvular.
Presentación clínica, progresión e historia natural de la enfermedadComo ya se ha reseñado, la EAo valvular es la más precoz de las 3 formas de EAo.
Cuando los síntomas aparecen en el período neonatal y en cualquier caso antes del primer año de vida, la ICC es de aparición muy precoz, condicionando acidosis, shock y el fallecimiento del paciente si no recibe tratamiento.
Cuando los síntomas aparecen en niños mayores de un año, la ICC es rara y el pronóstico con tratamiento es mejor.
En este grupo, el 40% requerirá tratamiento (percutáneo o quirúrgico) antes de los 25 años. Del mismo modo, el 70% de los que a esa edad presentan gradiente pico transvalvular > de 50mmHg, aunque estén asintomáticos, necesitarán intervención.
En general, es válido el algoritmo «a mayor severidad en la presentación, mayor rapidez de progresión», de modo que el 20% de EAo leves se hacen moderadas o severas en 10 años, y en 20 años les ocurre otro tanto al 45%. El 60% de las EAo moderadas pasan a ser severas a los 10 años de evolución5.
Indicación de tratamientoFrecuentemente, la primera decisión a tomar en estos pacientes, en los que la estenosis valvular aórtica se acompaña de grados variables de hipoplasia anular y en ocasiones no es la única lesión en el corazón izquierdo, es si el enfermo tolerará una reparación biventricular o, por el contrario, deberá seguir la vía del ventrículo único6.
Definido el paciente como reparable hacia 2 ventrículos, la presencia de síntomas debidos a estenosis aórtica valvular es indicación de tratamiento.
En el paciente asintomático no hay evidencia científica de cuándo debe ser tratado. La mayoría de los grupos optan por hacerlo con gradientes instantáneos superiores a 50mmHg y datos de hipertrofia ventricular izquierda.
Opciones técnicasEl reto técnico de cualquier procedimiento empleado es aliviar la salida del VI ampliando la zona de estenosis, con conservación del anillo valvular sin causar una insuficiencia valvular aórtica (IAo) no tolerable, ya que son niños en crecimiento y su medida de anillo valvular es muchas veces inferior a la mínima prótesis existente en el mercado. Se trata de ganar tiempo conservando la propia válvula nativa, para que los pacientes lleguen en las mejores condiciones a la edad en la que se ha completado el crecimiento, donde seguramente necesitarán la interposición de prótesis valvular con técnicas de ampliación del anillo aórtico (Nicks, Manougian, Konno, Bentall-Konno), o alternativamente una cirugía de Ross-Konno, si se opta por evitar la anticoagulación oral permanente.
La valvulotomía percutánea, realizada por primera vez en 1983 por Lababidi, es hoy en día la técnica de elección en casi todos los centros en el tratamiento de la EAo severa del neonato, lactante y del niño-adolescente.
La valvulotomía quirúrgica bajo circulación extracorpórea descrita por Spencer et al. en 19587, sin embargo, todavía desempeña su papel en determinados centros y condiciones, así:
- –
En la EAo severa del neonato y lactante, es técnica de elección para Vohué, en París8, o para el grupo de Santk Augustin9, y en determinadas anatomías (tricomisurales) para el grupo de Birmingham10.
- –
En la EAo severa del niño y adolescente: técnica de elección para los anteriores salvo Birmingham, y además para Stellin (Padua)11.
El procedimiento técnico se realiza mediante aortotomía transversa, procediendo a identificar las comisuras verdaderas, que son las únicas que se abren con bisturí oftalmológico hasta casi el anillo valvular, sin descolgarlas. Es preferible cierta estenosis residual que insuficiencia importante por comisurotomía demasiado agresiva.
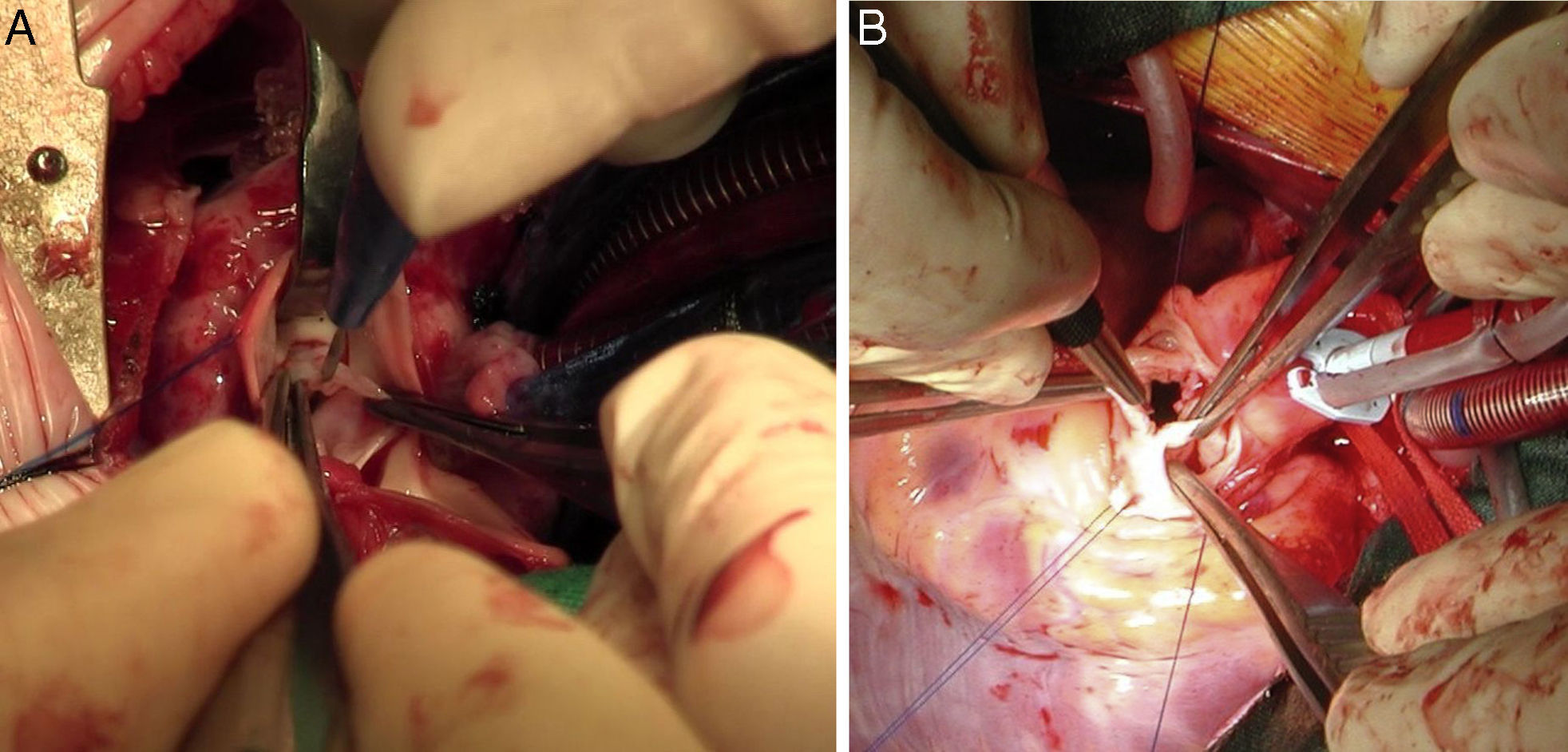
Además, la cirugía tiene importancia fundamental como técnica de rescate en situaciones de valvulotomía percutánea fallida con o sin (IAo) asociada, ya sea mediante comisurotomía quirúrgica +/– valvuloplastia o mediante técnica de Ross-Konno (fig. 1).
ResultadosAmbos procedimientos, quirúrgicos y percutáneos, deben considerarse solamente paliativos, con una importante tasa de reestenosis. Cuando esta ocurre, tampoco existe acuerdo de si es mejor la dilatación percutánea o la cirugía abierta, como proponen Brown et al. (Indianápolis)12.
Neonatos y lactantesMortalidad hospitalaria muy variable (0-21%). La mayoría alrededor del 6%.
Resultados tardíos (seguimiento medio superior a 10 años): supervivencia entre el 90-100%. Libertad de reintervención del 53%. Libres de recambio valvular aórtico entre el 57-79%9,13.
Niños mayores y adolescentesMortalidad hospitalaria en torno al 2%.
Resultados tardíos: supervivencia del 72% a los 30 años. Libertad de reintervención a los 20 años del 62-70%. Libres de recambio valvular aórtico a los 10 años el 85%14-16.
Estenosis aórtica subvalvularConsiste en la obstrucción a la salida del VI por debajo del plano valvular causada por un anillo corto (a veces incompleto) fibroso/fibromuscular, lo que ocurre en el 80% de los casos, o por un largo túnel fibroso (20% restante).
MorfologíaComo forma aislada (sin asociarse, por ejemplo, a una EAo valvular) aparece solo en el 50-65% del total y entonces la válvula aórtica suele ser tricúspide. El anillo fibroso puede adherirse a la base de implantación de uno o varios velos. El septo muscular bajo el velo coronariano derecho puede presentar hipertrofia asimétrica, contribuyendo a la obstrucción.
Asociaciones frecuentesGrados variables de hipoplasia de cavidades izquierdas, síndrome de Shone, anomalías aisladas del aparato subvalvular mitral, CIV, defectos del septo auriculoventricular, estenosis pulmonar (EP) y Fallot.
Presentación clínica, progresión e historia natural de la enfermedadComo ya se ha comentado, es rara en neonatos y más frecuente en niños pequeños. Aquí también es válido el algoritmo de que cuanto más severa y precoz es su aparición, mayor es su velocidad de progresión.
Algunos pacientes pueden presentar IAo asociada, generalmente leve.
Sin embargo, la EAo subvalvular, superada la adolescencia sin clínica, tiene un comportamiento mucho menos progresivo17.
Indicación de cirugíaEn pacientes con síntomas la indicación de cirugía es unánime.
De nuevo, no existe consenso en pacientes asintomáticos, pudiendo diferenciar una actitud más conservadora, que intervendría con gradientes instantáneos superiores a 50mmHg y/o gradiente medio superior a 30mmHg junto con datos de hipertrofia ventricular izquierda, y otra más agresiva, que llevaría al enfermo a quirófano con gradiente pico de tan sólo 30mmHg.
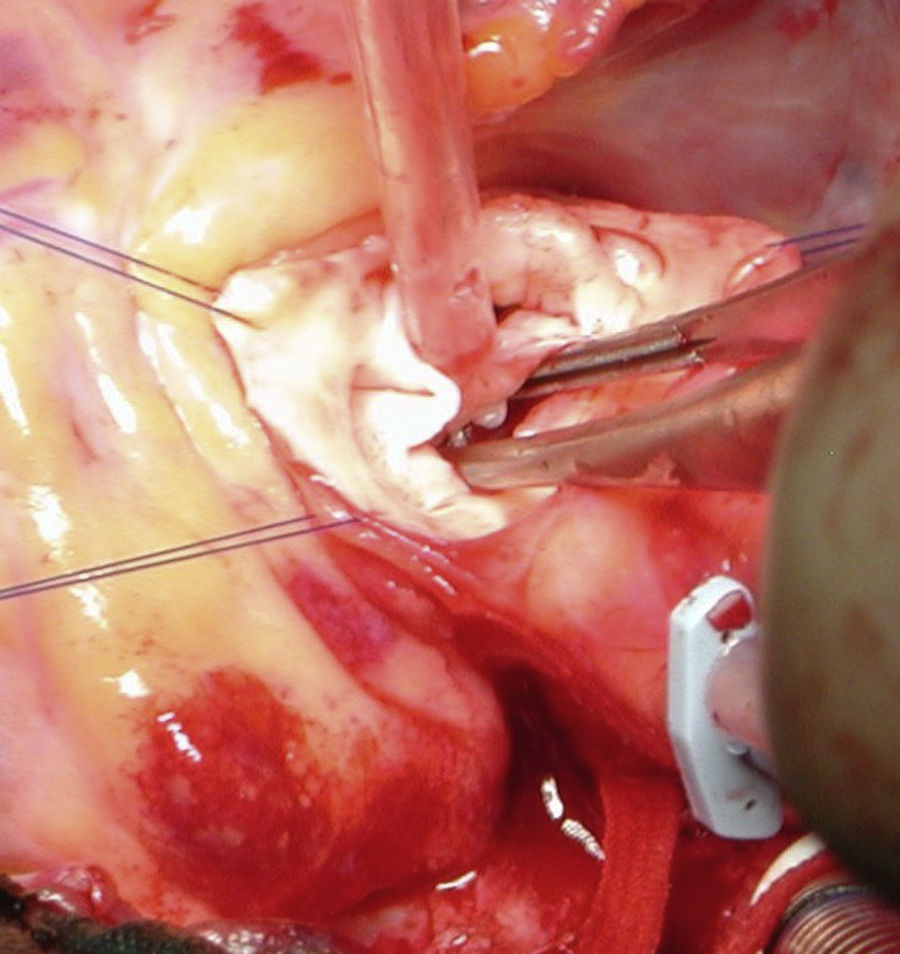
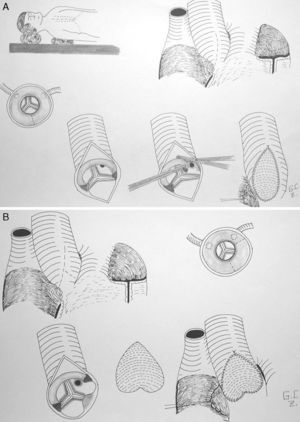
Técnicas quirúrgicasEstenosis aórtica subvalvular tipo rodeteAortotomía transversa baja y enucleación de la membrana mediante técnica de McKay-Ross18. No existe consenso sobre si la asociación de forma rutinaria de una miectomía cuando la hipertrofia de la vía de salida es concéntrica, previene la recurrencia de la membrana, si bien algunos grupos defienden esta práctica19 (fig. 2).
Estenosis aórtica subvalvular tuneliforme sin estenosis aórtica valvularCirugía tipo Konno modificado20. Se realiza mediante una aortotomía transversa y una infundibulotomía en ventrículo derecho, a través de la que se incide el septo interventricular, que se reseca, y se sustituye mediante algún tipo de material protésico (Dacron, pericardio heterólogo...). Desde la aortotomía, se comprueba la integridad del anillo y de los velos de la válvula aórtica, completando a veces la sutura de la porción más superior del parche. Esta técnica permite una mejor exposición del septo interventricular, consiguiéndose resecciones mucho más bajas, agresivas y resolutivas que con la miectomía transaórtica clásica.
Si coexiste además EAo valvular asociada con hipoplasia anular, situación frecuente, son posibles todas estas opciones técnicas:
- –
Aortoventriculoplastia anterior tipo Konno.
- –
Recambio de raíz aórtica con reimplante coronario y autoinjerto pulmonar+aortoventriculoplastia anterior (Ross-Konno).
- –
Recambio de raíz aórtica con conducto valvulado+reimplante coronario y aortoventriculoplastia anterior (Bentall-Konno).
- –
Conducto ápico-aórtico.
Se optará por una u otra, dependiendo de la edad, condiciones anatómicas del paciente, preferencia del enfermo o sus representantes legales y de la experiencia y resultados del cirujano o grupo quirúrgico con las mismas.
ResultadosForma discretaLa mortalidad hospitalaria inicialmente publicada, del 6-8%, ha mejorado significativamente. En la actualidad, oscila entre el 0 y el 4%. La supervivencia a largo plazo es buena (85-95% a 15 años), pero con una recurrencia significativa y variable: Serraf describe un 11%, pero reinterviniendo con gradientes muy elevados, Brauner un 20% y el grupo de Boston hasta de un 30%21-25. Grupos diferentes han identificado distintos factores de riesgo (edad temprana en la primera intervención, coexistencia de CoA, gradiente residual elevado muy precoz...) asociados a una mayor recurrencia y necesidad de reintervención24-27. Las complicaciones posibles son el bloqueo auriculoventricular completo transitorio o definitivo, que obligue al implante de marcapasos, la realización de una CIV accidental y la aparición de IAo, mitral o de ambas, de origen iatrogénico, por lesión de algún velo valvular. La cirugía de la EAo subvalvular discreta no previene la IAo, si acaso la empeora25,28.
Forma tuneliformeMortalidad hospitalaria variable según el grupo de edad. En lactantes y niños pequeños, se publica entre el 15 y el 20%, mientras que en niños mayores y adolescentes la mortalidad disminuye: 5-15%. Series más recientes, como la de Boston, mejoran significativamente los resultados29,30.
Lo heterogéneo de las técnicas (Konno, Konno modificado, Ross y Bentall-Konno...) por la frecuente coexistencia de EAo valvular hace difícil precisar la supervivencia a largo plazo y la libertad de reintervención, pero en general el conducto ápico aórtico en niños es lo más desfavorable, con mortalidad hospitalaria entre el 11 y el 22% y necesidad de reintervención entre el 24 y el 78%31. Las complicaciones quirúrgicas son similares a las descritas para la forma discreta (tabla 1A y tabla 1B).
Experiencia del Servicio de Cirugía Cardíaca InfantiI del Hospital La Paz con la EAo subvalvular en<de 15 años (período 2007-julio 2013)
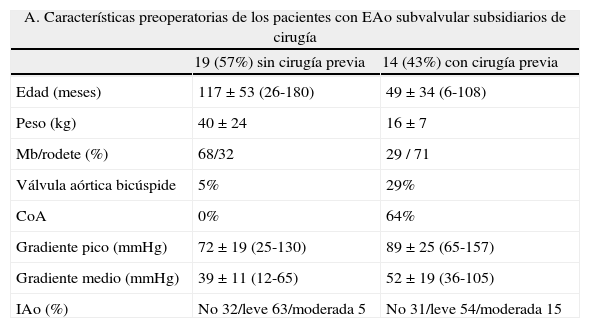
| A. Características preoperatorias de los pacientes con EAo subvalvular subsidiarios de cirugía | ||
| 19 (57%) sin cirugía previa | 14 (43%) con cirugía previa | |
| Edad (meses) | 117±53 (26-180) | 49±34 (6-108) |
| Peso (kg) | 40±24 | 16±7 |
| Mb/rodete (%) | 68/32 | 29 / 71 |
| Válvula aórtica bicúspide | 5% | 29% |
| CoA | 0% | 64% |
| Gradiente pico (mmHg) | 72±19 (25-130) | 89±25 (65-157) |
| Gradiente medio (mmHg) | 39±11 (12-65) | 52±19 (36-105) |
| IAo (%) | No 32/leve 63/moderada 5 | No 31/leve 54/moderada 15 |
| B. Resultados quirúrgicos hospitalarios de los pacientes con EAo subvalvular | ||
| 19 (57%) sin cirugía previa | 14 (43%) con cirugía previa | |
| Técnica quirúrgica | Resección mb/rodete 100%Miectomía asociada 53% | Resección mb/rodete 29%Resección mb+miectomía 50%Konno modificado 7%Ross-Konno 14% |
| Cirugía asociada | 10% | 50% |
| Tiempo CEC (min) | 70±23 (49-142) | 120±65 (60-285) |
| Tiempo pinzado (min) | 46±19 (27-99) | 89±61 (30-240) |
| Mortalidad hospitalaria | 5% | 0% |
| Intubación (h) | 37±153 (0-672) | 23±46 (1-166) |
| Días de reanimación (media ± DE) | 4,5±5,8 (1-28) | 5±3,7 (2-13) |
| Días de hospitalización (media ± DE) | 7±5 (4-28) | 10±4 (6-19) |
| C. Seguimiento de los pacientes con EAo subvalvular sometidos a cirugía | ||
| 17 sin cirugía previa | 14 con cirugía previa | |
| Meses de seguimiento (media ± DE) | 23±17 (0-61) | 35±18 (1,8-64) |
| Reoperación | 0% | 14% |
| Mortalidad tardía | 5,5% | 0% |
| Gradiente pico (mmHg) | 24±19 (8-63) | 39±43 (5-157) |
| Gradiente medio (mmHg) | 12±9 (4-31) | 22±28 (36-105) |
| IAo (%) | No 20/leve 60/moderada 20 | No 7/leve 57/moderada 36 |
(media ± DE)
Se trata de 33 CEC sobre 31 pacientes, el 85% varones y el 88% asintomáticos en el momento de la cirugía. Se diferencian 2 grupos, el de pacientes que tenían una o más intervenciones previas (CoA aislada 7 pacientes, hipoplasia o interrupción de arco aórtico+CIV 2 casos, EAo subvalvular previa 4 pacientes, CIV 3 casos, defectos del septo auriculoventricular 3 pacientes y DSVD tipo CIV un caso) y el de los que no tenían ninguna cirugía previa.
CIV: comunicación interventricular; CoA: coartación de aorta; CEC: circulación extracorpórea; DSVD: doble salida de ventrículo derecho; EAo: estenosis aórtica; IAo: insuficiencia aórtica; Mb: membrana subaórtica.
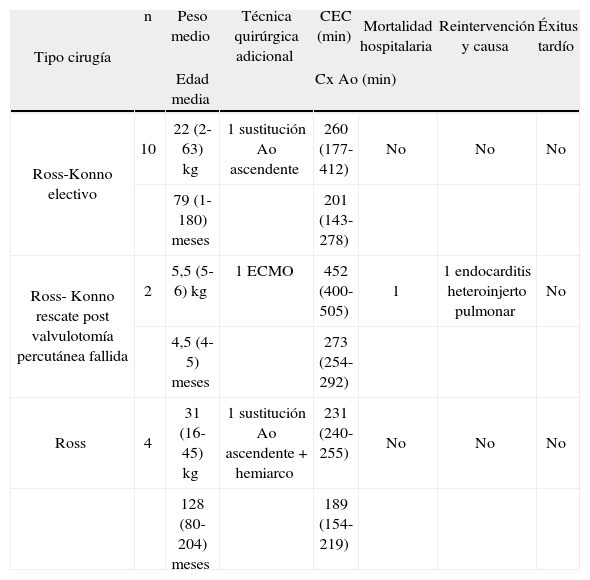
Experiencia quirúrgica del Servicio de Cirugía Cardíaca Infantil del Hospital La Paz con el recambio de raíz aórtica mediante autoinjerto pulmonar (Ross y técnicas derivadas). Período 2008-julio 2013
| Tipo cirugía | n | Peso medio | Técnica quirúrgica adicional | CEC (min) | Mortalidad hospitalaria | Reintervención y causa | Éxitus tardío |
| Edad media | Cx Ao (min) | ||||||
| Ross-Konno electivo | 10 | 22 (2-63) kg | 1 sustitución Ao ascendente | 260 (177-412) | No | No | No |
| 79 (1-180) meses | 201 (143-278) | ||||||
| Ross- Konno rescate post valvulotomía percutánea fallida | 2 | 5,5 (5-6) kg | 1 ECMO | 452 (400-505) | 1 | 1 endocarditis heteroinjerto pulmonar | No |
| 4,5 (4-5) meses | 273 (254-292) | ||||||
| Ross | 4 | 31 (16-45) kg | 1 sustitución Ao ascendente + hemiarco | 231 (240-255) | No | No | No |
| 128 (80-204) meses | 189 (154-219) | ||||||
Ao: aorta; CEC: circulación extracorpórea, Cx Ao: pinzado aórtico; ECMO: extracorpórea prolongada con oxigenador; min: minutos.
Es el estrechamiento localizado o difuso de la luz aórtica inmediatamente por encima del plano valvular, obstruyendo la salida del VI.
Hasta en un 60% de los casos esta cardiopatía se asocia al síndrome de Beuren-Williams, que a nivel vascular se expresa como un trastorno de la elastina por mutaciones en el gen 7q11.23, condicionando un engrosamiento de la media e hiperplasia intimal. También se ha descrito asociación al síndrome de Marfan en un 5% de los casos.
MorfologíaForma localizadaSe caracteriza por la presencia de un anillo fibroso entre el plano valvular y la unión sino tubular (UST), determinando un aspecto externo en «reloj de arena».
Forma difusaForma todavía más infrecuente (alrededor del 20% de todas las EAo supravalvulares). El engrosamiento de la media y la hiperplasia intimal se extienden a varios segmentos o a toda la aorta ascendente, arco, istmo y origen de troncos supraaórticos.
Lesiones asociadas en la raíz aórticaA nivel del plano valvular, se describen la presencia de válvula aórtica bicomisural hasta en el 40%, la posibilidad de hipoplasia anular asociada y el engrosamiento de los velos aórticos en el 30%. Este es uno de los mecanismos de oclusión coronaria por fusión al seno y al anillo fibroso descritos en esta entidad.
Además, se reporta obstrucción subvalvular hasta en el 30% de los pacientes. Los senos de Valsalva pueden estar moderadamente dilatados.
Se describen 2 tipos de lesiones coronarias:
- –
Estenosis ostial (principalmente a nivel de ostium izquierdo, con posibilidad de oclusión completa).
- –
Desarrollo de ateromatosis coronaria precoz.
La más frecuente estenosis de arterias pulmonares periféricas, con o sin significación clínica. También existen casos con EP central, CoA con o sin ductus persistente y CIV.
ClínicaEl debut clínico puede producirse desde la niñez hasta los 20-30 años.
Los síntomas son la angina (el más frecuente), la disnea y el síncope. Además, en muchos casos están presentes los estigmas y las manifestaciones del síndrome de Beuren-Williams (cara de elfo, retraso mental con hiperafectividad, hipercalcemia, estenosis pulmonar periférica).
Raramente puede producirse muerte súbita, más frecuente cuando se asocian EP periféricas.
DiagnósticoSe realiza mediante ecocardiograma. La TC y el cateterismo se emplean para descartar lesiones asociadas en arterias pulmonares y exploración coronaria.
Indicación quirúrgicaEn pacientes con síntomas atribuibles a la EAo supravalvular está indicada la cirugía.
En pacientes asintomáticos, de nuevo la mayoría de los grupos llevan al paciente a quirófano con gradiente instantáneo superior a 50mmHg.
Técnica quirúrgicaForma localizadaSon varias las técnicas descritas y también distintos los materiales protésicos empleados para reparar esta lesión. Aquí se citan las 4 más frecuentemente reproducidas, pero existen más variantes:
- 1.
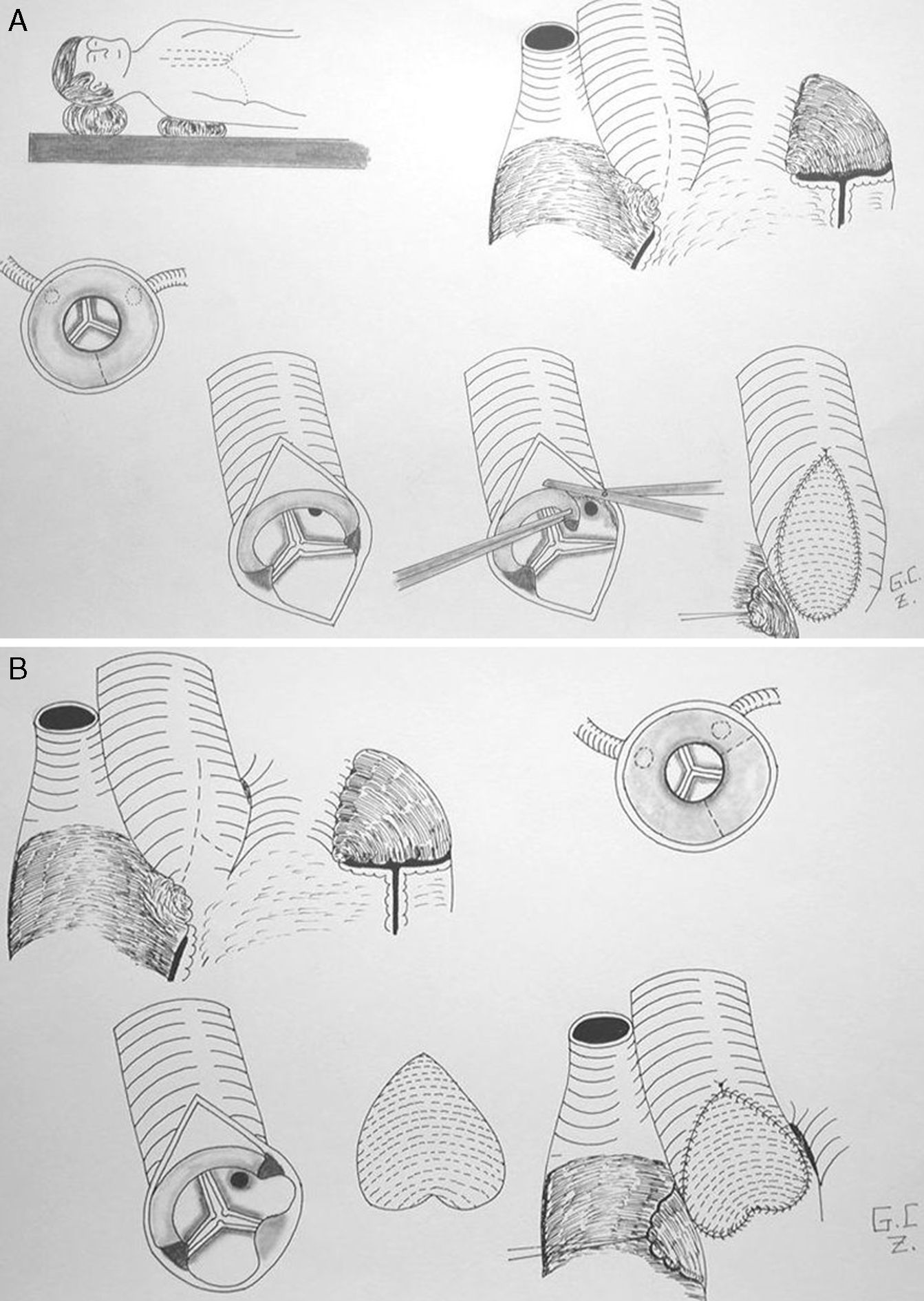
Aortoplastia clásica, o de McGoon, o de un solo seno de Valsalva. Con la aortotomía, se supera y secciona el anillo fibroso de la UST al extenderla hacia el seno de Valsalva no coronariano (a veces hacia el coronariano derecho). Posteriormente, se cierra la aortotomía con un parche de ampliación en forma de «lágrima». La técnica original describe la resección del anillo fibroso, pero esta práctica no es llevada a cabo por muchos cirujanos habitualmente32.
- 2.
Aortoplastia de 2 senos (técnica de Doty). En este caso, se realiza una incisión en la aorta en «Y» invertida, de forma que la aortotomía se extiende y secciona el anillo fibroso a nivel del seno coronariano derecho y del no coronariano. Posteriormente, se utiliza un parche de ampliación en «pantalón» o en «corazón invertido»33 (fig. 3).
- 3.
Aortoplastia de los 3 senos (técnica de Brom). Se realiza una aortototomía transversa justo por encima de la UST. Se inciden los 3 senos de Valsalva, seccionando el anillo fibroso en 3 puntos, ampliándose cada uno de ellos con un parche triangular invertido del material protésico que se considere. Posteriormente, se realiza una sutura término-terminal de la aorta ascendente con la raíz aórtica ampliada.
- 4.
Aortoplastia por deslizamiento (técnica de Myers-Waldhausen). Esta técnica no emplea material protésico. Secciona la aorta también justo por encima de la UST, abre los 3 senos de Valsalva a semejanza de la técnica de Brom, realiza 3 cortes en la aorta ascendente por encima de la UST y vuelve a suturar una porción con otra rotando 90° el cabo distal de la aorta con respecto a la raíz, de forma que los triángulos de un lado se acoplan con los del otro34.
Además, con cualquiera de las técnicas descritas, si existe obstrucción de alguno de los ostium coronarios, debe tratar de repermeabilizarse, pudiendo ser necesario algún tipo de plastia valvular aórtica cuando algún velo valvular está implicado en el mecanismo de obstrucción coronario y resulta lesionado al resecar la fibrosis que bloquea el seno del que nace el ostium, o un bypass coronario adicional si el paciente presenta una superficie corporal adecuada y la fibrosis afecta también al trayecto inicial de alguna arteria coronaria35.
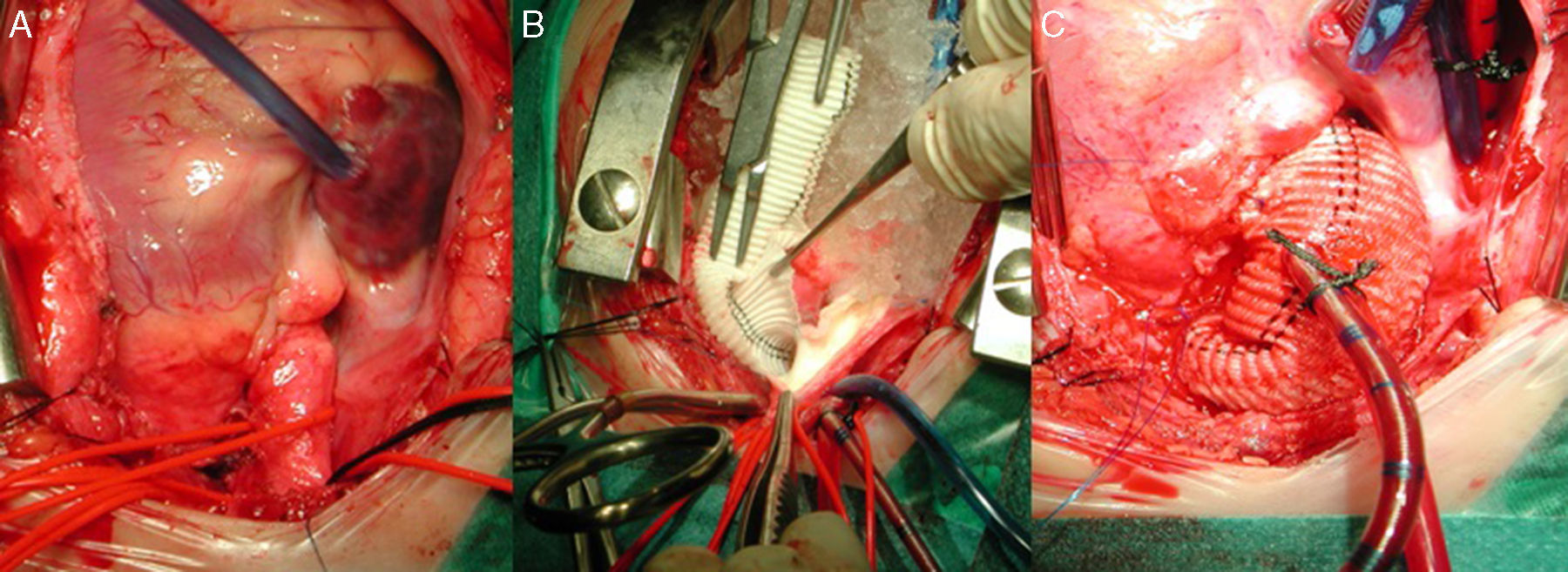
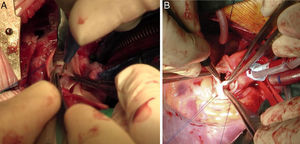
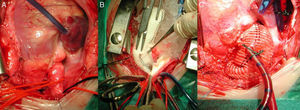
Forma difusaAortotomía desde el seno de Valsalva no coronariano, extendida hasta superar la porción estenótica (aorta ascendente, arco e istmo) de la aorta. Posterior aortoplastia mediante parche de ampliación, generalmente de Dacron o pericardio heterólogo, de la aorta ascendente y/o el arco y el istmo en hipotermia. Si la lesión interesa al arco aórtico, es necesario el empleo de técnicas de perfusión cerebral selectiva o parada circulatoria total (fig. 4).
Secuencia de reparación de una EAo supravalvular difusa. A) Severa hipoplasia de toda la arteria aorta. B) Mediante perfusión cerebral selectiva a través del tronco arterial braquiocefálico derecho, aortoplastia de ampliación con parche de Dacron de toda la aorta, desde distal al istmo, hasta el seno de Valsalva no coronariano. C) Resultado final de la aortoplastia, habiendo recolocado la cánula arterial en el parche para el recalentamiento y salida de CEC.
Mortalidad hospitalaria entre el 0 y el 9%, dependiendo de la antigüedad de la serie y/o si incluye formas difusas, de resultado quirúrgico más adverso.
Supervivencia a largo plazo: Leiden publica una supervivencia del 91% a 10 años y del 61% a 20 años. Boston del 96% a 10 años y del 77% a 20 años.
Necesidad de reintervención a largo plazo variable: Brown (Indianápolis), en un seguimiento medio de casi 10 años, 14%; el Texas Heart Institute, 22%. La libertad de reintervención en la serie de la Mayo Clinic en el año 2012 es del 97, el 93 y el 86% a 5, 10 y 20 años, respectivamente.
En cuanto a los factores de riesgo relacionados con la necesidad de reintervención, la Mayo apunta a la enfermedad valvular aórtica asociada y Boston a las formas difusas en las que la ampliación quedó limitada a la raíz aórtica36–39.
Tampoco hay acuerdo en si existen diferencias entre las distintas técnicas en cuanto a necesidad de reintervención: Boston encuentra significación estadística entre aortoplastia de un solo seno frente a 2 o más senos ampliados (más favorable esta última opción). Leiden no encuentra diferencias significativas entre las distintas técnicas, ni tampoco la Clínica Mayo comparando las técnicas de McGoon y Doty. Scott (Colorado) tampoco encuentra significación estadística al comparar la aortoplastia por deslizamiento sin ningún tipo de material protésico (Myers-Waldhausen), con el resto de las técnicas que sí lo emplean37,38,40,41 (tabla 1C).
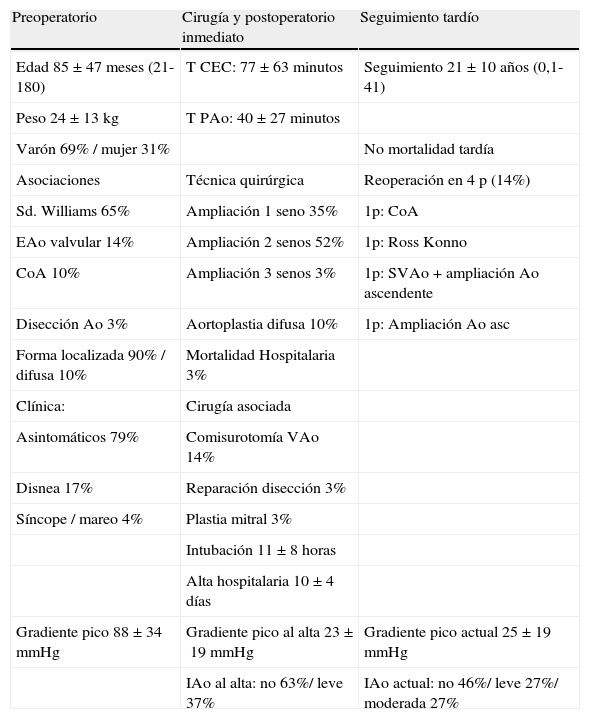
Experiencia del Servicio de Cirugía Cardíaca InfantiI del hospital La Paz con la EAo supravalvular en < de 15 años (período 1972-Julio 2013)
| Preoperatorio | Cirugía y postoperatorio inmediato | Seguimiento tardío |
| Edad 85±47 meses (21-180) | T CEC: 77±63 minutos | Seguimiento 21±10 años (0,1-41) |
| Peso 24±13 kg | T PAo: 40±27 minutos | |
| Varón 69% / mujer 31% | No mortalidad tardía | |
| Asociaciones | Técnica quirúrgica | Reoperación en 4 p (14%) |
| Sd. Williams 65% | Ampliación 1 seno 35% | 1p: CoA |
| EAo valvular 14% | Ampliación 2 senos 52% | 1p: Ross Konno |
| CoA 10% | Ampliación 3 senos 3% | 1p: SVAo+ampliación Ao ascendente |
| Disección Ao 3% | Aortoplastia difusa 10% | 1p: Ampliación Ao asc |
| Forma localizada 90% / difusa 10% | Mortalidad Hospitalaria 3% | |
| Clínica: | Cirugía asociada | |
| Asintomáticos 79% | Comisurotomía VAo 14% | |
| Disnea 17% | Reparación disección 3% | |
| Síncope / mareo 4% | Plastia mitral 3% | |
| Intubación 11±8 horas | ||
| Alta hospitalaria 10±4 días | ||
| Gradiente pico 88±34 mmHg | Gradiente pico al alta 23±19 mmHg | Gradiente pico actual 25±19 mmHg |
| IAo al alta: no 63%/ leve 37% | IAo actual: no 46%/ leve 27%/ moderada 27% |
T CEC: tiempo de circulación extracorpórea; T Pao: tiempo de pinzado aórtico; CoA: coartación; SVAo: sustitución valvular aórtica; EAo: estenosis aórtica; IAo: insuficiencia aórtica; Ao: aorta; VAo: válvula aórtica.
Se trata de 29 CEC sobre 29 pacientes: en las columnas de la tabla, de izquierda a derecha se describen respectivamente las características preoperatorias, quirúrgicas y del postoperatorio inmediato, y por último las del seguimiento tardío.
Los autores declaran no tener ningún conflicto de intereses.