El tratamiento de revascularización de la enfermedad aortoilíaca oclusiva ha experimentado un cambio muy importante con la aparición de las técnicas endovasculares. En esta revisión repasaremos las distintas estrategias de tratamiento en este sector, comenzando por la cirugía abierta (técnicas de revascularización anatómica, como la extraanatómica) y finalizando con el tratamiento endovascular. En esta última sección, no solo describiremos la técnica sino que también repasaremos los materiales necesarios, los diferentes tipos de stent, así como diferentes consejos y trucos relevantes para llevar acabo con éxito este tipo de intervenciones.
There has been a major change in revascularisation options for occlusive aortoiliac disease with the advent of endovascular techniques. In this review we will examine the different treatment strategies in this sector, starting with open surgery (anatomical revascularisation techniques, such as extra-anatomical) and ending with endovascular treatment. In this last section, we will describe not only the technique but also review the necessary materials, the different types of stents, and relevant tips and tricks to perform this type of intervention successfully.
Ningún otro territorio ha experimentado un cambio tan importante en el paradigma de tratamiento tras la irrupción de las técnicas endovasculares como el sector aortoilíaco. En líneas generales, las indicaciones para tratamiento revascularizador en la enfermedad oclusiva aortoilíaca (EOAI) son las mismas que para el sector infrainguinal, aunque, con frecuencia, se acepta intervenir lesiones aisladas que tienen menor repercusión clínica si son favorables para tratamiento endovascular. El tratamiento conservador se indica en pacientes asintomáticos o con claudicación no invalidante (estadios I y iia de Fontaine, categorías 0 a 2 de Rutherford).
Según distintos estudios, el 70% de los pacientes con claudicación intermitente permanecerán estables o experimentarán mejoría al cabo de 5 años y empeorarán el 20-30%. Durante ese tiempo, únicamente un 10-15% de los claudicantes evolucionarán a una isquemia crónica que amenace la extremidad y precise intervención, y tan solo el 1-3% perderán la extremidad. Por tanto, la morbimortalidad más importante en este grupo de pacientes tiene que ver con el riesgo elevado de enfermedad coronaria y cerebrovascular. El objetivo de la revascularización en estos casos será mejorar los síntomas de claudicación y la calidad de vida cuando estos sean limitantes y no mejoren tras un adecuado tratamiento médico. El grado de limitación es más definido por el paciente que objetivable por ninguna prueba: para una persona joven cuya ocupación laboral le exija caminar o que vea impedida su capacidad para determinada actividad vocacional o recreativa, claudicar a 300 m podría considerarse limitante; mientras para una persona añosa o con vida sedentaria quizá resultaría suficiente.
Recientemente se ha abandonado el concepto de isquemia crítica, definida mediante estrictos criterios, por el de isquemia crónica que amenaza la extremidad1, más práctico, al hacer referencia a un amplio espectro de situaciones en el contexto de una isquemia crónica avanzada que supone riesgo de amputación. Es en este grupo de enfermos en el que resulta más evidente la conveniencia de llevar a cabo una revascularización, salvo situaciones sobrepasadas o pacientes con grave deterioro, que obligan a determinar si se obtendría un beneficio significativo tras un procedimiento que fuera técnicamente exitoso.
El estudio con Doppler continuo, que evalúa la amplitud y morfología de las ondas, junto con un índice tobillo/brazo (iT/B) sigue siendo de gran utilidad al tratarse de una prueba sencilla que aporta información tanto en el preoperatorio como para el seguimiento. En claudicantes, ante discrepancias entre la gravedad de la clínica que relata el paciente y los hallazgos obtenidos mediante pruebas objetivas, una claudicometría resulta adecuada. Una vez determinada la necesidad de la intervención con base en la clínica y estado general del paciente, es preciso concretar qué tipo de procedimiento sería el más apropiado, para lo que se precisará de pruebas de imagen. En ausencia de insuficiencia renal grave, se hará una angiografía con tomografía computarizada (angio-TC) en la cual se visualice, al menos, el abdomen completo y las extremidades inferiores para la correcta planificación del procedimiento. Si existe la sospecha de una enfermedad adicional de la aorta torácica, del arco y sus ramas o de la extremidad superior que pudieran comprometer un eventual acceso arterial humeral, el estudio incluirá el tórax. La angio-TC permite evaluar la extensión y características de la enfermedad aortoilíaca, incluida la localización de la oclusión en relación con las arterias renales y la extensión de la calcificación de los vasos (tiende a sobrestimar las lesiones). Esto resulta especialmente relevante en la valoración de las arterias femoral común y femoral profunda, como arterias de acceso endovascular, vasos para anastomosis y de salida principal de la revascularización. La eco-Doppler color arterial y la angiografía mediante resonancia magnética (angio-RMN) son otras opciones para los pacientes que no pueden ser estudiados con una angio-TC con seguridad. Sin embargo, la eco-Doppler color presenta limitaciones, dado que una evaluación completa de la aorta y los vasos ilíacos puede resultar dificultosa debido al hábito corporal del paciente, los gases intestinales y la sombra de la calcificación, además de ser dependiente del operador. La angio-RNM es una modalidad de imagen que tiende a sobrestimar el grado de estenosis y tiene el riesgo de producir una fibrosis sistémica nefrogénica en pacientes con insuficiencia renal grave en caso de emplearse gadolinio. La arteriografía de sustracción digital con contraste yodado o CO2 solo se utiliza, habitualmente, en un entorno terapéutico y no para la planificación preoperatoria.
La toma de decisiones adecuada debe considerar, además de las comorbilidades y el riesgo quirúrgico del paciente, el tipo y características de la lesión, así como la experiencia del operador con una u otra modalidad revascularizadora.
Con respecto al tipo de lesión, en el año 2007 salió a la luz una nueva actualización, adaptada a la realidad del momento, del documento de consenso entre distintas sociedades médicas y quirúrgicas sobre el manejo de la enfermedad arterial periférica, que, además de Europa y Estados Unidos, incluía sociedades científicas de Australia, Sudáfrica y Japón (TASC II)2.
En él se abordan todos los aspectos referentes a la enfermedad oclusiva arterial periférica. Destaca la clasificación de las lesiones en 4grupos de acuerdo con su gravedad y con el objeto de establecer la mejor opción de tratamiento revascularizador para cada caso. El tratamiento endovascular sería la primera opción para las lesiones menos graves (tipo A y también preferente para lesiones tipo B), mientras el tratamiento quirúrgico se reservará para lesiones más complejas (lesiones tipo D y también preferente para lesiones tipo C)3.
La mayor experiencia adquirida con el tratamiento endovascular de los cirujanos vasculares junto con los avances tecnológicos surgidos en el campo de la imagen y los dispositivos endovasculares han hecho que cada vez se trate mayor número de lesiones complejas TASC C y D con stent cubiertos en pacientes de más edad y con mayor comorbilidad, tal como Banafsche et al. reflejaron recientemente en el registro ILIACS4.
La guía de la Society for Vascular Surgery publicada en 20155 contempla el tratamiento endovascular como una opción de primera línea para la revascularización de pacientes con EOAI difusa (incluyendo enfermedad aórtica extensa u oclusión completa del eje ilíaco). En la guía europea, elaborada 2años más tarde de forma conjunta por la European Society of Cardiology y la European Society for Vascular Surgery6, se matiza que en pacientes de bajo riesgo quirúrgico con oclusiones aortoilíacas debe considerarse el bypass aortobifemoral y reservar el tratamiento endovascular para lesiones largas o bilaterales en pacientes con importante comorbilidad (clase IIa, evidencia B), si bien deja la puerta abierta a una primera estrategia endovascular en lesiones oclusivas aortoilíacas si el procedimiento es llevado a cabo por un equipo con experiencia, siempre y cuando no impida o disminuya las posibilidades de éxito de una cirugía abierta en caso de que fuera necesaria en el futuro (clase IIb, evidencia B).
Tanto para la cirugía abierta como endovascular, uno de los factores que determinará la permeabilidad del procedimiento será la calidad de los vasos de salida (outflow), en general, la arteria femoral común, que frecuentemente se encuentra afectada por la enfermedad arteriosclerótica (60-70% de los casos).
Para la EOAI extensa en pacientes con riesgo quirúrgico bajo, la cirugía convencional continúa considerándose el tratamiento de referencia, si bien datos recientes publicados por Antonello et al. ya indican que con los procedimientos endovasculares se están alcanzando resultados equiparables de permeabilidad (permeabilidad primaria a 5 años 87,3% y 81,4%, respectivamente), con las ventajas añadidas de un procedimiento menos invasivo; excepto para las mujeres, para quienes la cirugía convencional continuaría siendo la opción más recomendable7.
Durante el proceso de toma de decisiones, se debe tener presente que se han objetivado excelentes resultados con el bypass aortobifemoral en pacientes de edad avanzada que presentan riesgo quirúrgico bajo, mientras se reportan inferiores tasas de permeabilidad en pacientes jóvenes y en aquellos que tienen diámetros del sector aortoilíaco reducidos, como es frecuente en el caso de las mujeres. Esto aconseja ser restrictivos a la hora de indicar, no solo el tratamiento endovascular, sino también la cirugía abierta, en pacientes claudicantes y con arterias pequeñas.
La tendencia actual a relegar la cirugía abierta como segunda línea de tratamiento ha hecho aumentar su complejidad técnica de forma significativa; ahora se indica con frecuencia para aquellos casos que precisan una reintervención por fracaso de tratamiento endovascular o de pontajes previos, o en pacientes con enfermedad más grave y multinivel que precisan varios procedimientos de revascularización simultáneos, o en caso de mayor necesidad de pinzamiento suprarrenal y revascularización renovisceral. Técnicas extranatómicas, como el bypass femorofemoral y axilofemoral, antes reservadas para pacientes con riesgo quirúrgico elevado, han caído en desuso, sustituidas por tratamiento endovascular, generalmente de preferencia en dichos casos.
En nuestra experiencia de más de 10años con procedimientos endovasculares complejos en el sector aortoilíaco, la opción endovascular constituye la primera línea terapéutica también para pacientes que presentan EOAI grave y extensa, incluso con un riesgo quirúrgico estándar, reservando la cirugía abierta para aquellos con a) oclusión aórtica yuxtarrenal, b) pacientes jóvenes con oclusión de ambas hipogástricas que presentan una arteria mesentérica inferior muy desarrollada cuando el tratamiento endovascular obligaría a su sacrificio, c) oclusiones aortoilícas largas con calcificación intensa y extensa y d) pacientes con ejes ilíacos pequeños (< 6mm), en especial mujeres8.
Revascularización quirúrgicaTécnicas anatómicasBypass aortobifemoralEs la intervención de referencia (gold standard) con la cual el resto de los procedimientos, tanto abiertos como endovasculares, deben compararse. Se trata de una intervención con una morbimortalidad significativa y que, por tanto, debe evitarse en los pacientes que presentan riesgo quirúrgico elevado (fig. 1A).
A) Injerto bifurcado aortobifemoral con anastomosis aórtica T-T y reimplante de arteria mesentérica inferior. B) Técnica de revascularización alternativa en un paciente con obstrucción aórtica yuxtarrenal, oclusión de arteria renal derecha y de los troncos digestivos. La aorta descendente era inadecuada como inflow (ectásica y con trombo). Se practicó bypass desde aorta ascendente, retrohepático, retropancreático a ambas arterias femorales comunes, con revascularización anterógrada del tronco celíaco y arteria mesentérica superior mediante pontajes con vena safena.
La exposición de la aorta infrarrenal puede llevarse a cabo mediante distintas vías, fundamentalmente una laparotomía media xifopúbica o un abordaje retroperitoneal izquierdo9.
También se han empleado la laparotomía pararrectal izquierda (algo más laboriosa que la laparotomía media, se lleva a cabo sobre el músculo recto anterior izquierdo, abriendo longitudinalmente su fascia anterior y posterior, lo que facilitaría el cierre en 2planos) y la laparotomía subcostal bilateral o transversa, si bien esta última no es recomendable para casos de enfermedad oclusiva, ya que se sacrificará importante circulación colateral a través de las arterias epigástricas, lo que incluso puede causar necrosis del borde inferior de la herida.
La laparotomía media permite un rápido y versátil acceso a la aorta infra- y pararrenal, a las arterias renales y digestivas y a ambos ejes ilíacos. Como inconvenientes cabe mencionar la incomodidad de las asas intestinales en el campo quirúrgico, la mayor pérdida insensible de líquidos consecuencia del largo tiempo de exposición, la necesidad de realizar una adecuada cobertura de la prótesis en el retroperitoneo y la posibilidad de presentar adherencias intestinales en el futuro.
La vía retroperitoneal izquierda tiene como ventaja que permite una adecuada exposición de la aorta infra- y pararrenal e incluso de la aorta supraceliaca, lo que resulta un excelente abordaje en pacientes obesos. También resulta ventajosa en pacientes con antecedentes de cirugía abdominal previa o con riñón en herradura. La pérdida de líquidos durante la intervención es menor, el tiempo de recuperación del tránsito intestinal es más corto, se minimiza el riesgo de presentar adherencias intestinales y no precisa llevar a cabo la cobertura del injerto en el retroperitoneo. Como ventajas se mencionan también menor incidencia de complicaciones respiratorias y menor estancia hospitalaria. La evidencia existente al respecto es de muy baja calidad y no demuestra ventajas sobre la vía transperitoneal. Como inconvenientes cabe citar: que resulta más demandante técnicamente, un acceso limitado a la arteria renal derecha y al trayecto del eje ilíaco derecho y mayor incomodidad para la disección de la arteria femoral común derecha, especialmente en obesos.
En general, se opta por un injerto de dacron como conducto, cuyo diámetro debe elegirse en función del que presenten los vasos de salida, casi siempre un 16×8mm se adapta bien en la mayoría, aunque, en casos con arterias pequeñas, un 14×7mm o 14×6mm pueden ser más convenientes, si bien también se puede utilizar prótesis de PTFe10.
En cuanto al tipo de anastomosis aórtica proximal, se puede llevar a cabo una anastomosis término-terminal (T-T) o término-lateral (T-L), sin que se haya demostrado superioridad de una sobre otra. La anastomosis T-T puede resultar preferible cuando exista una oclusión yuxtarrenal o alta de la aorta infrarrenal, ya que no se sacrificaría la circulación colateral y la anastomosis quedaría menos prominente, más fácil de cubrir, en una zona de riesgo para fístula aortoentérica. En este caso debe garantizarse el cierre del muñón aórtico distal. La anastomosis T-L sería de elección cuando el sector aortoilíaco, aunque muy enfermo, mantenga cierta permeabilidad y preserve flujo a la arteria mesentérica inferior, una arteria renal accesoria o las hipogástricas.
Cuando la arteria mesentérica inferior se encuentre permeable y no refluya de forma pulsátil, es recomendable su reimplante en el injerto, pues en caso de hipotensión postoperatoria y necesidad de aminas, el riesgo de isquemia de colon es muy alto.
Por último, hay que resaltar la importancia de garantizar una adecuada anastomosis distal, ya que en definitiva será lo que condicione la permeabilidad del procedimiento a largo plazo. Las anastomosis pueden ser llevadas a cabo sobre la arteria femoral común, salvo la existencia de lesiones significativas; quizá sea precisa una endarterectomía local con o sin profundoplastia mediante parche o insinuando la sutura de la rama hacia la arteria femoral profunda. Cuando la arteria femoral profunda sea el único vaso de salida, especialmente si es menor de 4-5mm de diámetro, debe valorarse la conveniencia de suturar la prótesis sobre un cuff o sobre un parche de material autógeno.
Es fundamental que la prótesis abdominal quede aislada de las asas intestinales. Un error común, en la cuarta porción duodenal, es cerrar exactamente por la misma línea de apertura, ya que aquí el duodeno es retroperitoneal en parte y, por tanto, eso lo dejaría en íntimo contacto con la prótesis implantada, con el subsiguiente riesgo de fístula aortoentérica. En ocasiones, será preciso practicar una cobertura de la prótesis con epiplón mayor (omentoplastia), teniendo la precaución de evitar cualquier restricción en el diámetro del colon que pudiera ocasionar una dificultad de tránsito a posteriori.
Una técnica útil que hemos empleado en casos puntuales, cuando la aorta por debajo de las arterias renales resulta impracticable por calcificación grave, consiste en abordar la aorta supraceliaca mediante laparotomía media a través del epiplón menor, tras desplazar el lóbulo caudado superiormente hacia la derecha, seccionando los pilares del diafragma, y realizar la anastomosis proximal en la aorta supraceliaca (pinzamiento lateral o transversal) mediante un injerto protésico que luego es tunelizado por vía retropancreática y, más tarde, retroperitoneal siguiendo la aorta infrarrenal y ambos ejes ilíacos hasta ambas ingles. También, tal como se comentó, la aorta suprarrenal y supraceliaca pueden exponerse mediante un abordaje retroperitoneal abdominal y llevar a cabo un bypass aortobifemoral mediante un pinzamiento lateral en la aorta.
Técnicas extraanatómicaasBypass femorofemoralEn gran medida su indicación ha disminuido por la proliferación de técnicas endovasculares. Debe garantizarse tanto un adecuado inflow a través del eje ilíaco (si es preciso mediante la realización de una ATP, angioplastia transluminal percutánea, con o sin stent), como una buena salida por la arteria femoral profunda o superficial. Es transcendental evitar una acodadura del bypass en las anastomosis, lo cual debe tenerse presente, especialmente, en pacientes obesos, cuando se encuentren en bipedestación o sentados. Para ello, con el bypass debería utilizarse una prótesis anillada (típicamente de 8mm), siguiendo un trayecto en «S» o en «C», dependiendo de las condiciones anatómicas locales. Las premisas ya mencionadas que garantizan una adecuada anastomosis distal deben tenerse siempre presentes11.
Bypass axilofemoral y axilobifemoralSu indicación también ha caído tras el desarrollo de las técnicas endovasculares. Se precisa una anestesia general con el paciente en decúbito supino. Deben descartarse lesiones en al arteria axilar donante mediante eco-Doppler o angio-TC. Una diferencia de presión>10mmHg entre ambos brazos indica existencia de lesiones en esa zona. En caso de no existir diferencias, puede seleccionarse como lado donante aquel donde la clínica sea predominante. Actualmente existen injertos dedicados de dacron o politetrafluoroetileno (PTFE) anillados (8mm) con rama bifemoral.
Bypass transobturadorSu principal indicación es la infección del triángulo de Scarpa y en ingles hostiles (p. ej. múltiples disecciones previas, radiación, etc.). La arteria donante suele ser el eje ilíaco ipsilateral o la aorta, pero incluso podría ser el eje ilíaco contralateral, accesibles mediante un abordaje habitual retro- o transperitoneal. La elección del material del injerto puede variar en función del contexto.
Bypass toracobifemoralGeneralmente se lleva a cabo en pacientes con antecedentes de cirugía convencional reiterada o con contraindicación para ella. En nuestra experiencia no encontramos necesario aquí el tubo de doble luz: con el hemitórax izquierdo levantado unos 45° y la pelvis paralela a la mesa, se realiza exposición de la aorta descendente distal a través del 8.° o 9.° espacio intercostal izquierdo.
De manera excepcional, otras alternativas menos frecuentes son posibles, como el bypass desde la aorta ascendente siguiendo un trayecto retrohepático o retropancreático hacia ambos trípodes femorales (fig. 1B).
Revascularización endovascularMaterial endovascularIntroductores, guías y catéteresLa mayoría de los procedimientos de recanalización en la EAOI se pueden realizar con un material básico endovascular. Los introductores más usados son los cortos de 11cm de 5-6F para iniciar el procedimiento y realizar la recanalización de la lesión, pasando después a introductores de 7-9F (preferiblemente con punta radiopaca) para la liberación del stent. Se recomiendan introductores largos para subir el stent por dentro, con el fin de evitar problemas de daño o dislocamiento en casos de oclusión completa, especialmente si está calcificada, o cuando tenemos que recurrir a la recanalización femoral contralateral o por vía braquial, en cuyo caso usaremos introductores mallados de 35 o 45cm y 90cm tipo DestinationTM (Terumo®) o FlexorTM (Cook®). Las guías más empleadas para la recanalización son las hidrofílicas estándar largas (260/300cm) de punta curva de 0,35” y, excepcionalmente, guías de 0,18” /0,14” en casos que presentan estenosis muy cerradas pero en los cuales no existe una oclusión completa, para evitar así levantar las placas y que se dificulte cruzar la lesión o se origine una vía subintimal no intencionada. Guías de más soporte, de tipo Amplatz o Back-up Meier®, según los casos, se reservan para subir el introductor largo y para que el despliegue del stent sea más seguro y preciso. El catéter de trabajo para acompañar a la guía en la recanalización suele ser un catéter 5F de punta angulada tipo multipropósito, vertebral o Berenstein II, si bien también se utilizan catéteres específicos para recanalización contralateral de la arteria ilíaca primitiva, como el SIM, el SOS o el SHK.
Elección del tipo de stentAunque la selección final del tipo de stent puede depender de la disponibilidad y la familiaridad del operador con cada dispositivo, las distintas propiedades de cada stent y las características del vaso hacen aconsejable el uso de uno u otro tipo (autoexpandible o expandible con balón, no recubiertos o recubiertos). Los stents expandibles con balón están fabricados en acero inoxidable o con una aleación de cromo-cobalto y se suelen usar para el tratamiento de lesiones de la bifurcación aortoilíaca, de las arterias ilíacas comunes calcificadas o de lesiones ostiales. La mayor fuerza radial y la precisión en su colocación los convierten en la mejor opción para el tratamiento de una lesión focal en un área con menor tortuosidad y sin traumatismos externos repetitivos (ligamento inguinal, articulación de la cadera). Los stents autoexpandibles están hechos de nitinol (aleación de níquel y titanio) y son más adecuados para vasos tortuosos, especialmente en áreas de fuerzas externas permanentes, como es el caso de la arteria ilíaca externa. Con estos últimos, no existe la posibilidad de aumentar el diámetro del dispositivo en la posdilatación, por lo que se requiere una medición precisa del tamaño del vaso, evitando el sobredimensionamiento excesivo que aumente el traumatismo crónico y el riesgo de restenosis. Este tipo de stent garantiza una colocación precisa solo en el extremo que se despliega primero, por eso su longitud final puede resultar difícil de prever. Por dicha razón, los stents autoexpandibles cubren lesiones más largas, pero son menos prácticos en lesiones focales. Su baja radiopacidad es otra limitación, con marcas radiopacas en sus externos que facilitan un posicionamiento adecuado.
Los stents recubiertos poseen un núcleo metálico en forma de malla cilíndrica revestida normalmente con PTFE e incluyen plataformas tanto autoexpandibles como expandibles con balón. Gracias a dicho revestimiento, estos stents superan el principal inconveniente del stent descubierto, como es la restenosis «intrastent», al introducir una barrera mecánica entre las paredes y la luz del vaso y evitar potencialmente la migración de macrófagos en la pared vascular atraídos por los mediadores proinflamatorios secretados y que contribuyen al inicio del proceso restenótico. Los stents recubiertos balón-expandibles pueden dilatarse 1-2mm más de su tamaño nominal con un balón de mayor diámetro, incluso alguno como el VBX® (W. L. Gore & Associates, Inc., Flastag, AZ, EE. UU.) permite mucho más sobredimensionamiento, si bien esto redunda en un mayor acortamiento de la longitud total del stent. Aunque en un principio los stents recubiertos se habían reservado en gran medida para el tratamiento de perforaciones ilíacas, lesiones con gran componente trombótico y las restenosis «intrastent», actualmente un número cada vez mayor de trabajos defienden su uso como primera estrategia de tratamiento para lesiones ilíacas complejas de tipo TASC C y D, al haberse obtenido mejores resultados que con los descubiertos12.
Dispositivos de reentradaEl desarrollo de dispositivos de reentrada ha aumentado el éxito técnico en procedimientos complejos, como son las oclusiones crónicas de la arteria ilíaca primitiva y la bifurcación aórtica. Básicamente, facilitan la reentrada proximal en la bifurcación aortoilíaca en los casos de recanalización subintimal retrógrada, que suele verse dificultada por la presencia de calcio. Los dispositivos más usados son el Outback® (CordisTM) y el Pionner® (MedtronicTM). Desde que se ha generalizado el uso del acceso humeral, el porcentaje de utilización de estos dispositivos no supera el 2-3% en la mayoría de las series.
Técnica endovascularPreparación del pacienteEl tratamiento endovascular de la EOAI debe efectuarse, de forma ideal, en un quirófano híbrido, aunque no siempre están disponibles en todas las instituciones; es cierto que estos procedimientos también pueden abordarse de manera segura en otros entornos. Sin embargo, aquellas salas son ideales para pacientes que requieren un abordaje mixto con endarterectomía o bypass asociados, así como para el manejo de complicaciones que requieran conversión a una cirugía abierta. Ambas ingles y uno de los brazos (generalmente el izquierdo) deben incluirse dentro del campo estéril. En nuestra institución, realizamos rutinariamente una preparación quirúrgica desde las mamilas hasta el borde proximal de las rodillas ante la excepcional eventualidad de precisar conversión a cirugía abierta. El brazo derecho puede colocarse pegado al cuerpo del paciente si existe la seguridad de que se puede acceder a la aorta desde la arteria braquial izquierda. La elección del grado de sedación o anestesia variará según el paciente y el alcance de la operación. Aunque algún procedimiento sencillo se puede efectuar bajo anestesia local con sedación (estenosis u oclusiones cortas sin afectación del trípode femoral), habitualmente se opta por la anestesia general o regional para aquellos pacientes más complejos. También habrá de considerarse la comodidad del paciente cuando se tratan lesiones que van a requerir un período de tiempo prolongado. La elección del medio de contraste depende del cirujano según la disponibilidad y la experiencia institucional. Aunque los nuevos agentes de contraste yodados de baja osmolaridad han demostrado ser útiles para reducir el riesgo de nefropatía, resulta ventajoso hacer un esfuerzo por aumentar el número de procedimientos con angiografía mediante CO2, no solo en casos de alergia a los contrastes yodados, sino también con intención de reducir las complicaciones renales, especialmente en población de riesgo (pacientes diabéticos o con deterioro renal previo).
Acceso arterialSegún la anatomía y la extensión de la EOAI, los accesos más empleados son el arterial femoral retrógrado por vía ipsilateral y el femoral anterógrado por vía contraleral cross-over, así como, una combinación del acceso femoral y braquial (generalmente humeral izquierdo) para los casos más complejos. Está demostrado que la punción arterial ecoguiada reduce el tiempo y el número de complicaciones, al identificar el segmento arterial más sano posible para la punción y permitir la visualización directa de la aguja entrando en la arteria femoral común. Siempre que sea factible se deben intentar cruzar las lesiones aortoilíacas desde un abordaje retrógrado-ipsilateral a través de la arteria femoral común: será la estrategia de primera elección en todos los casos de estenosis y en la mayoría de los casos de oclusión completa del eje aortoilíaco. Entre sus ventajas destacan: la menor distancia hasta la lesión, lo que proporciona un mayor empuje para cruzarla usando material más corto y menor radiación, al poder trabajar con colimaciones más amplias y evitar complicaciones derivadas de punciones adicionales. La punción femoral retrógrada puede obtenerse mediante punción directa o precisar de un abordaje quirúrgico abierto en casos con estenosis de la arteria femoral común mayor del 50% o con calcificación intensa, que requerirán asociar, generalmente, una endarterectomía más angioplastia con parche.
La recanalización ilíaca anterógrada con punción femoral contralateral se usa fundamentalmente como técnica de recurso en casos de imposibilidad de recanalización ilíaca (sobre todo, arteria ilíaca primitiva) mediante la punción femoral ipsilateral. Sin embargo, en nuestra experiencia, se indica como primera elección en casos de oclusión aislada de la arteria ilíaca externa porque, a la vez que facilita un estudio angiográfico previo completo, permite una liberación más precisa del stent en la porción proximal de la arteria femoral común en casos de afectación extensa de la arteria ilíaca externa y, sobre todo, evitará una oclusión no intencionada de la arteria ilíaca interna (algo que no se podría garantizar si la recanalización fuera retrógrada por vía subintimal). El acceso humeral se suele usar como técnica de rescate o asociado a un abordaje femoral en casos complejos, como son las oclusiones de la aorta distal o de la bifurcación aórtica, la oclusión de ambas arterias ilíacas externas, la oclusión ipsilateral de una arteria ilíaca externa con oclusión contralateral de la arteria ilíaca primitiva y en los casos en los que el cross-over femoral puede ser muy dificultoso o arriesgado, como en los pacientes tratados mediante EVAR, los que tengan un kissing-stenting aortoilíaco previo y en casos de bifurcación aórtica con un ángulo agudo. El lado izquierdo es preferido para minimizar la manipulación del catéter a través del arco aórtico. La canulación de la arteria braquial derecha estaría indicada, sobre todo, cuando exista compromiso por enfermedad oclusiva de la arteria subclavia izquierda o en pacientes portadores de un acceso vascular en miembro superior izquierdo.
Aspectos técnicos de la recanalizaciónEl procedimiento suele comenzar con la obtención de un acceso (introductor 4-5F) para la arteriografía inicial y la colocación de un introductor 5-6F en la arteria femoral común del sector tras su punción ecoguiada o apertura inguinal (si existe enfermedad grave que haga prever la necesidad de endarterectomía). Se administra heparinización sistémica (1mg/kg).
La lesión se cruza con el uso de una combinación de catéter y guía. Una guía hidrofílica primero seguida de un catéter de punta curva 5F (vertebral, Berenstein, multipropósito, etc.) suele ser la mejor combinación inicial para cruzar la lesión. En el sector aortoilíaco rara vez tenemos que recurrir a guías de chronic total occlusion (CTO), evitando el alto riesgo de perforación, si bien esta complicación, aunque ocurra, no suele ser motivo para abortar el procedimiento.
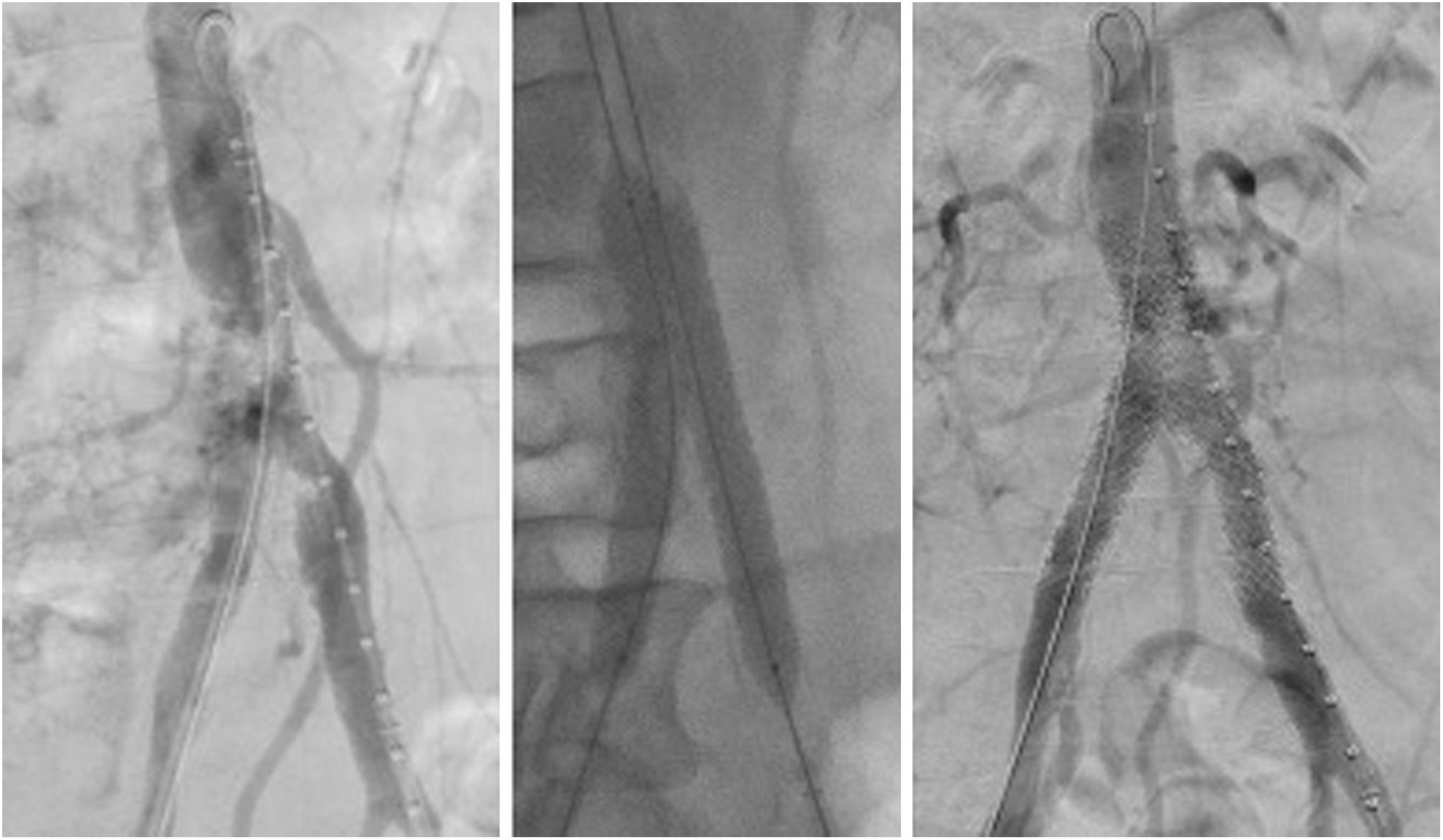
Después de hacer avanzar el catéter sobre la guía hidrofílica cruzando la lesión, tras sobrepasarla (intraluminal o subintimal), se retira y se comprueba que estamos en la luz mediante la aspiración de sangre por el extremo del catéter, girando su punta o haciendo una pequeña inyección de contraste. En aquellos casos complejos (oclusiones largas o muy calcificadas), en los cuales, tras un acceso femoral anterógrado o retrógrado no se ha conseguido atravesar la lesión, puede recurrirse al abordaje humeral mediante el uso de un catéter mallado 5-6F de 70-90cm, que nos permitirá llegar hasta la bifurcación aórtica telescopando por dentro un catéter multipropósito 5F de 125cm para iniciar la recanalización. Cuando fuera preciso recurrir a una recanalización desde la arteria femoral contralateral o desde la humeral, y dado que el stent se implantará de forma retrógrada por vía ipsilateral, la guía se rescatará a través del introductor (del lado de la lesión) o través de la arteria femoral común expuesta por medios quirúrgicos cuando esto fue necesario por enfermedad (fig. 2).
Recanalización del eje ilíaco izquierdo. A) Oclusión completa del eje ilíaco izquierdo. Ausencia de muñón en arteria ilíaca primitiva izquierda. Abundante circulación colateral con arteria mesentérica inferior prominente (flecha blanca). B) Recanalización del eje ilíaco izquierdo mediante kissing-stenting (2 stents recubiertos balón-expandibles VBX® 10×79mm en bifurcación aórtica) y extensión con stent recubierto autoexpandible (Viabahn® 9×150mm) hasta arteria femoral común endarterectomizada. C) Endarterectomía de arteria femoral común izquierda, cierre con parche de pericardio. Obsérvese la guía hidrofílica saliendo a su través.
Si tras el acceso femoral y humeral no conseguimos recanalizar la lesión y con el abordaje retrógrado existe imposibilidad de reentrada proximal en la aorta por persistencia de disección, recurriremos a dispositivos de reentrada. En nuestro caso empleamos el Outback® (CordisTM) a través del abordaje femoral ipsilateral. Una vez pasada la lesión, se colocará una guía de mayor soporte, que generalmente es suficiente una de tipo Amplatz de floppy corto, pero en determinadas situaciones con calcificación y tortuosidad importante podría precisarse una guía más rígida (Back-up Meier®), que permitirá subir el introductor con mayor facilidad (en este punto, normalmente se cambia de introductor y se adecúa al diámetro del stent) y una liberación más segura del stent ilíaco. A la hora de elegir el diámetro del stent, conviene evitar el sobredimensionamiento excesivo para no aumentar la hiperplasia, sobre todo en sus extremos. En oclusiones crónicas largas o muy calcificadas se recomienda subir el stent (sobre todo los expandibles con balón) por dentro de un introductor largo hasta la zona de liberación para evitar su dislocación. Si se trata de un stent autoexpandible, se procederá a posdilatarlo al diámetro de la arteria. El procedimiento finaliza con la angiografía de control. Un dispositivo de cierre se emplea para los casos de acceso femoral percutáneo.
Oclusión de la arteria ilíaca primitivaLa oclusión de la arteria ilíaca primitiva se trata generalmente mediante un abordaje retrógrado ipsilateral. Es precisa la colocación de un catéter angiográfico contralateral para hacer un estudio de diagnóstico completo antes de cualquier intento de recanalización que, además, servirá para un abordaje anterógrado contralateral (cross over) en caso de que la guía no progrese retrógradamente. Resulta importante tratar de recanalizar la lesión vía intraluminal para evitar los problemas de reentrada en la aorta asociados con la recanalización subintimal, que podrían obligar al uso de los dispositivos de reentrada. Si se llevó a cabo un abordaje contralateral, el empleo de un catéter tipo SIM o SOS facilita la recanalización de la arteria ilíaca primitiva. La recuperación de la guía en el lado ipsilateral se consigue mediante una lazada (en caso de abordaje percutáneo) o metiéndola por el introductor ahí previamente colocado. En aquellos casos en los que fue preciso llevar a cabo una disección quirúrgica del trípode femoral, la guía se recupera directamente a través de la arteriotomía. De igual manera, hay que dejar preparado un brazo para un eventual acceso humeral.
Nuestra preferencia ante la oclusión de la arteria ilíaca primitiva es el uso de un stent recubierto expandible con balón y, sin duda, esta debe ser la opción en los casos en los que exista gran calcificación. Si la lesión afecta al ostium de la arteria ilíaca primitiva, es aconsejable practicar un kissing-stenting de la bifurcación aortoilíaca para proteger el lado sano, procurando no introducir los stents en la aorta más de 2cm (fig. 3).
Kissing-stent con stents recubiertos. A) Arteriografia previa al tratamiento en la que se observa un coral reef en la aorta infrarrenal. B) Técnica kissing-stent (2 stents recubiertos balón-expandibles VBX® 11×79mm en bifurcación aórtica). C) Arteriografía de control final en la que se observa permeabilidad de ambos stents, además de la arteria mesentérica inferior y ambas arterias hipogástricas.
La oclusión de la arteria ilíaca externa se suele abordar mejor desde el lado contralateral porque, sobre todo, garantiza la permeabilidad de la arteria hipogástrica, ya que, en caso de que la recanalización retrógrada se hiciese subintimal, quedaría ocluida. Además, permite un tratamiento cómodo y preciso en la transición entre la arteria ilíaca externa y la arteria femoral común. Cuando se recurra al abordaje contralateral y no exista lesión de la arteria femoral común, el stent podría desplegarse directamente mediante este abordaje, asumiendo un mayor riesgo de embolización con esta estrategia.
Es frecuente que la oclusión de la arteria ilíaca externa coexista con afectación de la arteria femoral común, por lo que debe contemplarse una endarterectomía, con o sin profundoplastia, cuando se presente una estenosis mayor del 50%, o hacer una plastia simple con parche si la arteria femoral común es menor de 6mm, tal como sucede a menudo en el sexo femenino, para evitar un sobredimensionamiento del stenting con riesgo de restenosis de la boca distal a posteriori. En estos casos la guía se recupera directamente a través de la arteriotomía y el stent se despliega de forma retrógrada ipsilateral. Para el cierre de la plastia o la endarterectomía femoral, preferimos el uso de un parche biológico de pericardio bovino por su mayor distensibilidad y resistencia a la infección. En las oclusiones de la arteria ilíaca externa nuestra preferencia es emplear un stent recubierto autoexpandible, Viabahn® (W. L. Gore & Associates, Inc., Flastag, AZ, EE. UU.), por su gran conformabilidad, que ouede quedar dentro de la arteria femoral común sin temor a la fractura. En caso de permeabilidad de la arteria hipogástrica y un muñón proximal muy corto en la arteria ilíaca externa, con el fin de mantener la permeabilidad de aquella, se implanta primero un stent descubierto expandible con balón en la transición de arteria ilíaca primitiva a ilíaca externa y, después, el stent recubierto autoexpandible, asumiendo cierto riesgo de restenosis en esta área en el futuro.
Enfermedad de la bifurcación aortoilíacaLas lesiones que afectan a la bifurcación aortoilíaca, incluyendo las lesiones ostiales de la arteria ilíaca primitiva, representan un importante desafío al ser las más complejas de tratar y al necesitar un acceso bilateral a través de ambas femorales y con frecuencia de la arteria humeral izquierda. En estos casos, el kissing-stenting de la bifurcación aortoilíaca es obligatorio. Nuestra preferencia aquí es el uso de stents recubiertos expandibles con balón, ya que permiten hacer un flaring simultáneo de los stents en la aorta por debajo del origen de la AMI para minimizar el espacio muerto entre la pared aórtica y el stent que, desde un punto de vista teórico, podría mermar la permeabilidad al favorecer el flujo turbulento y la trombogenicidad. Para calcular el sobredimensionamiento de la porción aórtica del stent, se debe utilizar la fórmula del área del círculo (A = πr2), usándose habitualmente 2 balones de entre 10mm y 14mm de diámetro por 20 o 40mm de longitud.
Cuando la aorta infrarrenal distal se ve involucrada, la técnica covered endovascular reconstruction of aortic bifurcation (CERAB), que cubre con un stent recubierto balón-expandible y coloca por dentro otros 2de menor tamaño, a modo de kissing con flaring proximal para la bifurcación, constituye una buena alternativa; si bien, en ocasiones puede presentar algunos inconvenientes, como la cobertura de una excesiva longitud aórtica con sacrificio innecesario de ramas de la aorta infrarrenal, fundamentalmente la arteria mesentérica inferior (vía muy importante de colateralidad en muchos de estos pacientes), arterias lumbares o polares renales. También, obliga al uso de al menos 4-5 stents en más del 50% de los casos y es significativa su escasa utilidad para diámetros aórticos mayores de 16mm.
Tratamiento híbridoLos enfoques híbridos son habituales en caso de EOAI extensa, ya que con frecuencia coexiste afectación de la arteria femoral común, en la que una endarterectomía, con o sin profundoplastia, añade seguridad además de mejorar las tasas de permeabilidad, al garantizar el flujo de salida.
En los casos de abordaje ipsilateral, inicialmente se pincha la arteria femoral común a cielo abierto tras su exposición y se recanaliza de forma retrógrada dejando la guía hidrofílica in situ mientras se realiza la endarterectomía (si se hace primero la endarterectomía y luego se pasa la guía se corre el riesgo de que esta no progrese, al estar la arteria disecada). En las recanalizaciones anterógradas la guía es recuperada a través de la arteriotomía. Conseguida la recanalización del eje ilíaco y terminada la endarterectomía, se procede al cierre con parche para finalmente colocar el stent de forma retrógrada sobre la guía, que ha sido sacada a través del parche. De este modo, es factible desplegar, si fuera preciso, el extremo distal del stent recubierto autoexpandible dentro de la arteria femoral común endarterectomizada. Algunos pacientes con EOAI que se presentan con isquemia crítica pueden precisar, además, una revascularización infrainguinal estándar.
Manejo postoperatorioDebe mantenerse una estatina a dosis adecuada, así como doble antiagregación mediante AAS (100mg) y clopidogrel (75mg) durante al menos 3 meses. La anticoagulación oral rara vez está indicada y se reserva para pacientes que presentan estados de hipercoagulabilidad, trombosis recurrente y aquellos con otras indicaciones no relacionadas con el procedimiento.
Resultados del tratamiento revascularizadorPermeabilidad de la revascularización quirúrgicaEl bypass aortobifemoral ofrece buenos resultados, con una tasa de permeabilidad primaria a 5 años de entre el 85% y el 90%, que oscila a los 10 años entre el 75% y el 85%. La permeabilidad secundaria a 5 y 10 años se sitúa alrededor del 95%13. La edad ha demostrado ser un predictor de riesgo de trombosis y ofrece peores resultados en pacientes jóvenes menores de 50 años, con cifras de permeabilidad primaria a 5 años menores del 66%. Sin embargo, otros factores, como el sexo femenino y la oclusión previa de la arteria femoral superficial, que tradicionalmente se consideraban indicadores de peor resultado a largo plazo, son contradictorios en la actualidad. La permeabilidad de la endarterectomía aortoilíaca para casos con enfermedad limitada a la aorta distal y segmentos ilíacos proximales también es buena: permeabilidad primaria a 5 y 10 años del 95% y 90%, respectivamente.
Los pontajes extraanatómicos, bypass femorofemoral y bypass axilobifemoral, ofrecen un peor comportamiento en pacientes con enfermedad oclusiva que las técnicas anatómicas: las cifras de permeabilidad primaria a 5 años son muy variables (en general, rondan el 60-70%), reflejo de la gran heterogeneidad de pacientes tratados11. La permeabilidad a 5 años reportada del bypass transobturador es también variable (57-80%), habiendo sido comunicadas altas tasas de amputación, sobre todo, en caso de infección.
Los resultados del bypass toracobifemoral en las pocas series publicadas son equiparables a los del aortobifemoral; pueden considerarse excelentes si se tiene en cuenta que la mayor parte de las veces se trata de pacientes reintervenidos o en los que no es posible una técnica convencional.
Complicaciones de la revascularización quirúrgicaLos numerosos metaanálisis publicados sobre los resultados del injerto aortobifemoral reflejan una tasa de mortalidad a los 30 días entre el 4% y el 6%, que ha variado poco y que es la causa más frecuente de muerte el infarto de miocardio. Sin embargo, algunas series más recientes reportadas en la última década mencionan tasas de mortalidad perioperatoria cercanas al 1%, atribuibles a una mejor valoración preoperatoria y manejo postoperatorio de los pacientes. La edad avanzada, la enfermedad pulmonar crónica, la insuficiencia renal crónica y el bajo volumen de casos/año en la institución son factores predictivos de mortalidad operatoria. La mortalidad perioperatoria, tanto del bypass femorofemoral como del axilofemoral, se encuentran por debajo del 4%, que pueden considerarse buenas cifras, habida cuenta de que se trata en general de pacientes con elevada morbilidad y riesgo quirúrgico.
Las tasas de morbilidad tras la cirugía aórtica por EOAI varían entre el 17% y el 32%. Entre las complicaciones precoces (<30 días) más frecuentes se encuentran las derivadas del abordaje inguinal (hematoma, linfocele, infección de la herida) en el 3-15%. También, los problemas de la pared abdominal (10-20%) y la disfunción sexual (5-25%). Menos frecuentes pero más graves son el fracaso renal, especialmente en pacientes con deterioro renal previo (3-5%); el infarto agudo de miocardio (1-5%); la neumonía (3-7%); la hemorragia intraperitoneal (2-3%); la lesión del uréter en el 1% - 2% de los casos (durante la disección, tunelización o el cierre retroperitoneal) y, excepcionalmente, la isquemia medular (<1%), la cual puede prevenirse preservando la perfusión de al menos una arteria hipogástrica, evitando la hipotensión periopeatoria y llevando a cabo una técnica cuidadosa que evite el ateroembolia. La isquemia intestinal se produce en el 2% de los casos y el segmento afectado suele ser el rectosigmoideo. Aunque el sacrificio de la arteria mesentérica inferior o de sus colaterales durante la reconstrucción es la causa más común, la hipotensión perioperatoria y la ateroembolia son otros posibles contribuyentes. El reimplante de la AMI si se va a realizar una anastomosis aórtica en terminoterminal puede estar indicado para evitar la isquemia cólica, tal como se ha comentado. Las complicaciones tardías incluyen por orden de frecuencia: la trombosis de rama (5-30%), el pseudoaneurisma anastomótico en el 1-5% (sobre todo de la anastomosis femoral), la infección protésica (0,5-3%) y la fístula aortoentérica en menos del 3% de los casos. Estas 2últimas, aunque poco frecuentes, se asocian a una alta mortalidad (10-35%). En el caso del pontaje transobturador, la complicación más temida es la lesión del nervio y los vasos obturatrices, que causan una hemorragia de difícil control, al margen de la recurrencia de la infección cuando fuera esta la indicación de tratamiento.
Permeabilidad de la revascularización endovascularEl tratamiento endovascular de la EOAI tiene altas tasas de éxito técnico (85-98%), incluso para aquellos casos más complejos, como la oclusión de la bifurcación aortoilíaca.
A pesar de que la evidencia que respalda la estrategia del stenting ilíaco primario frente al selectivo para mejorar la permeabilidad a largo plazo y evitar complicaciones pueda resultar limitada, esta técnica se ha impuesto en la actualidad en la práctica totalidad de los estudios publicados, sobre todo cuando tratamos oclusiones o lesiones complejas. En uno de los últimos metaanálisis publicados, con 5.358 pacientes, en el que se comparaban el bypass aortobifemoral y el tratamiento endovascular en la EOAI, el brazo del stenting incluyó a 1.625 pacientes, con una permeabilidad primaria y secundaria a 5 años del 72% y 82,5%, respectivamente14.
De acuerdo con la clasificación TASC, es posible afirmar que el tratamiento endovascular de las lesiones tipo A y B tienen una permeabilidad primaria a 10 años del 70-80% y secundaria del 85-95%, con una elevada tasa de salvamento de extremidad (>92%), que son cifras comparables a la cirugía abierta. Por el contrario, el tratamiento endovascular de las lesiones tipo C y D ofrece una permeabilidad primaria a 5 años de alrededor del 70%, claramente inferior al bypass aortobifemoral, aunque la permeabilidad secundaria sería comparable (80-85%)2. Sin embargo, la irrupción de los stents recubiertos ha supuesto una auténtica revolución, al permitir competir en tasas de permeabilidad a largo plazo con el bypass aortobifemoral, incluso en las lesiones más complejas. Un reciente metaanálisis demuestra que el stent recubierto es superior a los descubiertos para el tratamiento de las lesiones de tipo C y D15.
En el único estudio aleatorizado publicado hasta la fecha en el que se comparaban los resultados del stent recubierto con los del stent descubierto en el tratamiento de las lesiones complejas (tipo C y D), se reportan tasas de permeabilidad primaria y secundaria a 5 años del 75% y 96%, respectivamente12.
Estos resultados mejoran de forma significativa cuando se emplea el stent autoexpandible recubierto de PTFE en el tratamiento de las lesiones que afectan a la arteria ilíaca externa, que alcanza tasas de permeabilidad primaria y secundaria a 2 años del 88% y 96%, respectivamente16. Dichas cifras concuerdan con las recientemente publicadas por nuestro grupo (permeabilidad primaria y secundaria a 2 años del 96,4%) para el tratamiento de oclusiones completas del eje ilíaco8. Estos buenos datos se observan también con el uso del stent recubierto para kissing-stenting en lesiones de la bifurcación aortoilíaca, con tasas de permeabilidad primaria a 2 años del 91%; incluso con la técnica CERAB, que muestra una permeabilidad primaria y secundaria a 3 años del 82% y 97%, respectivamente.
Complicaciones de la revascularización endovascularLa mortalidad perioperatoria del tratamiento endovascular en la mayoría de las series varía entre el 0% y el 1%, y es poco frecuente la comunicación de cifras superiores. La tasa de morbilidad informada varía ampliamente entre el 3% hasta 20%. Las complicaciones más comunes son las relativas al sitio de punción, como el hematoma inguinal o humeral (4-17%), la trombosis del sitio de punción, sobre todo en la zona humeral (1-6%), y los pseudoaneurismas (0,5-3%). Otras complicaciones son la embolización distal (1-11%), las disecciones arteriales (2-5%) y las roturas de arteria ilíaca o aórtica (0,5-3%). La mayoría de las complicaciones pueden tratarse mediante técnicas percutáneas o no invasivas. Los hematomas suelen resolverse con compresión simple; los pseudoaneurismas, mediante inyección ecoguiada de trombina y, menos frecuentemente, con colocación de un stent recubierto o con reparación abierta. La trombosis del sitio de punción requiere una revisión quirúrgica, trombectomía o colocación de parche. Las disecciones arteriales y las roturas se manejan en su mayoría mediante la colocación de un stent recubierto, mientras que la embolización distal se trata con dispositivos de aspiración o trombólisis y ocasionalmente se emplea trombectomía quirúrgica. Gran parte de estas complicaciones se pueden evitar con una punción ecoguiada y el uso de cierres percutáneos cuando el introductor es mayor de un 5F.
Comparación de cirugía abierta y tratamiento endovascularAun aceptando que las cifras de permeabilidad primaria a largo plazo para la cirugía abierta pueden ser superiores a las de los procedimientos endovasculares, con el aumento de la experiencia, la mejora de los materiales y del equipamiento endovascular, este paradigma se ve cada vez más desafiado, como muestra el estudio de Antonello et al., en el cual no se observaban diferencias significativas de permeabilidad (permeabilidad primaria a 5 años del bypass aortobifemoral de 87,3% y del tratamiento endovascular de 81,4%; p=0,317)7. Debe, además, tenerse presente que la cirugía abierta asocia una mayor morbimortalidad operatoria y hospitalización más prolongada, con la consiguiente repercusión en los costes.
Seguimiento ambulatorioSe recomienda la revisión de los pacientes, tanto tras revascularización abierta como endovascular, a los 3, 6, 12 meses y después, de forma anual. Se debe calcular el iTB con curvas Doppler de miembros inferiores y una exploración con eco-Doppler color, que debe comprender el sector aortoilíaco y femoral, para detectar posibles estenosis que pudieran comprometer la permeabilidad del procedimiento, lo cual permitirá aumentar la permeabilidad primaria asistida. En los casos de bypass aortobifemoral resulta aconsejable hacer una angio-TC cada 5 años.
Conflicto de interesesLos arriba firmantes declaran no tener conflicto de interés en la elaboración de este trabajo.