El tratamiento de la valvulopatía aórtica severa con implante de válvulas transcatéter es una alternativa cada vez más frecuente. Presentamos nuestra experiencia inicial con la prótesis Portico™ Abbott en el Centro Médico Teknon de Barcelona.
Pacientes y métodosEntre febrero de 2020 y junio de 2021 la prótesis aórtica transcatéter Portico™ Abbott se implantó en 30 pacientes (edad media: 75,7±3,1 años, 56,5% varones). Veintinueve fueron implante valvular aislado. En un paciente se realizó además revascularización coronaria. La vía de acceso fue abierta; transfemoral en 22 pacientes (73,3%), transaxilar en 4 (13,3%) y transcarotídea en 4 (13,3%). Los pacientes fueron estudiados al alta y a los 30 días.
ResultadosÉxito del implante en el 100% de los pacientes. Un paciente (3,3%) falleció durante el procedimiento por shock cardiogénico. No hubo complicaciones vasculares ni neurológicas. En 3 pacientes (10.3%) fue necesario implantar un marcapasos definitivo. Hubo fuga mínima residual en 10 pacientes (33,3%) y ligera en 7 (23,3%). El gradiente medio transprotésico fue de 5±0,8mmHg en válvulas nativas y de 10,25±2,2mmHg en valve-in-valve. La estancia en UCI fue de 22,56±4h y la estancia global de 4,1±0,8 días. Control a los 30 días sin otras complicaciones.
ConclusionesLa prótesis transcatéter Portico™ Abbott ha resultado factible, eficaz y muy versátil para adaptarse a escenarios muy variados y de alta complejidad técnica. Las complicaciones han sido bajas, el resultado satisfactorio y el comportamiento hemodinámico precoz excelente.
Transcatheter aortic valve implantation is a good alternative for treatment of severe aortic valvulopathy. We present our initial experience with the Portico™ Abbott prosthesis at Centro Médico Teknon in Barcelona.
Patients and methodsBetween February 2020 and June 2021, 30 patients underwent Portico™ Abbott transcatheter aortic prostheses implant (mean age: 75.7±3.1 years, 56.5% males). Twenty-nine underwent isolated valve replacement. One patient required associated coronary surgery. The approach was open surgical; transfemoral in 22 patients (73.3%), transaxillary in 4 (13.3%) and transcarotid in 4 (13.3%). The patients were studied at discharge and at 30 days.
ResultsThe implant was successful in 100% of the patients. One patient (3.3%) died during the procedure due to cardiogenic shock. There were no vascular or neurological complications. In 3 patients (10.3%) it was necessary to implant a permanent pacemaker. Minimal residual leak in 10 (33.3%), mild in 7 patients (23.3%). Mean gradient: 5±0.8mmHg in native valves and 10.25±2.2mmHg in valve-in-valve cases. ICU stay 22.56±4h and post-procedure stay 4.1 days±0.8. Follow-up at 30 days without other complications.
ConclusionsIn our initial experience, the Abbott™ Portico prosthesis has proven to be feasible, very effective and very versatile to adapt to scenarios of high technical complexity. The complications were low, the results satisfactory and the early haemodynamic performance excellent.
Una de cada 8 personas mayores de 75 años presentarán estenosis valvular aórtica moderada o severa1. Con el envejecimiento de la población, esa tendencia va aumentando, con pacientes de edad avanzada, más frágiles y de mayor riesgo quirúrgico2.
La cirugía de sustitución valvular aórtica es un tratamiento muy efectivo que ha mejorado la supervivencia y la calidad de vida de millones de pacientes3–6.
Sin embargo, un porcentaje significativo de pacientes nunca accedían a la cirugía por considerarse de edad muy avanzada, riesgo inaceptable o gran fragilidad7. Los procedimientos transcatheter aortic valve implantation (TAVI, «implante transcatéter de la válvula aórtica») significaron una nueva alternativa de tratamiento mucho menos intensiva y que evitaba el uso de la circulación extracorpórea y la parada cardíaca.
Desde el primer implante en 20028, la TAVI ha revolucionado el manejo de la estenosis aórtica severa y se ha convertido en el estándar de atención para pacientes inoperables o con alto riesgo quirúrgico, y el tratamiento preferido para muchos pacientes ancianos de riesgo intermedio y bajo9,10. Con el tiempo, se han desarrollado muchas prótesis transcatéter de nueva generación que incorporan características dirigidas a minimizar las complicaciones del procedimiento y mejorar los resultados clínicos11.
Presentamos nuestra experiencia inicial con la prótesis Portico™ con FlexNav™ TAVI System (Abbott Vascular, Santa Clara, CA, EE. UU.), en el servicio de cirugía cardíaca de Centro Médico Teknon de Barcelona.
Material y métodosEntre febrero de 2020 y junio de 2021 se trataron 30 pacientes consecutivos con valvulopatía aórtica severa e indicación de implante TAVI. Los casos fueron realizados por cirujanos cardíacos con la tutoría de otros cirujanos cardíacos expertos. Los criterios de inclusión en el grupo de estudio fueron: presencia de estenosis o insuficiencia aórtica severa sintomática y decisión del equipo de la necesidad de procedimiento transcatéter como mejor opción terapéutica.
A todos los pacientes del grupo se les implantó la prótesis Portico™ Abbott12–14.
La Portico™ Abbott es una prótesis autoexpandible compuesta por un stent de nitinol sobre el que van montados 3 velos de pericardio bovino y un recubrimiento o manguito de sellado de pericardio porcino exterior en la zona de aterrizaje o implante final (fig. 1).
Existen 4 tamaños de prótesis –23, 25, 27 y 29– que cubren un rango de anillo entre 19 y 27mm y un rango de perímetros entre 60 y 85mm.
Entre las características principales de la prótesis Portico™ Abbott destacan:
- -
Única prótesis autoexpandible que se implanta en posición intraanular.
- -
Velos de la prótesis tratados con el sistema Linx™ AC Abbott para mejorar la durabilidad de la bioprótesis.
- -
Nitinol de características únicas; superelastic nitinol con 2 secciones diferentes en la prótesis: una sección anular con alta densidad de celdas y alta fuerza radial para favorecer el anclado y sellado, y una sección aórtica con baja densidad de celdas y menor fuerza radial que favorece la alineación con el eje de la aorta. La baja densidad de celdas y la gran amplitud de estas (20,8Fr) favorece la potencial actuación percutánea posterior sobre las arterias coronarias y minimiza la posibilidad de bloqueo de los ostia coronarios durante el implante.
- -
Prótesis totalmente recapturable hasta liberaciones de hasta el 80%, reposicionable hasta 3 veces y que puede ser plegada en el interior del sistema de liberación a temperatura ambiente, sin necesidad de suero helado o hielo15,16.
- -
Sistema de liberación FlexNav™ Abbott de tamaño 14Fr (arterias con diámetro mínimo de 5,0mm), con introductor integrado, que puede utilizarse tanto por vía femoral como no femoral (axilar, carotídea, aórtica), y que por su gran flexibilidad e hidrofilia permite navegar con facilidad a través del árbol arterial (fig. 2).
Todos los pacientes fueron estudiados con ecocardiograma, coronariografía, angio-TAC y software 3mensio™ (Pie Medical Imaging BV, Bilthoven, Países Bajos). En 14 de los 30 casos también se utilizó la realidad virtual (Visuamed™, Techer Team, Valencia, España) para completar el estudio de la vía de acceso y la zona de aterrizaje.
Todos los procedimientos se realizaron en el quirófano híbrido Azurion™ de Philips de Centro Médico Teknon, y el paciente fue preparado como para una cirugía cardíaca convencional tipo reintervención, incluyendo las zonas femorales y radiales bilaterales. Máquina de circulación extracorpórea con el circuito cebado y preparado. Anestesia general con nuestro protocolo habitual de despertar en quirófano. En todos los casos hubo monitorización continua con ecocardiograma transesofágico.
La vía de acceso fue mayoritariamente transfemoral (73,3%) y el abordaje fue siempre quirúrgico (abierto).
Tras la exposición de la arteria elegida para el acceso, se administró heparina para conseguir tiempos de coagulación>300s. Posteriormente se introdujo por vía radial derecha un catéter pigtail hasta posicionarlo en el seno no coronariano y un electrocatéter provisional por vía vena yugular interna derecha hasta el ventrículo derecho, comprobando su correcto funcionamiento.
A través del pigtail, se realizó una aortografía para verificar la proyección de trabajo inicial (coplanar). Punción de la arteria de acceso con paso de guía y colocación de introductor 7Fr. Paso de una guía curva hasta la raíz de la aorta y sobre ella un catéter AL 1, AL 2 o JR. Intercambio de la guía curva por una guía recta de punta flexible y cruce de la válvula aórtica nativa (o de la antigua prótesis en los casos de valve-in-valve). Una vez pasa la guía, avanzamos el catéter hasta el interior del ventrículo izquierdo. Intercambio de la guía recta por una guía de soporte Safari™ Extra-Small (Boston Scientific, Marlborough, MA, EE. UU.) hasta posicionarla correctamente en la cavidad ventricular izquierda, comprobando por ecocardiograma transesofágico que no afectamos al aparato subvalvular mitral. Se retira el introductor de 7Fr, y a través de la guía de soporte se avanza un introductor DrySeal™ Gore® de 18 o 20Fr o bien el propio sistema de liberación de la válvula directamente.
Seguidamente, se realiza valvuloplastia con balón True™ Dilatation Balloon (Bard Medical, Tempe, AZ, EE. UU.) en aquellos casos con válvula aórtica muy estenótica, durante un periodo corto de sobreestimulación. El tamaño de balón elegido correspondió al mínimo diámetro de anillo aórtico medido por la angio-TAC. No se realizó valvuloplastia en aquellos casos con válvula poco calcificada o en pacientes con insuficiencia aórtica pura.
A continuación, sobre la guía de soporte Safari™, se avanza el sistema liberador con control radiológico hasta posicionarnos en la zona de despliegue, comprobando con angiografía. Se inició el despliegue muy lento de la prótesis corrigiendo la profundidad de implante mediante pequeñas variaciones del plano (generalmente hacia caudal) y con proyección de cusp overlaping para enrasar al máximo. El despliegue se continuó hasta el 80% del máximo (momento en que la prótesis ya abre y cierra) para comprobar de nuevo la posición y completar la liberación también de forma muy lenta. En caso de duda, se recuperó y se reposicionó sin problema. Tras el implante, se retira el sistema de liberación comprobando que no existen zonas aún atrapadas, dejando la guía de soporte en posición y comprobando con el ecocardiograma transesofágico y la angiografía el resultado final.
En los casos en que quedó una fuga periprotésica residual no aceptable, se procedió a realizar una nueva valvuloplastia con un balón de tamaño inferior al diámetro máximo del anillo.
Tras dar por bueno el implante, se retiraron todas las guías y catéteres. Se retiró el introductor y se controló la arteria femoral, cerrando la herida inguinal. Finalmente se administró protamina.
Despertar en quirófano y paso a la Unidad de Cuidados Intensivos (UCI) para monitorización y vigilancia durante 24h.
Se recogieron la mortalidad hospitalaria y la mortalidad a 30 días. Las complicaciones intra y posprocedimiento se reportan de acuerdo con las definiciones de consenso de las guías Valve Academic Research Consortium y Valve Academic Research Consortium-217. También se recogieron las variables demográficas y clínicas (tabla 1), y los datos ecocardiográficos, así como los días de estancia y las complicaciones en el momento del alta. Se realizó seguimiento clínico y ecocardiográfico a los 30 días.
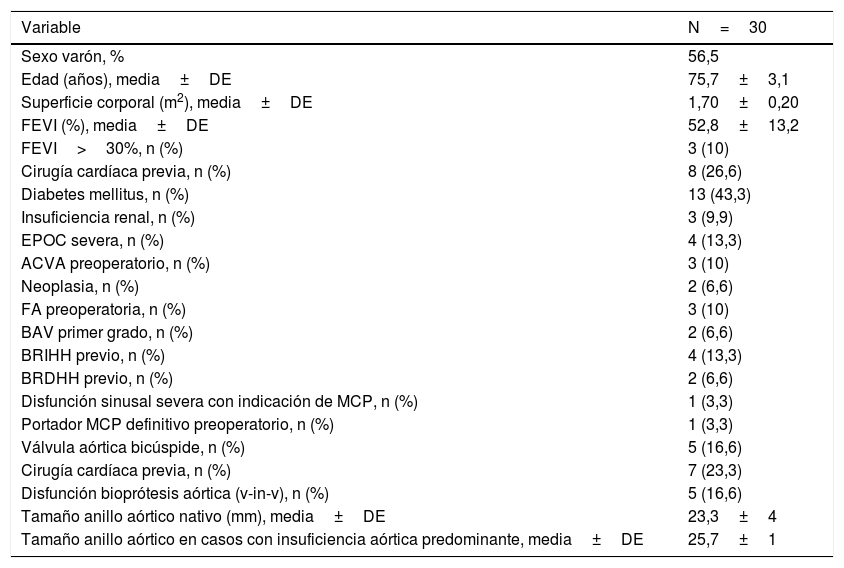
Datos demográficos y clínicos del grupo
| Variable | N=30 |
|---|---|
| Sexo varón, % | 56,5 |
| Edad (años), media±DE | 75,7±3,1 |
| Superficie corporal (m2), media±DE | 1,70±0,20 |
| FEVI (%), media±DE | 52,8±13,2 |
| FEVI>30%, n (%) | 3 (10) |
| Cirugía cardíaca previa, n (%) | 8 (26,6) |
| Diabetes mellitus, n (%) | 13 (43,3) |
| Insuficiencia renal, n (%) | 3 (9,9) |
| EPOC severa, n (%) | 4 (13,3) |
| ACVA preoperatorio, n (%) | 3 (10) |
| Neoplasia, n (%) | 2 (6,6) |
| FA preoperatoria, n (%) | 3 (10) |
| BAV primer grado, n (%) | 2 (6,6) |
| BRIHH previo, n (%) | 4 (13,3) |
| BRDHH previo, n (%) | 2 (6,6) |
| Disfunción sinusal severa con indicación de MCP, n (%) | 1 (3,3) |
| Portador MCP definitivo preoperatorio, n (%) | 1 (3,3) |
| Válvula aórtica bicúspide, n (%) | 5 (16,6) |
| Cirugía cardíaca previa, n (%) | 7 (23,3) |
| Disfunción bioprótesis aórtica (v-in-v), n (%) | 5 (16,6) |
| Tamaño anillo aórtico nativo (mm), media±DE | 23,3±4 |
| Tamaño anillo aórtico en casos con insuficiencia aórtica predominante, media±DE | 25,7±1 |
ACVA: accidente cerebrovascular agudo; BAV: bloqueo auriculoventricular; BRDHH: bloqueo rama derecha haz de His; BRIHH: bloqueo rama izquierda haz de His; DE: desviación estándar; EPOC: enfermedad pulmonar obstructiva crónica; FA: fibrilación auricular; FEVI: fracción de eyección del ventrículo izquierdo; MCP: marcapasos; v-in-v: valve-in-valve.
Las variables continuas con distribución normal se expresan como media y desviación estándar. Las variables categóricas se expresan como número y porcentaje.
ResultadosLa prótesis transcatéter Portico™ Abbott se implantó en todos los pacientes. La edad media de los pacientes del grupo fue de 75,7±3,1 años (rango 49-85 años) y el 56,5% fueron varones. El EuroSCORE log118 medio de los pacientes fue de 12,68±3,4. En 8 pacientes la lesión principal era insuficiencia aórtica. Cinco de los casos fueron procedimientos por disfunción protésica. Cinco tenían válvula nativa bicúspide. Uno de ellos tenía una prótesis mecánica mitral previa (tabla 1).
En todos los pacientes se implantó una sola prótesis (éxito del implante del 100%).
La vía de implante fue transfemoral en 22 pacientes (73,3%), transaxilar en 4 (13,3%) y transcarotídea en 4 (13,3%). En todos los casos, el acceso fue quirúrgico (abierto). En un caso se realizó –de forma asociada– cirugía coronaria sin circulación extracorpórea. Todos los procedimientos fueron programados.
La mortalidad hospitalaria de la serie fue de un paciente. Se trataba de un varón de 78 años con disfunción protésica severa en forma de estenosis crítica y disfunción ventricular severa (Labcor™ TLPB 25A), que tras la valvuloplastia aórtica con estimulación ventricular rápida inició shock cardiogénico refractario que no pudo revertirse pese al implante rápido de la prótesis y el intento de instaurar circulación extracorpórea por vía periférica. No hubo mortalidad durante el seguimiento inicial a 30 días.
Todos los casos se realizaron en el quirófano híbrido de Centro Médico Teknon (Azurion™ de Philips), con un tiempo medio del procedimiento de 93±9min. En 8 casos se realizó el implante sin introductor. En el resto, se utilizaron introductores DrySeal™ Gore® de 18Fr (para tamaños protésicos de 23 y 25) y de 20Fr (para tamaños de 27 y 29). Se realizó valvuloplastia con balón True™ antes del implante en 20 casos (66,6%) y valvuloplastia posterior al implante en 14 casos (46,6%). En todos los casos, la navegabilidad del sistema de implante fue buena, incluso en anatomías con ejes iliofemorales tortuosos o aortas más tumbadas. El implante se realizó en el primer intento en 21 (70%) casos, en el segundo intento (tras recuperación y nuevo despliegue) en 7 (23,3%) y en el tercer intento en 2 (6,6%). La retirada del sistema de liberación no ofreció dificultad en ningún caso.
En 2 casos, al final del procedimiento, se dejó el electrocatéter estimulando en punta de ventrículo derecho por aparición de bloqueo auriculoventricular (BAV) completo y ritmo de escape lento. En el resto, el electrocatéter se retiró hasta la vena yugular interna (tabla 2).
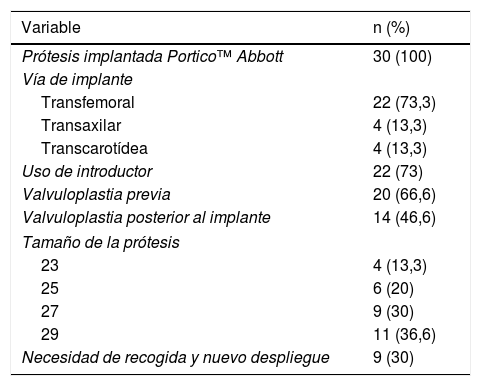
Características técnicas de los procedimientos
| Variable | n (%) |
|---|---|
| Prótesis implantada Portico™ Abbott | 30 (100) |
| Vía de implante | |
| Transfemoral | 22 (73,3) |
| Transaxilar | 4 (13,3) |
| Transcarotídea | 4 (13,3) |
| Uso de introductor | 22 (73) |
| Valvuloplastia previa | 20 (66,6) |
| Valvuloplastia posterior al implante | 14 (46,6) |
| Tamaño de la prótesis | |
| 23 | 4 (13,3) |
| 25 | 6 (20) |
| 27 | 9 (30) |
| 29 | 11 (36,6) |
| Necesidad de recogida y nuevo despliegue | 9 (30) |
Tras el implante dado como definitivo, quedó fuga residual periprotésica ligera en 7 pacientes (23,3%) y fuga trivial en 10 (33,3%). El gradiente medio transprotésico fue de 5±0,8mmHg en válvulas nativas y de 10,25±2,2mmHg en los casos de valve-in-valve. No se transfundió a ningún paciente y todos fueron extubados en el propio quirófano.
En la UCI el tiempo medio de estancia fue de 22,56±4h. Es de destacar la aparición de BAV completo en las primeras horas en uno de los pacientes, que requirió recolocar el electrocatéter.
Fue necesario implantar un marcapasos definitivo en 3 pacientes (10,3%) por BAV de tercer grado: 2 que se bloquearon en quirófano y otro en UCI en las primeras 24h. La estancia media en planta de hospitalización convencional fue de 4,1±0,8 días. Tres pacientes desarrollaron episodio arrítmico tipo fibrilación auricular que se controló farmacológicamente en menos de 24h. No se observaron nuevas complicaciones y todos los pacientes fueron dados de alta con control ecocardiográfico y electrocardiográfico, que no mostraron cambios respecto a los intraoperatorios (tabla 3).
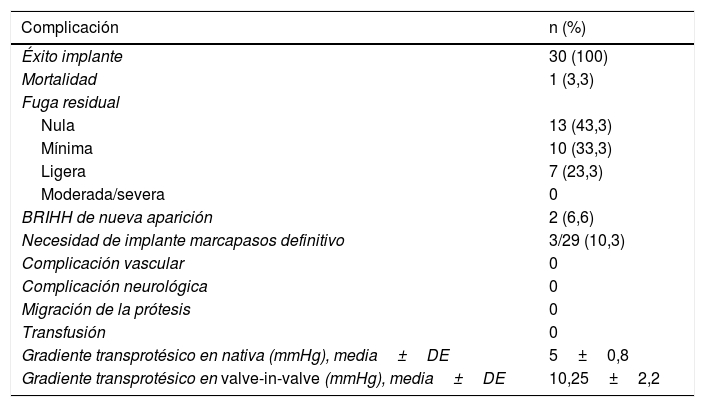
Resultados y complicaciones
| Complicación | n (%) |
|---|---|
| Éxito implante | 30 (100) |
| Mortalidad | 1 (3,3) |
| Fuga residual | |
| Nula | 13 (43,3) |
| Mínima | 10 (33,3) |
| Ligera | 7 (23,3) |
| Moderada/severa | 0 |
| BRIHH de nueva aparición | 2 (6,6) |
| Necesidad de implante marcapasos definitivo | 3/29 (10,3) |
| Complicación vascular | 0 |
| Complicación neurológica | 0 |
| Migración de la prótesis | 0 |
| Transfusión | 0 |
| Gradiente transprotésico en nativa (mmHg), media±DE | 5±0,8 |
| Gradiente transprotésico en valve-in-valve (mmHg), media±DE | 10,25±2,2 |
BRIHH: bloqueo de rama izquierda del haz de His; DE: desviación estándar.
Los procedimientos TAVI se han convertido en una realidad terapéutica incuestionable y se han ofrecido cada vez más frecuentemente a pacientes de riesgo intermedio y bajo19,20. En la actualidad, siguiendo la evolución de Alemania y EE. UU., en España en 2019 ya se realizaron más TAVI que sustituciones valvulares aórticas aisladas21. Presentamos la experiencia inicial con la prótesis transcatéter Portico™ Abbott, realizada por cirujanos y en un servicio de cirugía cardíaca.
La experiencia inicial ha sido muy satisfactoria y la prótesis se ha mostrado eficaz y segura. Pudo implantarse con éxito en el 100% de los casos y por diferentes accesos vasculares. En el 73% de los casos la vía fue transfemoral, que es siempre nuestra primera elección. La utilización de la vía femoral fue uno de nuestros objetivos principales, puesto que es la vía considerada el gold standard22 y porque –de acuerdo con las guías clínicas actualizadas– es la única vía que nos permite ofrecer los procedimientos TAVI a pacientes con riesgo intermedio o bajo, o simplemente a aquellos mayores de 75 años23.
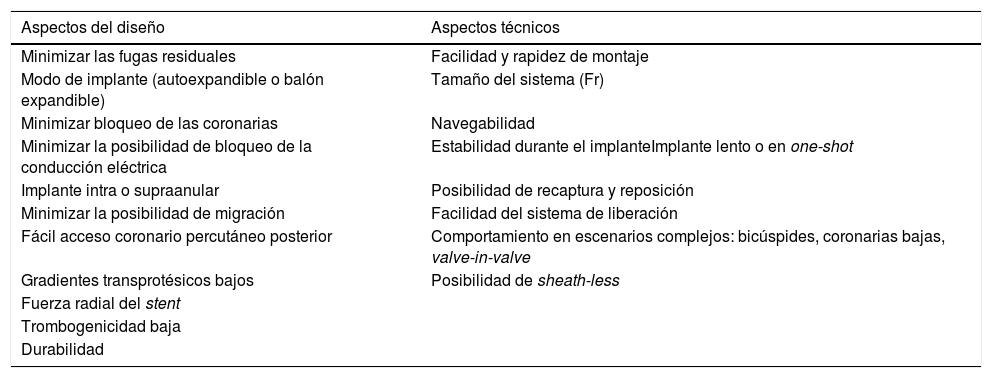
Podríamos asegurar que la gran mayoría de las prótesis transcatéter que están en el mercado tienen resultados óptimos. Sin embargo, las pequeñas diferencias en el diseño pueden favorecer nuestra elección (tabla 4) y nos permiten buscar aquella que mejor se adapte a cada paciente24. Los resultados reportados con prótesis autoexpandibles o balón expandible han sido muy buenos25 y han permitido afrontar casos cada vez más complejos26.
Aspectos a considerar al elegir una prótesis TAVI
| Aspectos del diseño | Aspectos técnicos |
|---|---|
| Minimizar las fugas residuales | Facilidad y rapidez de montaje |
| Modo de implante (autoexpandible o balón expandible) | Tamaño del sistema (Fr) |
| Minimizar bloqueo de las coronarias | Navegabilidad |
| Minimizar la posibilidad de bloqueo de la conducción eléctrica | Estabilidad durante el implanteImplante lento o en one-shot |
| Implante intra o supraanular | Posibilidad de recaptura y reposición |
| Minimizar la posibilidad de migración | Facilidad del sistema de liberación |
| Fácil acceso coronario percutáneo posterior | Comportamiento en escenarios complejos: bicúspides, coronarias bajas, valve-in-valve |
| Gradientes transprotésicos bajos | Posibilidad de sheath-less |
| Fuerza radial del stent | |
| Trombogenicidad baja | |
| Durabilidad |
TAVI: transcatheter aortic valve implantation («implante transcatéter de la válvula aórtica»).
El acceso a la vía de implante fue siempre abierto, mediante una pequeña incisión quirúrgica, que nos permitiera elegir muy bien el sitio de punción y que evitara los costes y complicaciones de los sistemas de cierre percutáneos27,28. No tuvimos ninguna complicación vascular ni tampoco problemas con la herida.
La elección de la prótesis Portico™ Abbott nos permitía disponer de una válvula autoexpandible y totalmente recapturable y reposicionable para mayor seguridad en el implante. Al poder liberarla casi al 80%, la sección anular del stent tiene un contacto completo con el anillo, la válvula ya abre y cierra durante el ciclo cardíaco (estabilidad hemodinámica), y permite una comprobación tranquila de la posición de implante (coaxialidad, profundidad) antes de la liberación total definitiva. Durante el implante la posición es muy estable y no es necesaria la sobreestimulación rápida (>120lpm) en la gran mayoría de los casos.
El sistema de navegación FlexNav™ es muy flexible y de avance muy suave, con bajo perfil (14Fr) y posibilidad de utilizarlo sin necesidad de introductor.
También fue muy importante para nosotros que el montaje de la válvula sobre el sistema de implante fuera sencillo, rápido y sin necesidad de suero helado o hielo picado. Eso permitió que nuestras instrumentistas aprendieran rápidamente cómo hacerlo y nos permitió ser autónomos en los implantes.
Las variadas características de los pacientes de nuestra serie inicial nos han permitido probar la prótesis en escenarios complejos y muy diferenciados.
En 5 de los 30 casos, la lesión principal de la válvula fue una insuficiencia aórtica pura, 4 de ellos sobre válvulas nativas con muy poco calcio. La prótesis se implantó de forma directa, sin introductor, y sin dejar fuga residual en ninguno de los casos. Aunque el uso de la TAVI en casos de insuficiencia aórtica severa no está comúnmente aceptado29, parece que la prótesis Portico™ Abbott puede ser una buena alternativa, sin dejar fugas significativas.
También funcionó bien en los 5 casos de válvulas aórticas bicúspides muy calcificadas y en los 3 casos en que existía un significativo componente de calcio en el tracto de salida del ventrículo izquierdo. La presencia de calcificación severa en la válvula, el tracto de salida o la raíz aórtica, la asimetría del anillo y la presencia de rafe son factores que aumentan la posibilidad de complicaciones graves (rotura del anillo o bloqueo de las coronarias) o de fugas paravalvulares significativas residuales, así como la necesidad de implantar un marcapasos definitivo por BAV completo30. Tan solo en 2 de esos casos quedó una fuga residual ligera sin ninguna otra incidencia.
En los 5 casos de valve-in-valve fue muy útil tener la posibilidad de un implante lento y con opción de recaptura para poder elegir mejor la profundidad de liberación. Dos de los casos eran pacientes a los cuales se les había implantado previamente una prótesis sin sutura Perceval S. En ambos casos, fue muy laborioso el pasar la guía por el centro de la válvula y no por alguna de las celdillas laterales y poder alinear el sistema de liberación de forma coaxial, aunque el resultado final fue muy bueno.
A lo largo de esta experiencia inicial, fuimos avanzando en afinar el enrasamiento o profundidad del implante buscando un equilibro entre no demasiado baja por el peligro de BAV completo, ni demasiado alta por la posibilidad de migración de la prótesis hacia la aorta. Dos estrategias que resultaron útiles fueron utilizar la proyección donde alineamos el seno no coronariano con los senos coronariano derecho e izquierdo (cusp-overlap view), y medir en la angio-TAC la longitud del septo membranoso.
La mayor experiencia de los equipos y la evolución en el diseño de las prótesis han determinado una significativa reducción de las complicaciones; sin embargo, las complicaciones mayores todavía aparecen en un 2-8% de los pacientes y se asocian a un aumento importante de la mortalidad31. Este hecho es muy relevante en el momento actual, en que cada vez se realizan procedimientos TAVI en pacientes más jóvenes y de riesgo muy bajo para cirugía convencional, y más si tenemos en cuenta que algunas de las potenciales complicaciones graves de estos procedimientos no son dependientes del riesgo.
Los procedimientos TAVI deben realizarse en unas condiciones adecuadas de seguridad y con la participación activa de profesionales entrenados en poder resolver expeditivamente las complicaciones. Aunque existen diferentes trabajos publicados que no muestran diferencias significativas en la mortalidad intraprocedimiento cuando la TAVI se realiza en un quirófano híbrido o en una sala de hemodinámica32,33, nunca se aclara si la mortalidad acontecida en este último escenario hubiera podido ser solucionada con una cirugía urgente.
El tratamiento de las enfermedades cardiovasculares evoluciona hacia procedimientos quirúrgicos menos invasivos y a las terapias transcatéter de forma muy rápida. Los cirujanos hemos de interpretar esa realidad inmutable como una oportunidad de crecimiento y transformación34. Desde nuestra perspectiva, la participación activa de los cirujanos (entrenados y acreditados) como actores principales en los procedimientos TAVI tiene argumentos de peso y muy reconocibles: conocimiento profundo de la anatomía y de la enfermedad valvular aórtica y de la raíz de la aorta, entrenamiento en el manejo de los accesos arteriales, ausencia de sesgo para elegir la opción quirúrgica o percutánea, posibilidad de realizar la TAVI por cualquier vía (transfemoral, transaxilar, transcarotídea, transaórtica, transapical, etc.) y capacidad para intentar resolver las complicaciones graves de esos procedimientos.
Este es un estudio descriptivo, prospectivo, no aleatorizado y sin grupo control. Es una cohorte pequeña, de un único centro, un único equipo y sin seguimiento más allá de los 30 días. Sin embargo, nuestra población refleja un escenario real, con pacientes de diferentes características y complejidad variable. Al ser pacientes consecutivos no ha existido ningún sesgo de selección ni otras restricciones que podrían haber distorsionado la experiencia.
ConclusionesEn nuestra experiencia, el implante transcatéter con la prótesis Portico™ Abbott para el tratamiento de la valvulopatía aórtica severa ha sido factible, eficaz y seguro. La prótesis se ha mostrado muy versátil y se ha comportado bien en escenarios muy diversos y de alta complejidad (válvula aórtica bicúspide, disfunción de bioprótesis aórtica previa, zona de aterrizaje con calcificación severa, insuficiencia valvular predominante, etc.). También ha permitido realizar implantes por las 3 vías más utilizadas (transfemoral, transaxilar y transcarotídea), de forma óptima y sin necesidad de cambios en el aparataje o la técnica de implante. El comportamiento hemodinámico inicial ha sido excelente en todas las medidas, y la tasa de complicaciones a 30 días ha sido baja.
Consideraciones éticasLos autores confirman que este estudio se realizó conforme a las normas éticas de la publicación y que obtuvo la aprobación del Comité Médico Teknon, así como el consentimiento informado de todos los pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.