Disponemos de una nueva clase de prótesis aórticas de despliegue rápido para tratamiento quirúrgico de la estenosis aórtica. Permitirían disminuir los tiempos quirúrgicos y facilitarían la cirugía mínimamente invasiva. Presentamos nuestra experiencia inicial con la válvula Edwards Intuity en el contexto del estudio multicéntrico Foundation.
Pacientes y métodosEntre septiembre de 2012 y febrero de 2014 se implantaron 25 prótesis aórticas Edwards Intuity en 26 pacientes (77±4,3años; 52% varones). Veinticuatro (96%) fueron reemplazo valvular aislado, y 9 pacientes (36%) tuvieron abordaje mínimamente invasivo. Los pacientes fueron estudiados al alta, a los 3meses y al año de la intervención.
ResultadosHubo éxito en el implante en el 96,2% de los pacientes (25/26). No hubo mortalidad hospitalaria. Seguimiento medio de 11±5,4meses, supervivencia acumulada del 96%. Un paciente falleció a los 11meses por un ictus isquémico. El tiempo medio de pinzamiento aórtico fue de 38,2±10,1min y el tiempo medio de circulación extracorpórea, de 62,4±11,1min. A los 3meses, el área valvular efectiva media fue de 1,70±0,42cm2. El 91% de los pacientes (23/25) estaban en grado funcionali en el seguimiento.
ConclusionesEl implante de la válvula Edwards Intuity para el tratamiento de la estenosis aórtica ha sido factible, seguro y eficaz. Los tiempos de isquemia miocárdica y de circulación extracorpórea parecen reducirse en comparación con la cirugía valvular aórtica habitual. El comportamiento hemodinámico inicial de la prótesis Edwards Intuity es excelente.
A new class of rapid deployment prostheses is now available for surgical treatment of aortic stenosis. These prostheses offer the possibility of reducing the duration of cardiopulmonary bypass and aortic clamping times, and facilitate the use of minimally invasive surgery. We present our initial experience with the Edwards Intuity valve in the context of a multicentre Foundation study.
Patients and methodsBetween September 2012 and February 2014, 25 Edwards Intuity valves were implanted in 26 patients (77±4.3years; 52% male). Twenty-four (96%) were isolated aortic valve replacement; a minimally invasive approach was used on 9 patients (36%). Patients were studied at discharge, three months, and one year after surgery.
ResultsImplantation success rate was 96.2% (25/26). There was no hospital mortality. Mean follow-up of 11±5.54months, cumulative survival of 96%. One patient died eleven months after surgery due to ischaemic stroke. The mean aortic clamping time was 38.2±10.1minutes, and the mean cardiopulmonary bypass (CPB) time was 62.4±11.1minutes. In the echocardiography at 3months, the mean effective valve area was 1.70±0.42cm2, and 91% of patients (23/25) were in functional classi NYHA at follow-up.
ConclusionsThe implantation of the Edwards Intuity valve for surgical treatment of aortic stenosis has shown to be feasible, safe and effective. Times of myocardial ischaemia and extracorporeal circulation appear to be reduced compared with normal aortic valve surgery. The initial haemodynamic performance of the Edwards Intuity prosthesis is excellent.
La estenosis de la válvula aórtica afecta al 3% de la población mayor de 65años1. Actualmente es la lesión valvular cardiaca más frecuente, ya que representa el 43% de las enfermedades valvulares2. En pacientes sintomáticos sin tratamiento quirúrgico la supervivencia es de 2-3años3.
El recambio valvular aórtico es el único tratamiento efectivo, pues mejora la supervivencia y la clínica de los pacientes con estenosis aórtica severa3,4. El recambio valvular aórtico vía esternotomía media y con la máquina corazón-pulmón es la segunda intervención quirúrgica cardiaca más frecuente tras la revascularización miocárdica y presenta una mortalidad del 4% en diferentes series5-8.
En los últimos años, para aquellos pacientes inoperables o con muy alto riesgo para la cirugía de recambio valvular aórtico se han desarrollado las técnicas de recambio valvular aórtico con catéter (TAVI)9,10, vía femoral, ápex de ventrículo izquierdo, vía transaórtica, subclavia, axilar o carotídea. Esta nueva técnica permite ofrecer una opción de tratamiento a pacientes con estenosis aórtica severa sintomática, con edad avanzada, pobre ventrículo izquierdo, comorbilidad asociada importante o por presentar muy alto riesgo por características anatómicas especiales.
Recientemente, el desarrollo de nuevas válvulas biológicas con facilidad de implante y despliegue nos puede permitir ofrecer la cirugía convencional a pacientes de mayor riesgo preoperatorio y más complejos con mayor seguridad, e incluso facilitar el uso de técnicas quirúrgicas menos invasivas.
Presentamos nuestra experiencia con la prótesis Edwards Intuity (Edwards Lifesciences LLC, Irvine, California) en el contexto del estudio prospectivo multicéntrico Foundation que evalúa la seguridad, la reproducibilidad y eficacia de dicha prótesis.
Material y métodosEntre octubre de 2012 y febrero de 2014 se trataron 26 pacientes consecutivos con estenosis aórtica severa sintomática en nuestro centro, y la mayoría de ellos (21/26) fueron tratados en el marco del estudio no aleatorizado de un único brazo, prospectivo y multicéntrico Foundation. Los criterios de inclusión en este estudio fueron: presencia de estenosis aórtica severa o doble lesión aórtica con predominio de la estenosis aórtica, y edad mayor de 18años. Los criterios de exclusión del estudio fueron: presencia de insuficiencia aórtica aislada, presencia de endocarditis aórtica o dilatación de la aorta ascendente o de la raíz aórtica. El promotor (Edwards Lifesciences LLC, Irvine, California) sufragó el estudio y dirigió la recogida de ciertos datos. El comité ético de investigación clínica de nuestro centro aprobó el protocolo y los pacientes dieron su consentimiento informado por escrito.
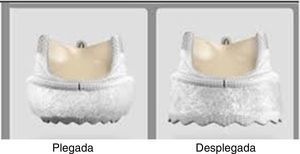
A los pacientes que aceptaron participar se les implantó la prótesis Edwards Intuity valve (modelo 8300A), que es una prótesis biológica de 3 velos de pericardio bovino con un sistema de despliegue con balón y un marco expandible infraanular de fijación (fig. 1).
El abordaje del tórax se realizó bien mediante esternotomía media completa o bien por hemiesternotomía superior por cuarto o quinto espacio intercostal derecho.
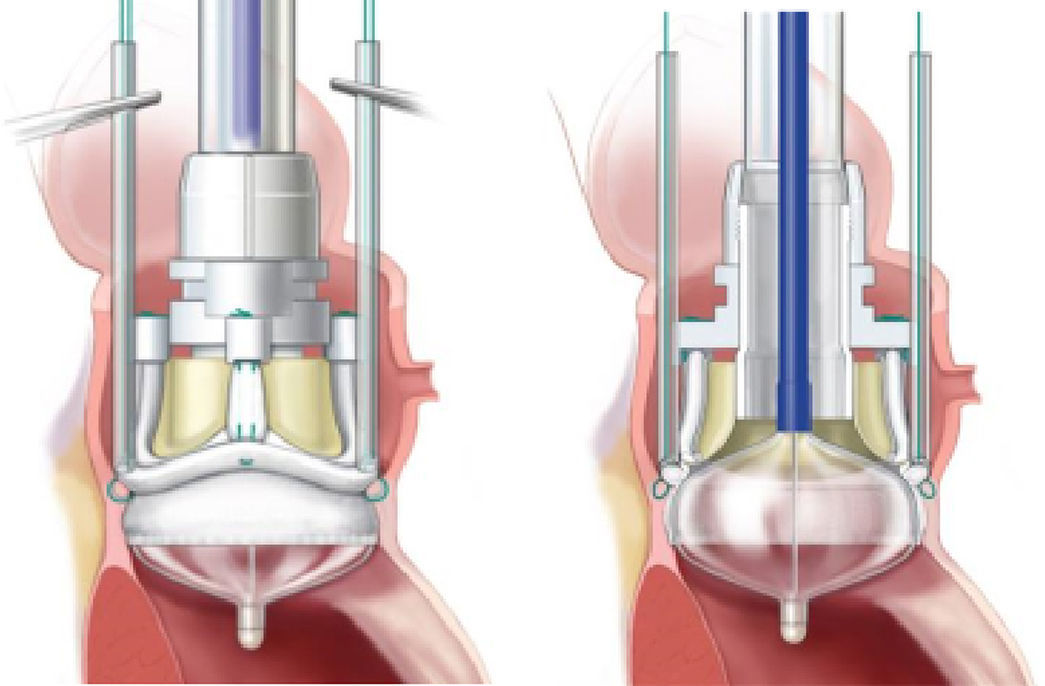
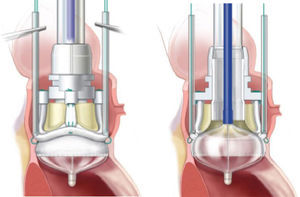
Después de una aortotomía convencional, se procede a la resección de los velos de la válvula aórtica enferma y a la decalcificación del anillo aórtico. A continuación 3 puntos equidistantes se colocan en el nadir de cada seno aórtico y se pasan por los sitios indicados en el anillo de sutura de la prótesis a estudiar. Usando estas suturas como guía, la válvula y el sistema de despliegue se bajan hasta el anillo aórtico y se aseguran en su posición bajo control visual directo. El catéter balón se infla para desplegar el marco expandible de forma controlada. Dependiendo del tamaño de la prótesis, las presiones de inflado oscilan entre 3 y 5atmósferas. Una vez desplegada la prótesis se fija en posición supraanular, mientras que el marco expandible se coloca por debajo del anillo aórtico en el tracto de salida del ventrículo izquierdo (fig. 2). Entonces tanto el sistema de despliegue como el soporte de la válvula se retiran juntos y las 3 suturas guía se anudan. La aortotomía se cierra y se procede a terminar la intervención de la manera habitual.
Se recogieron la mortalidad hospitalaria (<30días), la mortalidad tardía (>30días), la mortalidad relacionada con la prótesis, los episodios tromboembólicos, los episodios de sangrado y hemorrágicos, las fugas periprotésicas y la endocarditis protésica. También se recogieron las variables demográficas de cada paciente, el tratamiento previo, la situación funcional preoperatoria, la analítica basal, el electrocardiograma preoperatorio, las áreas valvulares, los gradientes transaórticos medios y los máximos preoperatorios en el ecocardiograma. Se recogieron variables operatorias como la vía de acceso, el tiempo de isquemia miocárdica y de circulación extracorpórea, la necesidad de transfusión y su cantidad, la necesidad de reintervención por sangrado, por problemas de esternón o por infección, los días de estancia en la UCI y en el hospital, así como los reingresos posteriores al alta y su causa.
Se realizó seguimiento clínico al alta hospitalaria, a los 3meses y al año de la intervención, incluyendo examen físico, valoración de complicaciones, ecocardiografía transtorácica, análisis de sangre y electrocardiograma.
Las variables continuas con distribución normal se expresan como media y desviación estándar. Las variables continuas sin distribución normal se expresan como mediana y rango intercuartil. Las variables categóricas se expresan como número y porcentaje.
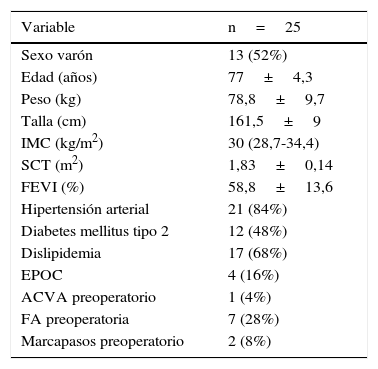
ResultadosEl sistema de válvula Edwards Intuity se implantó en 25 de los 26 pacientes. La edad media de los pacientes estudiados fue de 77±4,3años (rango, 69-83años), y el 52% de los pacientes fueron varones. El EuroScore logístico11,12 medio de los pacientes fue de 8,2±5,5. La escala de la Sociedad de Cirujanos Torácicos (STS)13 de mortalidad media de la población fue de 3,43±1,95, y la escala STS de complicaciones media13 fue de 19,2±6,24. La escala media de mortalidad para recambio valvular aórtico del grupo de estudio cardiovascular del norte de nueva Inglaterra14 fue de 3,96±2,9. La tabla 1 muestra los valores demográficos de la población intervenida.
Demografía y comorbilidad de la población
| Variable | n=25 |
|---|---|
| Sexo varón | 13 (52%) |
| Edad (años) | 77±4,3 |
| Peso (kg) | 78,8±9,7 |
| Talla (cm) | 161,5±9 |
| IMC (kg/m2) | 30 (28,7-34,4) |
| SCT (m2) | 1,83±0,14 |
| FEVI (%) | 58,8±13,6 |
| Hipertensión arterial | 21 (84%) |
| Diabetes mellitus tipo 2 | 12 (48%) |
| Dislipidemia | 17 (68%) |
| EPOC | 4 (16%) |
| ACVA preoperatorio | 1 (4%) |
| FA preoperatoria | 7 (28%) |
| Marcapasos preoperatorio | 2 (8%) |
ACVA: accidente cerebrovascular agudo; EPOC: enfermedad pulmonar obstructiva crónica; FA: fibrilación auricular; FEVI: fracción de eyección del ventrículo izquierdo; IMC: índice de masa corporal; SCT: superficie corporal total.
En una paciente no se logró implantar la prótesis estudiada (3,8%), lo que supone una tasa de éxito técnico del 96,2%. En 8 pacientes (32%) se implantó una prótesis n.° 19, en 6 (24%) se implantó prótesis n.° 21, en 10 pacientes (40%) prótesis n.° 23 y en uno (4%), n.° 25.
La válvula Edwards Intuity se implantó mediante una esternotomía media completa en el 64% (16) de los pacientes; en los restantes 9 (36%) se utilizó un abordaje mínimamente invasivo con hemiesternotomía media superior. En un paciente (4%) se realizó cirugía asociada, un injerto de arteria mamaria a la coronaria descendente anterior. El resto (96%) fue reemplazo valvular aórtico aislado. Cuatro pacientes (16%) fueron cirugías urgentes.
No hubo mortalidad hospitalaria en esta serie. Durante el seguimiento a los 11meses de la intervención, una paciente falleció por infarto cerebral isquémico de origen embólico (paciente en fibrilación auricular con anticoagulación por debajo de lo recomendado).
En quirófano, el tiempo medio de isquemia miocárdica fue de 38,2±10,1min, y el tiempo medio de circulación extracorpórea, de 62,4±11,1min. No hubo ningún caso de obstrucción de los orificios coronarios por la prótesis, o que esta dificultara el cierre de la aortotomía o que impidiera la función de la válvula mitral.
En la unidad de cuidados intensivos (UCI) el tiempo medio de ventilación mecánica fue de 6,4±3,6h, y el drenaje medio en las primeras 24h fue de 571±308cc (510 [350-740]). La estancia media en la UCI fue de 3±1,8días (2 [2-4]) y la estancia media hospitalaria fue de 13,2±6,7 días (11 [8,5-16]). En el período hospitalario se transfundió a 18 pacientes (72%), con una media de 3,6±2CH por paciente.
En el postoperatorio inmediato 2 pacientes (8%) tuvieron accidentes cerebrovasculares agudos con recuperación total. En el periodo hospitalario 8 pacientes (32%) sufrieron episodios de fibrilación auricular. Siete pacientes experimentaron deterioro de la función renal (28%) con buena respuesta al tratamiento médico, 2 pacientes tuvieron derrames pleurales que precisaron drenaje (8%), un paciente (4%) tuvo una hemorragia digestiva alta. Ningún paciente precisó marcapasos definitivo en el periodo hospitalario ni durante el seguimiento. Una paciente (4%) tuvo que ser reintervenida por sangrado en las primeras horas del postoperatorio en relación con sangrado en un cable del marcapasos transitorio. Otro paciente (4%) tuvo que volver a quirófano por una dehiscencia esternal no infecciosa por agitación en la UCI. Solo hubo un caso (4%) de fuga periprotésica moderada al alta, que se mantiene sin cambios durante el seguimiento. Tras el alta hospitalaria, 3 pacientes (12%) reingresaron en otros centros por insuficiencia cardiaca y/o anemia.
En el seguimiento hay 2 pacientes (8%) con fuga periprotésica moderada, ambas en grado funcionali de la NYHA y sin repercusión sobre el ventrículo izquierdo. La mayoría de los pacientes (91%) se encuentran en grado funcionali de la NYHA, el 9% restante se hallan en grado funcionalii. Hasta el momento, en el seguimiento no hemos observado casos de endocarditis, hemólisis o deterioro estructural de la prótesis. El seguimiento medio es de 11±5,4meses. Ningún paciente ha precisado marcapasos definitivo en el seguimiento.
Con vistas a conocer nuestra evolución durante el estudio, para investigar la curva de aprendizaje, dividimos a nuestra población en 2 partes con criterio cronológico. La primera mitad desde septiembre de 2012, fecha de inicio del estudio, a mayo de 2013, que incluiría a 13 pacientes, y la segunda mitad desde junio de 2013 a febrero de 2014, que incluiría los 12 pacientes restantes. Cuando comparamos diferentes variables (tabla 2) observamos que hay una clara tendencia a la significación estadística (p=0,06) en el tiempo de estancia hospitalaria total (16,6días de media en la primera mitad frente a 9,5días en la segunda mitad); se observa también una disminución del tiempo de CEC en la segunda mitad del estudio (65,1min en la primera mitad frente a 59,4min en la segunda mitad), aunque no tiene significación estadística (p=0,20). No hubo apenas cambios en el tiempo de isquemia ni en el volumen de drenaje en las primeras 24h, ni en la estancia en la UCI.
Evolución cronológica durante el estudio
| Variable | Primera mitad del estudio (13) | Segunda mitad del estudio (12) | p |
|---|---|---|---|
| Tiempo de isquemia (min) | 38,5±11,2 | 37,9±9,1 | 0,882 |
| Tiempo de CEC (min) | 65,1±12,3 | 59,4±9,4 | 0,20 |
| Tiempo de ventilación mecánica (horas) | 6,6±2,5 | 6,3±4,3 | 0,85 |
| Drenaje/24h (cc) | 575,7±253 | 565,4±371 | 0,935 |
| Tiempo en UCI (días) | 3±1,35 | 3,1±2,36 | 0,574 |
| Tiempo en hospital (días) | 16,6±7,4 | 9,5±3,3 | 0,06 |
CEC: circulación extracorpórea; UCI: unidad de cuidados intensivos.
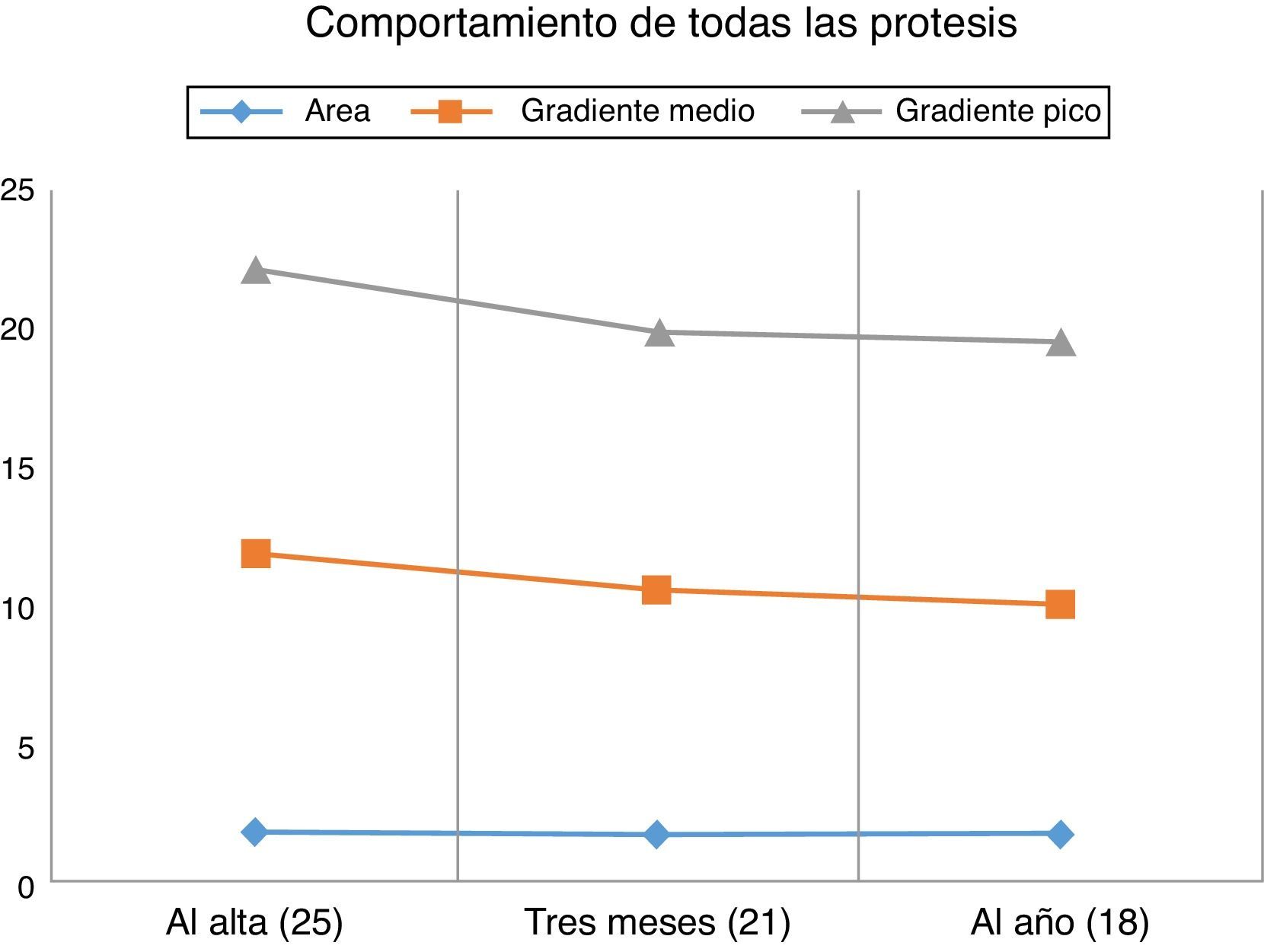
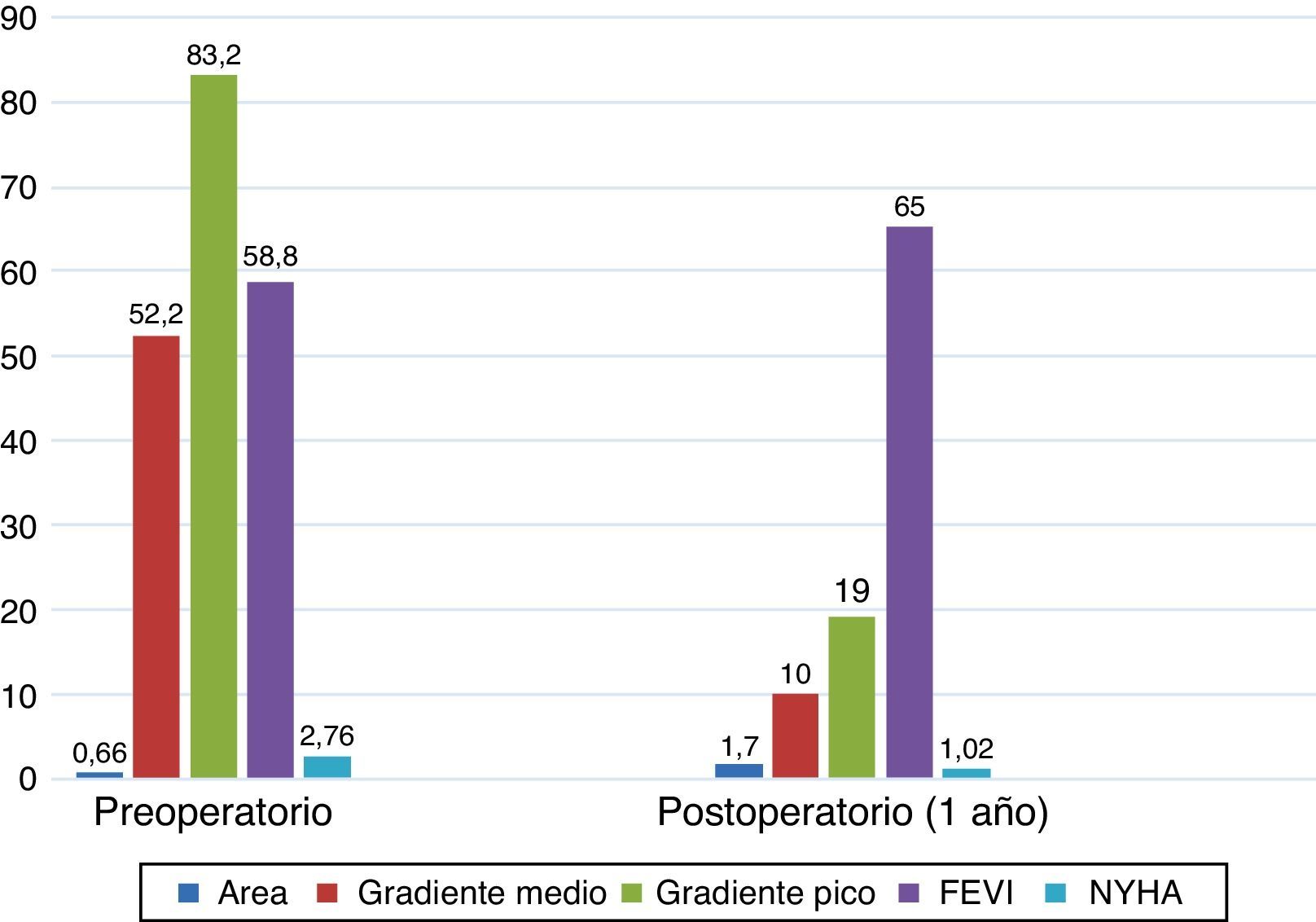
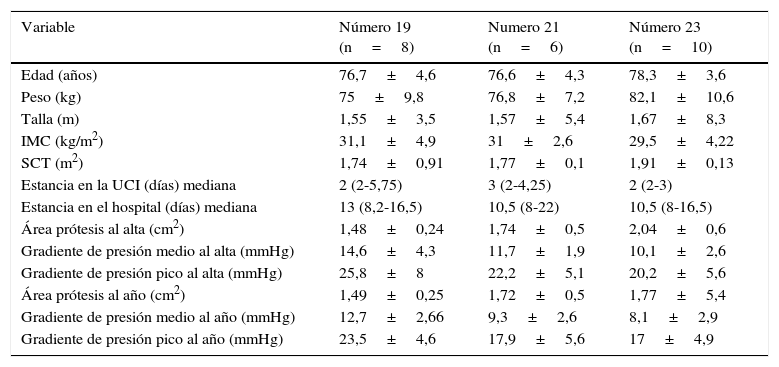
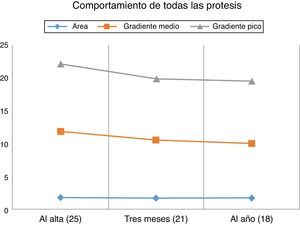
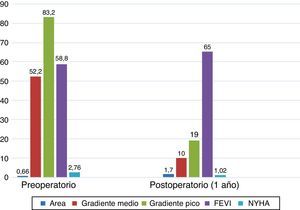
El área valvular indexada media de las prótesis implantadas en el momento del alta fue de 0,96±0,27cm2/m2. Estudiamos también el comportamiento hemodinámico de la prótesis en el tiempo; así, al alta (25) el área valvular efectiva media fue de 1,78±0,5 cm2, a los 3 meses (21) era de 1,70±0,42 cm2, y al año (16), de 1,70±0,29 cm2. Los gradientes de presión transprotésicos medio y pico al alta (25) fueron de 11,8±3,6 y 22,1±6,9mmHg. A los 3 meses (21) estos gradientes fueron de 10,5±3,3 y 19,9±6,4mmHg, respectivamente. Al año (16) fueron de 10±3,4 y 19,9±5,4mmHg. La figura 3 muestra el comportamiento hemodinámico y de área valvular de las prótesis en su conjunto al alta, a los 3meses y al año. La figura 4 muestra la evolución de los pacientes desde antes de la intervención quirúrgica hasta un año después de ella. Así, el área valvular media ha pasado de 0,66 a 1,70cm2, el gradiente medio de presión media ha pasado de 52,2 a 10mmHg, el gradiente medio de presión pico ha disminuido de 83,2 a 19,5mmHg. La función ventricular izquierda ha pasado del 58,8 al 65% un año después de la intervención, y el grado funcional medio (NYHA) ha disminuido de 2,76 a 1,02. La tabla 3 recoge información individualizada para cada número de prótesis: características preoperatorias de los pacientes, datos de estancias en la UCI y en planta de hospitalización, y datos ecocardiográficos al alta y al año.
Características preoperatorias, hemodinámicas postoperatorias y de estancias de los pacientes por tamaños de las prótesis implantadas
| Variable | Número 19 (n=8) | Numero 21 (n=6) | Número 23 (n=10) |
|---|---|---|---|
| Edad (años) | 76,7±4,6 | 76,6±4,3 | 78,3±3,6 |
| Peso (kg) | 75±9,8 | 76,8±7,2 | 82,1±10,6 |
| Talla (m) | 1,55±3,5 | 1,57±5,4 | 1,67±8,3 |
| IMC (kg/m2) | 31,1±4,9 | 31±2,6 | 29,5±4,22 |
| SCT (m2) | 1,74±0,91 | 1,77±0,1 | 1,91±0,13 |
| Estancia en la UCI (días) mediana | 2 (2-5,75) | 3 (2-4,25) | 2 (2-3) |
| Estancia en el hospital (días) mediana | 13 (8,2-16,5) | 10,5 (8-22) | 10,5 (8-16,5) |
| Área prótesis al alta (cm2) | 1,48±0,24 | 1,74±0,5 | 2,04±0,6 |
| Gradiente de presión medio al alta (mmHg) | 14,6±4,3 | 11,7±1,9 | 10,1±2,6 |
| Gradiente de presión pico al alta (mmHg) | 25,8±8 | 22,2±5,1 | 20,2±5,6 |
| Área prótesis al año (cm2) | 1,49±0,25 | 1,72±0,5 | 1,77±5,4 |
| Gradiente de presión medio al año (mmHg) | 12,7±2,66 | 9,3±2,6 | 8,1±2,9 |
| Gradiente de presión pico al año (mmHg) | 23,5±4,6 | 17,9±5,6 | 17±4,9 |
IMC: índice de masa corporal; SCT: superficie corporal total; UCI: unidad de cuidados intensivos.
Nuestra experiencia inicial con la prótesis Edwards Intuity ha sido buena. La prótesis ha demostrado ser eficaz, segura y su implante factible y reproducible. Nuestra tasa de éxito fue del 96,1%, semejante a estudios recientes más amplios15. Esta válvula de despliegue rápido pudo implantarse vía hemiesternotomía parcial superior en el 36% de nuestros pacientes, en un intento de disminuir la agresión quirúrgica de nuestros pacientes, que son cada vez más ancianos y frágiles, como indica el EuroScore logístico medio de nuestra población, y facilitar una más rápida recuperación e incorporación a sus actividades rutinarias de la vida diaria.
Nuestros tiempos medios de isquemia miocárdica y de circulación extracorpórea (38,2±10,1 y 62,4±11,1min, respectivamente) son levemente menores que los del estudio Triton15, publicado recientemente, y desde luego mucho menores que los estudios publicados de grandes series16,17 de cirugía de recambio valvular aórtico con prótesis convencionales. Si comparamos la población intervenida con la prótesis Edwards Intuity con una serie de 28 pacientes valvulares aórticos aislados, intervenidos con prótesis convencionales en las mismas fechas por los cirujanos del estudio (edad media de 75±3,9años, EuroScore logístico medio de 8,5±4,2, varones 47% y con tiempos medios de isquemia miocárdica y de CEC de 56,7±13,7 y de 89±19,6min, respectivamente), se obtiene una reducción media de 18,5min en la isquemia miocárdica (32,7% de disminución en el tiempo de isquemia miocárdica) y de 26,6min en la duración de la CEC (una reducción del 30% en el tiempo de perfusión). Hay literatura importante que avala el concepto de que tanto un mayor tiempo de isquemia miocárdica como de circulación extracorpórea implican mayor mortalidad, morbilidad y estancia hospitalaria18,19.
En comparación con los pacientes del estudio Triton15, nuestra serie, aunque es menor en tamaño y es el resultado del trabajo de un único centro, muestra tiempos medios de isquemia miocárdica y de circulación extracorpórea ligeramente menores, una mayor proporción de acceso mínimamente invasivo (36% vs 30%), una mayor proporción de válvulas n.° 19 (24% vs 0,7%), quizás en relación con una población más pequeña en nuestro estudio (SCT: 1,8±0,14m2), con un EuroScore logístico ligeramente superior en nuestro estudio (8,2±5,5 vs 7,9±6,5). Por el contrario, nuestra serie presenta un claro predominio de cirugía valvular aórtica aislada (96% vs 59%). Sin embargo, los datos de función de la prótesis en cuanto área y gradientes medio y pico transprotésicos son similares en ambas series (algo mayores al alta hospitalaria y a los 3meses y menores al año). Nuestra serie presenta una tasa de episodios tromboembólicos hospitalaria del 8% (2 pacientes), mayor que la serie del estudio Triton15, que es del 2,7%; ambos pacientes estaban en fibrilación auricular previa y se recuperaron completamente. En el seguimiento hubo un episodio de tromboembolismo (4%) con resultado de muerte por infarto cerebral. En nuestra serie encontramos una incidencia de fuga periprotésica moderada antes del alta, del 4%, frente al 2,7% del estudio Triton15. En el seguimiento hay otro paciente con fuga moderada, lo que supone un 8% del total, por el momento sin repercusión clínica ni ecocardiográfica. No implantamos ningún marcapasos ni en el periodo hospitalario ni en el seguimiento, lo que contrasta con la tasa de más del 7% de implante de marcapasos definitivo del estudio Triton15. La mortalidad de nuestra serie fue del 0% vs el 2,1% del estudio Tritón a corto plazo y del 4% vs 7,5% del estudio Triton15 en el seguimiento.
Con respecto a nuestra propia evolución durante el estudio (tabla 2), cabe destacar que se observa una clara disminución de la estancia hospitalaria en la segunda mitad del estudio (de hasta un 43%), con una clara tendencia estadística hacia la significación (p=0,06), con lo que esto supone de ahorro económico, que podría interpretarse como una mayor seguridad en el manejo de estos pacientes que se recuperan antes de la intervención por parte del todo el equipo médico. También se observa una disminución del tiempo de circulación extracorpórea en la segunda mitad del estudio, pero sin lograr significación estadística; es probable que esta se logre con una población mayor. Creemos que con mayor experiencia en el uso de estas prótesis de rápido despliegue y el consiguiente entrenamiento por parte de los equipos quirúrgicos, anestésicos y de cuidados postoperatorios en el manejo de estos pacientes se podrán lograr reducciones aún más significativas en los tiempos quirúrgicos, de estancia en la UCI y de estancia hospitalaria
La aparición de estas prótesis de rápido despliegue nos puede permitir a los clínicos ofrecer un mayor abanico de opciones terapéuticas a los pacientes con estenosis aórtica. Así, se puede ofrecer la cirugía valvular aórtica convencional para pacientes con riesgo bajo o medio, la TAVI para pacientes inoperables o con muy alto riesgo quirúrgico, y las nuevas prótesis de rápido despliegue para pacientes en esa zona gris que se podrían beneficiar tanto de la cirugía convencional como de la terapia percutánea por tener un alto riesgo operatorio.
Por otro lado, este tipo de prótesis de rápido despliegue facilitan y animan el abordaje menos invasivo en la cirugía de recambio valvular aórtico, bien mediante la hemiesternotomía media superior o mediante la minitoracotomía derecha. Diferentes estudios han mostrado beneficios clínicos de estos abordajes menos agresivos en forma de menor dolor, menor estancia en unidades de cuidados intensivos, menor tiempo de ventilación mecánica, menor tasa de transfusión postoperatoria, menor estancia hospitalaria y más rápida recuperación postoperatoria, así como beneficios estéticos20-22.
La presencia en esta válvula del marco expandible de acero que se despliega por debajo del anillo aórtico nos permite pensar en un comportamiento hemodinámico muy bueno al abrir más con el marco expandible el tracto de salida del ventrículo izquierdo, lo cual puede ser más útil en los pacientes con anillos aórticos pequeños y con septos muy hipertróficos. La evolución hemodinámica en el tiempo de esta válvula en pacientes con números pequeños nos puede confirmar esa atractiva hipótesis.
Un elemento a vigilar son las fugas periprotésicas mayores de grado2, que presentan una incidencia hospitalaria del 4% (un paciente), que resulta menor que los indicados en registros europeos de TAVI23,24 (14%), y que sube al 8% (2 pacientes) en el seguimiento, de nuevo mejor que los grados de regurgitación a más largo plazo informados en registros TAVI25 (21%). Aunque ambos pacientes se encuentran en gradoi de la NYHA, hay trabajos con TAVI que relacionan las fugas periprotésicas moderadas-severas con un peor pronóstico a medio-largo plazo23-25. También hay publicaciones en relación con TAVI que muestran que el grado de insuficiencia aórtica periprotésica permanece estable e incluso disminuye durante el primer año tras el implante26. Aunque hasta ahora en esta serie no hayamos tenido ni hemólisis ni endocarditis, debemos vigilar el impacto que esta regurgitación residual pueda tener en estas complicaciones más a largo plazo, así como su influencia sobre la normalización de la masa del ventrículo izquierdo. Con respecto a las causas de estas fugas periprotésicas, se puede pensar en una insuficiente decalcificación del anillo aórtico que dificulte un posterior despliegue homogéneo de la prótesis, una deficiente medición del anillo aórtico que provoque una liberación subóptima de la prótesis bien a nivel infraanular, bien a nivel supraanular, o bien por un imperfecto despliegue de la prótesis por no llegar a la presión necesaria. Estos factores se irán corrigiendo con una mayor experiencia del equipo quirúrgico, con la mejora de los instrumentos de medida del anillo aórtico, tanto en el estudio preoperatorio como en la intervención quirúrgica, así como con una progresiva simplificación del proceso de despliegue de estas prótesis. De cualquier manera, la reducción de la tasa de fugas periprotésicas representa un objetivo de primer nivel en la mejora del diseño de nuevas prótesis de rápido despliegue y de su técnica de implante.
Por otro lado, aunque el sistema Edwards Intuity es heredero de la prótesis Carpentier-Edwards Perimount, implantada en más de medio millón de pacientes en todo el mundo y con un óptimo comportamiento a largo plazo17,27-29, por lo que se podría asumir un comportamiento semejante del nuevo dispositivo, se deben realizar estudios a largo plazo para confirmar su durabilidad y su comportamiento hemodinámico a lo largo del seguimiento.
Este es un estudio no aleatorizado, de un único brazo y sin grupo control. Presentamos una población pequeña, de un único centro y con seguimiento limitado de un año, y el comportamiento a más largo plazo y las complicaciones pueden variar y diferir a lo largo de un periodo de tiempo más prolongado. Sin embargo, nuestra población refleja un escenario actual del mundo real, con pacientes de nuestra práctica clínica diaria, lejos de los pacientes altamente seleccionados para estrictos y restrictivos estudios controlados y aleatorizados. Los resultados obtenidos de estos registros del mundo real son importantes para guiar el futuro desarrollo de estas prótesis de despliegue e implante rápido en posición aórtica.
ConclusionesEn nuestra experiencia, el implante del sistema Edwards Intuity para el tratamiento de la estenosis aórtica ha resultado ser factible, seguro, reproducible y eficaz. Los tiempos de isquemia miocárdica y de circulación extracorpórea obtenidos parecen reducirse en comparación con la cirugía valvular aórtica habitual. Por otro lado, facilita y anima a la cirugía menos invasiva.
El comportamiento hemodinámico inicial y a medio plazo de la prótesis Edwards Intuity es excelente, aunque se debe continuar su estudio para lograr poblaciones y seguimientos más amplios. Debemos mantener una vigilancia estrecha sobre los pacientes con fugas periprotésicas, sobre todo en los de grado al menos moderado. Por último, hay que destacar la buena hemodinámica de los números más pequeños.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónParte de los pacientes de este trabajo pertenecen al estudio “Foundation”, patrocinado por Edwards lifesciencies LLC, Irvine, California.
Conflicto de interesesJMA y SJC declaran ser investigadores del estudio “Foundation” patrocinado por Edwards Lifesciences LLC, Irvine, California