En relación con los mecanismos de acción de la cardiomioplastia dinámica (CMPD), una reducción del estrés mecánico contribuye a reducir los niveles de apoptosis miocárdica. La recurrencia de la dilatación del ventrículo izquierdo, observado en pacientes con IC congestiva, determina un ciclo vicioso de estrés parietal y pérdida celular por apoptosis con dilatación progresiva de las cámaras ventriculares. Los resultados a largo plazo de la CMPD se hallan limitados por la condición preoperatoria de los pacientes y por la incidencia de muerte súbita.
La cardiomioplastia ofrece una cierta seguridad para ser utilizada como un puente al trasplante cardíaco en pacientes críticos con el fin de mejorar su calidad de vida a la espera de un órgano para el injerto. Por otra parte, la cooperación entre técnicas de regeneración celular e ingeniería de tejidos pueden ejercer beneficios funcionales ya que estos materiales proveerían de soporte evitando una remodelación excesiva y dilatación consecuente del ventrículo. Los mecanismos mencionados son algunos de los efectos demostrados por la aplicación de la CMPD con el dorsal ancho.
Concerning the mechanisms of action, a reduction in mechanical stress seems to contribute to a reduced level of myocardial apoptosis after cardiomyoplasty. Subsequent recurrence of left ventricular dilatation due to detrimental evolution of the underlying myocardial tissue observed in some cases could, in turn, instigate a return to pathological levels of wall stress, and to the vicious cycle of apoptotic cell loss and further progressive left ventricular enlargement. Long-term results of dynamic cardiomyoplasty are limited by the patient preoperative condition and by a high incidence of sudden cardiac death.
Cardiomyoplasty offers a relative secure mid to long-term bridge to heart transplant allowing critically ill patients to significantly improve their quality of life while waiting for heart donor. On the other hand, mixture of cell transplantation and tissue engineering can bridge functional benefits is that this implanted material should provide a supporting “band-aid” scaffolding effect, which can limit the spread of the infarcted area, preventing excessive remodeling and dilatation of the ventricle. The mechanisms mentioned above were one of the main effects demonstrated by the application of latissimus dorsi cardiomyoplasty.
«En el corazón, la relajación diastólica es un factor vital y no simplemente el estiramiento de un saco de caucho» Henderson, 19231
El origen del vocablo «corazón» deriva del sánscrito krid, cuyo significado es «órgano saltarín». Posteriormente pasó al griego kardia, para volcarse más adelante a hertz (germano), heart (inglés) y cor (latín). Pues bien, el impacto que ha provocado la insuficiencia de este «órgano saltarín» ha sido devastador, tanto en el número de pacientes como en el costo economicosocial2.
La insuficiencia cardíaca (IC) es un síndrome que traduce la ineficacia de la bomba cardíaca como situación extrema de diversas enfermedades: coronariopatías, miocardiopatías, valvulopatías y alteraciones congénitas. Si bien la clínica de este conjunto de enfermedades implica un cortejo sintomático común, de características progresivas hacia la descompensación, existen a nivel de la estructura cardíaca alteraciones específicas en sus componentes, de acuerdo con la patología que les dio origen. Es así, que tanto el miocito como las arterias coronarias, las válvulas o el sistema de conducción pueden ser las estructuras dañadas primaria o secundariamente, tanto en forma aislada como asociadas entre ellas. De esta forma, puede estar afectado el músculo del corazón per se o a través de la enfermedad coronaria o valvular. Asimismo, las estructuras valvulares pueden ser causa o consecuencia –fundamentalmente las auriculoventriculares– de la situación del problema congestivo. También son posibles las combinaciones entre las alteraciones estructurales que lleven a la IC en última instancia.
La enfermedad implica el inicio en la alteración estructural específica correspondiente al cuadro etiopatológico. La progresión de la afección puede determinar disfunciones consecutivas y secundarias en el resto de los componentes anatomofuncionales del corazón. Verbigracia, la coronariopatía puede alterar al miocardio, al sistema de conducción o llevar a una insuficiencia mitral, situación esta última en la que también puede desembocar la miocardiopatía denominada «idiopática». Asimismo, la enfermedad de Chagas-Mazza es capaz de provocar la desestructuración del miocardio y del sistema de conducción, y, consecuentemente, determinar valvulopatías auriculoventriculares que inciden en la progresión del daño fisiopatológico.
Tratamiento de la insuficiencia cardíaca grado DLa bomba cardíaca disfuncionante, cuando se vuelve refractaria a la alquimia del tratamiento médico optimizado, ha necesitado la terapéutica quirúrgica del reemplazo por un homoinjerto. El trasplante cardíaco como sustituto casi total del corazón ha demostrado ser una posibilidad de alto rendimiento, pero también de elección. De gran utilidad por su eficacia hemodinámica, pero desafortunadamente electiva debido a implicancias de su propio arte, como el número de donantes no disponibles, contraindicaciones psico-físico-sociales del receptor y consecuencias patológicas posteriores al trasplante (coronariopatías, tumores, rechazos e infecciones). Estas consideraciones limitan su uso a un número mínimo de candidatos3.
La pregunta que surge es: ¿qué posibilidades le asisten a la gran franja de pacientes sin respuesta al tratamiento médico optimizado, como asimismo a los que fueron desafectados de la posibilidad del trasplante? La baja frecuencia de trasplantes cardíacos4 ha motivado, desde hace varios años, la búsqueda de las llamadas «alternativas»5. Derivada del griego alternatus, esta palabra significa opción, implicancia que no debe subvalorarse en una enfermedad de pronóstico grave. Estas «alternativas», en un principio, persiguieron técnicas que mitigaran la IC en aquellos pacientes sin posibilidades de un homoinjerto. Actualmente, este concepto tiene límites más definidos y loables, basados en la posibilidad de postergar o reemplazar un trasplante con el fin de obtener una buena calidad de vida y pronóstico comparable. Por otra parte, el concepto de estructura cardíaca «culpable» de la fisiopatología que pueda presentar el paciente hace posible individualizar subpoblaciones que obtengan beneficios con el tratamiento instituido sobre la parte anatómica dañada del corazón. De esta manera, estas «alternativas» apuntan a mejorar los aspectos estructurales deficientes del corazón sin apelar a su reemplazo.
Así como no ha cesado la investigación farmacológica, tampoco se ha detenido la incorporación de procedimientos quirúrgicos alternativos. Con todas estas opciones, incluido el trasplante cardíaco, hemos aprendido dos aspectos fundamentales. Primero, que no existe un tratamiento único, ideal y definitivo para la IC, y derivado de esto hemos entendido un hecho antropológico –pro-clive a todo acto médico, y no sólo a la IC–, y es comprender la necesidad de la atención personalizada.
Es necesario considerar, en la estrategia quirúrgica de estos pacientes, la posibilidad de tratar la alteración estructural que compromete la función de la bomba cardíaca. Si conseguimos que el estudio de estos enfermos conlleve el concepto cognoscitivo –fundamentalmente en aquellos que no pueden acceder a un homoinjerto– de la alteración estructural mecánica «culpable» pasible de ser reparada, habremos dado un paso adelante en conseguir la sobrevida buscada.
Dentro de las «alternativas quirúrgicas», debemos mencionar aquellas que han permitido incorporarlas a la actividad médica en el marco de un contexto que indica cada uno de los protocolos. Ellas pueden corresponder a procedimientos anatomofisiológicos (reparación mitral, revascularización miocárdica, restauración ventricular), fisiológicos puros (asistencia biológica), funcionales (asistencia mecánica) o de autorreparación (regeneración cardíaca autóloga).
Cardiomioplastia dinámica con músculo dorsal anchoEn carácter de primum movens de este concepto, surgió en 1985 la primera CMPD realizada en el mundo por Carpentier y Chachques6, en París, la cual se situó rápidamente en el horizonte terapéutico clínico con aristas sorprendentes. «Madame S. Paska fue esa paciente operada en enero de 1985. Tenía 37 años, madre de dos niños. Presentaba un fibroma biventricular de 1,5kg que invadía también el diafragma. Había sido considerado inextirpable y no era viable para un trasplante»6. Los creadores habían recogido el guante que tenía su límite de suceso por el año 1959, cuando Kantrovich afirmaba7: «Yo creo que un músculo es un motor mucho más sensible para emplearse en este tipo de situación. Obtiene su energía de los huevos que usted toma en la mañana, y el sistema para transformar esto en energía ya está presente y funcionando».
Para que la técnica de la CMPD se trasladase a la clínica, fue necesario clarificar una serie de progresos fisiológicos en el conocimiento de la transformación del músculo8,9. Tanto los desarrollos en la búsqueda de generadores para la estimulación muscular como las técnicas quirúrgicas que debieron ser adecuadas progresivamente han permitido la realización de un número apreciable de CMPD en todo el mundo como para poder discernir diversos aspectos en los resultados logrados10–13 (Fig. 1). ¿Qué ha aportado la cardiomioplastia? La contribución ha sido enorme, tanto en el marco de la comprensión fisiológica de la IC como en la generación de otros procedimientos que, basados en aspectos de su eficacia, se desarrollaron posteriormente, como la aortoplastia dinámica14–18. En algunas patologías, como miocardio no compactado, ha sido (experiencia personal reciente) como el único recurso disponible con excelentes resultados.
Con la CMPD se inauguró una nueva era para el tratamiento de la IC, pero su desarrollo fue evolutivo. Para ello, tuvieron que desarrollar Salmons8 y Pette9 estudios fundamentales de biología molecular, genética e histoquímica de músculos crónicamente estimulados para demostrar que las fibras fatigables eran viables de volverse resistentes al esfuerzo y transformar su metabolismo anaeróbico en oxidativo. Chachques y Carpentier10–12 tuvieron que diseñar un cardiomioestimulador (SP 1005), electrodos de estimulación muscular, electrodos de detección de la señal de sincronización y un protocolo de estimulación (Fig. 2).
Un problema en su desarrollo fue el riesgo a que se exponía el equipo quirúrgico en un cambio de actitud. Los cirujanos estaban acostumbrados a resolver el estado crítico del paciente inmediatamente después de la cirugía. La CMPD es una cirugía delicada y juiciosa sobre un paciente grave, que no finaliza con el acto quirúrgico. Se debe esperar unos días de postoperatorio con un paciente crítico para poder iniciar el protocolo de estimulación. Sólo cirujanos con estirpe creadora y de hábitos pulcros fueron capaces de llevar el cuidado de este tipo de enfermos más allá del ámbito del quirófano. Otro factor que incidió negativamente en su desarrollo fue que en su inicio se indicó a pacientes en estado de gravedad terminal (grado IV de la New York Heart Association [NYHA]). En este nivel debía competir con el trasplante cardíaco, indicación de elección para el uso de un homoinjerto, por lo menos en ese periodo. Así como la IC plantea problemas diferentes derivados de su propia complejidad, y ha motivado distintos análisis basados en la segmentación del problema, el mismo razonamiento cartesiano debe seguirse en la interpretación de los resultados de la CMPD.
Resultados a largo plazo de la cardiomioplastia dinámicaLa CMPD ha sido realizada a 2.000 pacientes en el mundo19,20. Los resultados a largo plazo de la experiencia francesa han sido revisados recientemente: 212 pacientes operados de CMPD, desde 1985–2006 en seis hospitales20. Todos los pacientes tenían IC grado D, y la fracción de eyección media del ventrículo izquierdo (FEVI) fue de 22±9% (Tabla I). Las causas de la IC derecha fueron cardiomiopatía arritmogénica en 7 pacientes, isquémica en 2, enfermedad de Uhl en 1 y fibrosis endomiocárdica en 1. La CMPD fue realizada como procedimiento único sin necesidad de circulación extracorpórea al 74% de los pacientes, y al 26% se les realizó algún procedimiento asociado: resección de ventrículo izquierdo (7,3%), reparación o sustitución tricúspide (7%), cirugía de revascularización coronaria (6,6%), resección de tumor ventricular (2,7%), reparación o sustitución mitral (2,4%).
CMPD. Experiencia En Francia (212 Pacientes)
| Variable | N.o pacientes |
| Sexo | |
| – Hombre | 176 |
| – Mujer | 36 |
| Edad (años) | 53±11 (15–74) |
| Etiología | |
| – Miocardiopatía isquémica | 48% |
| – Miocardiopatía dilatada idiopática | 45% |
| – Otras (valvular, tumor, displasia VD) | 7% |
| Disfunción ventricular | |
| – Disfunción VI predominante | 68% |
| – Disfunción VD predominante | 9% |
| – Disfunción biventricular | 23% |
| Clase funcional nyHA (media) | 3,0 |
| – Clase II | 9% |
| – Clase III | 81% |
| – Clase IV | 10% |
VD: ventrículo derecho; VI: ventrículo izquierdo; NYHA: New York Heart Association.
La intervención quirúrgica fue realizada en la mayoría de los casos en dos fases, según la técnica previamente descrita10,12,19: a) disección del músculo dorsal ancho a través de una incisión con el paciente en decúbito lateral e introducción del músculo en la cavidad pleural izquierda después de resecar un segmento de la segunda costilla, y b) exposición del corazón por esternotomía media y aplicación del músculo alrededor del ventrículo izquierdo y/o derecho. La estimulación siguió un protocolo de activación progresiva con incremento del número de impulsos, hasta alcanzar un tren de seis impulsos (intervalo de 31 ms) sincronizado a través de ecocardiografía con el latido cardíaco. El protocolo de estimulación se inició después de 2 semanas de reposo postoperatorio para favorecer la recuperación muscular y el desarrollo de adherencias entre el músculo dorsal ancho y el corazón (Fig. 3).
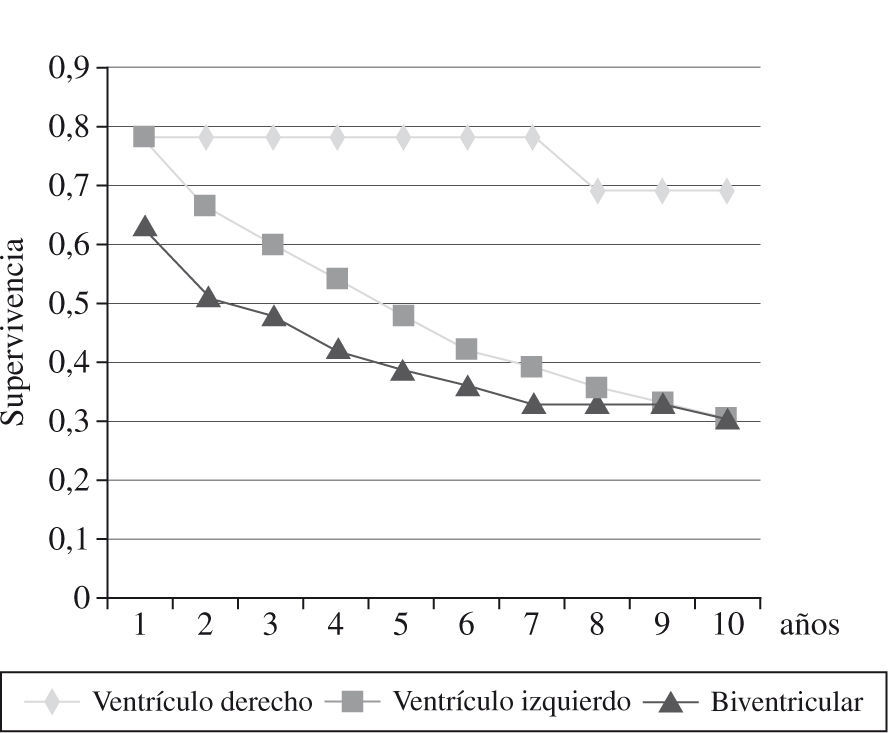
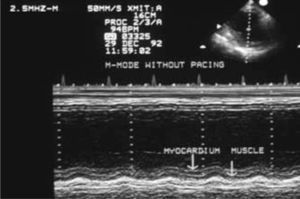
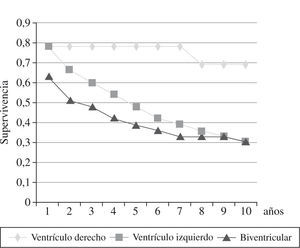
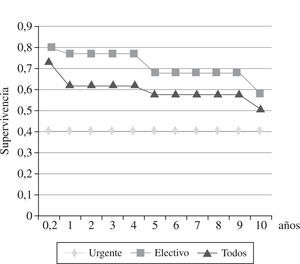
La mortalidad hospitalaria fue del 14% (29 pacientes), y estuvo relacionada con la clase funcional de la NYHA: 31,8% de los pacientes en clase IV NYHA, 12,4% en clase III, y 5,8% en clase II. La principal causa de mortalidad fue la IC (83%). Desde 1985 hasta diciembre de 2008, 99 pacientes fallecieron (tiempo medio, 4 años): 44% por IC, 37% por muerte súbita y 18% por causas no cardíacas (cáncer, hemorragia digestiva, accidente cerebrovascular). Los mejores resultados se obtuvieron en la insuficiencia ventricular derecha con una supervivencia a los 5 años del 78%, a los 10 años del 69%, mientras que en la insuficiencia ventricular izquierda y biventricular, la supervivencia descendió al 30% a los 10 años20 (Fig. 4). El 88% de los pacientes mejoraron su sintomatología. La clase funcional NYHA pasó de 3,0 en el preoperatorio a 1,7 en el postoperatorio, con un seguimiento medio de 7,2 años.
A 26 pacientes se les realizó trasplante cardíaco por persistencia de la IC después de la CMPD o recurrencia secundaria a progresión de la enfermedad cardíaca. La supervivencia después del trasplante (seguimiento medio 5,5 años, máximo 13,5 años) está representada en la figura 520. El músculo dorsal ancho estaba bien preservado en 9 pacientes, mostraba signos ligeros de hipertrofia y fibrosis en 11, importante atrofia y alteraciones ultraestructurales en 9 casos.
Estos resultados nos enseñan que:
- –
La mortalidad hospitalaria de la CMPD es asumible (4%) en los pacientes en clase funcional III de la NYHA, con unos beneficios demostrados a largo plazo: supervivencia a los 10 años del 69% en los casos de insuficiencia ventricular derecha, y del 30% en los pacientes con insuficiencia ventricular izquierda, la mayoría en clase funcional IV de la NYHA y con criterios de contraindicación al trasplante.
- –
La compatibilidad y beneficio que se puede obtener asociando un desfibrilador implantable y el generador de CMPD, mientras no se desarrolle un dispositivo integrando las dos funciones, debido a la incidencia de muerte súbita (37% de las muertes tardías).
- –
En los casos de IC recurrente, el trasplante cardíaco es asumible. La CMPD puede ser considerada una terapia definitiva en algunos casos o un paso intermedio de puente biológico al trasplante cardíaco, aunque también ha sido realizada la CMPD a pacientes inter-venidos previamente de trasplante cardíaco21,22.
Los resultados a largo plazo de la CMPD pueden mejorar modificando los protocolos de estimulación del músculo esquelético y asociando un desfibrilador implantable. Los avances científicos y del conocimiento durante los últimos años nos han mostrado el potencial de utilizar los músculos esqueléticos como base fisiológica para desarrollar el concepto de «bioasistencia cardíaca». El conocimiento de la anatomía vascular del músculo dorsal ancho y de la respuesta a la estimulación eléctrica debe ser la base para conseguir músculos viables a largo plazo23. La CMPD, con nuevos protocolos de estimulación, debe reducir el estrés sistólico de la pared, mejorar la asistencia biológica, contribuir a revertir el remodelado ventricular y mejorar la revascularización extramiocárdica a largo plazo24.
Las indicaciones de la CMPD se han ampliado recientemente:
- –
Los resultados a largo plazo están limitados por el número de muertes súbitas. Después de la CMPD, los pacientes que han requerido tratamientos electrofisiológicos se han beneficiado de la implantación de marcapasos de resincronización y desfibriladores implantables. El desarrollo de un cardiomioestimulador de CMPD que incorpore las funciones de desfibrilador y marcapasos de resincronización adquiere un interés preferente.
- –
La estimulación eléctrica continua para asistencia sistólica produce degeneración del músculo esquelético. Para evitar la transformación de todas las fibras en metabolismo oxidativo de contracción lenta, nuevos protocolos de estimulación han sido desarrollados con menos impulsos/día y periodos de descanso25.
- –
Una indicación de la cardiomioplastia son los pacientes con tumores cardíacos. En los casos con tumores extensos, la resección amplia del tumor ha sido seguida por la reconstrucción anatómica y funcional del ventrículo mediante la CMPD26.
- –
Otra aplicación de la CMPD es la depresión crónica del ventrículo derecho, por ejemplo por displasia arritmogénica. El tratamiento de esta patología no está resuelto todavía, con una mortalidad alta y pésima calidad de vida. La CMPD ha demostrado una mejora funcional, sin arritmias malignas y mejora de los parámetros hemodinámicos de función ventricular derecha27.
- –
Los resultados a largo plazo del trasplante cardíaco después de la CMPD son similares al trasplante primario. En algunos casos seleccionados, la CMPD puede considerarse un puente biológico al trasplante.
La asistencia mecánica en sístole sería el efecto más lógico de aceptar, pero no halla explicación este suceso con el pequeño incremento observado en FEVI. Asimismo, la ausencia de diferencia entre latidos asistidos y no asistidos a medio plazo poscirugía dejan en duda esta función28. La neovascularización, es decir, la posibilidad de establecer canales de irrigación entre el músculo dorsal ancho y el miocardio, no ha sido demostrada en el humano hasta el momento.
Si algo ha demostrado la CMPD, es su efectividad en la detención del proceso de dilatación de las cámaras cardíacas, situación que implica la fisiopatología de la cardiomiopatía dilatada. Este proceso de dilatación continuo lleva en sí mismo el mayor riesgo de mortalidad en estos pacientes, como fue aseverado por el grupo de Studies of Left Ventricular Dysfunction (SOLVD) investigadores29.
Capouya30 y Mott31 han sugerido que el procedimiento sirve para interrumpir la dilatación progresiva. Carpentier32 comunica que proporciona al índice cardiotorácico una estabilidad a los 3 años de seguimiento en sus valores. Nuestra experiencia ha sido similar en este aspecto33. Moreira34 demuestra, por su parte, evidencias clínicas de reducción del estrés parietal, disminución de los diámetros de las cámaras ventriculares y un aumento en la máxima elastancia del ventrículo izquierdo. Kass35 también halla efectos benéficos asociados con reverse remodeling en casos estudiados con análisis de curvas de presión-volumen, relatando una disminución de los volúmenes de fin de diástole y fin de sístole del ventrículo izquierdo y una mejora en la función ventricular. La reducción del estrés parietal, determinante fundamental del consumo de oxígeno, hallaría explicación al impedir la CMPD la progresión de la dilatación ventricular.
Estos efectos favorables de la CMPD, con respecto a la progresión de la dilatación, los hemos constatado en nuestra propia experiencia. Sobre 15 pacientes tratados, 12 de ellos sobrepasaron el umbral absoluto de los 2 años (promedio de seguimiento 31,3 meses/paciente). En estos enfermos, el valor del diámetro diastólico del ventrículo izquierdo (ecocardiográfico) era en el preoperatorio de 72,7±3 mm, siendo al año de seguimiento de 73,6±7 mm, y a los 2 años de 72,3±8 mm. La diferencia entre estos valores no fue significativa, es decir, que el ventrículo izquierdo mantuvo sus valores iniciales, no revelando progresión en su dilatación. En la propia estructura del corazón y en la consecuencia patológica que implica la dilatación progresiva y permanente de la cardiomiopatía dilatada, seguramente deberemos investigar los posibles efectos benéficos de la cardiomioplastia.
La fuerza generada por la contracción sistólica ejerce una compresión sobre los elementos elásticos-musculares del corazón de tal magnitud, que incluso sin el llenado interno diastólico, la tendencia de los ventrículos es la expansión. Esta presión negativa determina un mecanismo de bomba de succión. Las presiones intraventriculares negativas determinantes de este efecto fueron descritas desde 1930, siendo referidas las mismas a las propiedades elásticas de la pared ventricular que dirige la sangre desde las aurículas hacia los ventrículos36,37. Para que esta bomba de succión dinámica tenga efectividad, el proceso de retroceso elástico debe poseer una limitante que permita una efectiva sístole posterior.
Los sarcómeros miocárdicos en condiciones normales sufren un alargamiento que va desde 1,85 µm en el periodo de contracción hasta los 2,05 µm en el estado de reposo. Ahora bien, la posibilidad del alargamiento del sarcómero se halla inscrita tanto en su autoestructura muscular como en el citoesqueleto fibroso. Este citoesqueleto de colágeno se halla constituido por una malla de forma cuadricular que envuelve individualmente a los sarcómeros, los cuales se hallan reunidos en manojos por estructuras conectivas denominadas tirantes o amarras, giradas en forma helicoidal sobre su mismo eje. La disposición de los tirantes, similar a los cables tensores de los puentes colgantes, ha sugerido la idea de un almacenamiento de energía sistólica que liberada en el proceso diastólico permitiría el efecto de bomba de succión de los ventrículos38.
Los tirantes coordinan la acción de un gran número de células musculares. El hecho de ofrecer una arquitectura solidaria a la deformación del corazón permitiría a éste obtener una mejor succión y recobrar su longitud inicial más rápidamente. Este concepto de encaje de fibras conectivas como parte esencial de la funcionalidad cardíaca y adaptación a circunstancias variables es relativamente reciente. Dada esta estructura anatomofisiológica del corazón y la aplicación de la Ley de Laplace al mecanismo de su dilatación progresiva, el efecto diastólico benéfico, observado en el seguimiento de las CMPD, encuentra extensa aplicación en esta técnica. La interpretación más simple de estos hallazgos es que la estructura entrelazada de las fibras de colágeno evita que se produzca un estiramiento excesivo de los sarcómeros.
La cincha muscular obtenida con la CMPD provee una constricción elástica limitando la dilatación cardíaca. Esto trae aparejado beneficio en la función diastólica, ya que se ha observado una disminución en la presión de fin de diástole, la cual se incrementa al apagar el cardiomioestimulador. Asimismo, luego de discontinuado este último, se ha registrado que el llenado ventricular tiende a ocurrir más tardíamente, indicando que la contracción del músculo dorsal ancho mejora este llenado39. Esta situación de mayor rendimiento en la función diastólica determinaría una disminución en los diámetros del anillo mitral y de la aurícula izquierda, tal como fue la tendencia en los pacientes de series publicadas40,41. La CMPD es un estado operativo, contribuyente a la restauración de la fuerza muscular del corazón dilatado, con el fin de obtener el gradiente interno necesario para su llenado, mediante el mecanismo de bomba de succión. Hasta el momento, la CMPD ha demostrado en forma fehaciente una mejoría importante en la clase funcional de estos enfermos. En nuestra experiencia, a los 2 años del seguimiento, este dato había pasado de 3,06±0,2 a 1,7±0,6, con una sobrevida del 75% en este lapso, similar a otros informes publicados42,43. Hoy en día, debe considerarse a la clase funcional III como la única capaz de ser sometida a esta técnica. El seguimiento alejado ha mostrado en algunas series44 una sobrevida, en esta clase funcional del 66% a los 7 años. Otras publicaciones han relatado resultados menos optimistas, del orden del 56% a los 2 años45. Actualmente, con el fin de conseguir los efectos diastólicos de la CMPD, se ha presentado una malla de tejido que se inserta alrededor de los ventrículos (Acorn Cardiac Support) a través de una miniesternotomía. Se ha considerado que controla el deterioro de la función cardíaca a través de la estabilización de las dimensiones del corazón46.
En el campo de la medicina traslacional, el conocimiento adquirido con la CMPD ha sido aplicado a la medicina regenerativa. La aplicación de células madre para la regeneración miocárdica es un tema de interés, y recientemente se han descrito matrices bioartificiales para lograr soporte mecánico y regeneración cardíaca. La asociación de electroestimulación con cardiomioplastia celular puede ser una vía para transformar la terapia celular en soporte celular dinámico. De hecho, los principios de las condiciones electrofisiológicas de las fi-bras musculares esqueléticas son ahora aplicadas en la regeneración cardíaca. La hipótesis sustentada es que la electroestimulación de ambos ventrículos con el implante de células puede inducir la contracción de las células trasplantadas con alta expresión de miosinas lentas, mejor adaptadas para la asistencia ventricular crónica. El uso de la electroestimulación es una apertura para lograr que se diferencie el implante en células biogénicas de tipo cardíaco. Este concepto rememora que, en las fases iniciales de la formación embrionaria del corazón, las primeras células que laten inducen al futuro manto cardíaco a adquirir su función específica. Este tipo de diferenciación debe incluir la inducción de las uniones gap, la mejora del entramado con las células nativas y la reducción del riesgo en relación con los eventos arritmogénicos.
La ingeniería aplicada al tejido cardíaco emerge como una nueva terapéutica y extiende las posibilidades de avanzar sobre la creación de un miocardio bioartificial. En un reciente estudio que hemos publicado (MAGNUM [Myocardial Assistance by Grafting a New Bioartificial Upgraded Myocardium]), se ha encontrado que el implante celular asociado con una matriz de colágeno aumenta el espesor del miocardio infartado con tejido viable normalizando el estrés parietal para conseguir mejorar la función diastólica. Futuras investigaciones incluyen plataformas de membranas bioactivas donde las células puedan ser preacondicionadas para resistir el implante. Este concepto parece esencial para promover angiogénesis local en tejidos cardíacos necróticos47. La electroestimulación combinada con el implante celular, enseñanza derivada de la CMPD, puede transformar la terapia celular «pasiva» en un soporte dinámico. Estos principios de electrofisiología aplicada a la cardiomioplastia desde hace años para acondicionar las fibras musculares esqueléticas pueden ser aplicados para mejorar la eficacia del implante celular.