La terapia celular con células madre, como estrategia para regenerar tejidos dañados, es una de las áreas más prometedoras en el tratamiento de enfermedades con escasas o nulas expectativas de curación. La insuficiencia cardíaca, principalmente de origen isquémico, es una de las enfermedades que más se pueden beneficiar de esta estrategia. El objetivo es regenerar el músculo, reducir la apoptosis, aumentar la expresión del colágeno intersticial e inducir la generación de nuevos vasos. la terapia celular cardíaca ha sido propuesta con una gran variedad de células angiogénicas y miogénicas: mioblastos esqueléticos, células mononucleares y mesenquimales de médula ósea, progenitores endoteliales circulantes, células derivadas del estroma de la grasa o del endometrio, células mesoteliales y pluripotenciales (induced pluripotent stem cells [iPS]). las indicaciones incluyen a pacientes con miocardiopatía isquémica o dilatada, enfermedad de Chagas, insuficiencia mitral isquémica y miocardiopatía diabética. Los abordajes son quirúrgicos, con inyección periinfarto, intracoronario y endoventricular percutáneo. Los mecanismos de acción propuestos son la reducción del tamaño de la cicatriz del infarto, el aumento de la viabilidad miocárdica, la limitación del remodelado ventricular y los efectos paracrinos. Sin embargo, los resultados clínicos muestran sólo mejoras muy limitadas de la función sistólica y del remodelado ventricular. El desarrollo de estrategias que mejoren la supervivencia y la diferenciación celular deben ser prioritarias, tales como el preacondicionamiento con electroestimulación o la ingeniería tisular con el objetivo de desarrollar un miocardio bioartificial.
Stem cell therapy, as a strategy to regenerate injured tissues, has emerged as one of the most promising areas for the treatment of illnesses with low possibilities of treatment. The heart failure, mainly of ischemic ethiology, is one of the diseases that more can benefit from this therapeutic strategy. The aim is to regenerate the muscle, reduce apoptosis, increase the expression of the collagen and get an effective production of new vessels. This approach is undergoing with a variety of myogenic and angiogenic cells: skeletal myoblasts, mononuclear and mesenchymal bone marrow cells, circulating blood-derived progenitors, endometrial or adipose-derived stromal cells, mesothelial cells and induced pluripotent stem cells (iPS). The indications concern patients with ischemic cardiomyopathy, idiopathic dilated cardiomyopathies, Chagas heart disease, ischemic mitral regurgitation and diabetic cardiomyopathy. The approaches for cell delivery are surgical performing in the periinfarct area, intracoronary and endoventricular catheter-based cell delivery. The proposed mechanisms of action are reduction of the size and fibrosis of infarct scars, improvement of myocardial viability, limitation of ventricular remodeling, improvement of ventricular compliance and paracrine effects. However, the clinical results have reported only limited improvement in systolic function and remodeling. The development of strategies for improving cell survival and differentiation should be encouraged, such as preconditioning procedures with cell electrostimulation or by using tissue engineering in order to create a bioartificial myocardium.
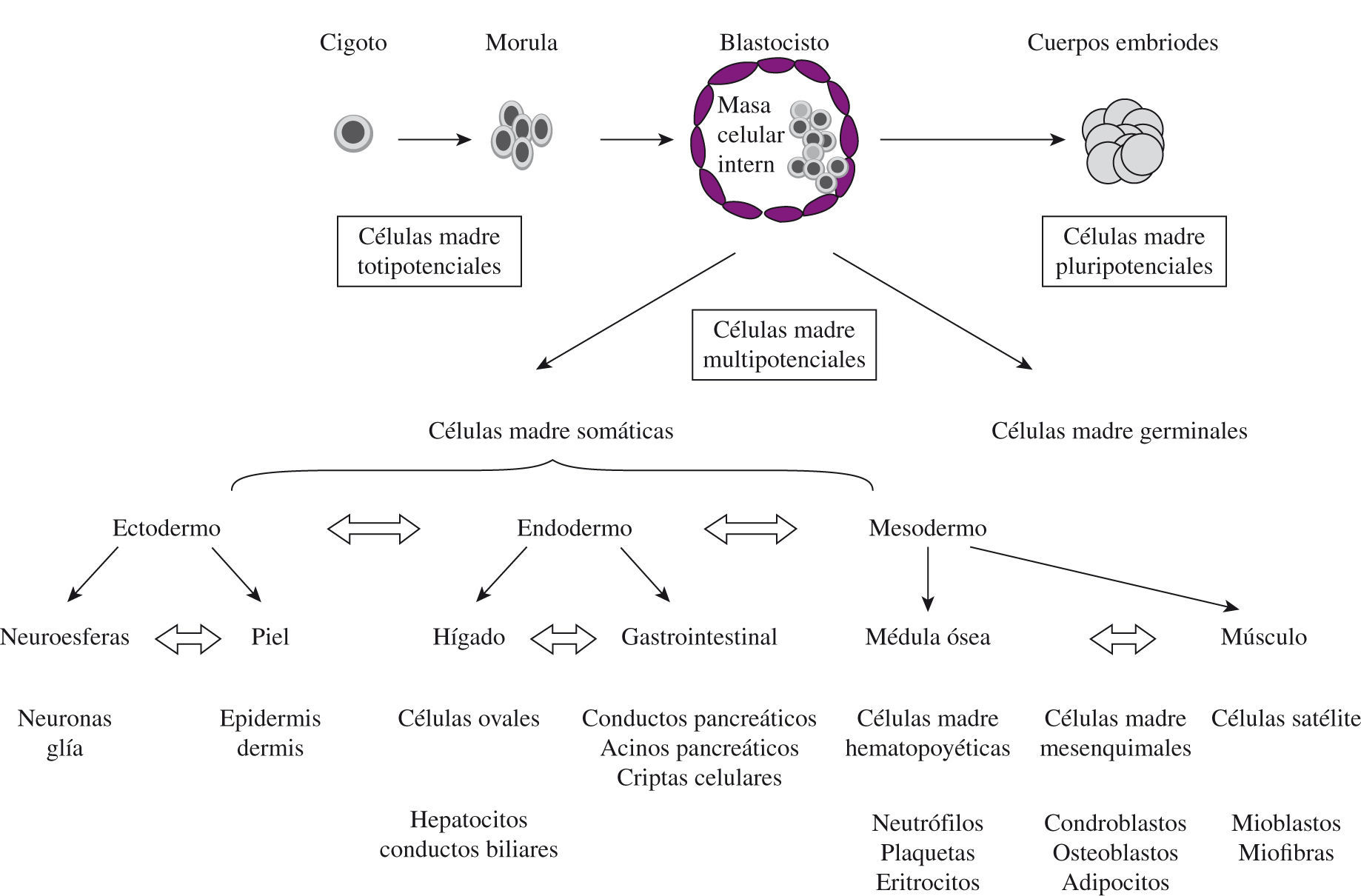
Las células madre han sido definidas como células clonogénicas, lo que significa que tienen: a) capacidad de autorrenovarse por división simétrica; b) capacidad de diferenciarse por división asimétrica, y c) posibilidad de reconstruir un tejido por repoblación funcional. De acuerdo con su plasticidad, pueden ser: a) totipotenciales, capaces de generar tejidos embrionarios y extraembrionarios. Esta capacidad es exclusiva del cigoto y las células descendientes inmediatas; b) pluripotenciales, capaces de diferenciarse en células de las tres capas germinales. A pesar de que se pensaba que eran exclusivas del embrión, recientemente se ha demostrado que tejidos adultos poseen células con esta plasticidad; c) multipotenciales, con una capacidad de diferenciación más limitada, y d) unipotenciales, con capacidad de diferenciación limitada a un tipo celular (Fig. 1).
La terapia con células madre, como estrategia para regenerar tejidos dañados, es una de las áreas más prometedoras del tratamiento de las enfermedades con escasas expectativas de curación. La insuficiencia cardíaca, principalmente de etiología isquémica, es una de las enfermedades que más se pueden beneficiar de este tratamiento. El objetivo de la terapia celular cardíaca es regenerar el músculo, reducir la apoptosis, aumentar la expresión del colágeno intersticial y conseguir una producción efectiva de nuevos vasos que aseguren una nutrición adecuada a la región afectada.
Tipo celularAunque la célula ideal debe tener el potencial de diferenciarse a cardiomiocito con capacidad de contracción y acoplamiento eléctrico con el resto del miocardio, la capacidad para formar nuevos vasos que irriguen el área dañada puede estimular la regeneración tisular1. Hay evidencias recientes de renovación de los cardiomiocitos, pero este proceso tiene escasa repercusión, y los estudios muestran que menos del 50% de los cardiomiocitos cambia durante la vida2. Esta capacidad del corazón adulto para generar nuevos cardiomiocitos debe inducir el desarrollo de estrategias terapéuticas dirigidas a estimular este proceso. Mientras tanto, debe proponerse el trasplante de células madre como procedimiento biológico para tratar las enfermedades cardíacas.
Varios tipos celulares han mostrado su capacidad funcional para regenerar tejidos cardiovasculares3 (Tabla I). Los mioblastos son resistentes a la isquemia, mejoran la función sistólica ventricular, reducen la fibrosis, regeneran células musculares, inducen angiogenesis4,5 y los resultados clínicos se mantienen a medio plazo6 (Fig. 2). Sin embargo, los mioblastos y las células derivadas de la médula ósea adulta no tienen la capacidad de integrarse electromecánicamente en el corazón receptor, con las consecuencias directas que esto conlleva en la supervivencia celular y la diferenciación.
Células adultas con propiedades potenciales de regeneración cardíaca
| Miogénesis y cardiomiogénesis |
| – Mioblastos esqueléticos |
| – Células madre musculares |
| – Células musculares lisas |
| – Cardiomiocitos atriales como marcapasos biológico |
| – Cardiomiocitos ventriculares adultos |
| – Progenitores epicárdicos |
| – Células multipotenciales del estroma endometrial |
| Angiogénesis |
| – Médula ósea y su fracción de células mononucleares de sangre periférica |
| – Médula ósea y progenitores endoteliales de sangre periférica |
| – Células endoteliales |
| – Células mesoteliales |
| – Células mesenquimales del estroma de la grasa |
| Células madre pluripotenciales |
| – Células del cordón umbilical |
| – Células mesenquimales de médula ósea |
| – Células pluripotenciales adultas de médula ósea (MAPC) |
| – Células pluripotenciales inducidas iPS |
Ensayo clínico de mioblastos. Evolución de la fracción de eyección a los 12 meses. A: grupo control. B: grupo mioblastos. p < 0,0016.
El tipo celular para realizar el trasplante está en función de la enfermedad tratada. En los pacientes con antecedente de infarto agudo de miocardio, la terapia celular debe reducir la necrosis e inducir angiogénesis. En la insuficiencia cardíaca, las células deben promover la miogénesis y revertir la apoptosis.
Mecanismos de acciónLos principales mecanismos involucrados en el beneficio de la cardiomioplastia celular son la reducción del tamaño y de la fibrosis de la escara del infarto, la limitación del remodelado ventricular, la mejora de la función sistólica y el incremento del grosor de la pared ventricular.
Hay lagunas en la demostración de los mecanismos involucrados en la regeneración celular asociado a células madre. La inmunomodulación, los efectos paracrinos, la capacidad de diferenciarse o transdiferenciarse han sido propuestas como hipótesis, pero su relevancia e implicación en el beneficio no ha sido demostrado7.
La identificación de los tipos celulares que pueden integrarse electromecánicamente en el miocardio receptor es prioritaria. Es posible dirigir la diferenciación de varios tipos celulares que incluyen los fibroblastos, células de médula ósea y células mesenquimales en células que expresan marcadores característicos del fenotipo cardíaco. Estos protocolos de transdiferenciación exigen el uso de fármacos potencialmente peligrosos o periodos de cocultivo con cardiomiocitos humanos o de ratas. Estos requerimientos impiden la traslación a la práctica clínica.
Los resultados preliminares sugieren que las células con un fenotipo cardiomiogénico, tales como las células madre cardíacas, células mesenquimales o pluripotenciales pueden satisfacer estos criterios y garantizar la regeneración del miocardio necrótico. Una diferenciación parcial hacia un fenotipo cardiomiogénico puede ser preferible a una diferenciación completa a cardiomiocito. En este contexto, un ambiente cardíaco puede proporcionar las señales bioquímicas y mecánicas para integrar la diferenciación. Después de completar su diferenciación, las células pueden reducir la fibrosis y restaurar la función del músculo cardíaco selectivamente. Este concepto de prediferenciación ha sido recientemente descrito7.
La supervivencia de las células en un ambiente inflamatorio, como ocurre en un infarto de miocardio, es un desafío para todos los tipos celulares. La isquemia persistente limita drásticamente el injerto celular. Inmediatamente después de un infarto agudo de miocardio, el proceso de reparación se inicia con una migración activa de células inflamatorias, reclutamiento de fibroblastos cardíacos y el remodelado eventual de la matriz extracelular dirigido a estabilizar el área y restaurar la función ventricular. Sin embargo, la pérdida de cardiomiocitos y la sustitución por tejido fibroso lleva a una dilatación progresiva, adelgazamiento de la pared y desarrollo de insuficiencia cardíaca.
Después de la inyección endovenosa de células de médula ósea, el 70% de las células se dirigen a los pulmones, y únicamente pequeños grupos celulares se depositan en el corazón, riñones e hígado7. Incluso, después de la inyección intramiocárdica, un porcentaje importante de células migran al bazo, pulmones e hígado. El número de células implantadas en el corazón es mayor cuando la inyección se realiza en el corazón parado bajo circulación extracorpórea y cardioplejía que en un corazón latiendo8.
Las células con verdadero fenotipo cardiomiogénico garantizan la regeneración del miocardio necrótico. Es preferible una diferenciación parcial de estas células con un fenotipo cardiomiogénico que células completamente diferenciadas a cardiomiocitos, porque el microambiente que rodea las células ofrece las señales biomecánicas necesarias para integrar la diferenciación. Después de completar su diferenciación en el miocardio, les células pueden reducir la fibrosis y restaurar la función cardíaca selectivamente9.
Indicaciones- –
Cardiopatía isquémica. La terapia está indicada en pacientes con fracción de eyección entre el 20–40%, grado funcional II-III de la New York Heart Association (NYHA) y antecedente de infarto de miocardio con extensión moderada, entre 9–14cm2, que representa menos de un tercio de la superficie del ventrículo izquierdo. El grosor de la pared del ventrículo izquierdo deberá ser mayor de 4mm para evitar la inyección extramiocárdica y lesiones iatrogénicas. La inyección precoz de las células puede prevenir el desarrollo de grandes cicatrices, aunque parece razonable demorar la inyección de las células hasta que haya concluido la reacción inflamatoria postisquémica3. Son contraindicaciones los grandes infartos con extensión mayor del 35% de la superficie del ventrículo izquierdo, asinergias por grandes cicatrices discinéticas, arritmias ventriculares malignas o historia reciente de síncopes. La terapia celular con mioblastos está contraindicada en los pacientes con enfermedades musculares y con células de médula ósea en las enfermedades hematológicas. Son contraindicación también el antecedente de cáncer con periodo de remisión completa inferior a 5 años, infección activa o serología de hepatitis o VIH positivas.
- –
Asociación a la cirugía de restauración ventricular. De acuerdo con los modelos biomecánicos de insuficiencia cardíaca crónica, los cambios de la geometría y forma del ventrículo izquierdo son responsables de cambios en los miocitos y la matriz extracelular10. Este concepto introduce la necesidad de asociar la terapia celular a la reducción del volumen y restauración de la geometría ventricular10: plastia endoventricular de V. Dor o pacopexia basada en la hipótesis de T. Guasp, asociada a cirugía de revascularización coronaria y terapia celular11.
- –
La insuficiencia mitral secundaria a disfunción isquémica del músculo papilar puede beneficiarse de la terapia celular, y un ensayo clínico está en fase de desarrollo en el Hospital Europeo Georges Pompidou de París.
- –
Miocardiopatías no isquémicas. Los estudios experimentales en miocardiopatías dilatadas y secundarias a toxicidad farmacológica han generado ensayos clínicos actualmente en curso. Los resultados iniciales muestran la eficacia del tratamiento y la mayor supervivencia de las células injertadas, porque la irrigación miocárdica no está significativamente alterada12.
- –
Miocardiopatía diabética. Independientemente de la mayor gravedad de la cardiopatía isquémica13, los pacientes diabéticos tienen un riesgo mayor de desarrollar insuficiencia cardíaca. Las características específicas de la miocardiopatía diabética son la enfermedad microvascular y fibrosis intersticial. Los estudios en modelos experimentales de diabetes han demostrado que la terapia con células mesenquimales incrementa la densidad vascular miocárdica, reduce el colágeno intersticial, mejora la función sistólica y atenúa el remodelado del ventrículo izquierdo14.
- –
Enfermedad de Chagas. Un siglo después de su descubrimiento en 1908, la tripanosomiasis americana continúa siendo un problema de salud pública, con 12 millones de portadores en América Latina, descripción de casos en EE.UU. y Europa por la globalización15. Cuatro mecanismos patogénicos explican la afectación cardíaca en la enfermedad de Chagas: alteración del sistema nervioso autonómico, reducción de la microcirculación, agresión miocárdica directa por el parásito y reacción inmunitaria a la agresión miocárdica. El 25% de los pacientes infectados desarrollan arritmias, miocardiopatía dilatada e insuficiencia cardíaca. El trasplante cardíaco es el único tratamiento reconocido capaz de modificar la evolución natural de la enfermedad de Chagas en su fase terminal16. Sin embargo, la reactivación de la enfermedad es un problema real, y la inmunosupresión predispone a la aparición de neoplasias y reactivación de la enfermedad. La terapia celular es una alternativa válida al trasplante, con resultados documentados a medio plazo para los pacientes que han desarrollado insuficiencia cardíaca secundaria a miocardiopatía dilatada17,18. Si la circulación coronaria es normal, los pacientes pueden ser tratados con inyección de célula mononuclear de médula ósea por un abordaje intracoronario17.
- –
Insuficiencia cardíaca pediátrica. La terapia celular con células pluripotenciales puede aportar células con capacidad funcional de comportarse como cardiomiocitos: células mesenquimales de la médula ósea o del estroma celular de la grasa, o bien células iPS reprogramadas que adquieren las características de pluripotenciales y favorecen la transcripción de factores3. Aunque la insuficiencia cardíaca pediátrica tiene un pronóstico excelente si la etiología es una cardiopatía congénita subsidiaria de tratamiento quirúrgico, algunas formas, especialmente la miocardiopatía dilatada, son cardiopatías con indicación de trasplante cardíaco. La mitad de los niños con miocardiopatía sintomática reciben un trasplante cardíaco o fallecen antes de 2 años. En este grupo de niños, la terapia celular con células pluripotenciales es una alternativa al trasplante3.
Nuevas técnicas de implante celular, a través de técnicas de cardiología intervencionista, se han sumado al implante quirúrgico: intracoronaria y endoventricular percutánea (Tabla II). El abordaje quirúrgico, generalmente asociado a cirugía de revascularización coronaria4, se realiza con múltiples puntos de inyección en el interior de la escara del infarto y en el área periinfarto con una aguja oftálmica retrobulbar 25G × 40mm. Nuestro grupo inyecta el 70% de las células en el área periinfarto porque la revascularización residual por circulación colateral incrementa la supervivencia celular19. El 30% de las células restantes son inyectadas en el área central de la escara. La inyección de las células por toracoscopia o por técnicas de cirugía robótica ha sido desarrollada con éxito en modelos experimentales, y actualmente está en fase de desarrollo clínico. El objetivo es reducir la agresión quirúrgica y no limitar este abordaje a los pacientes con indicación de realizar procedimientos asociados, como la cirugía de revascularización coronaria, restauración ventricular o corrección de la insuficiencia mitral.
Técnicas de administración celular
| Técnica | Ventajas | Inconvenientes |
| Quirúrgica (epicárdica) | Factibilidad, seguridad | Riesgos de cirugía |
| Endoventricular (catéter) | Escasa agresividad Administración periódica | Dificultad localización Pérdida de células |
| Intracoronaria | Fácil manipulación Bajo coste | Migración de células Riesgo microembolias |
El abordaje endoventricular percutáneo se realiza por punción de la arteria femoral, mediante catéteres dirigidos hasta la cavidad ventricular. Cuando, por mapeo electromagnético, el lugar de inyección es confirmado, la aguja es introducida en el miocardio y las células son liberadas. La inyección a través de una aguja en la pared ventricular contráctil produce la regurgitación parcial de las células, estimada alrededor del 40%. Nuestro grupo, en un modelo de infarto agudo de miocardio en cerdos tratado con mioblastos, ha demostrado un incremento de la fracción de eyección, un incremento del número de vasos y una reducción de la fibrosis, sin diferencias en cuanto a eficacia entre el abordaje quirúrgico y percutáneo, a pesar de no haber diferencias en el número de células inyectadas20 (Figs. 3 y 4).
Modelo de infarto de miocardio en cerdos. Incremento de la fracción de eyección del ventrículo izquierdo (FEVI) en los grupos de inyección de mioblastos por un abordaje quirúrgico y endoventricular percutáneo, con diferencias significativas con respecto al grupo control y sin diferencias entre los dos grupos de tratamiento20.
Modelo de infarto de miocardio en cerdos. A: reducción del colágeno tipo I y III en los grupos de inyección de mioblastos por un abordaje quirúrgico y endoventricular percutáneo (diferencias significativas con respecto al grupo control, sin diferencias entre los dos grupos de tratamiento). B: relación inversamente proporcional entre el área de fibrosis (CVF) y la FEVI20.
Hemos desarrollado un catéter de inyección endoventricular percutáneo que ha sido patentado recientemente en EE.UU.21. Este catéter aumenta la seguridad y eficacia de la inyección al impedir la perforación de la pared del ventrículo y el riesgo de producir hemopericardio, evita la pérdida de células que refluyan a la cavidad ventricular, simplifica el procedimiento y ahorra costes22.
La administración intracoronaria está basada en el potencial migratorio de algunas células que pueden atravesar la membrana basal. Este abordaje queda limitado a las células mononucleares de médula ósea (esféricas, con diámetro de 8–18μm), porque los mioblastos y las células mesenquimales, por su forma estrellada y tamaño de 25–30μm, pueden producir microembolias. Es el abordaje utilizado en el infarto de miocardio en la fase aguda, la miocardiopatía dilatada y la enfermedad de Chagas. Los estudios de inyección intracoronaria del factor de crecimiento de los fibroblastos muestra que solamente el 3% fue recuperado por el corazón. Sin embargo, la inyección intracoronaria con oclusión del seno coronario consigue injertos celulares superiores al 50%.
La vía endovenosa sistémica no es eficaz porque la mayoría de las células son retenidas en los pulmones, el hígado y el bazo. Solamente el 0,5% del factor de crecimiento de los fibroblastos administrado fue recuperado por el corazón. Esta pobre capacidad podría compensarse con un número mayor de células, asociando factores de crecimiento y movilización, como el factor de crecimiento granulocítico (G-CSF).
La inyección de las células, independientemente del abordaje local utilizado, se asocia a una supervivencia pequeña, inferior al 10% de las células injertadas19,20. Esta mortalidad probablemente esté relacionada con el traumatismo de la inyección y el pobre lecho vascular de la cicatriz isquémica (Fig. 5). De ahí, nuestra técnica de inyectar preferentemente las células en el área periinfarto y asociar la angiogénesis terapéutica para incrementar la supervivencia. Los mejores resultados funcionales parecen obtenerse en pacientes con infartos heterogéneos formados por miocardio viable e infartos pequeños múltiples. De todas formas, una fibrosis vascularizada parece ser una indicación mejor que una fibrosis no vascularizada postinfarto.
Hemos demostrado, en nuestro modelo de infarto en cerdos, que la inyección repetida de mioblastos es más eficaz que la inyección única20. La inyección periódica puede ser útil para reducir progresivamente la cicatriz postinfarto de la miocardiopatía isquémica o mejorar progresivamente la función del ventrículo izquierdo en las miocardiopatías no isquémicas. Este abordaje debe ser simplificado con el desarrollo de nuevos catéteres de inyección endoventricular percutáneos.
Lecho de la terapia celularLa propuesta de trasplantar células es atractiva, y exige el conocimiento de las bases biológicas de la angiogénesis y miogénesis. Su eficacia depende del tipo celular, vascularización, número de células y un proceso complejo en el que participan señales intracelulares, quimiocinas, moléculas de adhesión, proteasas, etc. El objetivo primario es asegurar la colonización y restauración del tejido miocárdico infartado o disfuncionante no isquémico, incrementando la viabilidad y mejorando la función sistólica y el remodelado. Hasta ahora, los resultados clínicos muestran una mejora muy limitada de la función ventricular. Las razones de estos pobres resultados son la escasa supervivencia de las células injertadas y su nula participación activa en la contracción cardíaca por la ausencia de uniones gap entre el miocardio nativo y las células injertadas (conexina 43). La mayoría de las células no sobreviven los primeros días por una asociación de isquemia, apoptosis e inflamación. La apoptosis puede ser inducida por una pérdida del anclaje de las células a la matriz extracelular. El desarrollo de estrategias que mejoran la supervivencia y la diferenciación celular debe ser prioritario. Dentro de estas estrategias destacan la prevascularización, la ingeniería tisular y las técnicas de preacondicionamiento como la electroestimulación celular in vitro, el cultivo celular en condiciones de hipoxia y la asociación de células madre angiogénicas-miogénicas3,23.
Desarrollos futurosIngeniería tisularLa ingeniería tisular se desarrolla sobre una estructura natural o sintética capaz de servir de andamio para la formación de tejidos 3D. Estas matrices deben reunir una serie de características: a) mantener la estructura de los tejidos y regular la expresión de las células con las que interaccionan; b) facilitar un intercambio activo entre las células y la matriz, y c) composición que sirva no sólo como apoyo físico a las células, sino también tienen que proveer las sustancias químicas y biológicas necesarias para guiar el crecimiento, la diferenciación, implantación, distribución y organización de las células24.
La ingeniería tisular emerge como un nuevo desafío terapéutico que potencia las posibilidades de la bioasistencia cardíaca con el objetivo de desarrollar un miocardio bioartificial. Los estudios preclínicos y los resultados del ensayo clínico MAGNUM (Myocardial Assistance by Grafting a New Bioartificial Myocardium) demuestran que la asociación de terapia celular con una matriz de colágeno incrementa el grosor del miocardio infartado sin viabilidad, normaliza el estrés de la pared y la viabilidad de las regiones lesionadas, mejora la función sistólica ventricular y limita el remodelado, mejorando la función diastólica24,25.
Los desarrollos futuros incluyen la nanotecnología y las plataformas de bioingeniería, donde las células son preacondicionadas para resistir su trasplante en un huésped hostil. Básicamente, este abordaje consiste en el desarrollo de membranas bioactivas compuestas por dos materiales integrados: una matriz de nanofibrillas con péptidos que tienen la capacidad de liberar, por ejemplo, factor de crecimiento del endotelio vascular (VEGF) y factor de crecimiento de fibroblastos (FGF), y una matriz formada por nanofibrillas que aporta la mecánica al tejido cardíaco. Los dos componentes son necesarios para promover la angiogénesis en un tejido necrótico.
ElectroestimulaciónEl concepto de electroestimulación de las células miogénicas injertadas es transformar las células con un comportamiento pasivo a una participación activa en la contracción cardíaca, es decir, convertir las células estáticas en células dinámicas. La electroestimulación se realiza con un marcapasos biventricular sincronizado a la contracción auricular. Aunque el principio electrofisiológico del acondicionamiento está basado en la cardiomioplastia dinámica con el músculo dorsal ancho, la electroestimulación celular se realiza con impulsos simples en lugar de los trenes de impulsos de la cardiomioplastia, para evitar la posibilidad de producir un daño a las células madre26. El injerto celular es necesario para aumentar la sincronización de la contracción y evitar alteraciones de la contracción eléctrica del corazón. Ha sido sugerido que la electroestimulación dirige la diferenciación celular hacia células miogénicas del tipo cardíaco. Esta diferenciación incluye la formación de uniones gap, una capacidad mayor de integración e injerto celular y una reducción del riesgo de complicaciones arritmogénicas.
Otros desarrollosEn las cardiopatías congénitas, los ventrículos neonatales han mostrado la presencia de numerosas modificaciones patológicas que incluyen una relativa inmadurez de la matriz extracelular, factores de transcripción inapropiadamente lentos y aumento de la apoptosis de los miocitos. Estos resultados ofrecen oportunidades para evaluar la asociación de ingeniería tisular y terapia celular. Parece que esta asociación proporciona un soporte a las células y previene el remodelado del ventrículo izquierdo.
Las células mesenquimales, también conocidas como células del estroma, son una población de células autorrenovables multipotenciales, presentes en la médula ósea y otros tejidos como el estroma de la grasa. Pueden ser aisladas de la médula ósea por adherencia al plástico o pueden diferenciarse a múltiples líneas celulares que generan hueso, cartílago, grasa, músculo, tendones. Pueden ser propuestas como «células donantes universales» para terapia regenerativa cardíaca. El conocimiento de los mecanismos inmunológicos que facilitan el uso clínico de células alogénicas tiene un interés preferente porque abre expectativas terapéuticas con implicaciones fascinantes27.
La reprogramación de células adultas humanas en células iPS tiene sus aplicaciones en biología básica, desarrollo de fármacos y trasplante27,28. Las células humanas iPS requieren previamente vectores que se integren dentro del genoma que pueden desarrollar mutaciones y limitar la utilidad de estas células en las aplicaciones de investigación básica y clínica. La derivación de células humanas iPS con el uso de vectores no integrados ha sido evaluada recientemente. Después de su liberación del episoma, las células iPS libres de vectores y secuencias transgénicas parecen tener la misma capacidad proliferativa y potencialidad que las células madre embrionarias. La reprogramación de células somáticas humanas no requiere la integración en el genoma o la presencia de factores de reprogramación exógena, eliminando un obstáculo importante para la aplicación clínica de las células humanas iPS29.
La cirugía de restauración ventricular asocia la reducción del volumen del ventrículo izquierdo, corrección de la geometría y revascularización coronaria en la miocardiopatía isquémica y/o la actuación sobre la insuficiencia mitral. Las técnicas quirúrgicas de reducción y corrección de la geometría ventricular pueden resumirse en la corrección de la insuficiencia mitral, la ventriculectomía parcial de Batista y la plastia endoventricular de V. Dor, desarrollada con algunas variantes por el grupo RESTORE30. Una de las bases de este tratamiento es que los efectos adversos del remodelado en las áreas remotas del miocardio no infartado son similares en la acinesia y discinesia. Es una propuesta factible, atractiva y lógica la realización de terapia celular durante la cirugía de restauración para inducir la regeneración de las áreas del miocardio no infartado.
ConclusionesLa aplicación clínica de la terapia celular cardíaca prosigue su desarrollo con nuevas indicaciones y criterios de selección de pacientes, desarrollo de nuevas técnicas de administración de las células e investigación sobre los efectos del trasplante celular en la función ventricular. Existen todavía obstáculos para realizar la traslación de los conocimientos básicos a la aplicación clínica, demostrando la necesidad de desarrollar ensayos clínicos muy bien diseñados y con gran rigor en su ejecución31. La terapia celular requiere el esfuerzo multidisciplinario de grupos científicos muy bien coordinados para demostrar los beneficios, conocer mejor los mecanismos de acción y así poder desarrollar guías clínicas aceptadas por la comunidad científica.
La regeneración cardíaca y su implicación terapéutica no es un tema más. Sus posibilidades ofrecen un horizonte nuevo que debe inscribirse en el marco de las palabras vertidas en la década de 1950 por L. Krehl, investigador de la Universidad de Heidelberg: «tardíamente comprendí que la terapéutica no es una consecuencia de las enfermedades, sino su complemento». Este hallazgo nos presenta el valor de la regeneración cardíaca como efecto curativo. Este beneficio está a favor del proceso natural, y si comprendemos su mecanismo y la potencialidad de este efecto, podremos llegar a cambiar bases fundamentales en las enfermedades del hombre a través de la artesanía humana.