El trasplante cardiaco es una terapia establecida para el paciente pediátrico con miocardiopatía o cardiopatía congénita terminales. El perfil de estos receptores ha ido cambiando. Presentamos nuestra experiencia de 24 años y analizamos los resultados.
MétodosAnálisis retrospectivo: 73 trasplantes cardiacos realizados durante el periodo 1994-2018. Estudio estadístico: SPSS-15.0.
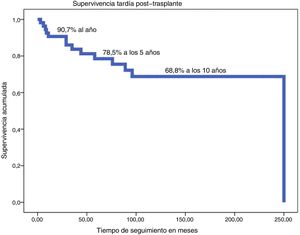
ResultadosEdad mediana 5 años (RIC: 1,1-12,3), 64,4% varones. Diagnóstico más frecuente: miocardiopatía 63% (generalmente dilatada) y cardiopatía congénita 37%. Cirugía previa: 55%. Los pacientes se trasplantan en grado de urgencia electivo 41%, con inotrópicos intravenosos 29%, y con asistencia ventricular 30%. Respecto a la técnica quirúrgica, en el 31,5% fue biatrial y en el 68,5% bicava. La mortalidad hospitalaria fue del 20,5%, y la mortalidad tardía 24%. Mediana de seguimiento 5,5 años (RIC: 2-9,3), con supervivencia según Kaplan-Meyer (excluyendo la mortalidad hospitalaria) del 90,7% al año, 78,5% a los 5 años y 68,8% a los 10 años. Comparamos los primeros 23 pacientes (1994-2007) con los 50 últimos (2008-2018): existen diferencias significativas (p < 0,05) respecto a la técnica quirúrgica empleada (biatrial al inicio, bicava posteriormente), mayor porcentaje de cirugía previa y disminución de la mortalidad hospitalaria: 39% inicial, frente 12% a partir de 2008.
ConclusionesNuestros resultados en trasplante pediátrico y de cardiopatías congénitas han mejorado con el tiempo. Nuestra serie muestra unos resultados excelentes a pesar del cambio en el perfil de los pacientes hacia una mayor complejidad.
Heart transplant is a well-established procedure in paediatric patients with either terminal myocardiopathy or congenital heart disease. The profile of these patients has changed over the years. An analysis and the results of 24 years’ experience are presented.
MethodsA retrospective analysis was carried out on 73 heart transplants performed between 1994 and 2018. The statistical analysis was performed using the SPSS-15.0.
ResultsThe median age of the patients was 5 years (IR: 1.1-12.3), and 64.4% were male. The most frequent diagnoses were: 63% cardiomyopathy (mostly dilated) and 37% congenital heart disease. Previous surgery: 55%. Patients transplanted in the following urgency levels: 41% elective, 29% on intravenous inotropes, and 30% on circulatory assistance. As regards the surgical technique performed: 31.5% were biatrial and 68.5% bicaval. Hospital mortality was 20.5%, and late mortality 24%. Median follow up was 5.5 years (IR: 2-9.3), with a Kaplan-Meier estimated survival (excluding hospital mortality) of 90.7% at 1 year, 78.5% at 5 years, and 68.8% at 10 years. The 23 first patients (1994-2007) were compared with the last 50 (2008-2018), showing significant differences (P<.05) as regards the surgical technique (biatrial in the beginning, bicaval subsequently), a higher percentage of previous surgery and a decrease in hospital mortality: 39% pre-2008 compared to 12% pos-2008.
ConclusionsThe results in paediatric and congenital heart disease transplant have improved over the years. This series shows excellent results despite the profile change of the patients towards a higher complexity.
Desde el primer intento de trasplante cardiaco pediátrico realizado en Nueva York en diciembre de 1967 por el Dr. Kantrowitz1, se ha progresado considerablemente, con mortalidades históricas reportadas de hasta el 40% por grupos reputados como el de Loma Linda en California2 que resulta ser una de las series más extensas publicadas, hasta excelentes resultados en la época actual y en nuestro medio, como los de nuestros colegas del Hospital Gregorio Marañón de un 14,4%3 en su época más reciente.
El trasplante cardiaco es hoy en día la única opción como terapia de destino para el paciente pediátrico con una miocardiopatía terminal, una cardiopatía congénita compleja que no puede ser reparada o cuando han fracasado los procedimientos reconstructivos y paliativos.
En los últimos años el perfil del receptor de trasplante cardiaco pediátrico ha variado, siendo cada vez más frecuente el uso de asistencias circulatorias pretrasplante hasta en un 30%4, tendiendo a la baja las cardiopatías congénitas como indicación primaria y siendo cada vez más frecuente que los pacientes hayan sido previamente intervenidos3. A través de nuestra serie de 73 pacientes, podremos observar esta evolución global traducida a nuestro medio de un centro público español; también estableceremos la comparación con nosotros mismos dividiendo el estudio en dos grupos, una «era temprana» (1994-2007) y otra «era actual» (2008-2018). Analizaremos los diferentes resultados y cómo ha cambiado el perfil del receptor de trasplante cardiaco pediátrico a lo largo de nuestros 24 años de experiencia.
Material y métodosPacientesEntre enero de 1994 y septiembre de 2018, se realizaron un total de 73 trasplantes cardiacos pediátricos y en adultos con cardiopatía congénita, en el Hospital Universitario La Paz. Todos los pacientes firmaron consentimiento para el acceso a su información clínica con fines científicos. Se ha respetado la ley de protección de datos en el manejo de esa información clínica.
Con el fin de analizar las tendencias en la indicación, perfil del receptor y diferencia en técnica quirúrgica hemos dividido nuestra serie en dos periodos: «temprano» de 1994 a 2007 (23 pacientes), y «actual» de 2008 a septiembre de 2018 (50 pacientes).
Técnica quirúrgicaLa extracción de los corazones donantes se realizó con protección miocárdica utilizando una sola dosis de solución Celsior® en el momento del explante, sin añadir dosis de recuerdo ni lavado de reperfusión previo al implante del injerto. Tradicionalmente, la extracción se limitaba a la sección de las venas pulmonares (salvo si había donación pulmonar), venas cavas y grandes troncos arteriales; solo se extendía la extracción más allá de estos límites según la necesidad de reconstrucción de diferentes estructuras. En la actualidad seguimos la máxima de «traernos tanto tejido donante como sea posible», y se emplea en muchos casos un tiempo extra para incluir en el injerto el arco aórtico, las ramas pulmonares hasta su bifurcación lobar, la vena innominada e incluso el pericardio anterior.
El implante se realizó mediante las técnicas biatrial y bicava. La selección de la técnica en nuestro caso ha evolucionado de la biatrial en el periodo «temprano», a la bicava que se ha convertido en nuestra técnica estándar en la actualidad.
Régimen de inmunosupresiónInicialmente se utilizó una inducción con basiliximab seguida con triple terapia de ciclosporina, micofenolato y corticoides, a partir de 2008 se sustituyó la ciclosporina por tacrolimus.
Recolección de datos y seguimiento clínicoSe recogieron las características demográficas, diagnósticos, intervenciones quirúrgicas, indicaciones de trasplante y grado de urgencia, entre otros, de la historia clínica del paciente. El seguimiento se realizó utilizando los informes más recientes de las consultas a las que acudieron los pacientes.
Análisis estadísticoPara el análisis estadístico se ha utilizado el programa SPSS 15.0. Las variables cuantitativas continuas se presentan como media± desviación estándar o mediana y rango intercuartílico. En las variables categóricas se expresa su frecuencia como porcentaje. Las diferencias entre grupos se analizan mediante test t de Student para variables continuas y test de χ2 y test exacto de Fisher para variables categóricas. Se ha considerado diferencia significativa las comparaciones con valor de p <0,05.
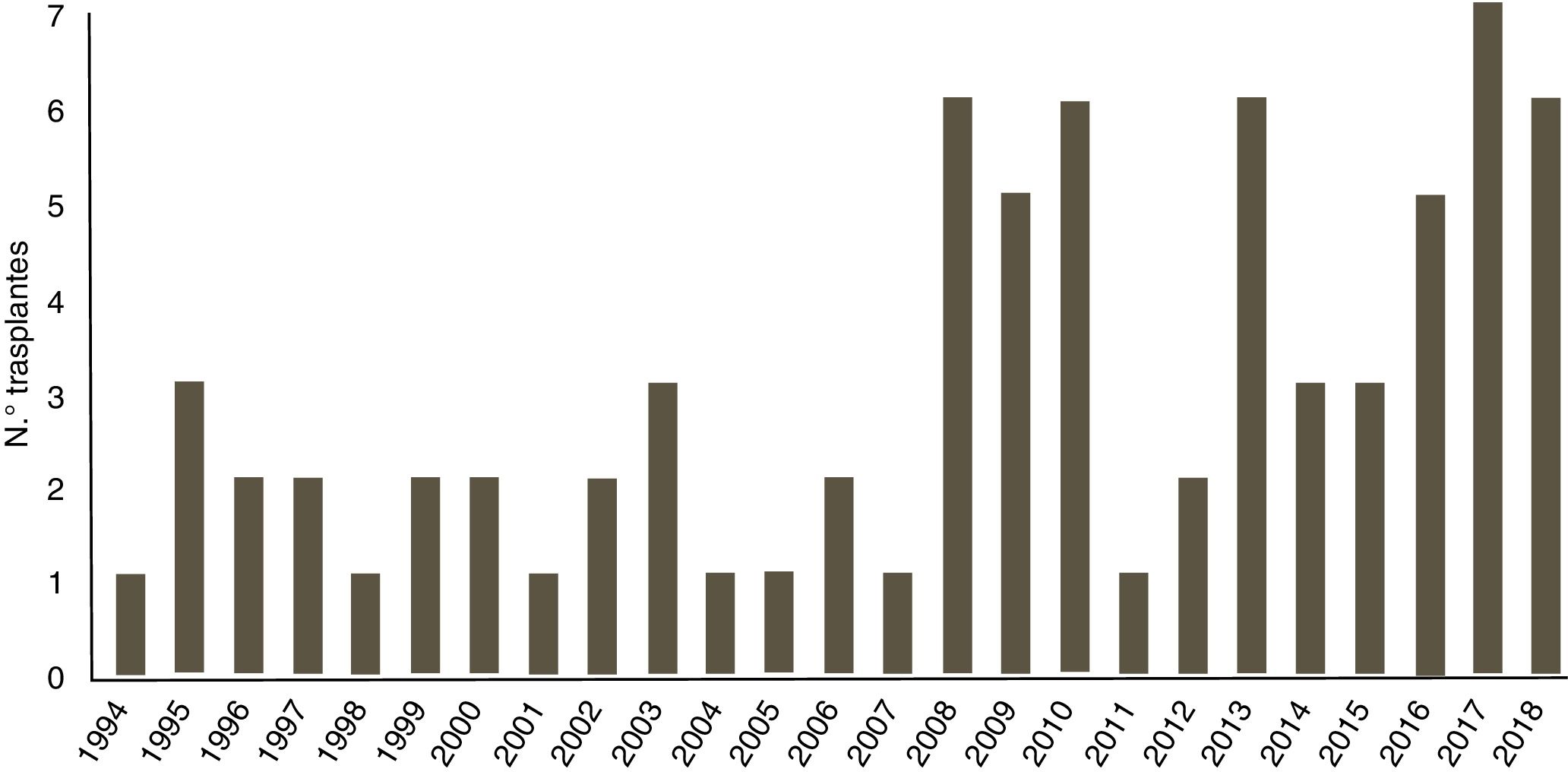
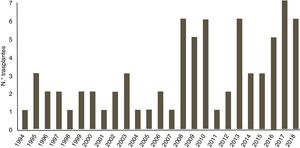
ResultadosEntre enero de 1994 y septiembre de 2018, se han realizado un total de 73 trasplantes cardiacos en el Servicio de Cirugía Cardiaca Infantil del Hospital Universitario La Paz, Madrid. Estos 73 trasplantes se realizaron en 73 pacientes, de los cuales 68 (93,1%) fueron en menores de 18 años y 5 (6,9%) en adultos con cardiopatía congénita. El volumen de trasplantes en nuestro centro ha ido aumentando a lo largo de los años como se puede observar en la figura 1, nótese el incremento en los últimos diez años; se distribuyen siendo 23 (31,5%) en el periodo 1994-2007 y 50 (68,5%) en el periodo más actual de 2008-2018.
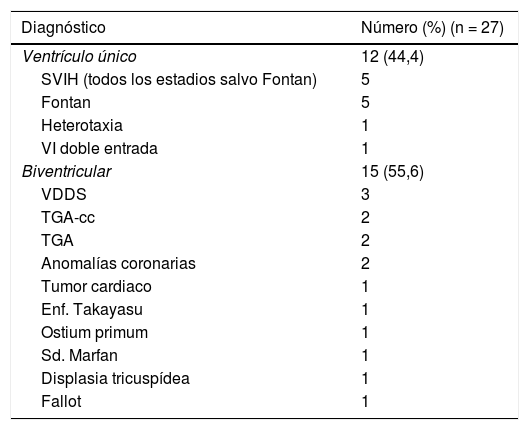
Indicación del trasplanteLa indicación del trasplante, por orden de frecuencia, fue: miocardiopatía dilatada en 32 (44%), cardiopatía congénita en 27 (37%), miocardiopatía restrictiva en 11 (15%) y miocardiopatía hipertrófica en 3 (4%); no hubo ningún retrasplante. La distribución de las diferentes cardiopatías congénitas se puede observar en la tabla 1. El 55% son fisiologías biventriculares, pero si las tomamos patología a patología, las más frecuentes son el síndrome de ventrículo izquierdo hipoplásico (primario, Norwood, Glenn, híbrido estadio 1: 18,5%) y el fallo de la circulación de Fontán (18,5%). Las cardiopatías congénitas (CC) biventriculares más frecuentes fueron el ventrículo derecho de doble salida (11%), la transposición de grandes arterias y transposición congénitamente corregida (7,4% respectivamente), y las anomalías coronarias (7,4%). Llama la atención la ausencia de retrasplantes en nuestra serie, mientras que ronda el 4-5% en otros trabajos3–5, posiblemente sea debido a que a pesar de la duración de 24 años de la misma, casi el 70% de los trasplantes cardiacos (TC) han sido realizados en los últimos 10 años, probablemente siguiendo la tónica de los otros estudios estos retrasplantes estén por llegar.
Desglose de indicacion por cardiopatía congénita
| Diagnóstico | Número (%) (n = 27) |
|---|---|
| Ventrículo único | 12 (44,4) |
| SVIH (todos los estadios salvo Fontan) | 5 |
| Fontan | 5 |
| Heterotaxia | 1 |
| VI doble entrada | 1 |
| Biventricular | 15 (55,6) |
| VDDS | 3 |
| TGA-cc | 2 |
| TGA | 2 |
| Anomalías coronarias | 2 |
| Tumor cardiaco | 1 |
| Enf. Takayasu | 1 |
| Ostium primum | 1 |
| Sd. Marfan | 1 |
| Displasia tricuspídea | 1 |
| Fallot | 1 |
SVIH: síndrome ventrículo izquierdo hipoplásico; TGA: transposición de grandes arterias; TGA-cc: transposición de grandes arterias congénitamente corregidas; VDDS: ventrículo derecho de doble salida; VI: ventrículo izquierdo.
La mediana de edad de los receptores fue 5 (1,1-12,3) años, para un rango de un mes a 41 años, con un 64,4% de varones. El grupo etario más importante fue entre 1-10 años con un 39,7%, mientras que la tendencia mundial según los informes de la International society for heart and lung transplantation4, reporta como grupo más frecuente el de menores de un año, que además está en constante crecimiento desde 2004; en nuestro caso creemos que la dificultad para encontrar donantes para los pacientes menores de un año es lo que mantiene a este grupo en último lugar en frecuencia entre los menores de 18 años, esperamos que con la reciente introducción del trasplante ABO incompatible en nuestro centro (2 TC ABO incompatible realizados en 2018), este segmento de pacientes crezca próximamente.
Un 55% de los pacientes habían sido intervenidos de corazón previamente, con una mediana de una intervención (RIC: 1-3) y hasta 10 en el caso más desfavorable. El grado de urgencia con el que más frecuentemente se trasplantó a los pacientes fue en espera domiciliaria (41%), seguida de asistencia circulatoria (30%) y en tratamiento con inotrópicos intravenosos (29%). El resto de características básicas de los pacientes pueden verse en la tabla 2.
Características preoperatorias receptores
| Características | Mediana (RIC) |
|---|---|
| N.° (%) | |
| (N=73) | |
| Edad (años) | 5 (RIC: 1,1-12,3) |
| < 1 | 19 (26) |
| 1-< 10 | 29 (39,7) |
| 10-< 18 | 20 (27,4) |
| > 18 | 5 (6,9) |
| Peso (kg) | 16 (RIC: 7,8-36) |
| Varones | 47 (64,4) |
| Indicaciones | |
| Miocardiopatía dilatada | 31 (42,5) |
| Cardiopatía congénita | 28 (38,5) |
| Miocardiopatía restrictiva | 11 (15) |
| Miocardiopatía hipertrófica | 3 (4) |
| Cirugia previa | 40 (55) |
| Grado urgencia | |
| En asistencia circulatoria | 22 (30) |
| Código urgente | 21 (29) |
| En domicilio | 30 (41) |
RIC: rango intercuartílico.
En el momento del trasplante 22 de los 73 pacientes (30,1%), se encontraban apoyados con una asistencia circulatoria; de esos 22 pacientes, 5 se encontraban en ECMO y 17 fueron asistidos con una asistencia ventricular tipo Berlin Heart EXCOR. En nuestra serie un paciente de los 5 (20%) en ECMO pretrasplante falleció, frente a uno de 17 (5,9%) apoyados con Berlin Heart, sin llegar a constituir una diferencia estadísticamente significativa (p=0,4). De los apoyados con Berlin-Heart 7 (41,2%) tuvieron previamente un «puente al puente» con ECMO. En nuestra serie el uso de asistencia circulatoria previa al TC no se asoció a una mayor mortalidad.
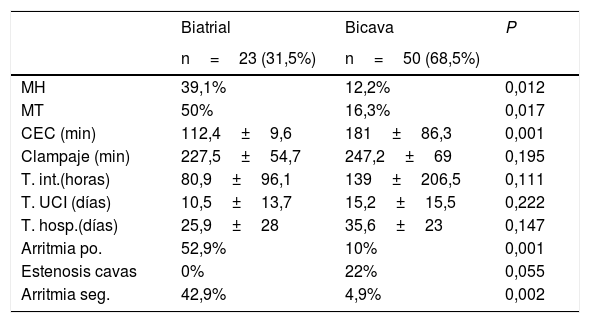
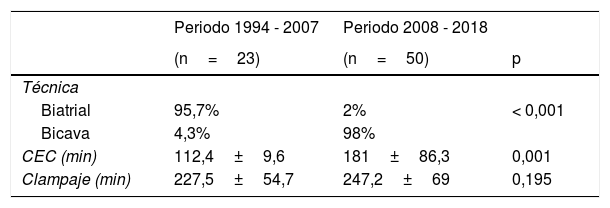
Técnica biatrial frente a técnica bicavaLa técnica quirúrgica empleada varió a lo largo de la serie, pasando de la biatrial (31,5%) a la que es actualmente nuestra técnica de elección, la bicava (68,5%). Si bien la técnica bicava presentó una mortalidad hospitalaria (MH) significativamente menor que la biatrial (12,2% frente a 39,1%. P=0,012). La mortalidad tardía (MT) experimentó el mismo fenómeno: 16,3% bicava frente a 50% biatrial (p=0,017). El tiempo de circulación extracorpórea fue significativamente menor en el grupo biatrial, mientras que la mediana de tiempo de isquemia fue la misma en ambos grupos. A pesar de que el tiempo de intubación, ingreso en Unidad de Cuidados Intensivos y hospitalización fueron mayores en el grupo bicava, en ninguno de estos parámetros se hallaron diferencias estadísticamente significativas como muestra la tabla 3; todo ello parece reflejar una evolución temporal hacia pacientes más complejos, como expondremos más adelante. Durante el postoperatorio inmediato y el seguimiento, los pacientes operados con técnica biatrial presentaron significativamente más arritmias y los pacientes operados con técnica bicava precisaron de un número significativamente mayor de cateterismos intervencionistas por estenosis de venas cavas (tabla 3).
Comparación técnica biatrial–técnica bicava
| Biatrial | Bicava | P | |
|---|---|---|---|
| n=23 (31,5%) | n=50 (68,5%) | ||
| MH | 39,1% | 12,2% | 0,012 |
| MT | 50% | 16,3% | 0,017 |
| CEC (min) | 112,4±9,6 | 181±86,3 | 0,001 |
| Clampaje (min) | 227,5±54,7 | 247,2±69 | 0,195 |
| T. int.(horas) | 80,9±96,1 | 139±206,5 | 0,111 |
| T. UCI (días) | 10,5±13,7 | 15,2±15,5 | 0,222 |
| T. hosp.(días) | 25,9±28 | 35,6±23 | 0,147 |
| Arritmia po. | 52,9% | 10% | 0,001 |
| Estenosis cavas | 0% | 22% | 0,055 |
| Arritmia seg. | 42,9% | 4,9% | 0,002 |
CEC: circulación extracorpórea; MH: mortalidad hospitalaria; MT: mortalidad tardía; T. hosp: tiempo ingreso hospitalario; po: postoperatorio; Seg: seguimiento; T. int.: tiempo de intubación; T. UCI: tiempo ingreso en Cuidados Intensivos.
La MH de nuestra serie es del 20,5%, siendo la causa más frecuente el fallo primario del injerto (33%), seguida de la infección (20%) que se desglosó en una neumonía por parainfluenza y 2 infecciones fúngicas generalizadas, una candidiasis y una aspergilosis. Cuando analizamos la relación de la mortalidad con otros factores, la única relación estadísticamente significativa que hallamos fue con la fecha del trasplante, de este modo la MH del periodo temprano (1994-2007) de nuestra serie fue del 39%, frente a una MH del 12% del periodo actual (2008-2018) (p=0,009). Ni el hecho de haber recibido una asistencia circulatoria pretrasplante, ni el haber sido intervenido previamente, se relacionaron con una mayor mortalidad. Sí se encontró una tendencia aunque no significativa respecto a la indicación del trasplante: un 26,9% de los pacientes indicados por CC fallecieron, frente a un 17,4% de los indicados por una miocardiopatía (p=0,25).
Las complicaciones más frecuentes en el postoperatorio inmediato fueron las infecciones en un 28% de los casos y el fracaso renal agudo con necesidad de terapias renales sustitutivas en un 21% de los pacientes; tras estas les siguieron las arritmias: 20% y el uso de ECMO: 11%.
La MT (excluida la MH) fue del 24% (14 de 58 supervivientes) en 24 años. El seguimiento medio fue de 6,4±5,2 años, con un rango de 3 meses a 21 años. La principal causa de MT fue la enfermedad vascular del injerto en 8 pacientes (57,1%) seguida por los síndromes linfoproliferativos en 3 pacientes (21,4%), el resto de fallecidos fueron una muerte súbita no filiada, un traumatismo y un taponamiento cardiaco tardío. El evento de morbilidad más frecuente en el seguimiento fue la enfermedad vascular del injerto en un 33,3%, con una mortalidad del 44% de los que la han sufrido. En segundo lugar fueron los síndromes linfoproliferativos, que aparecieron en un 17% de los pacientes con una letalidad del 33%. Por detrás de estas y sin mortalidad directamente relacionada aparecieron estenosis en venas cavas que requirieron angioplastia (16,4%) y alteraciones del ritmo (14,5%). El grado funcional de los supervivientes en la actualidad (44 pacientes) es: grado I: 90%, grado II: 2%, grado III: 8%.
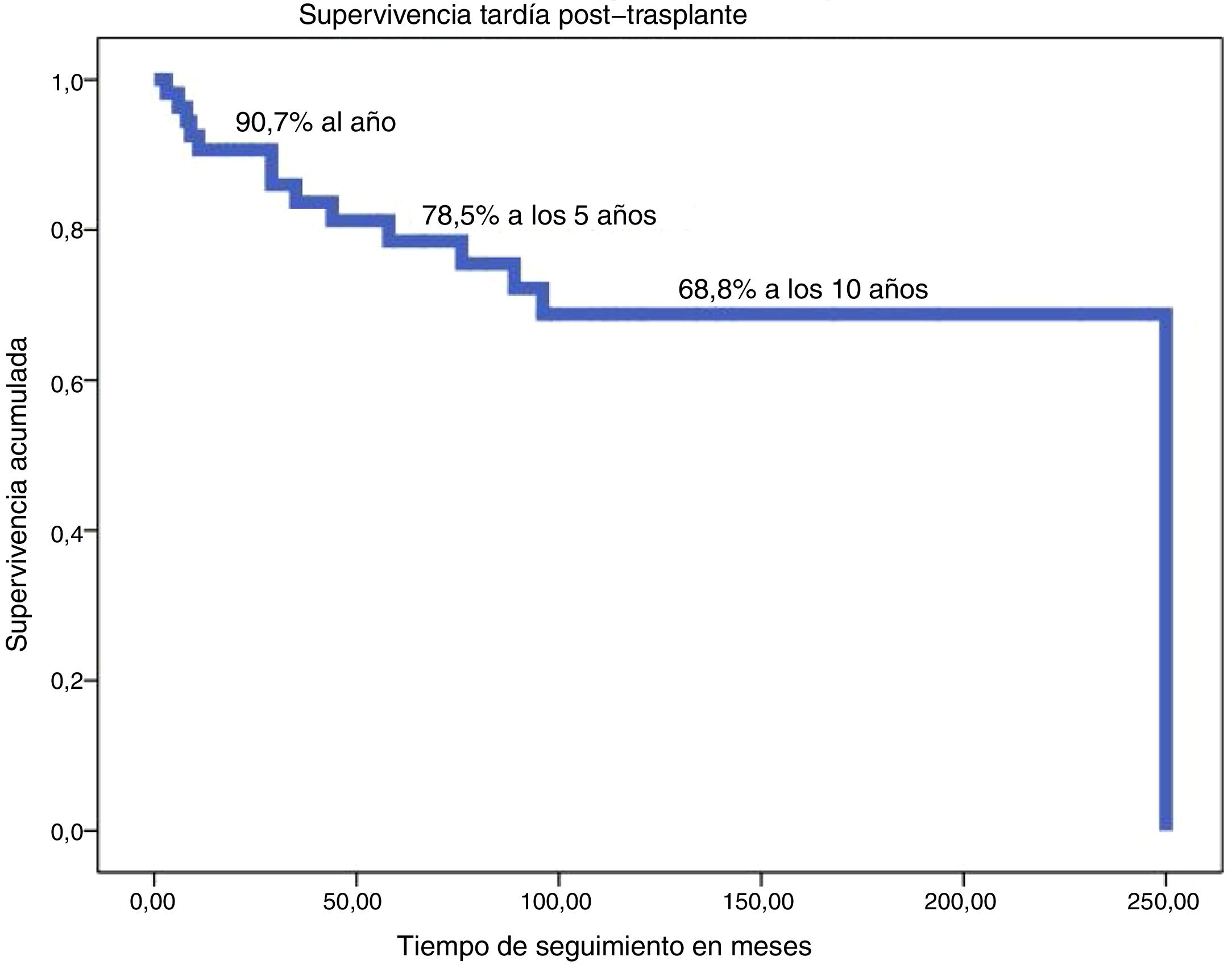
La supervivencia actual (excluida MH) a los 24 años es del 76%, con una supervivencia tardía (excluida MH) estimada según método de Kaplan-Meier de 90,7% a un año, 78,5% a 5 años y del 68,8% a los 10 años (fig. 2).
El grado funcional actual de los supervivientes es: I en el 90%, II en el 2% y III en el 8%.
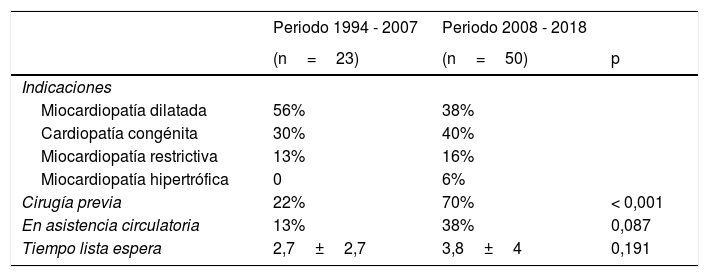
Comparación entre periodos y evolución del perfil del receptorLa división de nuestra serie en dos periodos, uno temprano (1994-2007, n=23) y otro actual (2008-2018, n=50) nos permite ver la evolución de nuestros resultados así como apreciar el cambio en el perfil de nuestros receptores (tablas 4-6).
Comparación por periodos: preoperatorio
| Periodo 1994 - 2007 | Periodo 2008 - 2018 | ||
|---|---|---|---|
| (n=23) | (n=50) | p | |
| Indicaciones | |||
| Miocardiopatía dilatada | 56% | 38% | |
| Cardiopatía congénita | 30% | 40% | |
| Miocardiopatía restrictiva | 13% | 16% | |
| Miocardiopatía hipertrófica | 0 | 6% | |
| Cirugía previa | 22% | 70% | < 0,001 |
| En asistencia circulatoria | 13% | 38% | 0,087 |
| Tiempo lista espera | 2,7±2,7 | 3,8±4 | 0,191 |
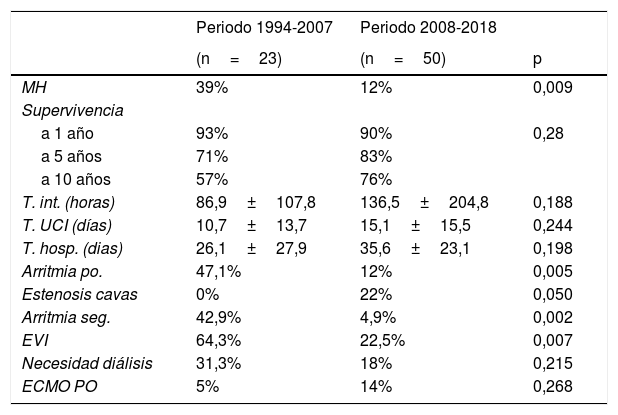
Comparación por periodos: postoperatorio y seguimiento
| Periodo 1994-2007 | Periodo 2008-2018 | ||
|---|---|---|---|
| (n=23) | (n=50) | p | |
| MH | 39% | 12% | 0,009 |
| Supervivencia | |||
| a 1 año | 93% | 90% | 0,28 |
| a 5 años | 71% | 83% | |
| a 10 años | 57% | 76% | |
| T. int. (horas) | 86,9±107,8 | 136,5±204,8 | 0,188 |
| T. UCI (días) | 10,7±13,7 | 15,1±15,5 | 0,244 |
| T. hosp. (dias) | 26,1±27,9 | 35,6±23,1 | 0,198 |
| Arritmia po. | 47,1% | 12% | 0,005 |
| Estenosis cavas | 0% | 22% | 0,050 |
| Arritmia seg. | 42,9% | 4,9% | 0,002 |
| EVI | 64,3% | 22,5% | 0,007 |
| Necesidad diálisis | 31,3% | 18% | 0,215 |
| ECMO PO | 5% | 14% | 0,268 |
ECMO PO: ECMO postoperatorio; EVI: enfermedad vascular del injerto; MH: mortalidad hospitalaria; po: postoperatorio; Seg: seguimiento; T. hosp: tiempo ingreso hospitalario; T. int.: tiempo de intubación; T. UCI: tiempo ingreso en Cuidados Intensivos.
Nuestros receptores han evolucionado como se aprecia en la tabla 4, con un aumento de la indicación por cardiopatía congénita de un 30% a un 40%, con la consiguiente disminución de las miocardiopatías, aunque la diferencia no llega a ser significativa (p=0,3). Sí es significativo, en cambio, el aumento de pacientes con cirugía cardiaca previa que pasa de un 22% a un 70% (p <0,001). También hemos detectado diferencias importantes en el grado de urgencia, con un empeoramiento del mismo pasando por ejemplo de un 13% de pacientes en asistencia circulatoria a un 38% (p=0,087), probablemente en relación con un aumento en el tiempo de espera por un órgano (2,7 a 3,8 meses en nuestra serie).
Un cambio notable es la técnica quirúrgica, inicialmente la mayor parte de los TC de nuestra serie se realizaron con técnica biatrial (22 de 23), pero a partir de 2008 la preferencia de nuestro servicio cambió pasando a la bicava (49 de 50), esto trajo apareado una clara disminución de las arritmias y por otro lado la aparición de la estenosis de venas cavas que requirió de angioplastia como ya hemos comentado previamente. Sí fue significativo (p <0,001) el aumento del tiempo de circulación extracorpórea, no así el del tiempo de clampaje cuyo aumento en media no fue significativo (p=0,636) y además mantuvo la misma mediana (240min) (tabla 5).
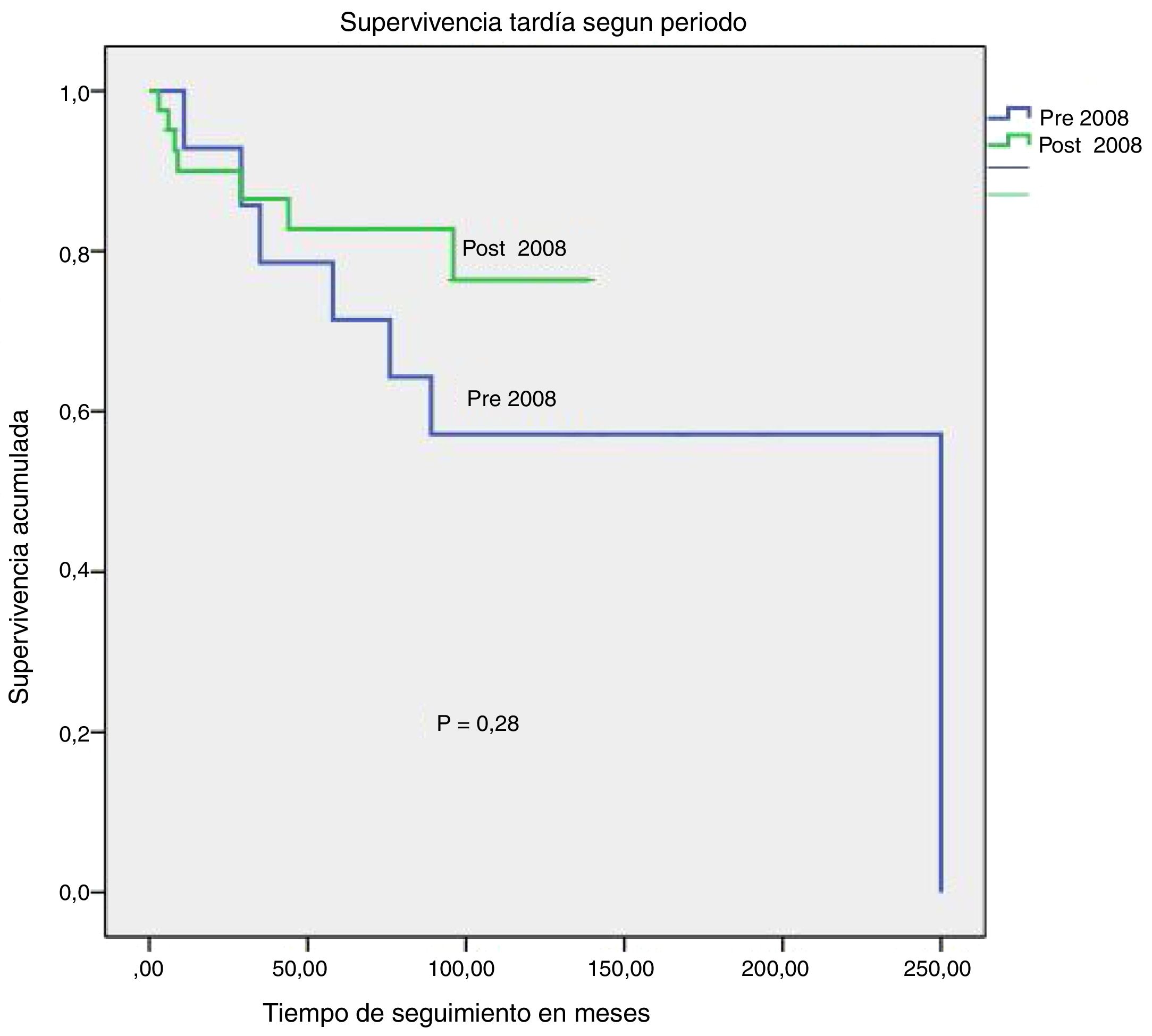
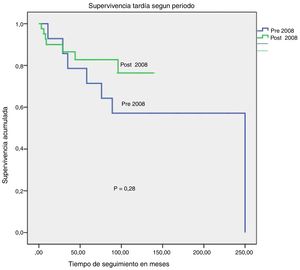
La MH experimenta una drástica caída de un 39% a un 12% (p=0,009). Igualmente, aunque no de forma estadísticamente significativa, aumentó la supervivencia tardía (excluyendo MH), como se puede apreciar en la figura 3. Las supervivencias tardías estimadas para el periodo 1994-2007 fueron: 93% a un año, 71% a 5 años y 57% a 10 años. Las supervivencias tardías estimadas para el periodo 2008-2018 fueron: 90% a un año, 83% a 5 años y 76% a 10 años (p=0,28).
En lo referente a morbilidad mejoraron a lo largo del tiempo: la enfermedad vascular del injerto y las arritmias en el postoperatorio inmediato y en el seguimiento que fueron claramente mayores en la época más temprana (1994-2018). Sin llegar a valores estadísticamente significativos también mejoraron a lo largo del tiempo la necesidad de terapias renales sustitutivas en el postoperatorio y la incidencia de los síndromes linfoproliferativos en el seguimiento. Por otro lado se observó un aumento rozando la significación estadística de la necesidad de angioplastia de cavas, y un aumento no significativo en el uso del ECMO y la tasa de infección en el postoperatorio (tabla 6).
El tiempo de espera medio en lista de trasplante fue de 3,4±3,7 meses. Cuando se separa por periodos se observa un aumento de la espera de más de un mes: pre-2008: 2,7 meses, frente a pos-2008: 3,8 meses. (p=0,191).
DiscusiónA pesar de que en los últimos años, con la mejoría en los resultados de los procedimientos paliativos y correctivos para las cardiopatías congénitas, el trasplante cardiaco ha disminuido como terapia primaria en estos casos, estas todavía suponen aproximadamente un 53% de los trasplantes cardiacos pediátricos en el mundo (algo menos en Europa) y siguen siendo un importante factor de riesgo de MH y en los primeros años postrasplante6,7. Esto es debido, entre otros, al elevado número de reintervenciones que presentan estos pacientes y a las complejas reparaciones y reconstrucciones anatómicas que algunas cardiopatías congénitas precisan para el implante del nuevo corazón. Es común la necesidad de reconstrucción de las arterias pulmonares en los pacientes que vienen de una paliación univentricular que además puede requerir la extracción de stents previamente implantados; en estos casos suele ser preferible la disponibilidad de ambas ramas pulmonares provenientes de un donante sin extracción pulmonar, no obstante cada vez más se evita limitar el perfil del donante y se opta por realizar dichas reconstrucciones con pericardio del donante, que será recogido en la extracción. En otras ocasiones se requerirá de la creación de canales venosos para poder casar el eje de cavas derecho del corazón donante con las alteraciones venosas del receptor con situs inversus o ambiguo, como ocurre en las heterotaxias. Podremos crear estos canales con el propio tejido de la aurícula derecha del receptor para la cava inferior, y utilizaremos la vena innominada del donante para la reconstrucción en casos de doble cava superior o vena cava superior izquierda única. En algunos casos se requerirá también de una reconstrucción de todo el arco aórtico, para lo que será útil la extracción extensa del mismo en el donante, y no solo en estos casos, sino también para utilizar dicho tejido como parche para acomodar los diferentes calibres vasculares de la aorta del donante y receptor8,9.
Nuestra serie muestra una frecuencia menor en la cardiopatía congénita como indicación de TC (40%) frente al 53% mundial, y esta en línea con los datos europeos en los que es menor que en América, aunque difiere en su evolución, que en nuestro caso es al alza frente a la reducción generalizada de esta indicación en favor de las miocardiopatías.
El uso de las asistencias ventriculares como puente al trasplante ha crecido mundialmente hasta un 30% del total de TC pediátrico, cifra que se dispara hasta un 50% por encima del año de edad4,6. El uso del ECMO como puente al trasplante es cada vez más limitado a favor de las asistencias de larga duración tipo Berlin Heart EXCOR4,5, dado el aumento en la mortalidad que supone; utilizaremos el ECMO para solucionar una situación de urgencia vital planteando un «puente a la recuperación» o un «puente al puente». Una vez descartada la posibilidad de recuperación del corazón, el ECMO sería sustituido por una asistencia de larga duración hasta la llegada de un órgano válido.
Muchos de nuestros pacientes, que son listados para trasplante electivo en un inicio, sufren un empeoramiento clínico progresivo, con una disfunción cardiaca cada vez mayor pero sin llegar a sufrir un deterioro agudo que dispare su grado de urgencia, hasta que finalmente reciben una asistencia ventricular. La presencia de anticuerpos anti-HLA secundarios a transfusiones múltiples o al uso de homoinjertos en reconstrucciones previas también prolonga el tiempo de espera llevando finalmente al uso de una asistencia10. En nuestra serie el aumento importantísimo de receptores en asistencia circulatoria (del 13% en la época temprana al 38% más actual) coincide tanto en la evolución como en las cifras de otros trabajos internacionales4–6. Al contrario que lo referenciado en otra serie de nuestro medio3, en nuestra opinión, la relativa escasez de los donantes pediátricos y el aumento del tiempo en lista de espera, nos ha llevado a ese aumento en la utilización de la asistencia ventricular.
La técnica quirúrgica empleada varió a lo largo de la serie, pasando de la biatrial (31,5%) a la bicava (68,5%). La técnica bicava presentó una MH significativamente menor que la biatrial (12,2% frente a 39,1%. P=0,012), este resultado debe ser tomado con prudencia, pues la mayor parte de los trasplantes biatriales pertenecen a la «era temprana» de nuestra serie, mientras que los trasplantes bicavos pertenecen a la época actual, beneficiándose de la experiencia ganada y los avances experimentados en este campo a lo largo de los años. El aumento del tiempo de CEC en nuestra serie, se relaciona en general con la técnica bicava, aunque en este caso la mediana del clampaje no varía, ese exceso de CEC, probablemente responde a una necesidad mayor de disección en bomba de determinadas estructuras o de procedimientos reconstructivos complejos, en línea con el aumento de la CC como indicación y del número de cirugías previas, en la era más actual. Estudios previos también describen una menor mortalidad relacionada con el uso de la técnica bicava, así como una menor presión en la aurícula derecha, un menor grado de insuficiencia tricuspídea en la evolución y un mejor mantenimiento del ritmo sinusal11,12.
El perfil del paciente pediátrico receptor de TC evoluciona hacia una mayor complejidad: aumentan el número de pacientes con cirugías previas y que requieren algún tipo de reconstrucción anatómica compleja para poder llevar a cabo el trasplante; también aumentan los tiempos en lista de espera, lo que conlleva un uso cada vez mayor de asistencias ventriculares como puente al trasplante. En nuestra experiencia, se ha incrementado también la indicación de TC en CC, que supone un factor de riesgo.
Nuestros resultados son comparables con los de otros grupos nacionales3 e internacionales2,5 y al igual que en trabajos precedentes vemos que son «tiempo dependientes», se observa una clara disminución de la MH, así como en el seguimiento, al analizar la época más actual, todo ello refleja no solo el avance en técnica quirúrgica, manejo perioperatorio, terapias inmunosupresoras y protocolos de seguimiento, sino también el aprendizaje de cada grupo con la adquisición de experiencia y la creación de una «memoria colectiva» en cada centro.
En la actualidad nos encontramos ante una nueva oportunidad con la incorporación a nuestro programa del trasplante ABO incompatible, del que en este 2018 hemos realizado 2 casos hasta septiembre. Esperamos que este nuevo tipo de trasplante nos permita acortar el tiempo de espera y disminuir la mortalidad en este periodo de los pacientes menores de 14 meses, así como conseguir un mejor aprovechamiento de los escasos donantes de los que se dispone en este rango de edad13.
ConclusionesNuestros resultados en trasplante pediátrico y de cardiopatías congénitas han mejorado con el tiempo y son reflejo de las mejoras en el manejo quirúrgico, perioperatorio y en las terapias inmunosupresoras. Nuestra serie muestra unos resultados excelentes a pesar del cambio en el perfil de los pacientes hacia una mayor complejidad, comparables a otras series internacionales. El uso de asistencias circulatorias es cada vez más frecuente en el mundo pediátrico, disminuyendo la mortalidad en lista de espera y aumentando los tiempos de espera. El trasplante ABO incompatible es ya una realidad en nuestro medio, del que esperamos poder comprobar su promesa de mejorar las posibilidades de supervivencia de nuestros pacientes más pequeños.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.