La insuficiencia mitral (IM) es muy prevalente en Europa a pesar de la reducción de la fiebre reumática. El desarrollo de las técnicas de reparación mitral introducido por Alain Carpentier ha cambiado el pronóstico y el manejo de los pacientes con IM. Las técnicas de imagen son fundamentales para la evaluación del tipo de lesión anatómica, etiología, mecanismo, cuantificación, así como para valorar la posibilidad de éxito de la reparación. La ecocardiografía transesófagica (ETE) bidimensional se emplea de forma rutinaria para planear la reparación mitral. Sin embargo, la ETE tiene una serie de dificultades en relación a las relaciones anatómicas y las anomalías morfológicas de la válvula mitral (VM). La recientemente introducida ecocardiografía tridimensional (3D) nos ha permitido entender la anatomía funcional de la VM, la fisiopatología de las lesiones mitrales y, en especial, de la insuficiencia mitral funcional (IMF). En la actualidad, la ecotransesofágico 3D (ETE-3D) supone una herramienta imprescindible, tanto para el diagnóstico de lesiones mitrales como para la monitorización en el quirófano de cirugía cardíaca y de los procedimientos percutáneos en hemodinámica. Permite evaluar online todas las estructuras cardíacas y ofrece nuevos planos como la «vista de cirujano» para valorar la morfología de la VM en una sola adquisición. El objetivo de este artículo es revisar la aportación de la ETE, así como la ETE-3D en el conocimiento de la anatomía funcional de la VM, sus aplicaciones clínicas y sus implicaciones terapéuticas.
Mitral regurgitation is increasing in Europe despite the reduction in the incidence of rheumatic disease. The development of surgical mitral valve repair by Alain Carpentier has changed the management and prognosis of patients with severe mitral regurgitation. Imaging techniques provide precise information on the type and extent of anatomic lesions, mechanisms of regurgitation, etiology, amount of regurgitation, and reparability of the valve. Two-dimensional transesophageal echocardiography is routinely used for planning mitral valve surgery. However, this technique has several potential pitfalls with regards to spatial relationships and valvular morphological abnormalities. Recently introduced, live, real-time three-dimensional transesophageal echocardiography has improved our understanding of the functional anatomy and pathophysiology of mitral valve disease, especially in functional mitral regurgitation. Nowadays, three-dimensional transesophageal echocardiography is a powerful tool, not only for the accurate diagnosis of mitral lesions, but also for the intraoperative monitoring and the guidance of invasive procedures in the catheterization laboratory. It allows evaluating online all cardiac structures and offers new views like the “surgeon view” of the mitral valve morphology with only one acquisition. The aims of this article are to review the contribution of two-dimensional and three-dimensional transesophageal echocardiography to the evaluation of the mitral valve functional anatomy and to summarize their clinical applications and therapeutic implications.
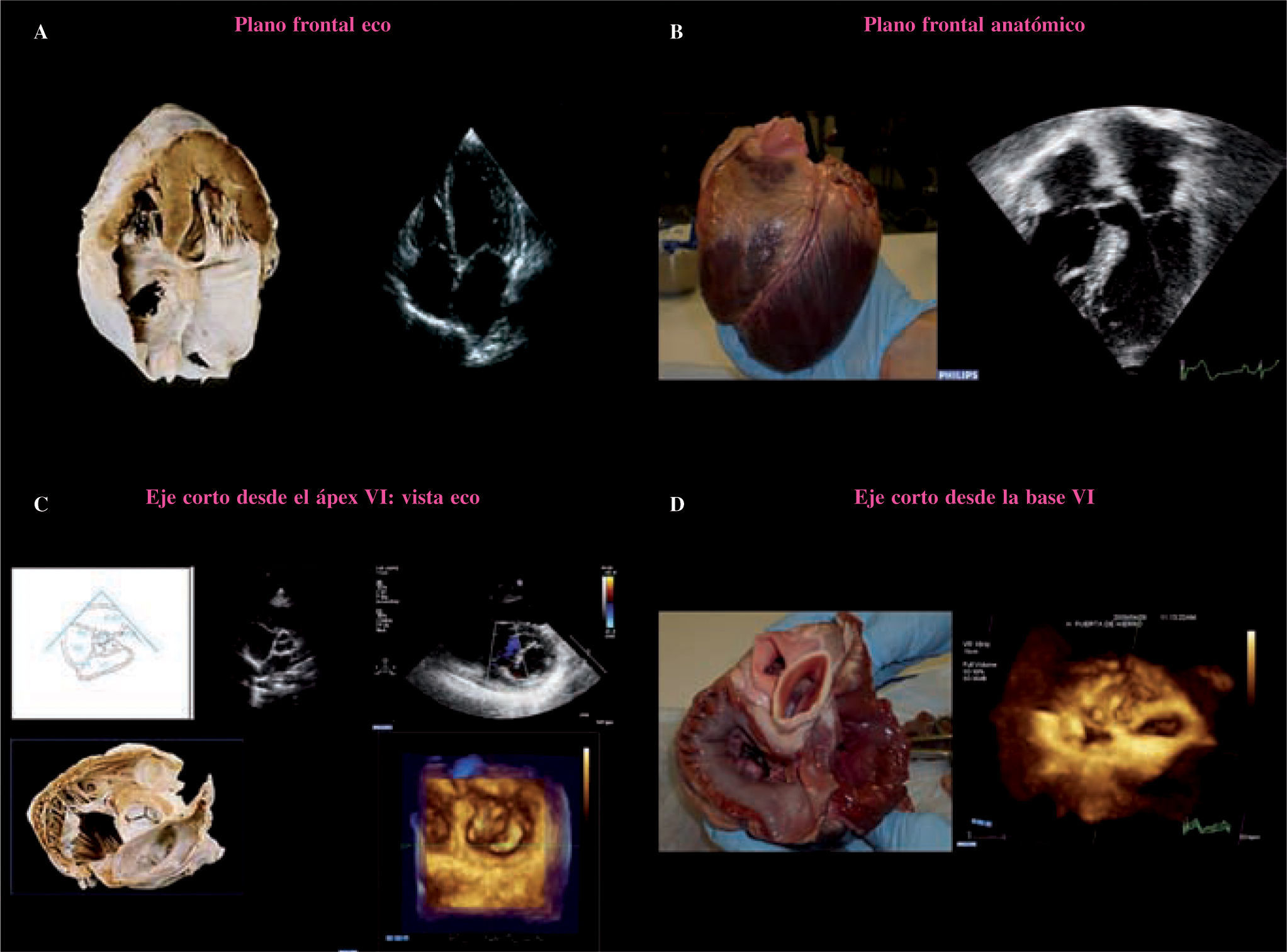
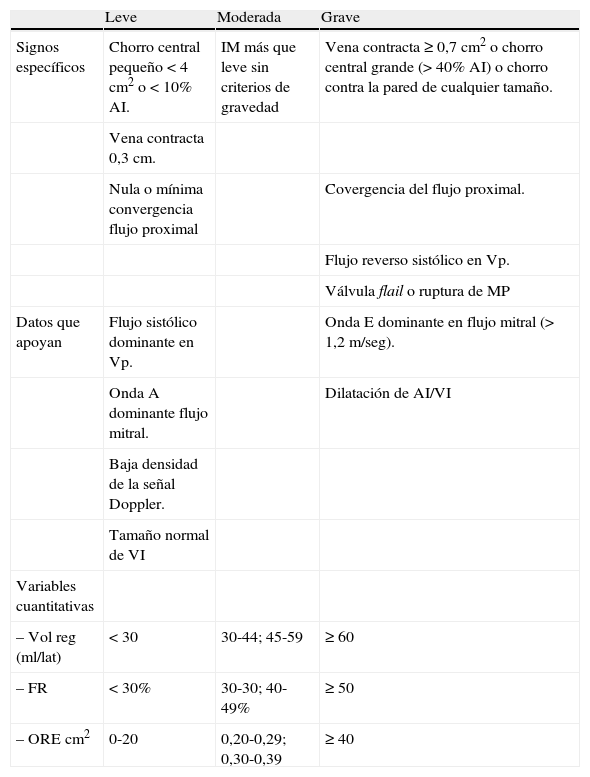
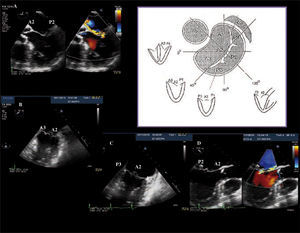
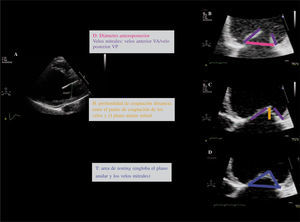
La ecocardiografía transtorácica (ETT) proporciona imágenes de gran resolución en tiempo real de las estructuras cardíacas y de su función, y constituye la base para el estudio con análisis Doppler y Doppler color de los flujos intracardíacos. Existen tres planos básicos de corte utilizados habitualmente para obtener las imágenes: paraesternal, eje corto y apicales. Para evitar confusión y que exista acuerdo entre ecocardiografistas, la Sociedad Americana de Ecocardiografía ha establecido unas recomendaciones sobre la orientación de las imágenes ecocardiográficas; es fundamental establecer referencias anatómicas básicas para facilitar el entendimiento entre ecocardiografistas y cirujanos (Fig. 1).
Planos anatómicos y su correlación con el ecocardiograma. A: plano frontal, vista anatómica y en eco plano apical cuatro cámaras visto desde el ápex del VI. B: plano frontal anatómico y vista frontal de un corazón, imagen anatómica de cuatro cámaras invertida. C: eje corto anatómico visto desde el ápex recortando el VI, en ETT vista de la VM eje corto desde el ápex de VI, vista 3D en una sola imagen desde el ápex visualizamos VM «vista cirujano» con aorta (AO) situada a las 12horas. D: eje corto anatómico de la VM, vista quirúrgica con AO situada a las 12horas, en imagen 3D vista similar velos mitrales y AO a las 12horas, se obtiene recortando ambas aurículas.
La prevalencia de la IM en Europa está aumentando a pesar de la reducción de la fiebre reumática. El desarrollo de técnicas novedosas de reparación mitral introducidas en la década de 1970 por Alain Carpentier ofrece un amplio abanico de posibilidades que han cambiado el manejo y el pronóstico de los pacientes con IM. El ecocardiograma juega un papel fundamental en la evaluación de la anatomía, etiología, mecanismo y cuantificación de la IM, y permite valorar de modo exacto la reparabilidad de la VM.
Anatomía y función de la válvula mitralLa función valvular mitral depende de la interacción perfecta de todos sus componentes: los velos, el aparato subvalvular (cuerdas y músculos papilares), el anillo y el ventrículo izquierdo (VI). La afectación de cualquiera de sus componentes puede producir IM en mayor o menor grado1.
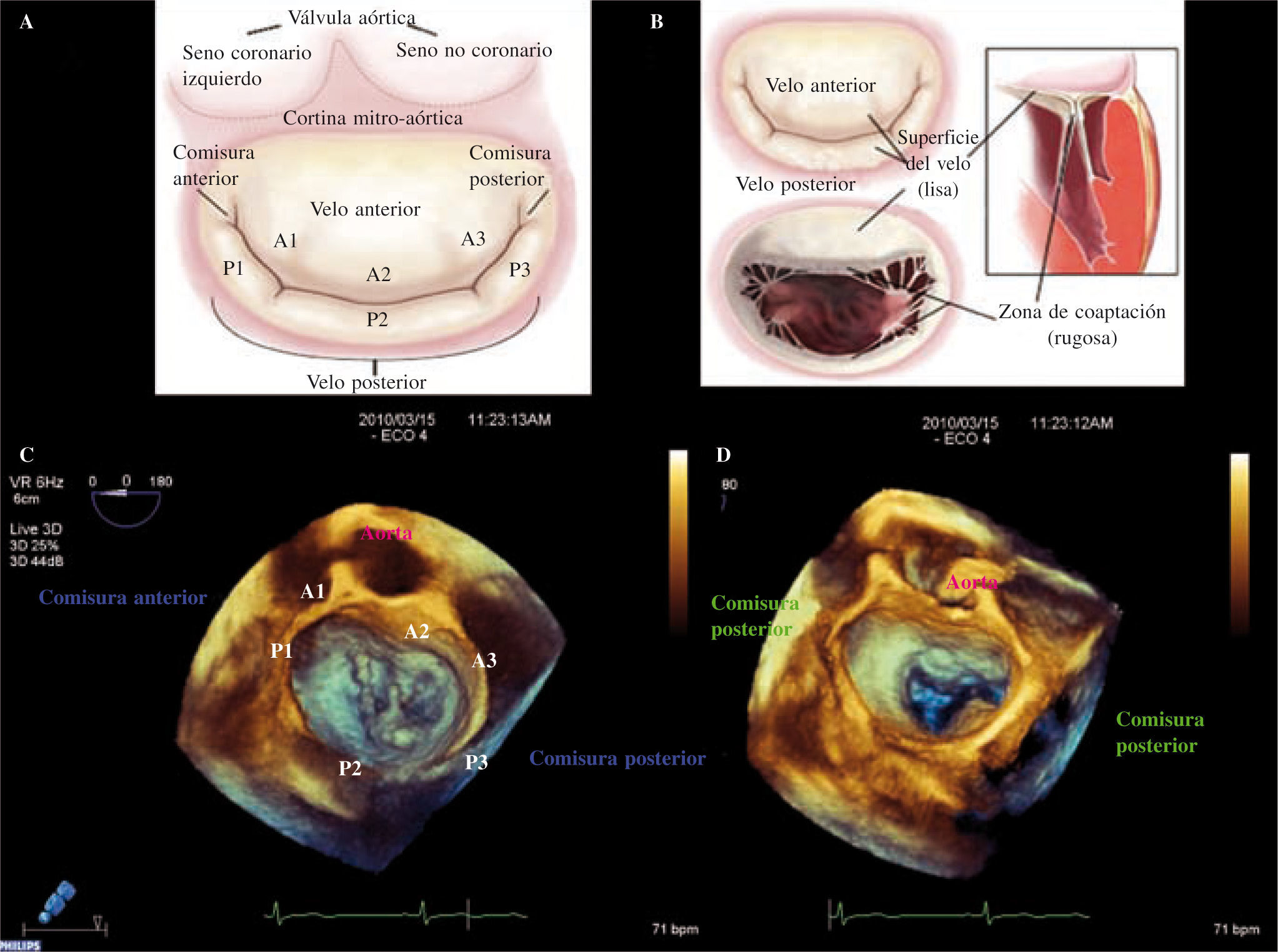
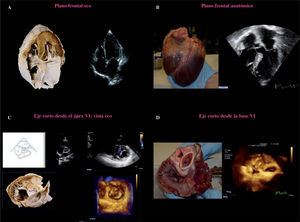
Velos mitralesEl velo anterior posee una forma semicircular y se encuentra anclado a 2/5partes de la circunferencia anular. Existe continuidad entre el velo anterior de la VM y el velo izquierdo no coronario de la válvula aórtica (continuidad mitroaórtica). El velo posterior de la VM tiene forma cuadrangular y se encuentra anclado a 3/5partes de la circunferencia del anillo mitral. Posee dos indentaciones bien definidas, las cuales dividen el velo en tres segmentos: P1 (segmento anterolateral, cerca de la comisura anterior y la orejuela izquierda), P2 (segmento medio) y P3 (segmento posteromedial, cerca de la comisura posterior y el anillo tricúspide) (Fig. 2). El borde libre del velo anterior es normalmente continuo, sin indentaciones. La falta de redundancia a lo largo del velo debe tenerse en cuenta en el caso de prolapso, ya que solamente pequeñas áreas del velo pueden ser resercionadas de forma segura.
A: segmentación anatómica de los velos mitrales. B: comisuras y zona de coaptación. C:imagen tridimensional obtenida mediante ETE-3D. Se visualiza la VM desde la aurícula con la AO a las 12 (visión del cirujano). La valva mitral posterior (VMP) presenta un prolapso a nivel de su festón medio P2 y posterior P3 con cuerda rota de primer orden válvula flail.D: misma imagen con VM abierta vista desde AI.
Esta nomenclatura es de vital importancia para describir detalles anatómicos específicos entre ecocardiografistas y cirujanos. Las indentaciones del velo posterior permiten su apertura en diástole. Además, conllevan la redundancia en el margen del velo posterior, lo cual puede conducir a la presencia de exceso de tejido en el segmento que prolapsa. Esta circunstancia permite una resección mucho más agresiva en comparación con el velo anterior. La altura del velo posterior es mucho menor que la del velo anterior, sin embargo, ambos velos tienen una superficie similar.
Las comisuras definen el área donde el velo posterior y el velo anterior se unen a nivel de su inserción en el anillo. Las comisuras pueden ser consideradas como segmentos velares bien definidos, identificadas gracias a dos puntos de referencia: el eje del músculo papilar (MP) correspondiente y las cuerdas comisurales, las cuales tienen una configuración específica. El borde libre de las comisuras se encuentra separado del anillo por un segmento milimétrico de tejido. Esta área debe ser abordada cuando tratamos de corregir un prolapso comisural, así como los segmentos contiguos del velo anterior y posterior (A3 y P3), evitando así una posible regurgitación en esta región.
En la superficie auricular de los velos podemos distinguir dos zonas principales: una zona periférica suave (cuerpo) y una zona rugosa (zona de coaptación). La línea curvada de coaptación entre ambos velos, evidenciada en una vista auricular (Fig. 2), separa ambas zonas. La zona rugosa representa la superficie de coaptación valvular. La zona de coaptación valvular es crítica para la competencia de ésta, y su profundidad y longitud está considerada actualmente como una medida importante de la función valvular.
La descripción de la segmentación de los velos es vital para que exista entendimiento entre ecocardiografistas y cirujanos, siendo fundamental en la descripción anatómica en casos de prolapso valvular en los pacientes con IM degenerativa. El ETE es recomendado en la mayoría de los laboratorios, aunque en manos expertas el ETT puede predecir adecuadamente si la válvula es reparable o no2.
Los planos que utilizamos habitualmente en la valoración de la VM son:
- –
Eje corto por ETT o ETE (transgástrico): permite visualizar los seis festones y las dos comisuras. En sístole la localización del prolapso permite visualizar el origen del chorro de IM.
- –
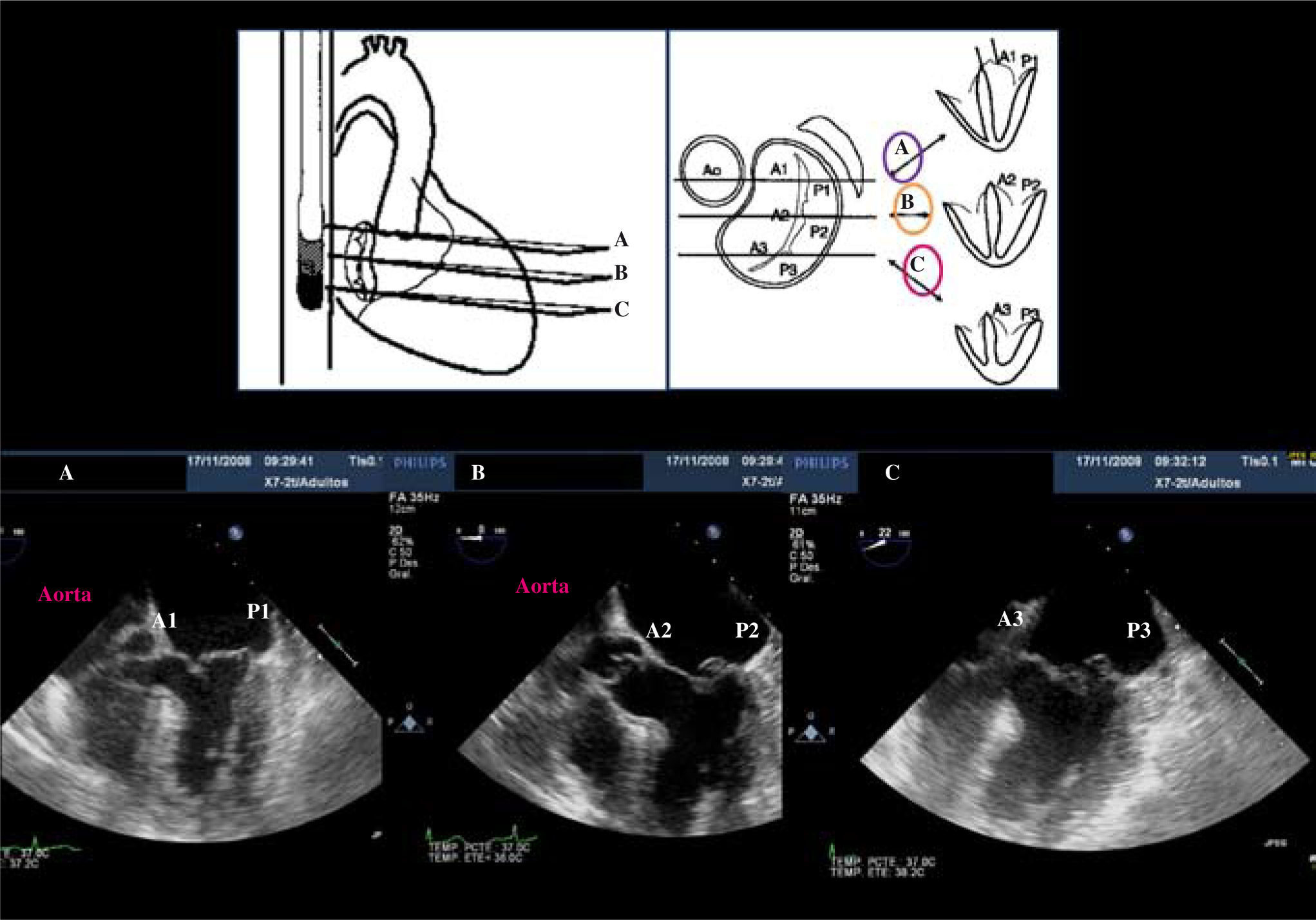
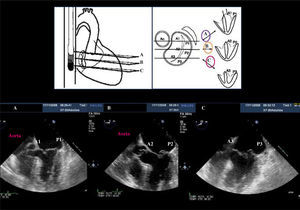
Ecocardiograma transesofágico (0grados): progresando la sonda a través del esófago tenemos distintas vistas de los segmentos, de arriba abajo visualizamos A1-P1 y comisura anterolateral, posteriormente A2-P2 y, para finalizar, A3-P3 y la comisura posteromedial (Fig. 3).
Figura 3.Prolapso de P2 con cuerda rota y P3 con chorro septal, velo anterior muy redundante IM grave. ETE plano medio. A: segmentos anterolaterales A1-P1, retirando la sonda hacia el esófago. B: segmentos medios A2-P2, en el plano medio.C: segmentos posteromediales A3-P3, introduciendo la sonda hacia el estómago.
(0.27MB). - –
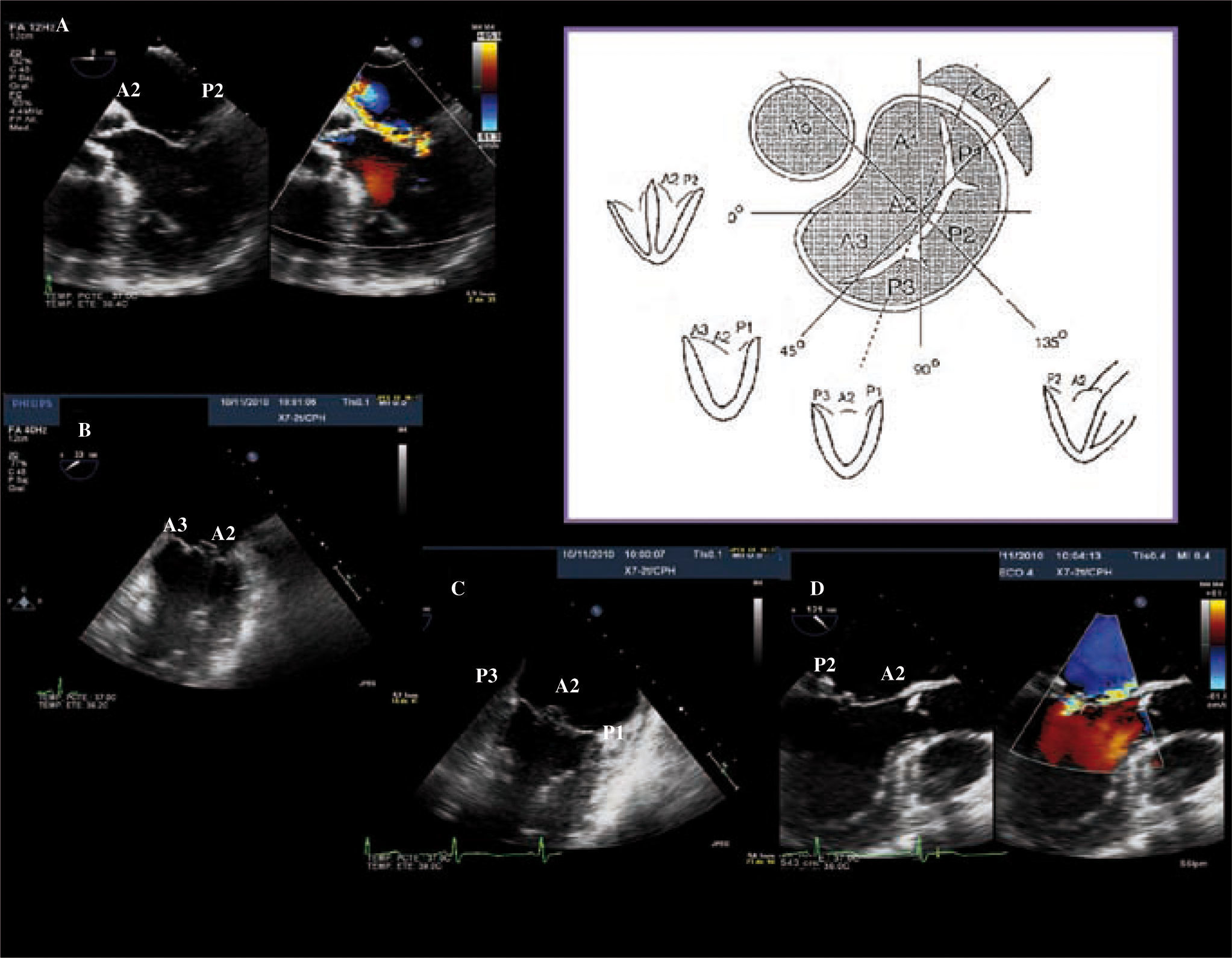
Ecocardiograma transesofágico (40-60grados): va a mostrar las dos comisuras y de izquierda a derecha P3, A2 y P1 (Fig. 4 y tabla I).
Figura 4.Ecotransesofágico que muestra la segmentación de los velos mitrales en un paciente con prolapso de P2 y leve de A2. A: a 0grados. B: rotando a 45grados de izquierda a derecha A3, A2 y P1. C: a 60grados visualizamos ambas comisuras de izquierda a derecha P3, A2, P1. D: plano sagital a 120grados permite visualizar A2-P2.
(0.3MB).Tabla I.Velos mitrales
Utilidad del ETE: – La insuficiencia mitral es la valvulopatía que más frecuentemente precisa valoración por ETE. – El ecocardiograma transesofágico es útil para decidir si la VM es reparable o no. – El ecocardiograma transesofágico intraoperatorio debe ser realizado para valorar detalles anatómicos y funcionales que permitan una decisión final. – El método de PISA es fundamental para valorar la severidad. – ETE intraoperatorio es de gran ayuda para valorar los resultados de la cirugía.
Mediante ecocardiograma tridimensional (Eco-3D), el segmento que prolapsa adquiere una forma convexa visto desde la aurícula izquierda (AI) y cóncavo desde el VI. En un estudio reciente3, se comparó la eficacia diagnóstica de la Eco-3D transtorácica para el prolapso mitral con la de la ETE-2D, existiendo buena correlación, siempre y cuando la calidad de imagen fuera adecuada (el 89% de los casos). Comparadas todas las modalidades ecocardiográficas (Eco-2D transtorácica y transesofágica, Eco-3D transtorácica o transesofágica), la Eco-3D tiene la mejor correlación con el examen anatómico que realiza el cirujano en el campo quirúrgico, con una correcta localización del prolapso en el 96% de los casos4–6.
El uso rutinario del ETE-3D se permite una excelente visualización de todos los segmentos/festones mitrales de ambos velos. Debido a que el anillo mitral no es plano durante la sístole, en el prolapso los velos protruyen hacia la aurícula. En los pacientes con ruptura de cuerdas, el extremo distal del velo protruye hacia la aurícula lejos del punto de coaptación durante la sístole7.
Con la sonda ETE-3D, de una forma rápida y con una sola adquisición de imagen, somos capaces de estudiar cada uno de los festones mitrales desde cualquier punto de vista, sin tener que hacer una reconstrucción mental tras diferentes cortes ecocardiográficos7. Existen múltiples planos que permiten una localización muy exacta del prolapso (Fig. 5). Dado que la VM es la estructura que se encuentra enfrente de la sonda transesofágica, va a ser la estructura mejor visualizada, debemos situar la imagen «de frente» de igual modo que en el campo quirúrgico, con una imagen comprensible para cirujano y ecocardiografista. Va a ser fundamental incluir dentro de la imagen estructuras de referencia anatómicas como la válvula aórtica y la orejuela izquierda (anterolateral) para colocar la imagen de forma quirúrgica siempre que sea posible. Permite visualizar la protusión hacia la aurícula de uno o más segmentos, así como la existencia de cuerdas rotas (Tabla II).
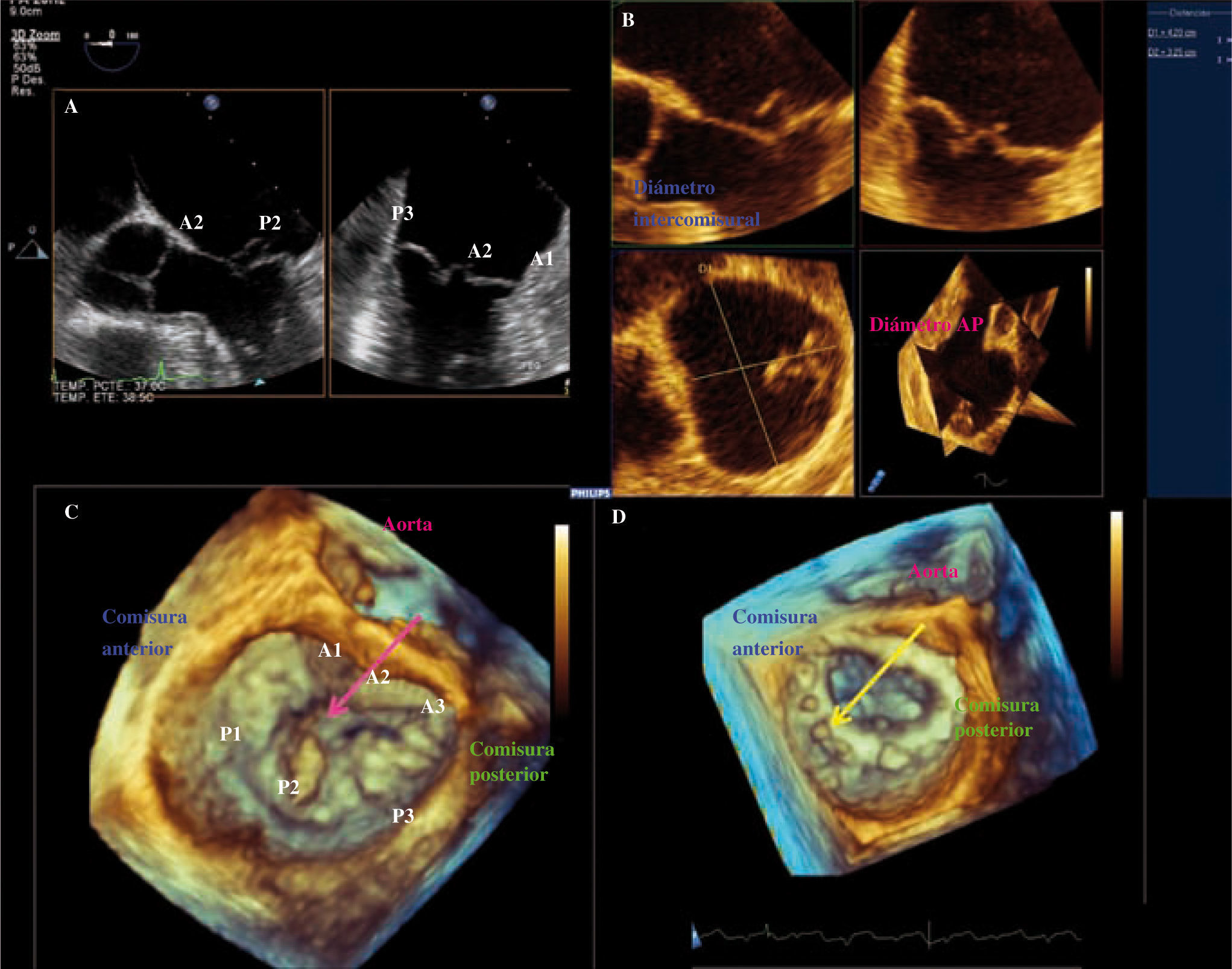
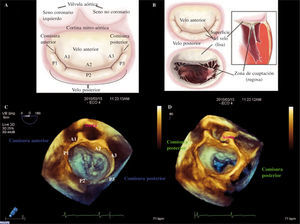
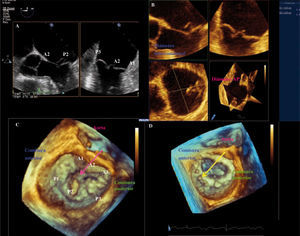
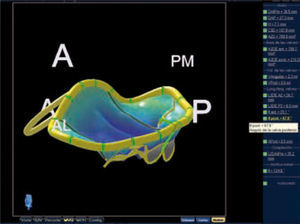
Ejemplo de paciente con prolapso de P2, tipo 2 de la clasificación de Carpentier. A: imagen ortogonal de ETE-3D con una sola vista en dos planos del espacio. B: reconstrucción tridimensional válvula y anillo mitral, prolapsan a nivel de P2 y P3. Adquisición mediante volumen completo en la que se visualizan simultáneamente tres planos; podemos realizar una medición online de los diámetros del anillo. C: imagen de la VM vista desde la AI «vista cirujano» con AO situada a las 12horas, se visualiza protusión hacia la aurícula de P2 fundamentalmente (flecha rosa). D: anillo normoposicionado tras reserción cuadrangular y anillo; podemos visualizar incluso los puntos de sura (flecha amarilla).
Ecocardiograma tridimensional
| Utilidad del ecocardiograma 3D: |
| – Reconstrucción exacta en espacio y en tiempo real. |
| – El ecocardiograma transtorácico 3D tiene menor resolución y es muy dependiente de la ventana acústica. |
| – La utilización del método PISA 3D podría permitir minimizar los errores que derivan de los chorros excéntricos. |
| – El ecotransesofágico 3D permite una valoración muy exacta de la anatomía de la VM, obteniendo reconstrucciones muy útiles para el cirujano. |
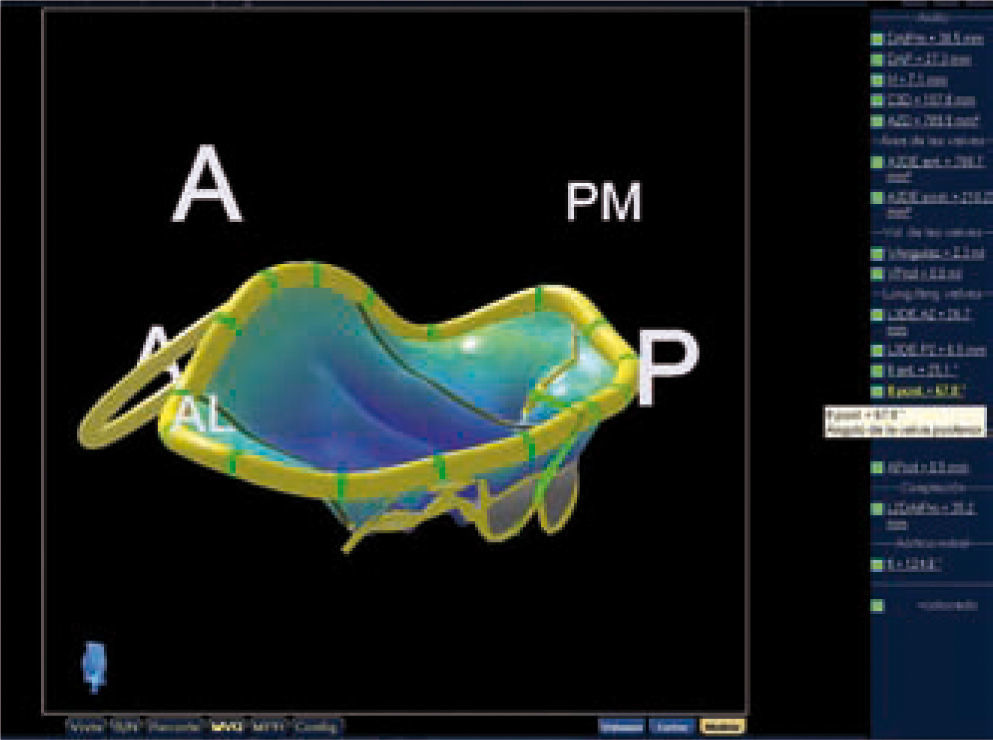
Antes de la intervención, mediante programas informáticos específicos, podemos medir el área y el volumen de las valvas para indicar al cirujano si hace falta o no la resección de algún festón (Fig. 6). Visualizaremos mediante recontrucción 3D la línea de coaptación valvular, siendo fundamental para saber si existe defecto de tejido en el caso de reparaciones complicadas como en los pacientes con enfermedad reumática o endocarditis.
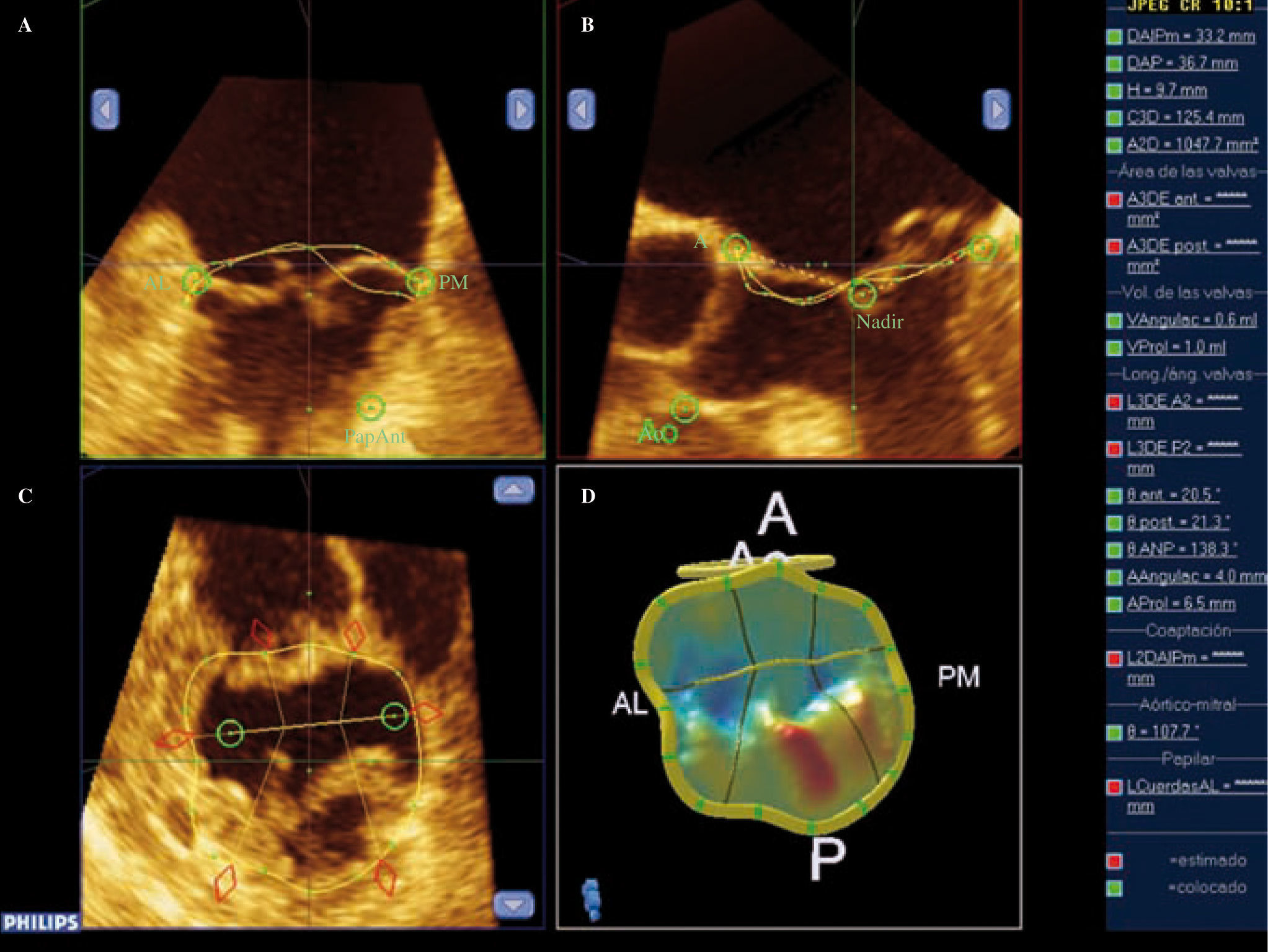
Reconstrucción tridimensional de válvula y anillo mitral: en azul segmentos normales y en rojo segmentos que prolapsan a nivel de P2. Adquisición mediante volumen completo, en la que se visualizan simultáneamente tres planos bidimensionales (A: corte sagital; B: corte sagital dos cámaras; C: corte transversal; D: superposición de los tres planos). Mediante la reorientación de estos planos se puede realizar con software específico el trazo del anillo, los velos mitrales y los puntos aórticos de referencia, obteniendo una recontrucción 3D del anillo que nos ofrece medidas como los diámetros AP e intercomisural, la altura del anillo, el área de los velos y el volumen del prolapso.
Constituye la unión anatómica entre aurículas y ventrículos, y es el lugar donde se insertan los velos. Presenta forma en silla de montar. Los puntos más elevados, es decir, más alejados del ápex cardíaco, corresponden a la región anterior más próxima a la raíz aórtica y la región posterior próxima a la pared posterior del VI. Los puntos más bajos son las dos comisuras mitrales. El anillo mitral posee una forma característica en silla de montar. Durante la fase sistólica las comisuras mitrales se desplazan apicalmente, mientras que la contracción anular contribuye al estrechamiento del diámetro circunferencial valvular (el anillo alcanza su menor área durante la mesosístole)8. Ambos procesos contribuyen al logro de una coaptación idónea, y pueden verse afectados por enfermedades como la dilatación o la calcificación anular. Tanto al final de la sístole como en la diástole, el anillo adquiere una forma más aplanada.
La porción anterior está anclada a los trígonos y está más desarrollada, a nivel de la inserción del velo posterior este segmento no se encuentra anclado a ninguna estructura fibrosa presentando un esqueleto discontinuo. Esta porción anular se presta a un crecimiento de su diámetro circunferencial en el contexto de IM asociada a una dilatación auricular o ventricular. La corrección del diámetro normal para restablecer el diámetro fisiológico es, por tanto, una característica esencial de la reparación valvular mitral en la enfermedad degenerativa.
Es fundamental una adecuada contracción del anillo en sístole para asegurar la competencia valvular, normalmente durante la sístole el anillo reduce su área un 25%9.
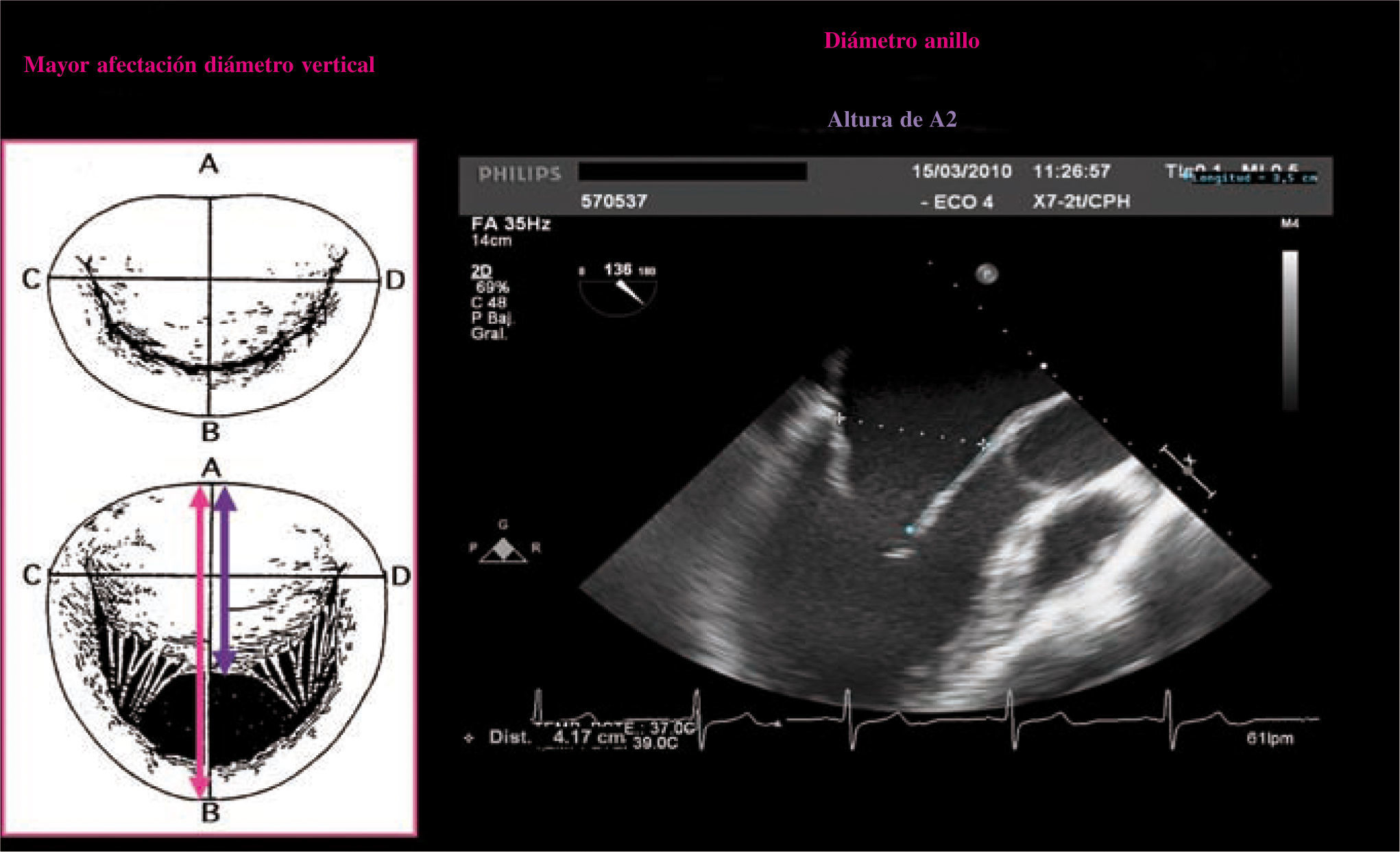
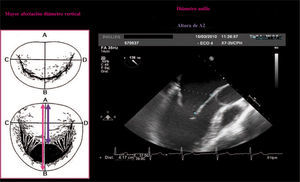
El diámetro AP se puede obtener por Eco-2D en el plano paraesternal eje largo o por ETE-2D a 120grados, obteniendo la medida del diámetro anteroposterior (AP) del anillo. La dilatación anular está presente si el diámetro anillo/longitud de A2>1,3 o si el diámetro del anillo es>35mm10 (Fig. 7).
La fecha rosa corresponde al diámetro AP del anillo y la moderada a la altura del velo anterior a nivel de A2. Ejemplo en ETE a 120grados de medición del diámetro AP del anillo y del velo anterior. Si su relación es mayor a 1,3cm, la posibilidad de éxito de la reparación disminuye.
Mediante ecotransesofágico 3D podemos cortar dos planos ortogonales en el espacio obteniendo una visualización no completa de toda la superficie del anillo; además, la reconstrucción 3D de todos los puntos del anillo y las valvas nos aporta información muy válida para la planificación de la cirugía (Tabla III) (Fig. 6).
Características desfavorables en ett para la reparación quirúrgica en la imf
| Válvula mitral |
| – Altura de tenting>1,1cm |
| – Área de tenting>2,5-3cm2 |
| – Chorros complejos |
| – Ángulo posterolateral>45° |
| Remodelado local VI |
| – Distancia interpapilar>20mm |
| – Distancia papilar-fibrosa aórtica>40mm |
| – Anomalías contractilidad segmentaria cara lateral |
| Remodelado global VI |
| – DTDVI>65mm, DTSVI>51mm, volumen sistólico 140ml |
| – Índice de esferidad sistólico VI>0,7 |
Las comisuras definen el área donde el velo posterior y el velo anterior se unen a nivel de su inserción en el anillo. Las comisuras pueden ser consideradas como segmentos velares bien definidos, identificadas gracias a dos puntos de referencia: el axis del MP correspondiente y las cuerdas comisurales, las cuales tienen una configuración específica. El borde libre de las comisuras se encuentra separado del anillo por un segmento milimétrico de tejido. Esta área debe ser abordada cuando tratamos de corregir un prolapso comisural, así como los segmentos contiguos del velo anterior y posterior (A3 y P3), evitando así una posible regurgitación en esta región.
En la superficie auricular de los velos podemos distinguir dos zonas principales: una zona periférica suave (cuerpo) y una zona rugosa (zona de coaptación). La línea curvada de coaptación entre ambos velos, evidenciada en una vista auricular, separa ambas zonas. La zona rugosa representa la superficie de coaptación valvular. La zona de coaptación valvular es crítica para la competencia de ésta, y su profundidad y longitud está considerada actualmente como una medida importante de la función valvular.
CuerdasExisten tres tipos de cuerdas según su inserción en el extremo libre o en la base de los velos. Las cuerdas de primer orden se insertan en el extremo distal de los velos y evitan la tendencia al prolapso. Las cuerdas de segundo orden se insertan en la cara ventricular de los velos y disminuyen la tensión del tejido valvular. Son fundamentales para preservar la forma y la función ventricular. Por último, las cuerdas terciarias, limitadas al velo posterior, conectan la base de la valva y el anillo al MP. Es fundamental su evaluación ya que su ruptura, calcificación o fusión puede producir IM.
Etiología y mecanismos de la insuficiencia mitralLas causas y los mecanismos en este ámbito no resultan sinónimos. La IM se clasifica en orgánica (primaria) o funcional (secundaria). Las causas de enfermedad primaria engloban la enfermedad degenerativa (Barlow, degeneración fibroelástica), afectación reumática y endocarditis. La IM funcional se refiere a la alteración de la función con velos normales en el contexto de miocardiopatía dilatada o cardiopatía isquémica11.
Insuficiencia mitral degenerativa: la causa más frecuente de insuficiencia mitral- –
Válvula billowing cuando una parte del cuerpo de la valva protruye en la aurícula, la coaptación valvular está preservada y la IM es leve.
- –
Válvula floppy cuando el grosor de los velos es mayor de 5mm por exceso de tejido velar.
- –
Prolapso cuando la línea de coaptación se desplaza por debajo del plano anular. La valoración debe realizarse por ETT en el plano paraesternal, evitando el plano apical cuatro cámaras, que aumenta los falsos positivos por la morfología del anillo. Cuando la afectación mixomatosa es difusa, se denomina síndrome de Barlow.
- –
Válvula flail cuando el extremo libre del velo protuye hacia la aurícula, generalmente por ruptura de una cuerda bien por causa degenerativa o endocarditis.
Se caracteriza por engrosamiento de los velos a nivel de su extremo libre. La fibrosis de las cuerdas es frecuente, fundamentalmente aquellas que se anclan al velo posterior, produciendo retracción importante del mismo. En algunos pacientes el velo posterior permanece semiabierto en todo el ciclo cardíaco y el velo anterior en sístole produce una falsa imagen de prolapso.
Insuficiencia mitral funcional isquémicaLos criterios diagnósticos de la IM isquémica crónica son: que ocurra en los siguientes 16días de un infarto, con una o más anomalías de la contractilidad segmentaria del VI, enfermedad significativa del vaso que irriga dicho territorio, con velos y cuerdas mitrales anatómicamente normales (una vez excluida la causa orgánica), asociada a enfermedad coronaria. El mecanismo por el cual se produce es el remodelado local o global que causa alteración de la geometría del VI con alteración de las relaciones del aparato subvalvular, existe un desplazamiento apical y posterior de los músculos papilares (generalmente el posterior) y de sus cuerdas tendinosas correspondientes, lo que tracciona (tethering) los velos valvulares y disminuye y progresivamente anula su superficie de coaptación (IM tipo IIIb de la clasificación funcional de Carpentier).
La dilatación y la alteración de la contracción del anillo, la disfunción del VI y la asincronía de los músculos papilares juegan un papel fundamental en la modulación del grado de IM.
El anillo se dilata y se aplana con pérdida de la morfología en silla de montar, existiendo más dilatación en los infartos anteriores que en los inferiores12. La dilatación es simétrica con afectación de la porción anterior y posterior de la distancia intertrigonal, así como de los seis segmentos de acuerdo con la clasificación de Carpentier. Además, el cambio de área, la función de esfínter y el movimiento están reducidos indicando pérdida de la contracción del anillo13.
La insuficiencia mitral crónica es dinámica y debemos ser cuidadosos en su evaluación en quirófano, pues en la inducción anestésica se emplean agentes inotrópicos como la dobutamina que aumentan la contractilidad del VI y las fuerzas de cierre, por lo tanto se reduce el grado de IM14.
Asimismo, las condiciones de carga baja reducen la cavidad del VI, disminuyendo el grado de IM.
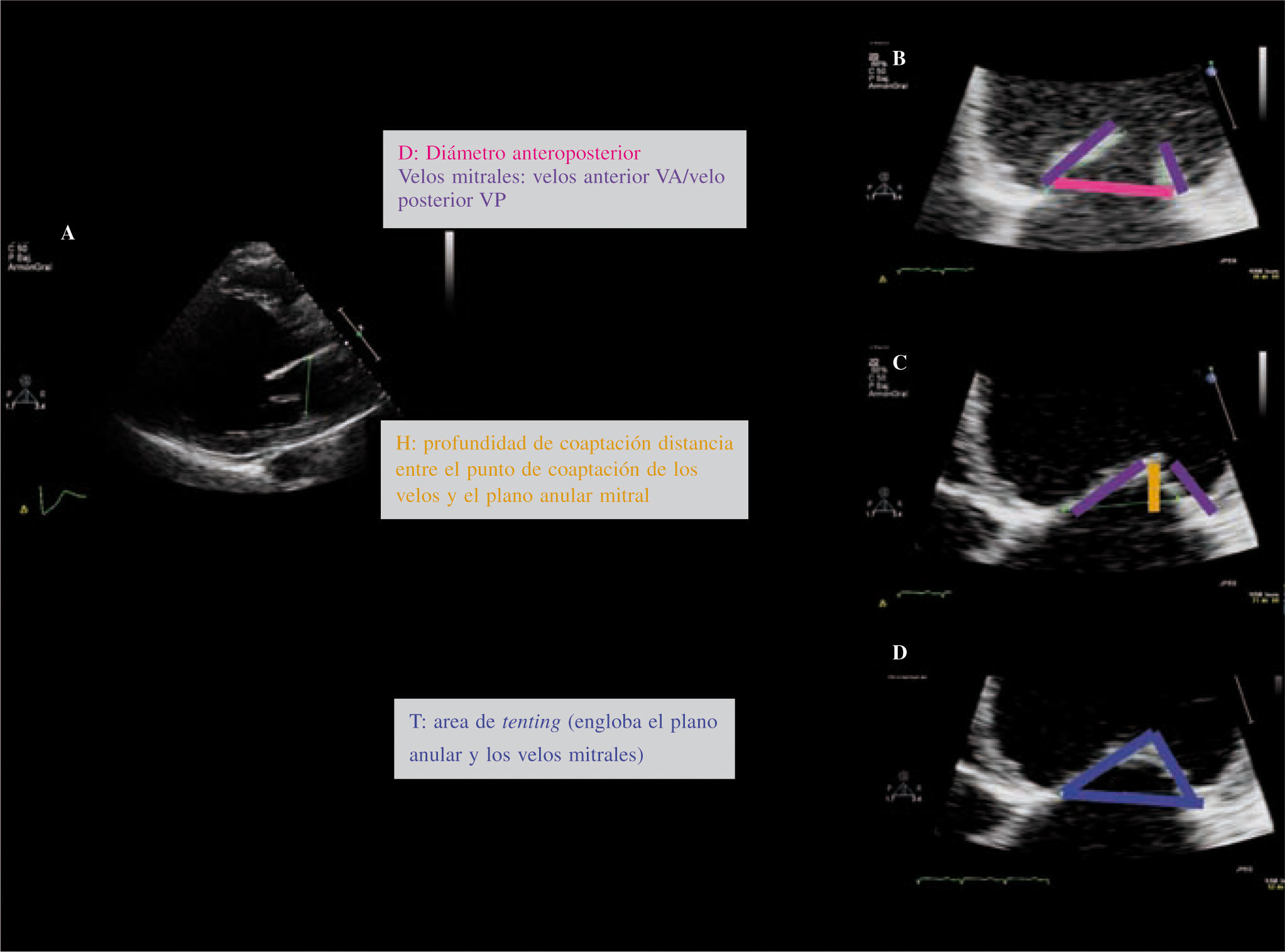
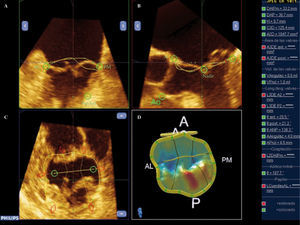
Cuantificación de la regurgitaciónEn individuos sanos el área de tenting es como máximo de 1cm2 y la profundidad de coaptación es de 0,6cm; cuando la evaluación se realiza en el eje largo del plano paraesternal del ETT en la fase mesosistólica, ambos parámetros se correlacionan con el grado de IM, así como el grado de disfunción del VI15 (Fig. 8). Estudios recientes han demostrado la asimetría de esta área16 y la existencia de diferentes patrones dependiendo de la etiología de la IMF17, por lo tanto un estudio basado en un único plano no sería óptimo.
Estudio del anillo mitral en un paciente con miocardiopatía dilatada idiopática e IMF. A: anillo, coaptación y área de tenting; eje largo ETT. En individuos sanos: distancia de coaptación 0,6cm, área tenting 1cm2. En el mismo paciente plano apical cuatro cámaras. Anillo (B), profundidad de coaptación (C) y área de tenting(D).
En la actualidad, el volumen de tenting estimado por ecocardiografía 3D es una herramienta mejor, ya que tiene en cuenta todos los componentes geométricos del tenting y del tethering. La variación es dinámica y está influenciada por la función sistólica del VI. El Eco-3D nos permite trazar las valvas mitrales y medir su área con la aplicación de programas informáticos especializados. Podemos medir el volumen entre el anillo mitral y las valvas mitrales para calcular el volumen de tenting, el diámetro máximo del anillo mitral (tanto AP como intercomisural), la superficie de las valvas mitrales, y visualizar la deformación que sufren las valvas desde la vista auricular (cirujano) o desde el VI, los ángulos existentes entre los velos y el anillo mitral, así como el ángulo mitroaórtico.
Patrones ecocardiográficos de tethering- –
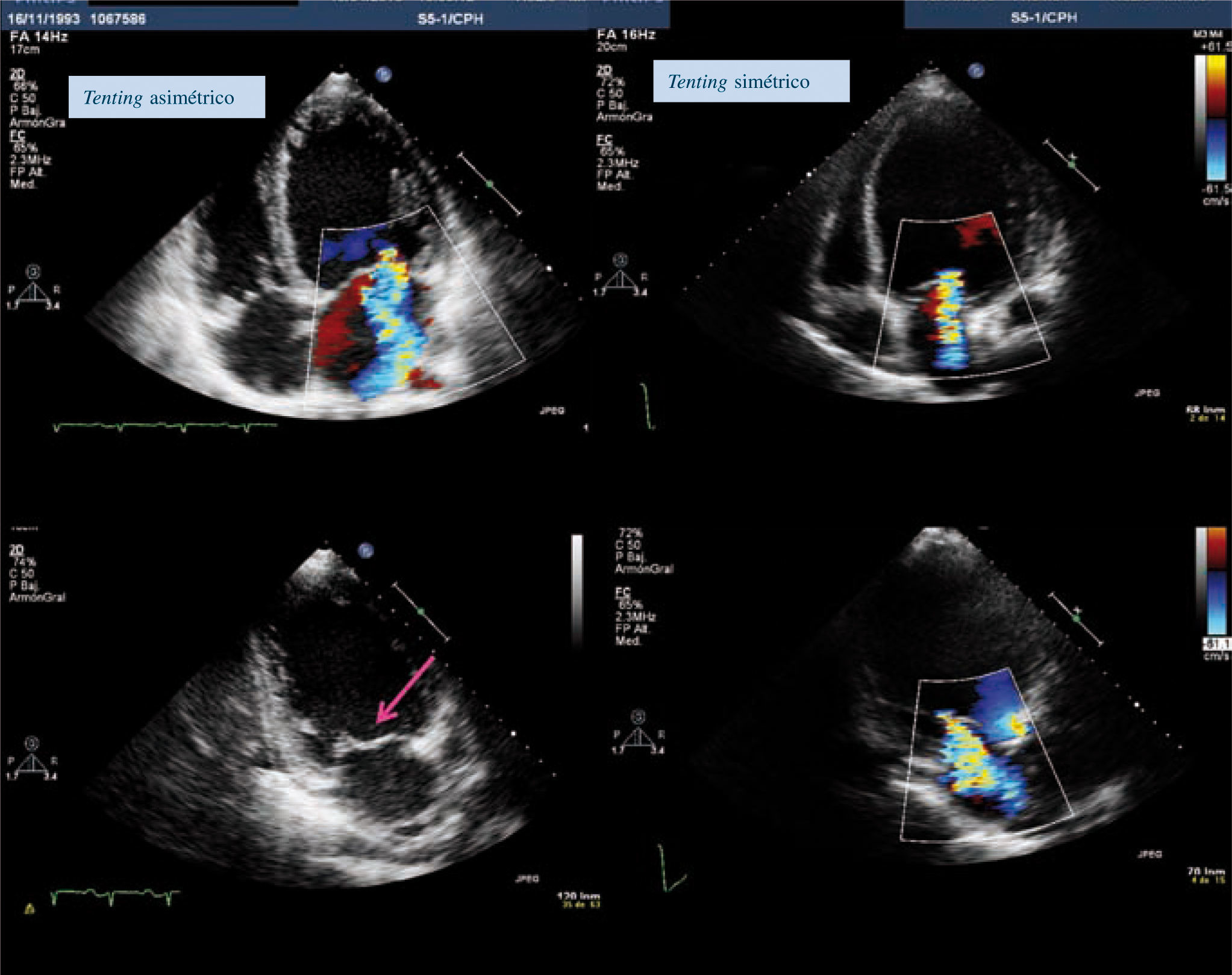
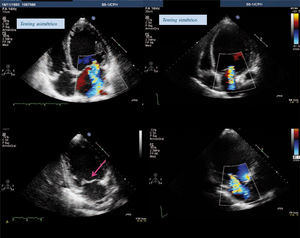
Asimétrico: se caracteriza por tethering posterior de ambas valvas. En este caso, el desplazamiento asimétrico del papilar posterior tira del velo posterior (VP) hacia atrás, mientras que el velo anterior (VA) permanece superior. Al estar cada MP sujeto por cuerdas a ambas valvas, el desplazamiento posterior de cualquiera de los papilares origina tracción de las dos valvas. La restricción tan grave del VP determina que el punto de coaptación se mueva posterior, creando una forma asimétrica de tethering. El VA también sufre la tracción. La restricción es visible con morfología en «ala de gaviota» del VA, que es debido a la tracción de las cuerdas de segundo orden, que excede las fuerzas del cuerpo del VA18,19 (Fig. 9). Es característico en infartos inferolaterales con remodelado local. Se caracteriza por dilatación variable del anillo.
Figura 9.Patrón de tenting asimétrico, chorro excéntrico en plano apical cuatro cámaras, en tres cámaras el velo anterior adquiere morfología en ala de gaviota. Patrón de tenting simétrico en plano apical cuatro cámaras chorro central, en tres cámaras mayor tracción apical de músculos papilares.
(0.29MB). - –
Simétrico: se caracteriza por tethering apical de ambas valvas, también se observa restricción en el movimiento de la porción distal del VA. El tethering es apical y mediolateral, además del componente posterior, con mayor desplazamiento del punto de coaptación más apicalmente. Es característico de los infartos anteriores y de infartos múltiples con enfermedad multivaso. El VI es esférico por mucho remodelado y es característico el chorro central. El anillo mitral está más aplanado y dilatado que en el patrón simétrico, existiendo un aumento del área y volumen de tenting.
- –
Disfunción/dilatación anular: en algunos pacientes no se observa tenting de los velos, pero el anillo aparece dilatado con pérdida de la función contráctil. Es típico un desplazamiento limitado apical de ambos velos con dilatación del anillo con un jet central o varios a lo largo de la línea de coaptación. Ocurre generalmente en infartos localizados en el segmento basal inferoposterior (Fig. 10).
Figura 10.Reconstrucción 3D del anillo mitral en una paciente con IM isquémica, forma típica en silla de montar con zonas azul oscuro desplazadas apicalmente por tenting de ambos velos, a la derecha medidas del anillo AP altura y volumen de tenting 2,3ml. Ángulo velo posterior/ anillo mitral de 63grados marcado en verde.
(0.09MB).
La determinación del mecanismo que produce la IM es fundamental para evaluar la posibilidad de reparar la VM. La triada fisiopatológica de Carpentier describe la interrelación entre etiología (causa de la enfermedad), lesión (resultado de la enfermedad) y disfunción valvular (el resultado de las lesiones). La clasificación de Carpen-tier está basada en los movimientos velares de apertura y cierre en relación al plano anular.
Clasificación funcional de carpentier- –
Tipo I: movimiento normal de los velos. Determinada por perforación (endocarditis) o dilatación anular.
- –
Tipo II: movimiento incrementado de los velos (prolapso valvular).
- –
Tipo IIIa: movimiento restringido de los velos durante las fases diastólica y sistólica, por acortamiento de cuerdas o engrosamiento del velo por enfermedad reumática.
- –
Tipo IIIb: movimiento restringido de los velos durante la fase sistólica, típico de IM funcional.
Debemos identificar los factores predictores ecocardiográficos de mal pronóstico para asegurar una alta posibilidad de reparación al cirujano y al paciente. Los pacientes con IM orgánica tendrán baja posibilidad de reparación si: chorro central de gran tamaño, diámetro del anillo mitral>50mm o afectación de los tres segmentos del velo, fundamentalmente si el velo implicado es el anterior. En caso de enfermedad reumática o perforación por endocarditis, debe asegurarse la existencia de tejido suficiente que asegure el éxito de la reparación.
La reparación en la IM isquémica presenta una alta tasa de recurrencia, del 30% en los primeros seis meses posquirúrgicos. El objetivo de la reparación va a ser obtener una IM trivial o grado 0, para lo que se emplean anillos de diámetros 24-26mm para lograr una superficie de coaptación de 8mm. La existencia de un chorro central indica mayor retracción de valvas con más tenting. Aquellos pacientes con diámetro del anillo≥3,7cm, área de tenting≥1,6cm2 en el eje largo e IM grado≥3,5 tienen una probabilidad de fallar durante el seguimiento del 50%.
Para conseguir el objetivo de una superficie de coaptación correcta y homogénea (≥8mm) en un paciente con insuficiencia mitral isquémica crónica (IMIC), debemos realizar una reparación que afecte a toda la superficie del anillo mitral (anillo completo), que disminuya la distancia AP del anillo mitral de forma más marcada que las técnicas habituales (anillo sobrecorrector), dado que en los casos de IM degenerativa los velos son más redundantes y no hay tracción del aparato subvalvular, y que actúe compensando el desplazamiento de los músculos papilares.
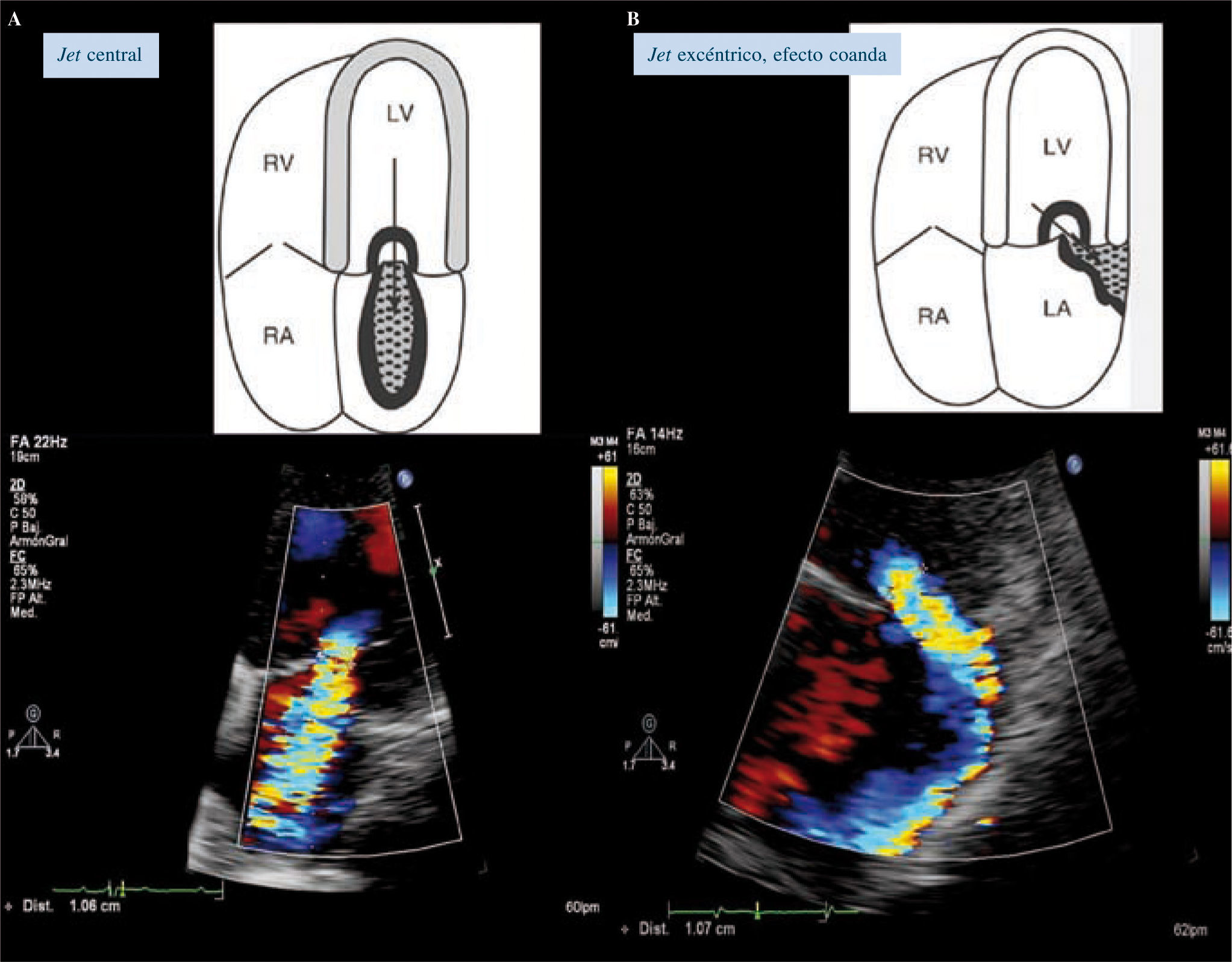
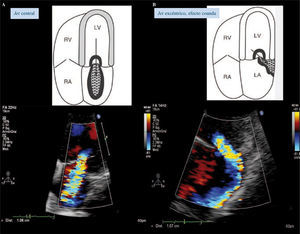
Cuantificación de la insuficiencia mitralÁrea doppler colorEs el método menos preciso para evaluar la gravedad de la IM, es semicuantitativo porque variables técnicas y fisiopatológicas pueden modificarla. Se asume que, a medida que aumenta la gravedad de la IM, aumenta el tamaño y la extensión del chorro en la AI (Fig. 11). En teoría, los chorros profundos que se extienden al fondo de la AI son más importantes que aquellos que están en el borde de los velos mitrales. Existe una variación muy amplia por factores anatómicos y hemodinámicos. Para grados similares aquellos pacientes con aumento de la presión de AI o chorros excéntricos pegados a la pared de la AI pueden presentar áreas del chorro menor que si la presión de AI es normal y el chorro es central (Tabla IV).
Grados de la im
| Leve | Moderada | Grave | |
| Signos específicos | Chorro central pequeño <4cm2 o <10% AI. | IM más que leve sin criterios de gravedad | Vena contracta≥0,7cm2 o chorro central grande (>40% AI) o chorro contra la pared de cualquier tamaño. |
| Vena contracta 0,3cm. | |||
| Nula o mínima convergencia flujo proximal | Covergencia del flujo proximal. | ||
| Flujo reverso sistólico en Vp. | |||
| Válvula flail o ruptura de MP | |||
| Datos que apoyan | Flujo sistólico dominante en Vp. | Onda E dominante en flujo mitral (>1,2m/seg). | |
| Onda A dominante flujo mitral. | Dilatación de AI/VI | ||
| Baja densidad de la señal Doppler. | |||
| Tamaño normal de VI | |||
| Variables cuantitativas | |||
| – Vol reg (ml/lat) | <30 | 30-44; 45-59 | ≥60 |
| – FR | <30% | 30-30; 40-49% | ≥50 |
| – ORE cm2 | 0-20 | 0,20-0,29; 0,30-0,39 | ≥40 |
AI: aurícula izquierda; Vp: vena pulmonar; MP: músculo papilar; VI: ventrículo izquierdo; Vol reg: volumen regurgitante; FR: fracción de eyección regurgitante; ORE: orificio efectivo regurgitante.
Existen una serie de factores que influyen en la cuantificación de la IM:
- –
Ganancia.
- –
La frecuencia de repetición del pulso.
- –
La profundidad del campo.
- –
La dirección del chorro.
- –
Las condiciones de carga.
Se calcula la relación área del flujo de IM/área de AI x 100.
La insuficiencia mitral es grave si el área flujo regurgitación es>10cm2 y el tanto por ciento del área de regurgitación/AI>40%. El método está sometido a muchos errores y solo se recomienda para el diagnóstico de IM, no para la cuantificación.
Vena contractaEs la anchura del chorro cuando abandona el orificio regurgitante. Guarda mejor correlación con otras técnicas cuantitativas. Se emplean las proyecciones paraesternal y apical cuatro cámaras con aumento, la vena contracta es perpendicular a la línea comisural. Es fundamental adaptar la línea del color para visualizar el cuello de la porción más estrecha del chorro. Si es posible se deben emplear dos planos ortogonales y hacer la media de ambas medidas. Si la vena contracta es ≤ 3mm, la IM se considera leve, y si es≥7mm, la IM se considera grave. Los valores intermedios requieren otros métodos para cuantificar la gravedad (Tabla V).
Vena contracta
| – Vena contracta≥7mm se asocia a orificio efectivo regurgitante (ORE)>0,4cm2;, es decir, IM grave. |
| – Cuando sea posible medir la vena contracta para cuantificar la IM. Los valores intermedios entre 3-7mm requieren un método cuantitativo. |
| – El ecocardiograma 3D puede ser útil cuando existen chorros múltiples. |
Es el método cuantitativo más recomendable siempre que sea posible. Se basa en la ecuación de continuidad o principio de conservación del flujo; el flujo a lo largo del tubo es constante en cualquier punto (flujo = área x velocidad del flujo).
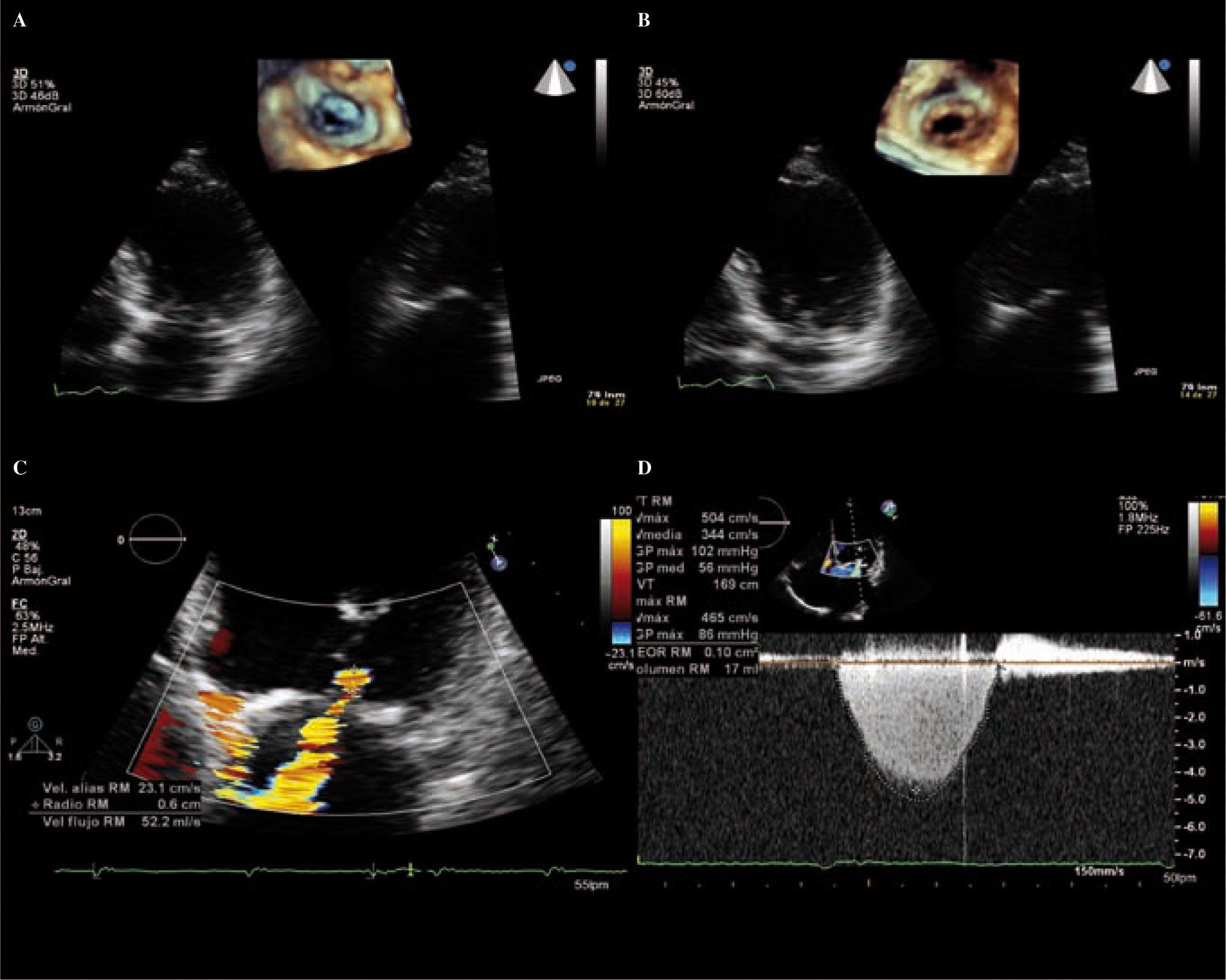
Se elije en el plano apical cuatro cámaras un lugar de la AI cercano a la VM, donde el Doppler color forma una serie de hemiesferas concéntricas con velocidad creciente, y radio y área decrecientes, porque la sangre del VI que converge hacia el orificio mitral regurgitante se acelera a medida que se aproxima al orificio valvular. Se optimiza la zona con aumento.
El cálculo requiere buscar una de las hemiesferas para estimar su área. Se identifica la hemiesfera al modificar la velocidad al límite Nyquist (velocidad de aliasing) entre 15-40cm/seg. Por el principio de conservación del flujo, la velocidad del flujo en la superficie de la hemiesfera (PISA) es igual a la del flujo regurgitante (Fig. 12).
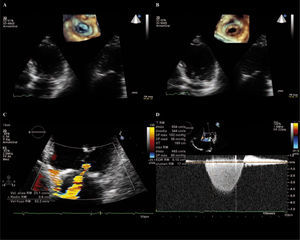
imagen de ecotranstorácico 3D; mediante dos planos ortogonales en 2D podemos visualizar con eco la VM desde el AI que se encuentra retraída. B: imagen de ecotranstorácico 3D; mediante dos planos ortogonales en 2D podemos visualizar con eco la VM desde el VI que se encuentra retraída. C: cuantificación de la IM mediante el método de PISA. D: Doppler continuo de la IM.
- –
Radio de la hemiesfera (cm).
- –
Velocidad de aliasing (cm/seg).
- –
Velocidad máxima de la regurgitación mitral (cm/seg).
- –
Tiempo velocidad integral (ITV) del flujo de regurgitación mitral (cm).
2 πr2 x velocidad de aliasing = ORE x velocidad de regurgitación mitralORE(cm2)=2πr2×velocidad de aliasing(cm/seg)velocidad de regurgitación mitral(cm/seg)
Se clasifica el grado de gravedad en leve moderada y grave:
- –
Leve: ORE <20mm, volumen regurgitante<20ml.
- –
Moderada: leve-moderada ORE 20-29mm, volumen regurgitante 30-44ml. moderada-grave ORE 30-59mm, volumen regurgitante 45-60ml.
- –
Grave: ORE>40mm, volumen regurgitante>60ml.
Si la IM es isquémica, se considera grave con valor pronóstico si ORE>20mm, volumen regurgitante>30ml. El ecocardiograma 3D es fundamental para la evaluación de la gravedad de la misma, ya que en la IM isquémica la hemiesfera es más elipsoide pudiendo infraestimar la misma, por ello el punto de corte es menor (Tabla VI).
Medidas requeridas
| – Cuando sea posible el PISA, está recomendado para cuantificar la IM. |
| – Un ORE40≥mm2 o un volumen regurgitante>60ml indican IM grave si es órganica. |
| – Si la IM es funcional isquémica ORE≥20mm2 o un volumen regurgitante>30ml indican aumento de eventos cardiovasculares. |
| – El ecocardiograma 3D permite dos proyecciones ortogonales con cálculo del volumen de la hemiesfera. |
La ecocardiografía transtorácica y transesófagica 2D es el método fundamental para la evaluación de la VM. Proporciona información anatómica y funcional crucial para valorar la reparabilidad, aportando información sobre la etiología del mecanismo y localización de las lesiones. El ETE es fundamental para aportar información clínica cuando existe mala ventana acústica, calcificación o sospecha de endocarditis. La principal ventaja respecto a la Eco-3D transesofágica es que permite ver la VM desde cualquier punto de vista y realizar un mapa de las valvas mitrales y el anillo tras una sola adquisición sin necesidad de una reconstrucción mental y permite la colocación de las imágenes de modo similar al campo quirúrgico, siendo más fácil el entendimiento entre ecocardiografista y cirujano. Aporta mediciones de gran utilidad para el cirujano, como los diámetros de anillo, el área de los velos, el volumen de prolapso, la altura y el volumen de tenting, siendo todos ellos fundamentales en la evaluación de la reparabilidad. Por ello, los cirujanos interesados en la VM solicitan cada vez con más frecuencia un estudio previo al procedimiento con esta nueva modalidad ecocardiográfica, y si es posible, también en quirófano.