La ecocardiografía transesofágica en la cirugía mínimamente invasiva mitral es una técnica imprescindible en la actualidad. La diversa información que nos ofrece durante todo el proceso quirúrgico implementa la monitorización continua intraoperatoria, ayuda al cirujano a guiar su actuación ante campos quirúrgicos de escasa visualización, permite valorar exhaustivamente la enfermedad valvular y diagnosticar potenciales complicaciones derivadas de la cirugía. En este trabajo se revisan y concretan los aspectos principales y específicos de esta técnica como soporte a la cirugía mini-invasiva mitral.
Transoesophageal echocardiography is an essential technique in minimally invasive mitral surgery. It provides continuous haemodynamic monitoring for the anaesthetic management and provides assistance to the surgeons during the different stages of the procedure when visibility can be limited. This paper reviews the value and role of transoesophageal echocardiography during minimally invasive mitral valve surgery.
El abordaje más utilizado en cirugía cardiaca de la válvula mitral ha sido la esternotomía media, ya que permite una adecuada exposición del corazón y de los grandes vasos. La cirugía cardiaca mínimamente invasiva (CMIV) representa un cambio significativo en el abordaje quirúrgico. Incluye técnicas y tecnología que intentan minimizar el trauma quirúrgico a través de incisiones torácicas pequeñas1,2. La Society of Thoracic Surgery de EE.UU.3 define la CMIV como cualquier procedimiento sobre el corazón no realizado a través de una esternotomía completa y con la asistencia de circulación extracorpórea (CEC). La estrategia de la CMIV introduce modificaciones en la canulación, en el pinzamiento aórtico y en la administración de la cardioplejia.
Las reticencias iniciales en la adopción de estas técnicas se han basado en la limitada exposición quirúrgica que podía comprometer la seguridad al incrementar los tiempos de pinzamiento aórtico y de CEC, así como las dificultades en la administración de la cardioplejia, lo que podría afectar negativamente los resultados. En los últimos años el interés por estas técnicas ha crecido de forma paralela al desarrollo de la tecnología mediante la adaptación del instrumental quirúrgico, técnicas de perfusión alternativas, sistemas vídeoasistidos y robóticos, permitiendo intervenciones cardiacas menos invasivas sin afectar a los tiempos quirúrgicos, ni alterar los resultados quirúrgicos4–8.
Aunque el aspecto técnico de cada vía de abordaje difiere ligeramente, sus objetivos son comunes: el desarrollo de una reparación o recambio valvular efectivo y seguro, con una reducción del trauma quirúrgico que logre minimizar el dolor postoperatorio, acelere la recuperación postoperatoria y la incorporación a la vida diaria9,10 y, por ende, reduzca la estancia hospitalaria y el consumo de recursos y, además, mejore los resultados estéticos y la satisfacción del paciente11. La evidencia científica11–15 establece que en pacientes con enfermedad valvular mitral, la CMIV puede ser una alternativa a la cirugía mitral convencional (indicación clase II, nivel de evidencia B) dado que presenta frente a la cirugía convencional:
- 1.
Resultados comparables de mortalidad a corto y largo plazo.
- 2.
Morbilidad comparable (renal, pulmonar, cardiaca, percepción del dolor y tasas de reingreso).
- 3.
Reducción de las complicaciones esternales, menor transfusión de concentrados de hematíes, reducción de la incidencia de fibrilación auricular postoperatoria, de la duración de la ventilación mecánica y las estancias en unidades de intensivos y hospitalarias.
A pesar de los beneficios expuestos, la CMIV no se encuentra exenta de ciertos inconvenientes como el potencial incremento del riesgo de accidentes cerebrovasculares, disección aórtica, parálisis del nervio frénico y tiempos quirúrgicos más prolongados.
La CMIV no está muy extendida en nuestro medio. Como cualquier técnica de nueva implantación, su difusión y puesta en marcha requiere la participación multidisciplinar tanto del equipo médico-quirúrgico como de los cuidados postoperatorios teniendo en cuenta la imprescindible curva de aprendizaje por parte de todos los profesionales implicados.
La ecocardiografía transesofágica (ETE) constituye actualmente una herramienta imprescindible en la monitorización hemodinámica de la cirugía cardiaca permitiendo evaluar con precisión la enfermedad valvular y la función cardiaca, así como el diagnóstico de potenciales complicaciones derivadas de la cirugía. En la CMIV, la ETE ayuda a diseñar el plan quirúrgico, dirige la canulación con seguridad, y es un elemento central para la obtención de resultados óptimos. El objetivo de este trabajo es detallar las peculiaridades de la ETE en la CMIV sobre la válvula mitral.
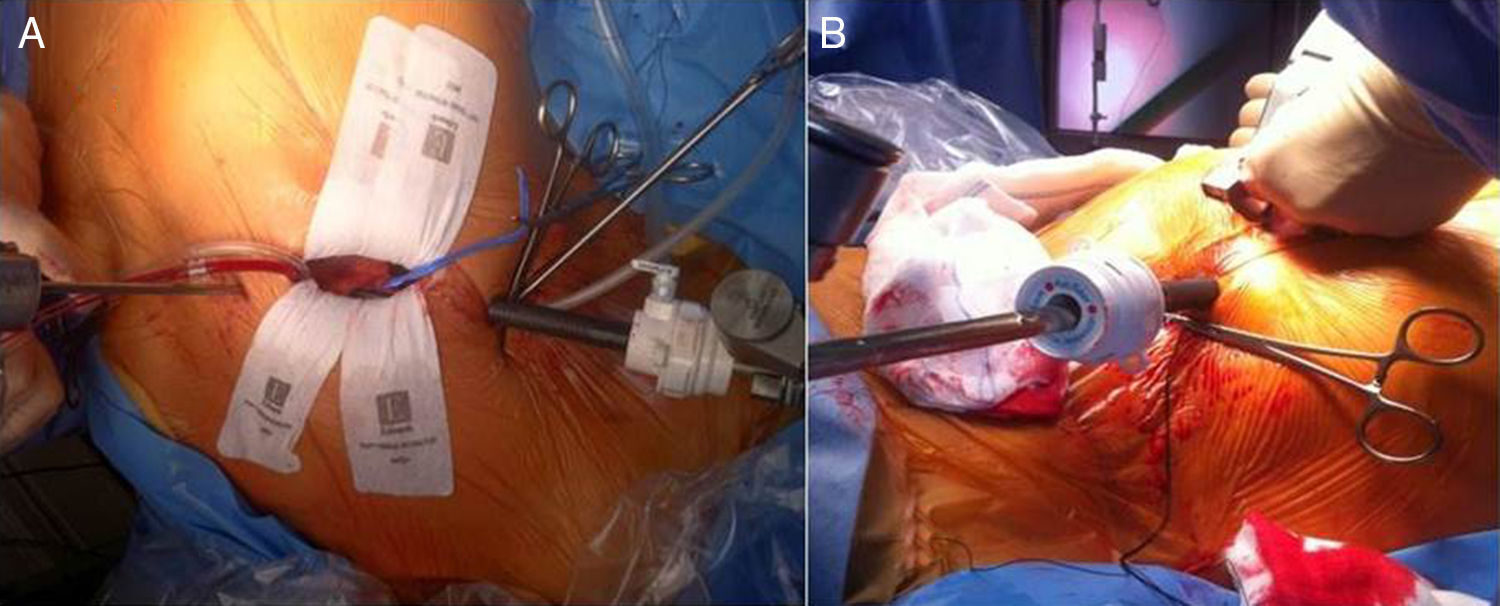
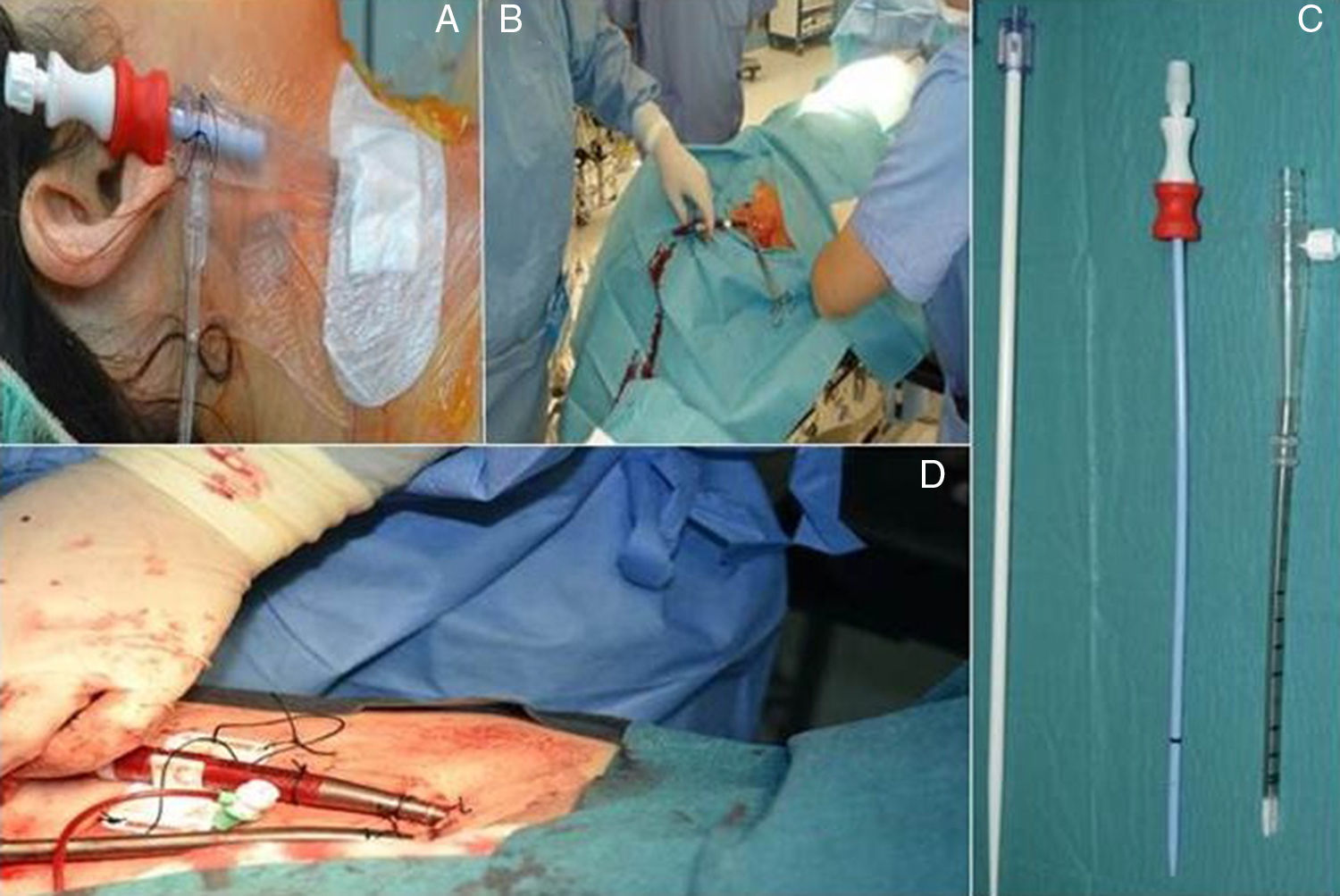
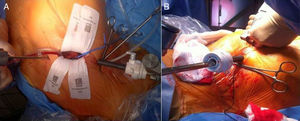
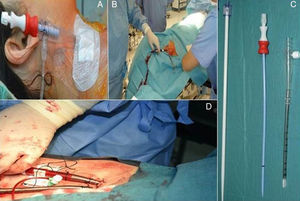
Papel de la ecocardiografía transesofágica en la cirugía cardiaca mínimamente invasivaLa CMIV vía minitoracotomía se realiza mediante incisiones de 5-7cm en el hemitórax derecho a nivel del cuarto/quinto espacio intercostal y en la línea medioclavicular (fig. 1A). La CEC se realiza mediante canulación de la arteria femoral derecha (cánula 18-20 French [F]), de la vena femoral derecha (cánula 21-23F), y canulación de la vena yugular interna derecha (cánula 18F). Una vez establecida la CEC, la técnica más usada es la realización del pinzamiento aórtico mediante clamp transtorácico externo y la administración de cardioplejia anterógrada mediante aguja (fig. 1B).
La ETE es mandatoria en la CMIV. Si hay una contraindicación absoluta para la ETE esto constituye un criterio para no optar por la CMIV. En ocasiones excepcionales la ecografía epicárdica puede aplicarse a través de las incisiones, y es una alternativa cuando no se puede introducir la sonda transesofágica16.
La ETE en cirugía cardiaca permite la toma de decisiones quirúrgicas y médicas en el intraoperatorio17,18. Además, la detección de hallazgos nuevos e inesperados en el examen intraoperatorio varía entre el 4 y el 25%17,19–21. Particularmente en la cirugía de reparación de la válvula mitral, el impacto de la ETE es incuestionable y debería ser utilizada en todos los pacientes sometidos a cirugía sobre la válvula mitral (indicación clase I, nivel de evidencia B)22,23.
La realización de un estudio exhaustivo que incluya los 11 y 20 planos estándares recomendados por la American Society of Echocardiography y por la Society of Cardiovascular Anesthesiologists permiten la valoración de los siguientes puntos de especial relevancia en la CMIV24:
- 1.
Valorar la idoneidad de la indicación de la CMIV.
- 2.
Evaluación de la insuficiencia aórtica.
- 3.
Colocación de las cánulas para la CEC.
- 4.
Evaluación del aparato valvular mitral.
- 5.
Factores de riesgo de la reparación.
- 6.
Evaluación tras la salida de la CEC.
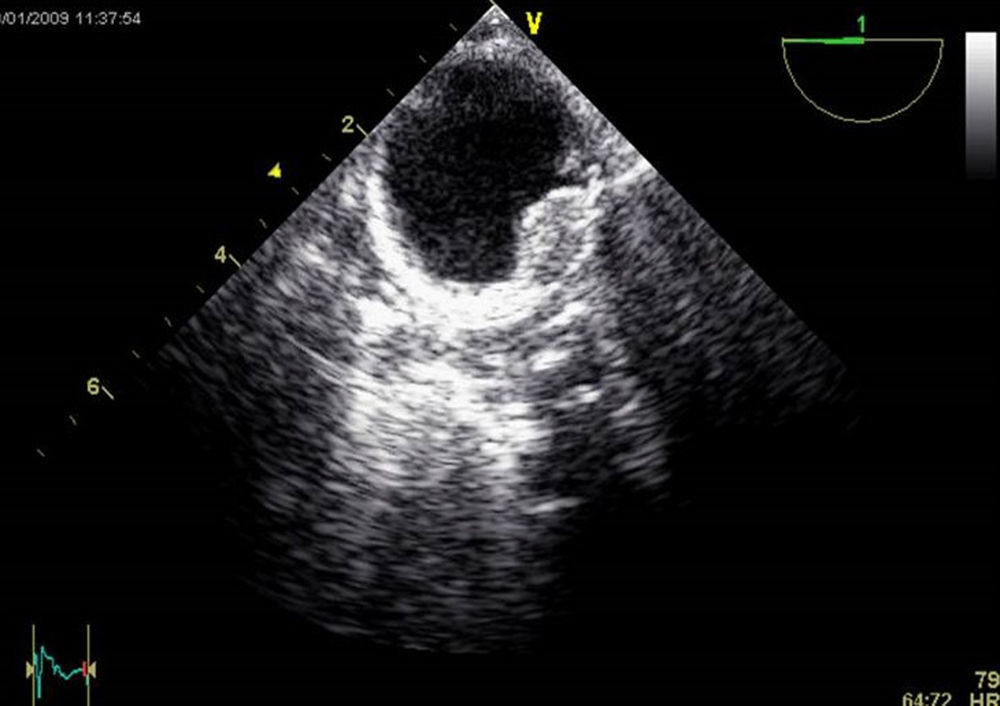
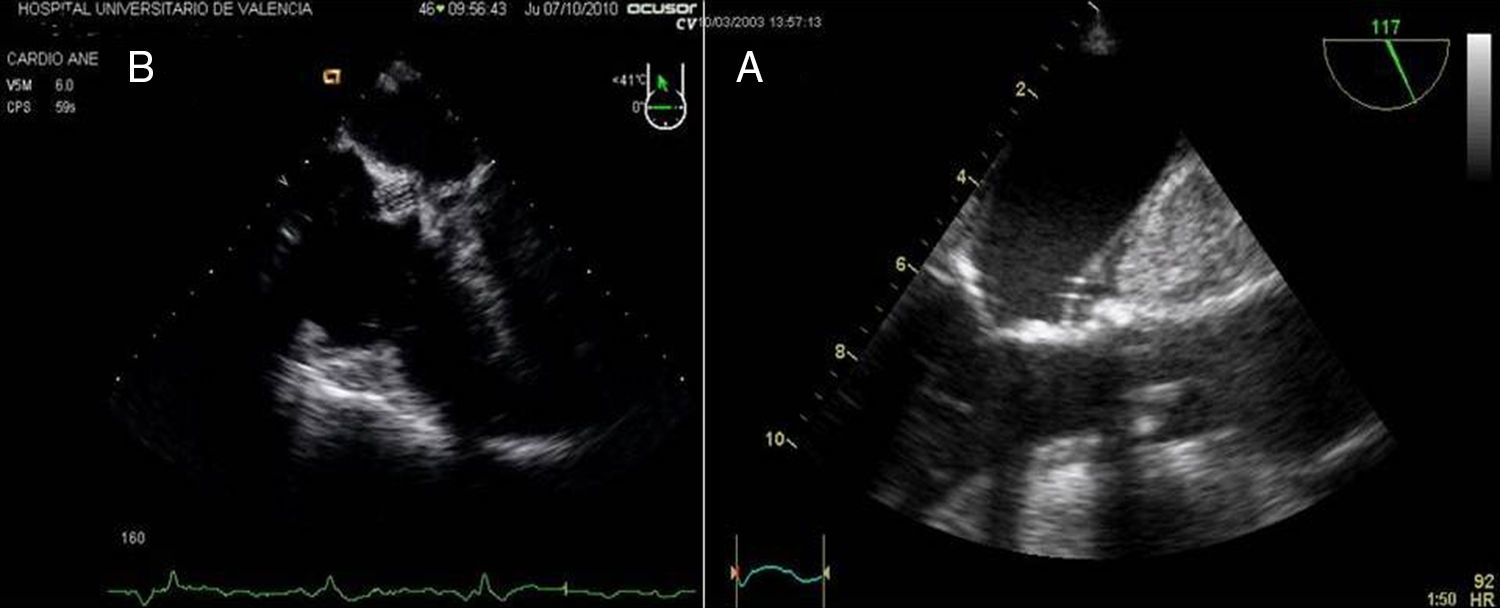
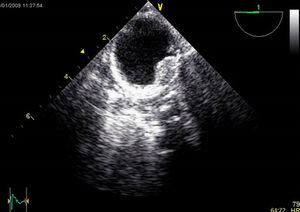
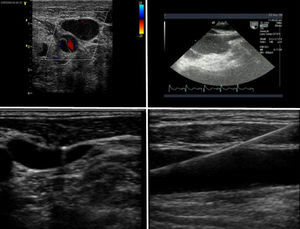
La presencia de placas de ateroma significativas en la aorta descendente que pudieran ser movilizadas por la perfusión retrógrada constituye una contraindicación relativa para la CMIV (fig. 2). La presencia de trombos intramurales es también otra contraindicación para la introducción de guías en la aorta descendente por el alto riesgo de movilización y eventos aterotrombóticos.
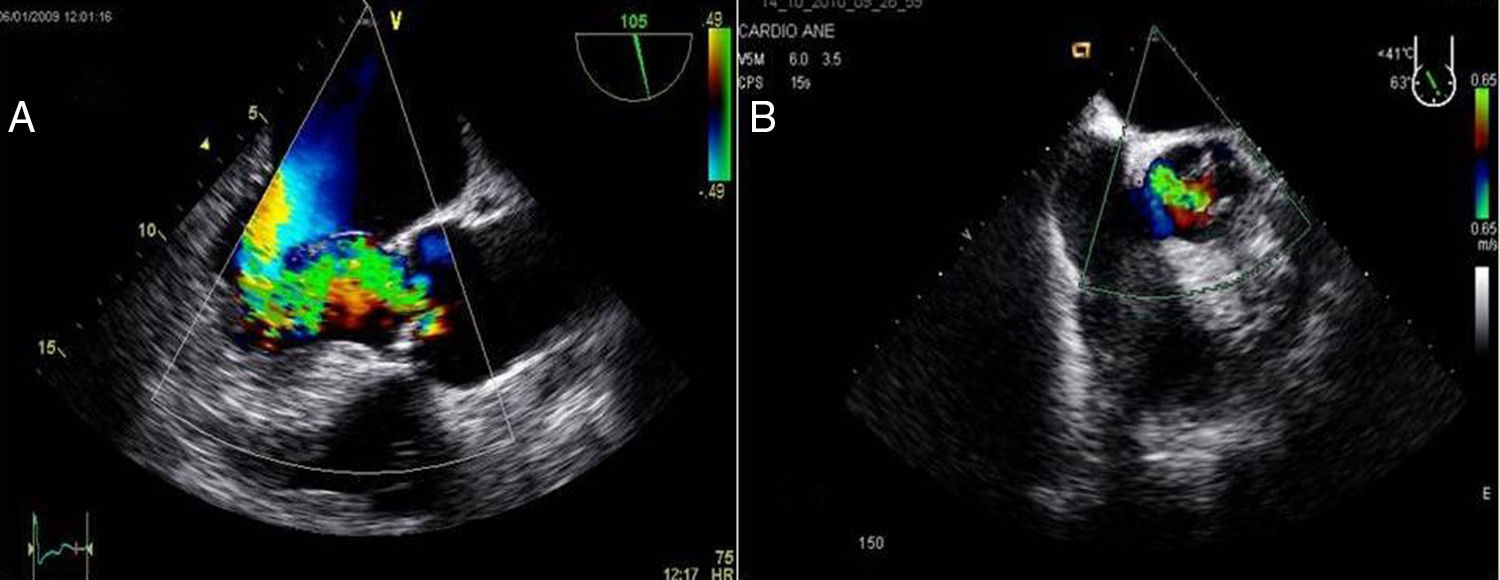
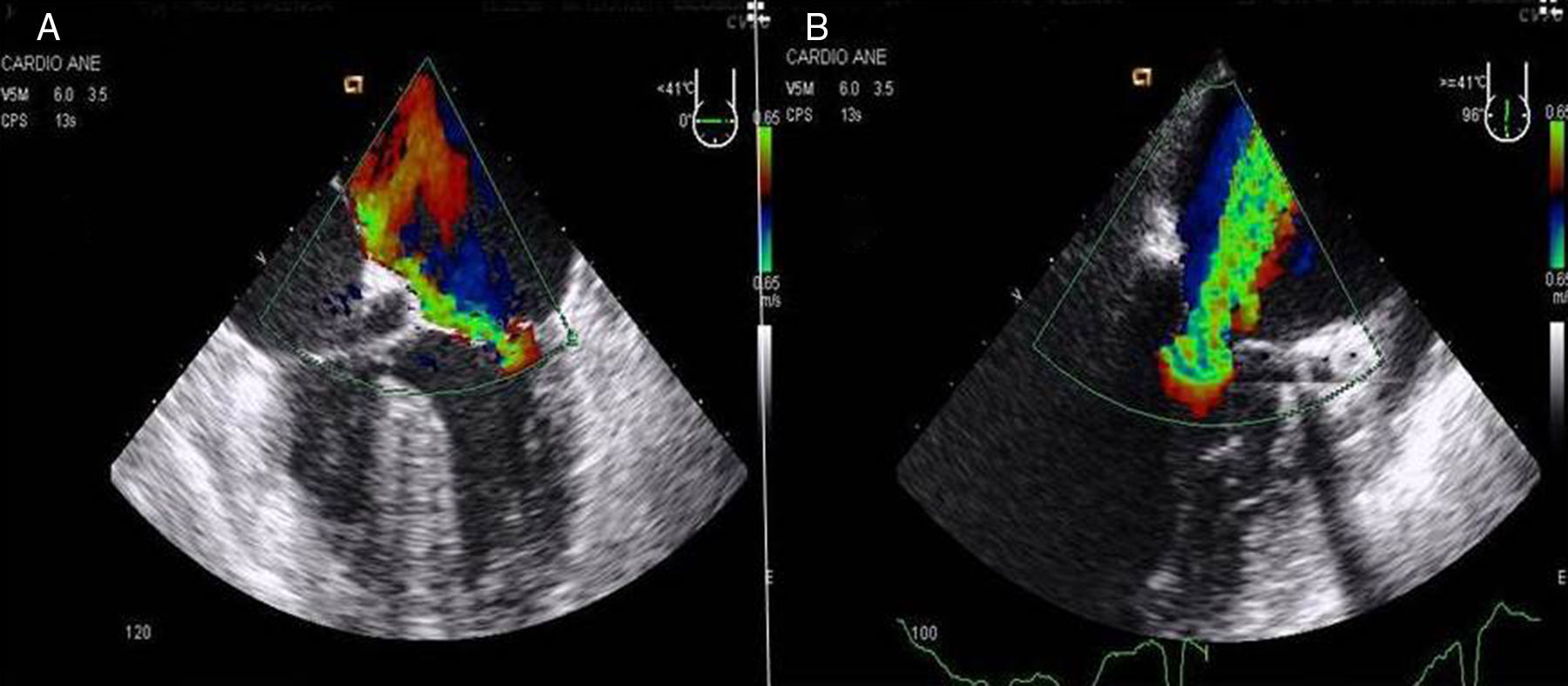
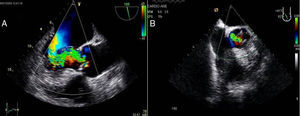
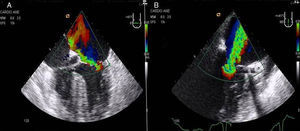
2Evaluación de la insuficiencia aórticaEn pacientes con insuficiencia aórtica superior a grado I o ligera, la CMIV debería ser considerada con cautela por los riesgos de una inadecuada administración de la cardioplejia y los riesgos de distensión ventricular (figs. 3A y B).
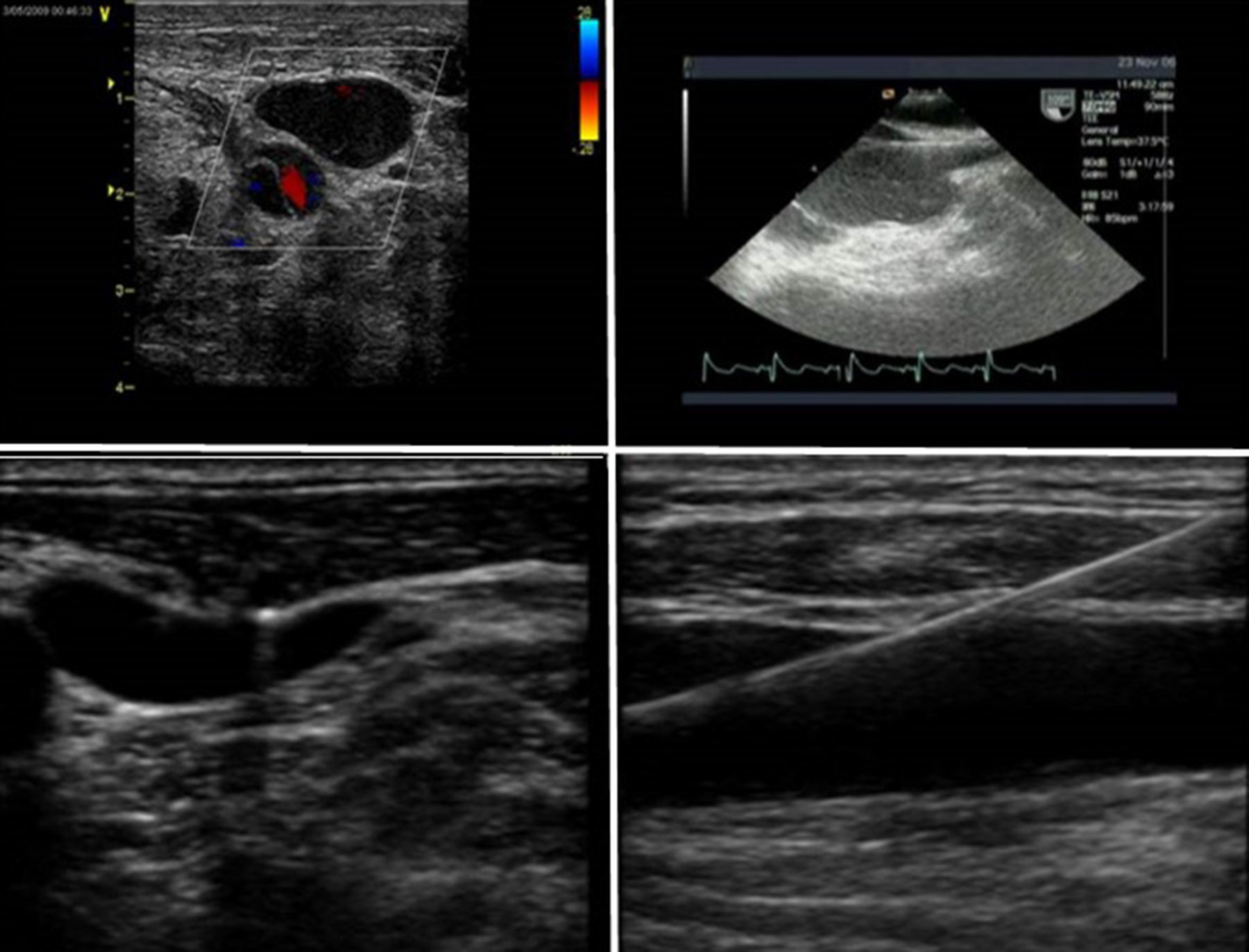
3Canulación para la cirugía cardiaca mínimamente invasivaCanulación venosaEl drenaje venoso del circuito del bypass cardiopulmonar es proporcionado de distintas maneras. Se dispone de varios tipos de cánulas largas de inserción percutánea a través de la vena femoral, y que alcanzan la aurícula derecha o la vena cava inferior. Tras la canalización de la vena femoral se inserta una guía que debe ser visualizada en aurícula derecha o en las venas cavas y, posteriormente se introduce la cánula en vena cava inferior y se confirma la adecuada posición mediante la ETE (figs. 4 y 5). La localización final de la cánula depende de la práctica individual y del tipo de procedimiento a realizar (fig. 6). Frecuentemente la localización es en la unión cavoauricular. En ocasiones, la utilización de una cánula multiperforada introducida desde la vena femoral y situada en la vena cava superior permite un drenaje adecuado si el cuerpo de la cánula está situado en la aurícula derecha.
En la mayor parte de los centros se emplea un drenaje suplementario introducido en la vena yugular interna derecha hasta la vena cava superior para el drenaje del territorio superior (figs. 5 y 6). La introducción de esta cánula en la vena yugular interna izquierda no se recomienda ya que aumenta el riesgo de lesión vascular, y al incrementar la distancia a la vena cava superior el drenaje puede ser más dificultoso.
La mejora en las técnicas de perfusión ha permitido la aplicación de una presión negativa de vacío que puede mejorar el drenaje venoso e incrementar el flujo entre el 20-40%25,26.
La inserción de estos catéteres aumenta el riesgo de lesiones vasculares que es proporcional al tamaño de las cánulas. Como en cualquier acceso vascular, pueden ocurrir lesiones traumáticas locales, así como lesiones de grandes vasos. La perforación de la aurícula derecha, las venas cavas u otras estructuras vasculares dentro del pericardio puede dar lugar a un taponamiento cardiaco16. Es por ello que todos los esfuerzos deben ir encaminados a una técnica estéril utilizando el método de Seldinger para minimizar las lesiones, y la utilización de la ecografía para la localización del punto de punción. El uso de dilatadores secuenciales con un incremento progresivo del diámetro favorece la introducción de la cánula (fig. 6C). Es recomendable la visualización de la guía intravascular y en la aurícula derecha tras la localización del acceso vascular27.
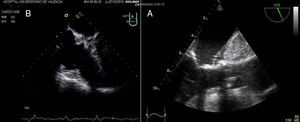
La correcta posición de las guías y de las cánulas insertadas a nivel de la vena femoral y vena yugular interna derecha debe confirmarse en el plano ecográfico medioesofágico 90°, plano bicava (fig. 8). Si no se inserta una cánula en la vena yugular interna, la cánula introducida por la vena femoral debería quedar en una posición al menos a 2-3cm en la vena cava superior. Si se decide la colocación de una segunda cánula en la vena yugular interna derecha, debe quedarse en la unión cavoauricular, y la cánula femoral posicionada en la vena cava inferior. Antes de la inserción de la cánula, la confirmación de la posición de la guía en la aurícula derecha es mandatoria para minimizar las complicaciones vasculares. Después de la inserción de la cánula es recomendable la realización de un test con suero salino agitado para asegurar la correcta posición endovascular de la cánula28.
Algunas instituciones utilizan el catéter endopulmonar (endopulmonary vent catheter Edwards Lifesciences, Irvine, CA, EE.UU.) en conjunción con una cánula venosa femoral larga, con el objetivo de descomprimir el corazón en lugar de la canulación de la vena yugular interna derecha. Su inserción es similar a la de un catéter de arteria pulmonar y la confirmación de su colocación se realiza mediante la ETE o fluoroscopia. Tiene un diseño especial con múltiples orificios distales para permitir el drenaje de aproximadamente 50ml/min para mejorar la exposición quirúrgica16. Esta estrategia es utilizada y aceptable en la CMIV ya que el acceso a la válvula mitral se realiza vía atriotomía izquierda en contraposición al abordaje vía transeptal utilizado con frecuencia en la cirugía convencional. Sin embargo, cuando es necesaria la apertura de la aurícula derecha, por ejemplo, por cirugía concomitante de cierre de defecto septal interauricular o cirugía sobre válvula tricúspide, la canulación bicava es obligatoria para evitar la entrada de aire en cavidades. Cuando se utiliza la canulación de la vena cava superior es necesaria la monitorización continua de la presión en la vena yugular interna derecha para confirmar el adecuado drenaje y evitar la congestión cerebral.
Canulación arterialIndependientemente del acceso arterial utilizado para la instauración del bypass cardiopulmonar vía percutánea central o canulación periférica o incluso mediante la canulación central directa, el papel del anestesiólogo resulta esencial para guiar la correcta posición de las cánulas mediante la ETE. La visualización de las guías por el cirujano para la inserción de las cánulas mediante técnica de Seldinger en la aorta descendente o ascendente es fundamental antes de la inserción de la cánula para evitar complicaciones vasculares (fig. 6D).
Como elemento fundamental de esta tecnología, inicialmente se utilizaba el balón aórtico intraluminal (endoclamp aortic catheter, Edwards Lifesciences, Irvine, CA, EE.UU.) para la realización del clampaje aórtico. Aunque, a lo largo de los años, se han hecho modificaciones, el concepto continúa siendo el mismo hoy día. El balón intraaórtico se coloca a través de un puerto lateral en forma de Y en la cánula arterial, y se avanza en la aorta descendente hasta llegar a la aorta ascendente. Este proceso requiere la monitorización continua con la ETE y la medición previa de los diámetros de la aorta. Alternativamente se puede insertar también a través de la arteria axilar o directamente vía cánula transtorácica. La visualización del endoclamp mediante la ETE en la aorta ascendente tiene que ser verificado en el plano medioesofágico, válvula aórtica, eje largo29,30.
La medición de la aorta es importante ya que diámetros mayores de 3,5cm pueden limitar la oclusión del flujo, y diámetros más pequeños pueden incrementar las posibilidades de migración del balón tras el inflado, así como el riesgo de lesión aórtica.
Tras la instauración de la circulación extracorpórea es necesario confirmar mediante la ETE que, con el hinchado del balón, el endoclamp permanece correctamente posicionado. El flujo de la cardioplejia debería ser visualizado mediante la ETE Doppler color. El posicionamiento por encima de la raíz aórtica es esencial para la adecuada administración de la cardioplejia y una cardioprotección adecuada. Por otra parte, la migración distal puede determinar la mala perfusión de los grandes vasos cerebrales. Este riesgo está presente a lo largo de todo el procedimiento. La monitorización de la migración distal del balón puede realizarse mediante la observación de las presiones arteriales invasivas en ambas extremidades superiores o, en lugar de la presión de la extremidad superior izquierda, emplearse la monitorización en arteria femoral. Una caída en la presión aislada del lado superior derecho indicaría una migración distal y una oclusión de la arteria innominada por el balón. La oximetría cerebral puede también ser utilizada, aunque puede haber falsos negativos con un polígono de Willis completo permeable. La migración proximal del balón puede limitar la oclusión aórtica, impedir la adecuada protección miocárdica y lesionar la válvula aórtica.
Por estas razones, está cada vez más extendida la aplicación de un pinzamiento externo utilizando un clamp transtorácico angulado denominado de Chitwood (Scanlan International Inc, Minneapolis MN, EE.UU.) que es guiado hacia la aorta ascendente mediante visión directa o mediante visión endoscópica. Se coloca también el catéter para la administración de cardioplejia anterógrada. Las ventajas y popularidad de esta técnica sobre el clásico port access están basadas en la facilidad de la técnica, la menor dependencia del control ecocardiográfico, menores costes económicos y menores riesgos vasculares y de disección de aorta. La elevación de la presión arterial puede ser el primer signo de disección, y la evaluación ecocardiográfica de la aorta ascendente y descendente tras la instauración del bypass descartarla, ya que los signos externos son más tardíos. El reconocimiento precoz de esta situación, y la instauración de flujo anterógrado puede minimizar los daños (fig. 7A).
Administración de cardioplejia en la cirugía cardiaca mínimamente invasivaEn la CMIV la administración de cardioplejia retrógrada vía catéter en el seno coronario puede ser difícil por la inserción del mismo, pero tiene la ventaja de permitir administrar la cardioplejia y realizar una cirugía completamente endoscópica. La canulación del seno coronario a través de un puerto desde una posición quirúrgica es factible aunque es imprescindible la confirmación de la posición exacta de la cánula mediante ecocardiografía (fig. 7B). Otra opción para la canulación del seno coronario es la inserción percutánea de un catéter desde la vena yugular interna derecha y posicionarlo en el seno coronario31. El catéter para la administración de cardioplejia retrógrada desde el seno coronario es insertado a través de un introductor de 11F. Es similar a un catéter de 3 luces con un balón al final que permite la oclusión del seno coronario, la medición de las presiones distales (la transmisión de una onda de aspecto ventricular confirma la correcta posición) y la infusión de la cardioplejia. Su inserción puede estar guiada por la ETE o por fluoroscopia. Es necesario garantizar un equilibrio en la inserción del catéter, para evitar introducirlo demasiado, asegurar la administración de cardioplejia a todos los segmentos y evitar posicionarlo muy cerca de su entrada con el riesgo de la malposición y dislocación con los movimientos quirúrgicos. A pesar de ello se ha sugerido que la distribución de la cardioplejia ocurre independientemente de la posición del catéter por la amplia red de colaterales dentro del sistema venoso cardiaco32.
Por las dificultades técnicas de la inserción del catéter en seno coronario, el mayor tiempo consumido en su inserción33, y el riesgo de complicaciones asociadas (rotura de seno coronario, perforación atrial34) no se ha popularizado ni extendido de manera uniforme. Por otra parte, la confianza de los cirujanos en que no es necesaria la administración de cardioplejia retrógrada para proteger el corazón, si se administra la cardioplejia anterógrada adecuadamente, ha determinado la escasa difusión de esta técnica. Indicaciones especiales, no absolutas, para la administración de cardioplejia retrógrada podrían ser los pacientes con hipertrofia ventricular muy significativa, casos en los que se prevén tiempos quirúrgicos largos, pacientes con historia previa de revascularización coronaria, en especial en aquellos con un injerto permeable de mamaria y en los pacientes con insuficiencia aórtica severa. Pacientes con cirugía previa de revascularización coronaria han sido sometidos con éxito a la CMIV sin cardioplejia retrógrada35.
En pacientes con miocardiopatía dilatada, baja fracción de eyección o aorta de porcelana, algunos autores proponen la técnica de cirugía con corazón latiendo o en fibrilación con resultados comparables a la cirugía con cardioplejia estándar36.
4Evaluación de la válvula mitral y del aparato subvalvularDadas las limitaciones del campo quirúrgico en la CMIV, la descripción detallada de los mecanismos de insuficiencia mitral y las medidas del anillo y del velo mitral anterior, resulta fundamental para el diseño en la estrategia quirúrgica28.
Para algunos grupos, la presencia de calcificación anular mitral severa constituye una contraindicación. El hallazgo de otra enfermedad concomitante que requiera intervención y que no pueda ser abordada por la minitoracotomía, debe ser valorada cuidadosamente antes de la incisión.
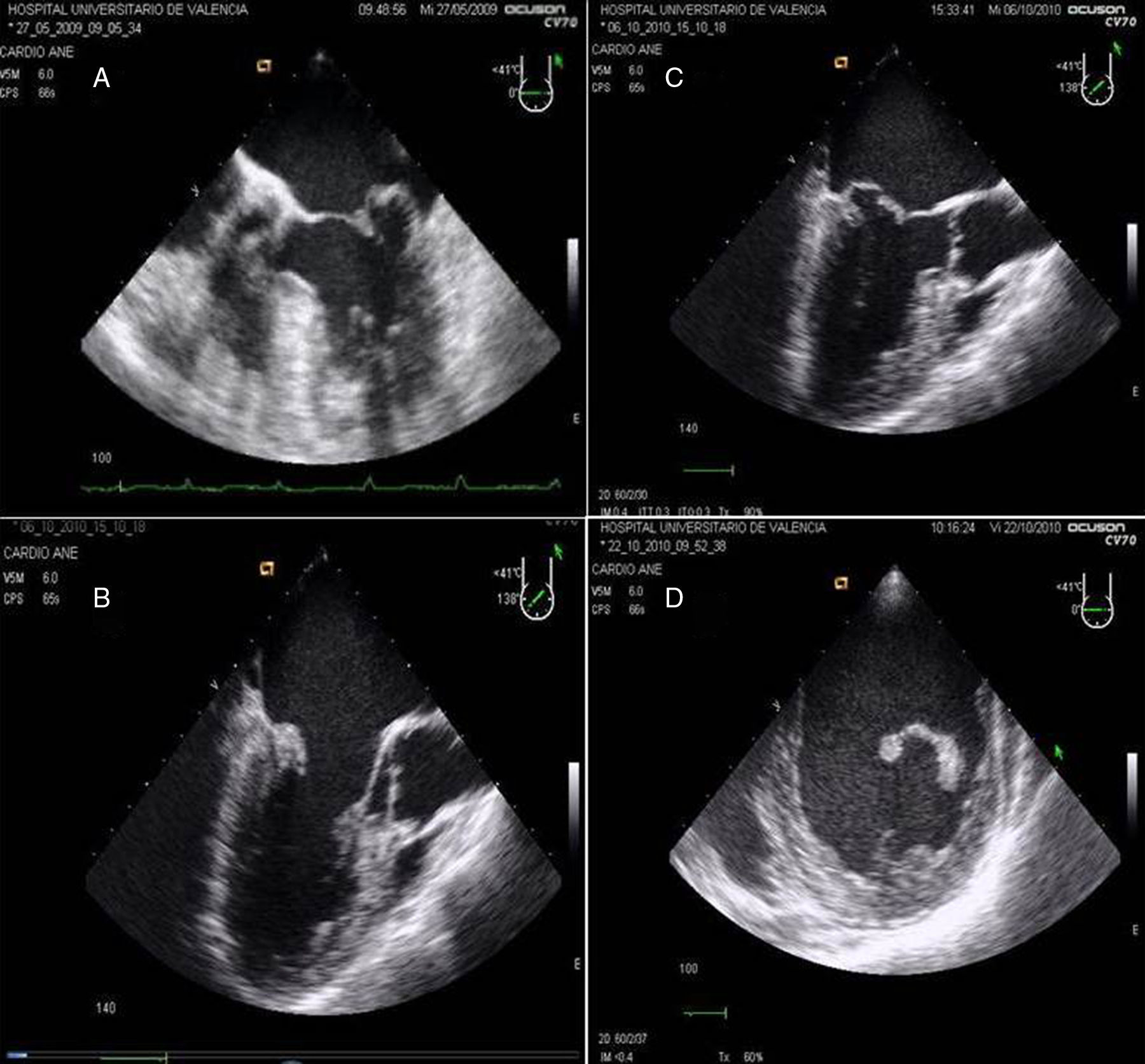
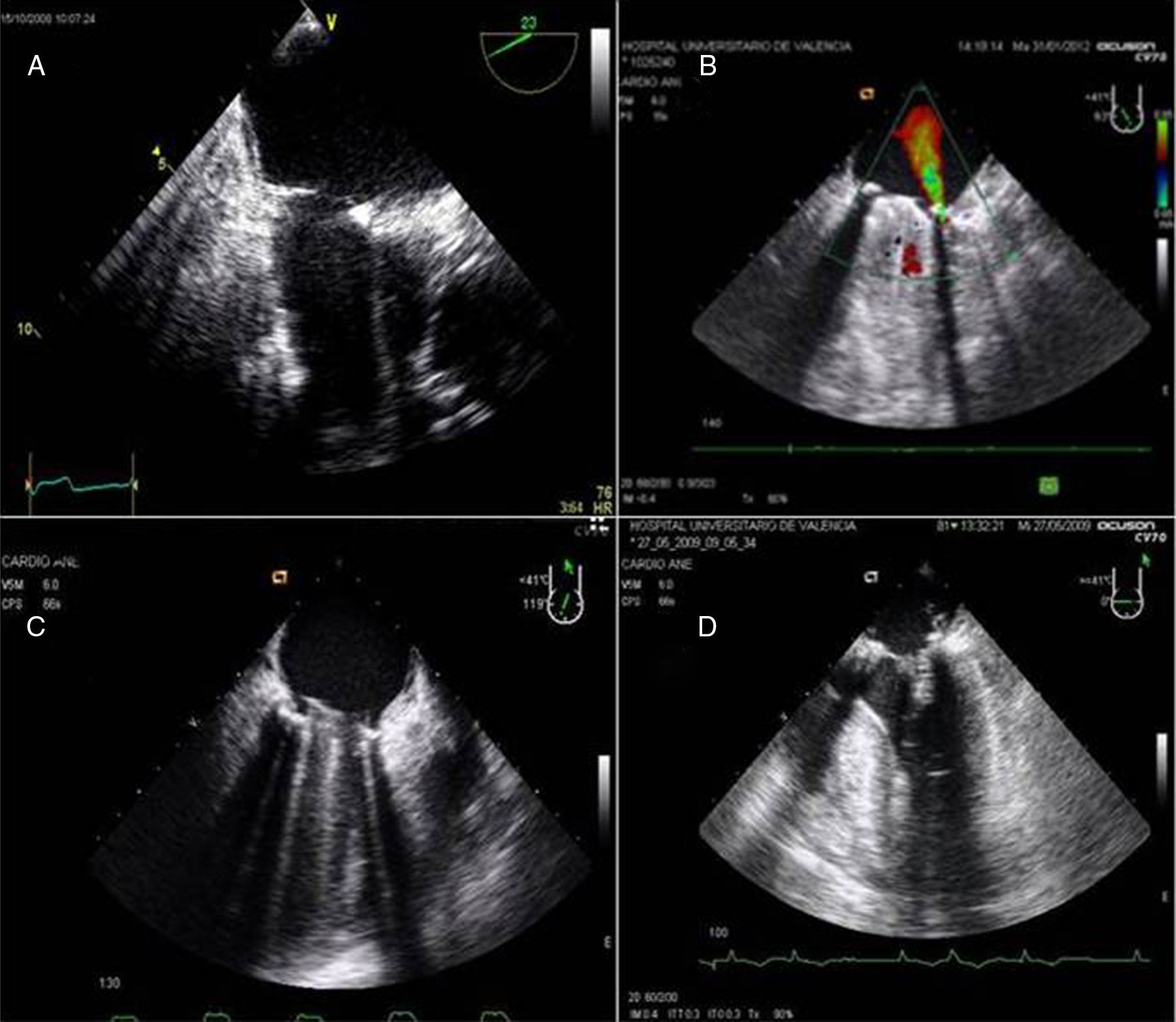
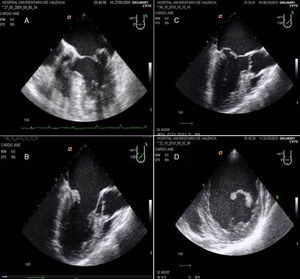
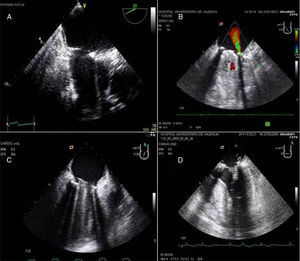
La evaluación de la válvula mitral se realiza por la ETE mediante los planos: medioesofágico 4 cámaras, 2 cámaras, plano bicomisural, 3 cámaras, plano transgástrico 2 cámaras eje largo y eje corto (fig. 8).
A) Plano medioesofágico 4 cámaras 0°. Evidencia de prolapso de velo posterior festón P2. B) Plano medioesofágico eje largo 3 cámaras para la medición de la longitud del velo anterior mitral. C) Plano medioesofágico eje largo 3 cámaras. Prolapso mitral de festón posterior P2 y anterior A2 en plano medioesofágico 3 cámaras. D) Plano transgástrico eje corto 0°. Ventrículo izquierdo de dimensiones aumentadas y pared posterior adelgazada.
En la evaluación ecocardiográfica es necesario medir las dimensiones del ventrículo izquierdo en sístole y diástole, del aparato subvalvular, los músculos papilares y las cuerdas tendinosas. El plano transgástrico permite la visualización de la válvula mitral y sus velos, así como el área de apertura y la visualización de todos los segmentos y las comisuras. En los planos medioesofágicos se puede valorar la movilidad y funcionalidad de la válvula. El valor de la ecocardiografía 3D en este campo es cada vez más importante por la mejora en la definición de la función y anatomía que ofrece37–40, especialmente en la enfermedad comisural.
Para la correcta selección de la técnica quirúrgica es necesario definir adecuadamente los segmentos patológicos y la causa de la disfunción. Así mismo, es recomendable la medición del velo anterior mitral en el plano medioesofágico, 3 cámaras, eje largo para orientar la selección del tamaño del anillo para la anuloplastia41.
Para la cuantificación de la severidad de la regurgitación mitral se emplean en el intraoperatorio:
- 1.
El cálculo del área del orificio de regurgitación efectivo (ORE) mediante el método del área de superficie de velocidades proximales (PISA). Es el parámetro más fiable cuando sea posible realizarlo. Sin embargo en los chorros excéntricos puede ser difícil de calcular (fig. 9A).
- 2.
La medición de la vena contracta: es la parte más estrecha del flujo de regurgitación con la máxima velocidad del flujo medido en el lado auricular a nivel de la punta de los velos mitrales (fig. 9B). Una vena contracta de <3mm se considera ligera, y >7mm es específica de regurgitación severa. Los valores intermedios se correlacionan pobremente con la severidad, por lo que debería ser utilizado otro método de cuantificación. La medición de la vena contracta es de gran utilidad para los flujos centrales y excéntricos, pero es difícil de aplicar en los chorros múltiples.
- 3.
La evaluación del flujo en las venas pulmonares: El flujo normal en las venas pulmonares se caracteriza por una onda S (relajación de la aurícula y llenado de la misma) mayor que una onda D (correspondiente a la contracción de la aurícula) y en la misma dirección. Con el incremento de la severidad de la regurgitación mitral, la velocidad de la onda sistólica S disminuye e incluso en ocasiones se invierte el flujo. En presencia de un jet excéntrico, la evaluación de todas las venas pulmonares debe realizarse con precaución.
- 4.
Otros métodos semicuantitativos pueden ser utilizados para cuantificar la severidad: Densidad de la señal del flujo regurgitante mediante Doppler continuo y el ratio entre el área del jet regurgitante en Doppler color/área de la aurícula izquierda (%).
Es necesario recordar que la evaluación intraoperatoria de la severidad de la regurgitación mitral con anestesia general puede infraestimarla debido a la alteración de precarga y poscarga42. La adecuación de las condiciones fisiológicas mediante fármacos y cambios del límite Nyquist puede compensar este efecto.
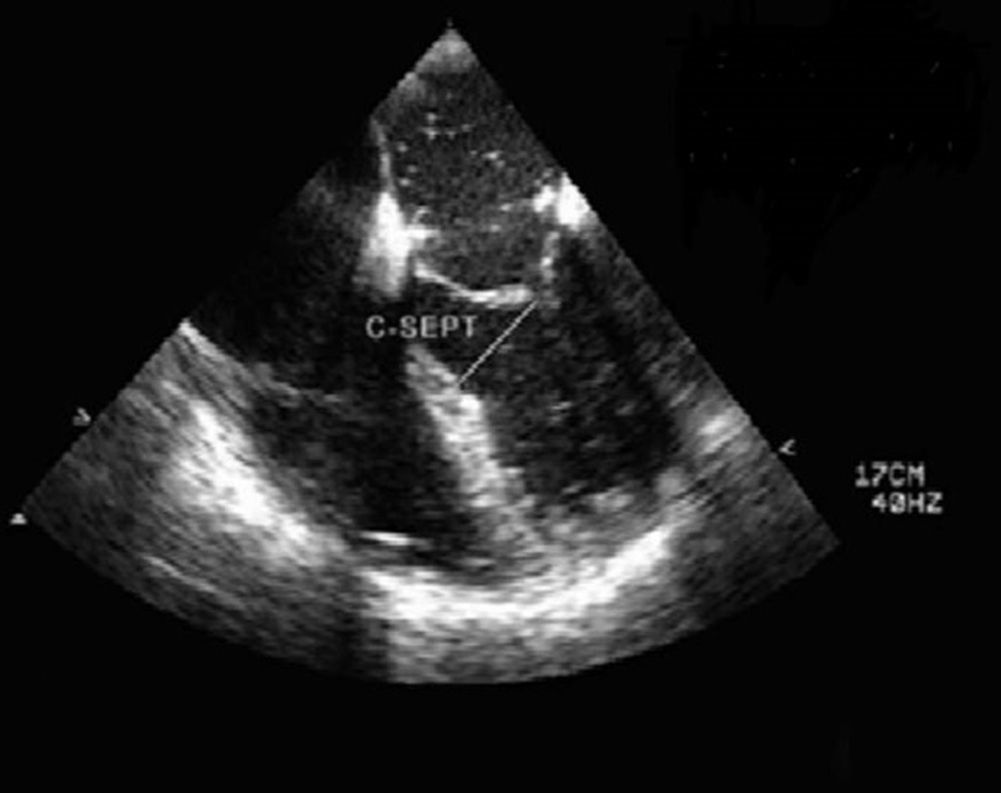
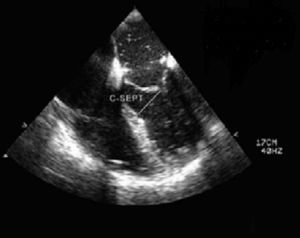
5Evaluación de factores de riesgo prequirúrgicos de movimiento sistólico anterior posreparación mitralEl movimiento sistólico anterior (SAM) secundario es una complicación única de la reparación mitral. La incidencia postoperatoria oscila entre el 1-16%28. El SAM puede aparecer como una protrusión mínima de una cuerda en el tracto de salida, o como una obstrucción completa del tracto de salida por el velo anterior mitral que comprometa la vida y con regurgitación mitral severa. En la ETE preoperatoria es muy importante la identificación de los factores de riesgo. El ratio entre la medición del velo anterior/posterior <1,4, la altura absoluta del velo posterior (>1,5cm), la hipertrofia septal >15mm y la distancia mínima desde el punto de coaptación hasta el septo (C-Sept, <2,5cm) pueden usarse como predictores de obstrucción dinámica al flujo en el tracto de salida y SAM posreparación43. Esta información es útil para adecuar la técnica quirúrgica y reducir el riesgo de SAM postoperatorio (fig. 10).
6Evaluación tras salida de circulación extracorpóreaLa evaluación tras salida de CEC se centra en los siguientes aspectos:
- 1.
Evaluación de la función de la global sistólica para salida de CEC y la posible lesión de la arteria circunfleja durante la colocación del anillo mitral.
- 2.
Correcto proceso de deaireación de cavidades.
- 3.
Evaluación de la insuficiencia mitral residual tras reparación o recambio.
- 4.
Evaluación de posible estenosis mitral.
- 5.
Evaluación de potenciales complicaciones de una reparación mitral (SAM, lesión de arteria circunfleja), evaluación de disección aórtica o hematoma aórtico.
- 6.
Evaluación de disección aórtica o hematoma aórtico.
Inmediatamente tras la liberación del pinzamiento aórtico, la visualización de la arteria circunfleja permite la detección precoz de una arteria comprometida si la visualización ha cambiado con respecto a la evaluación preoperatoria44. Con la ecocardiografía 3D podría definirse la causa de la distorsión.
Antes de la retirada de los catéteres de drenaje ventriculares es necesario comprobar ecográficamente la correcta deaireación de las cavidades cardiacas para evitar embolismos aéreos en las arterias coronarias (fig. 11A). El aire intracavitario es visualizado como burbujas ecodensas en los planos mediesofágicos.
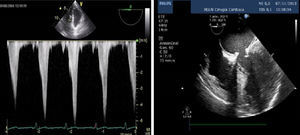
A) Burbuja aérea en aurícula izquierda. B) Plano medioesofágico 2 cámaras 90°. Sustitución valvular mitral con evidencia de fuga periprotésica tras salida de circulación de extracorpórea. C) Plano medioesofagico 2 cámaras. Válvula mitral protésica normofuncionante. D) Plano medioesofagico 4 cámaras 0°. Anuloplastia mitral por abordaje miniinvasivo.
La evaluación de la regurgitación mitral residual debe realizarse de forma completa y sistemática tras la salida de la CEC mediante los métodos descritos anteriormente (figs. 11B-D). La medición de gradientes tras la reparación es un aspecto más a valorar. Un gradiente medio de presión de >7mmHg medido con Doppler continuo se asocia a estenosis mitral significativa, aunque es necesario tomar con precaución estos gradientes. El estudio debe ser completado con una medición del área de apertura mediante planimetría en el plano transgástrico eje corto mediante 2D y, preferiblemente, mediante 3D.
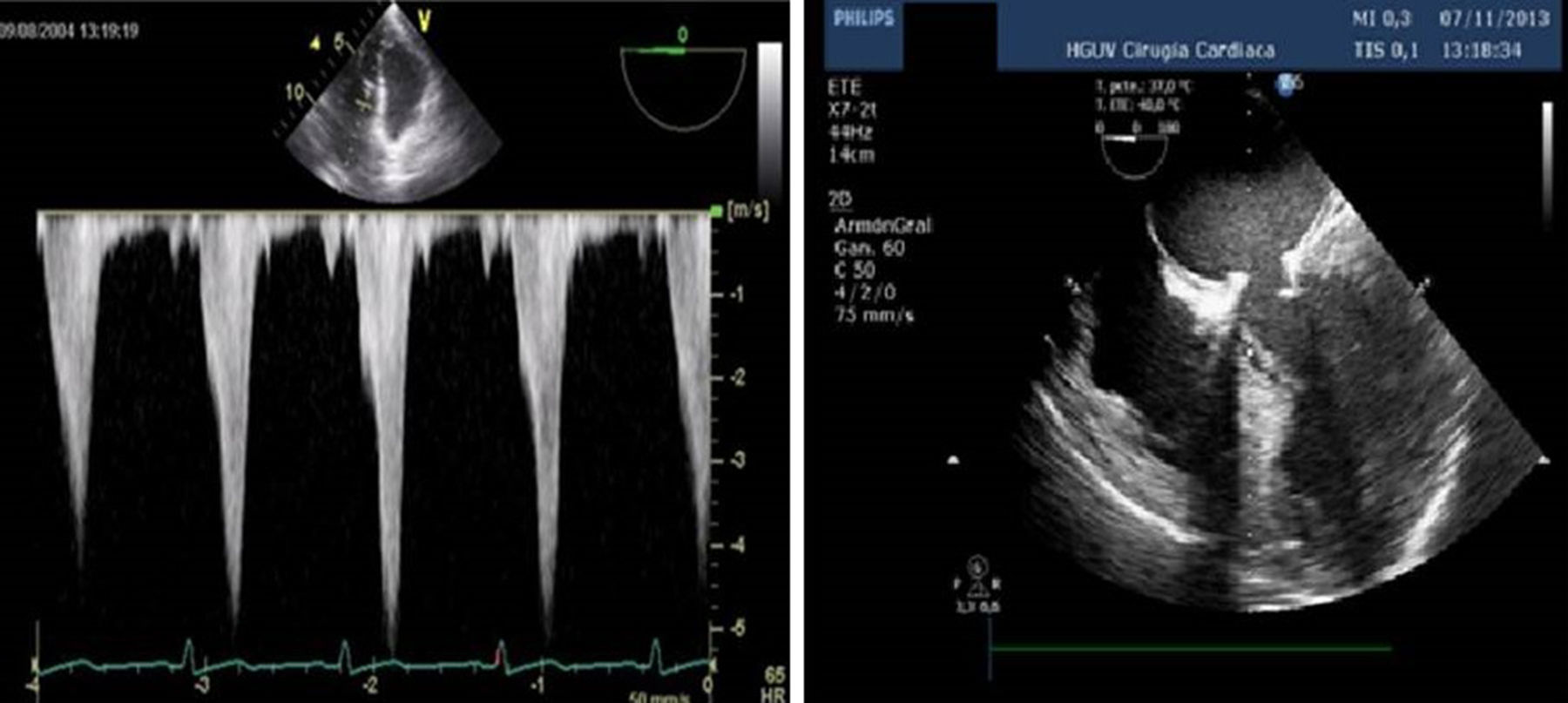
La obstrucción dinámica del tracto de salida acompañado de SAM es visualizada si está presente en el plano medioesofágico eje largo 5 cámaras o plano mediesofágico eje largo 3 cámaras. El Doppler continuo en el tracto de salida alineado con el flujo de eyección ofrece una característica onda en forma de daga debido a que el gradiente pico de presión ocurre al final de la sístole (fig. 12). Es recomendable realizar la medición de los gradientes en el plano transgástrico profundo o transgástrico eje largo, donde el Doppler está alienado con el flujo de salida.
Finalmente, la exclusión de una nueva regurgitación aórtica debido a la captura del velo no coronariano de la válvula aórtica por la sutura de la anuloplastia, una disección aórtica45 o una rotura ventricular46 debería ser parte del examen rutinario tras la salida de la CEC.
ConclusiónEn conclusión, la ETE intraoperatoria en la CMIV sobre válvula mitral es una técnica imprescindible, constituye una indicación mandatoria, y la información proporcionada durante las distintas fases de la intervención es de inestimable ayuda para incrementar la seguridad y calidad de la intervención y resultados en los pacientes sometidos a cirugía mínimamente invasiva de la válvula mitral.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.