El trasplante cardiaco tras un Fontan supone un reto quirúrgico. Presentamos a 10 pacientes, destacando las variantes técnicas en las anastomosis previas a la implantación del injerto.
MétodosRecogemos 8 casos de Fontan y 2 «take-down» consecutivos durante 32 meses, con medianas de edad (9 años), peso (30 kg) e intervalo entre Fontan y trasplante de 3 años. Siete pacientes presentaban conducto extracardiaco (diámetro 18/20), 2 conexión aurículo-pulmonar y uno, túnel lateral. Tres niños desarrollaron enteropatía pierde-proteínas. Nueve «stents» fueron implantados previamente.
ResultadosHubo modificaciones en las 5 anastomosis. Una vez en la aurícula izquierda (sutura en ambas aurículas del receptor), 2 en la aorta (hemiarco), 2 en vena cava superior (plastia en vena innominada), 7 veces en la arteria pulmonar (parche de aorta/pericardio donante de hilio a hilio tras retirada de «stents»), vena cava inferior en 7 ocasiones (manguito de conducto). El seguimiento fue completo con una mediana de 25 meses (rango 3-34). Un paciente falleció. Dos precisaron extracorporeal membrane oxygenation por hipertensión pulmonar. Tres pacientes requirieron cierre de colaterales en hemodinámica, incluyendo colocación de «stent» en cava superior (1) y aorta (1). Se resolvió la enteropatía pierde-proteínas en 2 pacientes.
ConclusionesTrasplantar a pacientes con Fontan previo es un reto. Podemos anticipar variantes en cada una de las 5 anastomosis previstas. Es recomendable obtener tejido extra del donante (aorta y arco, vena cava superior e innominada, pericardio). Los resultados pueden superponerse a otras series de trasplante cardiaco.
Heart transplantation after a Fontan procedure poses a unique challenge from a surgical point of view. The cases of ten patients are presented, stressing the technical variations performed in the five anastomoses in order to match the graft in the recipient.
MethodsEight Fontan and two takedown patients were included over 32 consecutive months. The median age was 9 years, median weight was 30 Kg, with a median time interval of 3 years between Fontan and transplant. An extra-cardiac conduit (size 18/20) was implanted in seven patients, whereas an atriopulmonary connection was found in two, and lateral tunnel in one. Three patients developed protein-losing enteropathy. Nine stents were previously implanted.
ResultsThe five anastomoses underwent some changes. Left atrium once (enlargement with recipient both atria), aorta twice (hemi-arch repair), superior vena cava twice (innominate donor plasty), pulmonary branches seven times (hilum to hilum plasty with donor aorta/pericardium patch after complete stent removal), and inferior vena cava seven times (conduit sleeve anastomoses). The patients were followed-up for a median of 25 months (range 5-34). One patient died. Extracorporeal membrane oxygenation was needed in two cases due to pulmonary hypertension. Three patients had collateral vessels occluded in the catheter laboratory, and stents placed in superior vena cava (1) and aorta (1). The protein-losing enteropathy was resolved in two children.
ConclusionsTransplant in Fontan patients is currently challenging. Variations in each of the five proposed anastomoses must be anticipated. Extra tissue from the donor (innominate vein, aortic arch, pericardium) is strongly advisable. Overall results can match other transplants cohorts.
En palabras del propio autor, incluso el «Fontan perfecto» se ve sometido a un lento deterioro (de causa multifactorial) haciendo que las cifras de supervivencia sean del 86% a los 5 años y del 74% a los 15 años1. Las diversas modificaciones de la técnica quirúrgica han mejorado los resultados, disminuyendo la morbimortalidad y la progresión hacia la insuficiencia cardiaca. Con todo, persiste una mortalidad tardía en esta paliación univentricular2-6. El «Fontan fracasado» se convierte así en una cohorte de pacientes susceptible de trasplante cardiaco7-14.
Debido a las distorsiones provocadas por las intervenciones quirúrgicas previas, el trasplante tras un Fontan precisa variantes técnicas respecto a un paciente convencional. La literatura es abundante al respecto15-21, de manera que prácticamente cualquier malformación congénita o distorsión tras procedimientos anteriores es abordable en el momento del trasplante. Aun así, el éxito depende de un trabajo en equipo, que comienza en la evaluación pretrasplante y continúa en el postoperatorio.
En el siguiente artículo, presentamos una serie de pacientes con fisiología de Fontan y sometidos a trasplante cardiaco. Revisamos la literatura, sin encontrar publicaciones en español al respecto. Los autores enfatizan las variantes técnicas realizadas, en un análisis secuencial de las anastomosis, a modo de algoritmo que facilite la estrategia quirúrgica.
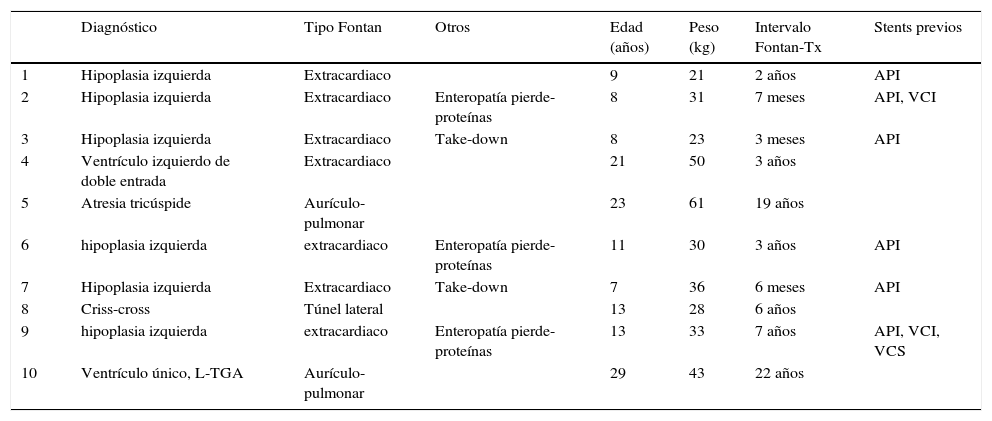
Material y métodosRecogemos datos de 10 pacientes trasplantados entre enero del 2013 y agosto del 2015 (32 meses). La mediana de edad fue de 9 años (rango 7-29), con 3 pacientes mayores de 18 años. La mediana de peso resultó 30 kg (rango 21-61). Como diagnóstico inicial, 7 de ellos presentaban hipoplasia de cavidades izquierdas. La técnica original consistió en un túnel extracardiaco en 7 casos (diámetro 18-20mm.), conexión aurículo-pulmonar en 2 y túnel intracardiaco en el restante (tabla 1). En el mismo periodo se realizaron 53 intervenciones tipo Fontan.
Datos demográficos
| Diagnóstico | Tipo Fontan | Otros | Edad (años) | Peso (kg) | Intervalo Fontan-Tx | Stents previos | |
|---|---|---|---|---|---|---|---|
| 1 | Hipoplasia izquierda | Extracardiaco | 9 | 21 | 2 años | API | |
| 2 | Hipoplasia izquierda | Extracardiaco | Enteropatía pierde-proteínas | 8 | 31 | 7 meses | API, VCI |
| 3 | Hipoplasia izquierda | Extracardiaco | Take-down | 8 | 23 | 3 meses | API |
| 4 | Ventrículo izquierdo de doble entrada | Extracardiaco | 21 | 50 | 3 años | ||
| 5 | Atresia tricúspide | Aurículo-pulmonar | 23 | 61 | 19 años | ||
| 6 | hipoplasia izquierda | extracardiaco | Enteropatía pierde-proteínas | 11 | 30 | 3 años | API |
| 7 | Hipoplasia izquierda | Extracardiaco | Take-down | 7 | 36 | 6 meses | API |
| 8 | Criss-cross | Túnel lateral | 13 | 28 | 6 años | ||
| 9 | hipoplasia izquierda | extracardiaco | Enteropatía pierde-proteínas | 13 | 33 | 7 años | API, VCI, VCS |
| 10 | Ventrículo único, L-TGA | Aurículo-pulmonar | 29 | 43 | 22 años |
API: arteria pulmonar izquierda; L-TGA: L-transposición de grandes arterias; VCI: vena cava inferior; VCS: vena cava superior.
El intervalo transcurrido entre el Fontan y el trasplante fue de una mediana de 3 años (rango 3 meses-22 años), siendo igual o inferior a 3 años en 6 de los pacientes. En 2 casos se procedió a un «take-down» del Fontan en las primeras 48 h. La indicación del trasplante fue disfunción ventricular y/o fracaso del circuito Fontan, además de enteropatía pierde-proteínas en 3 de ellos. Seis pacientes presentaban «stents» implantados previamente en 9 localizaciones: arteria pulmonar izquierda (6), vena cava inferior (VCI) (2) y arteria pulmonar derecha (1).
Como pruebas complementarias preoperatorias, se realizaron estudios de permeabilidad en sectores cervical e ílio-femoral (eco-Doppler, estudio hemodinámico) para valorar posibilidad de monitorización anestésica y canulación periférica, así como perfiles hepáticos en los 3 adultos para descartar hepatopatía asociada. Entre las pruebas de imagen resultó de gran utilidad la resonancia magnética (RM) o tomografía (particularmente en los casos de conexión aurículo-pulmonar) para definir trayectos y relaciones anatómicas (incluyendo adherencias de aurícula, ventrículo, aorta, conexión aurículo-pulmonar y vena innominada a esternón).
De manera rutinaria, el equipo quirúrgico extractor obtuvo tejido adicional del donante (aorta y arco incluido, vena cava superior (VCS) con innominada, parche de pericardio). Las ramas pulmonares no fueron disponibles por extracción pulmonar simultánea en 7 ocasiones.
ResultadosSe realizó trasplante con modificación de alguna de las 5 suturas (frente a la técnica tradicional de Shumway) en todos los pacientes (tabla 2). La canulación inicial para la circulación extracorpórea (CEC) fue periférica (arteria y vena femoral) en 2 de los adultos, siendo central en el resto (con drenaje accesorio de vena femoral en 3 casos más). Los tiempos de CEC e isquemia se reflejan en la tabla 3. La temperatura se redujo a 25°C para controlar el retorno de la circulación colateral, siendo precisa hipotermia profunda (18°C) con breves periodos de paro circulatorio en 6 casos (manipulación de ramas pulmonares y VCI).
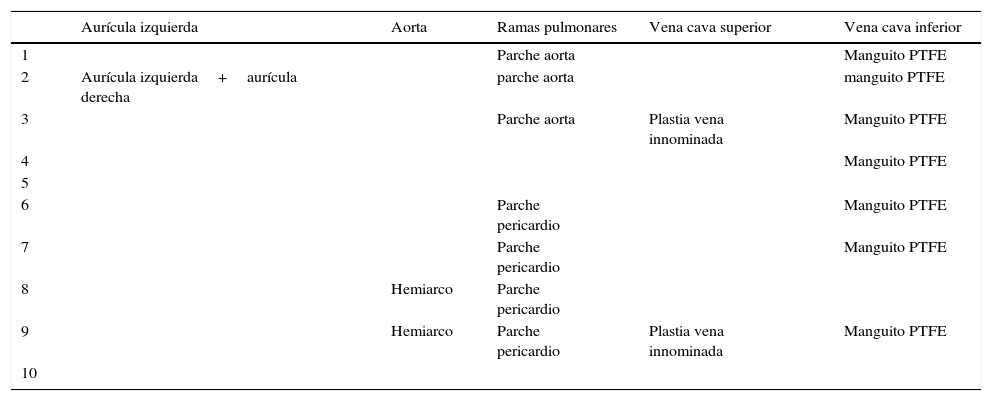
Modificaciones técnicas en las 5 anastomosis previas a trasplante
| Aurícula izquierda | Aorta | Ramas pulmonares | Vena cava superior | Vena cava inferior | |
|---|---|---|---|---|---|
| 1 | Parche aorta | Manguito PTFE | |||
| 2 | Aurícula izquierda+aurícula derecha | parche aorta | manguito PTFE | ||
| 3 | Parche aorta | Plastia vena innominada | Manguito PTFE | ||
| 4 | Manguito PTFE | ||||
| 5 | |||||
| 6 | Parche pericardio | Manguito PTFE | |||
| 7 | Parche pericardio | Manguito PTFE | |||
| 8 | Hemiarco | Parche pericardio | |||
| 9 | Hemiarco | Parche pericardio | Plastia vena innominada | Manguito PTFE | |
| 10 |
PTFE: poli-tetra-fluoroetileno-expandido.
Tiempos quirúrgicos, complicaciones y seguimiento
| Tiempo CEC (min) | Isquemia (min) | Post-op | Cateterismo | Evolución | |
|---|---|---|---|---|---|
| 1 | 186 | 140 | 34 meses | ||
| 2 | 465 | 283 | ECMO, sangrado | Cierre colaterales | 31 meses, no enteropatía |
| 3 | 431 | 260 | ECMO | Cierre colaterales, stent VCS | 31 meses |
| 4 | 120 | 273 | 29 meses | ||
| 5 | 290 | 239 | Sangrado | 27 meses | |
| 6 | 355 | 250 | plicatura Diafragma | Cierre colaterales, stent aorta | 25 meses, no enteropatía |
| 7 | 315 | 275 | Plicatura diafragma | 18 meses | |
| 8 | 265 | 287 | Sangrado | 12 meses | |
| 9 | 665 | 370 | Defunción | ||
| 10 | 269 | 264 | 5 meses |
ECMO: extracorporeal membrane oxygenation.
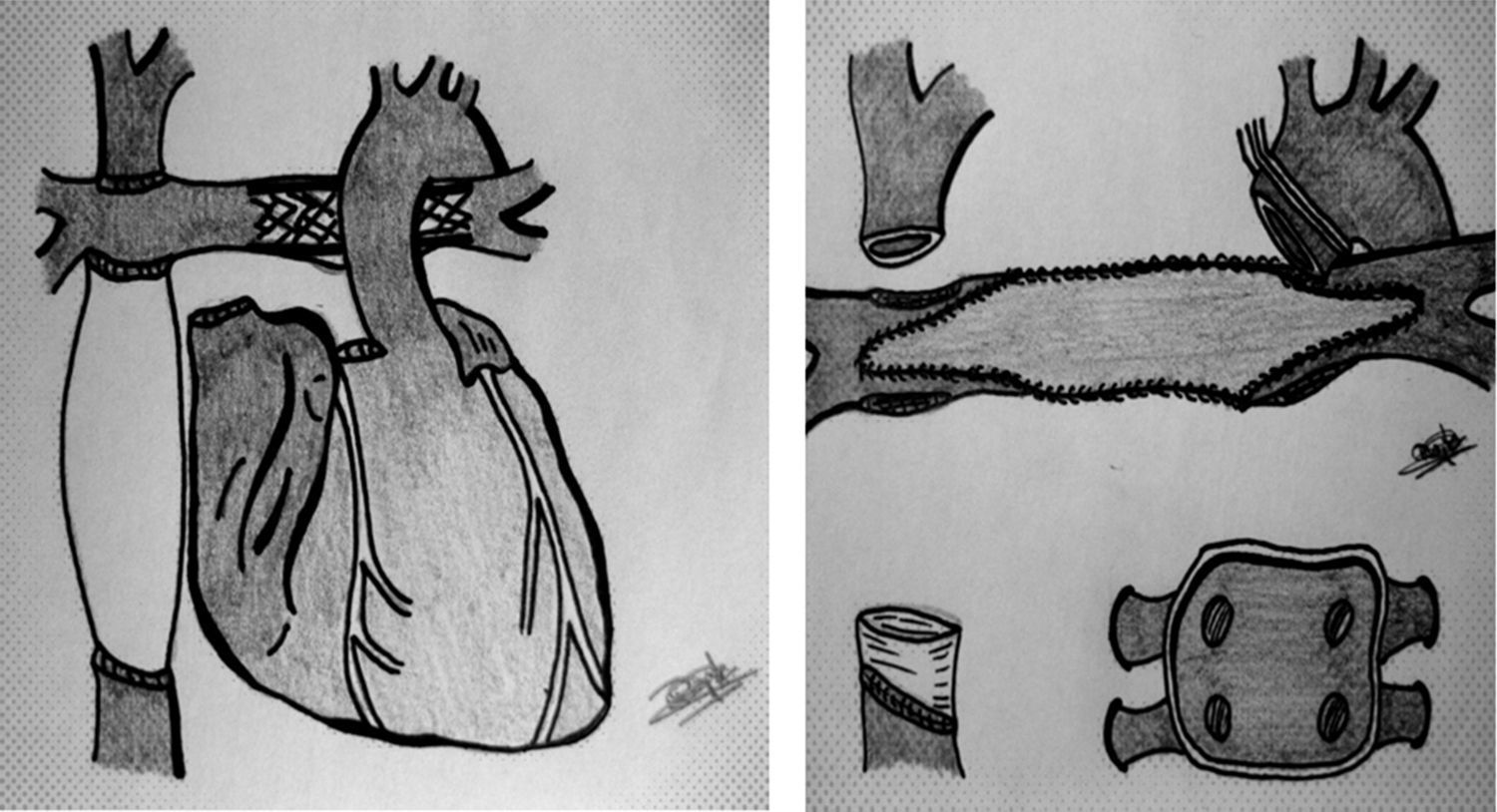
Las 5 anastomosis precisaron modificaciones en algún caso (tabla 2, fig. 1):
- 1.
Aurícula izquierda (un paciente). Ampliación de sutura abarcando el perímetro de ambas aurículas en el receptor, debido a presentar éste una aurícula izquierda muy pequeña.
- 2.
Aorta (2 pacientes). Anastomosis en hemiarco por aorta del receptor distorsionada (hipoplasia izquierda previa). Para ello se canuló selectivamente el tronco innominado derecho a través de una fístula de poli-tetra-fluoroetileno-expandido (PTFE) para el retorno arterial.
- 3.
Ramas pulmonares (7 pacientes). Ampliación de hilio a hilio de ambas ramas con parche del donante (aorta en 2 ocasiones y pericardio en cinco). Previamente, se extrajeron los «stents» en rama izquierda (6 casos) y derecha (un paciente).
- 4.
VCI (7 pacientes). En todos los casos que presentaban Fontan extracardiaco se dejó un manguito de PTFE de 1-2cm de longitud sobre el que suturar la aurícula derecha del donante. Además se retiró el «stent» presente en 2 de ellos.
- 5.
VCS (2 pacientes). Anastomosis directa a vena innominada debido a estenosis/trombosis de VCS en receptor.
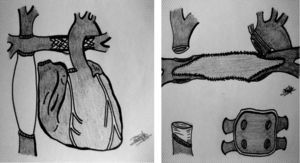
Esquema de conducto extracardiaco con stent en la arteria pulmonar izquierda. Campo quirúrgico tras desmontar el Glenn (vena cava superior) y conducto extracardiaco (manguito de PTFE en vena cava inferior), así como reconstrucción de ramas pulmonares con parche de pericardio/aorta del mismo donante (una vez retirado el stent).
El seguimiento ha sido completo (tabla 3), con una mediana de 25 meses (rango 5-34). Un paciente falleció en quirófano debido a sangrado difuso incoercible (9.° de la serie). Dos pacientes precisaron extracorporeal membrane oxygenation (ECMO) por hipertensión pulmonar. En 3 ocasiones se revisó quirúrgicamente por sangrado. Tres niños requirieron cierre de circulación colateral en hemodinámica, con implantación de «stent» en VCS (1) y aorta ascendente (1). Dos pacientes presentaron paresia frénica izquierda, precisando plicatura quirúrgica. La enteropatía pierde proteínas se resolvió en 2 pacientes en los primeros 3 meses.
DiscusiónConsideramos al Fontan como una «paliación definitiva», habida cuenta de la imposibilidad de conseguir una fisiología biventricular. La experiencia acumulada muestra cómo, tras múltiples variaciones de la descripción original, la tasa de fracaso a largo plazo es de un 26% a 15 años1. Podemos debatir sobre las causas últimas del deterioro12,13, tales como anatomía derecha/izquierda del ventrículo único, fracaso precoz/tardío, disfunción ventricular/circuito Fontan, etc., pero quedan lejos de los objetivos del presente trabajo.
El trasplante cardiaco tras un Fontan supone un reto desde el punto de vista técnico. A las dificultades propias de una reintervención (que puede tratarse de la cuarta esternotomía) se suman aspectos propios de la fisiopatología univentricular. Tratándose de pacientes que carecen de un ventrículo subpulmonar, las circulaciones pulmonar y sistémica se encuentran en serie. La precarga, crónicamente disminuida, predispone a una disfunción diastólica. Alteraciones en la poscarga (sistémica y/o pulmonar) anticipan fallo sistólico. Otros factores, no modificables, como la morfología ventricular, la heterotaxia, la aparición de enteropatía pierde-proteínas o la bronquitis plástica incrementan la morbilidad. En los pacientes adultos debe estudiarse también la función hepática14 y renal, ante la posibilidad de presentar «Fontan-associated liver disease» (FALD) que contraindique el trasplante cardiaco (o indique un trasplante combinado hepático y cardiaco).
Antes de considerar un trasplante en un paciente con Fontan, deben explorarse las posibilidades quirúrgicas e intervencionistas de mejorar la eficiencia de la circulación univentricular. Así, dilatación (incluidos «stents») de ramas pulmonares o aorta que disminuyan la poscarga, reparación de insuficiencias valvulares, resincronización en caso de arritmias, reconversión a Fontan extracardiaco22, etc. En general, y a pesar de la escasez de bibliografía al respecto, se considera el corazón univentricular como mal candidato a una asistencia circulatoria23 por la elevada mortalidad que presenta (más del doble —57,7% vs. 24,3%— que en biventricular).
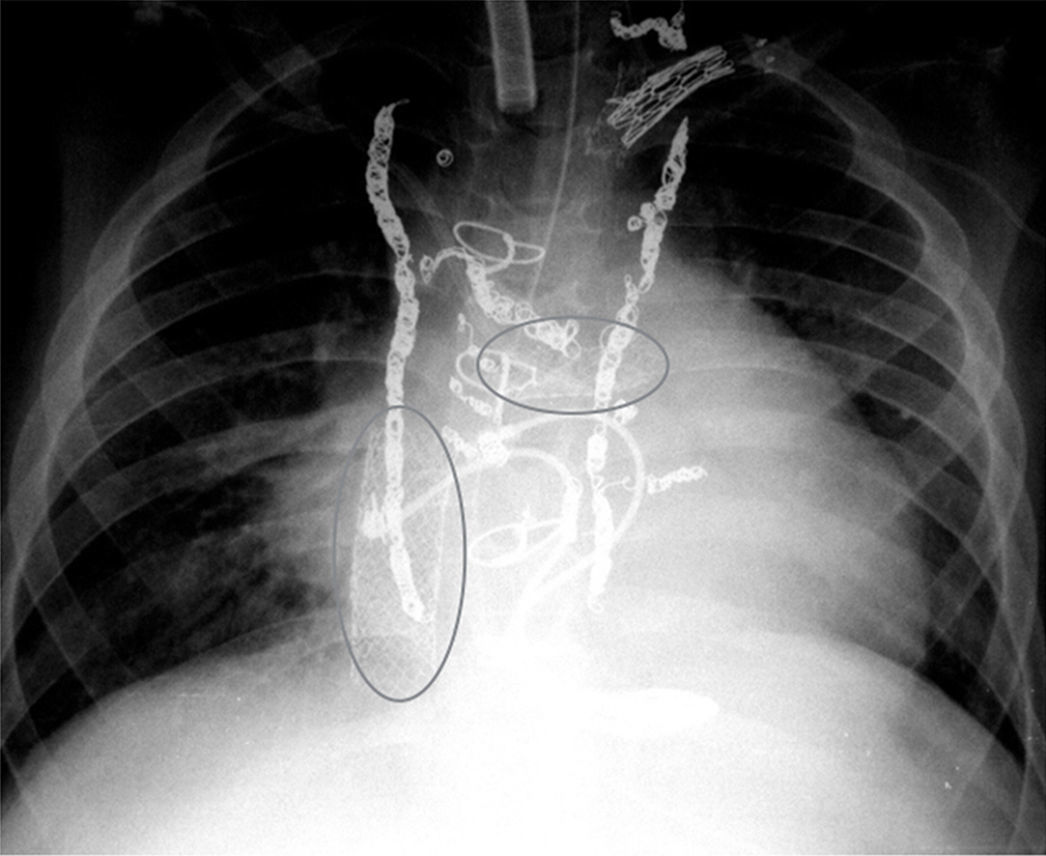
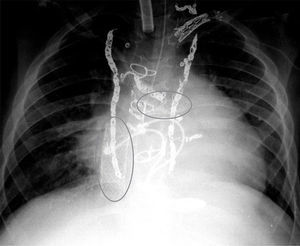
Las dificultades comienzan en la valoración pretrasplante, al tratarse de pacientes intervenidos y cateterizados en numerosas ocasiones (fig. 2) Esto supone múltiples transfusiones y material exógeno en las cirugías previas, con el consiguiente elevado título de anticuerpos linfocito-tóxicos. Por otro lado, las vías cervicales y femorales pueden no ser permeables. Además, no existe un método fiable de valorar la presión/resistencias pulmonares, con lo que, en la práctica, asumimos cierto grado de hipertensión pulmonar24. La planificación previa, así como una exquisita coordinación entre los equipos extractor e implantador, son clave en este tipo de cirugía.
Existen trabajos que sistematizan una estrategia a la hora de abordar estas intervenciones complejas14,25,26. De manera habitual el cirujano extractor nos proporciona tejido adicional del donante: aorta y arco, VCS con innominada, ramas pulmonares (en ausencia de extracción pulmonar) y pericardio. Igualmente, forma parte de nuestra rutina una aproximación por suturas, es decir, un algoritmo simple y reproducible mediante el que repasamos las posibles modificaciones técnicas por realizar en cada una de las anastomosis. Con toda la información disponible de antemano, sabemos qué vías son permeables (para anestesia y cirugía) y cómo abordar las variantes quirúrgicas en las distintas suturas por realizar, dejando así poco lugar a la improvisación.
En la tabla 2 se reflejan las diferentes modificaciones llevadas a cabo en los 10 pacientes. Comprobamos cómo las 5 suturas de la técnica bicava han sido modificadas en alguna ocasión (1-7 veces). Todas las variantes han sido descritas en trabajos anteriores15-21, de modo aislado, pero no como estrategia frente a reintervenciones complejas14,25,26. La diferencia de tamaño entre corazones de donante y receptor produjo un «mismatch» en la sutura de la aurícula izquierda en un paciente (solucionado al englobar ambas aurículas del receptor en la anastomosis) y en la aorta en 2 casos. En estos 2 últimos, debido a una distorsión por cirugías anteriores27, optamos por realizar una sutura en hemiarco y para ello canulamos previamente el primer tronco supraaórtico mediante una fístula de PTFE para el retorno arterial (de manera análoga a la cirugía de arco en neonatos). Obviamos de este modo la hipotermia profunda con paro circulatorio en la anastomosis de la aorta. La plastia de ramas pulmonares también se ha descrito recientemente como técnica asociada en los trasplantes tras un Fontan14,26, aunque con material exógeno (PTFE). Consideramos preferible la reconstrucción de hilio a hilio con pericardio o aorta del propio donante para disminuir el riesgo de infección sobre material extraño (fig. 1). Forma parte de nuestra rutina la retirada de «stents» implantados en procedimientos previos28 a la vez que reconstruimos las ramas pulmonares. En los Fontan extracardiacos dejamos un manguito de 1-2cm de longitud de PTFE para realizar la sutura de vena cava inferior (fig. 1). En 3 pacientes se canuló la vena femoral (en 2 casos para retirar un «stent»). Solo en 2 ocasiones hubo que modificar la sutura de cava superior, ampliándola hasta la vena innominada por estenosis en el receptor. La técnica bicava se justifica por el hecho de «desmontar» la sutura cavo-pulmonar superior (Glenn) en los Fontan extracardiacos (fig. 1). Globalmente, fueron precisos periodos de hipotermia profunda con paro circulatorio en las anastomosis de ramas pulmonares y VCI (ambas estructuras en campo quirúrgico profundo) y no así en arco aórtico (como ya citado más arriba). Debido a la complejidad de la técnica y sus modificaciones, 8 de los pacientes presentaron tiempos de isquemia miocárdica superiores las 4 h (salvo los casos n.° 1 y n.° 5). Por otro lado, no se precisaron cambios en las anastomosis de los pacientes n.° 5 y n.° 10 con Fontan tipo aurículo-pulmonar (salvo «deshacer» la sutura aurículo-pulmonar previa).
Invariablemente, cabe esperar complicaciones en el postoperatorio. Tres de nuestros pacientes fueron reintervenidos por sangrado (además del fallecido en quirófano). Es una complicación habitual por tratarse de una reintervención y con multitud de pequeñas colaterales6,11,12,14. No es infrecuente el fallecimiento intraoperatorio por dicha causa13, máxime si se asocia a coagulopatía y caquexia previas, como fue el caso. Dos pacientes requirieron ECMO por disfunción derecha causada por hipertensión pulmonar, descrito por otros autores24. Tres niños precisaron cierre de circulación colateral postrasplante29. Debe sospecharse la presencia de colaterales residuales ante la necesidad creciente de inotrópicos con buena función ventricular. La enteropatía pierde-proteínas se resolvió en 2 de los 3 pacientes (el restante fue el fallecido). Este hecho ya se había reportado previamente12, aunque se apunta como factor de riesgo en el postoperatorio inmediato por la predisposición infecciosa en el paciente trasplantado inmunodeprimido13.
Bernstein et al.10 publicaron en 2006 el primer estudio multicéntrico sobre trasplantes en Fontan. Desde entonces, son varias las series reportadas con más de 10 casos, recogidas en varios estudios multicéntricos recientes12-14. Todos coinciden en señalar una mortalidad hospitalaria cercana al 20%, claramente superior a la tasa de mortalidad en trasplantes por otras causas. De manera interesante, el grupo de Emory en Atlanta11, EE. UU., presenta cifras asombrosamente bajas como un 4%. Una revisión europea del 2015 aúna 61 pacientes de 11 centros a lo largo de 20 años13, lo que refleja la dispersión de casos y dificultad en acumular experiencia en trasplantes sobre Fontan en cada institución. En dicho trabajo13, un 26% de los pacientes provienen del grupo hipoplasia izquierda y un 72% son Fontan del tipo extracardiaco. Los diversos grupos enfatizan la importancia de un estudio preoperatorio que incluya estudio de permeabilidad de vías, técnicas de imagen (TC, RM) para definir las relaciones anatómicas con el esternón14, así como agotar las posibilidades de cirugía o intervencionismo convencional que mejore/demore el trasplante13. Aquí se incluyen cateterismo para oclusión de colaterales (fig. 2) o dilatación/stent de aorta y ramas pulmonares, cirugía de reparación valvular, reconversión a Fontan extracardiaco asociado a Maze, etc. Del mismo modo, se apuntan los mecanismos de «fracaso» de Fontan como disfunción del ventrículo único sistémico frente al malfuncionamiento del circuito Fontan subpulmonar (en ausencia de disfunción ventricular). Igualmente, el fracaso tardío (por disfunción ventricular) presenta mejor supervivencia (82% vs. 33% a 5 años) que el deterioro precoz (fracaso del circuito Fontan)12. Por tal motivo, la enteropatía pierde-proteínas (considerada como signo de fracaso del circuito Fontan) es indicador de inclusión en lista de trasplante en trabajos recientes13,14. Mención aparte merecen los casos de Fontan «take-down», que deben interpretarse como un caso genuino de fracaso precoz de Fontan (7% de pacientes en la serie europea, con una mortalidad del 25%13).
Desde el punto de vista quirúrgico, las series publicadas coinciden en la dificultad técnica del trasplante. Factores como reintervenciones previas, circulación colateral, coagulopatía, caquexia, etc. aumentan la complejidad de la intervención. La reconstrucción del sistema venoso (ambas cavas), de las ramas pulmonares (frecuentemente de hilio a hilio) y aorta (o arco aórtico) son habituales. Recordemos la importancia de la coordinación con el equipo extractor, además del tejido «extra» en el donante. Los tiempos de isquemia y CEC resultan prolongados. El uso de hipotermia profunda y paro circulatorio no es infrecuente… Ingredientes todos para esperar una morbimortalidad operatoria mayor de la habitual. A las complicaciones frecuentes de sangrado e hipertensión pulmonar (con fallo ventricular derecho) debe sumarse la presencia de circulación colateral residual. No es infrecuente visitar el laboratorio de hemodinámica para cierre de colaterales en el postoperatorio14,29.
Nuestra serie recoge 10 trasplantes consecutivos tras Fontan en un plazo inferior a 3 años, con un seguimiento de 25 meses (5-34). Siete son menores y 3 adultos. Siete presentan hipoplasia izquierda como diagnóstico de base. Seis se realizan antes de 3 años post-Fontan, incluidos 2 «take-down». Siete de los Fontan son de tipo extracardiaco, 2 aurículo-pulmonares y uno, túnel lateral. El estudio preoperatorio incluyó la permeabilidad de vías, facilitando la estrategia de canulación de antemano, así como técnicas de imagen (TC, RM) advirtiendo de posibles adherencias retroesternales. Mediante un análisis secuencial de anastomosis, a modo de algoritmo, planificamos las modificaciones en las diversas suturas de cada paciente (incluyendo retiradas de «stents» y periodos de hipotermia con paro circulatorio28). Nuestra estrategia trata de evitar al máximo la improvisación, tanto en técnicas como coordinación entre equipos extractor e implantador. En términos de mortalidad y complicaciones postoperatorias, nuestro resultado es superponible a lo publicado por otros grupos (salvando la brevedad de la serie y el escaso seguimiento).
Los buenos resultados actuales de la cirugía cardiaca infantil permiten que cada vez sean más los niños que llegan a adultos. Igualmente, es previsible que se incremente el número de pacientes paliados que sobrevivan y algunos precisen trasplante como tratamiento. Se prevé que hasta un 70% de los trasplantes en cardiopatías congénitas correspondan a fisiología univentricular30. En tal caso, el aumento de los posibles receptores nos aconsejaría apurar los tratamientos convencionales por un lado y a desarrollar estrategias quirúrgicas como las descritas en el presente trabajo, por otro lado.
ConclusionesDentro de los trasplantes en cardiopatías congénitas, el grupo de Fontan supone un reto quirúrgico y con un riesgo más alto. Junto a la planificación pre y postoperatoria, un análisis secuencial de cada una de las anastomosis facilita la estrategia quirúrgica. Tejido extra del donante (aorta, vena cava, ramas pulmonares, pericardio) permite realizar modificaciones técnicas en las diferentes suturas. Los resultados globales, peores a priori, pueden compararse con los trasplantes en otros grupos de cardiopatías congénitas.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.