El tratamiento de la estenosis aórtica grave sintomática se ha revolucionado con la técnica de reemplazo valvular aórtico transcatéter. El objeto del presente estudio es presentar la evolución y los predictores de mortalidad de los pacientes incluidos entre 2010 y 2011 en el Registro Nacional de Reemplazo Valvular Aórtico Transcatéter.
MétodosSe han recogido 131 variables previas al procedimiento; 31 perioperatorias y 76 de seguimiento clínico. Se ha analizado el éxito inmediato del implante, la variable combinada de seguridad a los 30 días y la mortalidad por cualquier causa a 30 días y al seguimiento máximo (media, 244 días).
ResultadosDesde enero de 2010 hasta diciembre de 2011, se ha incluido a 1.416 pacientes: 806 válvulas Edwards y 610 CoreValve. El éxito del implante y la mortalidad hospitalaria fueron del 94 y el 9% respectivamente, sin diferencias entre válvulas y accesos. La variable combinada de seguridad a 30 días y la mortalidad al seguimiento máximo fueron del 14 y el 16% del total respectivamente, también similares entre grupos de válvulas y accesos. La presencia de comorbilidades (insuficiencia renal, enfermedad vascular periférica, fracción de eyección y fibrilación auricular), la necesidad de conversión a cirugía y la insuficiencia aórtica al menos moderada tras el implante se identificaron como predictores independientes de mortalidad a medio plazo.
ConclusionesLa selección del paciente teniendo en cuenta su comorbilidad y la optimización del resultado para minimizar el grado de insuficiencia aórtica residual pueden mejorar el pronóstico de estos pacientes.
The treatment of severe symptomatic aortic stenosis has been revolutionized by the technique of transcatheter valve replacement. The purpose of this study was to present the outcomes and predictors of mortality in patients enrolled between 2010 and 2011 in the Transcatheter Aortic Valve Replacement National Registry.
MethodsWe collected 131 preprocedural, 31 periprocedural, and 76 follow-up variables, and analyzed the immediate implant success rate, the 30-day safety endpoint, and all-cause 30-day and mid-term (mean follow-up, 244 days) mortality.
ResultsFrom January 2010 to December 2011, a total of 1416 patients were included: 806 with Edwards valves and 610 with CoreValves. The implant success and 30-day mortality rates were 94% and 8%, respectively, without differences between types of valves and approaches. The 30-day safety endpoint and mid-term mortality rates were 14% and 16%, respectively, which were also similar between groups. The presence of comorbidities (renal failure, peripheral vascular disease, ejection fraction, and atrial fibrillation), the need for conversion to surgery, and at least moderate aortic regurgitation after transcatheter aortic valve implantation were identified as independent predictors of in-hospital and mid-term mortality.
ConclusionsThe prognosis of valve implant patients could be improved by including comorbidities in patient selection and by minimizing the degree of residual aortic regurgitation to optimize the results of the procedure.
El tratamiento de la estenosis aórtica grave sintomática ha evolucionado notablemente en los últimos años gracias al desarrollo de la técnica de implantación de válvula aórtica transcatéter (TAVI, transcatheter aortic valve implantation). Esta técnica se ha demostrado superior al tratamiento médico conservador para los pacientes no candidatos a cirugía1 y no inferior a la cirugía convencional para los pacientes de alto riesgo quirúrgico2. En este sentido, las nuevas guías de tratamiento de la enfermedad valvular elaboradas conjuntamente por la Sociedad Europea de Cardiología y la Sociedad Europea de Cirugía Cardiotorácica proporcionan a la TAVI un grado de recomendación I/B para pacientes no quirúrgicos y IIa/B para los de alto riesgo quirúrgico3. Asimismo, estas guías inciden en la necesidad de indicar la TAVI dentro del consenso de un «heart team» y que el procedimiento se lleve a cabo en un centro que cuente con un equipo de cirugía cardiaca3.
En 2010, se constituyó el Comité Nacional TAVI con el objetivo producir un registro nacional de los procedimientos que se llevaban practican en España y divulgar sus resultados. El número total de procedimientos se publica anualmente en el artículo del registro de actividad de la Sección de Hemodinámica y Cardiología Intervencionista4.
Desde la primera experiencia en España5, se han publicado los resultados de las válvulas implantadas en centros de alto volumen y mayoritariamente con un solo tipo de válvula6,7. Por lo tanto, los datos sobre otros tipos de válvulas y accesos que actualmente se utilizan de manera generalizada en España son escasos8. En consecuencia, el objetivo del presente estudio es determinar los resultados de los pacientes sometidos a tratamiento por medio de TAVI en una población representativa española desde 2010 e identificar los predictores de mortalidad hospitalaria y al seguimiento máximo.
MétodosSelección de pacientesEl Comité Nacional TAVI es un proyecto de colaboración entre la Sección de Hemodinámica y Cardiología Intervencionista de la Sociedad Española de Cardiología y la Sociedad Española de Cirugía Torácica-Cardiovascular que tiene como objetivos: conocer la actividad de TAVI en España, establecer los resultados de estas terapias en nuestro entorno, desarrollar estudios científicos basados en los datos acumulados en el registro, establecer recomendaciones de tratamiento relacionados con los procedimientos de TAVI y colaborar en registros similares internacionales. Son miembros natos de este comité, tres cardiólogos intervencionistas, tres cirujanos cardiacos, un cardiólogo clínico y un miembro de la Junta de la Sección de Hemodinámica y Cardiología Intervencionista como responsable del registro. Este comité se renueva en periodos de 3 años. No existe una financiación específica para este registro, aunque las empresas Edwards, Medtronic y Boston Scientific han hecho donación de una beca no restringida a la Sociedad Española de Cardiología. El diseño del registro y la publicación de estos datos son responsabilidad exclusiva de los miembros del Comité Nacional TAVI, sin intervención de ningún ente de la industria. La realización de este registro cumple con la ley de protección de datos y ha sido aprobada por un comité de ética central. La participación de los centros en este registro es voluntaria.
En este registro se han recogido los datos individualizados de los pacientes sometidos a TAVI desde 2010 por medio de un cuaderno de recogida de datos electrónico. Se recogen 131 varia-bles preoperatorias; 31 perioperatorias y 76 de seguimiento clínico. De estas, aproximadamente un 75% son variables de cumplimentación obligatoria.
Variables del estudioSiguiendo las recomendaciones de la Valve Academic Research Consortium9, se evaluó el éxito inmediato del implante y la variable combinada de seguridad a los 30 días (muerte de cualquier causa, accidente cerebrovascular mayor, hemorragia con riesgo vital, infarto de miocardio, lesión renal aguda de escala RIFLE tipo 3 y reintervención por disfunción valvular). Asimismo, se evaluó la mortalidad por cualquier causa a 30 días y al seguimiento máximo.
Descripción de los dispositivosEl registro está abierto a cualquier tipo de dispositivo comercializado. Hasta hoy, solo se han incluido dos tipos de válvulas: Medtronic CoreValveTM y Edwards SAPIENTM. Esta presenta la posibilidad de implantarla por vía femoral, transapical o transaórtica, mientras que la primera puede implantarse por vía femoral, subclavioaxilar o transaórtica. Los datos técnicos de estos dispositivos ya se han descrito previamente10.
Análisis estadísticoLas variables continuas se presentan como media±desviación estándar y las categóricas, como frecuencias y porcentajes. Para el análisis, las variables continuas se compararon mediante la prueba de la t de Student o el análisis de la varianza y las categóricas, mediante la prueba de la χ2 o la exacta de Fisher, según procediera. Se ha utilizado un modelo de regresión logística para identificar los predictores de mortalidad hospitalaria introduciendo las variables con p<0,05 en el análisis univariable (edad, enfermedad vascular periférica, aclaramiento de creatinina, EuroSCORE y gradiente pico) y las clínicamente relevantes (tipo de válvula empleada y acceso apical o no). El método utilizado es por pasos hacia atrás. Los resultados se expresan como odds ratio y su intervalo de confianza del 95% (IC95%). El análisis multivariable para la predicción de mortalidad en el seguimiento se llevó a cabo mediante regresión de Cox, incluyendo todas las variables que resultaron significativas en el análisis univariable (sexo, fracción de eyección del ventrículo izquierdo, EuroSCORE, fallo implante dispositivo, conversión a cirugía tras el implante e insuficiencia aórtica tras el implante) y las que se consideró clínicamente relevantes (tipo de válvula empleada y acceso apical o no). Los resultados se expresan en hazard ratio y su IC95%. La curva de supervivencia se ha obtenido mediante el método de Kaplan-Meier. Para comparar la supervivencia entre grupos con la variable mortalidad en el seguimiento, se ha empleado el test de Breslow. El análisis estadístico se realizó con el software SPSS 15.0 para Windows (SPSS Inc.; Chicago, Illinois, Estados Unidos). Para evaluar la representatividad del registro nacional TAVI, se ha calculado la razón entre pacientes incluidos en el registro y válvulas facturadas durante el periodo de reclutamiento.
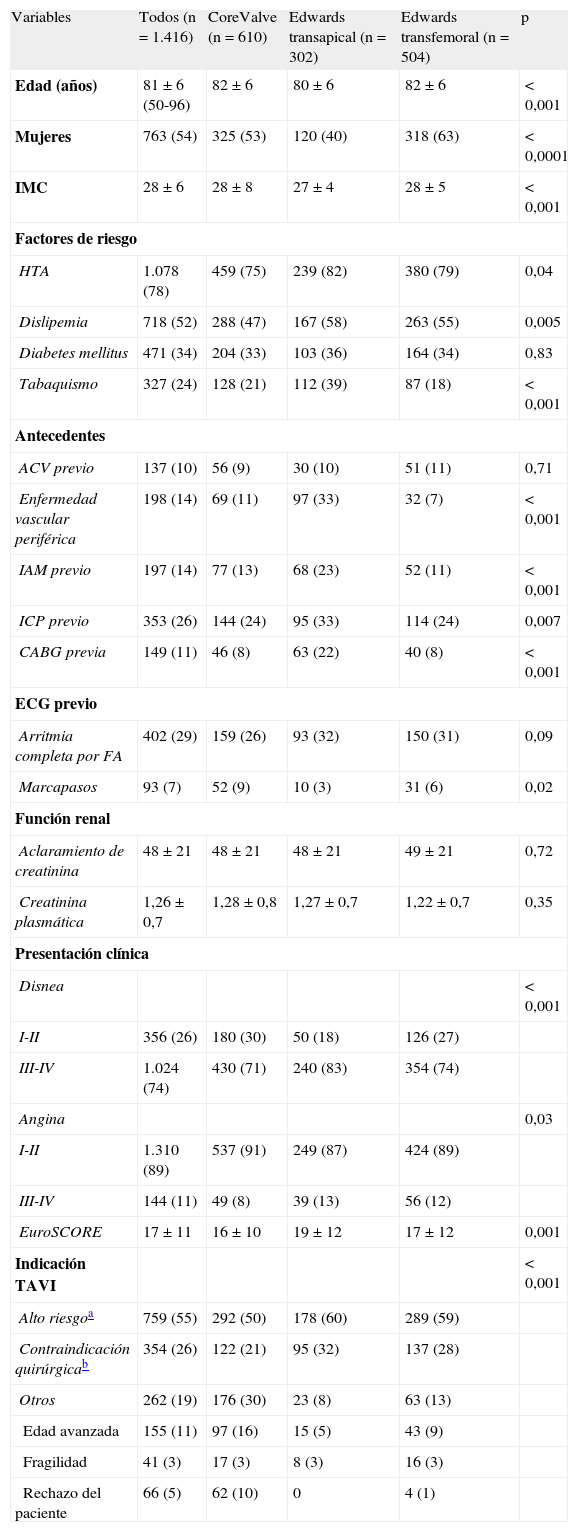
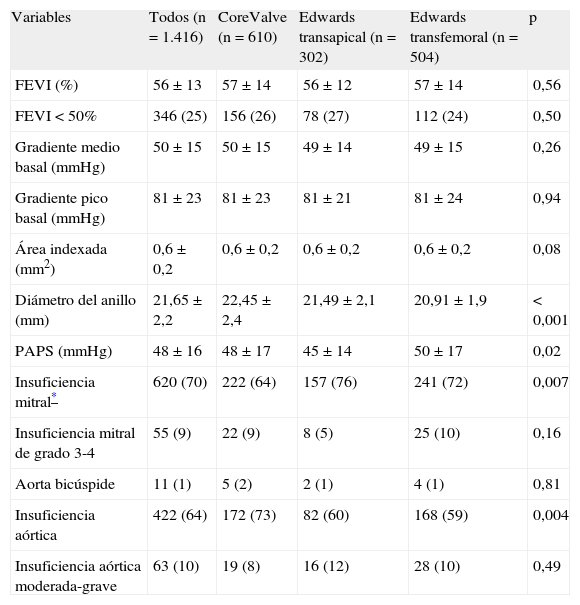
ResultadosCaracterísticas basalesDesde enero de 2010, se ha incluido en el registro TAVI a 1.416 pacientes. Esto representa el 80% del total de válvulas implantadas en España desde esa fecha (de un total de 1.767, según datos obtenidos de las dos empresas vendedoras de prótesis transcatéter: Medtronic Ibérica SA, Madrid, y Edwards Lifesciences España SL, Paterna, Valencia). Se ha incluido a 806 pacientes con válvula Edwards (el 80% del total de válvulas vendidas) y 610 pacientes con válvula Medtronic CoreValve (el 81% del total vendido). Por acceso y número de válvulas implantadas, se ha informado un mayor porcentaje de válvulas por acceso transfemoral que por acceso transapical: el 82% (1.114/1.359) frente al 74% (302/408) (p<0,0001). Las características basales de toda la población y estratificando por tipo de acceso y válvula se presentan en la tabla 1. El grupo de pacientes con implantación transapical de la prótesis eran significativamente más jóvenes, con menor porcentaje de mujeres, y presentaban con mayor frecuencia enfermedad vascular periférica, infarto de miocardio previo y revascularización percutánea o quirúrgica previa. En general, el EuroSCORE de este grupo de pacientes era significativamente más elevado que el de los grupos de implante transfemoral de Edwards o CoreValve. La contraindicación quirúrgica1 y el alto riesgo definido por un EuroSCORE>152 fueron las indicaciones clínicas en alrededor de un 90% de los pacientes tratados con la válvula Edwards y un 70% de los tratados con CoreValve (tabla 1). Los datos de la ecocardiografía basal se presentan en la tabla 2. No hubo diferencias clínicamente relevantes entre los tipos de válvulas y accesos, a excepción de un tamaño de anillo significativamente mayor en los pacientes tratados con CoreValve.
Características basales de la población y por tipo de válvula y acceso
| Variables | Todos (n=1.416) | CoreValve (n=610) | Edwards transapical (n=302) | Edwards transfemoral (n=504) | p |
| Edad (años) | 81±6 (50-96) | 82±6 | 80±6 | 82±6 | <0,001 |
| Mujeres | 763 (54) | 325 (53) | 120 (40) | 318 (63) | <0,0001 |
| IMC | 28±6 | 28±8 | 27±4 | 28±5 | <0,001 |
| Factores de riesgo | |||||
| HTA | 1.078 (78) | 459 (75) | 239 (82) | 380 (79) | 0,04 |
| Dislipemia | 718 (52) | 288 (47) | 167 (58) | 263 (55) | 0,005 |
| Diabetes mellitus | 471 (34) | 204 (33) | 103 (36) | 164 (34) | 0,83 |
| Tabaquismo | 327 (24) | 128 (21) | 112 (39) | 87 (18) | <0,001 |
| Antecedentes | |||||
| ACV previo | 137 (10) | 56 (9) | 30 (10) | 51 (11) | 0,71 |
| Enfermedad vascular periférica | 198 (14) | 69 (11) | 97 (33) | 32 (7) | <0,001 |
| IAM previo | 197 (14) | 77 (13) | 68 (23) | 52 (11) | <0,001 |
| ICP previo | 353 (26) | 144 (24) | 95 (33) | 114 (24) | 0,007 |
| CABG previa | 149 (11) | 46 (8) | 63 (22) | 40 (8) | <0,001 |
| ECG previo | |||||
| Arritmia completa por FA | 402 (29) | 159 (26) | 93 (32) | 150 (31) | 0,09 |
| Marcapasos | 93 (7) | 52 (9) | 10 (3) | 31 (6) | 0,02 |
| Función renal | |||||
| Aclaramiento de creatinina | 48±21 | 48±21 | 48±21 | 49±21 | 0,72 |
| Creatinina plasmática | 1,26±0,7 | 1,28±0,8 | 1,27±0,7 | 1,22±0,7 | 0,35 |
| Presentación clínica | |||||
| Disnea | <0,001 | ||||
| I-II | 356 (26) | 180 (30) | 50 (18) | 126 (27) | |
| III-IV | 1.024 (74) | 430 (71) | 240 (83) | 354 (74) | |
| Angina | 0,03 | ||||
| I-II | 1.310 (89) | 537 (91) | 249 (87) | 424 (89) | |
| III-IV | 144 (11) | 49 (8) | 39 (13) | 56 (12) | |
| EuroSCORE | 17±11 | 16±10 | 19±12 | 17±12 | 0,001 |
| Indicación TAVI | <0,001 | ||||
| Alto riesgoa | 759 (55) | 292 (50) | 178 (60) | 289 (59) | |
| Contraindicación quirúrgicab | 354 (26) | 122 (21) | 95 (32) | 137 (28) | |
| Otros | 262 (19) | 176 (30) | 23 (8) | 63 (13) | |
| Edad avanzada | 155 (11) | 97 (16) | 15 (5) | 43 (9) | |
| Fragilidad | 41 (3) | 17 (3) | 8 (3) | 16 (3) | |
| Rechazo del paciente | 66 (5) | 62 (10) | 0 | 4 (1) | |
ACV: accidente cerebrovascular; CABG: cirugía de revascularización aortocoronaria; ECG: electrocardiograma; FA: fibrilación auricular; HTA: hipertensión arterial; IAM: infarto agudo de miocardio; ICP: intervencionismo coronario percutáneo; IMC: índice de masa corporal; TAVI: implantación de válvula aórtica transcatéter.
Los valores expresan n (%) o media±desviación estándar (intervalo).
Características ecocardiográficas basales de la población y por tipo de válvula y acceso
| Variables | Todos (n=1.416) | CoreValve (n=610) | Edwards transapical (n=302) | Edwards transfemoral (n=504) | p |
| FEVI (%) | 56±13 | 57±14 | 56±12 | 57±14 | 0,56 |
| FEVI<50% | 346 (25) | 156 (26) | 78 (27) | 112 (24) | 0,50 |
| Gradiente medio basal (mmHg) | 50±15 | 50±15 | 49±14 | 49±15 | 0,26 |
| Gradiente pico basal (mmHg) | 81±23 | 81±23 | 81±21 | 81±24 | 0,94 |
| Área indexada (mm2) | 0,6±0,2 | 0,6±0,2 | 0,6±0,2 | 0,6±0,2 | 0,08 |
| Diámetro del anillo (mm) | 21,65±2,2 | 22,45±2,4 | 21,49±2,1 | 20,91±1,9 | <0,001 |
| PAPS (mmHg) | 48±16 | 48±17 | 45±14 | 50±17 | 0,02 |
| Insuficiencia mitral* | 620 (70) | 222 (64) | 157 (76) | 241 (72) | 0,007 |
| Insuficiencia mitral de grado 3-4 | 55 (9) | 22 (9) | 8 (5) | 25 (10) | 0,16 |
| Aorta bicúspide | 11 (1) | 5 (2) | 2 (1) | 4 (1) | 0,81 |
| Insuficiencia aórtica | 422 (64) | 172 (73) | 82 (60) | 168 (59) | 0,004 |
| Insuficiencia aórtica moderada-grave | 63 (10) | 19 (8) | 16 (12) | 28 (10) | 0,49 |
FEVI: fracción de eyección del ventrículo izquierdo; PAPS: presión arterial pulmonar sistólica.
Los valores expresan n (%) o media±desviación estándar.
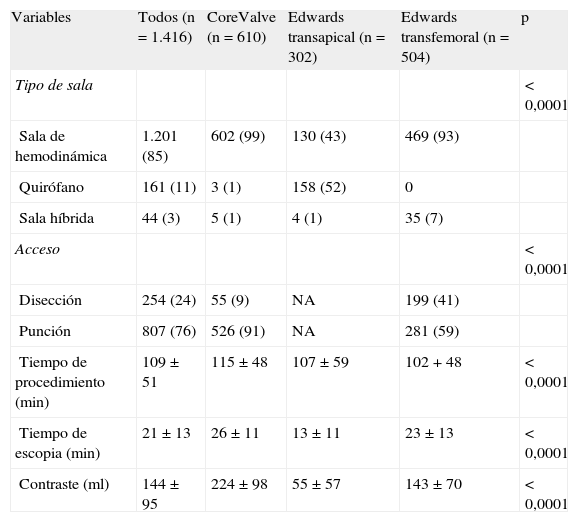
Los datos de procedimiento de presentan en la tabla 3. El procedimiento se llevó a cabo muy mayoritariamente en la sala de hemodinámica en los casos de acceso transfemoral, y se repartieron bastante paritariamente entre quirófano de cirugía cardiovascular y la sala de hemodinámica en los de acceso transapical. La sala híbrida solo estuvo disponible para un 3% de los procedimientos. Para los procedimientos con acceso transfemoral, la punción —en contraposición a la disección femoral— fue mayoritaria (el 76% de la población general; el 91% de los casos de CoreValve frente al 59% de los casos de Edwards; p<0,0001). El tamaño de la prótesis implantada en los casos de CoreValve fue 26 mm en el 61% de los casos; 29 mm en el 39% y 31 mm en el 0,3%. Para los casos de Edwards, el tamaño fue 23 mm en el 54% de los casos; 26 mm en el 43%, 29 mm en el 3,4% y 20 mm en el 0,3%. El tiempo de procedimiento, el tiempo de escopia y el volumen de contraste fueron significativamente mayores en los procedimientos con CoreValve.
Datos de procedimiento de toda la población y por tipo de válvula y acceso
| Variables | Todos (n=1.416) | CoreValve (n=610) | Edwards transapical (n=302) | Edwards transfemoral (n=504) | p |
| Tipo de sala | <0,0001 | ||||
| Sala de hemodinámica | 1.201 (85) | 602 (99) | 130 (43) | 469 (93) | |
| Quirófano | 161 (11) | 3 (1) | 158 (52) | 0 | |
| Sala híbrida | 44 (3) | 5 (1) | 4 (1) | 35 (7) | |
| Acceso | <0,0001 | ||||
| Disección | 254 (24) | 55 (9) | NA | 199 (41) | |
| Punción | 807 (76) | 526 (91) | NA | 281 (59) | |
| Tiempo de procedimiento (min) | 109±51 | 115±48 | 107±59 | 102+48 | <0,0001 |
| Tiempo de escopia (min) | 21±13 | 26±11 | 13±11 | 23±13 | <0,0001 |
| Contraste (ml) | 144±95 | 224±98 | 55±57 | 143±70 | <0,0001 |
NA: no aplicable.
Los valores expresan n (%) o media±desviación estándar.
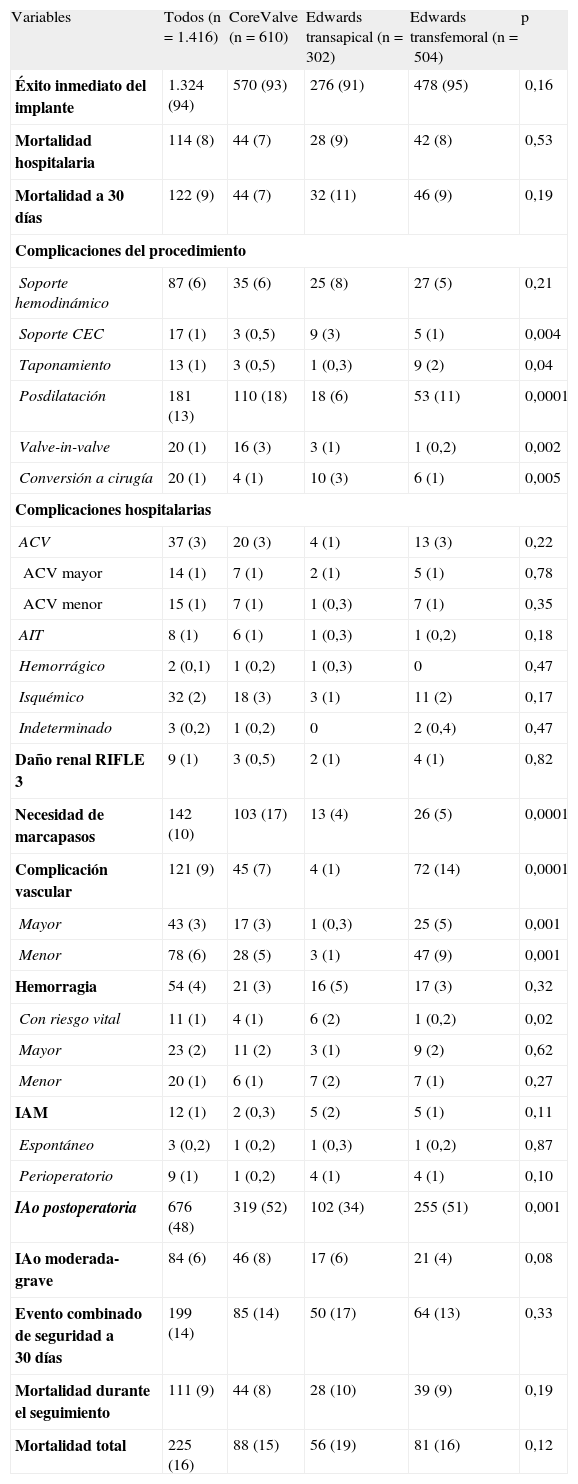
Los resultados hospitalarios se presentan en la tabla 4. La tasa total de éxito inmediato de la implantación de la prótesis fue del 94%. Por accesos, la tasa de éxito por vía transapical tuvo tendencia a ser menor que la de la vía transfemoral (el 91 frente al 94%; p=0,09). Se ha informado de una tasa significativamente mayor de necesidad de soporte con circulación extracorpórea y de conversión a cirugía convencional en las válvulas implantadas por vía transapical, mayor tasa de taponamiento en las válvulas de Edwards por vía transfemoral y mayor necesidad de posdilatación con las CoreValve. La conversión a cirugía (n=20) ha sido en su totalidad a cirugía de reemplazo valvular convencional, y en 3, además, se ha debido intervenir de disección aórtica. Las razones para ello han sido: insuficiencia aórtica residual grave (n=11); mal implante (n=4); migración de la válvula (n=2), disección de aorta (n=3). Durante la hospitalización fallecieron 114 pacientes (8%), sin diferencias por tipos de válvula y acceso. Las tasas de complicaciones fueron bajas en general. No hubo diferencias significativas entre válvulas y accesos en cuanto a incidencia de accidente cerebrovascular, insuficiencia renal o infarto de miocardio. Cabe destacar una necesidad significativamente mayor de marcapasos con CoreValve, una mayor tasa de complicaciones vasculares mayores y menores con la válvula Edwards implantada por vía transfemoral, y mayor presencia general de insuficiencia aórtica residual con las válvulas implantadas por vía transfemoral. Asimismo, con el acceso transapical hubo mayor tasa de hemorragia con riesgo vital. En general, la mortalidad y la variable combinada de seguridad a los 30 días6 fueron del 9 y el 14% respectivamente, comparable entre los dos tipos de válvulas y accesos.
Resultados hospitalarios y de seguimiento de la población y por tipo de válvula y acceso
| Variables | Todos (n=1.416) | CoreValve (n=610) | Edwards transapical (n=302) | Edwards transfemoral (n=504) | p |
| Éxito inmediato del implante | 1.324 (94) | 570 (93) | 276 (91) | 478 (95) | 0,16 |
| Mortalidad hospitalaria | 114 (8) | 44 (7) | 28 (9) | 42 (8) | 0,53 |
| Mortalidad a 30 días | 122 (9) | 44 (7) | 32 (11) | 46 (9) | 0,19 |
| Complicaciones del procedimiento | |||||
| Soporte hemodinámico | 87 (6) | 35 (6) | 25 (8) | 27 (5) | 0,21 |
| Soporte CEC | 17 (1) | 3 (0,5) | 9 (3) | 5 (1) | 0,004 |
| Taponamiento | 13 (1) | 3 (0,5) | 1 (0,3) | 9 (2) | 0,04 |
| Posdilatación | 181 (13) | 110 (18) | 18 (6) | 53 (11) | 0,0001 |
| Valve-in-valve | 20 (1) | 16 (3) | 3 (1) | 1 (0,2) | 0,002 |
| Conversión a cirugía | 20 (1) | 4 (1) | 10 (3) | 6 (1) | 0,005 |
| Complicaciones hospitalarias | |||||
| ACV | 37 (3) | 20 (3) | 4 (1) | 13 (3) | 0,22 |
| ACV mayor | 14 (1) | 7 (1) | 2 (1) | 5 (1) | 0,78 |
| ACV menor | 15 (1) | 7 (1) | 1 (0,3) | 7 (1) | 0,35 |
| AIT | 8 (1) | 6 (1) | 1 (0,3) | 1 (0,2) | 0,18 |
| Hemorrágico | 2 (0,1) | 1 (0,2) | 1 (0,3) | 0 | 0,47 |
| Isquémico | 32 (2) | 18 (3) | 3 (1) | 11 (2) | 0,17 |
| Indeterminado | 3 (0,2) | 1 (0,2) | 0 | 2 (0,4) | 0,47 |
| Daño renal RIFLE 3 | 9 (1) | 3 (0,5) | 2 (1) | 4 (1) | 0,82 |
| Necesidad de marcapasos | 142 (10) | 103 (17) | 13 (4) | 26 (5) | 0,0001 |
| Complicación vascular | 121 (9) | 45 (7) | 4 (1) | 72 (14) | 0,0001 |
| Mayor | 43 (3) | 17 (3) | 1 (0,3) | 25 (5) | 0,001 |
| Menor | 78 (6) | 28 (5) | 3 (1) | 47 (9) | 0,001 |
| Hemorragia | 54 (4) | 21 (3) | 16 (5) | 17 (3) | 0,32 |
| Con riesgo vital | 11 (1) | 4 (1) | 6 (2) | 1 (0,2) | 0,02 |
| Mayor | 23 (2) | 11 (2) | 3 (1) | 9 (2) | 0,62 |
| Menor | 20 (1) | 6 (1) | 7 (2) | 7 (1) | 0,27 |
| IAM | 12 (1) | 2 (0,3) | 5 (2) | 5 (1) | 0,11 |
| Espontáneo | 3 (0,2) | 1 (0,2) | 1 (0,3) | 1 (0,2) | 0,87 |
| Perioperatorio | 9 (1) | 1 (0,2) | 4 (1) | 4 (1) | 0,10 |
| IAo postoperatoria | 676 (48) | 319 (52) | 102 (34) | 255 (51) | 0,001 |
| IAo moderada-grave | 84 (6) | 46 (8) | 17 (6) | 21 (4) | 0,08 |
| Evento combinado de seguridad a 30 días | 199 (14) | 85 (14) | 50 (17) | 64 (13) | 0,33 |
| Mortalidad durante el seguimiento | 111 (9) | 44 (8) | 28 (10) | 39 (9) | 0,19 |
| Mortalidad total | 225 (16) | 88 (15) | 56 (19) | 81 (16) | 0,12 |
ACV: accidente cerebrovascular; AIT: accidente isquémico transitorio; CEC: circulación extracorpórea; IAM: infarto agudo de miocardio; IAo: insuficiencia aórtica.
Soporte hemodinámico indica la utilización de inotrópicos y/o balón de contrapulsación.
Los valores expresan n (%).
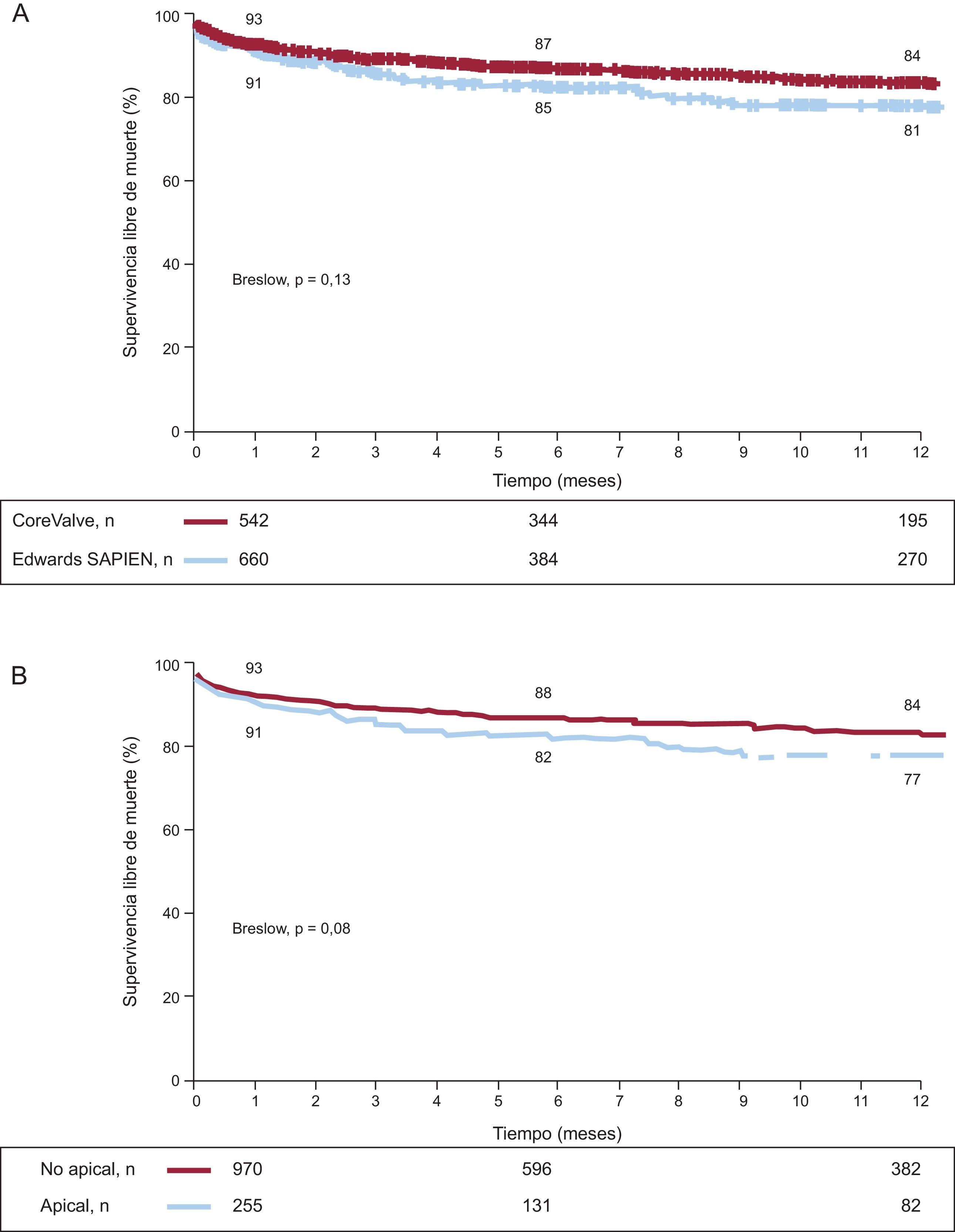
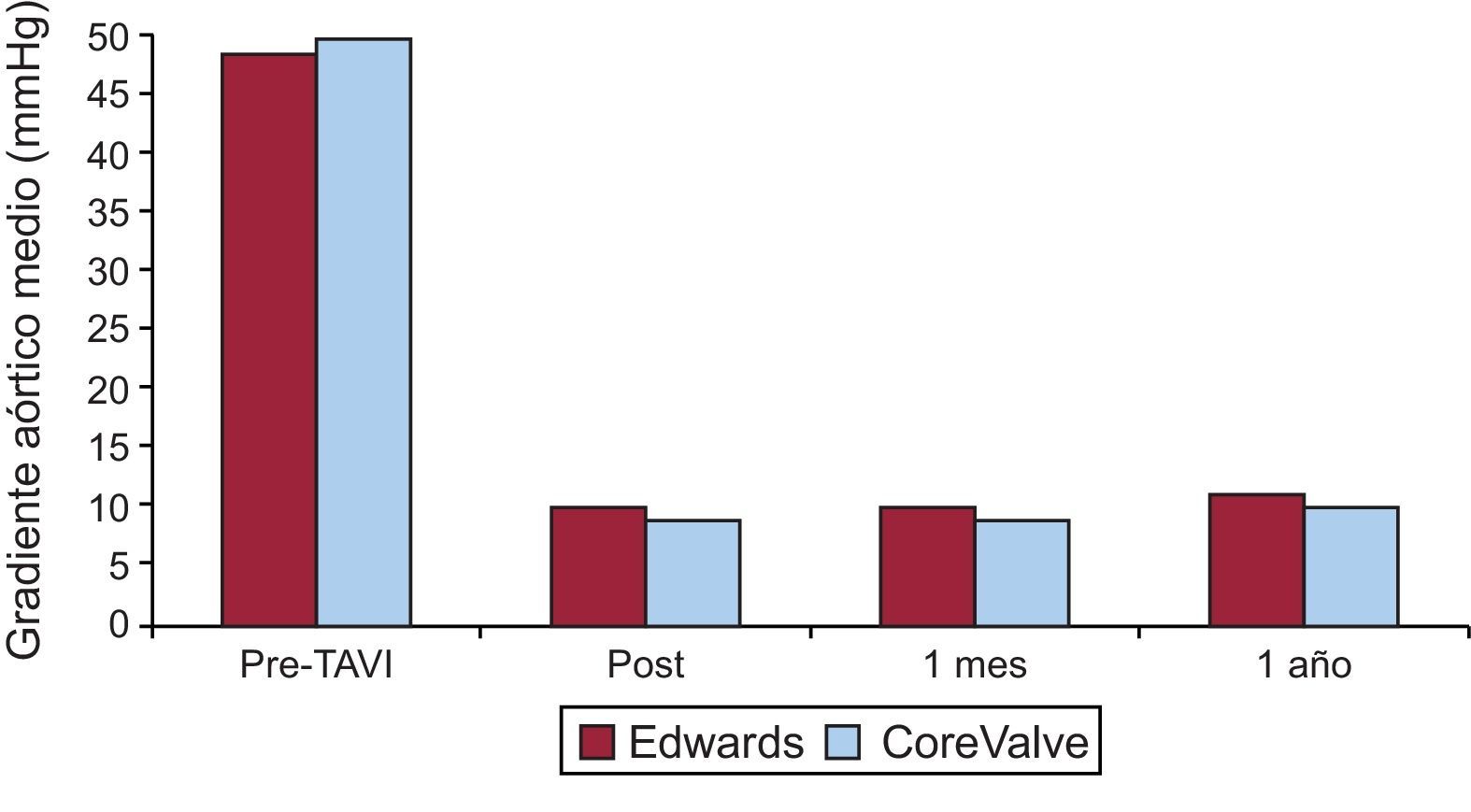
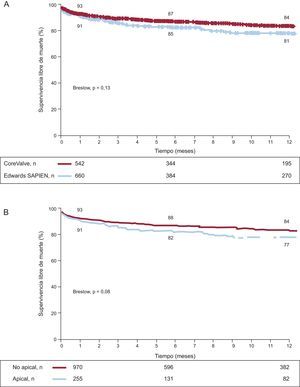
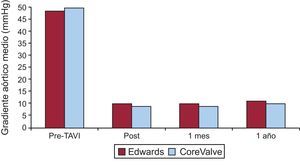
La media de seguimiento clínico fue 244 días. El tiempo de seguimiento informado es más corto con la válvulas implantadas por vía transapical que por la vía transfemoral (206±200 frente a 254±223 días; p=0,0001). La tasa general de mortalidad tras el alta hospitalaria fue del 9%, que resulta en una mortalidad acumulada del 16%, con tendencia a ser mayor para los pacientes tratados por vía transapical (figs. 1A y B). Desde el punto de vista clínico, las tasas de pacientes con disnea de clase III/IV y angina de clase III/IV pasaron del 76 y el 11% antes del procedimiento al 9 y el 0,1% durante el seguimiento, sin diferencias entre tipos de válvula o acceso. La figura 2 muestra los cambios en los gradientes transvalvulares por ecocardiografía durante el seguimiento. No se evidencian diferencias significativas entre los tipos de válvula o acceso (tabla 4).
Gradientes aórtico medio (mmHg) basal, tras el procedimiento (post), al mes y al año de seguimiento entre CoreValve y la válvula de Edwards. No hay diferencias significativas entre ambos tipos de válvulas ni cambios significativos en los gradientes obtenidos tras el procedimiento y al año de seguimiento. TAVI: implantación de válvula aórtica transcatéter.
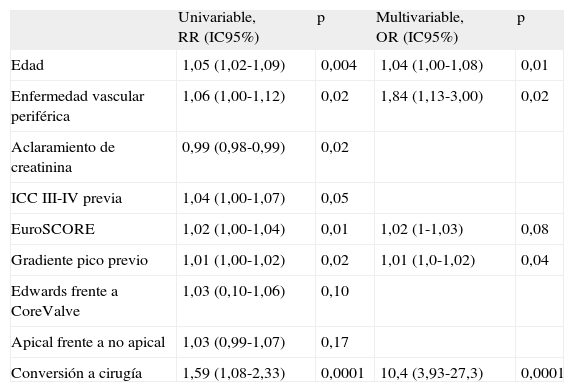
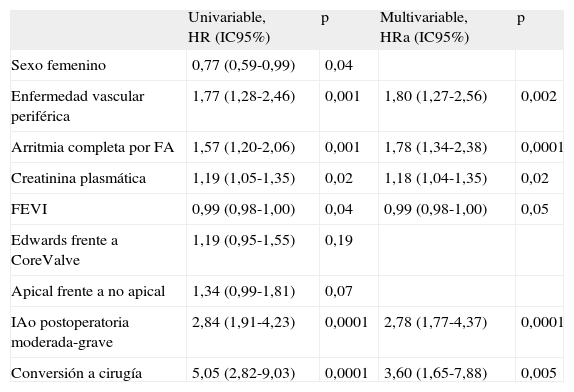
La edad, la enfermedad vascular periférica (según definición del EuroSCORE logístico), la conversión a cirugía y la gravedad de la estenosis aórtica aparecen como predictores de mortalidad a 30 días (tabla 5). Al seguimiento máximo, se identifica la enfermedad vascular periférica, la insuficiencia renal, la fibrilación auricular, la fracción de eyección, la conversión a cirugía y la insuficiencia aórtica residual (tabla 6). La variable insuficiencia mitral preoperatoria se asocia a mortalidad hospitalaria (odds ratio=4,12; IC95%, 1,99-8,5; p=0,001) y al seguimiento máximo (hazard ratio=1,67; IC95%, 0,94-2,96; p=0,09), pero no se pudo incluirla en el análisis multivariable por haberse consignado solo en el 63% de los pacientes.
Predictores de mortalidad a 30 días
| Univariable, RR (IC95%) | p | Multivariable, OR (IC95%) | p | |
| Edad | 1,05 (1,02-1,09) | 0,004 | 1,04 (1,00-1,08) | 0,01 |
| Enfermedad vascular periférica | 1,06 (1,00-1,12) | 0,02 | 1,84 (1,13-3,00) | 0,02 |
| Aclaramiento de creatinina | 0,99 (0,98-0,99) | 0,02 | ||
| ICC III-IV previa | 1,04 (1,00-1,07) | 0,05 | ||
| EuroSCORE | 1,02 (1,00-1,04) | 0,01 | 1,02 (1-1,03) | 0,08 |
| Gradiente pico previo | 1,01 (1,00-1,02) | 0,02 | 1,01 (1,0-1,02) | 0,04 |
| Edwards frente a CoreValve | 1,03 (0,10-1,06) | 0,10 | ||
| Apical frente a no apical | 1,03 (0,99-1,07) | 0,17 | ||
| Conversión a cirugía | 1,59 (1,08-2,33) | 0,0001 | 10,4 (3,93-27,3) | 0,0001 |
IC95%: intervalo de confianza del 95%; ICC: insuficiencia cardiaca congestiva; OR: odds ratio; RR: riesgo relativo.
Para las variables cuantitativas, el riesgo definido por la OR es por unidad de incremento en el valor de la variable.
Predictores de mortalidad a medio plazo
| Univariable, HR (IC95%) | p | Multivariable, HRa (IC95%) | p | |
| Sexo femenino | 0,77 (0,59-0,99) | 0,04 | ||
| Enfermedad vascular periférica | 1,77 (1,28-2,46) | 0,001 | 1,80 (1,27-2,56) | 0,002 |
| Arritmia completa por FA | 1,57 (1,20-2,06) | 0,001 | 1,78 (1,34-2,38) | 0,0001 |
| Creatinina plasmática | 1,19 (1,05-1,35) | 0,02 | 1,18 (1,04-1,35) | 0,02 |
| FEVI | 0,99 (0,98-1,00) | 0,04 | 0,99 (0,98-1,00) | 0,05 |
| Edwards frente a CoreValve | 1,19 (0,95-1,55) | 0,19 | ||
| Apical frente a no apical | 1,34 (0,99-1,81) | 0,07 | ||
| IAo postoperatoria moderada-grave | 2,84 (1,91-4,23) | 0,0001 | 2,78 (1,77-4,37) | 0,0001 |
| Conversión a cirugía | 5,05 (2,82-9,03) | 0,0001 | 3,60 (1,65-7,88) | 0,005 |
FA: fibrilación auricular; FEVI: fracción de eyección del ventrículo izquierdo; HR: hazard ratio; HRa: HR ajustada; IAo: insuficiencia aórtica; IC95%: intervalo de confianza del 95%.
Para las variables cuantitativas, el riesgo definido por la HR es por unidad de incremento en el valor de la variable.
Este registro multicéntrico nacional describe los resultados de una amplia cohorte de pacientes tras TAVI. En concreto, este registro ha sido capaz de incluir el 80% de todas las válvulas implantadas transcatéter en España entre 2010 y 2011. La mortalidad a 30 días (8%) y al seguimiento máximo (16%) han sido similares a lo descrito en otros registros como el canadiense (el 10,4% a los 30 días y el 22,1% a los 8 meses11) el francés (FRANCE-2: el 9,7% a los 30 días y el 24% a 1 año12), el británico (el 7,1% a los 30 días y el 26,3% a los 2 años13) y el italiano (el 5,4% a los 30 días y el 15% al año14).
Las características de los pacientes están diferenciadas según el tipo de acceso utilizado, y los de acceso transapical tienen más comorbilidades y mayor EuroSCORE que los tratados vía transfemoral. Sin embargo, tras corregir por las variables de confusión por medio del análisis multivariable, no había diferencias en mortalidad. Una vez superada la fase hospitalaria, no se observaron diferencias en cuanto a durabilidad de la válvula o mortalidad a largo plazo según el tipo de válvula o acceso.
Los más importantes factores predictores de mortalidad son la necesidad de conversión a cirugía convencional, las comorbilidades y la insuficiencia aórtica ≥ 3 tras el procedimiento. La necesidad de conversión a cirugía convencional refleja la complejidad del procedimiento y la aparición de complicaciones durante el mismo, lo cual obviamente se traduce en mayor mortalidad. Las comorbilidades que hemos encontrado asociadas a mortalidad son la enfermedad vascular periférica, la fibrilación auricular y la insuficiencia renal.
La enfermedad vascular periférica se encuentra con frecuencia en los pacientes tratados con TAVI. Asimismo, esta variable incrementa el EuroSCORE. En un registro alemán, se observó que los pacientes con enfermedad vascular periférica presentaban mayores tasas de complicaciones vasculares, infarto de miocardio, insuficiencia renal y mortalidad15. No obstante, la utilización del acceso transapical en estos pacientes tampoco se asoció a una reducción del riesgo total asociado a la vasculopatía periférica15.
La fibrilación auricular y la insuficiencia renal se han asociado a peor pronóstico tras la TAVI en un registro multicéntrico de 339 pacientes16. La fibrilación auricular crónica se asocia a peor pronóstico tras cirugía cardiaca17. Los pacientes con fibrilación auricular pueden fallecer por causas no cardiacas relacionadas con hemorragia fatal o causas vasculares de tipo accidente cerebrovascular. En este subgrupo de pacientes, el control estricto del tratamiento anticoagulante y evitar la combinación con otros tratamientos antitrombóticos son esenciales para el pronóstico a largo plazo. Aunque el daño renal post-TAVI ha sido bajo en nuestro registro, la función renal basal se asoció a mortalidad durante el seguimiento. En varias series, la disfunción renal basal aparece como el más potente predictor de mortalidad a largo plazo18,19.
La insuficiencia aórtica residual se ha asociado a peor pronóstico tras la TAVI. Así, en un estudio monocétrico de 400 pacientes, se evidenció mayor mortalidad entre los pacientes con insuficiencia aórtica de grado 3 o 4 que entre los de grado 2. Asimismo, estos tuvieron mayor mortalidad que los pacientes con grado 0 o 1 de insuficiencia aórtica residual20. En otro registro de 167 pacientes, se observó una tasa de insuficiencia aórtica residual del 67%, que era al menos moderada en el 14,4%. Este grado de insuficiencia aórtica residual se asoció a mortalidad durante el seguimiento. Además, un gradiente ≤ 18mmHg entre la presión diastólica aórtica y la telediastólica del ventrículo izquierdo fue predictor de mortalidad con un área bajo la curva receiver operating characteristic de 0,9721. En el mismo sentido, otro estudio evaluó el índice de regurgitación aórtica como el cociente de la diferencia entre la presión diastólica aórtica y la telediastólica del ventrículo izquierdo sobre la presión sistólica aórtica×100. Un índice<25 se identificó como predictor independiente de mortalidad al año22. La asociación entre regurgitación paravalvular y mortalidad se mantiene a los 5 años de seguimiento23. Finalmente, en el estudio PARTNER se evidenció que una fuga perivalvular incluso ligera se asociaba a incremento de la mortalidad a los 2 años de seguimiento24. En nuestro registro se evidenciaron tasas de posdilatación e insuficiencia aórtica al menos moderada con la CoreValve mayores que con la válvula Edwards, en línea con datos de otros registros12,13, sin que ello implique mayor mortalidad con una u otra válvula durante en el seguimiento actual.
Dado que no disponíamos de todos los datos sobre insuficiencia mitral previa a la intervención, no hemos podido incluirla en el análisis multivariable. Sin embargo, ha mostrado una asociación importante con la mortalidad hospitalaria y a medio plazo en el análisis univariable. Este hallazgo está en línea con el registro europeo, que incluyó a 4.571 pacientes de diez países, en el que la insuficiencia mitral ≥ 2, el fallo de la implantación, la edad y el EuroSCORE se identificaron como predictores de mortalidad hospitalaria25. La insuficiencia mitral es frecuente en pacientes con estenosis aórtica y aumenta el riesgo de sustitución aórtica tanto quirúrgica como transcatéter. En el estudio PARTNER B, hasta un 22% de los pacientes presentaban insuficiencia mitral concomitante moderada o grave, y esta se asociaba a mayor mortalidad por el procedimiento y mayor beneficio que el tratamiento médico1. Asimismo, en el estudio PARTNER A, un 20% de los pacientes presentaban insuficiencia mitral moderada-grave, y también se asoció a mayor mortalidad del procedimiento, pero menor con la TAVI que con la sustitución quirúrgica (el 24,2 frente al 35%)2. Aunque en la mayoría de los estudios se ha descrito mejoría de la insuficiencia mitral tras el tratamiento de la estenosis aórtica, este beneficio puede restringirse a la insuficiencia mitral funcional26. La gravedad de la insuficiencia mitral depende primariamente del orificio regurgitante y el gradiente de presión sistólica entre el ventrículo izquierdo y la aurícula izquierda27. La reducción de la poscarga tras la sustitución valvular aórtica puede inducir un remodelado ventricular positivo, con reducción de volumen ventricular izquierdo que pueda ayudar a la coaptación de los velos mitrales28. En este sentido, es menos probable la mejoría de la insuficiencia mitral de pacientes con enfermedad mitral estructural con velos deformados y calcificación significativa del anillo29.
LimitacionesEl registro nacional es de carácter voluntario y, por lo tanto, sujeto a sesgo de inclusión. Sin embargo, podemos considerar que este registro es representativo de la práctica habitual en España, pues se ha obtenido datos del 80% de las válvulas implantadas durante el periodo de inclusión. Asimismo, los datos de éxito y la tasa de complicaciones son comparables con los de otros registros nacionales europeos11–14,25.
No se pudo recoger variables clínicamente relevantes (como la insuficiencia mitral o la enfermedad pulmonar obstructiva crónica) de todos los pacientes, por lo que no se las ha incluido en el análisis multivariable final.
La tasa de inclusión y la duración del seguimiento en relación con las válvulas implantadas por vía transapical son significativamente menores que las de los tratados por vía transfemoral. En este sentido, puede haber cierto sesgo de inclusión de estos tipos de válvula y acceso. En la misma línea, unos pocos centros no han incluido todas las válvulas implantadas durante el periodo de registro, hecho que también puede condicionar cierto sesgo de inclusión.
Los eventos han sido reportados por los investigadores pero no han sido adjudicados de manera independiente. Asimismo, no existe hasta la fecha posibilidad de realizar auditorías independientes en cierto porcentaje de pacientes, por lo que tampoco se puede descartar ni confirmar que en cierto grado se haya infrarregistrado o sobrerregistrado eventos. Con todo ello, se trata del primer registro nacional con los datos individualizados de los pacientes tratados con esta técnica de reciente difusión.
Finalmente, las diferentes características basales pueden influir en el curso clínico de los pacientes con diferentes accesos o válvulas (figs. 1A y B). Para minimizar este hecho, hemos incluido en el análisis multivariable los tipos de válvula y acceso que no aparecen en el modelo como predictores de eventos.
ConclusionesEl registro nacional TAVI es un registro multicéntrico de pacientes individuales que ha conseguido los datos del 80% de las válvulas aórticas implantadas transcatéter en España entre 2010 y 2011. Se ha descrito por primera vez los predictores de mortalidad hospitalaria y a medio plazo tras el implante. La aparición de complicaciones durante el procedimiento reflejadas por la tasa de conversión a cirugía, las comorbilidades y la insuficiencia mitral significativa se asocian a mortalidad hospitalaria, mientras que la insuficiencia aórtica residual se añade a los previos como factor asociado a mortalidad durante el seguimiento. La selección del paciente teniendo en cuenta su comorbilidad y la optimización del resultado minimizando el grado de insuficiencia aórtica residual pueden ayudar a mejorar el pronóstico de estos pacientes de alto riesgo.
Conflicto de interesesNinguno.
Agradecemos a los Dres. Matías Feldman, María José Pérez-Vizcayno y Luis Alonso Pulpón su dedicación en el Comité TAVI y su colaboración en la elaboración de este manuscrito.
Manel Sabaté ha sido miembro de la Junta de la Sección de Hemodinámica y Cardiología Intervencionista de la Sociedad Española de Cardiología de 2009 a 2012.
Sergio Cánovas, Juan José Goiti y Alberto Igual son miembros de la Sociedad Española de Cirugía Torácica-Cardiovascular.
José María Hernández, Eulogio García y Rosana Hernández-Antolín son miembros de la Sección de Hemodinámica y Cardiología Intervencionista de la Sociedad Española de Cardiología.
Luis Alonso Pulpón es cardiólogo clínico del Hospital Puerta de Hierro, Majadahonda, Madrid.
Matías Feldman fue project manager del Comité TAVI en 2010-2011.
María José Pérez-Vizcayno es project manager del Comité TAVI en 2011-2013.
Garikotz Lasa Larraya y Miren Telleria Arrieta (Clínica Guipúzcoa de Donosti, San Sebastián). Gonzalo Pradas y Andrés Íñiguez (Complejo Hospitalario Universitario de Vigo, Vigo). Nicolás Vázquez González y José Joaquín Cuenca Castillo (Complejo Hospitalario Universitario A Coruña, A Coruña). Ramiro Trillo Nouche y Diego López Otero (Complejo Hospitalario de Santiago de Compostela, Santiago de Compostela). Javier Zueco y Dae-Hyun Lee (Hospital Universitario Marqués de Valdecilla, Santander). Federico Gimeno y Enrique Fulquet (Hospital Clínico Universitario de Valladolid, Valladolid). Vicenç Serra García y Bruno García del Blanco (Hospital Universitari Vall d’Hebron, Barcelona). Raquel del Valle Fernández y Pablo Avanzas Fernández (Hospital Universitario Central de Asturias, Oviedo). Raúl Moreno y Ulises Ramírez (Hospital Universitario La Paz, Madrid). Mariano Valdés Chávarri y Eduardo Pinar Bermúdez (Hospital Virgen de la Arrixaca, Murcia). Alberto Berenguer Jofresa (Hospital General, Valencia). Rafael Ruiz-Salmerón y Luis Felipe Valenzuela García (Hospital Virgen de La Macarena, Sevilla). Eduardo Molina Navarro y Norberto Herrera Gómez (Hospital Virgen de las Nieves, Granada). Cristóbal A. Urbano Carrillo y José L. Castillo Castro (Hospital Regional Universitario Carlos Haya, Málaga). Ángel Cequier Fillat y Rafael Romaguera (Hospital Universitari de Bellvitge, L’Hospitalet de Llobregat). Ignacio Cruz González y Javier Martín Moreiras (Complejo Hospitalario de Salamanca, Salamanca). Antonio Merchán y José Ramón González (Hospital Universitario Infanta Cristina, Badajoz). Agustín Albarrán y Jorge Centeno (Hospital 12 de Octubre, Madrid). Manuel Castellá (Hospital Clínic, Barcelona). Patricio Llamas y Vicente Mainar (Hospital General, Alicante). Roberto Blanco Mata y Juan Alcíbar Villa (Hospital de Cruces, Baracaldo). José Miguel Borrego y Ángel Sánchez González (Hospital Virgen del Rocío, Sevilla). Felipe Fernández-Vázquez y Mario Castaño Ruiz (Complejo Asistencial Universitario [CAULE], León). José María Aguirre Salcedo y Joseba Zuazo Meabe (Hospital de Basurto, Basurto). José Moreu Burgos y Fernando Pajín Valbuena (Hospital Virgen de la Salud, Toledo). Luis Felipe Navarro del Amo y Antonio Piñero Lozano (Fundación Jiménez Díaz, Madrid). Juan Francisco Oteo Domínguez y Javier Goicolea Ruigómez (Hospital Puerta de Hierro-Majadahonda, Madrid). José F. Díaz Fernández y Rosa Cardenal Piris (Hospital Juan Ramón Jiménez, Huelva). Luisa Salido y José Garrido (Hospital Ramón y Cajal, Madrid). Antoni Serra Peñaranda y Jose María Padró (Hospital de la Santa Creu i Sant Pau, Barcelona). Francisco Ten y Juan Margarit (Hospital La Fe, Valencia). Eduard Fernández Nofrerías y Xavier Carrillo Suárez (Hospital Universitari Germans Trias i Pujol, Badalona). Román Lezaun y Raúl Ramallal (Hospital de Navarra, Pamplona). Bernhard Seidelberger y Amparo Benedicto Buendía (Hospital de la Princesa, Madrid). Enrique Rodríguez-Hernández, Javier Cobiella y Pilar Jiménez-Quevedo (Hospital Universitario Clínico San Carlos, Madrid). Miguel Duch (Hospital Clínico Virgen de la Victoria, Málaga). Jaime Elízaga Corrales, Francisco Fernández-Avilés Díaz y Ángel González-Pinto (Hospital Gregorio Marañón, Madrid). Ignacio Gallo, Juan José Goiti, Mariano Larman y Alberto Sáenz (Clínica Guipúzcoa de Donosti, San Sebastián). José Antonio Baz, Darío Duran, Víctor Jiménez y Javier Montoto (Complejo Hospitalario Universitario de Vigo, Vigo). Jorge Salgado (Complejo Hospitalario Universitario A Coruña, A Coruña). Ángel Luis Fernández (Complejo Hospitalario de Santiago de Compostela, Santiago de Compostela). Iván García y José María de la Torre-Hernández (Hospital Universitario Marqués de Valdecilla, Santander). Alberto San Román (Hospital Clínico Universitario de Valladolid, Valladolid). Alberto Igual (Hospital Universitari Vall d’Hebron, Barcelona). César Morís (Hospital Universitario Central de Asturias, Oviedo). Nieves Montoro y José María Mesa (Hospital Universitario La Paz, Madrid). Ramón Arcas (Hospital Virgen de la Arrixaca, Murcia). Óscar Gil Albarova, Juan Vicente Vilar Herrero, Darío Sanmiguel Cervera, Salvador Morell Cabedo y Juan Martínez León (Hospital General, Valencia). José Miguel Barquero (Hospital Virgen Macarena, Sevilla). Rafael Melgares Moreno (Hospital Virgen de las Nieves, Granada). Joan Antoni Gómez Hospital y Miguel Ángel Sánchez Corral (Hospital Universitari de Bellvitge, L’Hospitalet de Llobregat). Fermín González y José Ramón López-Mínguez (Hospital Universitario Infanta Cristina, Badajoz). Juan Tascón y José María Cortina (Hospital 12 de Octubre, Madrid). Rut Andrea, Victoria Martín-Yuste, Bárbara Vidal, Joaquim Cevallos, Guillermina Fita y Matías Feldman (Hospital Clínic, Barcelona). Pascual Bordes y Juan Meseguer Oller (Hospital General, Alicante). José Ignacio Aramendi (Hospital de Cruces, Baracaldo). José María Cubero (Hospital Virgen del Rocío, Sevilla). Alejandro Diego Nieto y Javier Gualis (Complejo Asistencial Universitario [CAULE], León). Roberto Sáez Moreno, Leire Andraka Ikazuriaga, Vanessa Estévez Flórez y Abel Andrés Morist (Hospital de Basurto, Basurto). Alfonso Cañas (Hospital Virgen de la Salud, Toledo). Antonio Gómez Menchero (Hospital Juan Ramón Jiménez, Huelva). Antonio Epeldegui, Ignacio García Andrade y Jaime Pey (Hospital Ramón y Cajal, Madrid). Marcelo Jiménez (Hospital de la Santa Creu i Sant Pau, Barcelona). José Anastasio Romero y Elena Sánchez (Hospital La Fe, Valencia). Josepa Mauri, Carolina Oliete y Xavier Ruyra (Hospital Universitari Germans Trias i Pujol, Badalona).
De acuerdo con los autores y los editores, este artículo se publica simultáneamente y de forma íntegra en Revista Española de Cardiología (http://dx.doi.org/10.1016/j.recesp.2013.06.011).
En los anexos se relacionan los miembros del Comité TAVI 2010-2013 y los colaboradores del Grupo Nacional TAVI.