La reparación de la insuficiencia mitral por prolapso del velo posterior ha evolucionado en los últimos 20 años desde las técnicas clásicas de Carpentier hacia procedimientos menos agresivos con el tejido valvular. Nuestro objetivo es describir la evolución del tratamiento de esta patología en nuestro centro.
MétodosEstudio retrospectivo de pacientes con prolapso de velo posterior operados en nuestro centro desde 2001 a 2021. Recogida de datos intraoperatorios y datos ecocardiográficos y de seguimiento durante 20 años.
ResultadosSe incluyeron 260 pacientes operados en dos períodos: hasta 2010, 84 pacientes (grupo A) y desde 2011, 176 pacientes (grupo B). Las técnicas más utilizadas en el grupo A fueron la resección cuadrangular (51 pacientes, 60,7%), la triangular (20 pacientes, 23,8%) y la implantación de neocuerdas (8 pacientes, 9,5%) siendo la tasa de reparabilidad del 98,8%, y en el grupo B fueron la resección triangular (86 pacientes, 48,9%), la implantación de neocuerdas (45 pacientes, 25,6%) y la resección cuadrangular (28 pacientes, 15,9%) con una reparabilidad del 96,6%. La mortalidad hospitalaria fue del 3,6% (n=3) en el grupo A y del 0,6% (n=1) en el B. Supervivencia actuarial 50% a los 20 años (A) y 81% a los 10 años (B). Tasa libre de reintervención del 98% (A) y del 97,2% (B). Teniendo en cuenta las técnicas más frecuentemente utilizadas, la recidiva de insuficiencia mitral ≥II fue mayor en los pacientes con neocuerdas (n=14, 26,4%) que en los casos de resección cuadrangular (n=10, 13,2%) o triangular (n=13, 12,4%).
ConclusionesNuestro centro ha evolucionado hacia técnicas con menor resección tisular y mayor utilización de neocuerdas, aunque ambas técnicas han mostrado excelentes resultados a largo plazo. Las técnicas resectivas son más reproducibles y duraderas que la implantación de neocuerdas.
Repair of mitral regurgitation due to posterior leaflet prolapse has evolved in the last 20 years from the classic Carpentier techniques towards less aggressive procedures with the valve tissue. The objective of this study is to describe the evolution of our center in the treatment of this pathology.
MethodsRetrospective study of 260 patients with posterior leaflet prolapse operated on our center since 2001, including them into two groups: A (until 2010) and B (since 2011). We collected intraoperative data and echocardiographic and follow-up data for 20 years.
Results260 patients operated on in two periods were included: until 2010, 84 patients (group A) and since 2011, 176 patients (group B). The most commonly used techniques in group A were quadrangular resection (51 patients, 60.7%), triangular resection (20 patients, 23.8%), and neochordal implantation (8 patients, 9.5%), with a reparability rate of 98.8% and in group B, triangular resection (86 patients, 48.9%), neochordal implantation (45 patients, 25.6%) and quadrangular resection (28 patients, 15.9%) with a reparability rate of 96.6%. Hospital mortality was 3.6% (n=3) in group A and 0.6% (n=1) in group B. Actuarial survival was 50% at 20 years (A) and 81% at 10 years (B). Reoperation-free rate was 98% (A) and 97.2% (B). Taking into account the most frequently used techniques, the recurrence of mitral regurgitation ≥II was greater in patients with neochordae (n=14, 26.4%) than in cases with quadrangular (n=10, 13.2%) or triangular resection (n=13, 12.4%).
ConclusionsOur center has evolved towards techniques with less tissue resection and greater use of neochordae although both techniques have showed excellent long-term results. Resective techniques are more reproducible and durable than neochordal implantation.
El prolapso del velo posterior (PVP) es la causa más frecuente de insuficiencia mitral (IM) severa en la enfermedad degenerativa de la válvula mitral y el tipo de disfunción más fácil de reparar. Las técnicas de reparación publicadas por Carpentier, con el fin último de restaurar la superficie de coaptación entre ambos velos, han demostrado una gran eficacia, reproducibilidad y durabilidad1,2. A pesar de los buenos resultados publicados, en los últimos años la cirugía de esta patología ha evolucionado hacia otras técnicas que preservan mejor el tejido valvular y la geometría ventricular3,4, así como hacia accesos que disminuyan la agresión quirúrgica.
En este artículo describimos la evolución en nuestro centro en el tratamiento de la IM degenerativa secundaria a PVP aislado durante los últimos 20 años en términos de resultado operatorio, seguimiento ecocardiográfico y análisis de supervivencia.
Pacientes y métodosSe llevó a cabo un estudio observacional y descriptivo realizado en un único centro hospitalario que incluyó a todos los pacientes consecutivos intervenidos por una valvulopatía mitral degenerativa durante el período comprendido entre 2001 y julio de 2021. Se incluyeron 426 pacientes con IM severa (III-IV) secundaria a enfermedad degenerativa mitral mixoide o fibrolástica. De ellos, 307 enfermos presentaban PVP. Excluimos de este estudio aquellos enfermos en los que la severa calcificación del anillo mitral afectaba de manera determinante a la técnica quirúrgica y aquellos con cirugía asociada diferente de una anuloplastia tricuspídea. Finalmente 260 enfermos formaron la población de estudio. Para el análisis se dividió a los pacientes en dos períodos simétricos según la fecha de intervención: grupo A (2001-2010) y grupo B (2011-2021).
La fuente de datos utilizada fue el registro electrónico de nuestro centro, y para los pacientes operados provenientes de otros centros hospitalarios de nuestra área de referencia se utilizaron los canales de búsqueda de la historia compartida del sistema catalán de salud. Se recogieron todos los datos intraoperatorios y los correspondientes al seguimiento ecocardiográfico, reintervenciones, supervivencia y causa de muerte.
En todos los pacientes la IM era secundaria a una disfunción tipo II de la clasificación de Carpentier y estaban afectados uno o más festones del velo posterior.
Técnica quirúrgicaEl abordaje estándar hasta 2016 fue por esternotomía media y canulación aórtica y bicava. A lo largo de los años el tipo de protección miocárdica ha evolucionado desde la hipotermia moderada (30-34°) hasta la ligera (>34°) y desde la cardioplejía sanguínea intermitente hasta soluciones cristaloides (Del Nido o Custodiol). La exposición valvular se realizó por atriotomía izquierda o transeptal dependiendo de la anatomía cardíaca y de la actuación o no sobre la válvula tricúspide. A partir de 2016, y en casos seleccionados, se inició nuestro programa de cirugía mínimamente invasiva con acceso femoral para la circulación extracorpórea y abordaje por minitoracotomía derecha por 4.o espacio intercostal, hipotermia ligera, protección miocárdica con Custodiol y atriotomía izquierda para la exposición valvular. Finalmente, desde 2021 utilizamos videotoracoscopia 3D para la reparación valvular.
Una vez expuesta la válvula mitral se procedió al análisis valvular, detección de áreas prolapsantes y reparación de las mismas con diferentes técnicas (tabla 1) ya descritas en la literatura1–6. En los primeros años utilizamos, fundamentalmente, las técnicas clásicas de Carpentier y posteriormente fuimos introduciendo técnicas que disminuían la resección del tejido y evitaban la plicatura del anillo para no deformar la base del ventrículo, mantener su geometría y no distorsionar la arteria circunfleja en su recorrido.
Técnicas quirúrgicas
| Grupo A | Grupo B | |
|---|---|---|
| Pacientes, n | 84 | 176 |
| Técnicas | ||
| Resección cuadrangular | 51 (60,7) | 28 (15,9) |
| Resección triangular | 20 (23,8) | 86 (48,9) |
| Neocuerdas PTFE | 8 (9,5) | 45 (25,6) |
| Resección cuadrangular+PTFE | 0 | 1 (0,6) |
| Resección triangular+PTFE | 4 (4,8) | 4 (2,3) |
| Plicatura | 0 | 3 (1,7) |
| Otros | 0 | 3 (1,7) |
| Sustitución valvular | 1 (1,2) | 6 (3,4) |
| Anillos | ||
| St Jude Taylor | 57 (68,7) | 52 (30,6) |
| Physioring | 24 (28,9) | 80 (47,1) |
| Labcor | 2 (2,4) | 1 (0,6) |
| Memo 3D | 0 | 37 (21,8) |
Datos presentados como n (%).
PTFE: politetrafluoroetileno.
Por ello, y de manera progresiva, se fue reduciendo la amplitud de la resección y, en ocasiones, complementando la reparación con neocuerdas de politetrafluoroetileno PTFE CV-4 (WL Gore & Associates Inc, Flagstaff, Arizona, EE.UU.) para finalmente utilizar en determinados pacientes neocuerdas como única herramienta para la plastia valvular.
En todos los casos se realizó una anuloplastia con anillo flexible abierto o semirrígido cerrado. Al ser un centro público, la utilización de uno u otro anillo dependió, inicialmente, de la disponibilidad del dispositivo, y posteriormente de las preferencias de los cirujanos.
En todos los pacientes se realizó un ETE (equipo Phillips Sonos 5500, Sonos 7500 e IE33) tras finalizar la circulación extracorpórea para evaluar la reparación valvular. El grado de IM fue clasificado según el área de regurgitación mitral: IM grado 0: ausencia de IM; grado I:<2cm2; grado II: 2-4cm2; grado III:>4cm2. Se consideró como buen resultado de la cirugía la ausencia de IM o la presencia de IM grado I.
SeguimientoEl seguimiento medio de este estudio a octubre de 2021 fue de 11,9±5,1 años (rango: 0-20,2 años) en el grupo A y de 4,5±2,8 años (rango: 0-10,7 años) en el grupo B.
Análisis estadísticoLas características de los pacientes se resumieron y describieron expresando las variables continuas en forma de media±desviación estándar y las variables cualitativas en forma de frecuencia y porcentaje. Se compararon las características de los 2 grupos mediante la prueba de la t de Student para las variables continuas con una distribución normal. La comparación de las variables cuantitativas pre- y postreparación se realizó con la prueba de t de Student para datos apareados. El análisis de la supervivencia se ha realizado por el método de Kaplan-Meier. Los datos fueron analizados con el programa SPSS 25.0 Statistical Package (SPSS Inc, Chicago, IL).
Consideraciones éticasTras consultar con el Comité de Etica de Investigación (CEI) del centro, este consideró que, al tratarse de un trabajo asistencial, no era precisa su autorización.
ResultadosTécnicas quirúrgicasSe incluyeron un total de 260 pacientes: 84 en el grupo A y 176 en el grupo B. Las técnicas empleadas se detallan en la tabla 1. En el grupo A se reparó la válvula en 83 pacientes (98,8%) siendo la resección cuadrangular la técnica màs frecuente (60,7%), seguida por la resección triangular (23,8%), implantación de neocuerdas (9,5%) y resección triangular+neocuerdas (4,8%). En un paciente (1,2%) fue necesario implantar una prótesis. En un 68,7% de los casos se implantó un anillo SJM Tailor (St. Jude Medical Inc., Minnesota, EE.UU.). En el 28,9% restante el anillo utilizado fue el Carpentier-Edwards Physioring (Edwards Lifesciences LLC, Irvine, CA, EE.UU.).
En el grupo B la tasa de reparabilidad fue del 96,6% utilizando una mayor diversidad de técnicas siendo las más frecuentes la resección triangular (48,9%), implantación de neocuerdas (25,6%), resección cuadrangular (15,9%), triangular+neocuerdas (2,3%), la plicatura del velo (1,7%) y otros (1,7%). En 6 pacientes (3,4%) la reparación no fue adecuada y se sustituyó la válvula. En el 47,1% de los casos se implantó un Carpentier-Edwards Physioring, SJM Taylor en el 30,6% y Sorin Memo 3D (Sorin Biomedica Cardio S.r.L., Saluggia, Italia) en el 21,8% de los casos.
Evolución ecocardiográficaEn todos los pacientes excepto 5 la IM intraoperatoria fue grado 0 o I. En estos 5 pacientes (1 en el grupo A y 4 en el B) se observó una IM II central, sin áreas de prolapso residual y con una superficie de coaptación amplia y decidimos dar el resultado como adecuado. De estos pacientes uno de ellos desarolló una IM III 5 años después de la cirugía sin repercusión ventricular hasta el momento del cierre del estudio. Los otros 4 presentaron IM 0 o I en el último control.
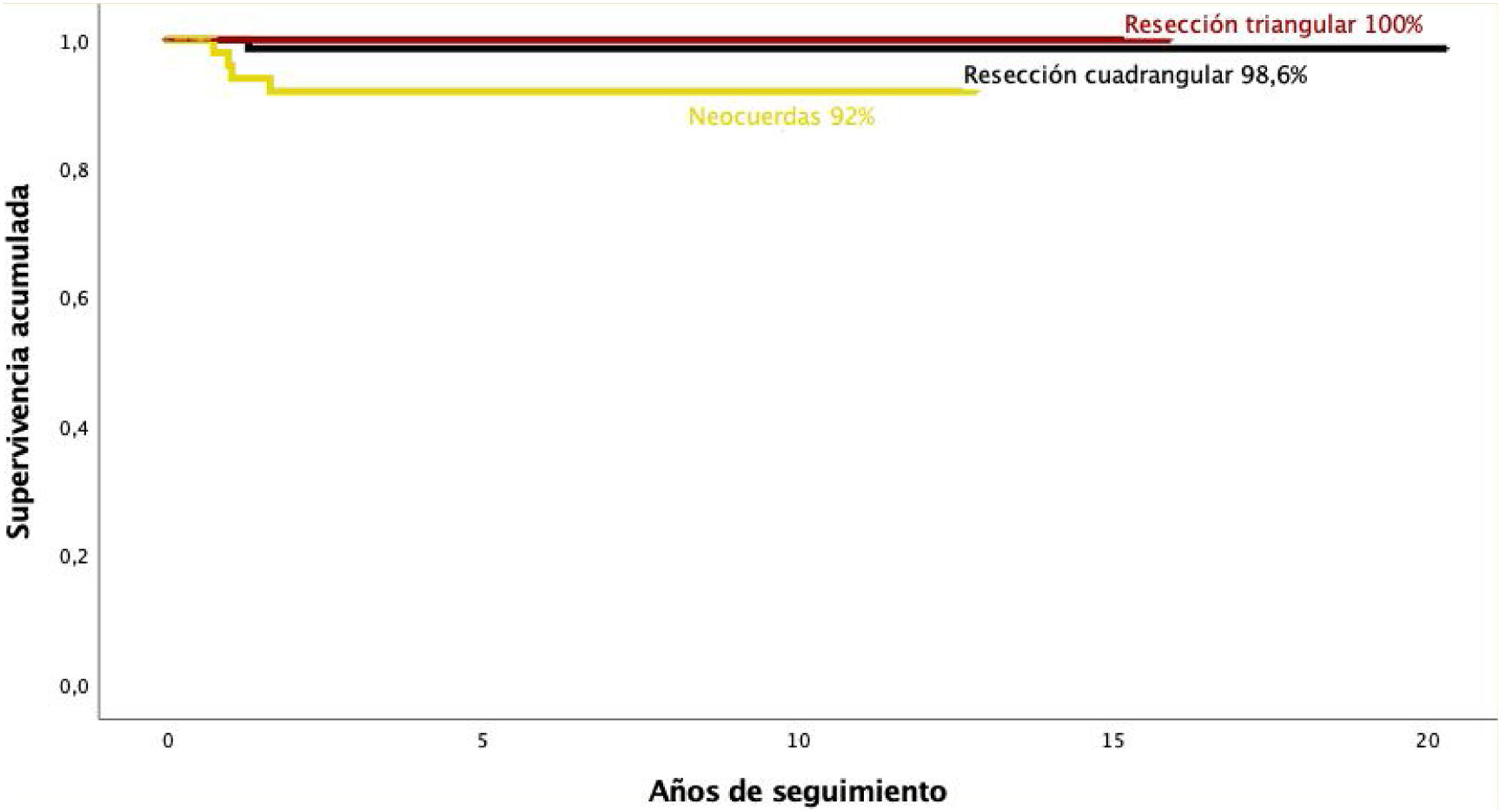
Los resultados ecocardiográficos tras la reparación valvular en el quirófano, al alta y durante el seguimiento se recogen en la tabla 2. En estos datos de ambos grupos se observa una gran estabilidad de la reparación, aunque con un progresivo pero lento deterioro de la reparación condicionado por la persistencia de la enfermedad degenerativa. De esta forma observamos que en el grupo A los pacientes con IM 0-I inicialmente son un 98,8% mientras que al final del seguimiento solamente son un 78,8%. Por su parte, en el grupo B, pasan de ser un 97,6% a un 85,2% de los enfermos. Al final del seguimiento 17 pacientes (21,3%) en el grupo A y 25 (14,9%) en el grupo B presentaban una IM≥II. Este lento deterioro se ha traducido en una baja tasa de reintervención (fig. 1). En el grupo A una única reoperación supone un 98,7% de pacientes libres de reintervención a los 20 años; 4 pacientes del grupo B fueron reoperados (97,2% de libertad de reintervención a los 10 años).
Evolución de la IM tras la reparación valvular
| Quirófano | Alta hospitalaria | Último control | |
|---|---|---|---|
| Grupo A | |||
| IM 0 | 64 (77,1) | 51 (63,7) | 17 (21,3) |
| IM I | 18 (21,7) | 25 (31,3) | 46 (57,5) |
| IM II | 1 (1,2) | 4 (5) | 13 (16,3) |
| IM III | 2 (2,5) | ||
| IM IV | 2 (2,5) | ||
| Grupo B | |||
| IM 0 | 129 (75,4) | 106 (62,7) | 72 (42,6) |
| IM I | 38 (22,2) | 58 (34,3) | 72 (42,6) |
| IM II | 4 (2,4) | 4 (2,3) | 16 (9,5) |
| IM III | 1 (0,6) | 5 (3) | |
| IM IV | 4 (2,4) |
Datos presentados como n (%).
IM: insuficiencia mitral.
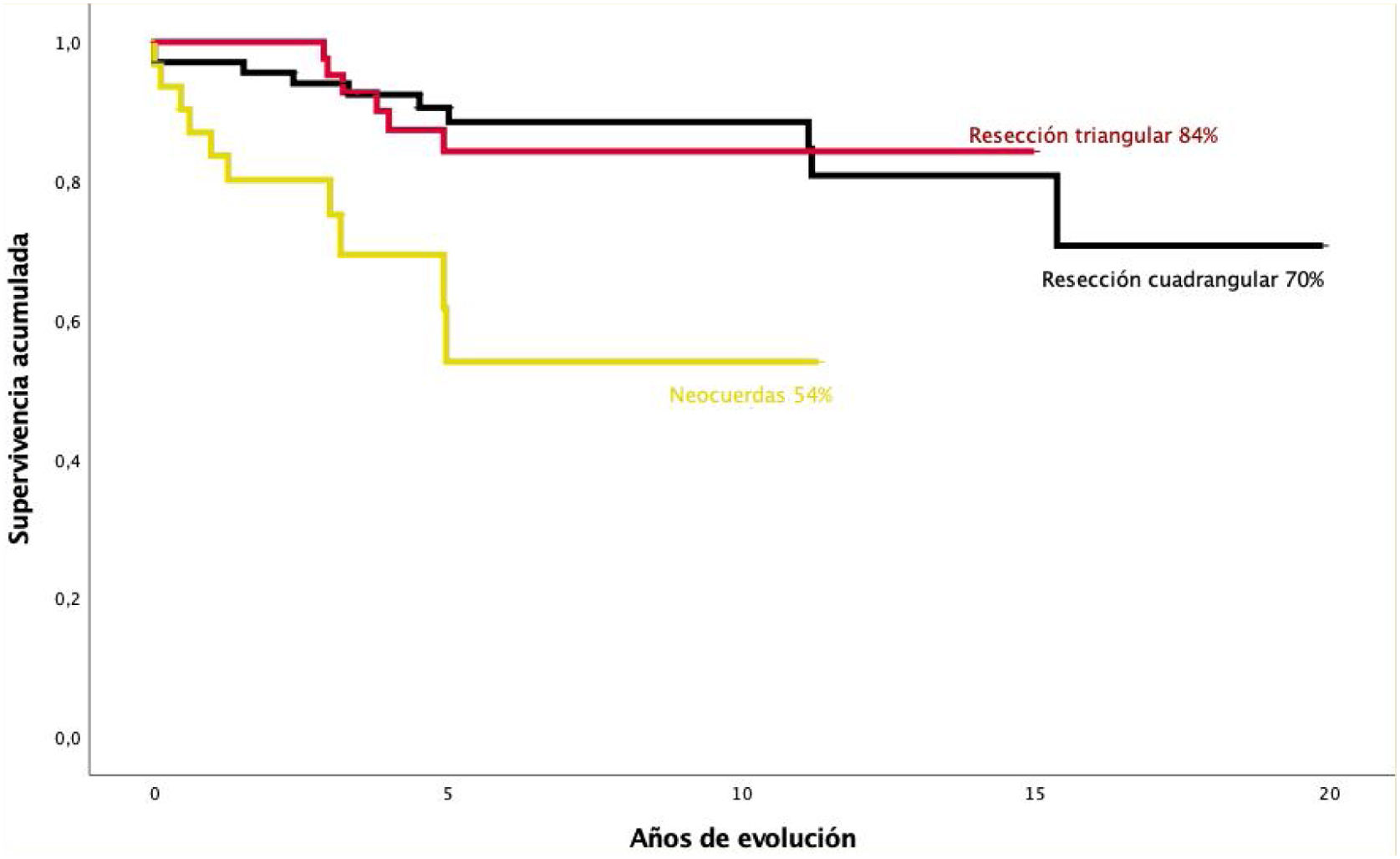
En el análisis de supervivencia libre de IM≥II (fig. 2) observamos una diferente evolución según el tipo de reparación realizado. De la misma forma en la figura 3 se muestra la tasa libre de reintervención para cada una de las 3 técnicas con más frecuencia utilizadas: resección triangular (100% a los 15 años), resección cuadrangular (98% a los 20 años) e implantación de neocuerdas (92% a los 12 años). Se puede constatar que los pacientes reparados con neocuerdas presentan una mayor incidencia de IM≥II (tabla 3) durante el seguimiento y una mayor tasa de reintervención a pesar de tener un menor seguimiento.
Recidiva de la IM según la técnica utilizada
| IM | Resección cuadrangular | Resección triangular | Neocuerdas PTFE |
|---|---|---|---|
| 0-I | 66 (86,8) | 92 (87,6) | 39 (73,6) |
| II | 6 (7,9) | 11 (10,5) | 7 (13,2) |
| III | 2 (2,6) | 2 (1,9) | 3 (5,7) |
| IV | 2 (2,6) | 0 | 4 (7,5) |
Datos presentados como n (%).
PTFE: politetrafluoroetileno; IM: insuficiencia mitral.
En la tabla 4 se compara la evolución de los parámetros ecocardiográficos. En el grupo A se observa una disminución significativa de los diámetros ventriculares, de la presión pulmonar y también de la FEVI. No hubo diferencias significativas en relación con el diámetro de la aurícula izquierda. En el grupo B todos los diámetros disminuyeron de manera significativa, incluido el de la aurícula izquierda. El hecho de que no se recupere la FEVI previa a la cirugía en ambos grupos confirma que, en el contexto de una IM severa, la función ventricular «normal» en realidad no lo es.
Comparación evolutiva de los parámetros ecocardiográficos hasta el final del seguimiento
| Precirugía | Seguimiento | p | |
|---|---|---|---|
| Grupo A | |||
| DTDVI | 59,1±6,5 | 48,8±7,1 | <0,001 |
| DTSVI | 36,8±7,1 | 33,8±8,1 | <0,001 |
| FEVI (%) | 65,3±9,8 | 61,1±10,4 | <0,001 |
| Aurícula izquierda (mm) | 51,5±7,1 | 50,2±9,4 | NS |
| PAP mmHg | 49,5±11,4 | 37,9±10,3 | <0,001 |
| Grupo B | |||
| DTDVI | 57,8±6,2 | 49,1±6,5 | <0,001 |
| DTSVI | 37,5±6,8 | 32,2±6,4 | <0,001 |
| FEVI (%) | 64,2±8,3 | 61±8,7 | <0,001 |
| Aurícula izquierda (mm) | 50,8±7,7 | 46,8±7,6 | <0,001 |
| PAP mmHg | 51,2±15,3 | 34,7±8 | <0,001 |
Los datos se expresan en media±desviación estándar.
DTDVI: diámetro telediastólico ventrículo izquierdo; DTSVI: diámetro telesistólico ventrículo izquierdo; FEVI: fracción de eyección del ventrículo izquierdo; NS: no significativo; PAP: presión arterial pulmonar sistólica.
Completamos el seguimiento en el 96,4% de los pacientes del grupo A y en el 98,3% del grupo B. Hubo una pérdida de seguimiento de 6 pacientes, 3 (3,6%) en el grupo A y 3 (1,7%) en el grupo B.
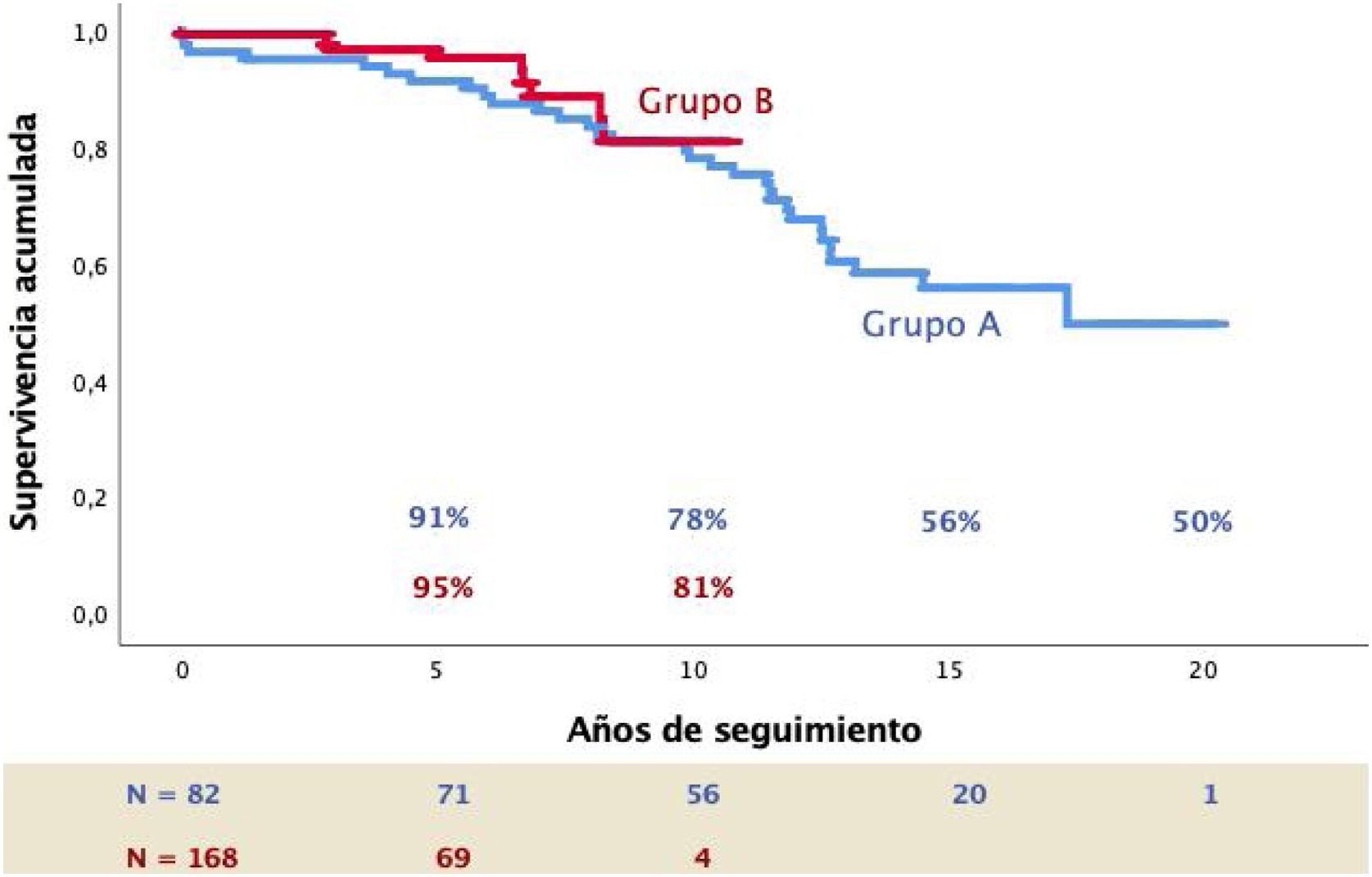
En el grupo A la mortalidad hospitalaria fue de 3 pacientes (3,6%), uno por mediastinitis en el contexto de obesidad mórbida y 2 pacientes con severa comorbilidad respiratoria (oxigenoterapia domiciliaria) por neumonías durante el postoperatorio. Hubo 29 muertes tardías, 7 (24,1%) de origen cardiovascular, 18 (62,1%) de otras causas y 4 de motivo desconocido (13,8%). Las causas de muerte cardiovascular fueron fallo cardíaco en 4 pacientes (3 por disfunción ventricular y 1 por recidiva de la IM), una hemorragia relacionada con la descoagulación y 2 muertes súbitas. La edad media de estos pacientes en el momento del deceso era de 82,2±7,4 años y salvo uno todos presentaban una IM≤II. A este paciente se le había practicado una resección cuadrangular y desarrolló una IM IV a lo largo de los 13 años de seguimiento falleciendo a los 90 años de edad. La tasa de supervivencia observada a los 20 años fue del 50%.
En el grupo B la mortalidad hospitalaria fue de un paciente (0,6%) que falleció por insuficiencia cardíaca biventricular en el contexto de severa dilatación y disfunción ventricular preoperatoria. La mortalidad tardía fue de 9 pacientes, 2 (22,2%) de origen cardiovascular (1 ictus y una hemorragia relacionada con la descoagulación) y 7 (77,8%) de otras causas. La edad media en el momento de la muerte fue de 84,4±5,3 años y todos presentaban una IM≤II en el último control. En este grupo la tasa de supervivencia observada a los 10 años es del 81%.
La figura 4 muestra el análisis de la supervivencia de Kaplan-Meier de ambas cohortes.
DiscusiónEn la reparación del PVP las técnicas descritas por Carpentier y, fundamentalmente, la resección cuadrangular con anuloplastia ha demostrado ser reproducible y duradera1,2,7. Los inconvenientes descritos derivados de esta técnica son el aumento de tensión en los márgenes de resección, la deformación de la base del ventrículo, la disminución de la superficie de coaptación o el empeoramiento de la movilidad anular y del velo posterior8,9. Todas estas limitaciones, de escasa repercusión clínica, no parecen haber tenido trascendencia dados los excelentes resultados publicados en la literatura. A pesar de ello, se ha impuesto la tendencia hacia técnicas menos o nada resectivas como la implantación de neocuerdas de PTFE o mixtas3–5,10.
El propósito de este estudio ha sido describir la evolución de nuestro centro en el tratamiento de la IM degenerativa por PVP iniciada ya en un articulo previo11.
Comenzamos nuestra experiencia en 2001 aplicando técnicas resectivas, fundamentalmente la resección cuadrangular. En 2005 comenzamos a reducir la extensión de la resección haciéndola triangular y evitando la deformación del anillo. Tras la publicación de la experiencia de Perier en 20083, iniciamos nuestra experiencia con neocuerdas de PTFE para, de manera progresiva, ir abandonando la resección cuadrangular.
Desde nuestro punto de vista, la resección triangular es técnicamente más fácil, rápida y no deforma el anillo ni la base del ventrículo. Con cierta frecuencia hemos observado, no obstante, que el tejido remanente puede ser excesivo y evitar el desplazamiento posterior de la línea de coaptación favoreciendo el movimiento del velo anterior hacia el septo ventricular durante la sístole (SAM). En la mayoría de las ocasiones la optimización de las condiciones hemodinámicas solucionan el cuadro, pero complementar esta técnica con la implantación de cuerdas restrictivas es, en estos casos, una buena opción.
En cuanto al tipo de anillo implantado, en nuestra serie se describe una clara evolución desde los anillos abiertos hasta la implantación actual solamente de anillos cerrados. Creemos que, aunque en la enfermedad degenerativa lo que fundamentalmente se dilata es el anillo posterior12, controlar la distancia anteroposterior del anillo es esencial para mantener una correcta superficie de coaptación entre los velos.
En nuestra experiencia tanto la tasa de reparabilidad (grupo A 98,8%, grupo B 96,6%) como los resultados operatorios (grupo A, IM 0-I 98,8% con área valvular 2,5±0,5cm2, grupo B, IM 0-I 97,7%, con área valvular 2,7±0,8cm2) han sido acordes con otras publicaciones13.
También la tasa de reintervención se ajusta a otras series publicadas2–4 aunque observamos una disparidad entre técnicas resectivas y no resectivas a favor de las primeras, teniendo en cuenta, además, la diferencia de seguimiento.
Se observa una diferencia en la evolución de la IM residual durante el tiempo de estudio. Frente a una recidiva de IM≥II del 13,2% y del 12,4% en la resección cuadrangular y triangular, respectivamente, en los enfermos reparados con neocuerdas de PTFE la recidiva de IM≥II ha sido del 26,4% (con un seguimiento menor) siendo grado III en 3 enfermos (5,7%) y IV en 4 pacientes (7,5%). Estos últimos 4 enfermos fueron dados de alta con un buen resultado ecocardiográfico (IM I central y amplia superficie de coaptación) y sin embargo fueron reintervenidos a los 8, 11, 12 y 19 meses, respectivamente, lo que sugiere un problema técnico durante la cirugía. Una consideración a destacar es que 2 de ellos fueron operados al comienzo de nuestra experiencia con la cirugía mínimamente invasiva.
La implantación de neocuerdas está ampliamente difundida y su eficacia y durabilidad, demostrada4,14,15. No obstante, el gran número de técnicas descritas para la medición de la longitud de las mismas hace pensar que la estandarización de la técnica no está del todo conseguida y por tanto su reproducibilidad es cuestionable. La curva de aprendizaje puede ser larga en centros con bajo volumen de enfermos, algo que es frecuente en España. Lo cierto es que también encontramos grandes centros donde se aboga por limitar la utilización de neocuerdas para casos más complejos, reservando para el velo posterior las técnicas resectivas16.
Analizando la mortalidad durante el seguimiento, observamos una supervivencia actuarial a los 20 años en el grupo A del 50% pero la edad media de los pacientes fallecidos en el momento del deceso es de 82 años (84 años en grupo de causa cardiovascular) y la edad actual de los supervivientes es de 74±12 años. En cuanto al grupo B, sin mortalidad de origen cardiovascular y con una supervivencia actuarial del 81% a los 10 años, la edad media de los pacientes en el momento de la muerte era de 84 años con una edad actual de los supervivientes de 70±12 años. Estos datos nos confirman que, como ya se ha descrito repetidamente, la reparación valvular mitral prolonga la vida de estos pacientes asemejándola a la de la población general2.
ConclusionesEl uso de técnicas resectivas así como la implantación de neocuerdas están ampliamente extendidas en el tratamiento de la reparación del velo posterior. Nuestro centro ha evolucionado durante los últimos 20 años hacia técnicas con menor distorsión del complejo valvular mitral con buenos resultados a lo largo de todo el período.
Nuestra experiencia sugiere, no obstante, que la utilización de neocuerdas es una técnica menos reproducible dado que ni un correcto resultado ecocardiográfico operatorio ni al alta aseguran una buena evolución posterior. Las técnicas resectivas han resultado ser más seguras y reproducibles en el tratamiento del PVP siendo, según nuestros resultados, la resección triangular la de elección dado que, además, evita la deformación del anillo y de la base del ventrículo. La utilización de neocuerdas puede reservarse como complemento de una resección triangular para evitar el SAM y en prolapsos multisegmentarios o del velo anterior donde la utilización de técnicas resectivas tiene más limitaciones.
LimitacionesEste grupo de pacientes ha sido intervenido por 3 cirujanos diferentes (solo uno de ellos durante todo el período de estudio) en diferentes momentos de experiencia profesional y utilizando técnicas y accesos diferentes. Por ello creemos que limita la posibilidad de sacar conclusiones estadísticamente significativas. No obstante, esta realidad es común a la de otros grupos españoles donde un insuficiente volumen de pacientes supone una dificultad añadida para la correcta implementación de nuevas técnicas y esto tiene un reflejo directo en los resultados. Por ello, creemos que nuestras conclusiones pueden serles de interés.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.