El prolapso de velos traduce falta de coaptación central e incrementa el exceso de tensión sobre ellos, esto predispone a su rotura. Presentamos este vídeo en el que realizamos una cirugía conservadora de válvula aórtica reconstruyendo un velo prolapsante y roto como alternativa al implante valvular protésico.
Materiales y métodosPaciente de 61 años, con válvula aórtica tricúspide, insuficiencia aórtica grado iv por prolapso y rotura de velo coronariano derecho y dilatación de aorta ascendente. Análisis retrospectivo de 19 pacientes con cirugía conservadora valvular aórtica sin tratamiento de la raíz aórtica (2011-2015).
ResultadosEn el vídeo se realiza: anuloplastia, reconstrucción de velo roto, eliminación del prolapso con plicaturas centrales, implante de tubo supracoronario y anuloplastia de la unión sinotubular. Tras cirugía, la insuficiencia aórtica era grado i.
El grupo presentaba: edad media 64,3±16,9 años; 5 (26,3%) mujeres; EuroSCORE logístico 9,4±7,6; EuroSCORE II 3,9±3,1. Procedimientos realizados: tubo supracoronario+plastia aórtica 11 (58%); PAoA 8 (42%).
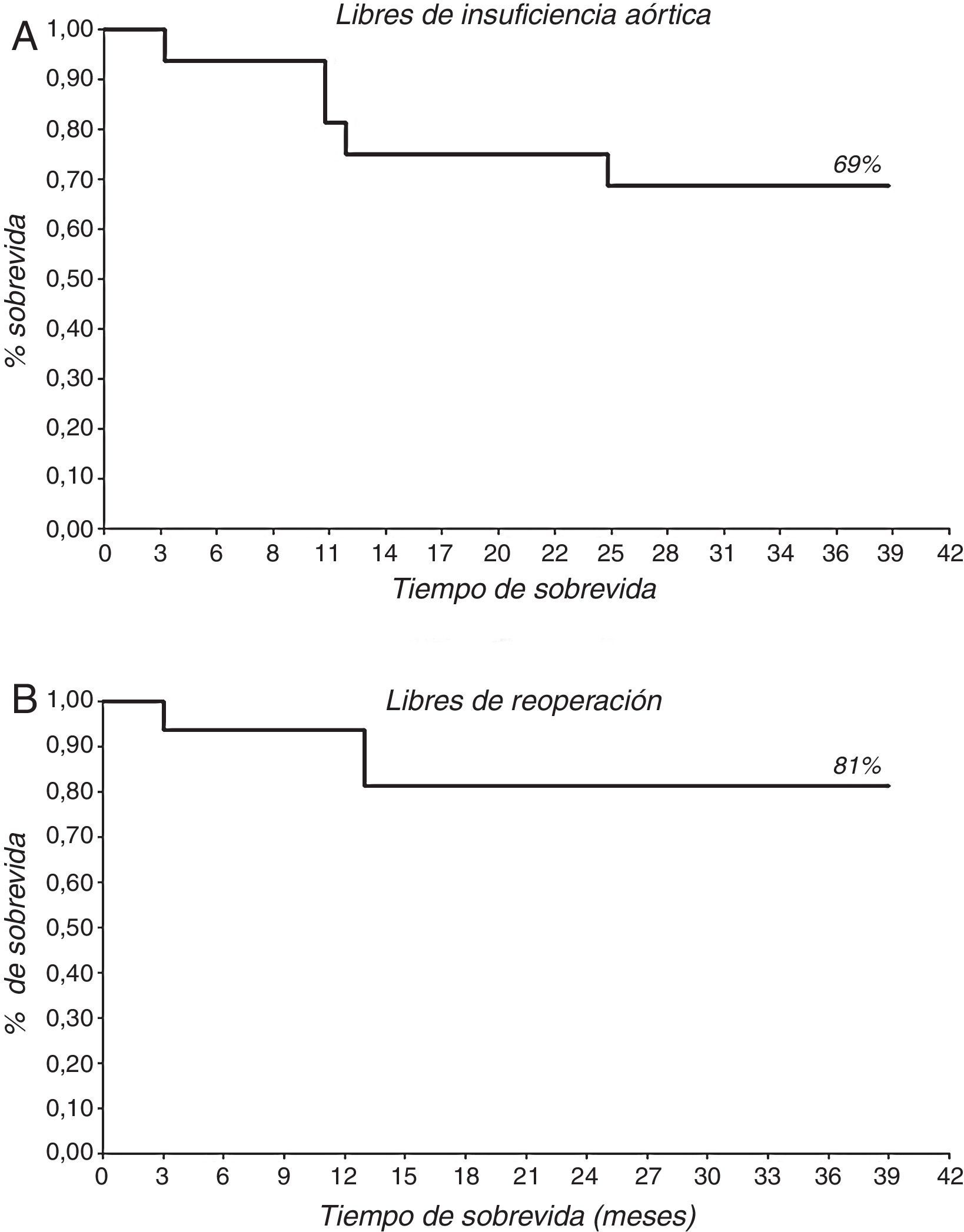
La insuficiencia aórtica preoperatoria: iii (36,8%) y iv (63,2%). Hubo 3 (15,8%) conversiones a prótesis. El seguimiento medio fue 25,4±11,4 meses (mediana 27) con un 81% libre de reoperación y un 69% libre de insuficiencia aórtica>ii.
ConclusionesLa reparación de válvula aórtica sin abordar la raíz es más compleja por los cambios dinámicos de la misma y menos estable en el tiempo.
Leaflets prolapse causes a lack of central coaptation and increases tension excessively on them. This fact predisposes to their rupture. This video is presented in which an aortic valve sparing surgery is performed by rebuilding a broken and prolapsing leaflet as an alternative to prosthetic implant.
Materials and methodsA 61 year-old patient with tricuspid aortic valve and aortic regurgitation grade iv due to a prolapse and rupture of right-coronary leaflet and dilated ascending aorta. A retrospective analysis was performed on 19 patients with aortic valve sparing surgery and an untreated aortic root (2011-2015).
ResultsThe video shows an annuloplasty, broken leaflet reconstruction, prolapse elimination with central plications, supracoronary conduit implantation, and sinotubular junction annuloplasty. Aortic regurgitation was grade i after surgery.
The retrospective analysis of the group showed a mean age of 64.3±16.9 years, of which 5 (26.3%) were women. The Logistic EuroSCORE was 9.4±7.6, and the EuroSCORE II was 3.9±3.1. The procedures performed included, supracoronary conduit+aortic plasty in 11 (58%) and an isolated aortic plasty in 8 (42%). Pre-operative aortic regurgitation grade was iii (36.8%) and iv (63.2%). There were 3 (15.8%) conversions to prosthesis. Mean follow-up was 25.4±11.4 months (median 27), with 81% free not requiring re-intervention, and 69% free from aortic regurgitation>ii.
ConclusionsAortic valve repair without addressing the root is more complex, due to its dynamic changes, and it is less stable over time.
Las prótesis valvulares aórticas funcionan excelentemente, mejoran el pronóstico y la calidad de vida, pero tienen complicaciones asociadas con las mismas, tanto las mecánicas como las biológicas, que alcanzan una incidencia del 3 al 5% por año1, con un riesgo acumulado de complicaciones del 50% a 10 años1,2. Así mismo, la supervivencia tras reemplazo valvular también está reducida, siendo solo del 50% a 10 años2,3 por algunos autores.
La insuficiencia aórtica (IAo) puede ser debida a varios mecanismos4, sobre los que se puede actuar antes de plantear el reemplazo valvular por prótesis como primera opción. Los procedimientos sobre la raíz aórtica (reimplante5 y remodelado6) han demostrado una tasa de supervivencia y libres de reoperación superiores al 851 y al 90%7, respectivamente, a 10 años. La IAo sin dilatación de la raíz, por mecanismos como la dilatación de anillo, prolapso de velos, defecto de los velos o la dilatación de la unión sinotubular (UST), son causas de IAo potencialmente reparables con técnicas quirúrgicas. Para la dilatación anular algunas técnicas han sido descritas hace años, como la plicatura subcomisural por Cabrol et al.8; otras son más recientes, como la anuloplastia con sutura9. Junto a ellas, la extensión con pericardio10 para corregir el defecto de los velos, la plicatura central11 para el tratamiento del prolapso valvular y el remodelado de la UST12 son técnicas que empleadas en conjunto permiten unos resultados buenos, manteniéndose por encima del 80% libres de reoperación a 5 años12,13.
En este artículo presentamos un vídeo en el que se realiza una reparación de un prolapso valvular por rotura de velo en el que combinamos varias técnicas para lograr un buen resultado evitando el implante de prótesis valvular. Al mismo tiempo, analizamos los resultados de nuestra serie de reparaciones valvulares sin tratamiento de la raíz aórtica.
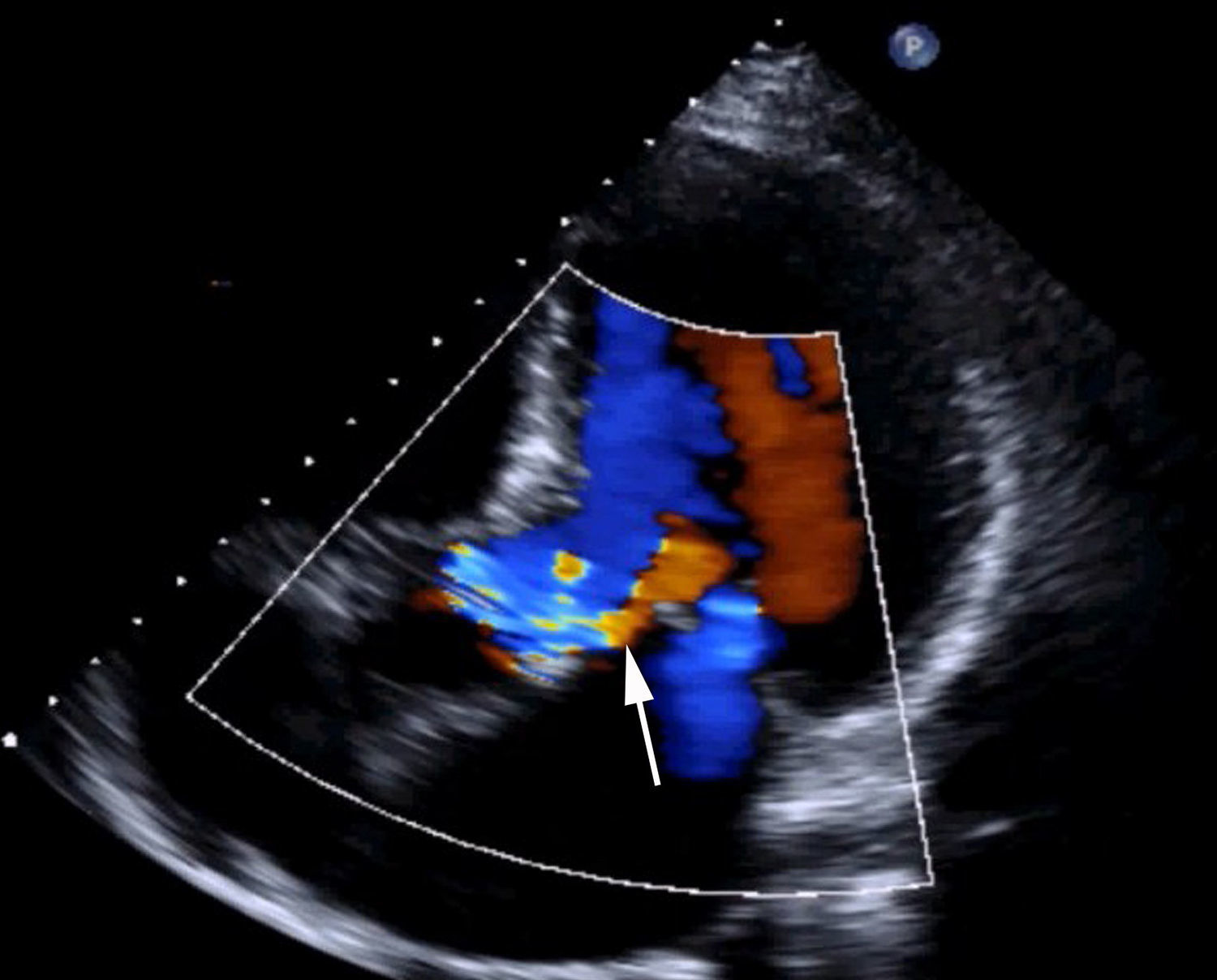
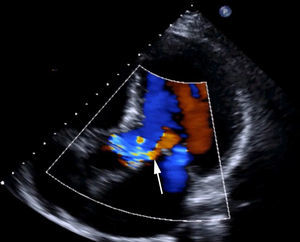
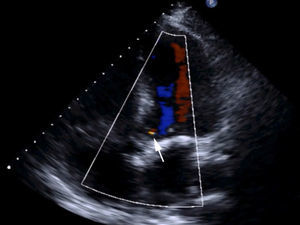
Materiales y métodosPaciente (vídeo)Presentamos el vídeo en el que realizamos una cirugía conservadora de válvula aórtica consistente en la reparación de un prolapso valvular por rotura de velo. El paciente es un varón de 61 años, que se encontraba en grado funcional iii-iv de la New York Heart Association (NYHA), diagnosticada por ecocardiografía de IAo grado iv por prolapso de velo coronariano derecho (fig. 1 y vídeo). Junto con la IAo, presentaba insuficiencia mitral moderada-severa por dilatación de anillo mitral. La raíz de la aorta estaba ligeramente dilatada (38mm), sin cumplir criterios de recambio, y la aorta ascendente era de 45mm (recomendado su recambio si se va a intervenir por otra razón clase i, nivel de evidencia B14). Las coronarias eran normales en la coronariografía. El resumen de las características del paciente del vídeo lo vemos en la tabla 1 y en el vídeo, junto con las imágenes de ecocardiografía.
Características paciente (vídeo)
| Edad (años) | 61 |
| Grado funcional para disnea | NYHA III-IV |
| Ecocardiograma | • VI moderadamente dilatado. FEVI 60%. • Válvula aórtica: tricúspide, prolapso de velo derecho. No calcificación. Insuficiencia aórtica severa • Válvula Mitral: insuficiencia grado iii, por dilatación de anillo • Raíz aórtica 38mm, aorta ascendente 45mm |
| Coronariografía | Coronarias normales |
FEVI: fracción de eyección del ventrículo izquierdo; NYHA: New York Heart Asociation; VI: ventrículo izquierdo.
Entre los años 2011 y 2015 se intervinieron quirúrgicamente en nuestro centro 19 pacientes que presentaban IAo, en los que se realizó cirugía conservadora valvular aórtica. Se ha realizado un análisis retrospectivo de estos pacientes. La indicación de cirugía fue en 18 pacientes (94,7%) la presencia de IAo severa sintomática; en un paciente (5,3%) la indicación fue la presencia de disección de aorta con IAo severa. Las características de los pacientes las podemos ver en la tabla 2.
Pacientes con cirugía conservadora sin tratamiento de raíz aórtica (2011-2015), n=19
| Edad media (años) (media ± DE) | 64,3±16,9 |
| Mujeres (n, %) | 5 (26,3) |
| EuroSCORE logístico (%) (media ± DE) | 9,4±7,6 |
| EuroSCORE-II (%) (media ± DE) | 3,9±3,1 |
| FEVI media (%) (media ± DE) | 46,6±8,9 |
| Emergente (n, %) | 1 (5,3) |
| Indicación de cirugía (n, %) | |
| IAo sintomática | 18 (94,7) |
| Disección aorta ascendente (n, %) | 1 (5,3) |
| Morfología valvular (n, %) | |
| Tricúspide | 15 (78,9) |
| Bicúspide | 3 (15,8) |
| Unicúspide | 1 (5,3) |
| Medidas medias de aorta (mm) (media ± DE) | |
| Anillo | 24,6±1,5 |
| Senos de Valsalva | 35,6±4,2 |
| Aorta ascendente | 43±10,2 |
| NYHA precirugía (n, %) | |
| II | 6 (31,6) |
| III | 8 (42,1) |
| IV | 5 (26,3) |
| IAo preoperatoria (n, %) | |
| III | 7 (36,8%) |
| IV | 12 (63,2%) |
DE: desviación estándar; EuroSCORE: European System for Cardiac Operative Risk Evaluation; FEVI: fracción de eyección de ventrículo izquierdo; IAo: insuficiencia aórtica; NYHA: New York Heart Association; m: media; mm: milímetros.
Se ha realizado un análisis retrospectivo y descriptivo. El análisis descriptivo de los datos se expresó mediante media±desviación estándar para las variables continuas y frecuencias (porcentajes) para las no continuas. El análisis de supervivencia se llevó a cabo con curvas de Kaplan-Meier. El análisis estadístico se realizó con SPSS Statistics for Windows versión 17.0 (SPSS, Inc, Chicago, IL, EE. UU.).
Técnica quirúrgicaLa intervención se realizó con anestesia general, bajo control de ecocardiografía transesofágica (ECO-TE), por esternotomía media en todos los pacientes. La circulación extracorpórea (CEC) se estableció a través de canulación en aorta ascendente, excepto en el paciente con la disección de aorta ascendente, que se realizó por arteria axilar derecha, y aurícula derecha. Bajo hipotermia ligera, se procedió a la parada cardiaca mediante la infusión de cardioplejía cristaloide Celsior© (Genzyme Corp., Boston, MA, EE. UU.) por vía retrógrada (cánula en seno coronario) y anterógrada directa por ostia coronaria.
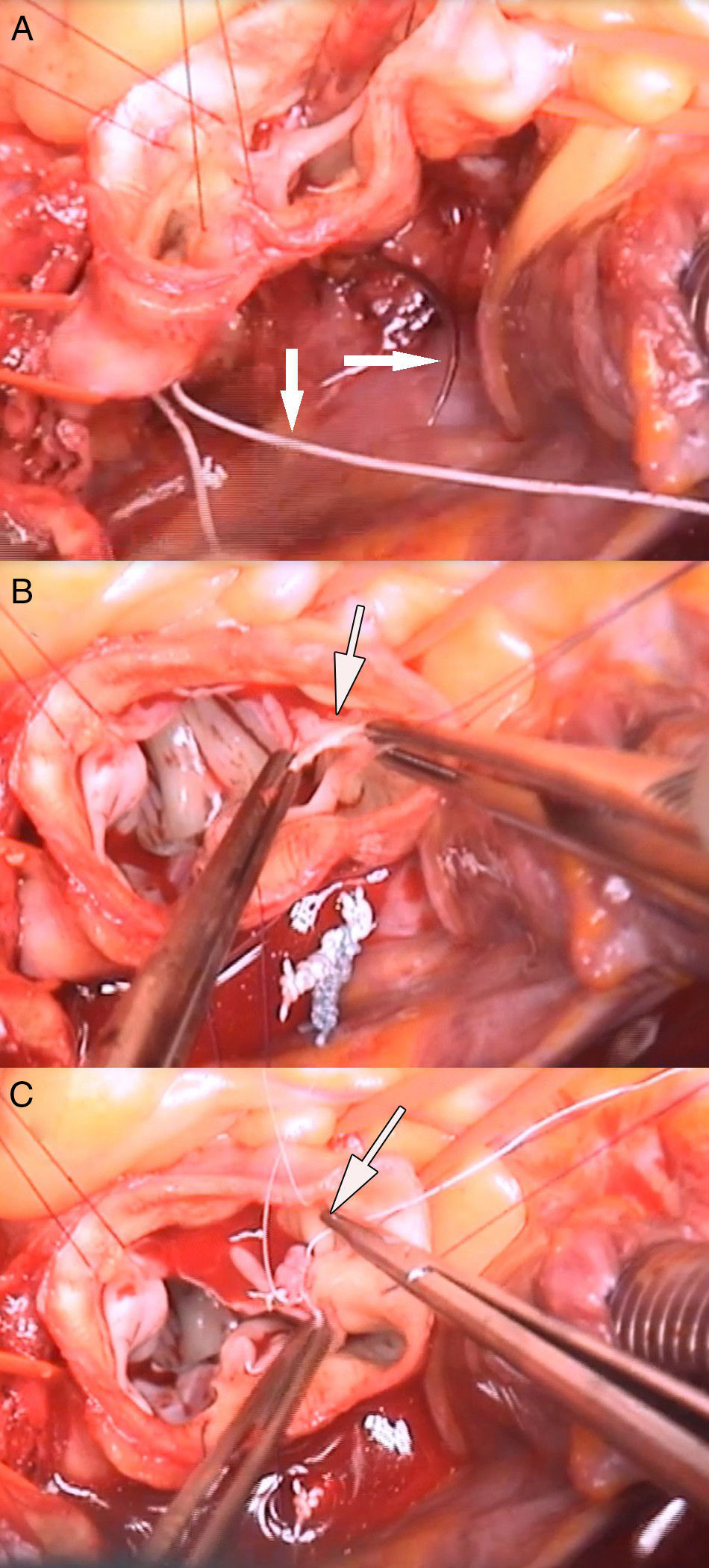
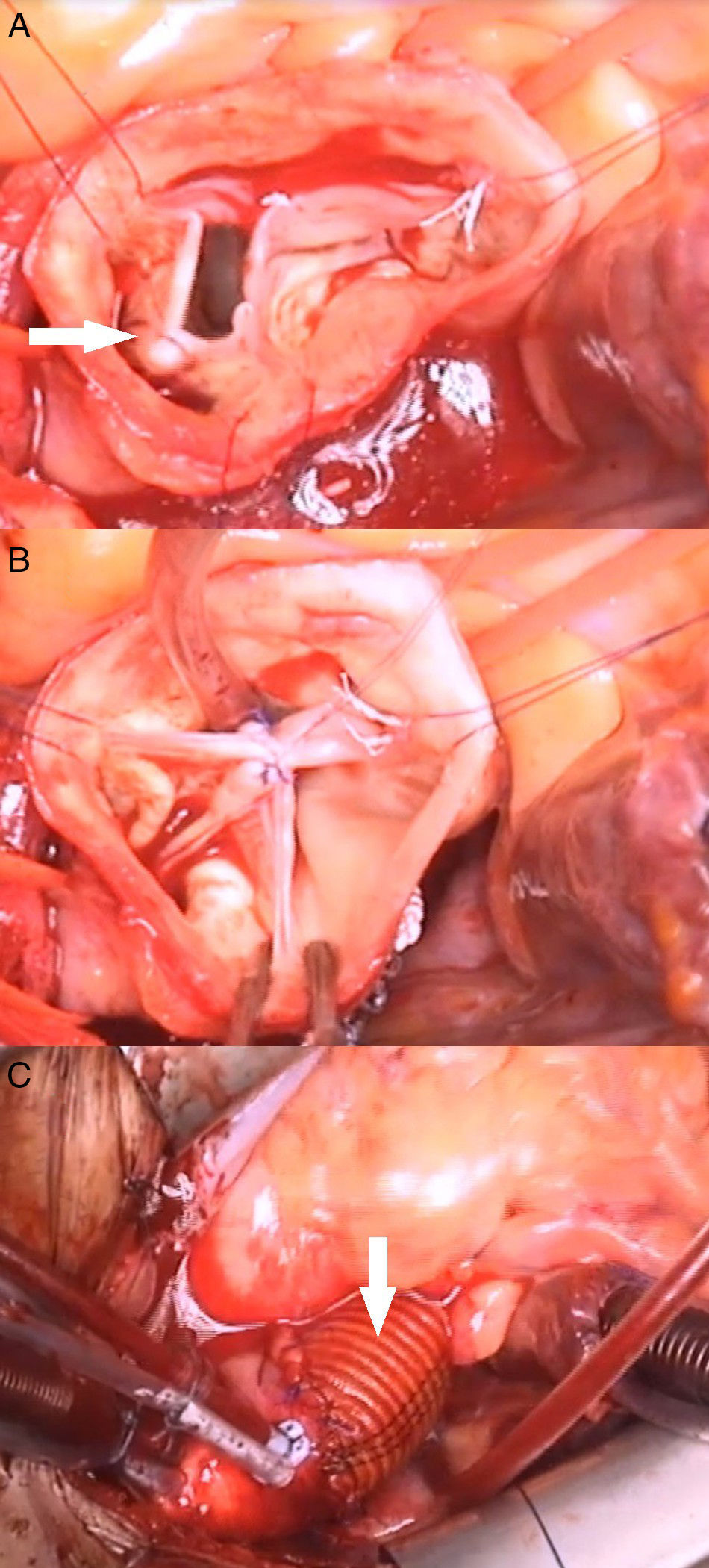
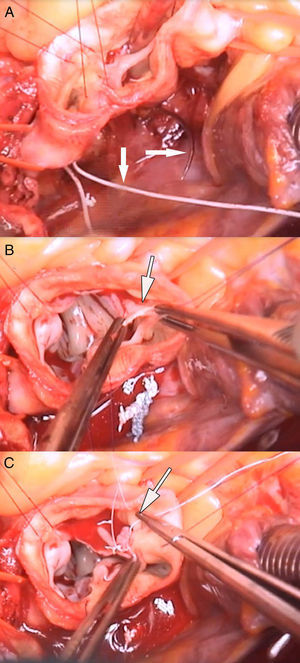
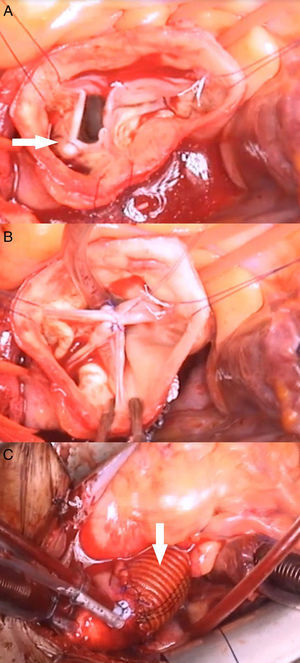
En el paciente del vídeo se realizaron los siguientes procedimientos quirúrgicos: 1) anuloplastia mitral; 2) reconstrucción velo coronariano derecho roto en comisura con no coronariano (fig. 2 B y C); 3) anuloplastia con sutura de politetrafluoroetileno (PTFE) (Gore-Tex CV-0, Gore, Múnich, Alemania), reduciendo el anillo de 28 a 24mm (fig. 2 A); 4) reducción de prolapsos coronariano derecho e izquierdo con plicaturas centrales (fig. 3 A y B); 5) plastia de la UST con sutura de PTFE, reduciendo el diámetro de 30 a 24mm, y 6) reemplazo de aorta ascendente por tubo supracoronario (TSC) de 28mm (fig. 3C).
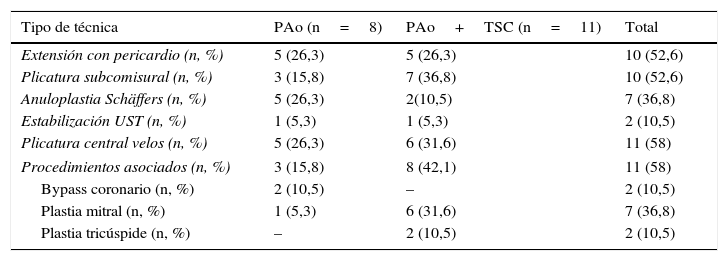
En el grupo de pacientes se realizaron plastia aórtica aislada (PAoA) en 8 (42%) y plastia aórtica asociada a recambio de aorta ascendente en 11 (58%). La plastia aórtica en todos los pacientes incluyó combinación de diferentes técnicas: anuloplastia de Schäffers9 con sutura de PTFE (Gore-Tex CV-0, Gore, Múnich, Alemania), plicatura subcomisural según técnica de Cabrol8, extensión con pericardio y plicatura central de velos11. También se realizaron procedimientos asociados, especialmente reparación mitral. Lo podemos ver detallado en la tabla 3.
Procedimiento quirúrgico
| Tipo de técnica | PAo (n=8) | PAo+TSC (n=11) | Total |
|---|---|---|---|
| Extensión con pericardio (n, %) | 5 (26,3) | 5 (26,3) | 10 (52,6) |
| Plicatura subcomisural (n, %) | 3 (15,8) | 7 (36,8) | 10 (52,6) |
| Anuloplastia Schäffers (n, %) | 5 (26,3) | 2(10,5) | 7 (36,8) |
| Estabilización UST (n, %) | 1 (5,3) | 1 (5,3) | 2 (10,5) |
| Plicatura central velos (n, %) | 5 (26,3) | 6 (31,6) | 11 (58) |
| Procedimientos asociados (n, %) | 3 (15,8) | 8 (42,1) | 11 (58) |
| Bypass coronario (n, %) | 2 (10,5) | – | 2 (10,5) |
| Plastia mitral (n, %) | 1 (5,3) | 6 (31,6) | 7 (36,8) |
| Plastia tricúspide (n, %) | – | 2 (10,5) | 2 (10,5) |
PAo: plastia aórtica; PAo+TSC: plastia aórtica más tubo supracoronario; UST: unión sinotubular.
El seguimiento se ha realizado en consulta a 1, 3 y 12 meses y posteriormente anual con Ecocardiograma transtorácico (ECO-TT) de control.
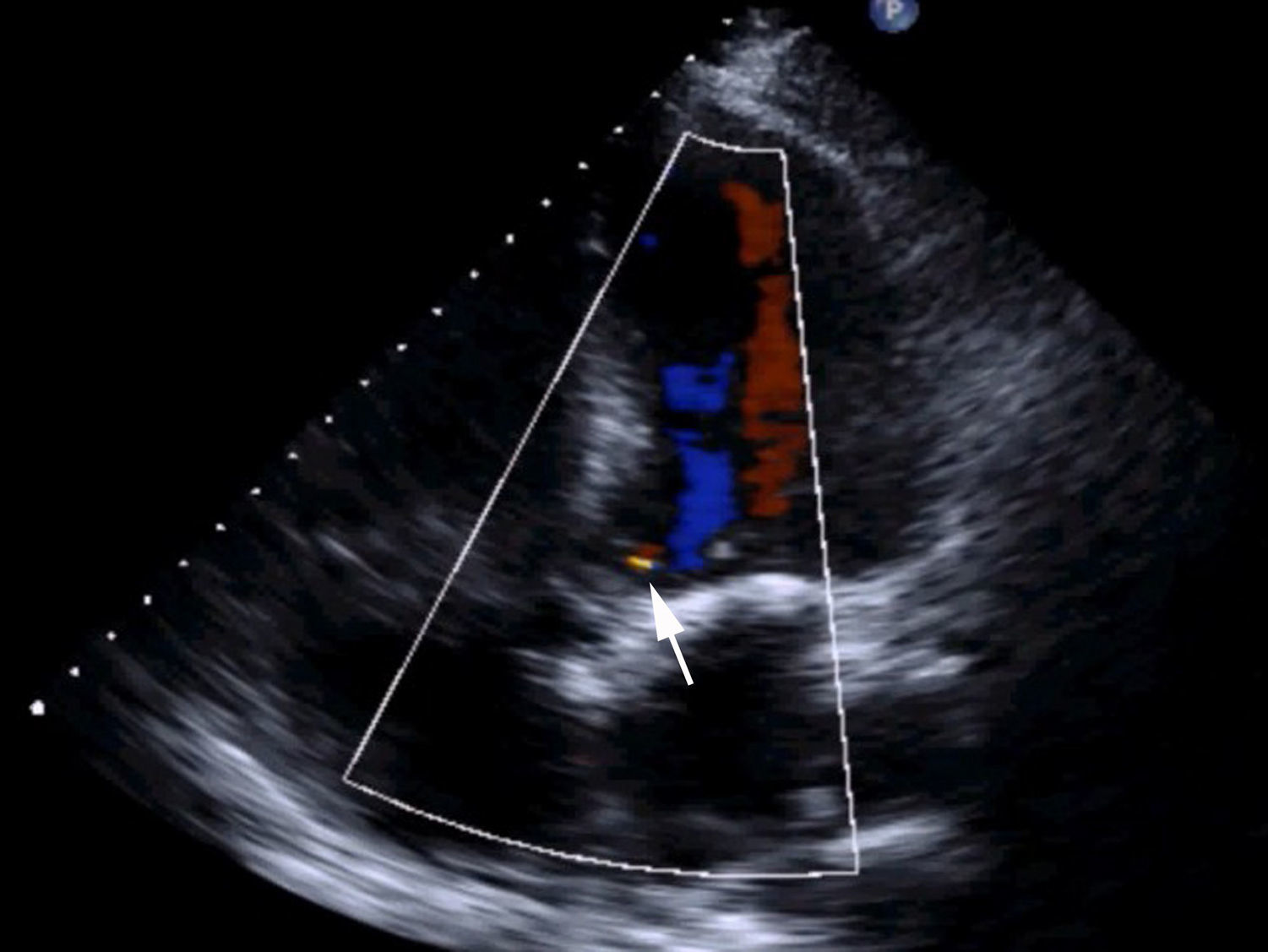
ResultadosEn el paciente del vídeo se consigue un resultado óptimo, presentando en ECO-TT al alta: ventrículo izquierdo (VI) de tamaño normal, con función conservada. Válvula aórtica normofuncionante (ausencia de estenosis, insuficiencia leve). Válvula mitral con anuloplastia e insuficiencia leve. Podemos ver el resultado anatómico y ecocardiográfico en el vídeo y en la figura 4.
En las características de la serie de pacientes, que podemos ver en la tabla 2, la edad media era de 64,3±16,9 años, predomina el sexo masculino y hubo solamente 5 mujeres (26,3%). Los pacientes tenían un riesgo moderado con un EuroSCORE logístico de 9,4±7,6% y un EuroSCORE II de 3,9±3,1%. La fracción de eyección del VI (FEVI) media era de 46,6±8,9%. La morfología valvular era predominantemente tricúspide 15 casos (78,9%), pero hubo válvulas bicúspides en 3 (15,8%) y unicúspide en un caso (5,3%). Las medidas medias de anillo aórtico (24,6±1,5mm), senos de Valsalva (35,6±4,2mm) y aorta ascendente (43±10,2mm) corresponden con cierto grado de dilatación de raíz y aorta ascendente. Si consideramos solo los 11 casos en los que se cambió la aorta ascendente, el diámetro medio era 50,2±6,2mm.
El 26,3% (5 pacientes) se encontraba en grado funcional iv de la NYHA para disnea, 42,1% (8 pacientes) en grado funcional iii de la NYHA y 6 pacientes (31,6%) se encontraban en grado funcional i de la NYHA. La IAo era severa (grado iv) en 12 pacientes (63,2%) y moderada-severa (grado iii) en 7 (36,8%).
Se realizaron procedimientos asociados: bypass coronario 2 (10,5%), plastia mitral 7 (36,8%) y plastia tricúspide 2 (10,5%), que por grupos los podemos ver desglosados en la tabla 3.
Los tiempos de cirugía fueron prolongados, 141,78±29,2min de pinzamiento aórtico y 171,9±30,1min de CEC; no obstante, se realizaron números procedimientos asociados. En la cirugía hubo reconversión a prótesis valvular si tras salida de CEC el ECO-TE mostraba una IAo ≥ grado ii, y esto ocurrió en 3 pacientes (15,8%). Estos pacientes pertenecían al grupo en el que se había realizado PAoA. El resto de los pacientes presentaban IAo trivial-leve (< grado ii). Un paciente (5,3%) falleció en el postoperatorio inmediato por shock cardiogénico a los 15 días de estancia en la Unidad de Vigilancia Intensiva. Era un paciente con varios procedimientos y disfunción ventricular precirugía, con FEVI<30%. No hubo complicaciones mayores tras la cirugía, ni sangrado posquirúrgico, ni infarto de miocardio, ni accidente cerebrovascular. La única complicación presentada fue una hipoxemia persistente en un solo paciente (5,3%), por lo que precisó intubación orotraqueal prolongada. La estancia media fue de 15,6±8,9 días (mediana 12). Los resultados postoperatorios los podemos ver en la tabla 4.
Resultados postoperatorios
| Tiempo de pinzamiento aórtico (min) (media ± DE) | 141,78±29,2 |
| Tiempo de CEC(min) (media ± DE) | 171,9±30,1 |
| Insuficiencia aórtica postoperatoria (n, %) | |
| Trivial-leve (< ii) | 16 (84,2) |
| Moderada (≥ ii) | 3 (15,8) |
| Reconversión a prótesis aórtica intraoperatoria (n, %) | 3 (15,8) |
| Defunción (n, %) | 1 (5,3) |
| Complicaciones (hipoxemia) (n, %) | 1 (5,3) |
| Estancia postoperatoria (días) (media ± DE; mediana) | 15,6±8,9; 12 |
CEC: circulación extracorpórea; DE: desviación estándar; m: media; n: número.
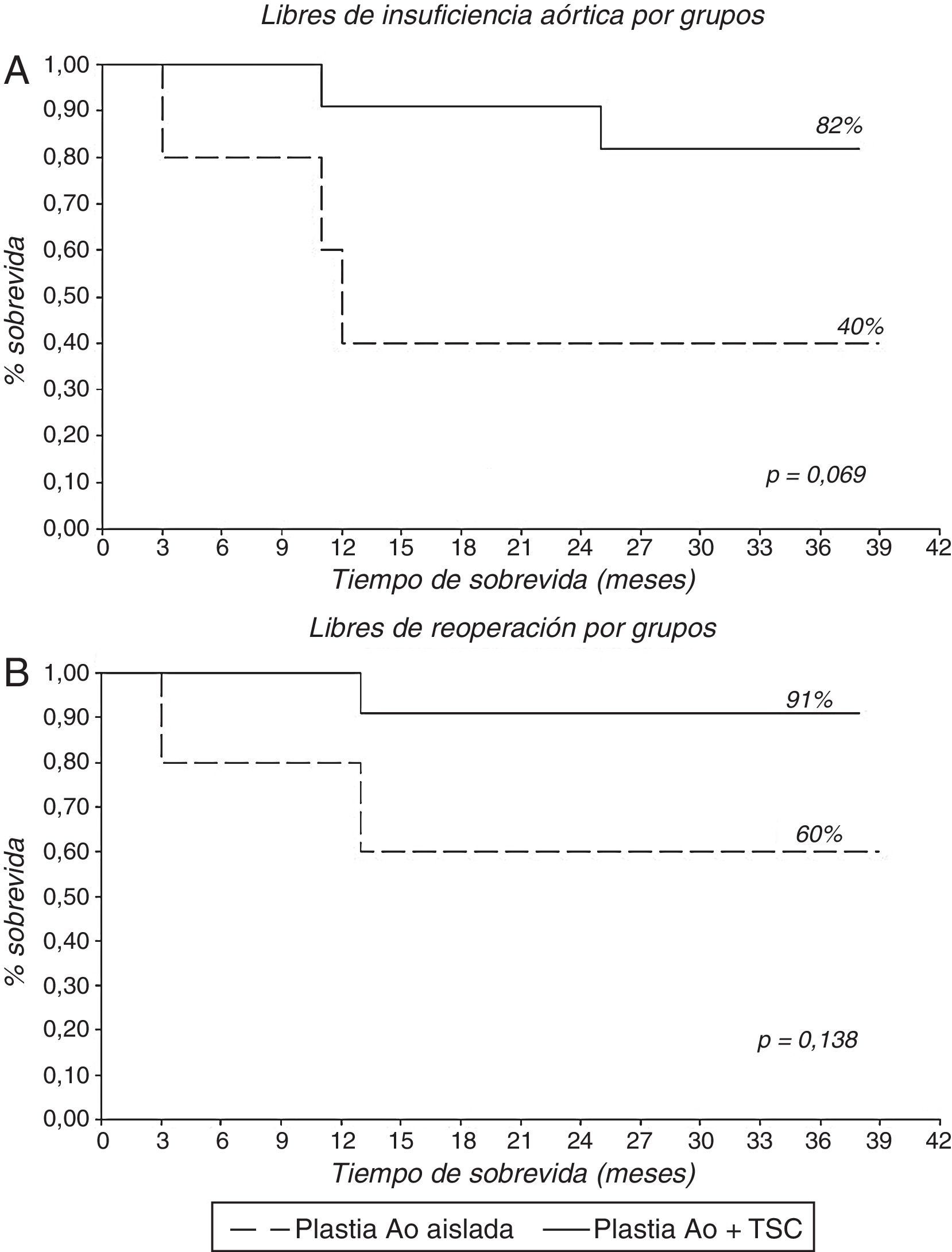
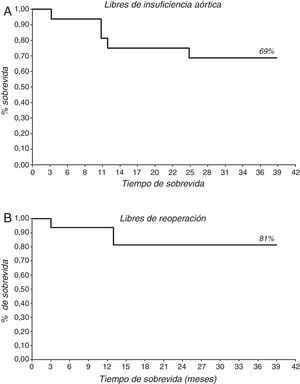
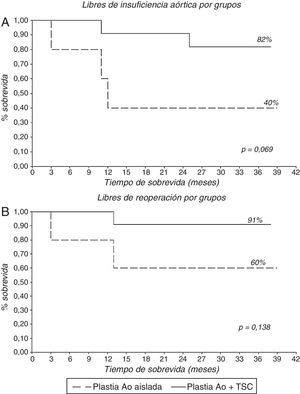
Tras las 3 reconversiones a prótesis intraoperatorias, se realizó el seguimiento de 16 pacientes, 5 (31,25%) con PAoA y 11 (68,75%) con PAo+TSC. El seguimiento medio fue de 25,4±11,4 meses (mediana 27 meses). Solo un paciente falleció durante el seguimiento. El 69% (11 pacientes) se encuentra libre de IAo>grado ii y el 81% (13 pacientes) se encuentra libres de reoperación (fig. 5; tabla 5). Al analizar los resultados del seguimiento por grupos, se encuentran libres de IAo>grado ii 2 pacientes (40%) en el grupo de PAoA y 9 pacientes (82%) en el grupo de PAo+TSC. Y se encuentran libres de reoperación 3 pacientes (60%) en el grupo de PAoA y 10 pacientes (91%) en el grupo de PAo+TSC (fig. 6). No hubo diferencias significativas. De los 5 pacientes que desarrollaron IAo>ii, 3 de ellos eran del grupo PAoA y 2 del grupo PAo+TSC. De estos 5 pacientes con IAo>ii, se reoperó a 3 pacientes, a 2 del grupo PAoA y 1 del grupo Pao+TSC. Los otros 2 pacientes con IAo>ii se encuentran en buen grado funcional y sin dilatación ventricular.
Resultados en el seguimiento (de 16 pacientes)
| PAo aislada (n, %) | 5 (31,25) | |
| Pao+TSC (n, %) | 11 (68,75) | |
| Seguimiento, meses(media ± DE; mediana) | 25,4±11,4; 27 | |
| Defunción durante seguimiento (n, %) | 1 (6,25) | – |
| Libres de reoperación (n, %) | 13 (81) | – |
| PAo aislada (n, %) | 3 (60) | Log Rank p=0,138 |
| PAo+TSC (n, %) | 10 (91) | |
| Libres de IAo>II (n, %) | 11 (69) | – |
| PAo aislada (n, %) | 2 (40) | Log Rank p=0,069 |
| PAo+TSC (n, %) | 9 (82) | |
| Grado funcional NYHA | ||
| II (n, %) | 3 (20) | – |
| I (n, %) | 12 (80) | – |
DE: desviación estándar; m: media; n: número; NYHA: New York Heart Association; PAo: plastia aórtica; PAo+TSC: plastia aórtica más tubo supracoronario.
No hubo eventos tromboembólicos ni endocardíticos durante el seguimiento en ningún paciente. Los pacientes se encuentran en buen grado funcional, 3 pacientes (20%) en grado funcional NYHA II y 12 pacientes (80%) en grado funcional NYHA I.
DiscusiónEl tratamiento de la enfermedad valvular aórtica con implante valvular protésico ha tenido muy buenos resultados en la mejoría de la calidad de vida y del pronóstico de vida15, pero tiene implicaciones como la necesidad de anticoagulación en las mecánicas y la degeneración en las biológicas, y hay complicaciones relacionadas con las prótesis, como el riesgo de trombosis y tromboembolismo en las mecánicas, y el riesgo de endocarditis en ambas. Estas complicaciones pueden tener una incidencia del 3 al 5% por año1, con un riesgo acumulado de complicaciones del 50% a 10 años1,2. Hammermeister et al.2, en un análisis de 394 válvulas aórticas en seguimiento durante 15 años, señalan un riesgo acumulado de sangrado del 40 y el 20% a 10 años para prótesis mecánicas y biológicas, respectivamente, y un riesgo acumulado de reoperación de aproximadamente el 18% para prótesis biológicas, pero casi el 10% para prótesis mecánicas, que en teoría deberían durar por un largo periodo. El mismo autor señala que la mortalidad acumulada para prótesis biológicas y mecánicas es del 25% a 5 años y del 50% a 10 años. Gaca et al.3, en su estudio de 2.148 pacientes, obtienen unos resultados parecidos, con una supervivencia tras reemplazo valvular aórtico del 75% a 5 años y del 50% a 10 años. Estos estudios nos advierten sobre una idea: las válvulas funcionan muy bien pero asocian unas complicaciones y una reducción de la esperanza de vida que al menos es llamativa y cuya etiología tampoco está esclarecida.
La terapéutica alternativa al implante protésico aórtico es la reparación valvular, cuando sea posible. Los primeros intentos de reparación valvular son bastante precoces en la historia de la cirugía cardiaca. La anuloplastia subcomisural o plicatura subcomisural fue descrita por Cabrol8 en 1966, con ello reducía el diámetro del anillo aórtico e incrementaba la superficie de coaptación de los velos. Es una técnica que todavía tiene vigencia y es empleada por diversos grupos16.
A lo largo de los años han ido surgiendo nueva técnicas de reparación, para el anillo, la raíz de aorta y los velos aórticos. Para el anillo, junto con la plicatura subcomisural, está la anuloplastia con sutura de PTFE descrita por Aicher et al. y Schäfers et al.9,17. La gran revolución de la reparación valvular aórtica llegó con las técnicas conservadoras de raíz, el reimplante5 y el remodelado6, descritas a principios de los años 90, con resultados a largo plazo que demuestran su estabilidad en el tiempo, una tasa de supervivencia y libres de reoperación superiores al 851 y el 90%7 a 10 años. Las técnicas sobre los velos son las más recientes y quizás las más complejas, pues hay que restablecer la geometría de la válvula aórtica en estático, con el corazón parado, y sabemos que esa geometría cambia cuando pasa a estado dinámico. El término «altura efectiva» (altura en vertical desde el borde del velo hasta la base del anillo aórtico), acuñado por Schäfers et al.18, ha sido de gran ayuda en la reparación de los velos, pues nos permite estandarizar unas medidas que podemos aplicar en estático, sabiendo que cuando la raíz aórtica y los velos pasen a estado dinámico, la geometría se va a mantener estable. Una vez conocidos unos estándares de cómo y qué relaciones deben tener los velos aórticos se han desarrollado técnicas para la corrección del prolapso valvular, como la plicatura central11, consistente en sutura de polipropileno de 5/0 o 6/0 en la zona central de menor tensión de los velos y que permite elevarlos, o la resuspensión del velo con politetrafluoroetileno (Gore Tex)19. La extensión de velos con pericardio10 también es útil en la reparación valvular aórtica.
La utilización de todas estas técnicas en conjunto ofrece unos resultados de reparación aórtica bastante duradera en el tiempo, con supervivencia del 92% a 5 años y el 80% a 10 años1, libre de reoperación por encima del 90% a 5 años y del 85% a 10 años1 y libres de complicaciones relacionadas con las válvulas el 88% a 10 años1. Son resultados excelentes, pero Aicher et al.1 ya señalan en su estudio que hay una diferencia entre los pacientes con reparación aórtica y tratamiento de la raíz aórtica y los que solo reciben reparación aórtica aislada. Los pacientes con reemplazo de raíz están libres de IAo ≥ II el 89% y el 84% a 5/10 años, mientras que los pacientes con PAoA están libres de IAo ≥ II el 83% a 5/10 años, p=0,025. Así mismo, los pacientes con reemplazo de raíz están más libres de reoperación que los pacientes con plastia aislada, aunque no fue significativo. Langer et al.13 también señalan esa diferencia entre los pacientes en los que se trata raíz y en los que no. Encuentran que los pacientes con plastia aórtica y sustitución de raíz aórtica están libres de IAo>II el 94% y libres de reoperación el 98% a 5 años, mientras que los pacientes con PAoA están libres de IAo>II el 81% y libres de reoperación el 93% a 5 años. De estos estudios deducimos que alguna diferencia hay entre reparar solo la válvula aórtica y repararla con tratamiento de la raíz aórtica.
En nuestro estudio hemos analizado a los pacientes con reparación aórtica aislada y a los pacientes con reparación aórtica y sustitución de aorta ascendente. Múltiples técnicas se han realizado conjuntamente, como describimos en la tabla 3, junto con bastantes procedimientos asociados (58%); esto ha supuesto tiempos de pinzamiento aórtico y CEC prolongados, 141,78±29,2min y 171,9±30,1min, respectivamente, pero que no se han traducido en complicaciones importantes, solo un paciente presentó hipoxemia mantenida y solo un paciente falleció durante la estancia hospitalaria. Las reconversiones a prótesis valvular intraoperatoria han sido 3 (15,8%), todas ellas producidas en pacientes con PAoA. Hemos de decir que 2 de estos pacientes se operaron al inicio de la serie y de la curva de aprendizaje. Todos los pacientes han estado libres de complicaciones relacionadas con las válvulas durante el seguimiento, con una mejoría de la clase funcional importante, pasando de NYHA II 31,6%, III 42,1% y IV 26,3% precirugía a NYHA I 80% y II 20% en el seguimiento. La supervivencia libre de IAo>II y libre de reoperación ha sido del 69 y el 81%, a casi 3 años. Son resultados algo inferiores a los de los grupos internacionales comentados. Sin embargo, al igual que Aicher et al.1 y Langer et al.13, hemos observado una diferencia entre los 2 grupos que tratamos en el estudio, con supervivencia libres de IAo>II y libres de reoperación del 40 y el 60%, respectivamente, a 3 años en el grupo de PAoA, mientras que el grupo que asociaba sustitución de la aorta ascendente la supervivencia libres de IAo>II y libres de reoperación era del 82 y el 91% a 3 años. No son significativas las diferencias (p=0,069 para la IAo>II, p=0,138 para la reoperación), pero hay una marcada tendencia a presentar más tasa IAo>II y reoperación en el grupo de plastia aislada. Si comparamos estos datos con los de nuestra serie de tratamiento de raíz aórtica (libres de IAo>II 95,5% y libres de reoperación 97,8%, a 5 años, datos no publicados), vemos cómo hay una clara diferencia, ofreciendo el tratamiento de la raíz más durabilidad en el tiempo, resultados similares a los publicados por Aicher et al.1 y Langer et al.13.
La reoperación de los pacientes en el seguimiento ha sido debida, en todos los casos, a la reaparición de la IAo por problemas con los parches de pericardio utilizados, bien sea por retracción o por rotura. Inicialmente, esos pacientes han salido con IAo grado i de quirófano. La causa de la rotura o retracción puede pensarse que es debida al estrés dinámico ejercido sobre los velos con el movimiento de la raíz y la no obtención de unos parámetros adecuados de altura efectiva y superficie de coaptación. Cuando se aborda el tratamiento de la raíz, las técnicas de reimplante y remodelado ofrecen un marco estático donde las técnicas de reparación son más fáciles de aplicar y conseguir parámetros óptimos de altura efectiva y coaptación, por lo que los velos sufren menos estrés cuando se pasa a la fase dinámica de la raíz aórtica, lo que ayudaría a conservar elementos como el pericardio empleado en la reparación.
ConclusionesLa reparación de válvula aórtica sin abordar la raíz es factible con aceptables resultados. El vídeo muestra cómo la combinación de técnicas permite obtener un resultado óptimo. Sin embargo, el componente dinámico de la raíz aórtica junto con la utilización de pericardio parecen ser los responsables de una mayor tasa de reconversión a prótesis intraoperatoria y de una menor estabilidad en el tiempo, con peores resultados en el seguimiento cuando se comparan con el tratamiento de la raíz aórtica, e incluso cuando se comparan con la reparación aórtica más reemplazo de aorta ascendente, aunque no de forma significativa. La utilización de estas técnicas quirúrgicas permite ofrecer a los pacientes una alternativa al implante valvular protésico, evitando el tratamiento anticoagulante y reduciendo las complicaciones protésicas asociadas, con mejoría de su clase funcional.
LimitacionesLa principal limitación de este estudio es el tamaño muestral de pacientes. No obstante, aunque solo son 19 pacientes, los resultados son aproximados a los publicados en la literatura. Estudios más amplios serán necesarios para dar consistencia a estos resultados.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.